Method Article
指南结构照明显微镜TIRF在高速,多种颜色
摘要
This article provides an in depth guide for the assembly and operation of a structured illumination microscope operating with total internal reflection fluorescence illumination (TIRF-SIM) to image dynamic biological processes with optical super-resolution in multiple colors.
摘要
与结构照明显微镜(SIM)光学超高分辨率成像是过程在化学和生物医学科学在分子水平可视化的关键技术。虽然商业SIM系统可供选择,这是定制设计在实验室中可以超越商业系统的系统,后者通常设计为易用性和通用应用,无论是在成像保真度和速度方面。本文介绍了一个深入的指南,构建一个使用全内反射(TIR)照明和能成像高达,分辨率达到了100纳米10赫兹三种颜色的SIM系统。由于SIM和TIRF的组合,该系统提供了比对手技术更好的图像对比度。为了实现这些规范,几个光学元件被用于使能在照明光的偏振状态和空间结构自动化控制可用于所有激励的wavelengths。给出了硬件实现和控制全部细节,实现与实现最大的采集帧率的重视激发光模式生成,波长,极化状态和摄像头控制之间的同步。一个一步一步的协议,用于系统校准和标定,并提出了可实现的分辨率提高是在理想的试验样品验证。用于视频率超分辨率成像的能力证明与活细胞。
引言
在过去五年的时间,超分辨率显微镜已经成熟,并从专业光学实验室搬进了生物学家的手中。商业显微镜解决方案,实现光学超分辨率的三个主要变量有:单分子定位显微镜(SMLM),受激发射损耗显微镜(STED)和结构照明显微镜(SIM)1,2。 SMLM比如光敏定位显微镜(PALM)和随机光学重建显微镜(STORM)一直是最流行的技术,主要是由于光学装置的简单性和高空间分辨率的承诺,随手下降到20纳米。 通过单个分子本地化然而超分辨率显微镜附带的特性折衷:空间分辨率可达到依赖于积累足够数量的个别荧光本地化的,因此,限制了时间分辨率。成像动态过程因此在活细胞中的ES成为问题的,因为必须充分检验的感兴趣结构的运动,以防止运动伪影,而在这段时间来重建图像还取得足够的定位事件。为了满足这些要求,活细胞SMLM演示已经通过大大增加的激励功率得到在荧光光控速率所需的增加,这导致在轮到光毒性和氧化胁迫,从而限制样品存活时间和生物相关3。
受激发射损耗超过两个SIM和SMLM的明显优势是,它可以与超分辨率厚的样品中,对纳米左右60的例子的横向分辨率的图像在器官型脑切片在深度达到高达120微米4。在成像深度等与SMLM或SIM卡的单一目标的实现是不可行的,但能够用单分子的发光纸或点阵灯片话筒roscopy 5。视频速率STED还已经证明和用于映射突触小泡的流动性,尽管到目前为止已不限于成像的视图6小字段。
在细胞生物学和分子自组装反应7应用- 12需要与在许多时间点高时间分辨率成像,结构照明显微镜(SIM),可非常适合,因为它不依赖于特定的荧光的光物理性质探测。尽管SIM卡的这种固有的优势,到现在为止的使用一直主要局限于成像固定细胞或缓慢移动的过程。这是由于市售的SIM系统的限制:这些仪器的探测帧速率被用于产生所需的正弦照射样式以及偏振保持光学光栅的旋转速度的限制。最新一代的商业SIM卡仪器能够快速成像,但他们都贵得离谱所有,但中央成像设施。
这个协议提供了一个引导到柔性SIM卡系统的结构为薄的样品中并邻近活细胞的基底表面成像快速过程。它使用全内反射荧光(TIRF),以产生穿透深度不超过约150纳米到其中极大地降低了失焦背景信号的样品13的照明图案。 SIM卡的TIRF相结合的思想是几乎一样古老的SIM本身14,但没有2006年15之前通过实验来实现。第一体内图像与TIRF-SIM得到报告,2009年11赫兹的16实现帧速率来可视化微管蛋白和驱动蛋白动态,和两个彩色的TIRF-SIM系统已被提出17,18。最近一段时间,在建设和使用的单色双光束SIM个导ystem提出具有高达18赫兹19,20帧速率。
这里提出的设置是能够SIM超分辨率成像的在三种颜色,其中两个可在TIRF-SIM操作20赫兹。整个系统是围绕倒置显微镜帧构造和使用了电动XY平移台上用压电驱动Z台。以产生用于TIRF-SIM所需的正弦励磁模式,提出了系统使用的强电介质的空间光调制器(SLM)。二元光栅图案显示在SLM和所得±1衍射级进行过滤,中继和聚焦到物镜的TIR环。所需的相移和光栅的旋转被通过改变所显示的SLM图像施加。本协议描述了如何构建和调整这样一个激发路径,详细介绍了发射路径的排列,并给出测试样品,以确保最佳的调整。它还取消介绍了有关偏振控制和零部件同步的问题,并高速TIRF-SIM的挑战尤其如此。
设计考虑和约束
在组装该协议提出的TIRF-SIM系统之前,有几个设计约束考虑其中确定光学元件的选择。光学部件的所有缩写参见图1。
空间光调制器(SLM)
二进制铁电体的SLM在该设置中使用,因为它是能够亚毫秒级的图案的切换。可以使用灰度向列的SLM但这些报价大大减少切换时间。每个打开或关闭的像素的二进制相位SLM将赋予任一的π或0的相位偏移到入射平面波前,因此,如果一个周期光栅图案被显示在其上将作为相位衍射光栅操作在SLM。
ENT">全内反射(TIR)以实现TIR并产生渐逝场,在玻璃样品接口的激发光束的入射角必须小于临界角更大的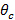 。此设置所需的最小入射角,并因此也最大间距或周期,瞬逝照明图案。最大入射角
。此设置所需的最小入射角,并因此也最大间距或周期,瞬逝照明图案。最大入射角 (接受角)是通过它可以从定义来计算物镜的数值孔径(NA)的限制
(接受角)是通过它可以从定义来计算物镜的数值孔径(NA)的限制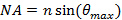 。这决定了最小图案根据阿贝式实现的间距
。这决定了最小图案根据阿贝式实现的间距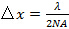 哪个环节NA和波长
哪个环节NA和波长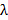 到最小图案间距
到最小图案间距 。在实践中,1.49的NA油浸TIRF目标产生的左右79°入射和164纳米使用488nm的激发波长的样本的最小图案周期的最大角度。这两个角度限定在物镜的后孔径超过该仪器达到的TIR照明( 即在TIR环),并在其中两个激发焦点必须准确地定位并精确地转动,以产生各照明图案的环。
。在实践中,1.49的NA油浸TIRF目标产生的左右79°入射和164纳米使用488nm的激发波长的样本的最小图案周期的最大角度。这两个角度限定在物镜的后孔径超过该仪器达到的TIR照明( 即在TIR环),并在其中两个激发焦点必须准确地定位并精确地转动,以产生各照明图案的环。
TIRF-SIM图像的重建需要的最低的每码形旋转三相移的获取,因此在SLM图案周期必须由3整除( 见图1)。例如,经过一段时间的9个像素为488纳米的照明和12像素为640纳米的照明。对于SLM的图案设计进行了全面讨论,包括使用剪切光栅间距模式的子像素优化见的Kner 等人 16和Lu-瓦尔特等 20 人,在两个励磁灶的位置的以前的工作必须在TIR环为所有波长内,然而,±1订单的衍射角从SLM是波长依赖。为标准的SIM,多色成像可以通过优化为最长波长的光栅周期,并且容忍为较短通道在性能上的损失来实现。对于TIRF-SIM然而,优化为一个波长意味着其他波长焦点是在TIR环内不再。例如,使用的9个像素的光栅周期是足以为488纳米提供的TIRF,作为焦点是在后面开口的及TIR环内直径的95%,但对于640纳米此期间将外定位病灶光圈。为此不同的像素图案间距必须用于每个激发波长。
的TIRF-SIM激发路径的取向在传统的SIM卡中的分色镜的位置,在镜身的微小变化(DM4 图1)极为敏感,远远超过了。不推荐的旋转滤波器立方体转台的使用,而是使用单一的,多波段分色镜,其被保持在一个固定的位置,并专门设计为使用的激发波长。至关重要的是,只有最高质量的分色镜被使用。这些要求中的至少厚3毫米基板,并且通常指定为"成像平面"制造商。所有其它基质导致的TIRF-SIM不可容忍像差和图像劣化。
偏振控制
实现的TIRF-SIM有必要与照明图案旋转同步的激励光的偏振态,使得其保持在目标光瞳平面方向偏光相对于光轴( 即。 s偏振光)。偏振控制光学对准,将取决于所用的具体的光学元件上,例如一个普克尔斯盒21,或半波片在一个机动化旋转台22。在这个协议中一个自定义的液晶可变延迟器(LCVR)时,设计成在波长范围提供全波(2π)延迟488至640纳米的,因为它允许快速(〜毫秒)切换。如果使用液晶延迟器,必须使用高质量的分量:标准组件通常不够稳定过的照相机曝光时间而引起的长度,得到恒定延迟模糊出照明图案和低调节对比度的。液晶延迟也强烈地依赖于温度,并且要求建在温度控制。
同步
激光器必须与SLM同步。二进制铁电SLM的是由s内部平衡开状态和关状态之间魔力。像素只有要么在帧间切换时间其打开或关闭状态,但不采取行动,如半波片。因此激光器只应在开/关状态通过在LED接通启用从SLM信号,以防止在图案对比度降低由于各像素的中间状态。声光调制器(AOM)也可选择使用作为快速快门如果激光器不能被数字调制。
镜头的选择
根据这些限制,以产生所需的在SLM平面的缩小到样品面上的期望的照明图案可被确定。这允许两个透镜L3和L4中的图像中继望远镜和激发聚光透镜L5的焦距的计算。在这个系统中的100X / 1.49NA油浸物镜使用具有488纳米和640纳米的激发,因此,使用300和140毫米焦距长度L4和L3,和300毫米L5,给人357X的总的缩小,相当于38毫微米在样品平面的SLM像素尺寸。使用的镜片这个组合,SLM光栅9周期为488纳米的照明和12像素为640纳米在样品给予的172和229纳米的图案间距,对应于分别为70°和67°的入射角。用于玻璃 - 水界面,临界角是61°,和是与波长无关,因此这两个图案间距允许两种波长的TIRF激发。或如果在37℃下操作装备有校正套环的物镜是用于通过在盖玻片的厚度变化引入的球差的校正是有用的。
影像重建
一旦原始SIM数据已经获取它的计算工作,以产生在一个两步骤过程的超分辨图像的问题。首先,照明图案具有用于待确定每一个形象其次,SIM频谱的组件必须分离,并适当地重新组合,以有效支持OTF(参见图6中的插图)的两倍。
投射照明图案的精确知识是至关重要的,因为超分辨频率分量必须是未混合的尽可能准确地防止由重叠部件的残余部分工件。我们确定照明图案参数从原始图像数据之后由Gustafsson 等人 23总之,一组照明参数描述归一化的二维正弦引入的过程后验已经为每个的发现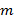 激励模式
激励模式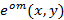 :
:
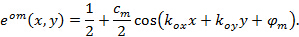
特此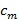 和
和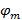 形容条纹对比度分别开始的每幅图像M期的格局。波矢量的分量,
形容条纹对比度分别开始的每幅图像M期的格局。波矢量的分量, 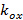 和
和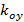 ,只有具有不同的取向变化
,只有具有不同的取向变化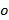 图案和CAN的假设,否则不变。粗略地确定波矢量进行原始图像光谱的互相关,这是由施加子像素转移到交叉相关图像之一作为优化交叠精制的组件。这是通过真实空间相梯度做乘法
图案和CAN的假设,否则不变。粗略地确定波矢量进行原始图像光谱的互相关,这是由施加子像素转移到交叉相关图像之一作为优化交叠精制的组件。这是通过真实空间相梯度做乘法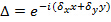 这引起FRE子像素移位昆西空间。要注意的是,以前的实际图案推定具有波矢量的良好估计有用,这可以通过成像的荧光珠层中找到。
这引起FRE子像素移位昆西空间。要注意的是,以前的实际图案推定具有波矢量的良好估计有用,这可以通过成像的荧光珠层中找到。
作为错开图案之间的相位的步骤是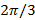 即 。
即 。 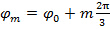 ,频率分量的分离可通过傅立叶来执行沿着"相轴"变换。全球阶段
,频率分量的分离可通过傅立叶来执行沿着"相轴"变换。全球阶段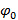 和条纹对比度
和条纹对比度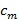 然后可以使用不同的组件的复杂的线性回归来确定。那么该个体分离的组分使用的是广义维纳滤波器相结合。广义维纳滤波器的两个参数提取和实现的详细说明,我们是指读者古斯塔夫森等 23其中使用相同的算法。
然后可以使用不同的组件的复杂的线性回归来确定。那么该个体分离的组分使用的是广义维纳滤波器相结合。广义维纳滤波器的两个参数提取和实现的详细说明,我们是指读者古斯塔夫森等 23其中使用相同的算法。
研究方案
1.安排和调整激发路径
- 标记在光学平台上的部件的位置( 见图1为光学装置的概述)。分离的目的,透镜L3,L4,L5和SLM各由各自的焦距,使得在SLM表面将被中继到所述物镜的焦平面的总和。
- 插入多边缘分色镜DM4到显微镜帧的滤波器立方体炮塔。
- 插入第二分色镜DM3成1"平方动力学镜座,并且其定位为一倍焦距距离聚光透镜L5。
注意:此激发路径设计包括两个相同分光镜DM3和DM4它们是从同一生产批次为确保相同的光学性质。分色镜(DM4)被定位成使得所述仲和对轴相比位于显微镜(DM3)分色切换从而消除任何偏振椭圆率通过其双折射引入( 图1)。这种补偿同样适用于每个照明波长。这个步骤是用于维持高调制对比度是必不可少的。 - 插入任何透镜进入激发路径之前,精确地确定该系统的光轴。
- 除去从转台物镜(OB),并在对准工具代替螺钉。这包括500毫米长的光学笼式系统与两端的两对准盘。
- 使用分色镜DM3和位于SLM的近似以后位置暂时对准镜穿过两个对准磁盘上的孔的中心引导从激光器1的准直参考光束。从激光器1的光束引导到临时镜作为使用三个反射镜和分色镜DM2 图1中描绘。在将SLM位置临时镜必须是接近垂直于光轴。
注意:使用激光器1作为参考光束,作为另一个激光器可以随后对准一旦激发路径就位。 - 拆下对齐工具一旦粗光轴一直determined.Insert虹膜成束路径它进入显微镜机身前后其中心在横梁上。附上一张白卡中心的iris.Reinsert物镜(OB)一个小洞。
注意:在离开物镜的光束现在将高度不同的,但会有从透镜将成为白卡上可见的背面上的非常弱反射。所有透镜,即使它们是防反射涂覆,将具有可用于确保同轴对准弱背反射。如果光束正好垂直于镜头然后背反射将回去通过虹膜的中心 - 让(在SLM位置DM3和校准镜),以两镜反复角度调整在中央背反射该卡与进入的光束。暂时取下物镜(OB)和标记天花板上的激光点来创建一个参考位置。
- 在沿该表的螺纹孔的参考光束的高度插入一对虹膜的。光束应平行于光学表的表面上。光轴现在定义。
- 插入聚光透镜(L5)大致一焦距从客观程。安装在一个线性平移阶段组该透镜沿参考光束的方向平移。
- 调整聚光透镜的位置和角度,使得光束在离开目标被准直并且击中天花板上的参考点。检查该透镜是垂直于光束通过再次检查与虹膜和白卡的背反射。取下物镜(OB),并插入图片继电器望远镜(L4)的第二个镜头。
注:确保的是正确的瞄准和非偏转当有偶数个中的光束路径的镜片时更加容易。 - 调整使用线性平移平台,以保持准直,并确保参照光束仍然击中天花板上的标记点的该透镜的位置和角度。
- 更换物镜(OB),并插入望远镜(L3)的第一透镜。调整该透镜的位置和角度,以确保准直和无偏转,如在先前步骤中所描述。
- 安装在一万向架在SLM芯片安装提供转动而不对芯片表面的中心平移。
注意:特定安装设计取决于所使用的SLM。如果在SLM而不装入供给,它应该被固定到一个定制加工铝板,然后附着到透镜万向安装。 - 与透镜对齐,插入在SLM代替镜子。调整在SLM使得参考光束位于SLM芯片的中心的位置,并调整一个GLE使得光束穿过这两个中继透镜(L3和L4)。检查该参考光束仍集中在显着的斑点。
- 扩展和使用开普勒扩束准直的参考光束。
- 安装在笼子系统的两个透镜(L1和L2),以便调整。
- 中心通过除去透镜,并与虹膜替换它们在参考光束笼系统。
- 插入两个透镜和调整L2的轴向位置进行准直使用剪切干涉仪的扩展光束。 L 2应该是焦距距离SLM的表面。
- 检查扩大束两个中继透镜L3和L4后仍有准直。使用剪切干涉只是DM3后检查准直。
- 一旦激发路径已被对准以单一波长,夫妇其他两个激光器进入光束路径。通过使用为中心的激励路径上的两个虹膜引导每个波束光束合成分色镜(DM1和DM2)。
2.偏振旋转对准
- 安装,其快轴的LCVR在45°入射偏振。
- 通过插入HWP和交叉偏振器之间的LCVR使用消色差半波片(HWP)束入射到LCVR的微调极化角。旋转HWP以最小化发射功率。
注意:为了充当可变旋光元件,液晶延迟器(LCVR)的快轴必须精确地在45°与入射垂直光束偏振对准。该LCVR被物理地安装在45°,但是这仅仅是一个粗对准。的HWP用于确保相对于所述LCVR快轴的入射偏振的完美45°取向。四分之一波片(QWP)由LCVR引起的倾斜的椭圆偏振转换回线性偏振在由所施加的电压控制的角度24。 - 插入LCVR后QWP和旋转由交叉的偏振器之间最小化发射功率到其慢轴对准到输入偏振。
3.发射路径对准
- 粗使用台千分尺幻灯片,透射光定位相机。
- 专注于使用显微镜目镜标线,并在该位置固定物镜。
- 大致居中相机和移动相机的位置通过在屏幕上观察图像,使标线的图像聚焦。
注意:如果一个外部滤波器轮则使用滤波器立方体将不包含发射滤光片,因此目镜不能用于当激光器接通。
- 微调整用荧光珠样品的相机位置。
- 通过散布的100纳米多色珠子上#1.5玻璃罩下降准备的荧光珠单层。离开到DRY吸附珠粒的玻璃罩,然后在水中再次浸入。
- 珠样品放置到与浸油的目标。精细地调整相机的位置,使得所述荧光珠层在焦点。一旦焦点已经发现不调整物镜的位置。
注:由于在SLM必须在一个平面共轭样品平面,SLM的位置,中继透镜,和目标必须是固定的。调整焦点,移动样品轴向而不是使用一个压电z平台的目标。
- 生成相应的SIM二元光栅图案为位图文件。
- 用于2D / TIRF-SIM生成一系列的9二元光栅图像:3图案取向各有3等间隔相移。产生这些数字(用MATLAB例如)从具有相位施加偏移的旋转二维正弦波,那么阈值以产生一个二进制图象。见补充代码文件示例代码。
- 对于alignmen吨的目的,还产生已经通过对每个3取向的小圆孔窗, 如图2光栅图案。该窗口对准光栅不需要外部触发,但可以由用户手动经由切换SLM的软件。
注:请参阅最佳旋转角度的讨论和光栅图形生成代码16,20的例子引用。
- 上传使用制造商的软件(例如MetroCon)的位图图像到SLM。
- 加载SLM控制软件,然后点击"连接"。
- 在"剧目"选项卡,单击"加载"打开曲目文件,并检查运行该文件中包含的订单数。在给出的例子剧目文件有五个运行订单。
- 点击"发送到板"上传曲目文件到SLM。
- 等待位图图像上传第二为设备自动重启。
注:一个例子曲目文件,其中包含光栅位图图像和定义的顺序文件,包括作为补充代码文件。在".repz"文件可以使用ZIP文件归档软件打开。
- 显示窗对准光栅在SLM用于第一方向(例如0°)。
- 在SLM控制软件,选择"状态"选项卡,(在本例中文件的情况下,这是运行命令"1")进入运行秩序的数量。
- 点击"选择"改变了运行秩序的排列光栅。
注意:这将在样品平面照亮一个小的圆形区域。如果在SLM表面被正确地缀合于样品平面则该区域的边缘将在焦点是急剧。光栅模式将在L3的焦点产生多个衍射级:零级反射距离的反光背板SLM,即从特定于SLM设备内部元件的衍射产生的-1和对应于光栅,也较弱高阶+1阶( 例如 ,在像素边缘处的SLM像素和凹凸的内部布线的反射) 。所有,但-1和+1订单必须被过滤掉。
- 插入空间掩模(SM),其安装在一个x,y阶段成L3的焦点位置的光路,且相对于光轴以使得只有所需的第一订单是通过翻译其位置。空间滤波器后直接,只有两个圆形光束是可见的。
注意:空间掩模是通过使用针刺6孔到铝箔制成。孔应足够大,以通过第一阶光束对所有激光波长。空间掩模的详细分析在参照20中给出。 - 显示对准光栅的下一个取向(60°,运行顺序2),并再次确保只有第一个订单是通过空间面具让,调整其位置,如果需要的话。
- 重复最后的方向(120°,运行命令3)。
- 检查相机上的荧光珠层的图像。如果如在图2中所描绘的两个圆形光束不重叠然后通过迭代地调整所述物镜和相机位置重新定位样品平面。
- 调整目标位置重叠的两束,这将带来的图像模糊。重新调整相机把图像成为焦点和微调目标的情况下,两个圈仍清晰可见。直到两束重叠和单个圆形区域处于对焦重复此过程。
- 一旦样品平面的位置已定,保持固定的目标位置。
- 以确认的TIRF照明,图像为488nm的激发波长的荧光染料的溶液中,例如,使用的10的溶液81,M罗丹明6G。
- 把染料样品成为关注的焦点。如果两束入射在正确的TIRF角度,然后单分子将不高的背景中可以看到,和圆孔的边缘,将成为市场关注焦点。参见图2B-D的对齐,对齐TIRF梁的例子。
- 显示窗光栅的每个方位反过来,并确保所有三个方向提供的TIRF照明和该两个光束在样品平面重叠。到的光束的位置的微调可通过调整分色镜DM3制成。
注意:虽然不同波长的光被聚焦在由于轴向色差稍微不同的位置,这不是关键的,并且可以通过施加被校正一个恒定的z偏移与所述第二波长与激发之前样本位置。
4.系统同步和校准
- 将珠单层小号充足的目标,并把成为关注的焦点。
- 利用其控制软件以显示每个依次3相移图象,为第一图案取向(0°)进行编程的SLM。
- 使用SLM控制软件,切换到运行示例剧目4阶。
- 一个正并在全局曝光期间一个负TTL触发信号:使用其采集软件(例如HCImage),以输出两个信号配置相机。在摄像头软件,在"高级相机属性",设置输出触发种类1和2分别为"曝光",并输出触发极性1和2"正面"和"负面"。
- 连接相机的输出1和2的"触发"和"完成"SLM的分别的输入,使用同轴电缆。在SLM现在同步到相机。
- 取得了一系列3图像。
- 在"序列"窗格中,选择"硬盘记录"作为扫描类型,并设置帧计数至3。
- 点击"开始"获取3幅图像。在SLM模式将在每次曝光变化。图像中的荧光珠会出现每3个图像之间的闪烁开启和关闭。闪烁的量是读出的正弦照明图案的调制对比度。
- 旋转激励激光器,以实现方位角偏振,因此,对于给定的图案取向最高调制的对比度使用定制软件的LCVR的极化。
- 加载LCVR校准软件。
- 分别为最小和最大电压输入0和8。
- 点击"扫描LCVR电压"旋转极化。
注意:LCVR延迟是温度的函数,并且可以漂移天到一天甚至与温度控制。在此步骤中,最佳方位角偏振由sweepi经验发现纳克其最小和最大电压具有在样品旋转的偏振入射的效果之间的施加电压。调制对比度计算每个电压25,并且达到峰值对比度在下面的步骤中使用的电压。 - 等待校准过程完成,并记下测得的电压。
- 重复此校准过程对于剩余的两个图案取向(60度和120度),并且每个激发波长。
- 同步相机曝光与LCVR,激光,发射滤光片轮和压电z台26。要做到这一点,使用高速数据采集(DAQ)板作为主时钟源系统,并使用SLM的LED输出使能信号调制激光器( 见图3B)。
注:具体实现是取决于所使用的组件,但为数字三正使用高速数据采集板的gger同步和使用模拟电压,通过软件控制的LCVR的控制下,值得推荐。在这个协议中使用的控制软件可根据要求。 - 由于轴向色差,对于每个波长,同时适用的z偏移到样品台。
- 确定通过集中多色珠粒单层样品在第一波长( 例如 488纳米),然后切换到第二( 例如 ,640纳米)的实验所抵消。珠现在将失焦。
- 重新聚焦珠和测量需要在z位置的变化。此偏移然后可以每次激发波长改变时施加到压电z平台。
- 使用SLM控制软件,切换SLM运行秩序到全系列的TIRF-SIM所需的9二元光栅图像。这是在本例中的曲目运行秩序0。
- 使用相机控制软件,收购珠样品9的图像。
- 在拍照软件的"序列"窗格中,选择"硬盘记录"作为扫描类型,并改变帧计数为9。
- 点击"开始",以获取图像。
- 选择"TIFF"作为"保存缓冲图像"窗口中的图像类型,然后单击确定保存采集的图像为TIFF文件。
- 重建使用商用或定制的软件,以验证在通过标准的TIRF分辨率的提高的原始TIFF图像的超分辨率图像。
注:对于我们的显微镜,我们使用自定义代码重构包括内部和林梢博士27开发的。
结果
多色100nm的直径的荧光珠成像以标准的TIRF比较的TIRF-SIM和量化在横向分辨率可达到的改善( 图4A - B)。使用如在文献27,28中概述的标准算法,进行原帧的重建成超分辨率图像。它可以看出,TIRF-SIM显然具有显著更高横向分辨率相比TIRF。显微镜的点扩散函数(PSF)是公由单个子衍射尺寸荧光珠的图像近似,因此在PSF和分辨率可以通过拟合2D高斯函数为每个波长单个珠子来量化。基于该半峰全宽(FWHM)的平均值显微镜的估计分辨率为89纳米和为488和640纳米的TIRF-SIM分别( 图4C)116纳米。这相当于一个双折即兴vement在相比于理论衍射极限情况下,两个波长的横向分辨率。荧光标记的淀粉样蛋白原纤维也可用于演示双倍分辨率( 图4D)优良的测试样品。通过温育标记的,用10%若丹明衍生物染料(488 nm激发)放置1周,随后用TIRF-SIM成像β淀粉样形成体外淀粉样蛋白原纤维。见参考文献12获取更多信息。
具有高对比度如emGFP亚细胞结构标记的微管( 图5B,G)或LifeAct-GFP( 图5D)是理想的TIRF-SIM成像和产生高对比度的超分辨率图像。使用在此协议中详述的设置TIRF-SIM成像使得位于基底细胞皮层附近的微管的亚群的观察,和微管聚合和解聚能b见过一段时间(动画图1)。并非所有的样品适合与TIRF-SIM,影像,尤其是低对比度样品中没有离散结构。表达胞质GFP的细胞从在质膜的边缘( 图5F,H和动画图2)预留缺乏高分辨率信息,因而是亚最佳为TIRF-SIM成像作为所得重建与工件重叠基本上TIRF图像。在这样的样品中,在对比度的增加常常可以归因于重建算法的解卷积步骤。
高调制对比度是成功的SIM成像的关键。傅立叶变换重建图像的允许SIM光学传递函数(OTF)( 图6A,插图)的可视化。如果没有通过确保方位极最大化每个方向调节对比度带有偏振旋转器化,存在导致在SIM通带的低信噪比样品中的高分辨率信息非常少的调制。其中使用标准的维纳滤波器方法重建算法将简单地放大在SIM通带的噪声,并产生一个图像,其实质上是六边形(或"蜂窝")振铃伪像( 图6A,右图)覆盖一个标准的TIRF图像。一种可能的增强可能是使用迭代29,30或盲重建算法31,32,以减少这些伪影取决于样品的类型。我们建议使用ImageJ的插件SIMcheck前和改造后33检查SIM数据的质量。
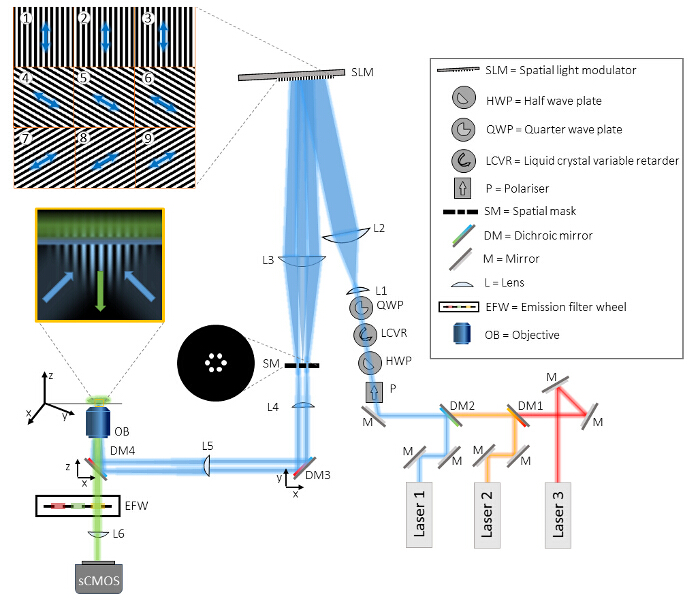
图1:在多色TIRF-SIM设置的布局 TIRF-SIM英里croscope包括三个主要部分,束生成单元,图案投影单元和检测单元。在光束生成单元,三个不同的激光对准到通过分色镜(DM1和DM2)相同的光路,并通过偏振控制四个光学元件引导。首先,偏振器(P),可以确保每个激光光束的线性偏振状态的纯度。需要下列三个光学元件如文中详细描述的一个快速,自动化的方式来旋转偏振。此后,两个透镜(L1和L2)的一个望远镜结构扩大光束到空间光调制器(SLM)的活性表面相匹配,并通过在SLM的投影二元光栅图案衍射成三个子束(实例示于瓦片1- 9)。相对于在SLM图案的照明光的偏光状态被示为箭头。第二望远镜(L3和L4)去放大模式,并提供访问TH在SLM模式电子傅立叶平面。在该平面中的空间掩模(SM)被用来从SLM的像素化结构和它的内部布线滤掉中央组件和其他不需要的衍射元件。前剩下的两个光束经聚光透镜(L5)聚焦到目标(OB)的后焦面,二分色镜(DM3和DM4)被包括在设置。 DM4作为从发射光在荧光显微镜传统的分色镜分离照明。但是,此镜不可避免诱导椭圆,其中可通过DM3,从理想同一批作为DM4的分色镜被补偿的照明光的偏振状态。油浸TIRF物镜具有足够大的NA来直接启动两个反向传播的波上被全反射盖玻片并产生一个结构渐逝场中的盖玻片。将样品安装在XYZ平移台。检测是PERF通过同样的目标和DM4传输ormed,加上带通发射滤光片额外的过滤,安装在计算机控制的滤光轮(EFW)。最后,图像被投影到SCMOS相机通过内部管显微镜镜头(L6)。 请点击此处查看该图的放大版本。

图2:重叠梁对齐 (A)与圆形光圈窗的SLM光栅图案是对齐非常有用。如果两个非重叠的光束是相机(左)上可见,则样品平面的位置必须被迭代地调整所述物镜和相机的轴向位置,以给出单一圆形照明点(右)重新定位。梁必须奥德重叠R以生产用于TIRF-SIM所需的正弦激励模式。如果光束不完全重叠这减小其上形成的干涉图案的视场。 (B和C)的光束的入射的精确角度为TIRF-SIM重要。如果角度不正确,光束之一将不会在为TIRF所需角度和此成像荧光染料溶液时易于看到。一个束入射比其产生的圆形光斑的临界角大的角度,而其他没有,这导致在图像的左侧的明亮的条纹在(B)中。 (D)调节镜DM3的角度可确保两个光束入射在相同的角度,并且这可以通过散焦物镜进行验证:如果正确对齐,荧光染料样品的Z堆叠的XZ投影应显示两个对称交叉与在后台可以忽略不计梁对焦。 请点击此处查看该图的放大版本。
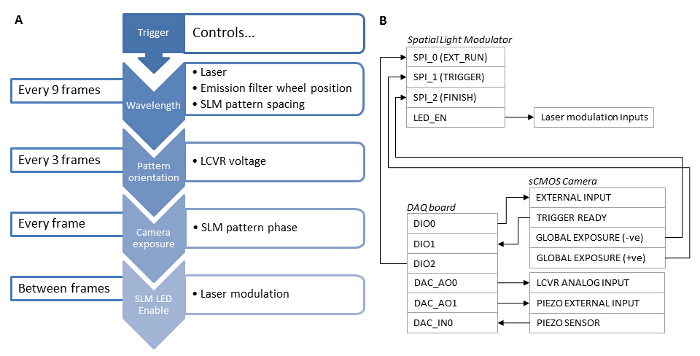
图3:不同系统组件的同步相关性 (A)对于快速SIM采集,使用基于硬件的解决方案系统组件的同步是必不可少的。 (B)的数据采集板(DAQ)应该作为主触发。从数据采集板上的TTL信号被发送到SCMOS外部输入和用于触发照相机曝光。然后相机全局曝光输出触发SLM显示一个光栅图形,和SLM LED使能输出用于以数字方式调节,使得当在SLM像素处于"开"的状态下的激光仅发射激光激发。后曝光是完井德,照相机全局曝光输出用于推进到下一个光栅相或角在SLM图案。该数据采集板还模拟电压输出到LCVR控制器来控制照明光束的线性偏振态。收购3相图像,每个模式的角度后,该电压切换。采集9图片用于单个波长的后,数据采集板输出一个信号到发射滤光轮控制器和切换到下一个波长。 DAQ板卡也适用的z偏移通过输出模拟电压的Z级压电控制器的样品。 请点击此处查看该图的放大版本。
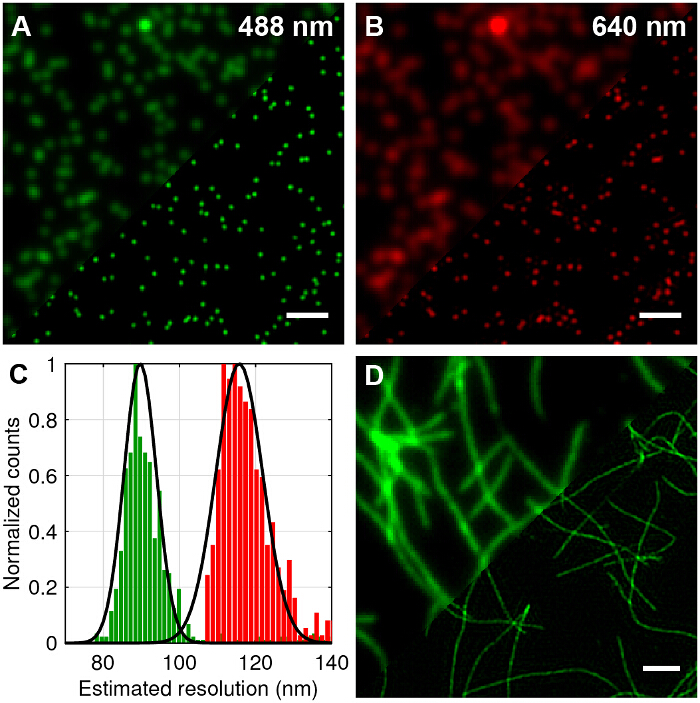
图4:100纳米多色珠子和荧光升试验样品的TIRF-SIM成像abelled淀粉样蛋白原纤维(A和B)标准的TIRF比较相比TIRF-SIM重建为488纳米和640纳米的激发。 (C)高斯全宽半高(FWHM)的直方图适合的TIRF-SIM珠显示分辨率有望提高。 (D)的TIRF与标记有10%的若丹明衍生物染料(488 nm激发)β淀粉样原纤维的TIRF-SIM卡。比例尺= 1微米。 请点击此处查看该图的放大版本。
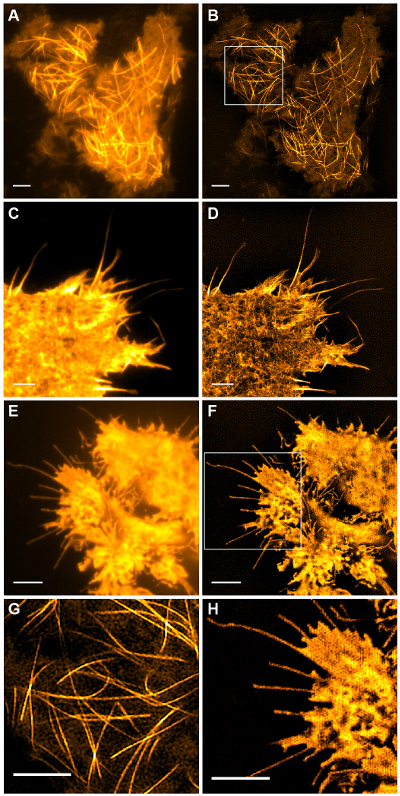
图5:中(A,B)微管(emGFP微管蛋白)在HEK293细胞常规全内反射荧光的活细胞TIRF-SIM成像比较TIRF-SIM图像,(C,D )丝状肌动蛋白(LifeAct-GFP)在COS-7细胞和(E,F)在HEK293细胞胞浆GFP。在B和F的图像是从电影单一时间点。盒装领域列在放大(G,H)。比例尺= 3微米。 请点击此处查看该图的放大版本。
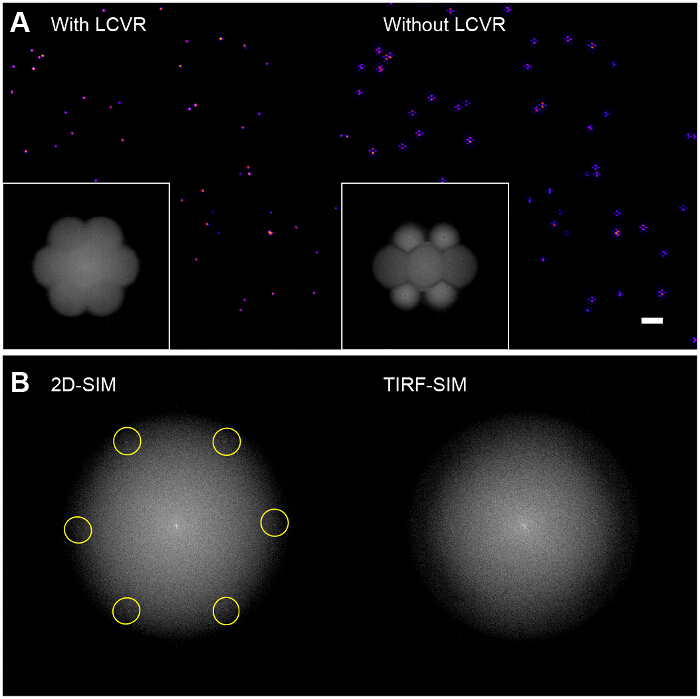
图6:偏振旋转器上重构珠子图像质量的影响 (A)中不使用的偏振旋转器的诸如LCVR,所述信噪比在SIM通带是低,这导致在重构的SIM特性六边形工件图像(右),(B)在2D-SIM卡中,结构照明图案是在傅立叶直接可见在TIRF-SIM但变换原始图像(左,激励空间频率高亮显示),因为它们属于排放OTF支持的范围内的,他们是OTF支持之外,因此不可见(右)。在这种情况下,该模式的调节对比度,必须使用稀疏珠单层进行评估,在协议中所述。 请点击此处查看该图的放大版本。
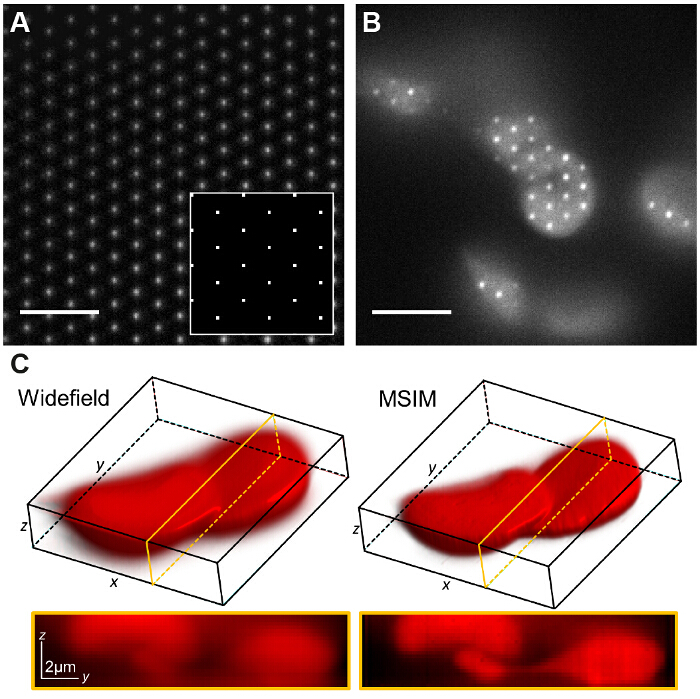
图7:基于空间光调制器模式生成允许其他成像方式,如多灶性SIM的执行情况 ( 一 )MSIM,方形的格子pointsdisplayed在SLM(插图)产生的像面衍射极限灶的网格。低浓度罗丹明6G的一个薄层成像到visua丽泽焦点。该图案在样品(B)的翻译和所获取的原始图像的z叠层重建以生成图像具有减少失焦光(℃)。比例尺= 5微米。 请点击此处查看该图的放大版本。
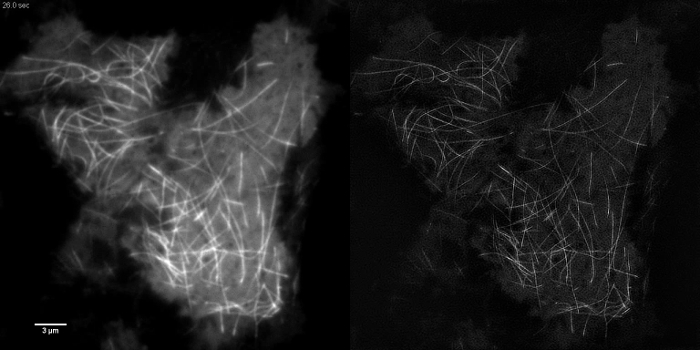
动画图1:在HEK293细胞EmGFP微管蛋白的时间序列的电影快速聚合和emGFP的解聚标记微管可使用的TIRF-SIM观察到。图片使用在0.5秒的间隔隔开每个原始帧50毫秒的曝光时间(每帧的SIM卡450毫秒)收购。所用的接触时间是由荧光团的亮度的限制,不是由照相机或SLM的速度。 3988movie1.mov"目标="_空白">请点击这里观看该视频。
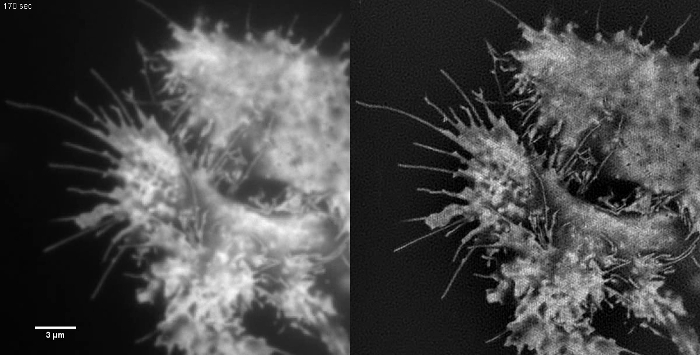
动画图2:胞质的GFP时间序列中的电影HEK293细胞具有低对比度的样品,如此不适合的TIRF-SIM成像理想采样。逆行膜流量可在TIRF图像中可以看出,但TIRF-SIM不会除了在小区边缘提供任何其他信息。 TIRF-SIM图像用每个原始帧(每帧的SIM卡450毫秒)以5秒的间隔隔开50毫秒的曝光时间获得的。 请点击此处观看该视频。
补充代码文件:示例SLM剧目文件(48449_300us_1-bit_Balanced.seq3)。D / 53988 / 48449_300us_1-bit_Balanced.seq3">请点击这里下载该文件。
补充代码文件:例SLM曲目文件(period9_001.bmp) 请点击此处下载此文件。
补充代码文件:例SLM曲目文件(period9_002.bmp) 请点击此处下载此文件。
补充代码文件:例SLM曲目文件(period9_003.bmp) 请点击此处下载此文件。
补充代码文件:示例SLM repertoi重新文件(period9_004.bmp)。 请点击此处下载此文件。
补充代码文件:例SLM曲目文件(period9_005.bmp) 请点击此处下载此文件。
补充代码文件:例SLM曲目文件(period9_006.bmp) 请点击此处下载此文件。
补充代码文件:例SLM曲目文件(period9_007.bmp) 请点击此处下载此文件。
补充编码文件:例SLM曲目文件(period9_008.bmp) 请点击此处下载此文件。
补充代码文件:例SLM曲目文件(period9_009.bmp) 请点击此处下载此文件。
补充代码文件:例SLM曲目文件(period9_mask_1.bmp) 请点击此处下载此文件。
补充代码文件:例SLM曲目文件(period9_mask_2.bmp) 请点击此处下载此文件。 >
补充代码文件:例SLM曲目文件(period9_mask_3.bmp) 请点击此处下载此文件。
补充代码文件:例SLM曲目文件(TIRF-SIM_example.rep) 请点击这里下载此文件。
补充代码文件:例光栅生成代码(1/2)(generate_gratings.m) 请点击此处下载此文件。
补充代码文件:示例光栅生成代码(2/2)(circular_mask.m)。="https://www.jove.com/files/ftp_upload/53988/circular_mask.m">请点击这里下载该文件。
补充代码文件:例子代码来计算调制对比度(calculate_contrast.m) 请点击此处下载此文件。
讨论
定制的TIRF-SIM系统,如在该协议中详述的设置在高速能够多色超分辨率成像相比市售显微镜。 SIM卡作为超分辨率技术的固有优点是,时间分辨率不被荧光团的光物理的限制,相对于其他方法,例如单分子定位显微镜(SMLM)或点扫描方法如受激发射损耗显微镜( STED)。与这些其他技术,SIM卡并不需要光开关或耗竭荧光所以多色成像非常简单。非TIRF-SIM系统,例如光学切片SIM和多焦点的SIM通常可以在实践中实现的1.7倍或更小的分辨率的改进,而不是2的改进这里所报告的因素,和商业系统也往往比系统慢和不灵活在该协议提出的。
">在实施该技术的两个主要的困难是首先对目标的背孔,这需要费时费力光学对准过程的TIR区内六个SIM光束的精确定位的必要性。其次,以产生高图案对比度在样品中,偏振旋转是必要的。对于低NA 2D-SIM卡的系统,偏振旋转可以由线性偏振取向的仔细选择来避免,但这对于TIRF-SIM 25变得不可能。对于高速多色成像,电光偏振控制是必要的,这增加了系统的复杂性和费用。该技术的局限性
TIRF-SIM,像常规的TIRF,自然限于生物结构和位于基底细胞膜能够由消逝场的150-200纳米的穿透深度被照射的处理的观察。而SIM卡被经常引用作为是photodamaging细胞比任STED或SMLM,横向分辨率加倍确实还通过至少4倍5相对于传统的TIRF显微镜增加所需的光子数少。对于以短的曝光时间高帧速率成像,这种光子增加需要增加使用的照明强度。虽然任何荧光团可用于固定或缓慢移动的样品,高亮度的荧光蛋白质或具有增强的光稳定性下一代合成染料的SIM成像推荐用于活细胞成像。
虽然该实施方式是能够成像在超过20赫兹的SIM卡的帧速率的单一色的,在所提出的系统的多色成像是由机动发射滤光轮的开关时间的限制。由于大尺寸的SCMOS相机芯片,利用一个多频带发射滤波器和影像分裂光学器件将是可能的,并且允许同时我与没有速度处罚多个波长maging。另一种可能性是交替的不同的激发激光器和使用多频带的陷波滤波器来拒绝激发光。在该实施方式中使用的二进制铁电SLM的也不是最佳的。这样的SLM的衍射效率是非常低的,所以大部分的入射光是在零阶反射,其通过空间掩模过滤掉。对于要求非常高的帧速率的应用中,成像速度因此由激光二极管的输出功率的限制。在SLM还介绍了极化的波长从550纳米设计波长,其中象素不操作为理想半波偏振片远一些椭圆度。虽然这可以通过使用一个附加的LCVR进行补偿,提供了理想的解决方案可以是作为图案发生器使用数字微镜器件(DMD)的。
可能的修改
设置prese这里nted是柔性的,并且更容易比商用仪器,以便其他成像模态,例如3D-SIM卡,快速2D-SIM卡,多焦点的SIM(MSIM)和非线性的SIM(NL-SIM),可以实现21,34,35修改。
2D-SIM卡可以是适合于成像相对平坦的,快速移动的结构,例如作为外围内质网。外围ER由于其平面结构在于比可使用的TIRF倏逝场,但被照射在小区内更深可以使用标准的2D-SIM卡具有可忽略的失焦背景成像。此外,利用改进的光学切片重建算法来抑制失焦光延长使用2D-SIM的以光学厚的样品,虽然在不要求21轴向分辨率增加一倍。
在MSIM,样品被激发灶36的稀疏晶格照射。这种方式可以通过简单地除去空间掩模来实现(SM),并用偏振替换它。该SLM目前经营作为一个振幅调制器。在SLM上显示的二进制的SIM光栅可以通过斑点的二维晶格代替,以选择为等于在图像平面上的衍射受限的焦点的尺寸的斑点尺寸。在图7A中 ,4×4象素的正方形格子被显示在其上时缩小的样品上产生的150×150纳米衍射有限焦点在SLM(插图),给定的13.62微米的物理SLM像素尺寸。激发灶然后可以通过在SLM上的格子图案移位进行翻译,这是为了照亮的整个视场重复多次。图像被获取为每个翻译图案位置和堆栈后处理,得到具有改进的向上分辨率的重建图像以的系数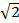 并减少失焦光相比相当于广角图像30。这一方式可以是用于成像厚,致密的样品的量标准的SIM是不适宜,例如低对比度结构,例如染色的红血细胞( 图7C)是有用的,虽然采集时间由于增加的大量原料的帧每个视场必需的(在这种情况下,N = 168)。
并减少失焦光相比相当于广角图像30。这一方式可以是用于成像厚,致密的样品的量标准的SIM是不适宜,例如低对比度结构,例如染色的红血细胞( 图7C)是有用的,虽然采集时间由于增加的大量原料的帧每个视场必需的(在这种情况下,N = 168)。
最后,设置可以被修改,以使任一高NA线性TIRF-SIM或图案化活化非线性的SIM(PA NL-SIM),如Li 等人最近提出,通过使用超高1.7 NA物镜或添加的405nm的光活化激光和SLM光栅图形35的仔细的优化。
未来应用
SIM卡仍是一个迅速发展的技术,在生命科学的许多应用将在未来被启用。速度,分辨率和对比度的技术的改进和使用标准荧光团M的能力EAN,对于生物成像,SIM卡被设置为替代传统的许多显微镜系统,例如共焦和宽视场的平台。商业SIM系统如今已经可以与优秀的技术规格,但是,它们超出了许多研究实验室的金融范围,以及关键的是,他们是不灵活的修改和发展,以实现在该领域的最新研究进展。他们还缺乏必要的能力"被改编为实验在手",经常在前沿生命科学研究的重要瓶颈。这里所描述的系统将特别适合于学习动态过程的细胞表面附近, 在体外重构双层系统的研究,以研究表面化学中的材料和物理科学, 例如 。的二维材料,以及许多其他应用。
披露声明
The authors have nothing to disclose.
致谢
这项工作是由来自利华休姆信托,工程和物理科学研究理事会资助项目[EP / H018301 / 1,EP / G037221 / 1];阿尔茨海默氏症研究英国[ARUK-EG2012A-1];威康信托[089703 / Z / 09 / Z]和医学研究委员会[MR / K015850 / 1,MR / K02292X / 1]。我们分别感谢E. Avezov和M.鲁为LifeAct-GFP转染和细胞质-GFP的细胞,并W. Chen所准备HEK293文化。我们也感谢K. O'Holleran与显微镜的设计服务和L.邵R. Heintzmann有用的讨论和建议。
材料
| Name | Company | Catalog Number | Comments |
| 488 nm laser | Toptica | iBeam SMART | with digital modulation |
| 561 nm laser | Coherent | OBIS LS | with digital modulation |
| 640 nm laser | Cobolt | MLD | with digital modulation |
| Long-pass dichroic mirrors | Thorlabs | for combining excitation beams | |
| Quad band dichroic mirror | Chroma | ZT405/488/561/640rpc | 3 mm thick, TIRF imaging flat, mounted in Olympus BX filter cube |
| Quad band dichroic mirror | Chroma | ZT405/488/561/640rpc | From same batch as above, 25 x 25 mm |
| 1" square kinematic mount | Edmund Optics | 58-860 | |
| Glan-Taylor calcite polarizers | Thorlabs | GT5-A | For alignment of LCVR |
| Glan-Taylor mount | Thorlabs | SM05PM5 | |
| Achromatic half wave plate | Thorlabs | AHWP05M-600 | 400-800 nm |
| Rotation cage mount | Thorlabs | CRM1/M | For HWP |
| Liquid Crystal Variable Retarder | Meadowlark Optics | SWIFT | Custom built to provide full wave retardance over the range 488 to 640 nm. |
| LCVR controller | Meadowlark Optics | D3060HV | Two channel high voltage controller for liquid crystal retarders |
| Achromatic quarter wave plate | Meadowlark Optics | AQM-100-0545 | |
| Rotation cage mount | Thorlabs | CRM1P/M | For QWP |
| 10 mm achromatic doublet | Thorlabs | AC080-010-A-ML | For beam expander |
| 200 mm achromatic doublet | Thorlabs | AC254-200-A-ML | For beam expander |
| Cage XY Translators | Thorlabs | CXY1 | |
| Ferroelectric spatial light modulator | Forth Dimension Displays | M0787-00249 | SXGA-3DM (IFF) Microdisplay Type M249, 1,280 x 1,024 pixels, with driver board |
| SLM mounting frame | Forth Dimension Displays | M0787-10014 | Fixed to custom built aluminium mount |
| Ø50.8 mm Gimbal Mirror Mount | Thorlabs | GM200/M | For SLM mounting |
| Two-Axis Linear Translation Stage with Rotating Platform | Thorlabs | XYR1/M | For SLM mounting |
| Rail carrier | Newport | M-PRC-3 | For SLM mounting |
| Precision Optical Rail | Newport | PRL-6 | For SLM mounting |
| 300 mm achromatic doublet lens | Qioptiq | G322 273 322 | f = 300 mm, 31.5 mm diameter |
| 140 mm achromatic doublet lens | Qioptiq | G322 239 322 | f = 140 mm, 31.5 mm diameter |
| Precision XY Translation Mounts | Thorlabs | LM2XY | |
| Lens Mounting Adapters | Thorlabs | SM2AD32 | For mounting 31.5 mm lenses in 2" mounts |
| Translation stages | Comar | 12XT65 | Dovetail, side drive |
| XY Translator with Differential Drives | Thorlabs | ST1XY-D/M | for spatial filter |
| Rotation cage mount | Thorlabs | CRM1/M | for spatial filter |
| 300 mm achromatic doublet | Thorlabs | AC508-300-A-ML | Excitation tube lens |
| Automated XY stage with Z-piezo top plate | ASI | PZ-2150-XYFT-PZ-IX71 | with MS-2000 controller |
| Inverted microscope frame | Olympus | IX-71 | |
| Objective lens | Olympus | UAPON100XOTIRF | 100X/1.49NA |
| High speed filter wheel | Prior Scientific | HF110A | with Prior ProScan III controller |
| Bandpass emission filters | Semrock | FF01-525/30, FF01-676/29 | |
| sCMOS camera | Hamamatsu | ORCA Flash v4.0 | |
| Stage top incubator | OKO Lab | H301-K-FRAME | For live cell imaging, with Bold Line temperature and CO2 controllers |
| Stainless steel optical posts | Thorlabs | TR series | for mounting optical components |
| Post holders | Thorlabs | PH series | for mounting optical components |
| Kinematic mirror mounts | Thorlabs | KM100 | for mounting 1" mirrors |
| Shearing interferometer | Thorlabs | SI100 | |
| 100 nm fluorescent microspheres | Life Technologies | T-7279 | Tetraspeck |
| Rhodamine 6G | Sigma Aldrich | 83697-250MG | |
| 8 well glass bottom dishes | ibidi | 80827 | with #1.5 coverglass |
| Nunc Lab-Tek II Chambered Coverglass | Thermo Fisher Scientific | 155409 | with #1.5 coverglass |
| 0.01 mm microscope reticle slide | EMS | 68039-22 | |
| CellLight Tubulin-GFP, BacMam 2.0 | Thermo Fisher Scientific | C10613 |
参考文献
- Heintzmann, R., Cremer, C. G. Laterally modulated excitation microscopy: improvement of resolution by using a diffraction grating. BiOS Eur. 3568, 185-196 (1999).
- Gustafsson, M. G. L. Surpassing the lateral resolution limit by a factor of two using structured illumination microscopy. J. Microsc. 198 (2), 82-87 (2000).
- Shim, S. H., et al. Super-resolution fluorescence imaging of organelles in live cells with photoswitchable membrane probes. Proc. Natl. Acad. Sci. U. S. A. 109 (35), 13978-13983 (2012).
- Urban, N. T., Willig, K. I., Hell, S. W., Nägerl, U. V. STED Nanoscopy of Actin Dynamics in Synapses Deep Inside Living Brain Slices. Biophys. J. 101 (5), 1277-1284 (2011).
- Liu, Z., Lavis, L. D., Betzig, E. Imaging Live-Cell Dynamics and Structure at the Single-Molecule Level. Mol. Cell. 58 (4), 644-659 (2015).
- Westphal, V., et al. Video-Rate Far-Field Optical Nanoscopy Dissects Synaptic Vesicle Movement. Science. 320 (5873), 246-249 (2008).
- Davies, T., et al. CYK4 Promotes Antiparallel Microtubule Bundling by Optimizing MKLP1 Neck Conformation. PLOS Biol. 13 (4), e1002121 (2015).
- Laine, R. F., et al. Structural analysis of herpes simplex virus by optical super-resolution imaging. Nat. Commun. 6, 5980 (2015).
- Pinotsi, D., et al. Direct observation of heterogeneous amyloid fibril growth kinetics via two-color super-resolution microscopy. Nano Lett. 14 (1), 339-345 (2014).
- Esbjörner, E. K., et al. Direct observations of amyloid β Self-assembly in live cells provide insights into differences in the kinetics of Aβ(1-40) and Aβ(1-42) aggregation. Chem. Biol. 21 (6), 732-742 (2014).
- Michel, C. H., et al. Extracellular monomeric tau protein is sufficient to initiate the spread of tau protein pathology. J. Biol. Chem. 289 (2), 956-967 (2014).
- Pinotsi, D., Kaminski Schierle, G. S., Kaminski, C. F. Optical Super-Resolution Imaging of β-Amyloid Aggregation In Vitro and In Vivo: Method and Techniques. Syst. Biol. Alzheimer's Dis. SE - 6. 1303, 125-141 (2016).
- Axelrod, D. Cell-substrate contacts illuminated by total internal reflection fluorescence. J. Cell Biol. 89 (1), 141-145 (1981).
- Cragg, G. E., So, P. T. Lateral resolution enhancement with standing evanescent waves. Opt. Lett. 25 (1), 46-48 (2000).
- Chung, E., Kim, D., So, P. T. Extended resolution wide-field optical imaging: objective-launched standing-wave total internal reflection fluorescence microscopy. Opt. Lett. 31 (7), 945 (2006).
- Kner, P., Chhun, B. B., Griffis, E. R., Winoto, L., Gustafsson, M. G. L. Super-resolution video microscopy of live cells by structured illumination. Nat. Methods. 6 (5), 339-342 (2009).
- Fiolka, R., Shao, L., Rego, E. H., Davidson, M. W., Gustafsson, M. G. L. Time-lapse two-color 3D imaging of live cells with doubled resolution using structured illumination. Proc. Natl. Acad. Sci. U. S. A. 109 (14), 5311-5315 (2012).
- Brunstein, M., Wicker, K., Hérault, K., Heintzmann, R., Oheim, M. Full-field dual-color 100-nm super-resolution imaging reveals organization and dynamics of mitochondrial and ER networks. Opt. Express. 21 (22), 26162-26173 (2013).
- Förster, R., et al. Simple structured illumination microscope setup with high acquisition speed by using a spatial light modulator. Opt. Express. 22 (17), 20663 (2014).
- Lu-Walther, H. W., et al. fastSIM: a practical implementation of fast structured illumination microscopy. Methods Appl. Fluoresc. 3, 014001 (2015).
- Shaw, M., Zajiczek, L., O'Holleran, K. High speed structured illumination microscopy in optically thick samples. Methods. , (2015).
- von Olshausen, P. . Total internal reflection microscopy: super-resolution imaging of bacterial dynamics and dark field imaging. , (2012).
- Gustafsson, M. G. L., et al. Three-dimensional resolution doubling in wide-field fluorescence microscopy by structured illumination. Biophys. J. 94 (12), 4957-4970 (2008).
- Meadowlark Optics Inc. . Basic Polarization Techniques and Devices. , (2005).
- O'Holleran, K., Shaw, M. Polarization effects on contrast in structured illumination microscopy. Opt. Lett. 37 (22), 4603 (2012).
- Brankner, S. Z., Hobson, M. . Synchronization and Triggering with the ORCA-Flash4.0 Scientific CMOS Camera. , (2013).
- Gustafsson, M. G. L., et al. Three-dimensional resolution doubling in wide-field fluorescence microscopy by structured illumination. Biophys. J. 94 (12), 4957-4970 (2008).
- Wicker, K. Non-iterative determination of pattern phase in structured illumination microscopy using auto-correlations in Fourier space. Opt. Express. 21 (21), 24692 (2013).
- Boulanger, J., Pustelnik, N., Condat, L. Non-smooth convex optimization for an efficient reconstruction in structured illumination microscopy. 2014 IEEE 11th Int. Symp. Biomed. Imaging. 3 (1), 995-998 (2014).
- Ströhl, F., Kaminski, C. F. A joint Richardson-Lucy deconvolution algorithm for the reconstruction of multifocal structured illumination microscopy data. Methods Appl. Fluoresc. 3 (1), 014002 (2015).
- Mudry, E., et al. Structured illumination microscopy using unknown speckle patterns. Nat. Photonics. 6 (5), 312-315 (2012).
- Ayuk, R., et al. Structured illumination fluorescence microscopy with distorted excitations using a filtered blind-SIM algorithm. Opt. Lett. 38 (22), 4723 (2013).
- Ball, G., et al. SIMcheck: a Toolbox for Successful Super-resolution Structured Illumination Microscopy. Sci. Rep. 5, 15915 (2015).
- York, A. G., et al. Resolution doubling in live, multicellular organisms via multifocal structured illumination microscopy. Nat. Methods. 9 (7), 749-754 (2012).
- Li, D., et al. Extended-resolution structured illumination imaging of endocytic and cytoskeletal dynamics. Science. 349 (6251), (2015).
- York, A. G., et al. Resolution doubling in live, multicellular organisms via multifocal structured illumination microscopy. Nat. Methods. 9 (7), 749-754 (2012).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。