Method Article
Руководство по Structured Illumination TIRF микроскопией на высокой скорости с несколькими цветами
В этой статье
Резюме
This article provides an in depth guide for the assembly and operation of a structured illumination microscope operating with total internal reflection fluorescence illumination (TIRF-SIM) to image dynamic biological processes with optical super-resolution in multiple colors.
Аннотация
Оптический супер-разрешением изображения с структурирован освещения микроскопии (SIM) является ключевой технологией для визуализации процессов на молекулярном уровне в химической и медико-биологических наук. Хотя коммерческие системы SIM доступны, системы, которые специально созданных в лаборатории может превзойти коммерческие системы, последний, как правило, предназначены для простоты использования и применения общего назначения, как с точки зрения верности изображения и скорости. В данной статье представлен детальный путеводитель по созданию системы, которая использует SIM полного внутреннего отражения (TIR) освещения и способна визуализации с частотой до 10 Гц в трех цветах при разрешении достигает 100 нм. Благодаря сочетанию SIM и TIRF, система обеспечивает лучшую контрастность изображения, чем конкурирующие технологии. Для достижения этих спецификаций, несколько оптических элементов используются для автоматизированного контроля за состоянием поляризации и пространственной структуры освещающего света для всех доступных WAV возбужденияelengths. Полная информация о аппаратной реализации и контроля приведены для достижения синхронизации между генерации возбуждающего света картины, длины волны, состояния поляризации и управления камерой с акцентом на достижение максимальной частоты кадров приобретения. Протокол шаг за шагом для выравнивания системы и калибровки представлена и улучшение достижимое разрешение проверяется на идеальных образцах. Возможность для видео-курса супер-разрешением изображения демонстрируется с живыми клетками.
Введение
За последние полгода десятилетия, супер-разрешение микроскопии созрел и переехал из специализированных лабораторий оптики в руки биолога. Существуют коммерческие микроскоп решения для трех основных вариантов для достижения оптических сверхвысокого разрешения: единая локализация молекулы микроскопии (SMLM), стимулируется истощение выбросов микроскопии (STED) и структурированная подсветка микроскопии (SIM) 1,2. SMLM, такие как фотоактивированного локализации микроскопии (PALM) и стохастические оптической микроскопии реконструкции (STORM) были наиболее популярные методы, во многом благодаря простоте оптической схемы и обещание высокого пространственного разрешения, легко вплоть до 20 нм. Однако супер-разрешение микроскопии с помощью локализации одной молекулы приходит с внутренней компромиссом: пространственное разрешение достижимо зависит от накопления достаточного количества отдельных флуорофоров локализаций, следовательно , ограничивает временное разрешение. Динамический процесс обработки изображенийES в живых клетках, следовательно, становится проблематичным, так как необходимо адекватно образец движение структуры, представляющие интерес для предотвращения артефактов движения в то же время приобретая достаточно локализации событий в то время, чтобы восстановить изображение. Для удовлетворения этих требований, живых клеток SMLM демонстрации получили требуемое увеличение ставок Флуорофор photoswitching за счет значительного увеличения мощности возбуждения, а это в свою очередь приводит к фототоксичности и окислительного стресса, ограничивая тем самым время выживания образца и биологическая релевантность 3.
Явное преимущество STED над обоими SIM и SMLM является то , что он может изображение с супер-разрешением в толстых образцах, например пространственным разрешением около 60 нм была достигнута в органотипических срезах мозга на глубинах до 120 мкм 4. Обработки изображений на таких глубинах с единственной целью реализаций SMLM или SIM неосуществим, но становится возможным либо светового листа одной молекулы или решетки света листа микрофонуroscopy 5. Видео-курс STED также было продемонстрировано и используется для сопоставления синаптическую мобильности везикул, хотя до сих пор это было ограничено визуализации небольшие поля зрения 6.
Для применения в клеточной биологии и реакций молекулярных самосборки 7 - 12 , которые требуют обработки изображений с высоким временным разрешением на протяжении многих временных точках, структурированной подсветки микроскопии (SIM - карта) может быть хорошо подходит , поскольку это не зависит от фотофизиче- свойств конкретного флуоресцентной зонд. Несмотря на это Бесспорное преимущество SIM, до сих пор его использование было в основном ограничено визуализации фиксированных клеток или медленно движущихся процессов. Это происходит из-за ограничений, имеющихся в продаже систем SIM: частота кадров Приобретение этих инструментов была ограничена скоростью вращения решетках, используемых для генерации требуемых синусоидальные шаблона освещения, а также с сохранением поляризации оптики. Новое поколение коммерческих SIMинструменты способны быстрой обработки изображений, но они слишком дороги для всех, кроме центральных объектов визуализации.
Этот протокол представляет собой руководство по построению гибкой системы SIM для визуализации быстропротекающих процессов в тонких образцах и вблизи базальной поверхности живых клеток. В нем используется полное внутреннее отражение флуоресценции (TIRF) для создания рисунка освещения , которая проникает не глубже примерно 150 нм в образце 13 , который значительно уменьшает вне фокуса фонового сигнала. Идея объединения SIM с TIRF почти так же стара , как и сама SIM 14 , но не был экспериментально реализован до 2006 года 15. Первый в естественных условиях изображения , полученные с TIRF-SIM были представлены в 2009 году 16 , достигающие частоты кадров 11 Гц для визуализации тубулина и кинезин динамика и две цветовые системы TIRF-SIM были представлены 17,18. Совсем недавно, руководство для строительства и эксплуатации одного цвета двухлучевые SIM-system был представлен с участием фреймовую со скоростью до 18 Гц 19,20.
Установка, представленная здесь, способна супер-разрешением изображения SIM при частоте 20 Гц в трех цветовых вариантах, два из которых могут работать в TIRF-SIM. Вся система построена вокруг перевернутой рамы микроскопа и использует моторизованный этап перевода ху с пьезоэлектрическим приводом г стадии. Для того, чтобы генерировать синусоидальные паттерны возбуждения, необходимые для TIRF-SIM, система представлена использует сегнетоэлектрический пространственного модулятора света (SLM). Бинарные образцы решетки отображаются на ОДС и результирующие ± 1 порядки дифракции фильтруют, ретранслируется и сосредоточены в кольцо МДП линзы объектива. Необходимые фазовые сдвиги и повороты решетках применяются путем изменения отображаемого изображения SLM. Этот протокол описывает, как построить и выровнять такой путь возбуждения, детали выравнивания пути выбросов, а также представлены тестовые образцы для обеспечения оптимального выравнивания. Кроме того, де писцы вопросы и проблемы, определенные на высокой скорости TIRF-SIM относительно контроля поляризации и синхронизации компонентов.
Вопросы проектирования и ограничения
Перед сборкой системы TIRF-SIM, представленный в данном протоколе, существует несколько проектные ограничения, которые следует учитывать, определяющие выбор оптических компонентов. Все сокращения оптических компонентов относятся к фиг.1.
Пространственного модулятора света (SLM)
Бинарное сегнетоэлектрическая ОДС используется в этой установке, как она способна коммутации, к югу от миллисекунды. Оттенки серого нематических SLMS могут быть использованы, но они сильно предлагают сократить время переключения. Каждый или выключает пиксель в двоичном фазе ОДС будет передавать либо я, либо 0 сдвиг фазы в падающей плоской волновой фронт, поэтому если периодическая решетка рисунок отображается на ПОМ он будет работать в качестве фазовой дифракционной решетки.
лор "> полного внутреннего отражения (TIR) Для достижения МДП и производят мимолетную поле, угол падения пучков возбуждения на границе между стеклом и образца должна быть больше, чем критический угол 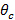 , Это устанавливает минимальный угол падения требуется, а значит, и максимальное расстояние, или период, в запредельном шаблона освещения. Максимальный угол падения
, Это устанавливает минимальный угол падения требуется, а значит, и максимальное расстояние, или период, в запредельном шаблона освещения. Максимальный угол падения  (Угол приема) ограничивается числовой апертуре (NA) линзы объектива, который может быть вычислен из определения
(Угол приема) ограничивается числовой апертуре (NA) линзы объектива, который может быть вычислен из определения 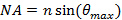 , Это определяет минимальный интервал достижимо шаблон в соответствии с формулой Аббе
, Это определяет минимальный интервал достижимо шаблон в соответствии с формулой Аббе 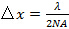 которая связывает NA и длину волны
которая связывает NA и длину волны 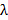 до минимального расстояния шаблона
до минимального расстояния шаблона  . На практике, 1,49 Н.А. масла погружения TIRF цель дает максимальный угол падения около 79 ° и минимальный период Узор на образце 164 нм с использованием длины волны возбуждения 488 нм. Эти два угла образуют кольцо в задней отверстия объектива , по которому прибор достигает освещения МДП (т.е.. Кольце МДП) и в котором должны быть точно расположены очаги возбуждения двух и точно вращают для генерации каждого шаблона освещения.
. На практике, 1,49 Н.А. масла погружения TIRF цель дает максимальный угол падения около 79 ° и минимальный период Узор на образце 164 нм с использованием длины волны возбуждения 488 нм. Эти два угла образуют кольцо в задней отверстия объектива , по которому прибор достигает освещения МДП (т.е.. Кольце МДП) и в котором должны быть точно расположены очаги возбуждения двух и точно вращают для генерации каждого шаблона освещения.
Реконструкция изображений TIRF-SIM требует приобретения минимум трех фазовых сдвигов на оборот шаблона поэтому период шаблон ОДС должен делиться на 3 (см рисунок 1). Например, в течение 9 пикселей для 488 нм подсветкой и 12 пикселей для 640 нм освещения. Для всестороннего обсуждения дизайна ОДС картины, в том числе оптимизации подпиксельной шаблона разнесением с помощью стриженого решеток, Смотрите предыдущую работу Кнер и др. 16 и Lu-Walther и др. 20 положения двух очагов возбуждения должны быть внутри кольца МДП для всех длин волн, однако угол дифракции ± 1 порядков от ОДС длины волны зависимой. Для получения стандартной SIM, многоцветные изображения может быть достигнуто за счет оптимизации период решетки для самой длинной длины волны, и допуская потерю в производительности для более коротких каналов. Для TIRF-SIM Однако оптимизации для одной длины волны означает, что другая длина волны фокусы больше не в пределах кольца МДП. Например, с помощью дифракционной решетки, период 9 пикселей является достаточным для обеспечения TIRF для 488 нм, в качестве фокусов на уровне 95% от диаметра задней апертуры и внутри кольца МДП, но на 640 нм, в этот период поместит фокусы снаружи диафрагма. По этой причине различные пиксельный рисунок интервалы должны быть использованы для каждой длины волны возбуждения.
Выравнивание пути возбуждения TIRF-SIMчрезвычайно чувствителен к небольшим изменениям в положении дихроичным зеркалом (DM4 на фиг.1) в корпусе микроскопа, гораздо больше, чем в обычной SIM - карты. Использование вращающегося фильтра куба башни не рекомендуется, вместо того, чтобы использовать один, многополосный дихроичное зеркало, которое удерживается в фиксированном положении и разработан специально для длин волн возбуждения, используемых. Крайне важно, что используются только самые высокие качества дихроичных зеркал. Они требуют толстых подложек не менее 3 мм, и часто обозначается как "плоский" изображение производителями. Все другие субстраты приводят к невыносимым аберрации и ухудшения качества изображения в TIRF-SIM.
Поляризация управления
Для достижения TIRF-SIM необходимо , чтобы повернуть состояние поляризации возбуждающего света в синхронности с рисунком освещения таким образом, что она остается азимутально поляризованным в объективном плане зрачка относительно оптической оси (т.е., s-поляризованной). Выравнивание управления поляризационной оптики будет зависеть от конкретного оптического элемента , используемого, например , ячейки Поккельса 21, или полуволны пластины в моторизованной стадии 22 вращения. В этом протоколе используется пользовательский жидкокристаллический переменная замедлитель (LCVR), предназначена для обеспечения полной волны (2л) retardance в диапазоне длин волн 488 до 640 нм, поскольку она позволяет быстро (~ мс) переключение. При использовании жидкокристаллического замедлитель необходимо использовать компоненту высокого качества: стандартные компоненты, как правило, недостаточно стабильны, чтобы дать постоянную retardance по длине от времени экспозиции камеры, что приводит к размыванию из шаблона освещения и низкой контрастности модуляции , Жидкокристаллические замедлители также сильно зависит от температуры и требуют встроенный контроль температуры.
синхронизация
Лазеры должны быть синхронизированы с ПОМ. Бинарные сегнетоэлектрических SLMS внутренне уравновешен сколдовской между включенном состоянии и выключенном состоянии. Пиксели действуют только как полуволна пластины в любом их или выключенном состоянии, но не во время межкадрового переключения времени. Поэтому лазеры должны включаться только во вкл / выкл состояний через светодиод Включить сигнал от ОДС, чтобы предотвратить снижение контрастности рисунка в связи с промежуточным состоянием пикселей. Акустооптический модулятор (АОМ) в качестве альтернативы может быть использован в качестве быстрого затвора, если лазеры не могут быть с цифровой модуляцией.
Выбор объективов
Исходя из этих ограничений требуемое уменьшение плоскости ОДС на плоскость образца для получения желаемого шаблона освещения может быть определена. Это позволяет рассчитать фокусных расстояний двух линз L3 и L4 в эстафете изображения телескопа и конденсатора возбуждения линзы L5. В этой системе 100X / 1.49NA масло погружением линзы объектива используется при длине волны 488 нм и 640 нм возбуждение, следовательно, использует фокусными расстояниями 300 и 140 ммдля L4 и L3, а также 300 мм для L5, доводя общую уменьшение масштаба от 357X, что эквивалентно размеру ОДС пикселя 38 нм в плоскости образца. С помощью этой комбинации линз, ОДС решетки периодов 9 для 488 нм подсветкой и 12 пикселей на 640 нм дают шаблонов расстояниями 172 и 229 нм, в образце, что соответствует углах падения 70 ° и 67 °, соответственно. Для поверхности раздела стекла и воды, критический угол составляет 61 °, и не зависит от длины волны, поэтому эти две модели позволяют расстояния TIRF возбуждения для обеих длин волн. Объектив оборудован коррекции воротник полезно для коррекции сферических аберраций, вносимых изменениями толщины покровного, или если он работает при 37 ° C.
Реконструкция изображения
После того, как исходные данные SIM было приобретено это вопрос вычислительных усилий, чтобы генерировать сверхвысоким разрешением изображения в два этапа. Во-первых, распределение освещенности должен быть определен длякаждое изображение и , во- вторых, компоненты спектра SIM должны быть разделены и рекомбинируют соответствующим образом , чтобы удвоить эффективную поддержку OTF (рисунок 6, вклейки).
Точное знание проектируемых моделей освещения имеет первостепенное значение, так как супер-разрешенные частотные компоненты должны быть несмешанное настолько точно, насколько это возможно, чтобы предотвратить артефакты, вызванные остаточными частями перекрывающихся компонентов. Определим распределение освещенности параметры апостериори из данных исходного изображения , следуя процедуре , введенной Густафссон и др. 23 Короче говоря, набор параметров освещения , которое описывает нормированную двумерную синусоиду должен быть найден для каждого из 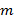 паттерны возбуждения
паттерны возбуждения 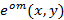 :
:
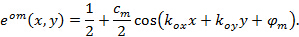
настоящим 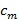 а также
а также 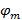 описывают контрастность интерференционных полос и образец начальной фазы каждого отдельного изображения м соответственно. Компоненты волнового вектора,
описывают контрастность интерференционных полос и образец начальной фазы каждого отдельного изображения м соответственно. Компоненты волнового вектора, 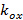 а также
а также 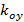 , Изменяются только с различной ориентацией
, Изменяются только с различной ориентацией  шаблона и может быть, предполагается, что в противном случае константа. Для крупно определить компоненты волнового вектора выполняется кросс корреляции спектров сырого изображения, которое рафинированного путем применения Subpixel сдвигов к одному из кросс-коррелированных изображений с целью оптимизации перекрытия. Это делается с помощью умножения фазовых градиентов в реальном пространстве
шаблона и может быть, предполагается, что в противном случае константа. Для крупно определить компоненты волнового вектора выполняется кросс корреляции спектров сырого изображения, которое рафинированного путем применения Subpixel сдвигов к одному из кросс-коррелированных изображений с целью оптимизации перекрытия. Это делается с помощью умножения фазовых градиентов в реальном пространстве 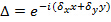 которые вызывают сдвиг субпикселей в Freтота-пространство. Обратите внимание, что полезно иметь хорошую оценку поверхности волновых векторов до фактической оценки шаблона и это можно найти с помощью получения изображения флуоресцентного шарик слой.
которые вызывают сдвиг субпикселей в Freтота-пространство. Обратите внимание, что полезно иметь хорошую оценку поверхности волновых векторов до фактической оценки шаблона и это можно найти с помощью получения изображения флуоресцентного шарик слой.
По мере того как шаг фаз между сдвинутыми паттернов 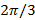 , То есть.
, То есть. 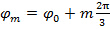 , Разделение частотных компонентов, могут быть выполнены с помощью преобразования Фурье вдоль "синфазной оси". Глобальная фаза
, Разделение частотных компонентов, могут быть выполнены с помощью преобразования Фурье вдоль "синфазной оси". Глобальная фаза 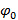 и контраст интерференционных полос
и контраст интерференционных полос 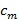 то может быть определено с использованием сложной линейной регрессии различных компонентов. Отдельные компоненты разделены затем комбинируют с использованием обобщенного фильтра Винера. Для детального описания как извлечения параметров и реализации обобщенного фильтра Винера мы отсылаем читателя к Густафссони др. 23 , где используется тот же алгоритм.
то может быть определено с использованием сложной линейной регрессии различных компонентов. Отдельные компоненты разделены затем комбинируют с использованием обобщенного фильтра Винера. Для детального описания как извлечения параметров и реализации обобщенного фильтра Винера мы отсылаем читателя к Густафссони др. 23 , где используется тот же алгоритм.
протокол
1. Расположение и выравнивание возбуждению Path
- Отметьте положение компонентов на оптическом столе (см рисунок 1 для обзора оптической установки). Отделить цель, линзы L3, L4, L5 и ОДС каждый на сумму соответствующих фокусных расстояний, что поверхность ОДС будет передана на фокальной плоскости объектива.
- Вставка нескольких кромок дихроичное зеркало DM4 в светофильтров револьверная головка корпуса микроскопа.
- Вставьте второй дихроичное зеркало DM3 в "квадрат кинетического зеркала 1 крепление, и расположить его один фокусное расстояние от линзы конденсатора L5.
Примечание: Эта конструкция включает в себя путь возбуждения двух одинаковых дихроичных зеркал DM3 и DM4, которые взяты из той же партии, чтобы обеспечить одинаковые оптические свойства. Дихроичное зеркало (DM4) расположен таким образом, что s- и p- осей переключаются по сравнению с дихроичной расположенной в микроскопе (дм3), таким образом, отменяя любыеэллиптичности поляризации представлен его двулучепреломления (рис 1). Эта компенсация работает одинаково хорошо для каждой длины волны освещения. Этот шаг имеет важное значение для поддержания высокой контрастности модуляции. - Перед тем как вставить какой-либо линзы в пути возбуждения, точно определить оптическую ось для системы.
- Снимите линзу объектива (OB) с башенкой и вместо того, чтобы ввернуть инструмент выравнивания. Он состоит из длинной оптической системы сепаратора 500 мм с двумя дисками выравнивания на обоих концах.
- С помощью дихроичного зеркала дм3 и временное зеркало выравнивания, расположенную на приблизительном месте последующего ПОМ, чтобы направить коллимированный эталонный пучок от лазера 1 по центру отверстий в двух дисков с выравниванием. Прямой луч от лазера 1 к временному зеркало , как показано на рисунке 1 с использованием трех зеркал и дихроичного зеркала DM2. Временное зеркало в позиции ОДС должна быть близка к перпендикулярной к оптической оси.
Примечание: используйте лазер 1 в качестве опорного пучка, а остальные лазеры могут быть впоследствии выровнены только путь возбуждения находится на месте. - Извлеките инструмент для центровки, как только грубой оптической оси была determined.Insert ирис в пути луча, прежде чем она входит в тело микроскопию и центрировать его на балку. Прикрепите лист белой карты с небольшим отверстием по центру на iris.Reinsert объектива (OB).
Примечание: луч покидает цель теперь будет сильно расходящиеся, но будет очень слабое отражение от задней поверхности линзы, которая будет отображаться на белую карточку. Все линзы, даже если они являются Антибликовое покрытие, будет иметь слабые обратные отражения, которые могут быть использованы для обеспечения коаксиального выравнивания. Если луч точно перпендикулярно к объективу, то обратного отражения вернется через центр радужной оболочки глаза - Сделайте итерационные угловые корректировки двух зеркал (дм3 и выравнивание зеркала на позиции ОДС), чтобы сосредоточить обратное отражение накарта с входящего пучка. Временно снимите линзы объектива (OB) и отметьте лазерное пятно на потолке, чтобы создать исходное положение.
- Вставьте пару ирисов на высоте опорного пучка вдоль резьбовых отверстий таблицы. Пучок должен быть параллельна поверхности оптического стола. теперь определяется оптической оси.
- Вставьте конденсатор объектив (L5) примерно один фокусное расстояние в сторону от цели. Установите этот объектив на линейном множестве этапе перевода для перевода по направлению опорного луча.
- Отрегулируйте положение объектива конденсатора и угол таким образом, что луч покидает цель коллимируется и попадает в опорную точку на потолке. Убедитесь, что объектив перпендикулярно к балке, снова проверяя обратное отражение с радужной оболочкой и белой карты. Снимите линзу объектива (OB) и вставьте второй объектив реле изображения телескопа (L4).
Примечание: Обеспечение надлежащего коллимации и не связанные с отклонением бытьутра становится проще, когда есть четное число линз в пути луча. - Отрегулируйте положение и угол этого объектива, используя линейную стадию перевода для поддержания коллимации и обеспечить опорный луч все еще попадает на заметное пятно на потолке.
- Заменить линзу объектива (OB) и вставьте первый объектив телескопа (L3). Отрегулируйте положение и угол этого объектива для обеспечения коллимации и не-отклонение, как описано в предыдущих шагах.
- Установите чип ОДС на кардановом подвесе, который обеспечивает вращение без перевода относительно центра поверхности чипа.
Примечание: Конкретный монтаж конструкции зависит от используемого ОДС. Если ОДС поставляется без монтировки, она должна быть прикреплена к пользовательской механической обработке алюминиевой пластины, которая затем крепится к линзе карданный крепление. - С помощью линзы выровнен, вставьте ОДС вместо зеркала. Отрегулируйте положение ОДС таким образом, что опорный луч находится в центре чипа ОДС, а также настроить апгле таким образом, что луч проходит через два реле линзы (L3 и L4). Убедитесь, что опорный луч по-прежнему сосредоточены на отмеченных месте.
- Расширить и сколлимировать опорного пучка с использованием кеплеровское расширитель пучка.
- Смонтировать две линзы (L1 и L2) в системе клетка для облегчения регулировки.
- Центр системы Клетка на опорном пучке путем удаления линз и заменить их ирисов.
- Вставьте две линзы и регулировать осевое положение L2 для коллимации расширенного луча с помощью интерферометра сдвига. L2, должен быть один фокусное расстояние от поверхности ПОМ.
- Убедитесь, что расширенный луч еще коллимировалось после двух релейных линз L3 и L4. С помощью интерферометра сдвига только после того, как DM3 для проверки коллимации.
- После того, как путь возбуждения был приведен в соответствие для одной длины волны, пара двух других лазеров в пути луча. Steer каждый луч через два ирисы, сосредоточенных на пути возбуждения с использованиемЛуч сочетания дихроичных зеркал (DM1 и DM2).
2. Выравнивание поляризационных Rotator
- Установить LCVR с его быстрой оси под углом 45 ° к падающему поляризации.
- Точная угол мелодия поляризации падающего пучка к LCVR с помощью ахроматический полуволна пластины (ВПТ), вставив ВПТ и LCVR между скрещенных поляризаторов. Поверните ВПТ для минимизации передаваемой мощности.
Примечание: Для того, чтобы выступать в качестве переменной вращатель поляризации, быстрой оси жидкокристаллического замедлитель (LCVR), должны быть точно выровнены под углом 45 ° по отношению к падающему вертикальной поляризации пучка. LCVR, физически установлен под углом 45 °, но это лишь грубое выравнивание. ВПТ используется для обеспечения идеальной 45 ° выравнивание падающей поляризации относительно LCVR быстрой оси. Четвертьволновой пластины (QWP) преобразует наклоненную эллиптическую поляризацию, вызванную LCVR обратно к линейной поляризации под углом под контролем приложенного напряжения24. - Вставьте QWP после LCVR и поверните его, чтобы выровнять его медленную ось, входящему поляризации путем минимизации передаваемой мощности между скрещенными поляризаторами.
3. Выравнивание Пути выбросов
- Крупно положение камеры с помощью микрометра слайд и проходящем свете.
- Фокус на визира с помощью микроскопа окуляра и зафиксировать объектив в этом положении.
- Грубо центрирования камеры и переместить положение камеры, чтобы привести образ визира в фокусе, наблюдая изображение на экране.
Примечание: Если внешний фильтр колесо используется то фильтр куб не будет содержать фильтр излучения, поэтому окуляры не должны использоваться, когда лазеры включаются.
- Мелко отрегулировать положение камеры, используя флуоресцентный образец шарик.
- Подготовьте монослой флуоресцентных шариков, распространяя каплю 100 нм многоцветным бисером на # 1,5 покровного стекла с. Оставьте ггу адсорбировать бус покровного стекла, а затем снова погружать в воду.
- Поместите образец шарик на цели с иммерсионного масла. Мелко отрегулировать положение камеры таким образом, что флуоресцентный шарик слой находится в фокусе. Не регулируйте объективную позицию объектива, как только внимание было найдено.
Примечание: В качестве ОДС должен быть в плоскости, сопряженной плоскости образца, положение ОДС, реле линзы, и цель должна быть исправлена. Для регулировки фокуса, перемещения образца по оси вместо цели, используя пьезо Z-стадии.
- Произведите соответствующие SIM-бинарные образцы решетки как растровые файлы.
- Для 2D / TIRF-SIM, генерирует серию из 9 двойных решеток изображений: 3 модели ориентаций каждая с 3 одинаково отстоящих друг от друга фазовых сдвигов. Сформировать их численно (с использованием MATLAB, например) из повернутого 2D синусоиды с фазовым сдвигом применяется, то для получения пороговой бинарное изображение. См дополнительные файлы кода, например кода.
- Для alignmenT цели, также генерируют образцы решетки , которые были оконную обработку небольшим круглым отверстием для каждой из 3 -х направлений, как показано на рисунке 2. оконного решетки выравнивание не нужно быть внешне срабатывает , но может быть вручную переключаться пользователем с помощью программное обеспечение ОДС в.
Примечание: Смотрите ссылки для обсуждения оптимальных углов поворота и пример решетки шаблона генерации кода 16,20.
- Вы можете добавить растровые изображения в ОДС, используя программное обеспечение производителя (например MetroCon).
- Загрузите программное обеспечение управления SLM и нажмите кнопку "Connect".
- На вкладке "Репертуар", нажмите кнопку "Загрузить", чтобы открыть файл репертуар и проверить количество запущенных заказов, содержащихся в файле. В примере файла репертуара данного есть пять Выполняемые заказы.
- Нажмите кнопку "Отправить Board", чтобы загрузить файл репертуар ПОМ.
- Подождите, пока растровые изображения для загрузкий для устройства автоматической перезагрузки.
Примечание: Репертуар пример файла, который содержит решетчатые растровые изображения и файл, определяющий порядок, включен в качестве файла Справочная кода. Файл ".repz" может быть открыт с помощью программного обеспечения архиватор ZIP файла.
- Дисплей оконном выравнивания решетки на SLM для первой ориентации (например, 0 °).
- В программном обеспечении управления SLM, выберите вкладку "Status", введите номер исправность (в случае примера файла, это снаряженном состоянии "1").
- Нажмите кнопку "Выбрать", чтобы изменить исправность на выравнивание решетки.
Примечание: Это будет освещать небольшую круглую область в плоскости образца. Если поверхность ОДС правильно конъюгированный с плоскости образца, то ребра этой области резко будут в фокусе. Решетка модели будет производить несколько заказов дифракции в фокусе L3: отражение нулевого порядка от отражающей объединительной панелиОДС, -1 и +1 заказы , соответствующие решетки, а также более слабых высших порядков , которые возникают из -за дифракции внутренних элементов , специфичных для устройства SLM (например. Отражения внутренних электропроводок пикселей , SLM и неровностей на пиксельных краев) , Все, кроме -1 и +1 заказы должны быть отфильтрованы.
- Вставка пространственная маска (SM) установлен в х, у сцены в пути луча в фокальной положении L3, и перевести его положение по отношению к оптической оси таким образом, что только желаемые первые заказы передаются. Непосредственно после того, как пространственного фильтра, только две круговые лучи будут видны.
Примечание: Пространственное маска изготовлена путем пробивки отверстий 6 в алюминиевую фольгу с помощью иглы. Отверстия должны быть достаточно большими, чтобы пройти первые лучи порядка для всех лазерных длин волн. Подробный анализ пространственной маски приведено в качестве ссылки 20. - Отображение следующей ориентации решетки выравнивания (60 °, работает порядка 2) и сновагарантировать, что только первые заказы пропускаются пространственной маски, регулируя его положение при необходимости.
- Повторите эти действия для окончательной ориентации (120 °, работает порядка 3).
- Проверьте изображение флуоресцентного слоя шарика на камере. Если две круговые лучи не перекрываются , как показано на рисунке 2 , а затем изменить положение плоскости образца путем итеративного регулировки линзы объектива и положения камеры.
- Отрегулируйте объективную позицию, чтобы перекрывать два луча, которые дадут изображение в фокусе. Переставьте камеру, чтобы принести изображение обратно в центр внимания и тонкой настройки цели в случае, если два круга все еще видны. Повторите этот процесс, пока два пучка не пересекаются и одна круговая область находится в фокусе.
- После того, как положение плоскости образца было установлено, сохранить объективную позицию фиксированной.
- Для подтверждения TIRF освещения, изображение раствор флуоресцентного красителя, например, для длины волны возбуждения 488 нм, используют раствор 1081; M родамина 6G.
- Принесите образец красителя в фокус. Если два луча падают под правильным углом TIRF, то отдельные молекулы будут видны без высокого фона, а края круглого отверстия будет находиться в фокусе. Смотрите рисунок 2B-D примеры выровненных и неровные TIRF балок.
- Дисплей каждую ориентацию окошками решетками, в свою очередь, и обеспечить, чтобы все три ориентации обеспечивают TIRF освещение и что два луча пересекаются в плоскости образца. Точная регулировка положения пучков могут быть сделаны путем корректировки дихроичного зеркала дм3.
Примечание: Несмотря на то, как различные длины волн сосредоточены на несколько разных позиций из-за осевой хроматической аберрации, это не является критическим и может быть исправлена путем приложения постоянного Z-смещение положения образца до начала возбуждения с второй длиной волны.
4. Система синхронизации и калибровки
- Поместите шарик монослоя Sобилен на цели и привести в фокус.
- Запрограммируйте SLM с помощью своего программного обеспечения управления для отображения каждого из изображений 3 фазового сдвига в свою очередь, для первой ориентации рисунка (0 °).
- С помощью программного обеспечения управления SLM, переключиться на запуск порядка 4 из примера репертуара.
- Настройка камеры с помощью своего программного обеспечения сбора данных (например HCImage) для вывода двух сигналов: один положительный и один отрицательный сигнал триггера TTL во время глобального периода экспозиции. В программном обеспечении камеры, в разделе "Advanced Camera Properties", установите выход триггера Вид 1 и 2 к «экспозиции», и выход триггера Полярность 1 и 2 на «позитивный» и «негативный» соответственно.
- Подключение выходов 1 и 2 камеры к "Trigger" и "Finish" входы SLM соответственно, с использованием коаксиального кабеля. ОДС теперь синхронизируются с камерой.
- Приобретать серию из 3 изображений.
- В "последовательности" панели выберите &# 34; Жесткий диск Запись "в качестве типа сканирования, а также установить количество кадров до 3.
- Нажмите кнопку "Пуск", чтобы получить 3 кадра. Структура ОДС будет меняться при каждой экспозиции. Флуоресцентные шарики в изображении будут появляться мигать и выключаться между каждой из 3-х изображений. Количество моргание является считаны из контраста модулирующего синусоидального шаблона освещения.
- Поворот поляризации лазерного возбуждения с LCVR с использованием специального программного обеспечения для достижения азимутальной поляризации и, следовательно, высокий контраст модуляции для данной ориентации образца.
- Загрузите программное обеспечение калибровки LCVR.
- Введите 0 и 8 для минимального и максимального значения напряжения соответственно.
- Нажмите "зачистка LCVR напряжение", чтобы повернуть поляризацию.
Примечание: LCVR retardance является функцией температуры и может дрейфовать изо дня в день, даже с контролем температуры. На этом этапе, оптимальная азимутальной поляризация найдена эмпирически Sweepiнг приложенного напряжения между его минимальным и максимальным напряжением, которое имеет эффект вращающегося инцидента поляризации в образце. Контраст модуляции рассчитывается для каждого напряжения 25 и напряжения , который достигает пика контраста используется в следующих шагах. - Дождитесь завершения процесса калибровки для завершения, и запишите измеренное напряжение.
- Повторите этот процесс калибровки для оставшихся двух шаблонов ориентаций (60 ° и 120 °), и каждая из длин волн возбуждения.
- Синхронизация экспозиции камеры с LCVR, лазеры, излучение фильтр колеса и пьезо г-стадии 26. Для достижения этой цели , использовать для сбора данных высокоскоростной (DAQ) плату в качестве источника тактового сигнала ведущего для системы, и использовать ОДС привело Включение выходного сигнала для модуляции лазеров (рис 3B).
Примечание: Конкретная реализация зависит от используемых компонентов, но с использованием высокоскоростного DAQ платы для цифрового три-Синхронизация gger и управление LCVR с использованием аналогового напряжения, управляемый с помощью программного обеспечения, рекомендуется. Программное обеспечение управления, используемый в данном протоколе предоставляется по запросу. - Из-за осевого хроматических аберраций, для каждой длины волны, а также применить Z-смещение на стадии образца.
- Определить экспериментально компенсировано фокусировки на образце монослоя многоцветной шарика на первой длине волны (например. 488 нм) , то переключение на второй (например. 640 нм). Шарики теперь будет в фокусе.
- Переориентировать шарики и измерить изменение в положении г, что было необходимо. Это смещение может быть применен к пьезоэлектрическим г ступени каждый раз, когда длина волны возбуждения изменяется.
- С помощью программного обеспечения управления SLM, переключить SLM порядок участия в полной серии из 9 двойных решеток изображений, необходимых для TIRF-SIM. Это Запуск порядка 0 в примере репертуара.
- С помощью программного обеспечения управления камерой, приобретают 9 изображений образца шарика.
- В "Sequence" панели программного обеспечения камеры, выберите "Hard Disk Record" в качестве типа сканирования, а также изменить количество кадров до 9.
- Нажмите кнопку "Пуск" для получения изображений.
- Сохраните полученные изображения как TIFF-файлов, выбрав "TIFF" как тип изображения в окне "Сохранить буферном Images", и нажав кнопку OK.
- Реконструировать супер-разрешением изображения из необработанных изображений TIFF с использованием коммерческого или специального программного обеспечения для проверки улучшения разрешения по сравнению со стандартными TIRF.
Примечание: Для нашего микроскопа мы используем пользовательский код реконструкции разработан как в доме , и д - р Лин Шао 27.
Результаты
Многоцветный диаметром 100 нм флуоресцентные шарики были обследованы для сравнения стандартный TIRF для TIRF-SIM и количественно достижимую улучшение бокового разрешения (Рисунок 4A - B). Реконструкция исходных кадров в изображения сверхвысокого разрешения осуществляли с использованием стандартных алгоритмов , как описано в литературе 27,28. Можно видеть, что TIRF-SIM, очевидно, имеет значительно выше боковое разрешение по сравнению с TIRF. Функция рассеяния точки (PSF) микроскопа хорошо аппроксимируется изображением одного суб-дифракционного размера флуоресцентного шарик, поэтому ФРТ и разрешающая способность может быть определена количественно путем подбора функции 2D гауссовых к отдельным бусин для каждой длины волны. Расчетная разрешающая способность микроскопа , основанного на среднем значении полувысоте полной ширины (FWHM) составляет 89 нм и 116 нм для 488 и 640 нм TIRF-SIM соответственно (фиг.4С). Это соответствует двукратному Improvement в боковом разрешении для обеих длин волн по сравнению с теоретической дифракции ограниченного случая. Флуоресцентно меченных амилоидные фибриллы также являются отличным тестовый образец для демонстрации удвоенное разрешение (рис 4D). Амилоидные фибриллы были сформированы в пробирке путем инкубирования -амилоида , меченного 10% родамин производными красителями (488 нм возбуждение) в течение 1 недели , а затем получения изображения с TIRF-SIM. См ссылку 12 для получения дополнительной информации.
Субклеточных структур с высокой контрастностью, как emGFP помечены микротрубочек (рис 5В, G) или LifeAct-GFP (рис 5D) идеально подходят для работы с изображениями TIRF-SIM и дают изображения сверхвысокого разрешения с высокой контрастностью. изображений TIRF-SIM с помощью установки, подробно описанную в данном протоколе позволяет наблюдать субпопуляции микротрубочек, расположенных в непосредственной близости от базальных клеток коры, и полимеризация микротрубочек и деполимеризации может бе видели в течение долгого времени (анимированные Рисунок 1). Не все образцы поддаются визуализации с TIRF-SIM, в частности, низких образцов контрастных без дискретных структур. Клетки , экспрессирующие цитозольного GFP отсутствие высокой информации о разрешающей способности в сторону от по краям плазматической мембраны (рис 5F, H и анимированные рисунок 2) и , следовательно , неоптимальной для визуализации TIRF-SIM в качестве результирующих реконструкциях по существу TIRF изображений наложенные с артефактами. В таких образцах, увеличение контраста часто можно отнести к шагу деконволюции алгоритма восстановления.
Высокая контрастность модуляции имеет важное значение для успешной визуализации SIM. Преобразование Фурье восстановленного изображения позволяет визуализировать оптической передаточной функции SIM (OTF) (6А, вставка). Без максимизации контраста модуляции для каждой ориентации путем обеспечения азимутальной полярнойризации с поляризационным ротатора, существует очень мало модуляции информации с высокой разрешающей способностью в образце, приводящей к низким отношением сигнал-шум в SIM-полос пропускания. Алгоритмы реконструкции , которые используют стандартный фильтр подход Винера просто усиливают шум в SIM и полос пропускания дают изображение , которое по существу представляет собой стандартное TIRF изображение перекрывается с гексагональной (или "соты") ореолы (рис 6A, правая панель). Возможное повышение может быть использование алгоритмов 31,32 итеративных 29,30 или слепота восстановления , чтобы уменьшить эти артефакты , в зависимости от типа образца. Мы рекомендуем использовать ImageJ плагин SIMcheck для проверки качества данных SIM до и после реконструкции 33.
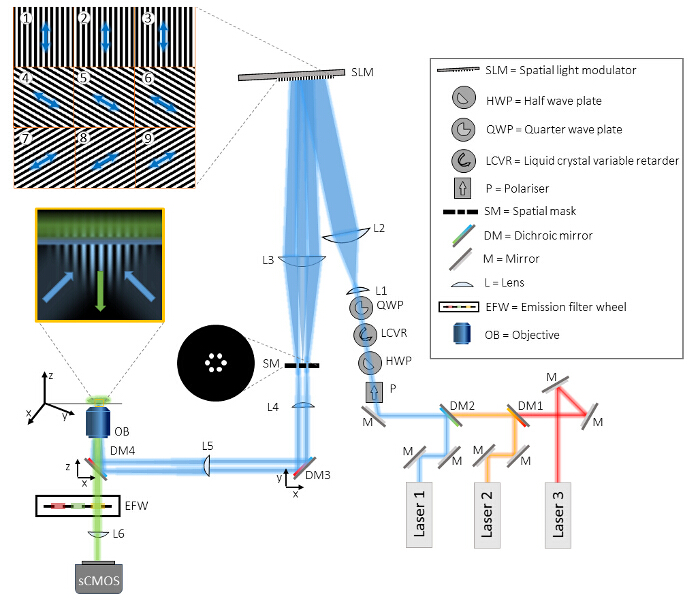
Рисунок 1:. Макет установки Многоцветный TIRF-SIM TIRF-SIM милиcroscope состоит из трех основных частей, блок формирования луча, блок проекции модели и блок обнаружения. В блоке формировани луча, три различных лазеров выровнены на той же траектории луча через дихроичных зеркал (DM1 и дм2) и направляется через четыре оптических элементов для управления поляризацией. Во-первых, поляризатор (Р) обеспечивает чистоту линейного состояния поляризации каждого из лазерных лучей. Следующие три оптических элемента необходимы для поворота поляризации в быстрой, автоматизированным способом, как подробно описано в тексте. После этого две линзы (L1 и L2) в телескопическую конфигурацию расширения луча, чтобы соответствовать активной поверхности пространственного оптического модулятора (SLM) и дифрагированного на три бимлетов по проектируемых двоичными образцы решетки ОДС (в примерах показаны в плитках 1- 9). Состояние поляризации освещения света по отношению к образцу ОДС показано, как стрела. Второй телескоп (L3 и L4) де-усиливающая шаблон и предлагает доступ к йплоскость е Фурье шаблона ОДС. В этом плане пространственная маска (SM) используется, чтобы отфильтровать центральный компонент и другие нежелательные компоненты дифракции от пиксельного структуры ОДС и ее внутренней проводки. Перед тем как два оставшихся пучки фокусируются на задней фокальной плоскости объектива (OB) с помощью линзы конденсатора (L5), два дихроичных зеркал (дм3 и DM4) включены в установку. DM4 действует как обычный дихроичным зеркалом в флуоресцентной микроскопии, чтобы отделить освещение от излучаемого света. Тем не менее, это зеркало неизбежно вызывает эллиптичность в состоянии поляризации света подсветки, которая может быть компенсировано DM3, дихроичного зеркала с идеально той же партии, DM4. Масло погружения TIRF цель имеет достаточно большой NA непосредственно запуск двух встречных волн на покровное, которые отражаются полностью и приводят к структурированной эванесцентной поля в покровное. Образец устанавливается на стадии XYZ перевода. Обнаружение является перфорацияormed через ту же самую объективную и DM4 в передаче, плюс дополнительная фильтрация с помощью фильтров выбросов полосовой, установленный в компьютерным управлением фильтра колеса (EFW). Наконец, изображение проецируется на камеру sCMOS с помощью внутреннего тубуса микроскопа линзы (L6). Пожалуйста , нажмите здесь , чтобы посмотреть увеличенную версию этой фигуры.

Рис . 2: Выравнивание перекрывающихся пучков (А) решетка шаблон ОДС оконном с круглым отверстием полезно для выравнивания. Если два не перекрывающихся пучков видны на камере (слева), то положение плоскости образца должна быть приложена путем итеративного регулировки осевого положения объектива и камеры, чтобы дать одно кольцевое освещение пятно (справа). Лучи должны перекрываться в Ordeг для получения синусоидальной картину возбуждения, необходимого для TIRF-SIM. Если лучи не полностью перекрывают это уменьшает поле зрения, по которой формируется интерференционная картина. (В и С) Точный угол падения пучков имеет важное значение для TIRF-SIM. Если угол является неправильным, один из лучей не будет под нужным углом для TIRF и это хорошо видно при визуализации раствора флуоресцентного красителя. Один пучок имеет угол падения больше , чем критический угол , который дает круговое пятно, а другой нет, что приводит к яркой полосой на левой части изображения в (B). (D) Регулировка угла наклона зеркала DM3 обеспечивает оба луча падает под тем же самым углом, и это может быть подтверждено расфокусировка цель: если правильно выровнены, XZ проекция г стопкой образца флуоресцентного красителя должны показать два симметрично пересекающихся балки с незначительным фон нафокус. Пожалуйста , нажмите здесь , чтобы посмотреть увеличенную версию этой фигуры.
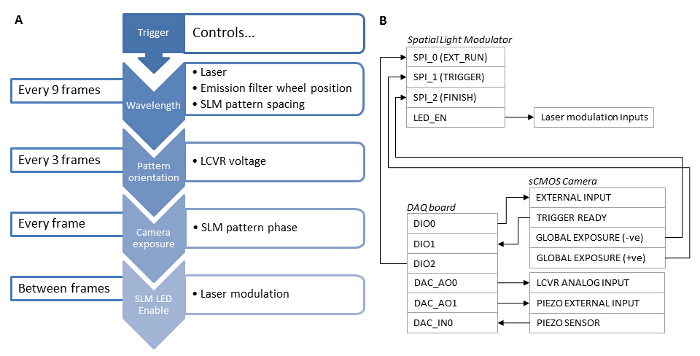
Рисунок 3: Синхронизация. Зависимости в различных системных компонентов (А) для быстрого сбора SIM, синхронизация системных компонентов с использованием решения на основе аппаратных средств имеет важное значение. (B) плата сбора данных (DAQ) следует использовать в качестве мастер - триггера. ТТЛ сигнал от платы сбора данных посылается на sCMOS внешнего входа и используется для запуска экспозиции фотокамеры. Камера Глобальный выход экспозиции затем запускает ОДС, чтобы отобразить образец решетки и SLM LED Включить выход используется для цифровой модуляции лазерного возбуждения таким образом, что лазер только испускать, когда пиксели ОДС находятся в состоянии «включено». После того, как экспозиция КомплексыТ.Е., камера глобальный выход экспозиции используется для продвижения шаблон SLM к следующей фазе решетки или под углом. Плата DAQ также выдает аналоговое напряжение на контроллер LCVR контролировать линейное состояние поляризации светового луча. Это напряжение включается после приобретения изображений фазы 3 для каждого угла рисунка. После приобретения 9 изображений для одной длины волны, плата DAQ выдает сигнал на контроллер колеса фильтра выбросов и переходит к следующей длине волны. Плата DAQ также применяет г-смещение образца путем вывода аналогового напряжения на контроллер Z-этап пьезо. Пожалуйста , нажмите здесь , чтобы посмотреть увеличенную версию этой фигуры.
Рисунок 4: TIRF-SIM визуализации опытных образцов 100 нм Многоцветный шариков и флуоресцентно Labelled амилоидные фибриллы. (А и В) Сравнение стандартного TIRF по сравнению с реконструкций TIRF-SIM для 488 нм и 640 нм возбуждения. (C) Гистограмма полноширинные половинной максимальной (FWHM) гауссовых подходит к шарикам TIRF-SIM с указанием ожидаемого улучшения разрешающей способности . (D) по сравнению с TIRF TIRF-SIM -амилоида фибрилл , меченных 10% родамина производной красителя (488 нм возбуждение). Масштабные полоски = 1 мкм. Пожалуйста , нажмите здесь , чтобы посмотреть увеличенную версию этой фигуры.
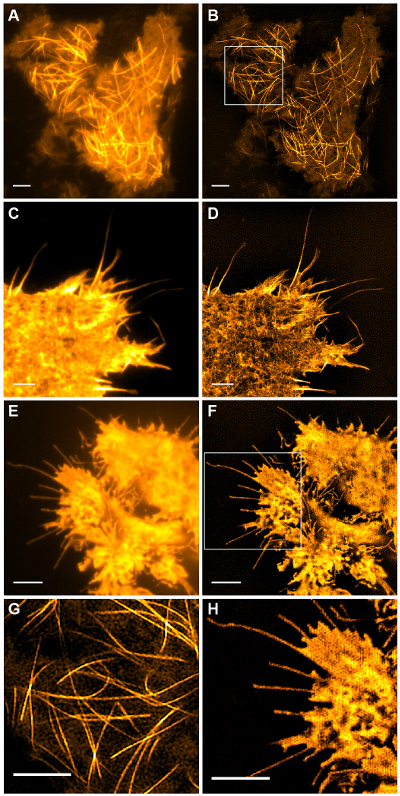
Рис . 5: Живая Cell TIRF-SIM визуализации Сравнение обычных TIRF и TIRF-SIM изображения (A, B) микротрубочек (emGFP-тубулина) в ячейке HEK293, (C, D ) нитчатые актин (LifeAct-GFP) в клетке COS-7 и (E, F) цитозольного GFP в клетке HEK293. Изображения в B и F единичные моменты времени из фильмов. Коробочные участки показаны в увеличенном (G, H). Масштабные полоски = 3 мкм. Пожалуйста , нажмите здесь , чтобы посмотреть увеличенную версию этой фигуры.
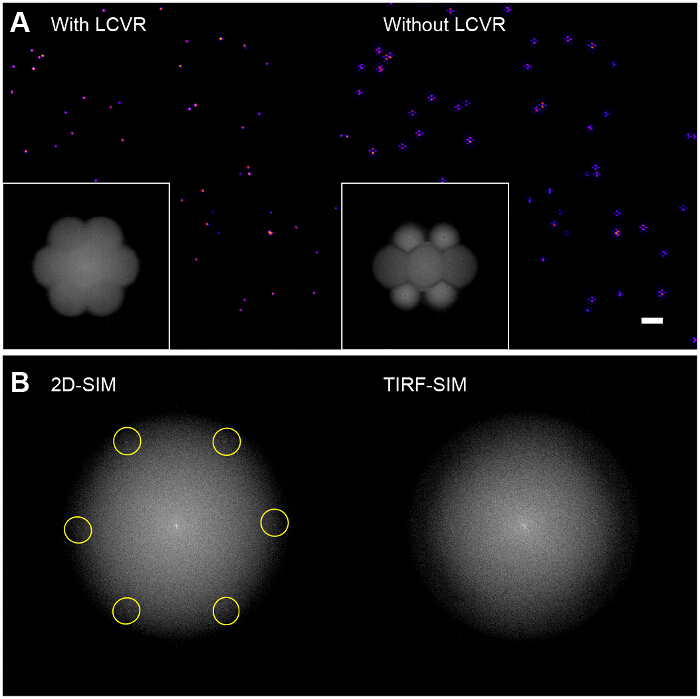
Рис . 6: Влияние поляризационных Rotator на реконструированный из бисера изображений (A) Без использования поляризационный ротатор , таких как LCVR, отношение сигнал-шум в SIM - полос пропускания мала , что приводит к характерным гексагональных артефактов в реконструированном SIM изображения (справа), (B) в 2D-SIM, структурированные модели освещения непосредственно видны в Фурьепреобразование исходных изображений (слева, пространственная частота возбуждения подсвечена), поскольку они находятся в пределах радиуса поддержки OTF выбросов, однако в TIRF-SIM, они находятся за пределами поддержки OTF и поэтому не видна (справа). В этом случае контраст модуляции картина должна быть оценена с помощью разреженного шарика монослой, как указано в протоколе. Пожалуйста , нажмите здесь , чтобы посмотреть увеличенную версию этой фигуры.
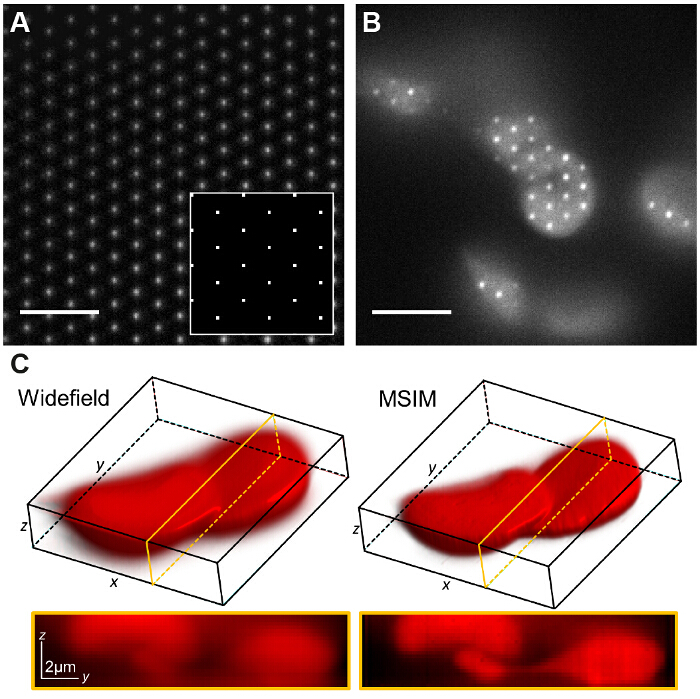
Рис . 7: пространственный модулятор света паттернов поколения позволяет реализовать другие методы визуализации , такие как Многофокальные SIM (А) В MSIM, решетка площади pointsdisplayed на SLM (врезке) дает решетку дифракции ограниченных очагов на плоскости изображения. Тонкий слой низкой концентрации родамина 6G проецируется в visua атрических фокусы. Картина переведена через образец (B) и приобретенное сырое изображение Z-стек перестраивается для создания изображения с уменьшенным вне фокуса света (C). Масштабные полоски = 5 мкм. Пожалуйста , нажмите здесь , чтобы посмотреть увеличенную версию этой фигуры.
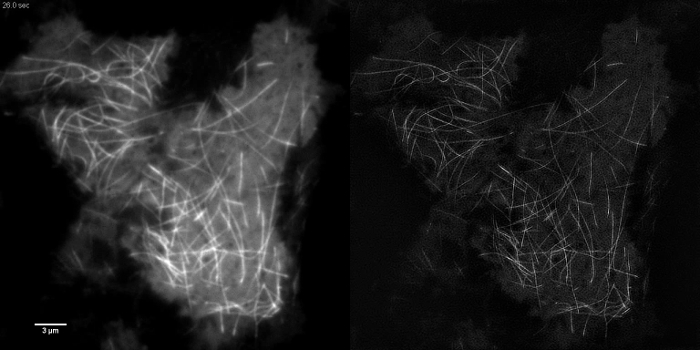
Анимированные Рисунок 1:. Время серии фильма EmGFP-тубулина в клетке HEK293 быстрой полимеризации и деполимеризации emGFP маркированы микротрубочки можно наблюдать с помощью TIRF-SIM. Изображения, полученные с использованием 50 мс время экспозиции каждого кадра сырой (450 мс на кадр SIM) с интервалом 0,5 сек. Время экспозиции была ограничена яркость флуорофора, а не скорость камеры или ОДС. 3988movie1.mov "целевых =" _blank "> Пожалуйста, нажмите сюда, чтобы просмотреть это видео.
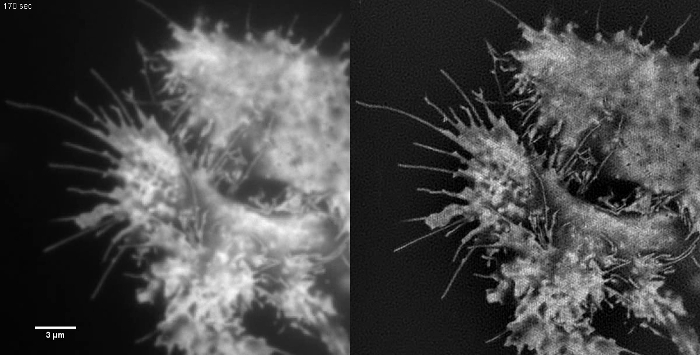
Анимированные Рисунок 2:. Время серии фильма цитозольного GFP в ячейке HEK293 Образцы с низкой контрастностью , такие как это не являются идеальными образцами для визуализации TIRF-SIM. Ретроградный кровоток мембрану можно увидеть в TIRF изображений, но TIRF-SIM не дает никакой дополнительной информации, кроме по краям клеток. Изображения TIRF-SIM были приобретены с использованием 50 мс время экспозиции каждого кадра сырой (450 мс на кадр SIM) с интервалом 5 сек. Пожалуйста , нажмите здесь , чтобы просмотреть это видео.
Справочная файла Код: Пример ОДС репертуар файла (48449_300us_1-bit_Balanced.seq3).d / 53988 / 48449_300us_1-bit_Balanced.seq3 "> Пожалуйста, нажмите здесь, чтобы загрузить этот файл.
Дополнительный код файла:. Пример ОДС Репертуар файл (period9_001.bmp) Пожалуйста , нажмите здесь , чтобы скачать этот файл.
Дополнительный код файла:. Пример ОДС Репертуар файл (period9_002.bmp) Пожалуйста , нажмите здесь , чтобы скачать этот файл.
Дополнительный код файла:. Пример ОДС Репертуар файл (period9_003.bmp) Пожалуйста , нажмите здесь , чтобы скачать этот файл.
Справочная файла Код: Пример ОДС repertoiповторно файл (period9_004.bmp). Пожалуйста , нажмите здесь , чтобы загрузить этот файл.
Дополнительный код файла:. Пример ОДС Репертуар файл (period9_005.bmp) Пожалуйста , нажмите здесь , чтобы скачать этот файл.
Дополнительный код файла:. Пример ОДС Репертуар файл (period9_006.bmp) Пожалуйста , нажмите здесь , чтобы скачать этот файл.
Дополнительный код файла:. Пример ОДС Репертуар файл (period9_007.bmp) Пожалуйста , нажмите здесь , чтобы скачать этот файл.
Дополнительный код файла:. Пример ОДС Репертуар файл (period9_008.bmp) Пожалуйста , нажмите здесь , чтобы скачать этот файл.
Дополнительный код файла:. Пример ОДС Репертуар файл (period9_009.bmp) Пожалуйста , нажмите здесь , чтобы скачать этот файл.
Дополнительный код файла:. Пример ОДС Репертуар файл (period9_mask_1.bmp) Пожалуйста , нажмите здесь , чтобы скачать этот файл.
Дополнительный код файла:. Пример ОДС Репертуар файл (period9_mask_2.bmp) Пожалуйста , нажмите здесь , чтобы скачать этот файл. >
Дополнительный код файла:. Пример ОДС Репертуар файл (period9_mask_3.bmp) Пожалуйста , нажмите здесь , чтобы скачать этот файл.
Дополнительный код файла:. Пример ОДС репертуар файла (TIRF-SIM_example.rep) Пожалуйста , нажмите здесь , чтобы скачать этот файл.
Дополнительный код файла:. Пример кода генерации решетки (1 из 2) (generate_gratings.m) Пожалуйста , нажмите здесь , чтобы скачать этот файл.
Справочная файла Код: Пример кода генерации решетки (2 из 2) (circular_mask.m).= "Https://www.jove.com/files/ftp_upload/53988/circular_mask.m"> Пожалуйста, нажмите здесь, чтобы загрузить этот файл.
Дополнительный код файла:. Пример кода для расчета контраста модуляции (calculate_contrast.m) Пожалуйста , нажмите здесь , чтобы скачать этот файл.
Обсуждение
Пользовательские встроенные системы TIRF-SIM, такие как настройки подробно в данном протоколе способны многоцветной супер-разрешением изображения на высокой скорости по сравнению с коммерчески доступными микроскопов. Бесспорное преимущество SIM в качестве метода сверхвысокого разрешения является то, что временное разрешение не ограничивается фотофизике флуорофора, по сравнению с другими методами, такими как одна молекула локализации микроскопии (SMLM) или методов сканирования точек, таких как стимулируется обеднения выбросов микроскопии ( STED). В отличие от этих других методов, SIM не требует фотопереключаемых или истощаемых флуорофоры так многоцветной визуализации проста. Номера системы TIRF-SIM, такие как оптический секционирования SIM и мультифокальной SIM обычно может добиться улучшения разрешения в 1,7 раза или менее на практике, в отличие от фактора 2 улучшения сообщили здесь, и коммерческие системы также часто медленнее и менее гибким, чем система представленные в этом протоколе.
"> Две основные трудности в реализации этой техники, во-первых, необходимость для точного позиционирования шести SIM-лучей в пределах зоны МДП задней апертуры объективной, которая требует трудоемкой и требует много времени оптическую процедуру выравнивания. Во-вторых, для получения высокой контрастности картины в образце, поворота плоскости поляризации имеет важное значение. для малых систем NA 2D-SIM, вращение поляризации можно избежать путем тщательного выбора ориентации линейной поляризации, но это становится невозможным для TIRF-SIM 25. для получения изображений многоцветной высокоскоростной, электро- оптический контроль поляризации необходимо, и это увеличивает сложность и стоимость системы.Ограничения метода
TIRF-SIM, как обычные TIRF, естественно ограничивается наблюдением биологических структур и процессов, расположенных на базальной мембране клетки, которые могут быть освещаемой глубины проникновения в 150-200 нм исчезающего поля. В то время какSIM - часто цитируется как менее photodamaging к клеткам , чем либо STED или SMLM, латеральное разрешение Удвоение ли еще увеличить требуемое число фотонов , по крайней мере , в 4 раза по сравнению с 5 обычными TIRF микроскопии. Для получения изображений при высокой частоте кадров с короткими выдержками времени, это увеличение фотонов требует использования повышенных освещенностей. Хотя любой флуорофор может быть использован для SIM-визуализации фиксированных или медленных движущихся образцов, высокая яркость флуоресцентных белков или следующего поколения синтетических красителей с повышенной светостойкости рекомендуются для получения изображений живых клеток.
Несмотря на то, что эта реализация способна визуализации одного цвета с частотой кадров SIM свыше 20 Гц, многоцветные изображения в представленной системе ограничена временем переключения моторизованной эмиссионного фильтра колеса. Из-за большого размера чипа камеры sCMOS, использование фильтра эмиссии многополосные и изображения расщепления оптики было бы и разрешить одновременное Imaging с несколькими длинами волн при скорости не штрафа. Другой возможностью было бы чередовать различные лазеры возбуждения и использовать многополосный режекторный фильтр, чтобы отказаться от возбуждающего света. Использование бинарной сегнетоэлектрической SLM в этом варианте осуществления, также не является оптимальным. Дифракционная эффективность такого ОДС очень низка, так что большая часть падающего света в отражении нулевого порядка, который отфильтровывается пространственной маской. Для применений, требующих очень высокую частоту кадров, скорость формирования изображения, таким образом, ограничена выходной мощности лазерного диода. ОДС также вносит некоторую эллиптичность в поляризации для длин волн вдали от 550 нм расчетной длины волны, где пиксели не работают в идеальных полуволна пластин. Хотя это может быть компенсировано за счет использования дополнительного LCVR, идеальным решением может быть использование цифрового микрозеркальное устройства (DMD) в качестве генератора шаблона.
Возможные модификации
Установка Presented здесь является гибким и более легко модифицировать , чем коммерческие инструменты , так что другие методы визуализации , такие как 3D-SIM, быстрая 2D-SIM, мультифокальной SIM (MSIM) и нелинейном SIM (NL-SIM) могут быть реализованы 21,34,35.
2D-SIM может быть хорошо подходит для работы с изображениями относительно плоский, быстро движущихся структур, таких как периферической эндоплазматической сети. Периферийное ER лежит глубже внутри клетки, чем может быть освещена с помощью мимолетную поле TIRF, но благодаря своей плоской конструкции могут быть отображены с использованием стандартного 2D-SIM с незначительным фоном не в фокусе. Кроме того, использование улучшенных алгоритмов реконструкции оптических секционирования для подавления вне фокуса света расширить использование 2D-SIM для оптически толстых образцов, хотя и где осевое разрешение Удвоение не требуется 21.
В MSIM образец освещается редкой решеткой возбуждения очагов 36. Эта модальность может быть реализован путем простого удаления пространственной маски (СМ) И заменив его на поляризатор. ПОМ в настоящее время работает как амплитудный модулятор. Бинарные решетками SIM, отображаемые на SLM могут быть заменены 2D-решетки пятен, с размером пятен, выбранных, чтобы быть равным размеру дифракционного ограниченного фокуса в плоскости изображения. На фиг.7А, решетка из 4 - х 4 пикселя квадратов отображается на ОДС (вставка) , который , когда на , уменьшенной пробе генерирует ограниченную дифракционную фокусы 150 х 150 нм, учитывая физический размер ОДС пикселя 13,62 мкм. Очаги возбуждения, то можно перевести сдвигая решетчатый узор на SLM и это повторяется несколько раз для того, чтобы осветить все поле зрения. Изображения приобретаются для каждого переведенного позиции шаблона и стек после обработки для получения реконструированного изображения с улучшенным разрешением до фактора 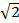 и снижение вне фокуса света по сравнению с эквивалентной Widefield изображения30. Эта модальность может быть полезно для получения изображений толстые, плотные образцы , для которых стандарт SIM - непригодна, например , с низкой контрастностью структур , таких , как окрашенными красных кровяных телец (рис 7c), хотя время обнаружения увеличивается из - за большого количества необработанных кадров требуется на поле зрения (в данном случае N = 168).
и снижение вне фокуса света по сравнению с эквивалентной Widefield изображения30. Эта модальность может быть полезно для получения изображений толстые, плотные образцы , для которых стандарт SIM - непригодна, например , с низкой контрастностью структур , таких , как окрашенными красных кровяных телец (рис 7c), хотя время обнаружения увеличивается из - за большого количества необработанных кадров требуется на поле зрения (в данном случае N = 168).
И, наконец, установка может быть изменена для того, чтобы либо высокой NA линейный TIRF-SIM или с рисунком активации нелинейную SIM (PA NL-SIM), представленный недавно Ли и др., С использованием сверхвысокой 1.7 цели НС или дополнение фотоактивации лазера 405 нм и тщательной оптимизации решетки моделей SLM 35.
Будущие приложения
SIM-прежнему быстро развивается техника и многие приложения в области наук о жизни будет включена в будущем. Скорость, разрешение, и улучшения контраста техники и возможность использования стандартных флуорофоров мЕАН что для биоимиджинга, SIM устанавливается для замены обычных многих систем микроскопа, таких как конфокальной и широкое поле платформ. Коммерческие системы SIM уже доступны сегодня с выдающимися техническими характеристиками, однако они выходят за рамки финансовых возможностей многих научно-исследовательских лабораторий, и, самое главное, они являются негибкими быть изменены и разработаны для реализации новейших разработок научных исследований в этой области. Они также не имеют существенный потенциал для 'быть адаптирована для эксперимента под рукой ", часто критически узкое место в передний край жизни науки исследований. Система , описанная здесь , будет особенно хорошо подходит для изучения динамических процессов вблизи поверхности клеток, для исследования реконструированных двухслойных систем в пробирке, чтобы изучать химию поверхности в материалах и физических наук, например. 2D-материалов, а также многих других приложений.
Раскрытие информации
The authors have nothing to disclose.
Благодарности
Эта работа была поддержана грантами от Leverhulme Trust, инженерным и физическим научным исследованиям Совета [EP / H018301 / 1, EP / G037221 / 1]; Болезнь Альцгеймера Research UK [Aruk-EG2012A-1]; Wellcome Trust [089703 / Z / 09 / Z] и Совет по медицинским исследованиям [MR / K015850 / 1, MR / K02292X / 1]. Мы благодарим Е. Авезовым и М. Лу для трансфекции LifeAct-GFP и цитозольная-GFP клеток соответственно, и W. Chen для подготовки культуры HEK293. Мы также благодарим К. O'Holleran за помощь в разработке микроскопа, и Л. Шао и Р. Heintzmann за полезные обсуждения и предложения.
Материалы
| Name | Company | Catalog Number | Comments |
| 488 nm laser | Toptica | iBeam SMART | with digital modulation |
| 561 nm laser | Coherent | OBIS LS | with digital modulation |
| 640 nm laser | Cobolt | MLD | with digital modulation |
| Long-pass dichroic mirrors | Thorlabs | for combining excitation beams | |
| Quad band dichroic mirror | Chroma | ZT405/488/561/640rpc | 3 mm thick, TIRF imaging flat, mounted in Olympus BX filter cube |
| Quad band dichroic mirror | Chroma | ZT405/488/561/640rpc | From same batch as above, 25 x 25 mm |
| 1" square kinematic mount | Edmund Optics | 58-860 | |
| Glan-Taylor calcite polarizers | Thorlabs | GT5-A | For alignment of LCVR |
| Glan-Taylor mount | Thorlabs | SM05PM5 | |
| Achromatic half wave plate | Thorlabs | AHWP05M-600 | 400-800 nm |
| Rotation cage mount | Thorlabs | CRM1/M | For HWP |
| Liquid Crystal Variable Retarder | Meadowlark Optics | SWIFT | Custom built to provide full wave retardance over the range 488 to 640 nm. |
| LCVR controller | Meadowlark Optics | D3060HV | Two channel high voltage controller for liquid crystal retarders |
| Achromatic quarter wave plate | Meadowlark Optics | AQM-100-0545 | |
| Rotation cage mount | Thorlabs | CRM1P/M | For QWP |
| 10 mm achromatic doublet | Thorlabs | AC080-010-A-ML | For beam expander |
| 200 mm achromatic doublet | Thorlabs | AC254-200-A-ML | For beam expander |
| Cage XY Translators | Thorlabs | CXY1 | |
| Ferroelectric spatial light modulator | Forth Dimension Displays | M0787-00249 | SXGA-3DM (IFF) Microdisplay Type M249, 1,280 x 1,024 pixels, with driver board |
| SLM mounting frame | Forth Dimension Displays | M0787-10014 | Fixed to custom built aluminium mount |
| Ø50.8 mm Gimbal Mirror Mount | Thorlabs | GM200/M | For SLM mounting |
| Two-Axis Linear Translation Stage with Rotating Platform | Thorlabs | XYR1/M | For SLM mounting |
| Rail carrier | Newport | M-PRC-3 | For SLM mounting |
| Precision Optical Rail | Newport | PRL-6 | For SLM mounting |
| 300 mm achromatic doublet lens | Qioptiq | G322 273 322 | f = 300 mm, 31.5 mm diameter |
| 140 mm achromatic doublet lens | Qioptiq | G322 239 322 | f = 140 mm, 31.5 mm diameter |
| Precision XY Translation Mounts | Thorlabs | LM2XY | |
| Lens Mounting Adapters | Thorlabs | SM2AD32 | For mounting 31.5 mm lenses in 2" mounts |
| Translation stages | Comar | 12XT65 | Dovetail, side drive |
| XY Translator with Differential Drives | Thorlabs | ST1XY-D/M | for spatial filter |
| Rotation cage mount | Thorlabs | CRM1/M | for spatial filter |
| 300 mm achromatic doublet | Thorlabs | AC508-300-A-ML | Excitation tube lens |
| Automated XY stage with Z-piezo top plate | ASI | PZ-2150-XYFT-PZ-IX71 | with MS-2000 controller |
| Inverted microscope frame | Olympus | IX-71 | |
| Objective lens | Olympus | UAPON100XOTIRF | 100X/1.49NA |
| High speed filter wheel | Prior Scientific | HF110A | with Prior ProScan III controller |
| Bandpass emission filters | Semrock | FF01-525/30, FF01-676/29 | |
| sCMOS camera | Hamamatsu | ORCA Flash v4.0 | |
| Stage top incubator | OKO Lab | H301-K-FRAME | For live cell imaging, with Bold Line temperature and CO2 controllers |
| Stainless steel optical posts | Thorlabs | TR series | for mounting optical components |
| Post holders | Thorlabs | PH series | for mounting optical components |
| Kinematic mirror mounts | Thorlabs | KM100 | for mounting 1" mirrors |
| Shearing interferometer | Thorlabs | SI100 | |
| 100 nm fluorescent microspheres | Life Technologies | T-7279 | Tetraspeck |
| Rhodamine 6G | Sigma Aldrich | 83697-250MG | |
| 8 well glass bottom dishes | ibidi | 80827 | with #1.5 coverglass |
| Nunc Lab-Tek II Chambered Coverglass | Thermo Fisher Scientific | 155409 | with #1.5 coverglass |
| 0.01 mm microscope reticle slide | EMS | 68039-22 | |
| CellLight Tubulin-GFP, BacMam 2.0 | Thermo Fisher Scientific | C10613 |
Ссылки
- Heintzmann, R., Cremer, C. G. Laterally modulated excitation microscopy: improvement of resolution by using a diffraction grating. BiOS Eur. 3568, 185-196 (1999).
- Gustafsson, M. G. L. Surpassing the lateral resolution limit by a factor of two using structured illumination microscopy. J. Microsc. 198 (2), 82-87 (2000).
- Shim, S. H., et al. Super-resolution fluorescence imaging of organelles in live cells with photoswitchable membrane probes. Proc. Natl. Acad. Sci. U. S. A. 109 (35), 13978-13983 (2012).
- Urban, N. T., Willig, K. I., Hell, S. W., Nägerl, U. V. STED Nanoscopy of Actin Dynamics in Synapses Deep Inside Living Brain Slices. Biophys. J. 101 (5), 1277-1284 (2011).
- Liu, Z., Lavis, L. D., Betzig, E. Imaging Live-Cell Dynamics and Structure at the Single-Molecule Level. Mol. Cell. 58 (4), 644-659 (2015).
- Westphal, V., et al. Video-Rate Far-Field Optical Nanoscopy Dissects Synaptic Vesicle Movement. Science. 320 (5873), 246-249 (2008).
- Davies, T., et al. CYK4 Promotes Antiparallel Microtubule Bundling by Optimizing MKLP1 Neck Conformation. PLOS Biol. 13 (4), e1002121 (2015).
- Laine, R. F., et al. Structural analysis of herpes simplex virus by optical super-resolution imaging. Nat. Commun. 6, 5980 (2015).
- Pinotsi, D., et al. Direct observation of heterogeneous amyloid fibril growth kinetics via two-color super-resolution microscopy. Nano Lett. 14 (1), 339-345 (2014).
- Esbjörner, E. K., et al. Direct observations of amyloid β Self-assembly in live cells provide insights into differences in the kinetics of Aβ(1-40) and Aβ(1-42) aggregation. Chem. Biol. 21 (6), 732-742 (2014).
- Michel, C. H., et al. Extracellular monomeric tau protein is sufficient to initiate the spread of tau protein pathology. J. Biol. Chem. 289 (2), 956-967 (2014).
- Pinotsi, D., Kaminski Schierle, G. S., Kaminski, C. F. Optical Super-Resolution Imaging of β-Amyloid Aggregation In Vitro and In Vivo: Method and Techniques. Syst. Biol. Alzheimer's Dis. SE - 6. 1303, 125-141 (2016).
- Axelrod, D. Cell-substrate contacts illuminated by total internal reflection fluorescence. J. Cell Biol. 89 (1), 141-145 (1981).
- Cragg, G. E., So, P. T. Lateral resolution enhancement with standing evanescent waves. Opt. Lett. 25 (1), 46-48 (2000).
- Chung, E., Kim, D., So, P. T. Extended resolution wide-field optical imaging: objective-launched standing-wave total internal reflection fluorescence microscopy. Opt. Lett. 31 (7), 945 (2006).
- Kner, P., Chhun, B. B., Griffis, E. R., Winoto, L., Gustafsson, M. G. L. Super-resolution video microscopy of live cells by structured illumination. Nat. Methods. 6 (5), 339-342 (2009).
- Fiolka, R., Shao, L., Rego, E. H., Davidson, M. W., Gustafsson, M. G. L. Time-lapse two-color 3D imaging of live cells with doubled resolution using structured illumination. Proc. Natl. Acad. Sci. U. S. A. 109 (14), 5311-5315 (2012).
- Brunstein, M., Wicker, K., Hérault, K., Heintzmann, R., Oheim, M. Full-field dual-color 100-nm super-resolution imaging reveals organization and dynamics of mitochondrial and ER networks. Opt. Express. 21 (22), 26162-26173 (2013).
- Förster, R., et al. Simple structured illumination microscope setup with high acquisition speed by using a spatial light modulator. Opt. Express. 22 (17), 20663 (2014).
- Lu-Walther, H. W., et al. fastSIM: a practical implementation of fast structured illumination microscopy. Methods Appl. Fluoresc. 3, 014001 (2015).
- Shaw, M., Zajiczek, L., O'Holleran, K. High speed structured illumination microscopy in optically thick samples. Methods. , (2015).
- von Olshausen, P. . Total internal reflection microscopy: super-resolution imaging of bacterial dynamics and dark field imaging. , (2012).
- Gustafsson, M. G. L., et al. Three-dimensional resolution doubling in wide-field fluorescence microscopy by structured illumination. Biophys. J. 94 (12), 4957-4970 (2008).
- Meadowlark Optics Inc. . Basic Polarization Techniques and Devices. , (2005).
- O'Holleran, K., Shaw, M. Polarization effects on contrast in structured illumination microscopy. Opt. Lett. 37 (22), 4603 (2012).
- Brankner, S. Z., Hobson, M. . Synchronization and Triggering with the ORCA-Flash4.0 Scientific CMOS Camera. , (2013).
- Gustafsson, M. G. L., et al. Three-dimensional resolution doubling in wide-field fluorescence microscopy by structured illumination. Biophys. J. 94 (12), 4957-4970 (2008).
- Wicker, K. Non-iterative determination of pattern phase in structured illumination microscopy using auto-correlations in Fourier space. Opt. Express. 21 (21), 24692 (2013).
- Boulanger, J., Pustelnik, N., Condat, L. Non-smooth convex optimization for an efficient reconstruction in structured illumination microscopy. 2014 IEEE 11th Int. Symp. Biomed. Imaging. 3 (1), 995-998 (2014).
- Ströhl, F., Kaminski, C. F. A joint Richardson-Lucy deconvolution algorithm for the reconstruction of multifocal structured illumination microscopy data. Methods Appl. Fluoresc. 3 (1), 014002 (2015).
- Mudry, E., et al. Structured illumination microscopy using unknown speckle patterns. Nat. Photonics. 6 (5), 312-315 (2012).
- Ayuk, R., et al. Structured illumination fluorescence microscopy with distorted excitations using a filtered blind-SIM algorithm. Opt. Lett. 38 (22), 4723 (2013).
- Ball, G., et al. SIMcheck: a Toolbox for Successful Super-resolution Structured Illumination Microscopy. Sci. Rep. 5, 15915 (2015).
- York, A. G., et al. Resolution doubling in live, multicellular organisms via multifocal structured illumination microscopy. Nat. Methods. 9 (7), 749-754 (2012).
- Li, D., et al. Extended-resolution structured illumination imaging of endocytic and cytoskeletal dynamics. Science. 349 (6251), (2015).
- York, A. G., et al. Resolution doubling in live, multicellular organisms via multifocal structured illumination microscopy. Nat. Methods. 9 (7), 749-754 (2012).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены