Method Article
Una guía para la iluminación estructurada de microscopía TIRF a alta velocidad con colores múltiples
En este artículo
Resumen
This article provides an in depth guide for the assembly and operation of a structured illumination microscope operating with total internal reflection fluorescence illumination (TIRF-SIM) to image dynamic biological processes with optical super-resolution in multiple colors.
Resumen
Óptica de super-resolución de imagen con iluminación estructurada microscopía (SIM) es una tecnología clave para la visualización de los procesos a nivel molecular de las ciencias biomédicas y químicas. Aunque los sistemas de SIM comerciales están disponibles, los sistemas que están diseñados a medida en el laboratorio puede superar los sistemas comerciales, este último típicamente diseñados para facilidad de uso y aplicaciones de uso general, tanto en términos de la fidelidad de imagen y velocidad. Este artículo presenta una guía detallada para la construcción de un sistema de SIM que utiliza la iluminación de reflexión interna total (TIR) y es capaz de imágenes de hasta 10 Hz en tres colores con una resolución de llegar a 100 nm. Debido a la combinación de SIM y TIRF, el sistema proporciona un mejor contraste de la imagen que las tecnologías rivales. Para cumplir con estas especificaciones, varios elementos ópticos se utilizan para habilitar el control automatizado sobre la estructura y estado de polarización espacial de la luz de iluminación para todos wav excitación está disponibleelengths. se dan detalles sobre la ejecución y control de hardware para lograr la sincronización entre la generación de luz de excitación patrón, longitud de onda, estado de polarización, y el control de la cámara con un énfasis en lograr la máxima velocidad de fotogramas de adquisición. Un protocolo paso a paso para la alineación y calibración del sistema se presenta y la mejora alcanzable resolución se valida en muestras de ensayo ideales. La capacidad para la velocidad de vídeo de super-resolución de imagen se demuestra con las células vivas.
Introducción
Durante la última media década, super-resolución de la microscopía ha madurado y se trasladó de los laboratorios de óptica especialistas en manos de los biólogos. Existen soluciones comerciales de microscopio para las tres variantes principales para lograr la óptica de super-resolución: sola molécula de microscopía de localización (SMLM), estimuló la microscopía agotamiento de emisión (STED), y estructurado iluminación microscopía (SIM) 1,2. SMLM como la microscopía photoactivated localización (PALM) y estocástico microscopía óptica de reconstrucción (Storm) han sido las técnicas más populares, en gran parte debido a la simplicidad de la configuración óptica y la promesa de alta resolución espacial, con facilidad hasta 20 nm. Sin embargo super-resolución microscopía vía única localización molécula viene con una compensación intrínseca: la resolución alcanzable espacial depende de la acumulación de un número suficiente de localizaciones de fluoróforos individuales, por lo tanto, la limitación de la resolución temporal. proceso dinámico de imágenesES en células vivas, por tanto, se convierte en problemático, ya que hay que muestrear adecuadamente el movimiento de la estructura de interés para evitar artefactos de movimiento mientras que también adquirir suficientes eventos de localización en ese momento para reconstruir una imagen. Con el fin de cumplir con estos requisitos, demostraciones en vivo de células SMLM han obtenido el incremento requerido en las tasas de fluoróforo photoswitching aumentando en gran medida la potencia de excitación, y esto a su vez conduce a la fototoxicidad y el estrés oxidativo, lo que limita el tiempo de supervivencia de la muestra y relevancia biológica 3.
Una clara ventaja de STED sobre ambos SIM y SMLM es que puede se logró imagen con super-resolución en muestras gruesas, por ejemplo la resolución lateral de alrededor de 60 nm en cortes de cerebro organotípicos a profundidades de hasta 120 micras 4. Imaging a tales profundidades con implementaciones objetivos individuales de SMLM o SIM es inviable, sino que se hace posible con cualquiera de lámina de luz de una sola molécula o celosía de lámina de luz micrófonoroscopy 5. -STED velocidad de vídeo también se ha demostrado y se utiliza para mapear la movilidad de las vesículas sinápticas, aunque hasta ahora esto se ha limitado a la formación de imágenes pequeños campos de visión 6.
Para aplicaciones en la biología celular y reacciones moleculares de autoensamblaje 7 - 12 que requiere de formación de imágenes con alta resolución temporal sobre muchos puntos de tiempo, estructurado microscopía de iluminación (SIM) puede ser muy adecuado, ya que no depende de las propiedades fotofísicas de un fluorescente particular, sonda. A pesar de esta ventaja inherente de SIM, hasta ahora su uso se ha limitado principalmente a las imágenes de células fijas o procesos de movimiento lento. Esto es debido a las limitaciones de los sistemas SIM disponibles en el mercado: la velocidad de cuadro de adquisición de estos instrumentos estaba limitada por la velocidad de rotación de las rejillas utilizadas para generar los patrones de iluminación sinusoidales requeridas, así como el mantenimiento de la polarización óptica. La nueva generación de SIM comercialinstrumentos son capaces de imágenes rápidas, pero su precio es prohibitivo para todos excepto para las instalaciones centrales de imagen.
Este protocolo presenta una guía para la construcción de un sistema flexible de SIM para obtener imágenes de procesos rápidos en muestras delgadas y cerca de la superficie basal de las células vivas. Se emplea fluorescencia de reflexión total interna (TIRF) para generar un patrón de iluminación que penetra más profundo que aproximadamente 150 nm en la muestra 13, que reduce enormemente la salida de la señal de fondo del foco. La idea de combinar SIM con TIRF es casi tan antigua como la propia SIM 14, pero no se realizó de forma experimental antes de 2006 15. La primera vez en vivo las imágenes obtenidas con TIRF-SIM se informó en 2009 16 han alcanzado velocidades de cuadro de 11 Hz para visualizar la tubulina y kinesin dinámica, y dos sistemas de TIRF-SIM de color se han presentado 17,18. Más recientemente, una guía para la construcción y el uso de un solo color de dos haces SIM sistema se presentó con el frame-rate de hasta 18 Hz 19,20.
La puesta a punto que aquí se presenta es capaz de SIM de super-resolución de imagen a 20 Hz en tres colores, dos de los cuales pueden ser operados en TIRF-SIM. Todo el sistema se construye alrededor de un marco microscopio invertido y utiliza una etapa de traducción xy motorizado con una etapa z piezo-accionada. Para generar los patrones de excitación sinusoidal necesarios para TIRF de SIM, el sistema presentado utiliza un modulador espacial de luz ferroeléctrico (SLM). rallado patrones binarios se muestran en el MST y los órdenes de difracción ± 1 resultantes se filtraron, se transmiten y se centró en el anillo TIR de la lente objetivo. Los desplazamientos y rotaciones de las rejillas de fase necesarias se aplican cambiando la imagen SLM mostrada. Este protocolo describe cómo construir y alinear una trayectoria tal excitación, detalles de la alineación de la trayectoria de emisión, y presenta muestras de prueba para asegurar una alineación óptima. También De escribas los problemas y retos particulares a alta velocidad TIRF-SIM en relación con el control de la polarización y la sincronización de los componentes.
Consideraciones de diseño y limitaciones
Antes de montar el sistema TIRF-SIM presentado en este protocolo, hay varias limitaciones de diseño a considerar que determinan la elección de los componentes ópticos. Todas las abreviaturas de los componentes ópticos se refieren a la Figura 1.
Espacial modulador de luz (SLM)
A ferroeléctrico SLM binario se utiliza en esta configuración, ya que es capaz de la conmutación de patrón de sub-milisegundo. MFEE nemáticos en escala de grises se pueden usar, pero estos ofrecen reducen en gran medida los tiempos de conexión. Cada dentro o fuera de píxel en una fase binaria SLM se impartir desplazamiento a la frente de onda plano incidente sea un π o 0 de fase, por lo tanto, si un patrón de red periódica se muestra en el SLM se operará como una difracción rejilla de fase.
ent "> reflexión interna total (TIR) Para lograr TIR y producir un campo evanescente, el ángulo de incidencia de los haces de excitación en la interfase vidrio-muestra debe ser mayor que el ángulo crítico 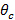 . Esto establece el ángulo mínimo requerido incidente, y por lo tanto también la separación máxima, o periodo, del patrón de iluminación evanescente. El máximo ángulo incidente
. Esto establece el ángulo mínimo requerido incidente, y por lo tanto también la separación máxima, o periodo, del patrón de iluminación evanescente. El máximo ángulo incidente  (El ángulo de aceptación) está limitada por la apertura numérica (NA) de la lente objetivo que se puede calcular a partir de la definición
(El ángulo de aceptación) está limitada por la apertura numérica (NA) de la lente objetivo que se puede calcular a partir de la definición 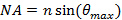 . Esto determina el patrón de espaciado mínimo alcanzable de acuerdo con la fórmula Abbe
. Esto determina el patrón de espaciado mínimo alcanzable de acuerdo con la fórmula Abbe 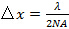 que une NA y longitud de onda
que une NA y longitud de onda 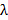 a la separación mínima patrón
a la separación mínima patrón  . En la práctica, un 1,49 NA de inmersión en aceite objetivo TIRF se obtiene un ángulo máximo de incidencia de alrededor de 79 ° y un período mínimo patrón en la muestra de 164 nm utilizando una longitud de onda de excitación de 488 nm. Estos dos ángulos definen un anillo en la abertura posterior de la objetivo sobre el cual el instrumento logra TIR de iluminación (es decir. El anillo TIR) y en el que los focos dos de excitación debe colocarse con exactitud y precisión girar para generar cada patrón de iluminación.
. En la práctica, un 1,49 NA de inmersión en aceite objetivo TIRF se obtiene un ángulo máximo de incidencia de alrededor de 79 ° y un período mínimo patrón en la muestra de 164 nm utilizando una longitud de onda de excitación de 488 nm. Estos dos ángulos definen un anillo en la abertura posterior de la objetivo sobre el cual el instrumento logra TIR de iluminación (es decir. El anillo TIR) y en el que los focos dos de excitación debe colocarse con exactitud y precisión girar para generar cada patrón de iluminación.
Reconstrucción de imágenes TIRF-SIM requiere la adquisición de un mínimo de tres cambios de fase por la rotación del patrón, por lo tanto el período patrón SLM debe ser divisible por 3 (véase la figura 1). Por ejemplo, un período de 9 píxeles para la iluminación de 488 nm y 12 640 píxeles para la iluminación nm. Para una discusión completa de diseño del modelo del MST, incluyendo la optimización de sub-píxeles de patrón espaciado utilizando rejillas cizallados, Ver el trabajo previo de Kner et al. 16 y Lu-Walther et al. 20 La posición de los dos focos de excitación debe estar dentro de la anilla TIR para todas las longitudes de onda, sin embargo, el ángulo de difracción de los ± 1 órdenes del SLM es la longitud de onda dependiente. Para SIM estándar, imágenes multicolor se puede conseguir mediante la optimización del periodo de rejilla para la longitud de onda más larga, y tolerar una pérdida en el rendimiento de los canales más cortos. Para TIRF-SIM sin embargo, la optimización para una longitud de onda significa que la longitud de onda de otros focos ya no dentro del anillo TIR son. Por ejemplo, el uso de un periodo de red de 9 píxeles es suficiente para proporcionar TIRF de 488 nm, ya que los focos están en 95% del diámetro de la abertura hacia atrás y dentro del anillo de TIR, pero para 640 nm este período posicionaría los focos fuera la abertura. Por esta razón diferentes espaciamientos patrón de píxeles deben ser usados para cada longitud de onda de excitación.
La alineación de la trayectoria de excitación TIRF-SIMes extremadamente sensible a pequeños cambios en la posición del espejo dicroico (DM4 en la Figura 1) en el cuerpo del microscopio, mucho más que en el SIM convencional. No se recomienda el uso de una torreta giratoria filtro de cubo, en lugar utilizar una sola, espejo dicroico multi-banda, que se mantiene en una posición fija y diseñado específicamente para las longitudes de onda de excitación utilizadas. Es esencial que solamente se utilizan los más altos espejos dicroicos calidad. Estos requieren gruesas sustratos de al menos 3 mm, y se designan a menudo como "plano de formación de imágenes" por los fabricantes. Todos los otros sustratos conducen a la aberración intolerable y degradación de la imagen en TIRF-SIM.
control de la polarización
Para lograr TIRF-SIM es esencial para hacer girar el estado de polarización de la luz de excitación en sincronía con el patrón de iluminación de tal manera que permanece azimutal polarizada en el plano de la pupila objetivo con respecto al eje óptico (es decir,. s-polarizada). La alineación de la óptica de control de polarización dependerá del elemento óptico específico empleado, por ejemplo una célula Pockels 21, o una placa de media onda en una etapa de rotación motorizada 22. En este protocolo se utiliza un cristal líquido encargo retardador variable (LCVR), diseñado para proveer de onda completa (2π) retraso de todo el rango de longitud de onda de 488 a 640 nm, ya que permite la conmutación rápida (~ ms). Si se utiliza un retardador de cristal líquido, es esencial utilizar un componente de alta calidad: componentes estándar no son normalmente lo suficientemente estable como para dar un retardo de la constante en la duración del tiempo de exposición de la cámara que conduce a una borrosidad de la patrón de iluminación y bajo contraste de modulación . retardadores de cristal líquido también son fuertemente dependientes de la temperatura y requieren construidas en el control de la temperatura.
Sincronización
Los láseres se deben sincronizar con el MST. MFEE ferroeléctricos binarios están equilibrados internamente por sbrujas entre un estado encendido y apagado del estado. Los píxeles sólo actúan placas de onda como medio, ya sea en su estado activado o desactivado, pero no durante el tiempo de conmutación entre tramas. Por lo tanto, los láseres sólo deben estar encendidos durante los estados de encendido / apagado a través del LED de señal de habilitación del SLM para evitar la disminución del contraste patrón debido al estado intermedio de los píxeles. Un modulador acústico-óptico (AOM), alternativamente, podría ser utilizada como un obturador rápido si los láseres no pueden ser moduladas digitalmente.
Elección de las lentes
Sobre la base de estas limitaciones, el desmagnificación requerida del plano de SLM en el plano de muestra para producir los patrones de iluminación deseados se pueden determinar. Esto permite el cálculo de las distancias focales de las dos lentes L3 y L4 en el telescopio de retransmisión de la imagen y la lente condensadora de excitación L5. En este sistema a / de inmersión en aceite 1.49NA lente objetivo 100X se utiliza con 488 nm y 640 nm de excitación, por lo tanto, utiliza longitudes focales de 300 y 140 mmpara L4 y L3, y 300 mm para L5, dando un total de desmagnificación 357x, equivalente a un tamaño de píxel de SLM 38 nm en el plano de la muestra. El uso de esta combinación de lentes, SLM rejilla de períodos de 9 para 488 iluminación nm y 12 píxeles para 640 nm dan espaciamientos patrón de 172 y 229 nm en la muestra, que corresponde a ángulos de incidencia de 70 ° y 67 ° respectivamente. Para una interfaz vidrio-agua, el ángulo crítico es 61 °, y es independiente de la longitud de onda, por lo tanto estos dos espaciamientos patrón permiten excitación TIRF para ambas longitudes de onda. Una lente de objetivo equipado con un collar de corrección es útil para la corrección de aberraciones esféricas introducidas por variaciones en el espesor cubreobjetos, o si funciona a 37 ° C.
Reconstrucción de imagen
Una vez que los datos en bruto SIM ha sido adquirida es una cuestión de esfuerzo computacional para generar imágenes de super-resolverse en un proceso de dos pasos. En primer lugar, el patrón de iluminación tiene que ser determinada paracada imagen y en segundo lugar, los componentes del espectro de SIM se deben separar y recombinar apropiadamente como para duplicar el apoyo OTF efectiva (véase la Figura 6, inserciones).
El conocimiento preciso de los patrones de iluminación proyectado es de suma importancia, ya que los componentes de frecuencia de super-resuelto tienen que ser mezclado con la mayor precisión posible para evitar artefactos causados por las partes residuales de componentes superpuestos. Determinamos el patrón de iluminación parámetros a posteriori de los datos de imágenes en bruto siguiendo el procedimiento establecido por Gustafsson et al. 23 En resumen, un conjunto de parámetros de iluminación que describe una sinusoide de dos dimensiones normalizadas tiene que ser encontrado para cada una de las 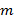 patrones de excitación
patrones de excitación 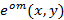 :
:
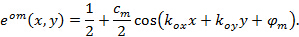
Por la presente 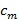 y
y 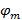 describir el contraste franja y el patrón de la fase de arranque de cada imagen m individuo respectivamente. Los componentes del vector de onda,
describir el contraste franja y el patrón de la fase de arranque de cada imagen m individuo respectivamente. Los componentes del vector de onda, 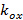 y
y 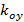 , Sólo cambian con diferentes orientaciones
, Sólo cambian con diferentes orientaciones 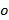 del patrón y lata supone que es de otro modo constante. Para determinar groseramente los componentes del vector de onda se realiza una correlación cruzada de los espectros de imágenes en bruto, que se refina mediante la aplicación de cambios de subpixel a una de las imágenes cruzada correlacionados como para optimizar la superposición. Esto se hace a través de la multiplicación de los gradientes de fase-espacio real
del patrón y lata supone que es de otro modo constante. Para determinar groseramente los componentes del vector de onda se realiza una correlación cruzada de los espectros de imágenes en bruto, que se refina mediante la aplicación de cambios de subpixel a una de las imágenes cruzada correlacionados como para optimizar la superposición. Esto se hace a través de la multiplicación de los gradientes de fase-espacio real 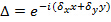 que inducen un cambio en los subpíxeles frecuencia-espacio. Observe que es útil tener una buena estimación de la onda-vectores antes de la estimación patrón real y esto se puede encontrar por la imagen de una capa de bolas fluorescentes.
que inducen un cambio en los subpíxeles frecuencia-espacio. Observe que es útil tener una buena estimación de la onda-vectores antes de la estimación patrón real y esto se puede encontrar por la imagen de una capa de bolas fluorescentes.
A medida que el paso de fase entre los patrones desplazado es 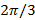 , Es decir.
, Es decir. 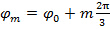 , La separación de componentes de frecuencia puede ser realizada por una transformada de Fourier a lo largo de los "eje de fase". La fase mundial
, La separación de componentes de frecuencia puede ser realizada por una transformada de Fourier a lo largo de los "eje de fase". La fase mundial 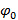 y el contraste de la franja
y el contraste de la franja 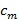 a continuación, se puede determinar usando regresión lineal compleja de diferentes componentes. Los componentes individuales separados se combinan a continuación, utilizando un filtro de Wiener generalizada. Para una descripción detallada tanto de extracción de parámetros y la aplicación del filtro de Wiener generalizado remitimos al lector a Gustafssonet al. 23, donde se utiliza el mismo algoritmo.
a continuación, se puede determinar usando regresión lineal compleja de diferentes componentes. Los componentes individuales separados se combinan a continuación, utilizando un filtro de Wiener generalizada. Para una descripción detallada tanto de extracción de parámetros y la aplicación del filtro de Wiener generalizado remitimos al lector a Gustafssonet al. 23, donde se utiliza el mismo algoritmo.
Protocolo
1. Organización y Alineación de la pista de excitación
- Marque la posición de los componentes de la mesa óptica (ver Figura 1 para una descripción de la configuración óptica). Separar el objetivo, las lentes de L3, L4, L5, y el SLM cada por la suma de sus distancias focales respectivas tales que la superficie SLM será retransmitido sobre el plano focal del objetivo.
- Inserte multi-DM4 borde espejo dicroico en la torreta filtro de cubo del pie del microscopio.
- Inserte el segundo espejo dicroico DM3 en un espejo cinética cuadrado de 1 "de montaje, y la posición de la mano la distancia focal lejos de la lente condensadora L5.
Nota: Este diseño incorpora dos pista de excitación dicroico refleja idéntica DM3 y DM4 que son tomadas del mismo lote de producción para asegurar las propiedades ópticas idénticas. El espejo dicroico (DM4) está posicionado de tal manera que los ejes S y p- se conmutan en comparación con el dicroico situado en el microscopio (DM3) cancelando así cualquierpolarización elipticidad introducido por su birrefringencia (Figura 1). Esta compensación funciona igualmente bien para cada longitud de onda de iluminación. Este paso es esencial para el mantenimiento de un alto contraste de modulación. - Antes de insertar las lentes en la trayectoria de excitación, definir con precisión el eje óptico del sistema.
- Retire la lente del objetivo (OB) de la torreta y en su lugar el tornillo en una herramienta de alineación. Este consiste en un sistema óptico jaula largo 500 mm con dos discos de alineación en ambos extremos.
- Utilice la DM3 espejo dicroico y un espejo de alineación temporal ubicado en la posición más tarde aproximado del SLM para dirigir un haz de referencia colimado de láser 1 a través del centro de los agujeros en los dos discos de alineación. Dirigir el haz de láser 1 al espejo temporal tal como se representa en la Figura 1 usando tres espejos y DM2 espejo dicroico. El espejo temporal en la posición de SLM debe estar cerca de la perpendicular al eje óptico.
Nota: El uso de láser 1 como el haz de referencia, ya que los otros láseres pueden ser posteriormente alineados una vez que el camino de excitación está en su lugar. - Retire la herramienta de alineación una vez que el eje óptico gruesa ha sido determined.Insert un iris en la trayectoria del haz antes de entrar en el cuerpo de microscopía y centrarla en la viga. Coloque un pedazo de cartulina blanca con un pequeño agujero centrado en el iris.Reinsert la lente del objetivo (OB).
Nota: El haz de abandonar el objetivo será ahora muy divergentes, pero habrá una reflexión muy débil de la superficie posterior de la lente que será visible en la tarjeta blanca. Todas las lentes, incluso si están recubiertos con anti-reflejo, tendrán reflexiones débiles de la espalda que se pueden utilizar para asegurar una alineación coaxial. Si el haz es exactamente perpendicular a la lente entonces la reflexión de retorno será volver a través del centro del iris - Hacer ajustes iterativos angulares a los dos espejos (DM3 y espejo de alineación en la posición SLM) para centrar la reflexión de retorno dela tarjeta con el haz entrante. Retire temporalmente la lente del objetivo (OB) y marque el punto de láser en el techo para crear una posición de referencia.
- Insertar un par de diafragmas a la altura del haz de referencia a lo largo de los agujeros roscados de la tabla. El haz debe ser paralela a la superficie de la mesa óptica. El eje óptico se define ahora.
- Insertar la lente condensadora (L5) aproximadamente una distancia focal de distancia del objetivo. Montar esta lente en un conjunto lineal etapa de traducción para traducir a lo largo de la dirección del haz de referencia.
- Ajustar la posición de la lente condensador y ángulo tal que el haz que sale el objetivo es colimado y pega en el punto de referencia en el techo. Compruebe que el objetivo es perpendicular a la viga de nuevo el control de la reflexión de retorno con el iris y la tarjeta blanca. Retire la lente del objetivo (OB) e inserte la segunda lente del telescopio de retransmisión de imagen (L4).
Nota: Asegurar la correcta colimación y no desviación del seram se hace más fácil cuando hay un número par de lentes en la trayectoria del haz. - Ajuste la posición y el ángulo de esta lente utilizando una etapa de traslación lineal de mantener la colimación y para asegurar el haz de referencia todavía golpea el punto marcado en el techo.
- Vuelva a colocar la lente objetivo (OB) e inserte la primera lente del telescopio (L3). Ajuste la posición y el ángulo de esta lente para asegurar la colimación y no de deflexión, como se describe en los pasos anteriores.
- Montar el chip SLM en un montaje de cardán que proporciona la rotación sin necesidad de traducción alrededor del centro de la superficie del chip.
Nota: El diseño de montaje específico depende del SLM utilizado. Si el SLM es suministrado sin montura, que debe fijarse a una placa de aluminio mecanizada a medida que a su vez está unida a una lente de montaje de cardán. - Con las lentes alineadas, inserte el SLM en lugar del espejo. Ajustar la posición del SLM de manera que el haz de referencia se encuentra en el centro del chip SLM, y ajustar la unativar de tal manera que el haz pasa a través de las dos lentes de relé (L3 y L4). Compruebe que el haz de referencia todavía se centra en el punto marcado.
- Ampliar y colimar el haz de referencia usando un expansor de haz de Kepler.
- Montar las dos lentes (L1 y L2) en un sistema de jaula para facilitar el ajuste.
- Con el sistema de jaula en el haz de referencia mediante la eliminación de las lentes y su sustitución con los diafragmas.
- Insertar las dos lentes y ajustar la posición axial de L2 para colimar el haz expandido utilizando un interferómetro de cizalladura. L2 debe ser una longitud focal lejos de la superficie del SLM.
- Compruebe que el haz expandido aún se colima después de las dos lentes de relé L3 y L4. Utilice el interferómetro de cizalladura justo después de DM3 para comprobar la colimación.
- Una vez que la trayectoria de excitación se ha alineado para una sola longitud de onda, par los otros dos rayos láser en la trayectoria del haz. Steer cada haz a través de dos iris centradas en el camino de excitación utilizandoel haz de la combinación de espejos dicroicos (DM1 y DM2).
2. La alineación de la polarización de los rotadores
- Montar la LCVR con su eje rápido a 45 ° a la polarización incidente.
- ángulo de sintonizar la polarización Fine del haz incidente a la LCVR usando una placa de media onda acromático (HWP) mediante la inserción de la HWP y la LCVR entre polarizadores cruzados. Girar el programa de armonización para reducir al mínimo la potencia transmitida.
Nota: Con el fin de actuar como un rotador de polarización variable, el eje rápido del retardador de cristal líquido (LCVR) debe estar alineada con precisión en 45 ° a la polarización incidente del haz vertical. El LCVR está montado físicamente en 45 °, pero esto es sólo una alineación aproximada. El HWP es usado para asegurar perfecta 45 ° alineación de la polarización incidente con respecto al eje rápido LCVR. La placa de cuarto de onda (QWP) convierte la polarización elíptica inclinada inducida por el LCVR de nuevo a la polarización lineal en un ángulo controlado por el voltaje aplicado24. - Inserte la QWP después de la LCVR y girarlo para alinear su eje lento a la polarización de entrada, reduciendo al mínimo la potencia transmitida entre polarizadores cruzados.
3. La alineación de la trayectoria de emisiones
- Toscamente coloque la cámara utilizando un micrómetro de portaobjetos y la luz transmitida.
- Centrarse en la retícula usando los oculares del microscopio y fijar la lente objetivo en esta posición.
- Aproximadamente centrar la cámara y mover la posición de la cámara para que la imagen de la retícula en el foco mediante la observación de la imagen en pantalla.
Nota: Si se utiliza una rueda de filtros externa, entonces el filtro de cubo no contendrá un filtro de emisión, por lo tanto, los oculares no deben ser utilizados cuando los láseres se encienden.
- Ajustar con precisión la posición de la cámara usando una muestra de bolas fluorescentes.
- Preparar una monocapa de perlas fluorescentes mediante la difusión de una caída de 100 nm granos multicolores sobre un cubreobjetos # 1.5. Dejar dry para adsorber las cuentas a la cubreobjetos y luego volver a sumergirse en el agua.
- Coloque la muestra gota sobre el objetivo con aceite de inmersión. Finamente ajustar la posición de la cámara de tal manera que la capa de bolas fluorescentes está en el foco. No ajuste la posición de la lente objetivo una vez que se ha encontrado el foco.
Nota: A medida que el MST debe estar en un plano conjugado con el plano de la muestra, la posición del MST, el relé lentes, y el objetivo debe ser fijo. Para ajustar el enfoque, mover la muestra en lugar de axialmente el objetivo usando un z-etapa piezoeléctrico.
- Generar los correspondientes patrones de red binaria SIM como archivos de mapa de bits.
- Por 2D / TIRF-SIM, generar una serie de imágenes de red binaria 9: 3 orientaciones patrón cada uno con 3 cambios de fase a intervalos idénticos. Generar estos numéricamente (usando MATLAB por ejemplo) de una sinusoide rotada 2D con un desplazamiento aplicado fase, entonces umbralización para producir una imagen binaria. Ver archivos de código suplementario para ejemplo de código.
- para alignmenfines T, también generan patrones de rejilla que han sido windowed por una pequeña abertura circular para cada uno de los 3 orientaciones, como se muestra en la Figura 2. Las rejillas de alineación con ventanas no necesitan ser activado externamente pero se puede cambiar manualmente por el usuario a través de la El software de SLM.
Nota: Véanse las referencias para una discusión de los ángulos de rotación óptimos y un ejemplo de código de generación de patrones de rejilla 16,20.
- Subir las imágenes de mapa de bits al SLM utilizando el software del fabricante (por ejemplo MetroCon).
- Cargar el software de control de SLM y haga clic en "Conectar".
- En la pestaña "Repertorio", haga clic en "Cargar" para abrir el archivo repertorio y comprobar el número de Ejecución de Órdenes contenidos en el archivo. En el archivo de ejemplo del repertorio dado hay cinco órdenes de manejo.
- Haga clic en "Enviar a subir" para cargar el archivo repertorio al SLM.
- Espere a que las imágenes de mapa de bits para cargar unand para el dispositivo se reinicie automáticamente.
Nota: Un archivo repertorio ejemplo, que contiene las imágenes de mapa de bits de rejilla y un archivo de definición de la orden, se incluye como un archivo de código suplementario. El archivo ".repz" se puede abrir usando el software archivador de ficheros ZIP.
- Mostrar una alineación de ventana de rejilla en el SLM para la primera orientación (por ejemplo, 0 °).
- En el software de control de SLM, seleccione la pestaña "Status", introduzca el número de la orden de marcha (en el caso del archivo de ejemplo, esto se ejecuta orden "1").
- Haga clic en "Seleccionar" para cambiar el orden de marcha a la rejilla de alineación.
Nota: Esta se iluminará una pequeña región circular en el plano de la muestra. Si la superficie SLM se conjuga correctamente al plano de la muestra a continuación, los bordes de esta región serán fuertemente en el enfoque. El patrón de rejilla producirá múltiples órdenes de difracción en el foco de L3: La reflexión de orden cero de la placa posterior reflectante de laSLM, el -1 y +1 órdenes correspondientes a la rejilla, y órdenes superiores también más débiles que surgen de difracción de elementos internos específicos al dispositivo SLM (por ejemplo. Reflexiones de los cableados internos de los píxeles y las irregularidades de GST en los bordes de los píxeles) . Todos pero los -1 y +1 órdenes deben ser filtrados.
- Insertar una máscara espacial (SM) montado en un x, y etapa en la trayectoria del haz en la posición focal de L3, y traducir su posición con respecto al eje óptico de tal manera que sólo los primeros órdenes deseados se pasan. Directamente después del filtro espacial, sólo dos haces circulares serán visibles.
Nota: La máscara espacial se fabrica por la perforación 6 agujeros en papel de aluminio usando una aguja. Los agujeros deben ser lo suficientemente grandes como para pasar los primeros rayos de orden para todas las longitudes de onda láser. Un análisis detallado de la máscara espacial se da en la referencia 20. - Mostrar la siguiente orientación de la rejilla de alineación (60 °, corriendo orden 2) y de nuevoa garantizar que sólo los primeros pedidos se permiten a través de la máscara espacial, ajustando su posición si es necesario.
- Repita el procedimiento para la orientación final (120 °, se ejecuta la orden 3).
- Compruebe la imagen de la capa de bolas fluorescentes en la cámara. Si las dos vigas circulares no son de solapamiento como se muestra en la Figura 2 a continuación, cambiar la posición del plano de muestra, ajustando iterativamente la posición de la lente y la cámara objetivo.
- Ajustar la posición objetiva para solapar las dos vigas que traerán la imagen fuera de foco. Cambiar la posición de la cámara para que la imagen de nuevo en el enfoque y ajustar el objetivo en el caso de dos círculos son todavía visibles. Repita este proceso hasta que los dos haces se superponen y una sola región circular está en el foco.
- Una vez que la posición del plano de la muestra se ha establecido, mantener la posición objetivo fijo.
- Para confirmar la iluminación TIRF, imagen una solución de colorante fluorescente, por ejemplo, para una longitud de onda de excitación 488 nm, utilizar una solución de 1081; M rodamina 6G.
- Llevar la muestra de tinte en el foco. Si los dos haces inciden en el ángulo TIRF correcta, entonces las moléculas individuales serán visibles sin alto fondo y los bordes de la abertura circular estarán enfocados. Ver Figura 2B-D para ejemplos de vigas TIRF alineados y no alineados.
- Mostrar cada orientación de las rejillas con ventanas a su vez, y asegurar que las tres orientaciones proporcionan una iluminación TIRF y que los dos haces se superponen en el plano de la muestra. ajustes precisos en la posición de las vigas se pueden hacer mediante el ajuste de DM3 espejo dicroico.
Nota: Aunque diferentes longitudes de onda se centran en posiciones ligeramente diferentes debido a la aberración cromática axial, esto no es crítico y puede ser corregido mediante la aplicación de una constante z-offset a la posición de la muestra antes de la excitación con la segunda longitud de onda.
4. Sistema de sincronización y calibración
- Coloque el cordón monocapa samplia sobre el objetivo y poner en foco.
- Programar el SLM utilizando su software de control para visualizar cada una de las imágenes de cambio de fase 3, a su vez, por primera orientación patrón (0 °).
- Usando el software de control de SLM, cambie al orden de marcha 4 del ejemplo del repertorio.
- Configurar la cámara utilizando su software de adquisición (por ejemplo HCImage) a la salida dos señales: una positiva y una señal TTL disparador negativo durante el período de exposición global. En el software de la cámara, en "Propiedades" avanzadas de la cámara, ajuste de salida de disparo Tipo 1 y 2 de "exposición", y la salida de disparo de polaridad 1 y 2 de "positiva" y "negativa", respectivamente.
- Conecte la salida 1 y 2 de la cámara a la "Trigger" y "Finalizar" entradas del SLM, respectivamente, utilizando cables coaxiales. El SLM se ha sincronizado a la cámara.
- Adquirir una serie de 3 imágenes.
- En el panel "Secuencia", selecciona &# 34; Disco Duro Record "como el tipo de escaneo, y establecer el número de fotogramas a 3.
- Haga clic en "Inicio" para adquirir 3 cuadros. El patrón de SLM cambiará en cada exposición. Las perlas fluorescentes en la imagen aparecerá a parpadear y fuera entre cada una de las 3 imágenes. La cantidad de parpadeo es una lectura fuera del contraste de modulación del patrón de iluminación sinusoidal.
- Girar la polarización del láser de excitación con la LCVR usando software personalizado con el fin de lograr la polarización azimutal y por lo tanto el mayor contraste de modulación para la orientación patrón dado.
- Cargar el software de calibración LCVR.
- Introduzca 0 y 8 para el mínimo y máximo de tensión, respectivamente.
- Haga clic en "barrido de tensión LCVR" para rotar la polarización.
Nota: El retardo de LCVR es una función de la temperatura y puede deriva día a día incluso con control de temperatura. En este paso, la polarización azimutal óptima se encontró empíricamente por Sweeping de la tensión aplicada entre su mínimo y máximo de voltaje que tiene el efecto de la rotación de la polarización incidente en la muestra. El contraste de modulación se calcula para cada tensión 25 y la tensión que alcanza el pico de contraste se usa en los siguientes pasos. - Espere a que el proceso de calibración para completar, y anotar la tensión medida.
- Repita este proceso de calibración para las dos orientaciones restantes del patrón (60 ° y 120 °) y cada una de las longitudes de onda de excitación.
- Sincronizar la exposición de la cámara con el LCVR, láseres, rueda de filtros de emisión y piezo-z etapa 26. Para lograr esto, utilice una tarjeta de adquisición de datos de alta velocidad (DAQ) como fuente de reloj maestro para el sistema, y el uso del LED SLM Activar señal de salida para modular el láser (véase la Figura 3B).
Nota: La implementación específica depende de los componentes utilizados, pero el uso de una tarjeta DAQ de alta velocidad para tri digitalesla sincronización y el control de la LCVR usando un voltaje analógico, controlado a través de software gger, se recomienda. El software de control utilizado en este protocolo está disponible bajo petición. - Debido a la aberración cromática axial, para cada longitud de onda, también se aplican una z-offset a la etapa de la muestra.
- Determine la variación experimental, centrándose en una muestra monocapa de perlas multicolor en la primera longitud de onda (por ejemplo. 488 nm), se puede cambiar a la segunda (p. 640 nm). Las cuentas serán ahora fuera de foco.
- Reorientar las cuentas y medir el cambio en la posición z que se necesitaba. Este desplazamiento puede entonces ser aplicado a la z-etapa piezo cada vez que se cambia la longitud de onda de excitación.
- Usando el software de control de SLM, cambiar el orden de marcha SLM a la serie completa de imágenes 9 de red binaria necesarios para TIRF-SIM. Esta es orden de marcha 0 en el ejemplo del repertorio.
- Utilizando el software de control de la cámara, adquirir 9 imágenes de la muestra de perlas.
- En el panel "secuencia" del software de la cámara, seleccione "Grabar disco duro" como el tipo de escaneo, y cambiar el número de fotogramas a 9.
- Haga clic en "Inicio" para adquirir imágenes.
- Guardar las imágenes adquiridas como archivos TIFF seleccionando "TIFF" como el tipo de imagen en la opción "Guardar tamponada Imágenes" de la ventana, y haciendo clic en Aceptar.
- Reconstruir una imagen de super-resolución de las imágenes TIFF primas utilizando software comercial o personalizado para validar la mejora en la resolución sobre TIRF estándar.
Nota: Para nuestro microscopio usamos código de la reconstrucción de encargo desarrollado tanto en la casa y por el Dr. Lin Shao 27.
Resultados
Perlas fluorescentes multicolor diámetro de 100 nm se obtuvieron imágenes para comparar TIRF estándar para TIRF-SIM y cuantificar la mejora posible en la resolución lateral (Figura 4A - B). La reconstrucción de los marcos primas en imágenes super-resolución se realizó utilizando algoritmos estándar como se describe en la literatura 27,28. Puede ser visto que TIRF-SIM claramente tiene significativamente mayor resolución lateral en comparación con TIRF. La función de dispersión de punto (PSF) de un microscopio está bien aproximada por la imagen de una única perla fluorescente de tamaño sub-difracción, por lo tanto, la PSF y la resolución se puede cuantificar mediante el ajuste de las funciones gaussianas 2D a perlas individuales para cada longitud de onda. La resolución estimada del microscopio basado en el valor medio de la anchura total medio máximo (FWHM) es 89 nm y 116 nm para 488 y 640 nm TIRF-SIM respectivamente (Figura 4C). Esto corresponde a una Impro de dos vecesvimiento en la resolución lateral para ambas longitudes de onda en comparación con el caso de difracción limitada teórica. Fibrillas de amiloide marcados con fluorescencia también son una excelente muestra de prueba para demostrar la resolución duplicado (Figura 4D). Fibrillas de amiloide se formaron in vitro mediante la incubación de β-amiloide marcado con 10% colorantes derivados de rodamina (excitación 488 nm) durante 1 semana y posteriormente de imagen con TIRF-SIM. Véase la referencia 12 para obtener más información.
Estructuras subcelulares con alto contraste, como emGFP etiquetados microtúbulos (Figura 5 B, G) o LifeAct-GFP (Figura 5D) son ideales para la formación de imágenes TIRF-SIM y producir imágenes de alto contraste super-resolución. imágenes TIRF-SIM usando la configuración se detalla en este protocolo permite la observación de una subpoblación de los microtúbulos situados en las proximidades de la corteza de células basales, y la polimerización de microtúbulos y despolimerización puede be visto a través del tiempo (figura animada 1). No todas las muestras son susceptibles de obtener imágenes con TIRF-SIM, en particular, las muestras de bajo contraste y sin estructuras discretas. Las células que expresan GFP citosólica carecen de información de alta resolución, aparte de en los bordes de la membrana plasmática (Figura 5F, H y animada Figura 2) y por lo tanto son sub-óptimos para la imagen TIRF-SIM como las reconstrucciones resultantes son imágenes esencialmente TIRF superpuestos con los artefactos. En estas muestras, el aumento de contraste a menudo se puede atribuir a la etapa de deconvolución del algoritmo de reconstrucción.
Contraste de modulación es esencial para la formación de imágenes SIM éxito. La transformada de Fourier de la imagen reconstruida permite la visualización de la función de transferencia óptica SIM (OTF) (Figura 6A, recuadro). Sin maximizar el contraste de modulación para cada orientación azimutal asegurando polarzación con un rotador de polarización, hay muy poca modulación de la información de alta resolución en la muestra que conduce a una baja relación de señal a ruido en las bandas de paso de SIM. Algoritmos de reconstrucción que utilizan el enfoque del filtro de Wiener estándar simplemente amplificar el ruido en las bandas de paso SIM y producir una imagen que es esencialmente una imagen superpuesta con TIRF estándar hexagonal (o "nido de abeja") artefactos de anillo (Figura 6A, panel derecho). Una posible mejora podría ser el uso de iterativos 29,30 o ciegos algoritmos de reconstrucción de 31,32 para reducir estos artefactos en función del tipo de muestra. Se recomienda el uso del plugin de ImageJ SIMcheck para comprobar la calidad de los datos de la tarjeta SIM antes y después de la reconstrucción 33.
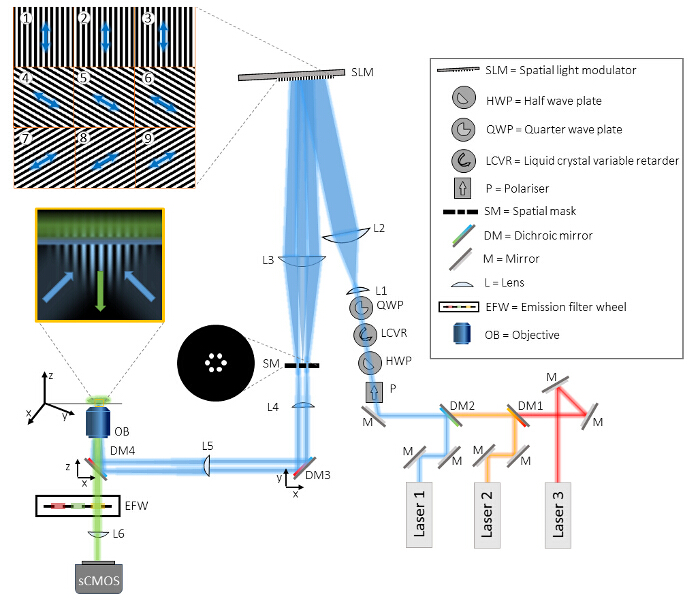
Figura 1:. Diseño de la instalación de Multicolor TIRF-SIM El TIRF de mi SIMcroscope consta de tres partes principales, la unidad de generación de haz, la unidad de proyección de patrones, y la unidad de detección. En la unidad de generación de haz, tres láseres diferentes están alineados en la misma trayectoria del haz a través de espejos dicroicos (DM1 y DM2) y dirigidos a través de cuatro elementos ópticos para el control de polarización. En primer lugar, un polarizador (P) asegura la pureza del estado de polarización lineal de cada uno de los rayos láser. Se necesitan los siguientes tres elementos ópticos para girar la polarización de una manera rápida y automatizada como se describe en detalle en el texto. Después, dos lentes (L1 y L2) en una configuración de telescopio expanden el haz para que coincida con la superficie activa del modulador espacial de luz (SLM) y se difractan en tres haces elementales por los modelos de red binaria proyectadas del SLM (ejemplos se muestran en azulejos 1- 9). El estado de polarización de la luz de iluminación en relación con el patrón de SLM se muestra como una flecha. Un segundo telescopio (L3 y L4) de-magnifica el patrón y ofrece acceso a thplano E de Fourier del patrón de SLM. En este plano una máscara espacial (SM) se utiliza para filtrar el componente central y otros componentes no deseados de difracción de la estructura pixelada del SLM y su cableado interno. Antes de que los dos haces restantes se centran en el plano focal posterior del objetivo (OB) a través de la lente condensadora (L5), dos espejos dicroicos (DM3 y DM4) están incluidos en la configuración. DM4 actúa como un espejo dicroico convencional en microscopía de fluorescencia a la iluminación de la luz separada de emisión. Sin embargo, este espejo induce inevitablemente elipticidad en el estado de polarización de la luz de iluminación que puede ser compensada por DM3, un espejo dicroico de idealmente el mismo lote que DM4. El objetivo de inmersión en aceite TIRF tiene una gran suficiente NA para lanzar directamente dos ondas de contador de propagación en el cubreobjetos que se reflejan totalmente y dar lugar a un campo evanescente estructurada en el cubreobjetos. La muestra se monta en una etapa de traslación xyz. La detección es performed a través de la misma DM4 objetivo y en la transmisión, además de un filtrado adicional por filtros de emisión de paso de banda, montada en una rueda de filtros controlado por ordenador (EFW). Finalmente, la imagen se proyecta sobre una cámara sCMOS por el lente del tubo interno microscopio (L6). Por favor, haga clic aquí para ver una versión más grande de esta figura.

Figura 2:. La alineación de la superposición de haces (A) Un patrón de rejilla de SLM de ventana con una abertura circular es útil para la alineación. Si dos vigas que no se solapan son visibles en la cámara (a la izquierda), entonces la posición del plano de muestra debe ser reposicionado por iterativamente ajustar las posiciones axiales de la lente objetivo y la cámara para dar un único punto de iluminación circular (derecha). Las vigas deben solaparse en el order para producir el patrón de excitación sinusoidal requerida para TIRF-SIM. Si los haces no se superponen totalmente esto reduce el campo de visión sobre el cual se forma el patrón de interferencia. (B y C) El ángulo preciso de la incidencia de los haces es importante para TIRF-SIM. Si el ángulo es incorrecto, una de las vigas no estará en el ángulo requerido para TIRF y esto es fácilmente visible cuando la imagen de una solución de colorante fluorescente. Una viga tiene un ángulo de incidencia mayor que el ángulo crítico que da el punto de circular, y el otro no lo hace, lo que conduce a la raya brillante a la izquierda de la imagen en (B). (D) ajustar el ángulo de espejo DM3 asegura ambos haces inciden en el mismo ángulo, y esto puede ser validado por desenfoque del objetivo: si alineado correctamente, la proyección xz de una pila z de una muestra colorante fluorescente debe mostrar dos simétricamente intersección vigas con el fondo insignificante en elcentrarse. Haga clic aquí para ver una versión más grande de esta figura.
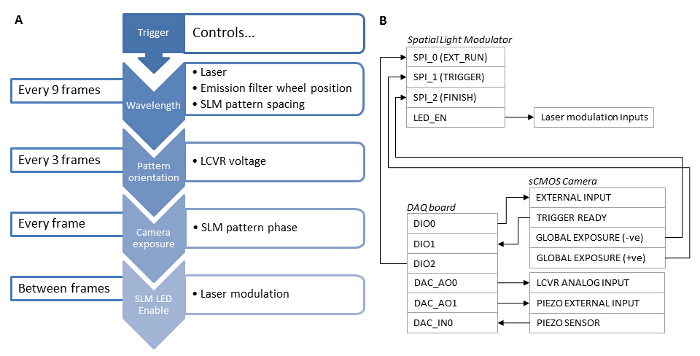
Figura 3: Sincronización. Dependencias de los diferentes componentes del sistema (A) Para una rápida adquisición SIM, la sincronización de los componentes del sistema utilizando una solución basada en hardware es esencial. (B) una tarjeta de adquisición de datos (DAQ) se debe utilizar como un disparador maestro. Una señal TTL de la placa de adquisición de datos se envía a la entrada externa sCMOS y se utiliza para desencadenar la exposición de la cámara. La salida de exposición Global cámara entonces activa el SLM para mostrar un patrón de rejilla y el SLM LED Salida de habilitación se utiliza para modular digitalmente la excitación láser de manera que el láser sólo se emite cuando los píxeles del SLM están en el estado "on". Después de la exposición es complete, la salida de la exposición global de la cámara se usa para avanzar el patrón SLM a la siguiente rejilla de fase o ángulo. La tarjeta DAQ también da salida a una tensión analógica al controlador LCVR para controlar el estado de polarización lineal del haz de iluminación. Esta tensión se conmuta después de la adquisición de las imágenes 3 de fase para cada ángulo del patrón. Después de la adquisición de 9 imágenes de una sola longitud de onda, la tarjeta DAQ emite una señal al controlador rueda de filtros de emisión, y pasa a la siguiente longitud de onda. La tarjeta DAQ también se aplica un z-offset a la muestra mediante la salida de un voltaje analógico al controlador Z-etapa piezoeléctrico. Por favor, haga clic aquí para ver una versión más grande de esta figura.
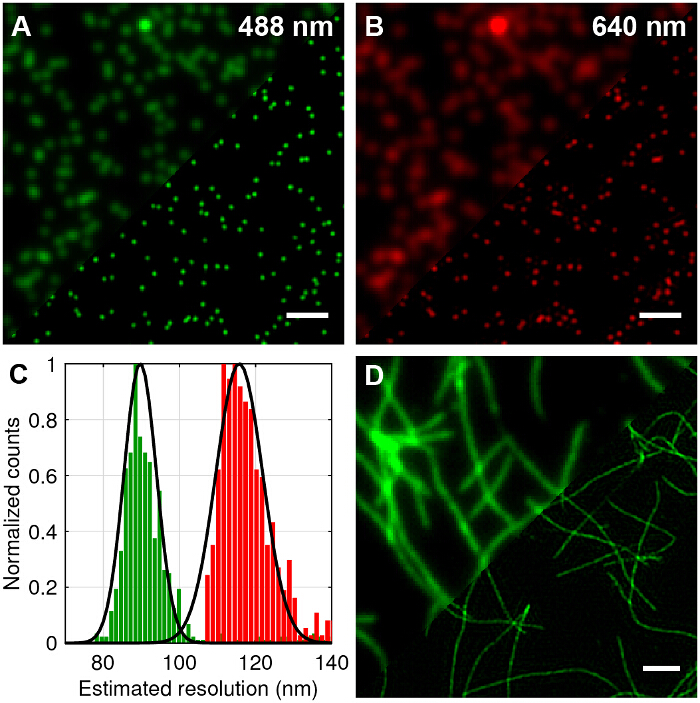
Figura 4: TIRF-SIM de imágenes de muestras de ensayo de 100 nm granos multicolores y con fluorescencia Labelled fibrillas de amiloide. (A y B) Comparación de la norma TIRF en comparación con reconstrucciones TIRF-SIM para 488 nm y 640 nm de excitación. (C) Histograma de la mitad del máximo de ancho completo (FWHM) de Gauss se ajusta a las perlas TIRF-SIM que muestran la mejora resolución esperada. (D) TIRF frente TIRF-SIM de fibrillas de amiloide beta-etiquetados con un 10% de colorante rodamina derivado (488 nm de excitación). Las barras de escala = 1 m. Haga clic aquí para ver una versión más grande de esta figura.
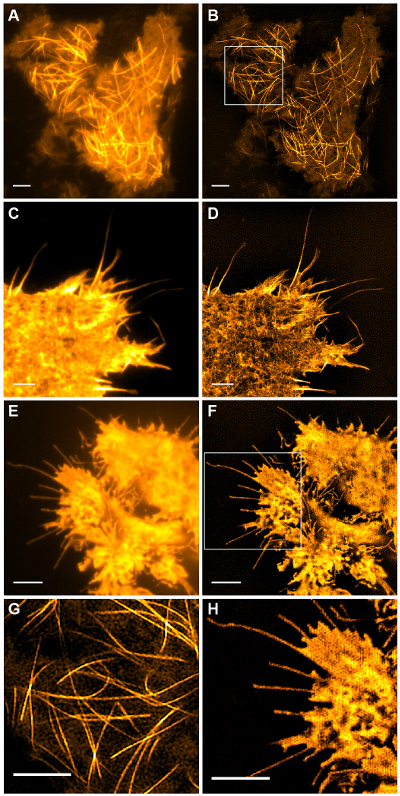
Figura 5:. TIRF-SIM de células vivas de imagen de la comparación de TIRF convencional y TIRF-SIM de imágenes (A), B microtúbulos (emGFP-tubulina) en una célula HEK293, (C, D ) actina filamentosa (LifeAct-GFP) en una célula COS-7 y (E, F) GFP citosólico en una célula HEK293. Imágenes en B y F son los puntos de tiempo individuales de las películas. Áreas enmarcadas se muestran magnifican en (G, H). Las barras de escala = 3 m. Haga clic aquí para ver una versión más grande de esta figura.
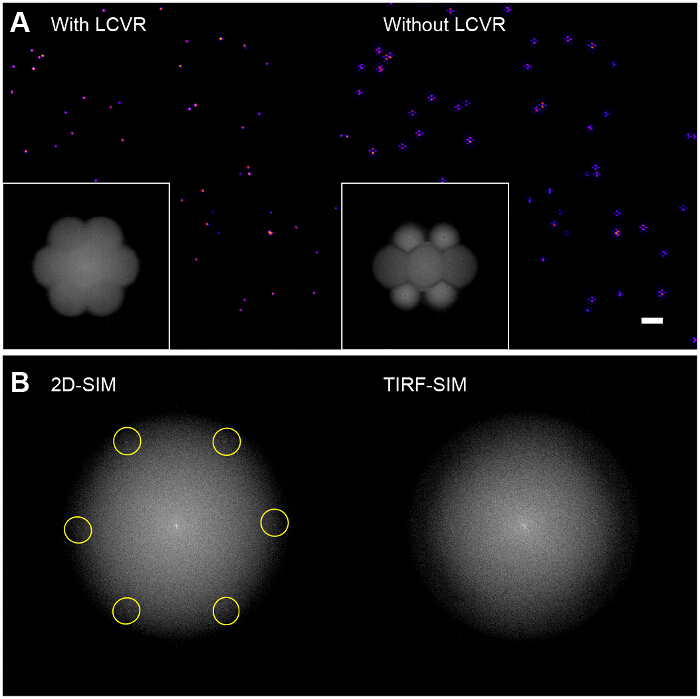
Figura 6:. Influencia de la polarización de los rotadores en reconstruida del grano de Imágenes (a) sin el uso de un rotador de polarización tal como un LCVR, la relación señal a ruido en las bandas de paso de SIM es baja, lo que da lugar a artefactos hexagonales característicos en el reconstruida SIM imágenes (derecha), (B) en 2D-SIM, los patrones de iluminación estructurados son directamente visibles en el de Fouriertransformar las imágenes en bruto (izquierda, la excitación de frecuencia espacial resaltado) a medida que caen dentro del radio de la ayuda OTF de emisión, sin embargo, en TIRF-SIM, que están fuera del soporte OTF y por lo tanto no es visible (derecha). En este caso, el patrón de modulación de contraste debe ser evaluada utilizando una monocapa de perlas escasa, tal como se indica en el protocolo. Por favor, haga clic aquí para ver una versión más grande de esta figura.
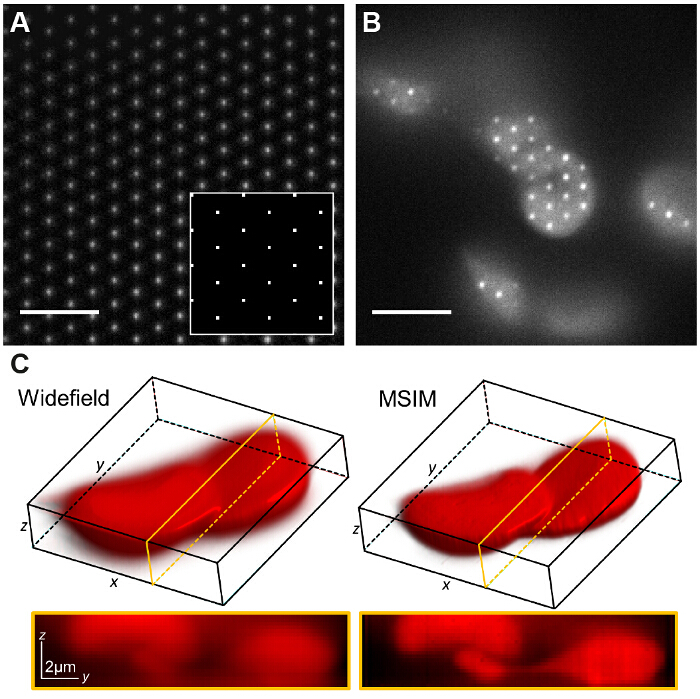
Figura 7:. Modulador espacial de luz patrón basado generación permite la implementación de otras modalidades de imágenes tales como multifocal SIM (A) En MSIM, una retícula cuadrada de pointsdisplayed en el SLM (recuadro) produce una retícula de difracción de focos limitados en el plano de la imagen. Una capa delgada de baja concentración de rodamina 6G se forma la imagen de visua LIZE los focos. El patrón se traduce a través de la muestra (B) y la imagen en bruto z-pila adquirida se reconstruye para generar una imagen con menos tiempo fuera de foco de luz (C). Las barras de escala = 5 micras. Haga clic aquí para ver una versión más grande de esta figura.
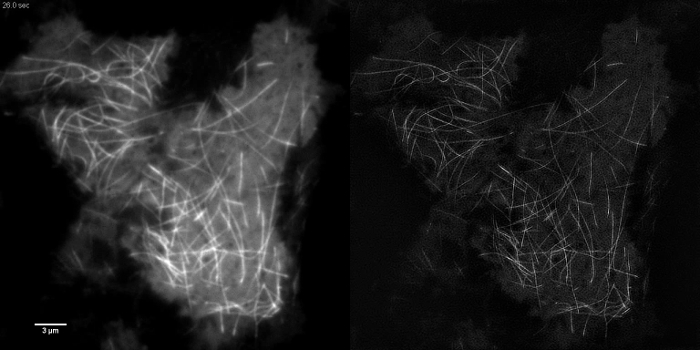
Animada Figura 1:. Tiempo de serie Movie EmGFP-tubulina en una célula HEK293 rápida polimerización y despolimerización de los microtúbulos emGFP etiquetado pueden observarse utilizando TIRF-SIM. Imágenes adquiridas utilizando 50 ms de tiempo de exposición por cuadro en bruto (450 ms por marco SIM) espaciados a intervalos de 0,5 seg. Tiempo de exposición utilizado fue limitado por el brillo del fluoróforo, no por la velocidad de la cámara o el MST. 3988movie1.mov "target =" _ blank "> Haga clic aquí para ver el vídeo.
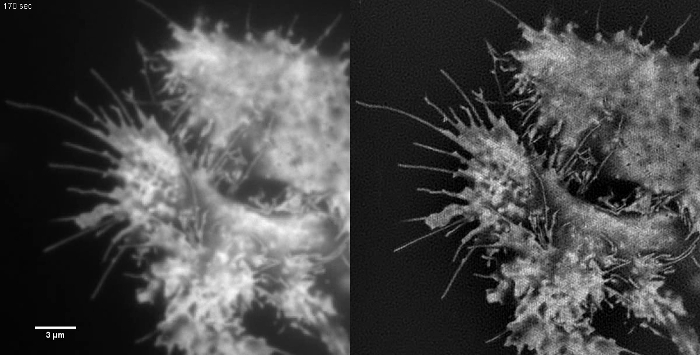
Animada Figura 2:. Tiempo de serie Movie citosólica de GFP en una célula HEK293 Las muestras con bajo contraste, como esto no son ideales para muestras de imágenes TIRF-SIM. flujo retrógrado de membrana se puede ver en las imágenes TIRF pero TIRF-SIM no proporciona ninguna información adicional aparte de en los bordes de células. Imágenes TIRF-SIM fueron adquiridos mediante la exposición de 50 ms de tiempo por trama en bruto (450 ms por marco SIM) espaciados a intervalos de 5 seg. Por favor, haga clic aquí para ver el vídeo.
Archivo Código Suplementario: archivo repertorio Ejemplo SLM (48449_300us_1-bit_Balanced.seq3).d / 53988 / 48449_300us_1-bit_Balanced.seq3 "> Haga clic aquí para descargar este archivo.
Código Suplementario Archivo:. Fichero repertorio Ejemplo SLM (period9_001.bmp) Haga clic aquí para descargar este archivo.
Código Suplementario Archivo:. Fichero repertorio Ejemplo SLM (period9_002.bmp) Haga clic aquí para descargar este archivo.
Código Suplementario Archivo:. Fichero repertorio Ejemplo SLM (period9_003.bmp) Haga clic aquí para descargar este archivo.
Archivo Código Suplementario: Ejemplo SLM repertoire archivo (period9_004.bmp). Por favor, haga clic aquí para descargar este archivo.
Código Suplementario Archivo:. Fichero repertorio Ejemplo SLM (period9_005.bmp) Haga clic aquí para descargar este archivo.
Código Suplementario Archivo:. Fichero repertorio Ejemplo SLM (period9_006.bmp) Haga clic aquí para descargar este archivo.
Código Suplementario Archivo:. Fichero repertorio Ejemplo SLM (period9_007.bmp) Haga clic aquí para descargar este archivo.
Suplementario Código del archivo:. fichero repertorio Ejemplo SLM (period9_008.bmp) Haga clic aquí para descargar este archivo.
Código Suplementario Archivo:. Fichero repertorio Ejemplo SLM (period9_009.bmp) Haga clic aquí para descargar este archivo.
Código Suplementario Archivo:. Fichero repertorio Ejemplo SLM (period9_mask_1.bmp) Haga clic aquí para descargar este archivo.
Código Suplementario Archivo:. Fichero repertorio Ejemplo SLM (period9_mask_2.bmp) Haga clic aquí para descargar este archivo. >
Código Suplementario Archivo:. Fichero repertorio Ejemplo SLM (period9_mask_3.bmp) Haga clic aquí para descargar este archivo.
Código Suplementario Archivo:. Fichero repertorio Ejemplo SLM (TIRF de SIM_example.rep) Haga clic aquí para descargar este archivo.
Código Suplementario Archivo:. Ejemplo de generación de código de rejilla (1 de 2) (generate_gratings.m) Haga clic aquí para descargar este archivo.
Archivo Código Suplementario: Ejemplo de código de rejilla generación (2 de 2) (circular_mask.m).= "Https://www.jove.com/files/ftp_upload/53988/circular_mask.m"> Haga clic aquí para descargar este archivo.
Código Suplementario Archivo:. Código de ejemplo para calcular el contraste de modulación (calculate_contrast.m) Haga clic aquí para descargar este archivo.
Discusión
Hechas a medida sistemas TIRF-SIM como la configuración se detalla en este protocolo son capaces de imágenes multicolores de super-resolución a alta velocidad en comparación con los microscopios disponibles en el mercado. La ventaja inherente de SIM como una técnica de super-resolución es que la resolución temporal no está limitado por los fotofísica del fluoróforo, en comparación con otros métodos, como única molécula de microscopía de localización (SMLM) o métodos de exploración de punto tales como la microscopía de agotamiento de la emisión estimulada ( STED). A diferencia de estas otras técnicas, SIM no requiere fluoróforos photoswitchable o no renovables de modo de imagen multicolor es sencillo. sistemas TIRF-SIM no, como óptica de seccionamiento SIM y multifocal SIM generalmente pueden lograr mejoras en la resolución de 1,7 veces o menos en la práctica en comparación con el factor de 2 mejora informado aquí, y sistemas comerciales también son a menudo más lento y menos flexible que el sistema de presentado en este protocolo.
"> Las dos dificultades principales en la aplicación de esta técnica son en primer lugar la necesidad de un posicionamiento preciso de las seis vigas SIM dentro de la zona TIR de la abertura posterior del objetivo, que requiere un tiempo de laborioso y consume procedimiento de alineación óptica. En segundo lugar, para producir alto contraste patrón en la muestra, la rotación de la polarización es esencial. para los sistemas de NA 2D-SIM bajos, la rotación de la polarización se puede evitar mediante una cuidadosa elección de la orientación de la polarización lineal, pero esto se hace imposible para TIRF-SIM 25. para imágenes multicolor de alta velocidad, electro- control de la polarización óptica es necesaria y esto aumenta la complejidad y el costo del sistema.Las limitaciones de la técnica
TIRF-SIM, como TIRF convencional, es, naturalmente, limitada a la observación de las estructuras y procesos localizados en la membrana celular basal que puede ser iluminado por la profundidad de penetración 150 a 200 nm del campo evanescente biológicos. MientrasSIM es a menudo citado como menos photodamaging a las células que cualquiera STED o SMLM, resolución duplicación lateral tiene todavía aumentar el número requerido de fotones por al menos 4 veces 5 en comparación con la microscopía TIRF convencional. Para imágenes en alta velocidad de cuadros con exposiciones breves momentos, este aumento de fotones hace necesario el uso de mayores intensidades de iluminación. Mientras que cualquier fluoróforo se puede utilizar para obtener imágenes de muestras SIM móviles fijos o lentos, proteínas fluorescentes de alta luminosidad o tintes sintéticos de nueva generación con fotoestabilidad mejorada se recomiendan para imágenes de células vivas.
Aunque esta aplicación es capaz de formar imágenes de un solo color a velocidades de cuadro SIM en exceso de 20 Hz, de formación de imágenes multicolor en el sistema presentado está limitado por el tiempo de conmutación de la rueda de filtro de emisión motorizado. Debido al gran tamaño del chip de la cámara sCMOS, el uso de un filtro de emisión de multibanda y de imagen óptica de división sería posible y permitir i simultáneaMaging con múltiples longitudes de onda a ninguna pérdida de velocidad. Otra posibilidad sería la de alternar los diferentes láseres de excitación y utilizar un filtro de muesca multibanda para rechazar la luz de excitación. El uso de un SLM ferroeléctrico binario en esta implementación también no es óptima. La eficiencia de difracción de un SLM de este tipo es muy baja, por lo que la mayor parte de la luz incidente es en la reflexión de orden cero, que se filtra por la máscara espacial. Para aplicaciones que requieren velocidades de fotogramas muy altas, la velocidad de formación de imágenes está por lo tanto limitada por la potencia de salida de los diodos láser. El MST también introduce algunas elipticidad en la polarización para longitudes de onda de distancia de la longitud de onda de diseño de 550 nm, donde los píxeles no funcionan placas de media onda como ideales. Aunque esto podría compensarse mediante el uso de una LCVR adicional, la solución ideal puede ser el uso de un dispositivo de micro-espejo digital (DMD) como un generador de patrones.
Las posibles modificaciones
La configuración presented aquí es flexible y más fácil de modificar que los instrumentos comerciales para que otras modalidades de imágenes tales como 3D-SIM, rápido 2D-SIM, SIM multifocal (MSIM) y SIM no lineal (NL-SIM) se pueden implementar 21,34,35.
2D-SIM puede ser muy adecuado para la formación de imágenes relativamente plana, de movimiento rápido estructuras tales como el retículo endoplasmático periférica. El ER periférica es más profundo dentro de la célula que puede ser iluminado mediante un campo evanescente TIRF pero debido a su estructura plana se pueden obtener imágenes utilizando el estándar 2D-SIM con insignificante fondo fuera de foco. Además, el uso de mejores algoritmos de reconstrucción de seccionamiento óptico para suprimir fuera de foco de luz se extiende el uso de 2D-SIM para muestras ópticamente gruesas, aunque donde no se requiere una resolución axial de 21 duplicación.
En MSIM, la muestra es iluminada por una celosía escasa de focos de excitación 36. Esta modalidad puede ser implementado por la simple eliminación de la máscara espacial (SM) Y su sustitución por un polarizador. El SLM ahora funciona como un modulador de amplitud. Las rejillas SIM binarias que aparecen en el SLM pueden ser reemplazados por una celosía 2D de manchas, con el tamaño de los lugares elegidos para ser igual al tamaño de un enfoque limitado de difracción en el plano de la imagen. En la Figura 7A, un enrejado de 4 x 4 píxeles cuadrados se muestra en el SLM (recuadro) que cuando demagnified sobre la muestra genera difracción focos limitados de 150 x 150 nm, dado el tamaño SLM pixel física de 13,62 m. Los focos de excitación se puede traducir al cambiar el patrón reticular en el MST y esto se repite varias veces con el fin de iluminar todo el campo de visión. Las imágenes se adquieren para cada posición del patrón traducida y la pila es post-procesados para producir una imagen reconstruida con una mejor resolución de hasta un factor de 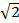 y la reducción de fuera de foco de luz en comparación con la imagen de campo amplio equivalente30. Esta modalidad puede ser útil para la formación de imágenes gruesas muestras y densos para los que SIM estándar no es adecuado, por ejemplo, las estructuras de bajo contraste, tales como células rojas de la sangre teñidas (Figura 7C), aunque el tiempo de adquisición se incrementa debido a la gran cantidad de marcos primas requerido por campo de visión (en este caso N = 168).
y la reducción de fuera de foco de luz en comparación con la imagen de campo amplio equivalente30. Esta modalidad puede ser útil para la formación de imágenes gruesas muestras y densos para los que SIM estándar no es adecuado, por ejemplo, las estructuras de bajo contraste, tales como células rojas de la sangre teñidas (Figura 7C), aunque el tiempo de adquisición se incrementa debido a la gran cantidad de marcos primas requerido por campo de visión (en este caso N = 168).
Por último, la configuración puede ser modificado para permitir que sea de alta NA lineal TIRF-SIM o activación modelado no lineal SIM (PA NL-SIM), tal como se presenta recientemente por Li et al., Mediante el uso de un 1,7 objetivo o adición ultra alta NA de un láser de fotoactivación 405 nm y optimización cuidadosa de los patrones de rejilla SLM 35.
Las aplicaciones futuras
SIM es todavía una técnica rápida evolución y muchas aplicaciones en las ciencias de la vida se habilitará en el futuro. La velocidad, la resolución y mejoras de contraste de la técnica y la capacidad de utilizar fluoróforos estándar mean que para bioimagen, SIM está configurado para reemplazar muchos sistemas de microscopio convencionales, tales como plataformas de campo confocal y de ancho. Los sistemas SIM comerciales ya están disponibles hoy en día con las especificaciones técnicas pendientes, sin embargo, están fuera del alcance económico de muchos laboratorios de investigación, y, sobre todo, son inflexibles para ser modificado y desarrollado para implementar las investigaciones más recientes en el campo. También carecen de la capacidad esencial para 'ser adaptado para el experimento a la mano ", a menudo un cuello de botella crítico en la reducción de la investigación biológica borde. El sistema descrito aquí será especialmente adecuado para estudiar los procesos dinámicos cerca de la superficie de la célula, para estudios in vitro de los sistemas bicapa reconstituidas, para estudiar la química de superficie en los materiales y las ciencias físicas, por ejemplo. de materiales 2D, y muchas otras aplicaciones.
Divulgaciones
The authors have nothing to disclose.
Agradecimientos
Este trabajo fue apoyado por becas de la Fundación Leverhulme, la Ingeniería y Ciencias Físicas de Investigación [EP / H018301 / 1, EP / G037221 / 1]; Alzheimer Research UK [Aruk-EG2012A-1]; Wellcome Trust [089703 / Z / 09 / Z] y Consejo de Investigación Médica [MR / K015850 / 1, MR / K02292X / 1]. Agradecemos a E. Avezov y M. Lu para la transfección de la LifeAct-GFP y células citosólica-GFP, respectivamente, y W. Chen para la preparación de la cultura HEK293. Agradecemos también a K. O'Holleran para obtener ayuda con el diseño del microscopio, y L. Shao y R. Heintzmann para las discusiones y sugerencias útiles.
Materiales
| Name | Company | Catalog Number | Comments |
| 488 nm laser | Toptica | iBeam SMART | with digital modulation |
| 561 nm laser | Coherent | OBIS LS | with digital modulation |
| 640 nm laser | Cobolt | MLD | with digital modulation |
| Long-pass dichroic mirrors | Thorlabs | for combining excitation beams | |
| Quad band dichroic mirror | Chroma | ZT405/488/561/640rpc | 3 mm thick, TIRF imaging flat, mounted in Olympus BX filter cube |
| Quad band dichroic mirror | Chroma | ZT405/488/561/640rpc | From same batch as above, 25 x 25 mm |
| 1" square kinematic mount | Edmund Optics | 58-860 | |
| Glan-Taylor calcite polarizers | Thorlabs | GT5-A | For alignment of LCVR |
| Glan-Taylor mount | Thorlabs | SM05PM5 | |
| Achromatic half wave plate | Thorlabs | AHWP05M-600 | 400-800 nm |
| Rotation cage mount | Thorlabs | CRM1/M | For HWP |
| Liquid Crystal Variable Retarder | Meadowlark Optics | SWIFT | Custom built to provide full wave retardance over the range 488 to 640 nm. |
| LCVR controller | Meadowlark Optics | D3060HV | Two channel high voltage controller for liquid crystal retarders |
| Achromatic quarter wave plate | Meadowlark Optics | AQM-100-0545 | |
| Rotation cage mount | Thorlabs | CRM1P/M | For QWP |
| 10 mm achromatic doublet | Thorlabs | AC080-010-A-ML | For beam expander |
| 200 mm achromatic doublet | Thorlabs | AC254-200-A-ML | For beam expander |
| Cage XY Translators | Thorlabs | CXY1 | |
| Ferroelectric spatial light modulator | Forth Dimension Displays | M0787-00249 | SXGA-3DM (IFF) Microdisplay Type M249, 1,280 x 1,024 pixels, with driver board |
| SLM mounting frame | Forth Dimension Displays | M0787-10014 | Fixed to custom built aluminium mount |
| Ø50.8 mm Gimbal Mirror Mount | Thorlabs | GM200/M | For SLM mounting |
| Two-Axis Linear Translation Stage with Rotating Platform | Thorlabs | XYR1/M | For SLM mounting |
| Rail carrier | Newport | M-PRC-3 | For SLM mounting |
| Precision Optical Rail | Newport | PRL-6 | For SLM mounting |
| 300 mm achromatic doublet lens | Qioptiq | G322 273 322 | f = 300 mm, 31.5 mm diameter |
| 140 mm achromatic doublet lens | Qioptiq | G322 239 322 | f = 140 mm, 31.5 mm diameter |
| Precision XY Translation Mounts | Thorlabs | LM2XY | |
| Lens Mounting Adapters | Thorlabs | SM2AD32 | For mounting 31.5 mm lenses in 2" mounts |
| Translation stages | Comar | 12XT65 | Dovetail, side drive |
| XY Translator with Differential Drives | Thorlabs | ST1XY-D/M | for spatial filter |
| Rotation cage mount | Thorlabs | CRM1/M | for spatial filter |
| 300 mm achromatic doublet | Thorlabs | AC508-300-A-ML | Excitation tube lens |
| Automated XY stage with Z-piezo top plate | ASI | PZ-2150-XYFT-PZ-IX71 | with MS-2000 controller |
| Inverted microscope frame | Olympus | IX-71 | |
| Objective lens | Olympus | UAPON100XOTIRF | 100X/1.49NA |
| High speed filter wheel | Prior Scientific | HF110A | with Prior ProScan III controller |
| Bandpass emission filters | Semrock | FF01-525/30, FF01-676/29 | |
| sCMOS camera | Hamamatsu | ORCA Flash v4.0 | |
| Stage top incubator | OKO Lab | H301-K-FRAME | For live cell imaging, with Bold Line temperature and CO2 controllers |
| Stainless steel optical posts | Thorlabs | TR series | for mounting optical components |
| Post holders | Thorlabs | PH series | for mounting optical components |
| Kinematic mirror mounts | Thorlabs | KM100 | for mounting 1" mirrors |
| Shearing interferometer | Thorlabs | SI100 | |
| 100 nm fluorescent microspheres | Life Technologies | T-7279 | Tetraspeck |
| Rhodamine 6G | Sigma Aldrich | 83697-250MG | |
| 8 well glass bottom dishes | ibidi | 80827 | with #1.5 coverglass |
| Nunc Lab-Tek II Chambered Coverglass | Thermo Fisher Scientific | 155409 | with #1.5 coverglass |
| 0.01 mm microscope reticle slide | EMS | 68039-22 | |
| CellLight Tubulin-GFP, BacMam 2.0 | Thermo Fisher Scientific | C10613 |
Referencias
- Heintzmann, R., Cremer, C. G. Laterally modulated excitation microscopy: improvement of resolution by using a diffraction grating. BiOS Eur. 3568, 185-196 (1999).
- Gustafsson, M. G. L. Surpassing the lateral resolution limit by a factor of two using structured illumination microscopy. J. Microsc. 198 (2), 82-87 (2000).
- Shim, S. H., et al. Super-resolution fluorescence imaging of organelles in live cells with photoswitchable membrane probes. Proc. Natl. Acad. Sci. U. S. A. 109 (35), 13978-13983 (2012).
- Urban, N. T., Willig, K. I., Hell, S. W., Nägerl, U. V. STED Nanoscopy of Actin Dynamics in Synapses Deep Inside Living Brain Slices. Biophys. J. 101 (5), 1277-1284 (2011).
- Liu, Z., Lavis, L. D., Betzig, E. Imaging Live-Cell Dynamics and Structure at the Single-Molecule Level. Mol. Cell. 58 (4), 644-659 (2015).
- Westphal, V., et al. Video-Rate Far-Field Optical Nanoscopy Dissects Synaptic Vesicle Movement. Science. 320 (5873), 246-249 (2008).
- Davies, T., et al. CYK4 Promotes Antiparallel Microtubule Bundling by Optimizing MKLP1 Neck Conformation. PLOS Biol. 13 (4), e1002121 (2015).
- Laine, R. F., et al. Structural analysis of herpes simplex virus by optical super-resolution imaging. Nat. Commun. 6, 5980 (2015).
- Pinotsi, D., et al. Direct observation of heterogeneous amyloid fibril growth kinetics via two-color super-resolution microscopy. Nano Lett. 14 (1), 339-345 (2014).
- Esbjörner, E. K., et al. Direct observations of amyloid β Self-assembly in live cells provide insights into differences in the kinetics of Aβ(1-40) and Aβ(1-42) aggregation. Chem. Biol. 21 (6), 732-742 (2014).
- Michel, C. H., et al. Extracellular monomeric tau protein is sufficient to initiate the spread of tau protein pathology. J. Biol. Chem. 289 (2), 956-967 (2014).
- Pinotsi, D., Kaminski Schierle, G. S., Kaminski, C. F. Optical Super-Resolution Imaging of β-Amyloid Aggregation In Vitro and In Vivo: Method and Techniques. Syst. Biol. Alzheimer's Dis. SE - 6. 1303, 125-141 (2016).
- Axelrod, D. Cell-substrate contacts illuminated by total internal reflection fluorescence. J. Cell Biol. 89 (1), 141-145 (1981).
- Cragg, G. E., So, P. T. Lateral resolution enhancement with standing evanescent waves. Opt. Lett. 25 (1), 46-48 (2000).
- Chung, E., Kim, D., So, P. T. Extended resolution wide-field optical imaging: objective-launched standing-wave total internal reflection fluorescence microscopy. Opt. Lett. 31 (7), 945 (2006).
- Kner, P., Chhun, B. B., Griffis, E. R., Winoto, L., Gustafsson, M. G. L. Super-resolution video microscopy of live cells by structured illumination. Nat. Methods. 6 (5), 339-342 (2009).
- Fiolka, R., Shao, L., Rego, E. H., Davidson, M. W., Gustafsson, M. G. L. Time-lapse two-color 3D imaging of live cells with doubled resolution using structured illumination. Proc. Natl. Acad. Sci. U. S. A. 109 (14), 5311-5315 (2012).
- Brunstein, M., Wicker, K., Hérault, K., Heintzmann, R., Oheim, M. Full-field dual-color 100-nm super-resolution imaging reveals organization and dynamics of mitochondrial and ER networks. Opt. Express. 21 (22), 26162-26173 (2013).
- Förster, R., et al. Simple structured illumination microscope setup with high acquisition speed by using a spatial light modulator. Opt. Express. 22 (17), 20663 (2014).
- Lu-Walther, H. W., et al. fastSIM: a practical implementation of fast structured illumination microscopy. Methods Appl. Fluoresc. 3, 014001 (2015).
- Shaw, M., Zajiczek, L., O'Holleran, K. High speed structured illumination microscopy in optically thick samples. Methods. , (2015).
- von Olshausen, P. . Total internal reflection microscopy: super-resolution imaging of bacterial dynamics and dark field imaging. , (2012).
- Gustafsson, M. G. L., et al. Three-dimensional resolution doubling in wide-field fluorescence microscopy by structured illumination. Biophys. J. 94 (12), 4957-4970 (2008).
- Meadowlark Optics Inc. . Basic Polarization Techniques and Devices. , (2005).
- O'Holleran, K., Shaw, M. Polarization effects on contrast in structured illumination microscopy. Opt. Lett. 37 (22), 4603 (2012).
- Brankner, S. Z., Hobson, M. . Synchronization and Triggering with the ORCA-Flash4.0 Scientific CMOS Camera. , (2013).
- Gustafsson, M. G. L., et al. Three-dimensional resolution doubling in wide-field fluorescence microscopy by structured illumination. Biophys. J. 94 (12), 4957-4970 (2008).
- Wicker, K. Non-iterative determination of pattern phase in structured illumination microscopy using auto-correlations in Fourier space. Opt. Express. 21 (21), 24692 (2013).
- Boulanger, J., Pustelnik, N., Condat, L. Non-smooth convex optimization for an efficient reconstruction in structured illumination microscopy. 2014 IEEE 11th Int. Symp. Biomed. Imaging. 3 (1), 995-998 (2014).
- Ströhl, F., Kaminski, C. F. A joint Richardson-Lucy deconvolution algorithm for the reconstruction of multifocal structured illumination microscopy data. Methods Appl. Fluoresc. 3 (1), 014002 (2015).
- Mudry, E., et al. Structured illumination microscopy using unknown speckle patterns. Nat. Photonics. 6 (5), 312-315 (2012).
- Ayuk, R., et al. Structured illumination fluorescence microscopy with distorted excitations using a filtered blind-SIM algorithm. Opt. Lett. 38 (22), 4723 (2013).
- Ball, G., et al. SIMcheck: a Toolbox for Successful Super-resolution Structured Illumination Microscopy. Sci. Rep. 5, 15915 (2015).
- York, A. G., et al. Resolution doubling in live, multicellular organisms via multifocal structured illumination microscopy. Nat. Methods. 9 (7), 749-754 (2012).
- Li, D., et al. Extended-resolution structured illumination imaging of endocytic and cytoskeletal dynamics. Science. 349 (6251), (2015).
- York, A. G., et al. Resolution doubling in live, multicellular organisms via multifocal structured illumination microscopy. Nat. Methods. 9 (7), 749-754 (2012).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados