Method Article
Ein Leitfaden für Strukturierte Beleuchtung TIRF Mikroskopie bei hoher Geschwindigkeit mit mehreren Farben
In diesem Artikel
Zusammenfassung
This article provides an in depth guide for the assembly and operation of a structured illumination microscope operating with total internal reflection fluorescence illumination (TIRF-SIM) to image dynamic biological processes with optical super-resolution in multiple colors.
Zusammenfassung
Optische Super-Resolution-Bildgebung mit strukturierter Beleuchtung Mikroskopie (SIM) ist eine Schlüsseltechnologie für die Visualisierung von Prozessen auf molekularer Ebene in der chemischen und biomedizinischen Wissenschaften. Obwohl kommerzielle SIM-Systeme verfügbar sind, Systeme, die benutzerdefinierte im Labor entwickelt werden können kommerzielle Systeme entwickeln, die diese in der Regel für einfache Bedienung und allgemeine Anwendungen, sowohl im Hinblick auf Abbildungstreue und Schnelligkeit. Dieser Artikel stellt eine ausführliche Anleitung zur SIM-System aufzubauen, die interne Totalreflexion (TIR) Beleuchtung verwendet und ist in der Lage Bildgebung bei bis zu 10 Hz in drei Farben bei einer Auflösung erreicht 100 nm. Durch die Kombination von SIM und TIRF liefert das System eine bessere Bildkontrast als konkurrierende Technologien. Um das zu erreichen sind diese Spezifikationen, mehrere optische Elemente verwendet, um automatisierte Kontrolle über den Polarisationszustand und die räumliche Struktur des Beleuchtungslichts ermöglichen für alle verfügbaren Anregung wavelengths. Ausführliche Informationen über Hardware-Implementierung und Steuerung gegeben zu erreichen Synchronisation zwischen Anregungslicht Mustererzeugung, Wellenlänge, Polarisationszustand, und die Kamerasteuerung mit einem Schwerpunkt auf maximalen Erwerbsframerate zu erreichen. Ein Schritt-für-Schritt-Protokoll für die System Ausrichtung und Kalibrierung wird vorgestellt und die erreichbare Auflösungsverbesserung wird auf ideale Testproben validiert. Die Fähigkeit zur Video-Rate superauflösende Bildgebung mit lebenden Zellen nachgewiesen werden.
Einleitung
Im Laufe des letzten halben Jahrzehnt hat Super-Resolution-Mikroskopie gereift und bewegte sich von Fachoptik-Labors in die Hände des Biologen. Kommerzielle Mikroskop Lösungen existieren für die drei Hauptvarianten zur Erzielung optischer Super-Resolution: Einzelmoleküllokalisationsmikroskopie (SMLM), Emission Depletion - Mikroskopie stimuliert (STED) und strukturierte Beleuchtung Mikroskopie (SIM) 1,2. SMLM wie photoaktivierte Lokalisierungsmikroskopie (PALM) und stochastische optische Rekonstruktionsmikroskopie (STORM) sind die beliebtesten Techniken gewesen, vor allem wegen der Einfachheit des optischen Aufbaus und dem Versprechen hoher räumlicher Auflösung, leicht bis zu 20 nm. Allerdings superauflösende Mikroskopie über die Lokalisierung einzelner Moleküle kommt mit einer intrinsischen Trade-off: die räumliche Auflösung erreichbar auf Akkumulieren einer ausreichenden Anzahl von einzelnen Fluorophor Lokalisierungen abhängig ist, damit die zeitliche Auflösung zu begrenzen. Imaging dynamischer Prozessdaher es in lebenden Zellen wird problematisch, als eine ausreichend um die Bewegung der Struktur von Interesse Probe muss Bewegungsartefakte zu verhindern, während auch genug Lokalisierung Ereignisse in dieser Zeit den Erwerb eines Bildes zu rekonstruieren. Um diese Anforderungen, Live - Zelle SMLM Demonstrationen zu treffen haben die erforderliche Erhöhung der Fluorophore Photoschaltbarkeit Raten , die durch stark die Erregungsleistung erhöht wird , und dies führt wiederum zu Phototoxizität und oxidativen Stress, wodurch Probenüberlebenszeiten und biologische Relevanz 3 zu begrenzen.
Ein klarer Vorteil von STED über beide SIM und SMLM ist , dass es Bild mit Superauflösung in dicken Proben, beispielsweise laterale Auflösung von etwa 60 nm wurde in einer Tiefe in organotypischen Hirnschnitten erreicht bis zu 120 & mgr; m 4. Imaging in solchen Tiefen mit Einzel Ziel Implementierungen von SMLM oder SIM ist nicht machbar, aber möglich wird, entweder mit Einzelmolekül-Lichtbogen oder Gitterlichtblatt microscopy 5. Video-Rate STED hat auch das kleine Sichtfelder 6 Bildgebung beschränkt wurde synaptischen Vesikel Mobilität auf der Karte, obwohl bisher gezeigt und verwendet worden.
Für Anwendungen in der Zellbiologie und der molekularen Selbstorganisation Reaktionen 7 bis 12 , die Bildgebung mit hoher zeitlicher Auflösung erfordern über viele Zeitpunkte, strukturierte Beleuchtung Mikroskopie (SIM) können gut geeignet , da sie nicht abhängig von den photophysikalischen Eigenschaften eines bestimmten fluoresziert Sonde. Trotz dieser inhärenten Vorteil von SIM, bis jetzt seine Verwendung ist im Wesentlichen beschränkt auf fixierte Zellen oder sich langsam bewegende Prozesse Bildgebung. Dies ist aufgrund der Beschränkungen von handelsüblichen SIM-Systeme: die Erfassungsbildrate dieser Instrumente wurde durch die Rotationsgeschwindigkeit der Gitter begrenzt die benötigten sinusförmigen Beleuchtungsmuster sowie die polarisationserhaltende Optiken verwendet, zu erzeugen. Die neueste Generation von kommerziellen SIMInstrumente sind schnelle Bildgebung geeignet, aber sie sind unerschwinglich für alle, aber zentrale Imaging Einrichtungen teuer.
Dieses Protokoll stellt einen Leitfaden für den Aufbau eines flexiblen SIM-System zur Abbildung schnelle Prozesse in dünnen Proben und in der Nähe der Basisfläche von lebenden Zellen. Es beschäftigt Totalreflexions - Fluoreszenz (TIRF) ein Beleuchtungsmuster zu erzeugen , die 13 nicht tiefer als etwa 150 nm in die Probe eindringt , die in beträchtlichem Ausmaß die aus dem Fokus Hintergrund Signal reduziert. Die Idee der SIM mit TIRF Kombination ist fast so alt wie die SIM - 14 selbst wurde aber nicht experimentell realisiert vor 2006 15. Die erste in vivo erhaltenen Bilder mit TIRF-SIM wurden im Jahr 2009 16 zu erreichen Bildraten von 11 Hz zu visualisieren Tubulin und Kinesin berichtet Dynamik und zwei Farb TIRF-SIM - Systeme wurden 17,18 präsentiert. Zuletzt eine Führung für den Aufbau und die Verwendung einer einzigen Farbe Zweistrahl-SIM system wurde mit Bildraten von bis zu 18 Hz 19,20 dargestellt.
Das Set-up hier präsentiert ist in der Lage SIM superauflösende Bildgebung bei 20 Hz in drei Farben, von denen zwei in TIRF-SIM betrieben werden. Das ganze System ist um ein inverses Mikroskop Rahmen aufgebaut und verwendet eine motorisierte XY - Translationsstufe mit einem piezobetätigten Z - Stufe. Um die sinusförmigen Erregungsmuster, die für TIRF-SIM generieren, präsentiert das System einen ferroelektrischen räumlichen Lichtmodulator (SLM). Binäre Gitterstrukturen sind auf dem SLM angezeigt und die resultierenden ± 1 Beugungsordnungen werden gefiltert, weitergeleitet und fokussiert in das TIR-Ring der Objektivlinse. Die erforderlichen Phasenverschiebungen und Drehungen der Gitter werden durch Ändern der angezeigten SLM Bild angewendet. Dieses Protokoll beschreibt, wie zu bauen, und eine solche Anregungspfad auszurichten, beschreibt die Ausrichtung der Emissionspfad und zeigt Testproben für eine optimale Ausrichtung gewährleistet ist. Es de auch ritzt die Probleme und Herausforderungen, insbesondere für High-Speed-TIRF-SIM in Bezug auf eine Polarisationssteuerung und Synchronisation von Komponenten.
Design-Überlegungen und Einschränkungen
Vor der Montage in diesem Protokoll das TIRF-SIM-System präsentiert, gibt es mehrere Designbeschränkungen zu berücksichtigen, die die Wahl von optischen Komponenten bestimmen. Alle Abkürzungen von optischen Komponenten siehe Abbildung 1.
Spatial Light Modulator (SLM)
Eine binäre ferroelektrischen SLM ist in dieser Konfiguration verwendet, wie es in der Lage Musterschalt Sub-Millisekunden ist. Graustufen-nematischen SLMs verwendet werden, aber diese bieten stark reduzierte Schaltzeiten. Jeweils ein oder aus Pixel in einem binären Phasen SLM wird verleihen entweder ein π oder 0-Phase zu der einfallenden ebenen Wellenfront versetzt, also wenn ein periodisches Gittermuster auf dem SLM angezeigt wird Gitter als Phasenbeugungs arbeitet.
ent "> Total Internal Reflection (TIR) Um TIR erreichen und eine abklingende Feld erzeugen, der Einfallswinkel der Anregungsstrahlen an der Glasprobe Schnittstelle muss größer sein als der kritische Winkel 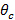 . Dies legt die minimale Einfallswinkel erforderlich und damit auch den maximalen Abstand oder Zeit des abklingenden Beleuchtungsmusters. Der maximale Einfallswinkel
. Dies legt die minimale Einfallswinkel erforderlich und damit auch den maximalen Abstand oder Zeit des abklingenden Beleuchtungsmusters. Der maximale Einfallswinkel  (Akzeptanzwinkel) wird durch die numerische Apertur (NA) der Objektivlinse begrenzt, die von der Definition berechnet werden kann,
(Akzeptanzwinkel) wird durch die numerische Apertur (NA) der Objektivlinse begrenzt, die von der Definition berechnet werden kann, 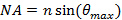 . Dies bestimmt die minimale Muster erreichbare Abstand entsprechend der Abbe Formel
. Dies bestimmt die minimale Muster erreichbare Abstand entsprechend der Abbe Formel 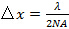 welche Links NA und Wellenlänge
welche Links NA und Wellenlänge 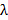 auf den minimalen Musterabstand
auf den minimalen Musterabstand  . In der Praxis ergibt eine 1,49 NA Ölkapselung TIRF Ziel einen maximalen Einfallswinkel von etwa 79 ° und einer minimalen Musterperiode auf der Probe von 164 nm eine Anregungswellenlänge von 488 nm verwendet wird. Diese beiden Winkel definieren , um einen Ring in der hinteren Öffnung des Objektivs über die das Gerät erreicht TIR Beleuchtungs (dh. Der TIR - Ring) , und in dem die zwei Anregungs Brennpunkte genau positioniert werden müssen und exakt jeden Beleuchtungsmuster zu erzeugen , gedreht wird .
. In der Praxis ergibt eine 1,49 NA Ölkapselung TIRF Ziel einen maximalen Einfallswinkel von etwa 79 ° und einer minimalen Musterperiode auf der Probe von 164 nm eine Anregungswellenlänge von 488 nm verwendet wird. Diese beiden Winkel definieren , um einen Ring in der hinteren Öffnung des Objektivs über die das Gerät erreicht TIR Beleuchtungs (dh. Der TIR - Ring) , und in dem die zwei Anregungs Brennpunkte genau positioniert werden müssen und exakt jeden Beleuchtungsmuster zu erzeugen , gedreht wird .
Die Rekonstruktion der TIRF-SIM - Bilder erfordert der Erwerb von mindestens drei Phasenverschiebungen pro Musterrotation daher die Musterperiode SLM muss von 3 (siehe Abbildung 1) teilbar sein. Beispielsweise einen Zeitraum von 9 Pixeln für 488 nm Beleuchtung und 12 Pixel für 640 nm Licht. Für eine umfassende Diskussion des SLM-Musterentwurf, einschließlich Subpixel-Optimierung des Musters mit gescherten Gitter AbstandZu sehen, die bisherige Arbeit von Kner et al. 16 und Lu-Walther et al. 20 , um die Position der beiden Erregungsherde innerhalb des TIR - Ring sein muss für alle Wellenlängen, jedoch den Beugungswinkel der ± 1 Aufträge von der SLM Wellenlänge abhängig. Für Standard-SIM, Multicolor-Bildgebung kann durch eine Optimierung der Gitterperiode für die längste Wellenlänge, und Tolerierung einen Verlust in der Leistung für die kürzeren Kanäle erreicht werden. jedoch für TIRF-SIM, bedeutet für eine Wellenlänge zu optimieren, dass die andere Wellenlänge Brennpunkte sind nicht mehr im TIR-Ring. Zum Beispiel ist eine Gitterperiode von 9 Pixeln ausreichend TIRF bereitzustellen, um 488 nm, da die Schwerpunkte bei 95% des Durchmessers der hinteren Öffnung und innerhalb des TIR-Ring sind, aber für 640 nm dieser Zeit würde die Foci Außenposition die Öffnung. Aus diesem Grund verschiedene Pixelmuster Abstände müssen für jede Anregungswellenlänge verwendet werden.
Die Ausrichtung der TIRF-SIM-Anregungspfadist extrem empfindlich gegenüber kleinen Veränderungen in der Position des dichroitischen Spiegels (DM4 in 1) in dem Mikroskopkörper, viel mehr als in herkömmlichen SIM. Verwendung eines rotierenden Filterwürfel Revolvers ist nicht zu empfehlen, kann stattdessen eine einzige Mehrband dichroitischer Spiegel, der in einer festen Position gehalten wird und zwar für die Anregungswellenlängen verwendet ausgelegt. Es ist wesentlich, dass nur die höchsten Qualitäts dichroitische Spiegel verwendet werden. Diese erfordern dicke Substrate von mindestens 3 mm und sind als "Imaging-flat" von den Herstellern oft bezeichnet. Alle anderen Substrate führen zu unerträglichen Aberration und Bildverschlechterung in TIRF-SIM.
polarisations~~POS=TRUNC
Zu erreichen TIRF-SIM ist es wesentlich , den Polarisationszustand des Anregungslichts in Synchronität mit dem Beleuchtungsmuster zu drehen , so dass sie azimutal polarisierter in der Objektivpupille Ebene in Bezug auf die optische Achse bleibt (dh. s-polarisiert). Ausrichtung der Polarisationssteuerungsoptik hängt von der spezifischen optischen Elements abhängen eingesetzt, beispielsweise eine Pockels - Zelle 21 oder eine Halbwellenplatte in einem motorischen Rotationsstufe 22. In diesem Protokoll eine benutzerdefinierte Flüssigkristall variablen Verzögerer (LCVR) verwendet wird, entworfen Vollwellen (2π) Retardierung über den Wellenlängenbereich von 488 bis 640 nm zur Verfügung zu stellen, wie es schnell (~ ms) Schalt ermöglicht. Wenn ein Flüssigkristall-Retarder Verwendung ist es wesentlich, eine hohe Qualität Komponente zu verwenden: Standardkomponenten sind in der Regel nicht stabil genug, um eine konstante Verzögerung über die Länge der Kamerabelichtungszeit zu geben, die auf eine aus dem Beleuchtungsmuster Unschärfen führt und niedrigen Modulationskontrast . Flüssigkristall Verzögerer sind auch stark temperaturabhängig und erfordern bei der Temperaturregelung eingebaut.
Synchronisation
Die Laser müssen mit dem SLM synchronisiert werden. Binary ferroelektrischen SLMs werden intern von s ausgeglichenwitching zwischen einem Ein-Zustand und Aus-Zustand. Die Pixel wirken nur als Halbwellenplatten entweder in ihre ein- oder ausgeschalteten Zustand, aber nicht während der Zwischenbildschaltzeit. Deshalb sollte der Laser nur während der Ein / Aus-Zuständen über die LED Freigabesignal von dem SLM eingeschaltet werden, um eine Verringerung der Musterkontrast zu verhindern aufgrund der Zwischenzustand der Pixel. Ein akustooptischer Modulator (AOM) könnte alternativ als schneller Shutter verwendet werden, wenn die Laser nicht digital moduliert werden kann.
Wahl der Objektive
Auf der Grundlage dieser Randbedingungen zu erzeugen, die erforderliche Verkleinerungs der SLM Ebene auf die Probenebene die gewünschte Beleuchtungsmuster bestimmt werden kann. Dies ermöglicht die Berechnung der Brennweiten der beiden Linsen L3 und L4 in dem Bild Umsetzteleskop und der Anregungs Kondensorlinse L5. In diesem System wird ein 100x / 1.49NA -Ölimmersionsobjektiv Objektiv mit 488 nm und 640 nm Anregung verwendet wird, verwendet daher Brennweiten von 300 und 140 mmfür L4 und L3 und 300 mm für L5, insgesamt Verkleinerungs von 357x, das entspricht einem SLM Pixelgröße von 38 nm auf der Probenebene geben. Unter Verwendung dieser Kombination von Linsen, Gitter SLM Perioden von 9 für 488 nm Beleuchtung und 12 Pixel für 640 nm Muster geben Abständen von 172 und 229 nm an der Probe, entsprechend Einfallswinkel von 70 ° und 67 ° sind. Für ein Glas-Wasser-Grenzfläche, ist der kritische Winkel 61 °, und ist unabhängig von der Wellenlänge, daher sind diese zwei Musterabstände TIRF Anregungs für beide Wellenlängen ermöglichen. Eine Objektivlinse mit einem Korrekturring ausgestattet ist, zur Korrektur der sphärischen Aberrationen nützlich durch Variationen in Deck Dicke eingeführt, oder wenn bei 37 ° C arbeitet.
Bildrekonstruktion
Sobald raw SIM-Daten erworben worden ist, ist es eine Frage der Rechenaufwand super-aufgelöste Bilder in einem zweistufigen Verfahren zu erzeugen. Erstens hat das Beleuchtungsmuster für die zu bestimmendejedes Bild und zum anderen müssen die Komponenten des SIM - Spektrum entsprechend getrennt und rekombiniert werden als die effektive OTF Unterstützung zu verdoppeln (siehe Abbildung 6, Einschübe).
Die genaue Kenntnis der projizierten Beleuchtungsmuster ist von größter Bedeutung, da die superaufgelöste Frequenzkomponenten ungemischt sein müssen, so genau wie möglich Artefakte, die durch die restlichen Teile von überlappenden Komponenten zu verhindern. Wir bestimmen das Beleuchtungsmuster nach dem Verfahren a posteriori aus der rohen Bilddaten Parameter , die von Gustafsson eingeführt et al. 23 Kurz gesagt, eine Reihe von Beleuchtungsparameter , die eine normalisierte zweidimensionale Sinuskurve beschreibt hat für jede der gefunden werden 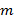 Erregungsmuster
Erregungsmuster 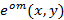 :
:
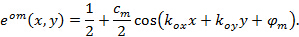
Hiermit 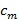 und
und 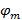 beschreiben den Streifenkontrast und die Musterphase jedes m Einzelbild beginnend jeweils. Die Komponenten des Wellenvektors,
beschreiben den Streifenkontrast und die Musterphase jedes m Einzelbild beginnend jeweils. Die Komponenten des Wellenvektors, 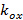 und
und 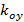 , Nur mit unterschiedlichen Orientierungen ändern
, Nur mit unterschiedlichen Orientierungen ändern 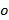 des Musters und kann angenommen ansonsten konstant. Um zu bestimmen, grob die Komponenten des Wellenvektors eine Kreuzkorrelation von Rohbild Spektren durchgeführt wird, die durch Anlegen Subpixel Verschiebungen zu einer der kreuzkorrelierten Bildern verfeinert wird als Überlappungs zu optimieren. Dies wird durch Multiplikation des Realraum Phasengradienten getan
des Musters und kann angenommen ansonsten konstant. Um zu bestimmen, grob die Komponenten des Wellenvektors eine Kreuzkorrelation von Rohbild Spektren durchgeführt wird, die durch Anlegen Subpixel Verschiebungen zu einer der kreuzkorrelierten Bildern verfeinert wird als Überlappungs zu optimieren. Dies wird durch Multiplikation des Realraum Phasengradienten getan 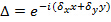 dass eine Subpixel-Verschiebung in fre induzierenquenz-Raum. Man beachte, dass es nützlich ist, eine gute Schätzung der Wellenvektoren zu haben, vor dem eigentlichen Muster Schätzung und dies kann durch Abbilden einer fluoreszierenden Perlenschicht gefunden werden.
dass eine Subpixel-Verschiebung in fre induzierenquenz-Raum. Man beachte, dass es nützlich ist, eine gute Schätzung der Wellenvektoren zu haben, vor dem eigentlichen Muster Schätzung und dies kann durch Abbilden einer fluoreszierenden Perlenschicht gefunden werden.
Da der Phasenschritt zwischen verschobenen Muster ist 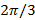 , Dh.
, Dh. 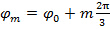 Kann die Trennung von Frequenzkomponenten durch eine Fourier entlang der "Phasenachse" Transformation durchgeführt werden. Die globale Phase
Kann die Trennung von Frequenzkomponenten durch eine Fourier entlang der "Phasenachse" Transformation durchgeführt werden. Die globale Phase 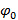 und der Streifenkontrast
und der Streifenkontrast 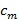 kann dann komplexe lineare Regression von verschiedenen Komponenten bestimmt werden. Die einzelnen getrennten Komponenten werden dann ein generalisiertes Wiener-Filter kombiniert werden. Für eine detaillierte Beschreibung der beiden Parameterextraktion und Implementierung des verallgemeinerten Wiener-Filters verweisen wir den Leser auf Gustafssonet al. 23 , wo der gleiche Algorithmus verwendet wird.
kann dann komplexe lineare Regression von verschiedenen Komponenten bestimmt werden. Die einzelnen getrennten Komponenten werden dann ein generalisiertes Wiener-Filter kombiniert werden. Für eine detaillierte Beschreibung der beiden Parameterextraktion und Implementierung des verallgemeinerten Wiener-Filters verweisen wir den Leser auf Gustafssonet al. 23 , wo der gleiche Algorithmus verwendet wird.
Protokoll
1. Organisation und Ausrichtung des Anregungspfad
- Markieren Sie die Positionen der Komponenten auf der optischen Tabelle (siehe Abbildung 1 für einen Überblick über den optischen Aufbau). Trenne die objektive, Linsen L3, L4, L5 und der SLM jeweils durch die Summe ihrer jeweiligen Brennweiten so dass der SLM Oberfläche wird auf die Brennebene des Objektivs weitergeleitet werden.
- Legen Sie DM4 mehrschneidigen dichroitische Spiegel in den Filterwürfelrevolver des Mikroskops Rahmen.
- Setzen Sie den zweiten dichroitischen Spiegel DM3 in eine 1 "quadratische kinetische Spiegelhalterung und positionieren sie eine Brennweite entfernt von der Kondensorlinse L5.
Hinweis: Diese Anregung Pfad Entwurf enthält zwei identische dichroitischen Spiegel DM3 und DM4, die aus der gleichen Produktionscharge genommen werden identische optische Eigenschaften zu gewährleisten. Der dichroitische Spiegel (DM4) positioniert ist, so dass die s- und p-Achsen geschaltet werden im Vergleich zu dem dichroitischen in dem Mikroskop angeordnet (DM3), wodurch jede CancellingPolarisations Elliptizität durch seine Doppelbrechung (Figur 1) eingeführt. Diese Kompensation funktioniert genauso gut für jede Beleuchtungswellenlänge. Dieser Schritt ist wichtig für hohe Modulations Kontrast beibehalten. - Vor dem Einsetzen Pfad alle Linsen in der Anregungs definieren genau die optische Achse für das System.
- Entfernen Sie die Objektivlinse (OB) aus dem Revolver und schrauben statt in einem Ausrichtungswerkzeug. Diese besteht aus einer 500 mm langen optischen Käfigsystem mit zwei Ausrichtungsplatten an beiden Enden.
- Verwenden Sie die dichroitischen Spiegel DM3 und eine temporäre Ausrichtungsspiegel am ungefähren späteren Position des SLM positioniert, um einen kollimierten Referenzstrahl vom Laser 1 durch den Mittelpunkt der Löcher in den beiden Ausrichtungsplatten zu lenken. Lenken den Strahl von Laser 1 zum temporären Spiegel , wie dargestellt in Figur 1 unter Verwendung von drei Spiegel und dichroitischen Spiegel DM2. Der temporäre Spiegel am SLM Position muss nahe an der optischen Achse senkrecht ist.
: Verwenden Sie Laser 1 als Referenzstrahl, wie die anderen Laser anschließend ausgerichtet werden kann, wenn die Anregungspfad vorhanden ist. - Entfernen Sie die Ausrichtungswerkzeug einmal das grobe optische Achse determined.Insert eine Iris in den Strahlengang wurde, bevor es den Körper Mikroskopie eintritt und Zentrieren auf dem Balken. Bringen Sie ein Stück weiße Karte mit einem kleinen Loch zentriert auf dem iris.Reinsert die Objektivlinse (OB).
Hinweis: Der Strahl das Ziel verlassen wird nun stark divergenten sein, aber es wird eine sehr schwache Reflexion von der Rückfläche der Linse, die auf der weißen Karte sichtbar. Alle Objektive, auch wenn sie beschichtet Antireflex sind, werden schwache Rückreflexionen, die verwendet werden können, koaxiale Ausrichtung zu gewährleisten. Wenn der Strahl exakt senkrecht zu der Linse ist, dann wird die Rückreflexion durch die Mitte der Iris zurück - Machen Sie iterativen Winkeleinstellungen an den beiden Spiegeln (DM3 und Ausrichtungsspiegel an der SLM-Position) auf die Rückreflexion zum Zentrumdie Karte mit dem einfallenden Strahl. Vorübergehend entfernen Sie die Objektivlinse (OB) und den Laserpunkt an der Decke markieren eine Referenzposition zu schaffen.
- Setzen Sie ein Paar Blenden auf der Höhe des Referenzstrahls entlang der Gewindebohrungen des Tisches. Der Strahl sollte auf der Oberfläche des optischen Tisch parallel sein. Die optische Achse ist nun definiert.
- Legen Sie die Kondensorlinse (L5) etwa eine Brennweite entfernt von dem Ziel. Montieren Sie das Objektiv auf einer linearen Übersetzung Bühnenbild entlang der Richtung des Referenzstrahls zu übersetzen.
- Stellen Sie die Kondensorlinse Position und den Winkel, so dass der Strahl verlässt das Ziel kollimiert und trifft den Referenzpunkt auf der Decke. Überprüfen Sie, ob die Linse auf den Strahl senkrecht ist wieder durch die Rückreflexion mit der Iris und weiße Karte zu überprüfen. Entfernen Sie die Objektivlinse (OB) und legen Sie die zweite Linse des Bild Relais Teleskop (L4).
Hinweis: Die Gewährleistung der richtigen Kollimation und nicht Ablenkung von der seinUhr erleichtert wird, wenn es eine gerade Anzahl von Linsen in den Strahlengang ist. - Stellen Sie die Position und der Winkel dieser Linse eine lineare Translationsstufe unter Verwendung Kollimation zu erhalten und der Referenzstrahl noch trifft die markierte Stelle an der Decke sicherzustellen.
- Bringen Sie die Objektivlinse (OB) und legen Sie die erste Linse des Teleskops (L3). Stellen Sie die Position und der Winkel dieser Linse Kollimation und nicht-Auslenkung zu gewährleisten, wie in den vorhergehenden Schritten beschrieben.
- Montieren Sie den SLM-Chip auf einem kardanisch montieren, Drehung bereitstellt, ohne Übersetzung um das Zentrum der Chipoberfläche.
Hinweis: Die spezifische Montage-Design auf dem SLM hängt verwendet. Wenn der SLM ohne Halterung geliefert wird, sollte es zu einer benutzerdefinierten gefräste Aluminium-Platte befestigt werden, die dann zu einer Linse Kardan-Halterung befestigt ist. - Mit den Linsen ausgerichtet sind, legen Sie die SLM anstelle des Spiegels. Stellen Sie die Position des SLM, so dass der Referenzstrahl in der Mitte des SLM-Chip angeordnet ist, und stellen Sie die eingle, so dass der Strahl die beiden Relais gelangt durch Linsen (L3 und L4). Überprüfen Sie, ob der Referenzstrahl immer noch auf der markierten Stelle zentriert ist.
- Erweitern und den Referenzstrahl mit einem Keplerian Strahlaufweiter kollimieren.
- Montieren der beiden Linsen (L1 und L2) in einem Käfigsystem für eine einfache Justierung.
- Centre Das Käfigsystem auf dem Referenzstrahl durch die Linsen entfernt und durch Irisblenden ersetzen.
- Setzen Sie die beiden Linsen und passen die axiale Position des L2 den aufgeweiteten Strahl mit einem Shearinginterferometers parallel zu richten. L2 sollte von der Oberfläche des SLM eine Brennweite entfernt sein.
- Überprüfen Sie, dass der aufgeweitete Strahl immer noch nach den beiden Relaislinsen L3 und L4 parallel gerichtet ist. Verwenden Sie das Shearinginterferometers kurz nach DM3 zur Kollimation zu überprüfen.
- Sobald der Anregungspfad wurde für eine einzelne Wellenlänge ist, koppeln die beiden anderen Laser in den Strahlengang ausgerichtet sind. Steer jeden Strahl durch zwei Iris zentriert auf der Anregung Pfaddie Strahlkombiniermittel dichroitische Spiegel (DM1 und DM2).
2. Ausrichtung der Polarisationsrotator
- Montieren Sie die LCVR mit seiner schnellen Achse bei 45 ° zum einfallenden Polarisation.
- Feinabstimmung Polarisationswinkel des einfallenden Strahls auf die LCVR eine achromatische Halbwellenplatte mit (HWP), indem der HWP Einsetzen und die LCVR zwischen gekreuzten Polarisatoren. Drehen Sie das HWP die Sendeleistung zu minimieren.
Hinweis: Um als variable Polarisationsdreher zu wirken, die schnelle Achse des Flüssigkristall Retarder (LCVR) muss genau auf 45 ° zum einfallenden vertikalen Strahlpolarisation ausgerichtet werden. Die LCVR wird bei 45 °, aber dies ist nur eine grobe Ausrichtung physisch montiert ist. Die HWP wird verwendet in Bezug auf die LCVR schnellen Achse perfekt 45 ° Ausrichtung der einfallenden Polarisation zu gewährleisten. Die Viertelwellenplatte (QWP) wandelt die geneigte elliptische Polarisation durch die LCVR zurück zu linearer Polarisation in einem Winkel durch die angelegte Spannung gesteuert induzierte24. - Legen Sie die QWP nach dem LCVR und drehen sie ihre langsame Achse auf das ankommende Polarisation auszurichten, indem die Sendeleistung zwischen gekreuzten Polarisatoren zu minimieren.
3. Ausrichtung des Emissionspfad
- Position grob die Kamera einen Stufenmikrometer Rutsche und Durchlicht.
- Konzentrieren Sie sich auf das Absehen die Mikroskop-Okulare mit und befestigen Sie die Objektivlinse an dieser Position.
- Zentrum rund um die Kamera und bewegen Sie die Kameraposition das Bild des Retikels in den Fokus zu bringen, indem das Bild auf dem Bildschirm beobachten.
Hinweis: Wenn ein externes Filterrad verwendet wird, dann wird der Würfel Filter nicht ein Emissionsfilter enthalten, daher müssen die Okulare nicht verwendet werden, wenn Laser eingeschaltet.
- Feinabstimmung der Kameraposition eine fluoreszierende Perle Probe verwendet wird.
- Bereiten Sie eine Monoschicht von fluoreszierenden Kügelchen durch einen Tropfen von 100 nm mehrfarbige Perlen auf einem # 1.5 Deckglas zu verbreiten. Lassen Sie auf dry die Perlen auf die Abdeckglas zu adsorbieren und dann wieder in Wasser eintauchen.
- Legen Sie die Perle Probe auf das Objektiv mit Sionsöl. Feinabstimmung der Position der Kamera, so dass die Leuchtstoffperlenschicht im Fokus ist. Nicht über die Objektivlinsenposition einstellen, sobald der Fokus gefunden wurde.
Hinweis: Da die SLM in einer Ebene konjugiert zu der Probenebene sein muß, die Position des SLM, Relaislinsen und Ziel muss fixiert werden. den Fokus, bewegen Sie die Probe in axialer Richtung statt das Ziel mit Hilfe eines Piezo-Z-Stufe einzustellen.
- Generieren Sie die entsprechende SIM-binäre Gittermuster als Bitmap-Dateien.
- 3 Muster Orientierungen mit jeweils 3 in gleichem Abstand Phasenverschiebungen: Für 2D / TIRF-SIM, eine Reihe von 9 binäre Gitterbilder erzeugen. Erzeugen diese numerisch (unter Verwendung von MATLAB zum Beispiel) aus einem gedrehten 2D sinusoid mit einem Phasenversatz angewendet, dann Schwellwertbildung ein binäres Bild zu erzeugen. Siehe Ergänzenden Code-Dateien zum Beispiel Code.
- Für alignment Zwecke, erzeugen auch Gitterstrukturen , die durch eine kleine kreisförmige Öffnung für jede der drei Ausrichtungen Fenster wurden, wie in Abbildung 2 gezeigt. Die gefensterten Ausrichtung Gitter müssen nicht extern getriggert werden , sondern kann manuell durch den Benutzer über die umgeschaltet werden SLM-Software.
Hinweis: Siehe Referenzen für eine Diskussion über die optimale Drehwinkel und ein Beispiel für Gittermuster Generation Code 16,20.
- Laden Sie die Bitmap-Bilder auf den SLM der Software des Herstellers (zum Beispiel MetroCon).
- Laden Sie die SLM-Steuerungssoftware und klicken Sie auf "Verbinden".
- Im "Repertoire", klicken Sie "Laden" das Repertoire-Datei zu öffnen und überprüfen Sie die Anzahl der Lauf in der Datei enthaltenen Aufträge. Im Beispiel Repertoire-Datei angegeben sind fünf Laufaufträge.
- Klicken Sie auf "Senden an Board", das Repertoire-Datei auf den SLM zu laden.
- Warten Sie auf die Bitmap-Bilder ein hochladennd für das Gerät automatisch neu gestartet.
Hinweis: Ein Beispiel Repertoire-Datei, die Gitter-Bitmap-Bilder und eine Datei, die die Reihenfolge der Definition enthält, wird als Zusatzcode-Datei enthalten. Die ".repz" Datei kann unter Verwendung von ZIP-Datei Archivierungssoftware geöffnet.
- Anzeigen einer Fenster Ausrichtung auf dem SLM zum ersten Orientierungsgitter (beispielsweise 0 °).
- In der SLM Steuerungssoftware, wählen Sie die Registerkarte "Status", geben Sie die Nummer der Running Order (im Falle der Beispieldatei, diese Order "1" ausgeführt wird).
- Klicken Sie auf "Wählen", um die Ausrichtung Gitter die Running Order zu ändern.
Anmerkung: Dies wird einen kleinen kreisförmigen Bereich in der Probenebene zu beleuchten. Wenn der SLM Oberfläche richtig auf die Probe Ebene konjugiert ist dann die Ränder dieser Region sein scharf im Fokus. die Null-Ordnung Reflexion von der reflektierenden Backplane des: Das Gittermuster wird mehrere Beugungsordnungen im Fokus der L3 produzierenSLM, die -1 und +1 Aufträge an das Gitter entspricht, und auch schwächer höheren Ordnungen , die aus der Beugung der inneren Elemente der spezifisch auf die SLM - Gerät entstehen (z. B. Reflexionen der internen Verdrahtungen der SLM - Pixeln und Unregelmäßigkeiten an den Pixelkanten) . Alle aber die -1 und +1 Aufträge müssen herausgefiltert werden.
- Einfügen eine räumliche Maske (SM), die in einem x, y-Tisch in den Strahlengang an der Fokusposition L3, und zu übersetzen seine Position in Bezug auf die optische Achse, so dass nur die gewünschten ersten Aufträge übergeben werden. Direkt nach dem räumlichen Filter, nur zwei kreisförmige Balken sichtbar.
Anmerkung: Die räumliche Maske durch Stanzen 6 Löcher in Aluminiumfolie mit einer Nadel hergestellt wird. Die Löcher sollten groß genug sein, um die Strahlen erster Ordnung für alle Laserwellenlängen passieren. Eine detaillierte Analyse der räumlichen Maske wird in Bezug 20 gegeben. - Zeigt die nächste Ausrichtung des Ausrichtungs Gitter (60 °, fahrbereitem Zustand 2) und wiedersicherzustellen, dass nur die ersten Aufträge durch die räumliche Maske lassen werden, seine Position anpassen, falls erforderlich.
- Wiederholen Sie für die endgültige Ausrichtung (120 °, fahrbereitem Zustand 3).
- Überprüfen Sie das Bild der Leuchtstoffperlenschicht auf der Kamera. Wenn die beiden kreisförmigen Strahlen nicht überlappend sind , wie in 2 dargestellt ist, dann die Probenebene neu positionieren , indem iterativ der Objektivlinse und Kameraposition eingestellt wird .
- Stellen Sie die Zielposition die beiden Strahlen zu überlappen, die das Bild unscharf zu bringen. Positionieren Sie die Kamera das Bild, um wieder in den Fokus und die Feinabstimmung des Ziels für den Fall, zwei Kreise sind noch sichtbar. Wiederholen Sie diesen Vorgang, bis die beiden Strahlen überlappen und eine einzige kreisförmigen Bereich ist im Fokus.
- Sobald die Position der Probenebene eingestellt worden ist, halten Sie die Zielposition festgelegt.
- Um zu bestätigen, TIRF-Beleuchtung, Bild, eine Lösung von Fluoreszenzfarbstoff, zum Beispiel für eine 488 nm Anregungswellenlänge, verwenden Sie eine Lösung von 1081; M Rhodamin 6G.
- Bringen Sie die Farbstoffprobe in den Fokus. Wenn die beiden Strahlen, an der richtigen TIRF Winkel sind, dann werden einzelne Moleküle ohne hohe Hintergrund sichtbar sein, und die Ränder der kreisförmigen Öffnung im Fokus sein wird. Siehe Abbildung 2B-D für Beispiele ausgerichteter und falsch ausgerichtete TIRF Balken.
- Zeigen Sie jede Ausrichtung der Fenster-Gitter wiederum und sicherzustellen, dass alle drei Orientierungen TIRF-Beleuchtung zur Verfügung stellen und dass die beiden Strahlen überlappen sich an der Probenebene. Feineinstellungen der Position der Strahlen kann durch Einstellen dichroitischen Spiegel DM3 erfolgen.
Hinweis: Obwohl verschiedene Wellenlängen in leicht unterschiedlichen Positionen fokussiert sind aufgrund der chromatischen Aberration zu Axial-, dies nicht kritisch und kann durch Anlegen einer konstanten z-Offset zu der Probenposition vor der Anregung mit der zweiten Wellenlänge korrigiert werden.
4. Systemsynchronisation und Kalibrierung
- Legen Sie die Perle einschichtigen sreichlich auf dem Ziel und bringen in den Fokus.
- Programmieren Sie die SLM seine Steuerungssoftware, für das erste Muster Orientierung (0 °) jede der drei Phasenverschiebung Bilder wiederum angezeigt werden soll.
- Mit der SLM Steuerungssoftware, schalten Sie auf Running Order 4 des Beispiels Repertoire.
- Konfigurieren Sie die Kamera seine Erfassungssoftware (zum Beispiel HCImage), um zwei Signale: ein positiver und ein negativer TTL Triggersignal während der globalen Belichtungszeit. In der Kamera-Software unter "Advanced Camera Eigenschaften", Set Output Trigger-Art 1 und 2 "Belichtung" und Output Polarität des Triggers 1 und 2 auf "positiv" und "negativ" bezeichnet.
- Schließen Sie Ausgang 1 und 2 von der Kamera auf den "Trigger" und "Fertig stellen" Eingänge des SLM jeweils unter Verwendung von Koaxialkabeln. Der SLM wird nun auf der Kamera synchronisiert.
- Erwerben Sie eine Serie von 3 Bildern.
- In der "Sequenz" Fenster wählen &# 34; Hard Disk Record "als Scan-Typ, und stellen Sie die Framezahl auf 3.
- Klicken Sie auf "Start" 3 Frames zu erwerben. Das SLM-Muster wird bei jeder Belichtung ändern. Die fluoreszierenden Kügelchen in dem Bild erscheint und Ausschalten zwischen jedem der drei Bilder zu blinken. Die Menge an zu blinken ist ein Auslesen der Modulationskontrast des sinusförmigen Beleuchtungsmuster.
- Drehen Sie die Polarisation des Anregungslasers mit dem LCVR mit kundenspezifischer Software, um azimutale Polarisation zu erreichen und damit die höchste Modulationskontrast für das gegebene Muster Orientierung.
- Laden Sie die LCVR Kalibrierungssoftware.
- Geben Sie 0 und 8 für die Mindest- und Höchstspannung sind.
- Klicken Sie auf "Sweep LCVR Spannung", um die Polarisation drehen.
Hinweis: Die LCVR Retardierung eine Funktion der Temperatur ist und von Tag zu Tag driften kann sogar mit Temperaturregelung. In diesem Schritt wird eine optimale azimutale Polarisations empirisch durch Sweepi gefundenng die angelegte Spannung zwischen seiner minimalen und maximalen Spannung, die die Wirkung der Drehung der Polarisation einfall an der Probe aufweist. Der Modulationskontrast für jede Spannung 25 und der Spannung berechnet, die Spitzenkontrast erzielt in den folgenden Schritten verwendet wird. - Warten Sie auf den Kalibrierungsprozess zu vervollständigen, und notieren Sie die gemessene Spannung nach unten.
- Wiederholen Sie diese Kalibrierungsprozess für die verbleibenden zwei Muster Orientierungen (60 ° und 120 °), und jede der Anregungswellenlängen.
- Synchronisieren Sie die Kamera die Belichtung mit dem LCVR, Laser, Emissionsfilter Rad und Piezo - Z-Stufe 26. Um dies zu erreichen, eine Hochgeschwindigkeits - Datenerfassung verwenden (DAQ) Platte als Master - Taktquelle für das System, und verwenden Sie die SLM - LED Ausgangssignal aktivieren den Laser zu modulieren (siehe 3B).
Hinweis: Die spezifische Implementierung auf den Komponenten abhängt verwendet, aber die Verwendung einer High-Speed-Messkarte für die digitale trigger Synchronisation und Steuerung des LCVR eine analoge Spannung verwendet, über Software gesteuert wird, wird empfohlen. Die Steuerungssoftware in diesem Protokoll verwendet wird, ist auf Anfrage erhältlich. - Durch axiale chromatische Aberration für jede Wellenlänge, gelten auch eine z-Offset auf den Probentisch.
- Bestimme die experimentell Offset von der ersten Wellenlänge auf einer Mehrfarben bead einschichtigen Probenfokussierung (z. B. 488 nm) , dann mit dem zweiten Schalt (z. B. 640 nm). Die Perlen werden nun unscharf sein.
- Refocus die Perlen und messen Sie die Änderung in z-Position, die erforderlich war. Dieser Offset kann dann jedes Mal an das piezo z-Stufe angewendet werden, die Anregungswellenlänge verändert.
- Mit der SLM Steuerungssoftware, schalten Sie den SLM Running Order auf die volle Serie von 9 binären Gitterbilder erforderlich für TIRF-SIM. Dies ist Running Order 0 im Beispiel Repertoire.
- Mit Hilfe der Kamera-Software erwerben 9 Bilder von der Perle Probe.
- In der "Sequenz" Fensterbereich der Kamera-Software, wählen Sie "Hard Disk Record" als Scan-Typ, und die Zählung Rahmen bis 9 ändern.
- Klicken Sie auf "Start", um Bilder zu erwerben.
- Speichern Sie die aufgenommenen Bilder als TIFF-Dateien von "TIFF" als Bildtyp in der "Save gepufferte Bilder" Fenster auswählen und auf OK klicken.
- Rekonstruieren einer Super-Resolution-Bild aus den rohen TIFF-Bilder mit kommerziellen oder kundenspezifische Software, die Verbesserung der Auflösung gegenüber Standard-TIRF zu validieren.
Hinweis: Für unser Mikroskop erzeugen wir durch gezielte Rekonstruktion Code sowohl im Haus und von Dr. Lin Shao 27 entwickelt.
Ergebnisse
Multicolor 100 nm Durchmesser wurden fluoreszierende Kügelchen abgebildeten Standard TIRF TIRF-SIM zu vergleichen und die erreichbare Verbesserung der lateralen Auflösung (4A - B) zu quantifizieren. Die Rekonstruktion der Roh - Frames in Super-Resolution - Bilder wurde unter Verwendung von Standardalgorithmen durchgeführt , wie in der Literatur 27,28 skizziert. Es ist ersichtlich, dass TIRF-SIM hat eindeutig signifikant höhere laterale Auflösung im Vergleich zu TIRF. Die Punktbildfunktion (PSF) eines Mikroskops ist gut mit dem Bild eines einzelnen Unterbeugungs Größe fluoreszierende Perle angenähert, damit die PSF und die Auflösung kann durch Anbringen 2D-Gauß-Funktionen auf einzelne Perlen für jede Wellenlänge quantifiziert werden. Die geschätzte Auflösung des Mikroskops auf dem Mittelwert der Halbwertsbreite basiert (FWHM) beträgt 89 nm und 116 nm für 488 und 640 nm TIRF-SIM bzw. (4C). Dies entspricht einer zweifachen improserung in laterale Auflösung für beide Wellenlängen auf die theoretische beugungsbegrenzten Fall verglichen. Fluoreszenzmarkierte Amyloidfibrillen sind auch eine ausgezeichnete Testprobe für doppelte Auflösung (4D) zu demonstrieren. Amyloidfibrillen wurden in vitro durch Inkubation β-Amyloid , markiert mit 10% Rhodamin - Derivat - Farbstoffe (488 nm Anregung) für 1 Woche und anschließend Bildgebung mit TIRF-SIM gebildet. Siehe 12 für weitere Informationen verweisen.
Subzellulärer Strukturen mit hohem Kontrast wie emGFP markierte Mikrotubuli (5B, G) oder LifeAct-GFP (5D) sind ideal für TIRF-SIM - Bildgebung und ergeben einen hohen Kontrast superauflösende Bilder. TIRF-SIM-Bildgebung das Setup detailliert in diesem Protokoll ermöglicht die Beobachtung einer Subpopulation von Mikrotubuli befindet sich in der Nähe der basalen Zellkortex mit und Mikrotubuli-Polymerisation und Depolymerisation kann be gesehen im Laufe der Zeit (Animierte Abbildung 1). Nicht alle Proben sind zugänglich mit TIRF-SIM-Karte auf die Abbildung, insbesondere mit geringem Kontrast Proben ohne diskrete Strukturen. Zellen cytosolischen GFP fehlt beiseite Hochauflösungsinformationen exprimierenden von an den Rändern der Plasmamembran (5F, H und animierte Figur 2) und daher suboptimal sind für TIRF-SIM - Bildgebung wie die resultierenden Rekonstruktionen im wesentlichen TIRF Bilder mit Artefakte überlagert sind. In solchen Proben kann oft die Zunahme im Gegensatz zu dem Entfaltungsschritt des Rekonstruktionsalgorithmus zurückgeführt werden.
Hohe Modulationskontrast ist von wesentlicher Bedeutung für eine erfolgreiche SIM-Bildgebung. Die Fourier des rekonstruierten Bildes Transformation ermöglicht die Visualisierung der SIM optischen Übertragungsfunktion (OTF) (6A, Einschub). Ohne die Modulationskontrast für jede Orientierung zu maximieren durch Azimut polar sichergestelltModulation der Hochauflösungsinformation in der Probe führt zu einem niedrigen Signal-Rausch-Verhältnis in den SIM Durchlaßbänder isierung mit einem Polarisationsdreher, es sehr wenig. Rekonstruktionsalgorithmen , die den Standard Wiener - Filter - Ansatz verwenden , wird einfach das Rauschen in den SIM - Durchlaßbänder verstärken und ein Bild ergeben , das im Wesentlichen ein Standard TIRF Bild mit hexagonal überlagert (oder "Honigwabe") Ringing - Artefakten (6A, rechts). Eine mögliche Verbesserung könnte die Verwendung von iterativen 29,30 oder Blindrekonstruktionsalgorithmen 31,32 , um diese Artefakte zu reduzieren , die auf der Art der Probe abhängig. Wir empfehlen die Verwendung des ImageJ SimCheck Plugin die Qualität der SIM - Daten zu überprüfen , bevor und nach dem Umbau 33.
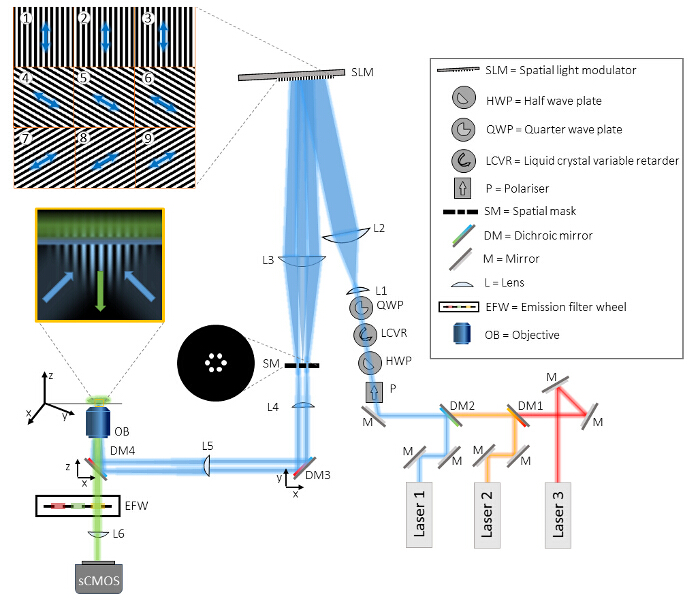
Abb . 1: Aufbau des Multicolor-TIRF SIM - Setup Das TIRF-SIM mikop besteht aus drei Hauptteilen, die Strahlerzeugungseinheit, die Musterprojektionseinheit und die Detektionseinheit. In der Strahlerzeugungseinheit werden drei verschiedene Laser auf dem gleichen Strahlengang durch dichroitische Spiegel (DM1 und DM2) ausgerichtet ist und durch vier optische Elemente zur Polarisationssteuerung gerichtet. Zuerst wird ein Polarisator (P) gewährleistet, um die Reinheit des linearen Polarisationszustand von jedem der Laserstrahlen. Die folgenden drei optische Elemente benötigt, um die Polarisation in einem schnellen, automatisierten Weise zu drehen, wie im Detail im Text beschrieben. Danach zwei Linsen (L1 und L2) in einem Teleskop-Konfiguration den Strahl erweitern, um die aktive Fläche des räumlichen Lichtmodulator (SLM) zu entsprechen und sind in drei Teilstrahlen gebeugt durch die projizierten SLM binären Gitterstrukturen (Beispiele sind in Kacheln dargestellt 1- 9). Der Polarisationszustand des Beleuchtungslichts relativ zu dem SLM Muster wird als Pfeil dargestellt ist. Ein zweites Teleskop (L3 und L4) de-preist die Größe des Musters und bietet Zugang zu the Fourier-Ebene des SLM Muster. In dieser Ebene eine räumliche Maske (SM) wird verwendet, um die zentrale Komponente und andere unerwünschte Beugungskomponenten von dem pixelierten Struktur des SLM und die interne Verdrahtung auszufiltern. Bevor die beiden verbleibenden Strahlen auf der hinteren Brennebene des Objektivs (OB) über die Kondensorlinse (L5), zwei dichroitische Spiegel (DM3 und DM4) fokussiert werden, werden in der Einrichtung enthalten. DM4 wirkt als herkömmliche von Emissionslicht zu trennen Beleuchtung in der Fluoreszenzmikroskopie dichroitische Spiegel. Jedoch bewirkt dieser Spiegel unvermeidbar Elliptizität des Polarisationszustandes des Beleuchtungslichtes, das durch DM3, einen dichroitischen Spiegel vom Idealfall der gleichen Charge wie DM4 kompensiert werden kann. Das Eintauchen in Öl TIRF Ziel hat eine ausreichend große NA direkt auf das Deckglas zwei gegenläufigen Wellen zu starten, die vollständig und führen zu einer strukturierten abklingende Feld in das Deckglas reflektiert werden. Die Probe wird auf einem xyz-Translationsstufe montiert. Die Erkennung ist perfORMED durch das gleiche Ziel und DM4 in Übertragung, sowie eine zusätzliche Filterung durch Bandpaß-Emissionsfilter, montiert in einem computergesteuerten Filterrad (EFW). Schließlich wird das Bild auf eine sCMOS projiziert Kamera durch das interne Mikroskoptubus Linse (L6). Bitte hier klicken , um eine größere Version dieser Figur zu sehen.

Fig . 2: Alignment von überlappenden Strahlen (A) Ein SLM Gittermuster mit einer kreisförmigen Öffnung gefenstert ist nützlich für die Ausrichtung. Wenn zwei nicht überlappenden Strahlen auf der Kamera (links) sichtbar sind, dann die Position der Probenebene muss durch iteratives Einstellen der axialen Position der Objektivlinse und der Kamera positioniert werden, um einen einzelnen kreisförmigen Beleuchtungsfleck zu geben (rechts). Die Träger müssen in orde überlappenr den sinusförmigen Erregungsmuster für TIRF-SIM erforderlich zu produzieren. Wenn die Strahlen nicht vollständig überlappen, reduziert dies das Sichtfeld über die das Interferenzmuster gebildet wird. (B und C) Die genaue Einfallswinkel der Strahlen ist wichtig für die TIRF-SIM. Wenn der Winkel nicht korrekt ist, einer der Strahlen wird nicht auf dem erforderlichen Winkel für TIRF sein, und dies ist leicht sichtbar, wenn eine Fluoreszenzfarbstofflösung Bildgebung. Ein Strahl hat einen Einfallswinkel größer als der kritische Winkel, der der kreisförmigen Fleck liefert und die andere nicht, die auf der linken Seite des Bildes in (B) zu dem hellen Streifen führt. (D) Einstellen des Winkels des Spiegels DM3 sorgt bei beiden Strahlen fallen im gleichen Winkel, und dies kann durch Defokussieren des Ziels validiert werden: wenn sie richtig ausgerichtet sind , die XZ - Projektion eines z Stapel von einem fluoreszierenden Farbstoff Probe zeigen sollten zwei symmetrisch sich kreuz Strahlen mit vernachlässigbarer Hintergrund bei derkonzentrieren. Bitte hier klicken , um eine größere Version dieser Figur zu sehen.
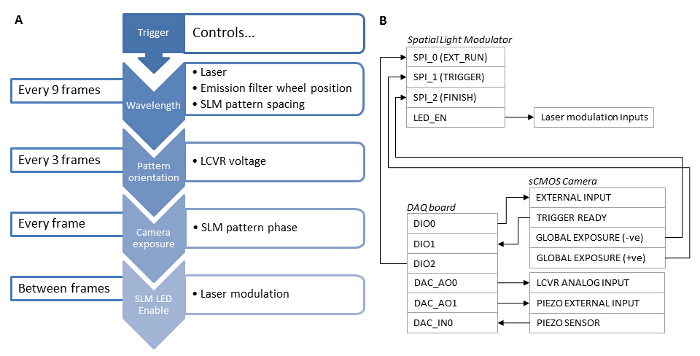
Abbildung 3:. Synchronization Abhängigkeiten der verschiedenen Systemkomponenten (A) Für eine schnelle SIM Akquisition Synchronisation der Systemkomponenten eine Hardware - basierte Lösung mit unabdingbar. (B) Ein Datenerfassungskarte (DAQ) sollte als Master - Trigger verwendet werden. Ein TTL-Signal von der Messkarte ist mit dem sCMOS External Input und verwendet geschickt, um die Belichtung der Kamera auszulösen. Die Kamera Globale Belichtungs Ausgang löst dann die SLM ein Gittermuster angezeigt werden, und die SLM-LED-Freigabeausgang digital verwendet wird, um die Laseranregung modulieren, dass der Laser nur emittiert, wenn die SLM-Pixel in der "Ein" -Zustand sind. Nach der Belichtung ist complete, die Kamera Globale Belichtungsausgang wird verwendet, um auf die nächste Gitterphase oder der Winkel des SLM Muster vorzurücken. Der DAQ-Board gibt auch eine analoge Spannung an den LCVR Steuerung den linearen Polarisationszustand des Beleuchtungsstrahls zu steuern. Diese Spannung wird nach dem Erwerb der 3 Phasenbilder für jedes Muster Winkel umgeschaltet. Nach dem Erwerb von 9 Bildern für eine einzelne Wellenlänge, gibt der Messkarte ein Signal an den Emissionsfilter Radregler und schaltet auf die nächste Wellenlänge. Die Messkarte gilt auch für eine z-Offset auf die Probe durch eine analoge Spannung an die Steuerung z-Stufe Piezo ausgibt. Bitte hier klicken , um eine größere Version dieser Figur zu sehen.
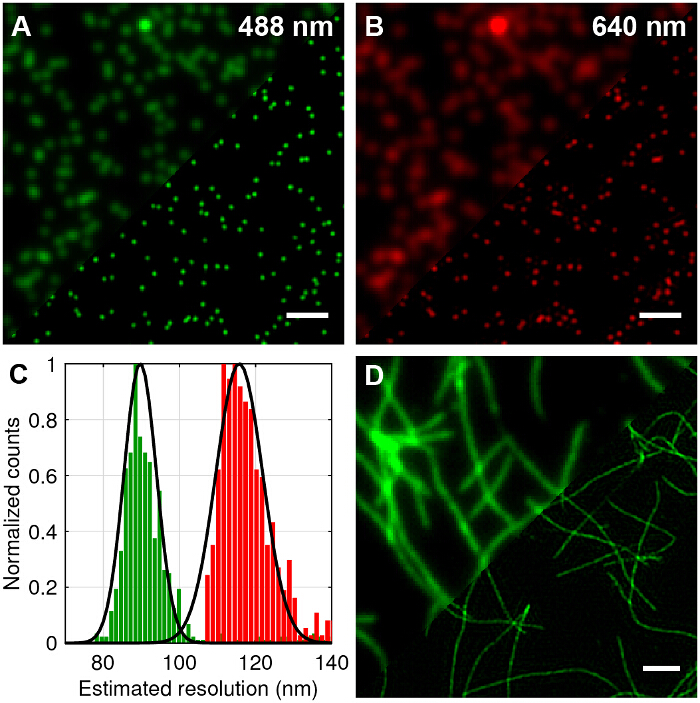
Abbildung 4: TIRF-SIM - Imaging von Testproben von 100 nm Multicolor Perlen und fluoreszenz Labelled Amyloidfibrillen. (A und B) Vergleich von Standard - TIRF im Vergleich zu TIRF-SIM - Rekonstruktionen für 488 nm und 640 nm Anregung. (C) Histogramm von voller Breite Halbmaximum (FWHM) der Gaußschen passt zu den TIRF-SIM - Perlen die erwartete Verbesserung der Auflösung zeigt. (D) TIRF gegen TIRF-SIM von β-Amyloid - Fibrillen mit 10% Rhodamin - Derivat - Farbstoff markiert (488 nm Anregung). Maßstabsbalken = 1 um. Bitte klicken Sie hier , um eine größere Version dieser Figur zu sehen.
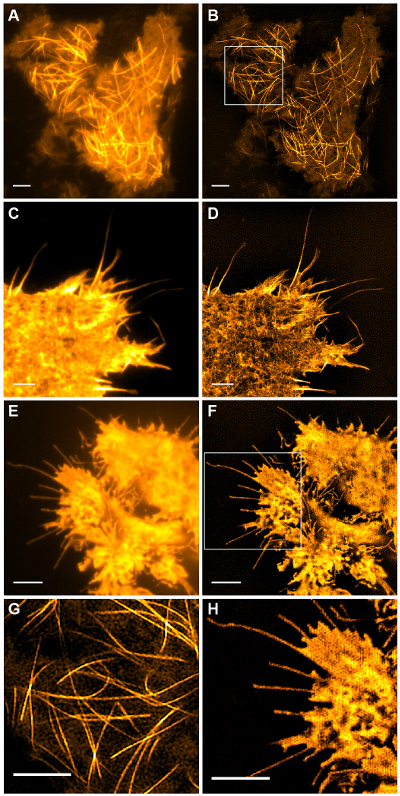
Abb . 5: Live Cell TIRF-SIM Imaging Vergleich konventioneller und TIRF TIRF-SIM Bilder (A, B) Mikrotubuli (emGFP-Tubulin) in eine HEK293 - Zelle, (C, D ) filamentösen Aktin (LifeAct-GFP) in einer COS-7 - Zelle und (E, F) cytosolischen GFP in einer HEK293 - Zelle. Bilder in B und F sind einzelne Zeitpunkte aus den Filmen. Boxed Bereiche werden in (G, H) vergrößert. Maßstabsbalken = 3 & mgr; m. Bitte klicken Sie hier , um eine größere Version dieser Figur zu sehen.
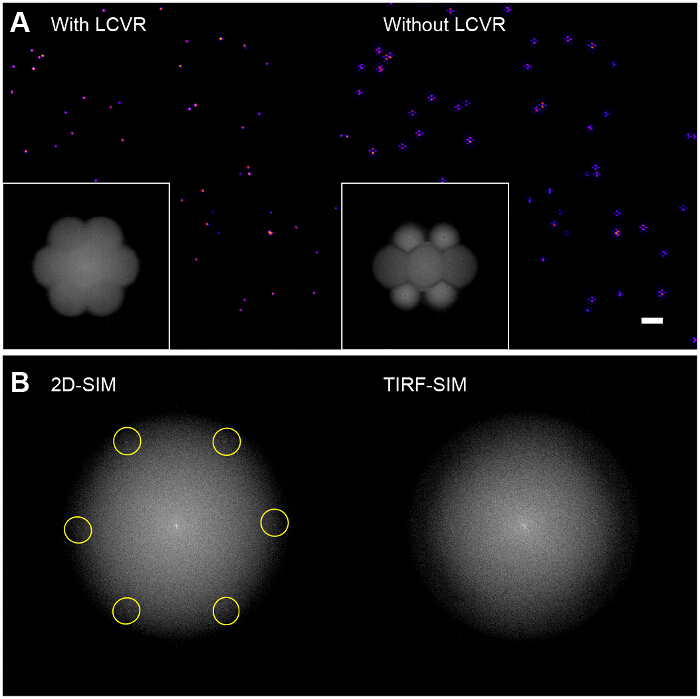
Abb . 6: Einfluss der Polarisationsdreher auf Reconstructed Bead Bilder (A) , ohne die Verwendung eines Polarisationsdreher, wie einem LCVR, das Signal-Rausch - Verhältnis in den SIM Durchlaßbänder niedrig ist, die in charakteristischen hexagonal Artefakte in dem rekonstruierten SIM Ergebnisse Bilder (rechts), (B) in 2D-SIM sind die strukturierten Beleuchtungsmuster direkt sichtbar in der FourierTransformation der Rohbilder (links, Anregung Raumfrequenz markiert), da sie innerhalb des Radius der Emission OTF Unterstützung fallen, jedoch in TIRF-SIM, sie sind außerhalb der OTF Unterstützung und somit nicht sichtbar (rechts). In diesem Fall muss das Muster Modulationskontrast mit einer spärlichen Perle einschichtigen beurteilt werden, wie im Protokoll beschrieben. Bitte klicken Sie hier , um eine größere Version dieser Figur zu sehen.
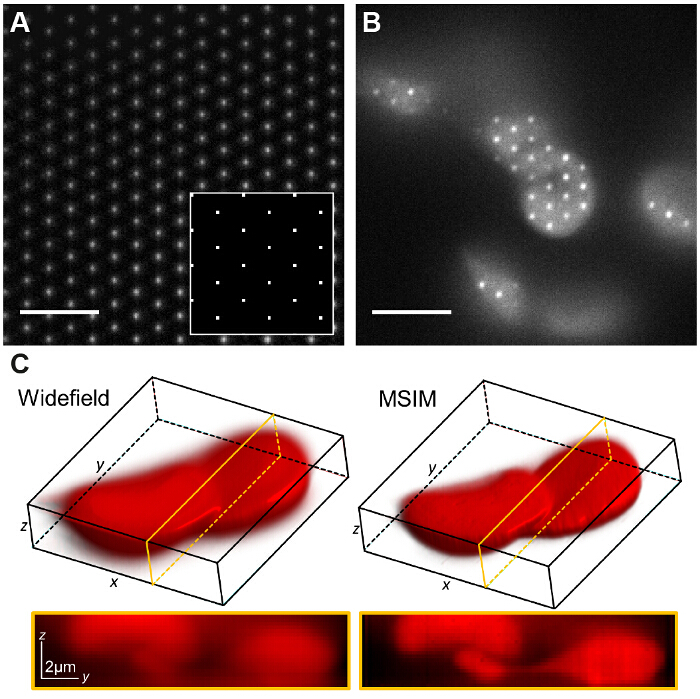
Abbildung 7:. Spatial Light Modulator Basierend Pattern Generation ermöglicht die Implementierung von anderen Bildgebungsverfahren wie die multifokale SIM (A) In MSIM, ein Gitter aus quadratischen pointsdisplayed auf dem SLM (kleines Bild) ergibt ein Gitter von beugungsbegrenzten Brennpunkte auf der Bildebene. Eine dünne Schicht mit niedriger Konzentration Rhodamin 6G auf visua abgebildet Lize die Brennpunkte. Das Muster wird über die Probe (B) und die erworbene Rohbild z-Stack wird rekonstruiert übersetzt ein Bild zu erzeugen mit Out-of-Focus - Licht (C) reduziert. Maßstabsbalken = 5 & mgr; m. Bitte klicken Sie hier , um eine größere Version dieser Figur zu sehen.
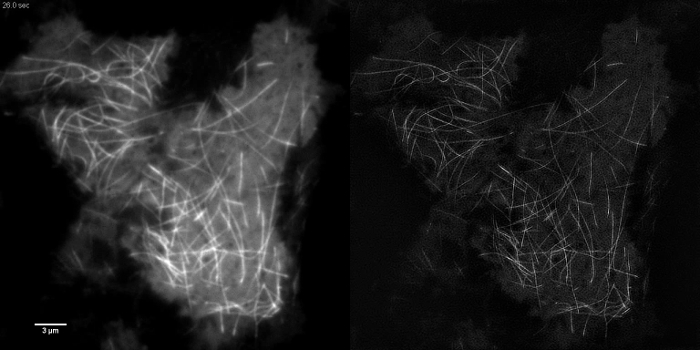
Animierte Abbildung 1:. Time Series Film von EmGFP-Tubulin in einer HEK293 Zellen eine schnelle Polymerisation und Depolymerisation von emGFP markierten Mikrotubuli beobachtet werden kann TIRF-SIM verwenden. Bilder mit 50 ms Belichtungszeit pro rohen Rahmen (450 ms pro SIM-Rahmen) in Intervallen von 0,5 Sekunden Abstand erworben. Belichtungszeit verwendet wurde, durch die Helligkeit des Fluorophors, nicht durch die Geschwindigkeit der Kamera oder SLM beschränkt. 3988movie1.mov "target =" _ blank "> Bitte hier klicken, um dieses Video anzusehen.
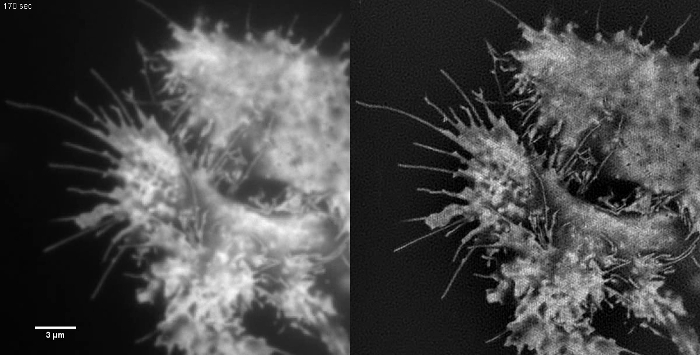
Animierte Abbildung 2:. Time Series Film von Cytosolic GFP in einer HEK293 von Zellproben mit geringem Kontrast wie diese sind nicht ideal Proben für die TIRF-SIM - Bildgebung. Retrograden Membranfluss in den TIRF-Bilder zu sehen, aber TIRF-SIM liefert keine zusätzliche Information außer an den Zellenrändern. TIRF-SIM - Bilder wurden mit 50 ms Belichtungszeit pro rohen Rahmen (450 ms pro SIM - Rahmen) erworben in Abständen von 5 sec. Bitte hier klicken , um dieses Video anzusehen.
Ergänzenden Code Datei: Beispiel SLM Repertoire - Datei (48449_300us_1-bit_Balanced.seq3).d / 53988 / 48449_300us_1-bit_Balanced.seq3 "> Bitte hier klicken, um diese Datei herunterzuladen.
Ergänzenden Code Datei:. Beispiel SLM Repertoire - Datei (period9_001.bmp) Bitte hier klicken , um diese Datei herunterzuladen.
Ergänzenden Code Datei:. Beispiel SLM Repertoire - Datei (period9_002.bmp) Bitte hier klicken , um diese Datei herunterzuladen.
Ergänzenden Code Datei:. Beispiel SLM Repertoire - Datei (period9_003.bmp) Bitte hier klicken , um diese Datei herunterzuladen.
Ergänzenden Code Datei: Beispiel SLM repertoiRe - Datei (period9_004.bmp). Bitte hier klicken , um diese Datei herunterzuladen.
Ergänzenden Code Datei:. Beispiel SLM Repertoire - Datei (period9_005.bmp) Bitte hier klicken , um diese Datei herunterzuladen.
Ergänzenden Code Datei:. Beispiel SLM Repertoire - Datei (period9_006.bmp) Bitte hier klicken , um diese Datei herunterzuladen.
Ergänzenden Code Datei:. Beispiel SLM Repertoire - Datei (period9_007.bmp) Bitte hier klicken , um diese Datei herunterzuladen.
Ergänzenden Code Datei:. Beispiel SLM Repertoire - Datei (period9_008.bmp) Bitte hier klicken , um diese Datei herunterzuladen.
Ergänzenden Code Datei:. Beispiel SLM Repertoire - Datei (period9_009.bmp) Bitte hier klicken , um diese Datei herunterzuladen.
Ergänzenden Code Datei:. Beispiel SLM Repertoire - Datei (period9_mask_1.bmp) Bitte hier klicken , um diese Datei herunterzuladen.
Ergänzenden Code Datei:. Beispiel SLM Repertoire - Datei (period9_mask_2.bmp) Bitte hier klicken , um diese Datei herunterzuladen. >
Ergänzenden Code Datei:. Beispiel SLM Repertoire - Datei (period9_mask_3.bmp) Bitte hier klicken , um diese Datei herunterzuladen.
Ergänzenden Code Datei:. Beispiel SLM Repertoire - Datei (TIRF-SIM_example.rep) Bitte hier klicken , um diese Datei herunterzuladen.
Ergänzenden Code Datei:. Beispiel Gittergenerierungscode (1 von 2) (generate_gratings.m) Bitte hier klicken , um diese Datei herunterzuladen.
Ergänzenden Code Datei: Beispiel Gittergenerierungscode (2 von 2) (circular_mask.m).= "Https://www.jove.com/files/ftp_upload/53988/circular_mask.m"> Bitte hier klicken, um diese Datei herunterzuladen.
Ergänzenden Code Datei:. Beispiel - Code - Modulation Kontrast (calculate_contrast.m) zu berechnen Bitte hier klicken , um diese Datei herunterzuladen.
Diskussion
Maßgeschneiderte TIRF-SIM-Systeme wie das detaillierte Setup in diesem Protokoll sind in der Lage mehrfarbige superauflösende Bildgebung mit hoher Geschwindigkeit im Vergleich zu handelsüblichen Mikroskope. Der inhärente Vorteil der SIM als Superauflösungstechnik besteht darin, dass die zeitliche Auflösung nicht durch die Photophysik des Fluorophors im Vergleich zu anderen Verfahren, wie beispielsweise Einzelmoleküllokalisierungsmikroskopie (SMLM) oder Punktscanverfahren wie stimulierte Emission Depletion Mikroskopie beschränkt ( STED). Im Gegensatz zu diesen anderen Techniken SIM benötigt keine photoschaltbarer oder abnutzbaren Fluorophore so mehrfarbige Bildgebung einfach ist. Non TIRF-SIM-Systeme, wie beispielsweise optische SIM und multifokale SIM sectioning kann üblicherweise Auflösung Verbesserungen von 1,7-fache oder weniger in der Praxis zu erzielen, als mit dem Faktor 2 Verbesserung gegen hier berichtet wird, und kommerzielle Systeme sind auch oft langsamer und weniger flexibel als das System in diesem Protokoll dargestellt.
"> Die beiden Hauptprobleme bei dieser Technik die Umsetzung sind zum einen die Notwendigkeit für eine präzise Positionierung der sechs SIM Strahlen innerhalb des TIR Zone der hinteren Apertur das Ziel, die eine mühsame und zeitraubende optische Ausrichtungsprozedur erfordert. Zweitens, um hohe Musterkontrast erzeugen in der Probe ist Polarisationsdrehung wesentlich. für niedrige NA 2D-SIM - Systemen Polarisationsdrehung durch sorgfältige Auswahl der linearen Polarisationsrichtung kann vermieden werden, aber dies wird unmöglich für TIRF-SIM 25. für Hochgeschwindigkeits - Mehrfarben - Abbildungs, elektro optische Polarisationssteuerung ist notwendig, und dies erhöht die Komplexität und die Kosten des Systems.Einschränkungen der Technik
TIRF-SIM, wie herkömmliche TIRF wird natürlich Beobachtung biologischer Strukturen und Prozesse an der basalen Zellmembran beschränkt, die von der 150-200 nm Eindringtiefe des evaneszenten Feldes beleuchtet werden kann. WährendSIM wird oft als weniger Schädigungs als entweder STED an Zellen notiert oder SMLM, immer noch laterale Auflösung Verdoppelung der erforderlichen Anzahl von Photonen , die von mindestens 4-fach - 5 im Vergleich zu herkömmlichen TIRF - Mikroskopie erhöhen. Für die Bildgebung bei hohen Bildraten mit kurzen Belichtungszeiten, diese Photonen-Anstieg erfordert die Verwendung erhöhter Beleuchtungsintensitäten. Während jedes Fluorophor für die SIM-Bildgebung von festen oder sich langsam bewegenden Proben verwendet werden kann, hohe Helligkeit fluoreszierende Proteine oder der nächsten Generation synthetischer Farbstoffe mit verbesserter Lichtstabilität sind für Live Cell Imaging empfohlen.
Obwohl diese Implementierung der Bebilderung einer einzigen Farbe bei SIM Bildraten von über 20 Hz, Mehrfarben- Abbildungs im vorliegenden System in der Lage ist, durch die Schaltzeit des motorisierten Emissions Filterrad begrenzt. Aufgrund der Größe des sCMOS Kamerachip, wäre die Verwendung eines Multiband-Emissionsfilter und Bildteileroptik möglich und gleichzeitige i ermöglichenMaging mit mehreren Wellenlängen ohne Geschwindigkeitsverlust. Eine andere Möglichkeit wäre es, die verschiedenen Anregungslaser abzuwechseln und ein Multiband-Sperrfilter verwenden, um das Anregungslicht abzuweisen. Die Verwendung eines ferroelektrischen binären SLM in dieser Implementierung ist auch nicht optimal. Der Beugungswirkungsgrad eines solchen SLM ist sehr gering, so dass die meisten der einfallenden Licht in der Reflexion nullter Ordnung ist, die durch die räumliche Maske herausgefiltert wird. Für Anwendungen, die sehr hohe Bildraten wird die Bilderzeugungsgeschwindigkeit daher durch die Ausgangsleistung der Laserdioden beschränkt. Der SLM führt auch einige Elliptizität der Polarisation für Wellenlängen von 550 nm Wellenlänge Design entfernt, wo die Pixel arbeiten nicht als ideal Halbwellenplatten. Obwohl dies durch Verwendung eines zusätzlichen LCVR kompensiert werden kann, kann die ideale Lösung ist die Verwendung einer digitalen Mikrospiegelvorrichtung (DMD) als Mustergenerator sein.
Mögliche Änderungen
Das Setup-Presented hier ist flexibel und leicht modifiziert als kommerzielle Instrumente , so dass andere Bildgebungsverfahren wie 3D-SIM, schnelle 2D-SIM, multifokale SIM (MSIM) und nichtlineare SIM (NL-SIM) 21,34,35 umgesetzt werden können.
2D-SIM kann zum Abbilden relativ flach gut geeignet sein, schnell Strukturen wie der periphere endoplasmatische Retikulum bewegt. Die periphere ER liegt tiefer innerhalb der Zelle, als man mit einem TIRF abklingende Feld beleuchtet werden, aber aufgrund seiner flachen Struktur kann unter Verwendung von Standard-2D-SIM mit vernachlässigbarer out-of-Focus Hintergrund abgebildet werden. Zusätzlich zu der Verwendung von verbesserten optischen Schneidens Rekonstruktionsalgorithmen unterdrücken out-of-Fokus Licht die Verwendung von 2D-SIM erweitern , um optisch dicken Proben, wenn auch , wo die axiale Auflösung Verdoppelung nicht 21 erforderlich.
In MSIM wird die Probe durch eine sparse Gitter von Anregungs Foki 36 beleuchtet. Diese Modalität kann die räumliche Maske durch einfaches Entfernen implementiert werden (SM), Und es durch einen Polarisator zu ersetzen. Der SLM arbeitet nun als Amplitudenmodulator. Die binären SIM-Gitter auf dem SLM angezeigt werden, können durch ein 2D-Gitter von Punkten ersetzt werden, mit der Größe der zu sein, die gleich der Größe eines beugungsbegrenzten Fokus in der Bildebene gewählt Flecken. In 7A wird ein Gitter von 4 x 4 Pixel Quadrate wird auf dem SLM (Nebenbild) angezeigt , die , wenn angesichts der physischen SLM Pixelgröße von 13,62 & mgr; m verkleinert Beugungs auf die Probe begrenzt Foci von 150 x 150 nm erzeugt. Die Anregungs Foci kann dann durch Verschieben des Gittermusters auf dem SLM übersetzt werden, und dies mehrmals, um wiederholt das gesamte Sichtfeld zu beleuchten. Die Bilder werden für jede übersetzte Musterposition erworben und der Stapel nachbearbeitet ein rekonstruiertes Bild zu ergeben, mit einer verbesserten Auflösung von bis zu einem Faktor 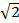 und reduzierte out-of-focus verglichen Licht auf die äquivalente Bild Weitfeld-30. Diese Modalität kann zur Abbildung dicken, dichten Proben , für die Standard - SIM ist nicht geeignet, zum Beispiel mit geringem Kontrast Strukturen wie gefärbten roten Blutkörperchen (7C) nützlich sein, obwohl die Erfassungszeit kann aufgrund der großen Anzahl von rohen Frames erhöht erforderlich je Sichtfeld (in diesem Fall N = 168).
und reduzierte out-of-focus verglichen Licht auf die äquivalente Bild Weitfeld-30. Diese Modalität kann zur Abbildung dicken, dichten Proben , für die Standard - SIM ist nicht geeignet, zum Beispiel mit geringem Kontrast Strukturen wie gefärbten roten Blutkörperchen (7C) nützlich sein, obwohl die Erfassungszeit kann aufgrund der großen Anzahl von rohen Frames erhöht erforderlich je Sichtfeld (in diesem Fall N = 168).
Schließlich kann die Einrichtung geändert werden , damit entweder qualitativ NA linear TIRF-SIM oder gemusterten Aktivierungsnichtlinearen SIM (PA NL-SIM), wie kürzlich von Li dargestellt et al., Unter Verwendung eines ultrahohen 1,7 NA - Objektiv oder Additions einer 405 nm Photoaktivierungs Laser und sorgfältige Optimierung der SLM Gittermuster 35.
Zukünftige Anwendungen
SIM ist immer noch ein sich schnell entwickelndes Technik und viele Anwendungen in den Lebenswissenschaften wird in Zukunft ermöglicht werden. Die Geschwindigkeit, Auflösung und Kontrast Verbesserungen der Technik und die Fähigkeit, unter Verwendung von Standard-Fluorophore mean, dass für Bioimaging, SIM eingestellt herkömmlichen viele Mikroskopsysteme, wie die konfokale und weites Feld Plattformen zu ersetzen. Kommerzielle SIM-Systeme sind bereits heute mit hervorragenden technischen Spezifikationen, sie aber über die finanziellen Möglichkeiten vieler Forschungslabors sind, und entscheidend ist, sind sie unflexibel modifiziert und die neuesten Entwicklungen in der Forschung auf dem Gebiet zur Umsetzung entwickelt werden. Es fehlt auch die wesentliche Fähigkeit zu "für das Experiment zur Hand angepasst werden ', die oft einen kritischen Engpass beim Schneiden von Science-Forschung Rand Leben. Das hier beschriebene System wird besonders gut geeignet , dynamische Prozesse in der Nähe der Zelloberfläche zu untersuchen, für in - vitro - Studien von rekonstituiertem bilayer Systeme, die Oberflächenchemie in den Materialien und physikalischen Wissenschaften zu untersuchen, beispielsweise. 2D Materialien und viele andere Anwendungen.
Offenlegungen
The authors have nothing to disclose.
Danksagungen
Diese Arbeit wurde durch Zuschüsse aus dem Leverhulme Trust unterstützt wurde, der Engineering and Physical Sciences Research Council [EP / H018301 / 1, EP / G037221 / 1]; Alzheimer Research UK [ARUK-EG2012A-1]; Wellcome Trust [089703 / Z / 09 / Z] und Medical Research Council [MR / K015850 / 1, MR / K02292X / 1]. Wir danken E. Avezov und M. Lu zur Transfektion der LifeAct-GFP und cytosolische-GFP-Zellen sind, und W. Chen zur Herstellung der HEK293 Kultur. Wir danken auch K. O'Holleran für die Unterstützung bei der Gestaltung des Mikroskops und L. Shao und R. Heintz für nützliche Diskussionen und Anregungen.
Materialien
| Name | Company | Catalog Number | Comments |
| 488 nm laser | Toptica | iBeam SMART | with digital modulation |
| 561 nm laser | Coherent | OBIS LS | with digital modulation |
| 640 nm laser | Cobolt | MLD | with digital modulation |
| Long-pass dichroic mirrors | Thorlabs | for combining excitation beams | |
| Quad band dichroic mirror | Chroma | ZT405/488/561/640rpc | 3 mm thick, TIRF imaging flat, mounted in Olympus BX filter cube |
| Quad band dichroic mirror | Chroma | ZT405/488/561/640rpc | From same batch as above, 25 x 25 mm |
| 1" square kinematic mount | Edmund Optics | 58-860 | |
| Glan-Taylor calcite polarizers | Thorlabs | GT5-A | For alignment of LCVR |
| Glan-Taylor mount | Thorlabs | SM05PM5 | |
| Achromatic half wave plate | Thorlabs | AHWP05M-600 | 400-800 nm |
| Rotation cage mount | Thorlabs | CRM1/M | For HWP |
| Liquid Crystal Variable Retarder | Meadowlark Optics | SWIFT | Custom built to provide full wave retardance over the range 488 to 640 nm. |
| LCVR controller | Meadowlark Optics | D3060HV | Two channel high voltage controller for liquid crystal retarders |
| Achromatic quarter wave plate | Meadowlark Optics | AQM-100-0545 | |
| Rotation cage mount | Thorlabs | CRM1P/M | For QWP |
| 10 mm achromatic doublet | Thorlabs | AC080-010-A-ML | For beam expander |
| 200 mm achromatic doublet | Thorlabs | AC254-200-A-ML | For beam expander |
| Cage XY Translators | Thorlabs | CXY1 | |
| Ferroelectric spatial light modulator | Forth Dimension Displays | M0787-00249 | SXGA-3DM (IFF) Microdisplay Type M249, 1,280 x 1,024 pixels, with driver board |
| SLM mounting frame | Forth Dimension Displays | M0787-10014 | Fixed to custom built aluminium mount |
| Ø50.8 mm Gimbal Mirror Mount | Thorlabs | GM200/M | For SLM mounting |
| Two-Axis Linear Translation Stage with Rotating Platform | Thorlabs | XYR1/M | For SLM mounting |
| Rail carrier | Newport | M-PRC-3 | For SLM mounting |
| Precision Optical Rail | Newport | PRL-6 | For SLM mounting |
| 300 mm achromatic doublet lens | Qioptiq | G322 273 322 | f = 300 mm, 31.5 mm diameter |
| 140 mm achromatic doublet lens | Qioptiq | G322 239 322 | f = 140 mm, 31.5 mm diameter |
| Precision XY Translation Mounts | Thorlabs | LM2XY | |
| Lens Mounting Adapters | Thorlabs | SM2AD32 | For mounting 31.5 mm lenses in 2" mounts |
| Translation stages | Comar | 12XT65 | Dovetail, side drive |
| XY Translator with Differential Drives | Thorlabs | ST1XY-D/M | for spatial filter |
| Rotation cage mount | Thorlabs | CRM1/M | for spatial filter |
| 300 mm achromatic doublet | Thorlabs | AC508-300-A-ML | Excitation tube lens |
| Automated XY stage with Z-piezo top plate | ASI | PZ-2150-XYFT-PZ-IX71 | with MS-2000 controller |
| Inverted microscope frame | Olympus | IX-71 | |
| Objective lens | Olympus | UAPON100XOTIRF | 100X/1.49NA |
| High speed filter wheel | Prior Scientific | HF110A | with Prior ProScan III controller |
| Bandpass emission filters | Semrock | FF01-525/30, FF01-676/29 | |
| sCMOS camera | Hamamatsu | ORCA Flash v4.0 | |
| Stage top incubator | OKO Lab | H301-K-FRAME | For live cell imaging, with Bold Line temperature and CO2 controllers |
| Stainless steel optical posts | Thorlabs | TR series | for mounting optical components |
| Post holders | Thorlabs | PH series | for mounting optical components |
| Kinematic mirror mounts | Thorlabs | KM100 | for mounting 1" mirrors |
| Shearing interferometer | Thorlabs | SI100 | |
| 100 nm fluorescent microspheres | Life Technologies | T-7279 | Tetraspeck |
| Rhodamine 6G | Sigma Aldrich | 83697-250MG | |
| 8 well glass bottom dishes | ibidi | 80827 | with #1.5 coverglass |
| Nunc Lab-Tek II Chambered Coverglass | Thermo Fisher Scientific | 155409 | with #1.5 coverglass |
| 0.01 mm microscope reticle slide | EMS | 68039-22 | |
| CellLight Tubulin-GFP, BacMam 2.0 | Thermo Fisher Scientific | C10613 |
Referenzen
- Heintzmann, R., Cremer, C. G. Laterally modulated excitation microscopy: improvement of resolution by using a diffraction grating. BiOS Eur. 3568, 185-196 (1999).
- Gustafsson, M. G. L. Surpassing the lateral resolution limit by a factor of two using structured illumination microscopy. J. Microsc. 198 (2), 82-87 (2000).
- Shim, S. H., et al. Super-resolution fluorescence imaging of organelles in live cells with photoswitchable membrane probes. Proc. Natl. Acad. Sci. U. S. A. 109 (35), 13978-13983 (2012).
- Urban, N. T., Willig, K. I., Hell, S. W., Nägerl, U. V. STED Nanoscopy of Actin Dynamics in Synapses Deep Inside Living Brain Slices. Biophys. J. 101 (5), 1277-1284 (2011).
- Liu, Z., Lavis, L. D., Betzig, E. Imaging Live-Cell Dynamics and Structure at the Single-Molecule Level. Mol. Cell. 58 (4), 644-659 (2015).
- Westphal, V., et al. Video-Rate Far-Field Optical Nanoscopy Dissects Synaptic Vesicle Movement. Science. 320 (5873), 246-249 (2008).
- Davies, T., et al. CYK4 Promotes Antiparallel Microtubule Bundling by Optimizing MKLP1 Neck Conformation. PLOS Biol. 13 (4), e1002121 (2015).
- Laine, R. F., et al. Structural analysis of herpes simplex virus by optical super-resolution imaging. Nat. Commun. 6, 5980 (2015).
- Pinotsi, D., et al. Direct observation of heterogeneous amyloid fibril growth kinetics via two-color super-resolution microscopy. Nano Lett. 14 (1), 339-345 (2014).
- Esbjörner, E. K., et al. Direct observations of amyloid β Self-assembly in live cells provide insights into differences in the kinetics of Aβ(1-40) and Aβ(1-42) aggregation. Chem. Biol. 21 (6), 732-742 (2014).
- Michel, C. H., et al. Extracellular monomeric tau protein is sufficient to initiate the spread of tau protein pathology. J. Biol. Chem. 289 (2), 956-967 (2014).
- Pinotsi, D., Kaminski Schierle, G. S., Kaminski, C. F. Optical Super-Resolution Imaging of β-Amyloid Aggregation In Vitro and In Vivo: Method and Techniques. Syst. Biol. Alzheimer's Dis. SE - 6. 1303, 125-141 (2016).
- Axelrod, D. Cell-substrate contacts illuminated by total internal reflection fluorescence. J. Cell Biol. 89 (1), 141-145 (1981).
- Cragg, G. E., So, P. T. Lateral resolution enhancement with standing evanescent waves. Opt. Lett. 25 (1), 46-48 (2000).
- Chung, E., Kim, D., So, P. T. Extended resolution wide-field optical imaging: objective-launched standing-wave total internal reflection fluorescence microscopy. Opt. Lett. 31 (7), 945 (2006).
- Kner, P., Chhun, B. B., Griffis, E. R., Winoto, L., Gustafsson, M. G. L. Super-resolution video microscopy of live cells by structured illumination. Nat. Methods. 6 (5), 339-342 (2009).
- Fiolka, R., Shao, L., Rego, E. H., Davidson, M. W., Gustafsson, M. G. L. Time-lapse two-color 3D imaging of live cells with doubled resolution using structured illumination. Proc. Natl. Acad. Sci. U. S. A. 109 (14), 5311-5315 (2012).
- Brunstein, M., Wicker, K., Hérault, K., Heintzmann, R., Oheim, M. Full-field dual-color 100-nm super-resolution imaging reveals organization and dynamics of mitochondrial and ER networks. Opt. Express. 21 (22), 26162-26173 (2013).
- Förster, R., et al. Simple structured illumination microscope setup with high acquisition speed by using a spatial light modulator. Opt. Express. 22 (17), 20663 (2014).
- Lu-Walther, H. W., et al. fastSIM: a practical implementation of fast structured illumination microscopy. Methods Appl. Fluoresc. 3, 014001 (2015).
- Shaw, M., Zajiczek, L., O'Holleran, K. High speed structured illumination microscopy in optically thick samples. Methods. , (2015).
- von Olshausen, P. . Total internal reflection microscopy: super-resolution imaging of bacterial dynamics and dark field imaging. , (2012).
- Gustafsson, M. G. L., et al. Three-dimensional resolution doubling in wide-field fluorescence microscopy by structured illumination. Biophys. J. 94 (12), 4957-4970 (2008).
- Meadowlark Optics Inc. . Basic Polarization Techniques and Devices. , (2005).
- O'Holleran, K., Shaw, M. Polarization effects on contrast in structured illumination microscopy. Opt. Lett. 37 (22), 4603 (2012).
- Brankner, S. Z., Hobson, M. . Synchronization and Triggering with the ORCA-Flash4.0 Scientific CMOS Camera. , (2013).
- Gustafsson, M. G. L., et al. Three-dimensional resolution doubling in wide-field fluorescence microscopy by structured illumination. Biophys. J. 94 (12), 4957-4970 (2008).
- Wicker, K. Non-iterative determination of pattern phase in structured illumination microscopy using auto-correlations in Fourier space. Opt. Express. 21 (21), 24692 (2013).
- Boulanger, J., Pustelnik, N., Condat, L. Non-smooth convex optimization for an efficient reconstruction in structured illumination microscopy. 2014 IEEE 11th Int. Symp. Biomed. Imaging. 3 (1), 995-998 (2014).
- Ströhl, F., Kaminski, C. F. A joint Richardson-Lucy deconvolution algorithm for the reconstruction of multifocal structured illumination microscopy data. Methods Appl. Fluoresc. 3 (1), 014002 (2015).
- Mudry, E., et al. Structured illumination microscopy using unknown speckle patterns. Nat. Photonics. 6 (5), 312-315 (2012).
- Ayuk, R., et al. Structured illumination fluorescence microscopy with distorted excitations using a filtered blind-SIM algorithm. Opt. Lett. 38 (22), 4723 (2013).
- Ball, G., et al. SIMcheck: a Toolbox for Successful Super-resolution Structured Illumination Microscopy. Sci. Rep. 5, 15915 (2015).
- York, A. G., et al. Resolution doubling in live, multicellular organisms via multifocal structured illumination microscopy. Nat. Methods. 9 (7), 749-754 (2012).
- Li, D., et al. Extended-resolution structured illumination imaging of endocytic and cytoskeletal dynamics. Science. 349 (6251), (2015).
- York, A. G., et al. Resolution doubling in live, multicellular organisms via multifocal structured illumination microscopy. Nat. Methods. 9 (7), 749-754 (2012).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten