Method Article
複数の色で高速構造化照明TIRF顕微鏡のガイド
要約
This article provides an in depth guide for the assembly and operation of a structured illumination microscope operating with total internal reflection fluorescence illumination (TIRF-SIM) to image dynamic biological processes with optical super-resolution in multiple colors.
要約
構造化照明顕微鏡(SIM)と光学的に超解像イメージングは、化学および生物医学科学の分子レベルでのプロセスの可視化のためのキーテクノロジーです。商用SIMシステムが利用可能であるが、カスタム商用システムを上回ることができ、実験室で設計されているシステムでは、後者は、典型的には、イメージングの忠実度と速度の点で両方、使用および汎用アプリケーションを容易にするために設計されました。この記事では、全反射(TIR)照明を使用し、100nmでの到達分解能で3色で最大10 Hzで撮像が可能であるSIMシステムを構築するための綿密なガイドを提示します。 SIMとTIRFの組み合わせに、システムは、ライバルの技術よりも優れた画像コントラストを提供します。これらの仕様を達成するために、いくつかの光学要素は、すべての利用可能な励起WAVする照明光の偏光状態と空間構造上の自動制御を可能にするために使用されていますelengths。ハードウェア実装および制御の詳細は、励起光パターン生成、波長、偏光状態、および最大の取得フレームレートを達成することに重点を置いてカメラ制御との間の同期を達成するために与えられています。システムのアライメントおよびキャリブレーションのためのステップバイステップのプロトコルが提示され、達成可能な解像度の向上は、理想的な試験サンプルで検証されています。ビデオレートの超解像画像化する能力は、生きた細胞を用いて実証されています。
概要
最後の5年にわたり、超解像顕微鏡は成熟しており、生物学者の手に専門光学研究室から移動しました。商業用顕微鏡ソリューションは、光超解像を実現するための3つの主要なバリアントのために存在する:単一分子の局在顕微鏡(SMLM)、排出量の枯渇顕微鏡(STED)を刺激し、構造化照明顕微鏡(SIM)1,2。 SMLMは、光活性化ローカライゼーション顕微鏡(PALM)と確率的光学再構成顕微鏡(STORM)のような容易にダウンして20 nmまで、主として光学セットアップの簡単さと高空間分解能の約束に、最も人気のある技術となっています。しかし、単一分子の局在化を介した超解像顕微鏡は、本質的なトレードオフが付属しています:空間分解能の達成可能では時間分解能を制限するため、個々のフルオロフォアローカライズの十分な数を蓄積に依存しています。イメージング動的プロセス1が適切にも画像を再構成するためにその時間内に十分なローカライズイベントを取得しながらモーションアーチファクトをpreventする関心のある構造の動きをサンプリングしなければならないため、生細胞におけるESは、したがって、問題となります。これらの要件を満たすために、生細胞SMLMデモが大きく励起パワーを増加させることによって、フルオロフォアphotoswitching率の必要な増加が得られており、これにより、サンプルの生存時間および生物学的関連性3制限毒性および酸化ストレスに順番につながります。
SIMとSMLM両方を超えるSTEDの明確な利点は、それは厚い試料中の超解像度の画像は、例えば60nm程度の横方向の解像度は、最大120ミクロン〜4の深さで器官脳スライスで達成されたことができますされていること。 SMLMまたはSIMの単一目的の実装と、そのような深さでのイメージングが実現不可能であるが、単一分子光シートまたは格子光シートマイクのどちらかで可能になりますroscopy 5。これまでのところ、これは図6の小さなフィールドを撮像するために制限されているが、ビデオレートSTEDはまた、実証及びシナプス小胞の移動をマッピングするために使用されてきました。
細胞生物学および分子の自己集合反応7における用途のために-それは特定の蛍光の光物理的特性に依存しないように、多くの時間点にわたって高時間分解能でイメージングを必要とする12、構造化照明顕微鏡(SIM)よく適合することができますプローブ。 SIMのこの固有の利点にもかかわらず、今までその使用は、主に固定された細胞または動きの遅いプロセスを画像化するために限定されています。これは、市販されているSIMシステムの限界によるものである。これらの商品の獲得フレームレートが必要と正弦波照明パターン並びに光学偏光維持を生成するために使用される回折格子の回転速度によって制限されました。商業SIMの最新世代機器は、高速撮像が可能であるが、彼らは中央イメージング施設が、すべてに非常に高価です。
このプロトコルは、薄い試料中の生細胞の基底面付近で高速処理を撮像するための柔軟なSIMシステムの構築へのガイドを提示します。それは非常にフォーカス背景信号のうちを減少させ、サンプル13にノー深く約150 nm未満を貫通照明パターンを生成するために、全反射蛍光(TIRF)を採用しています。 TIRFでSIMを組み合わせるという発想は、SIM自体14とほぼ同じくらい古いですが、2006年15前に実験的に実現しなかった。TIRF-SIMで得られた第一のin vivo画像がチューブリンとキネシンを視覚化するために11ヘルツのフレームレートを達成2009年16で報告されましたダイナミクス、2色TIRF-SIMシステムは17,18を提示されました。最近では、単一色2ビームSIM秒の構築および使用のためのガイドystemは最大18 Hzの19,20のフレームレートをフィーチャー発表されました。
ここに提示され、セットアップは、TIRF-SIMで動作することができる2つのうちの3色で20HzでSIM超解像度イメージングが可能です。システム全体は、倒立顕微鏡のフレームの周りに構築され、ピエゾ作動Zステージと電動式のXY移動ステージを使用しています。 TIRF-SIMに必要な正弦波励磁パターンを生成するために、提示システムは、強誘電体空間光変調器(SLM)を使用します。バイナリ格子パターンがSLM上に表示され、結果の±1回折次数は、フィルタリング中継され、対物レンズのTIRリングに重点を置いています。必要な位相シフト及び格子の回転は、表示されたSLMの画像を変更することによって適用されます。このプロトコルは、このような励起パスを構築し、位置合わせする方法について説明し、排出路の位置合わせを詳述し、最適なアラインメントを確保するための試験サンプルを提示します。また、デスクライブ偏光制御とコンポーネントの同期に関する高速TIRF-SIMに特定の問題や課題を。
設計上の考慮事項と制約
このプロトコルで提示TIRF-SIMシステムを組み立てる前に、光学部品の選択を決定考慮すべきいくつかの設計上の制約があります。光学部品の全ての略号は図1を参照してください。
空間光変調器(SLM)
それは、サブミリ秒パターン切替が可能であるようにバイナリ強SLMは、この設定で使用されています。階調ネマチックのSLMを使用することができるが、これらはスイッチング時間を大幅に提供減少しました。二位相のピクセルをオンまたはオフに各SLMは、入射面波面にオフセットπまたは0相のいずれかを付与する周期的な格子パターンがSLM上に表示されている場合はそのためには、位相回折格子として動作します。
ENT ">全反射(TIR) TIRを達成し、エバネッセント場を生成するために、ガラスサンプル界面における励起ビームの入射角が臨界角よりも大きくなければなりません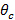 。また、これは、したがって、エバネッセント照明パターンの最大間隔または期間を、必要とされる最小の入射角を設定し、。最大入射角
。また、これは、したがって、エバネッセント照明パターンの最大間隔または期間を、必要とされる最小の入射角を設定し、。最大入射角 (受光角)を定義から計算することができ、対物レンズの開口数(NA)によって制限されます
(受光角)を定義から計算することができ、対物レンズの開口数(NA)によって制限されます 。これは、アッベ式に従って達成間隔の最小パターンを決定します
。これは、アッベ式に従って達成間隔の最小パターンを決定します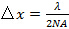 NAと波長をリンクします
NAと波長をリンクします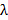 最小パターン間隔に
最小パターン間隔に 。実際には、1.49のNA油浸TIRF対物レンズは、約79°の最大入射角と488nmでの励起波長を用いて164 nmでのサンプルの最小限のパターン周期をもたらします。これら二つの角度は、(TIRリング。 すなわち )機器がTIR照明を実現する上で、対物レンズの後部開口部のリングを定義し、2つの励起焦点を正確に位置決めして正確に各照明パターンを生成するために回転する必要があります。
。実際には、1.49のNA油浸TIRF対物レンズは、約79°の最大入射角と488nmでの励起波長を用いて164 nmでのサンプルの最小限のパターン周期をもたらします。これら二つの角度は、(TIRリング。 すなわち )機器がTIR照明を実現する上で、対物レンズの後部開口部のリングを定義し、2つの励起焦点を正確に位置決めして正確に各照明パターンを生成するために回転する必要があります。
TIRF-SIMの画像の再構成は、パターン回転あたり3位相シフトの最小の買収は、したがって、SLMパターン期間は3で割り切れる必要があります必要があります( 図1を参照)。例えば、488nmの照明用の9画素と640 nmの照明のための12ピクセルの期間。剪断された格子を用いたパターン間隔のサブピクセル最適化などのSLMパターン設計の包括的な議論については、、16及びLu-ヴァルターら ら Knerの前の仕事を参照してください。2つの励起焦点の20位置は全ての波長のためのTIRリングの内側にある必要があります、しかし、SLMからの±1次数の回折角は波長であります依存。標準SIMため、多色画像は、最長波長に対する格子周期を最適化し、より短いチャンネルに対する性能の損失を許容することによって達成することができます。 TIRF-SIMの場合はしかし、一つの波長を最適化すると、他の波長の焦点は、もはやTIRリング内であることを意味しません。病巣バック開口部の直径の95%で、およびTIRリング内にあるが、640nmのため、この期間外焦点を配置と同じように、例えば、9画素の格子周期を使用して、488 nmのためのTIRFを提供するのに十分ですアパーチャ。この理由のために、異なるピクセルパターンの間隔は、各励起波長のために使用されなければなりません。
TIRF-SIM励起経路のアラインメントはるかので、従来のSIMよりも、顕微鏡本体内のダイクロイックミラーの位置における小さな変化( 図1中のDM4)に非常に敏感です。回転フィルタキューブターレットの使用は、固定位置に保持され、使用される励起波長のために特別に設計されたシングル、マルチバンドダイクロイックミラーを使用する代わりに、推奨されません。最高品質のダイクロイックミラーを使用することが必須です。これらは、少なくとも3mmの厚さの基板を必要とし、多くの場合、製造業者によって「撮影フラット」として指定されます。他のすべての基板は、TIRF-SIMに耐え難い収差や画像劣化につながります。
偏光制御
TIRF-SIMを達成するために、それが光軸に対して対物レンズの瞳面内の方位角方向に偏光ままであるように照明パターンと同期して励起光の偏光状態を回転させることが不可欠である( すなわち。 s偏光)。偏光制御光学系の位置合わせは、電動式回転ステージ22、例えば、使用される特定の光学素子のポッケルスセル21、または半波長板を左右される。このプロトコルでは、カスタム液晶可変リターダ(LCVR)は、それが高速(〜ミリ秒)のスイッチングを可能にするように640 nmの波長範囲488を完全に波(2π)リターダンスを提供するように設計、使用されています。液晶リターダを使用する場合には、高品質のコンポーネントを使用することが必須である:標準部品は、典型的には、照明パターンと低い変調コントラストのうち、ぼけにつながるカメラの露光時間の長さにわたって一定のリターダンスを与えるのに十分安定ではありません。液晶リターダは、また、温度に強く依存し、温度制御に内蔵必要。
同期
レーザーは、SLMと同期する必要があります。バイナリ強誘電体のSLMは、内部のでバランスされていますオン状態とオフ状態の間魔術。ピクセルは、いずれか一方のみでそれらの状態をオンまたはオフではなく、時間を切り替えインターの間に半波長板として作用します。したがって、レーザーはのみによるピクセルの中間状態にパターンコントラストの低下を防止するために、SLMからの信号を有効にLEDを介してオン/オフ状態の間にオンにする必要があります。レーザをデジタル変調することができない場合、音響光学変調器(AOM)を交互に高速シャッターとして使用することができます。
レンズの選択
これらの制約に基づいて、所望の照明パターンを生成するために試料面上にSLM面の必要な縮小を決定することができます。これは、画像中継望遠鏡励起集光レンズL5に2つのレンズL3とL4の焦点距離を計算することができます。このシステムでは100X / 1.49NAの油浸対物レンズ488 nmおよび640 nmの励起で使用され、従って300および140ミリメートルの焦点距離を使用してL4およびL3のための、およびL5のための300ミリメートル、試料面での38ナノメートルのSLMの画素サイズに相当357Xの合計縮小を与えます。レンズの組み合わせを使用して、SLMは、それぞれ70°と67°の入射角に対応し、488 nmの照明とサンプルで172および229 nmでのパターン間隔を与えるnmの640のための12画素について9の期間を格子。ガラス - 水界面の場合、臨界角は、したがって、これらの2つのパターンの間隔は、両方の波長のためのTIRF励起を可能にする、61°であり、かつ波長とは無関係です。 37℃で動作する場合、または補正環を備えた対物レンズは、カバーガラスの厚さの変動によって導入される球面収差の補正のために有用です。
画像再構成
生SIMデータが取得されると、それは、2段階のプロセスで超解像を生成するための計算量の問題です。まず、照明パターンのために決定されなければなりませんすべての画像および第二に、SIMスペクトルの構成要素は、( 図6、インセットを参照してください)効果的なOTF支援を倍増するように適切に分離して再結合する必要があります。
超解周波数成分が重複する成分の残留部分によって引き起こされるアーティファクトを防止するためにできるだけ正確に純粋でなければならないように投影された照明パターンの正確な知識は、最も重要です。我々は、照明パターンのそれぞれについて発見されたグスタフソンら要するに23、正規化された二次元の正弦波を記述する照明パラメータのセットによって導入された手順に従って、生の画像データから事後パラメータ決定します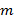 励起パターン
励起パターン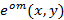 :
:
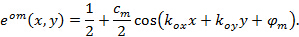
これによって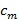 そして
そして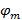 縞コントラストとそれぞれ個別の画像メートルのフェーズを開始するパターンを記述しています。波数ベクトルの成分
縞コントラストとそれぞれ個別の画像メートルのフェーズを開始するパターンを記述しています。波数ベクトルの成分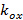 そして
そして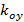 、唯一の異なる向きに変更
、唯一の異なる向きに変更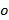 パターンと缶のそれ以外の場合は一定であると仮定。粗重なりを最適化するように相互相関のイメージのいずれかにサブピクセルシフトを適用することによって、精製された原画像のスペクトルの相互相関が実行される波数ベクトルの成分を決定します。これは、実空間位相勾配の乗算を介して行われます
パターンと缶のそれ以外の場合は一定であると仮定。粗重なりを最適化するように相互相関のイメージのいずれかにサブピクセルシフトを適用することによって、精製された原画像のスペクトルの相互相関が実行される波数ベクトルの成分を決定します。これは、実空間位相勾配の乗算を介して行われます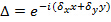 それがfreにおけるサブピクセルシフトを誘発します波数空間。前に実際のパターン推定に波ベクトルの良好な推定値を有することが有用であり、これは蛍光ビーズ層を画像化することにより求めることができることに注意してください。
それがfreにおけるサブピクセルシフトを誘発します波数空間。前に実際のパターン推定に波ベクトルの良好な推定値を有することが有用であり、これは蛍光ビーズ層を画像化することにより求めることができることに注意してください。
シフトパターンとの間の位相ステップがあるように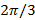 、 すなわち 。
、 すなわち 。 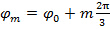 、周波数成分の分離は、「相軸」に沿ってフーリエ変換することにより行うことができます。大域的位相
、周波数成分の分離は、「相軸」に沿ってフーリエ変換することにより行うことができます。大域的位相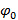 フリンジのコントラスト
フリンジのコントラスト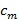 次いで、異なる成分の複雑な線形回帰を用いて決定することができます。個々の分離された成分は、その後、一般的なウィーナーフィルタを使用して合成されます。一般化ウィナーフィルタの両方のパラメータ抽出と実装の詳細については、我々はグスタフソンに読者を参照してください。ら 23と同じアルゴリズムが使用されています。
次いで、異なる成分の複雑な線形回帰を用いて決定することができます。個々の分離された成分は、その後、一般的なウィーナーフィルタを使用して合成されます。一般化ウィナーフィルタの両方のパラメータ抽出と実装の詳細については、我々はグスタフソンに読者を参照してください。ら 23と同じアルゴリズムが使用されています。
プロトコル
1.励起パスの配置と整列
- 光学テーブル上の部品の位置をマークします(光学セットアップの概要について図1を参照)。目的を分離、レンズL3、L4、L5、及びSLM SLM面が対物レンズの焦点面上に中継されるように、それぞれの焦点距離の合計によってそれぞれ。
- 顕微鏡フレームのフィルタキューブターレットにマルチエッジダイクロイックミラーDM4を挿入します。
- マウント1 "平方運動ミラーに第2のダイクロイックミラーDM3を挿入し、1焦点距離離れて集光レンズL5からそれを配置します。
注:この励起パス設計は、2つの同一のダイクロイックが同一の光学特性を確保するために、同じ製造バッチから取得されDM3及びDM4をミラー内蔵しています。ダイクロイックミラー(DM4)は、S-及びP-軸が顕微鏡(DM3)に位置し、ダイクロイックに比べてスイッチングされるように配置されることにより、任意のキャンセル偏光楕円率の複屈折によって導入された( 図1)。この補償は、各照明波長についても同様に適しています。このステップは、高い変調コントラストを維持するために必須です。 - 励起経路に任意のレンズを挿入する前に、正確にシステムの光軸を定義します。
- タレットから対物レンズ(OB)を取り外し、代わりにアライメントツールにねじ込みます。これは、両端の2つの位置合わせディスクと500ミリメートル長い光ケージシステムから構成されています。
- 2つのアライメントディスクの穴の中心を通ってレーザー1からの平行基準ビームを操縦するためにダイクロイックミラーDM3とSLMのおおよその後ろの位置に配置一時的なアライメントミラーを使用してください。 図1に示すように3つのミラーと、ダイクロイックミラーDM2を使用して、一時的なミラーにレーザー1からの光束を導きます。 SLMの位置での一時的なミラーは、光軸に対して垂直に近いなければなりません。
注:使用レーザー1を参照光として、励起経路が配置されると、他のレーザはその後整列させることができるように。 - それは梁に顕微鏡本体とセンターに入る前に、粗い光軸がビーム経路に絞りdetermined.Insertされた後、アライメントツールを削除してください。 iris.Reinsert対物レンズ(OB)を中心に小さな穴で白いカードの一枚を取り付けます。
注:目標を出るビームは現在、非常に発散になりますが、白のカード上に表示されるようになり、レンズの後面から非常に弱い反射が存在することになります。全てのレンズは、それらは、反射防止コーティングされていても、同軸の位置合わせを確実にするために使用することができる弱い後方反射を有することになります。ビームが正確にレンズに垂直である場合、後方反射は、虹彩の中心を通って戻ります - 上の後方反射を中心に二つのミラー(SLMの位置にDM3とアライメントミラー)への反復角度の調整を行います入射ビームのカード。一時的に対物レンズ(OB)を削除し、基準位置を作成するために、天井にレーザスポットをマーク。
- テーブルのネジ穴に沿って基準ビームの高さで虹彩のペアを挿入します。ビームは、光学テーブルの表面に平行でなければなりません。光軸が定義されました。
- およそ1焦点距離離れて客観から集光レンズ(L5)を挿入します。基準ビームの方向に沿って移動するように設定リニア並進ステージ上にこのレンズをマウントします。
- 目的を出るビームがコリメートされ、天井上の基準地点に当たるような集光レンズの位置や角度を調整します。レンズは再びアイリスと白のカードとの後方反射をチェックすることにより、ビームに垂直であることを確認してください。対物レンズ(OB)を取り外し、画像リレー望遠鏡(L4)の第2レンズを挿入します。
注:あることの適切なコリメーションと非たわみを確保光路内のレンズの偶数である場合AMが容易になります。 - コリメーションを維持するために、参照ビームはまだ天井に著しいスポットをヒット確実にするために、リニア移動ステージを使用して、このレンズの位置や角度を調整します。
- 対物レンズ(OB)を交換し、望遠鏡(L3)の第1のレンズを挿入します。前の手順で説明したように、コリメーションおよび非たわみを確実にするために、このレンズの位置や角度を調整します。
- チップ表面の中央部約翻訳せずに回転を提供するジンバル上のSLMチップマウントをマウントします。
注:特定の実装設計が使用SLMによって異なります。 SLMは、マウントせずに供給された場合、それは、レンズジンバルマウントに装着されているカスタム機械加工のアルミニウム板に固定してください。 - レンズが整列すると、ミラーの代わりにSLMを挿入します。参照ビームは、SLMチップの中央に位置するように、SLMの位置を調整し、ANを調整しますビームは、2つのリレーレンズ(L3及びL4)を通過するようGLE。基準ビームがまだ顕著なスポットに集中していることを確認してください。
- 展開し、ケプラービームエキスパンダを使用して、参照ビームをコリメート。
- 調整を容易にするために、ケージシステム内の2つのレンズ(L1およびL2)をマウントします。
- センターのレンズを除去し、虹彩とそれらを置き換えることにより、参照ビーム上のケージシステム。
- 二つのレンズを挿入し、シアリング干渉計を使用して、拡大されたビームをコリメートするL2の軸方向の位置を調整します。 L2は、1焦点距離離れSLMの表面からでなければなりません。
- 拡大されたビームは、まだ2リレーレンズL3、L4の後にコリメートされていることを確認してください。コリメーションをチェックするだけDM3後シアリング干渉計を使用してください。
- 励起経路は、単一の波長のために整列された後、ビーム経路に結合他の2つのレーザを。使用した励起パスを中心に2アイリスを通して各ビームを操縦ダイクロイックミラー(DM1とDM2)を組み合わせビーム。
偏光ローテータの2アライメント
- 入射偏光に対して45°で、その高速軸とのLCVRをマウントします。
- HWPと交差偏光子間のLCVRを挿入することにより、無彩色半波長板(HWP)を使用してLCVRに入射する光束のファインチューン偏光角。送信電力を最小化するためにHWPを回転させます。
注:可変偏光回転子として機能するためには、液晶リターダ(LCVR)の高速軸が正確に入射する垂直ビームの偏光に対して45°に位置合わせされなければなりません。 LCVRは、物理的に45°に搭載されているが、これは唯一の粗いアラインメントです。 HWPは、LCVR速軸に対する入射偏光の完全な45°の位置合わせを確実にするために使用されます。四分の一波長板(QWP)が印加された電圧によって制御される角度で背面直線偏光にLCVRによって誘発される傾斜した楕円偏光に変換します24。 - LCVR後QWPを挿入し、交差した偏光子の間で送信された電力を最小化することにより、受信偏波にその遅軸を整列させるために、それを回転させます。
排出パスの3アライメント
- 粗くステージマイクロメータスライドと透過光を使用して、カメラを置きます。
- 顕微鏡の接眼レンズを用いて、レチクルに集中し、この位置で対物レンズを固定します。
- 大体、カメラを中心に、画面上の画像を観察することにより焦点にレチクルの画像をもたらすために、カメラの位置を移動させます。
注:外部フィルタホイールが使用される場合、レーザがオンにされたときにフィルターキューブは、したがって、接眼レンズを使用してはいけません、発光フィルターは含まれません。
- 細かく蛍光ビーズのサンプルを使用して、カメラの位置を調整します。
- #1.5カバーガラス上に100nmの多色ビーズの低下を広げることによって蛍光ビーズの単層を準備します。 Dに残しますRYは、カバーガラスのビーズを吸着した後、水に再浸漬します。
- イマージョンオイル対物にビーズサンプルを置きます。細かく蛍光ビーズ層にフォーカスがあるようにカメラの位置を調整します。フォーカスが発見された後、対物レンズの位置を調整しないでください。
注:SLMはサンプル平面に共役である必要がありますように、SLMの位置は、リレーレンズ、および目的が固定されなければなりません。フォーカスを調整するには、サンプル軸方向の代わりにピエゾZステージを使用して目的を移動します。
- ビットマップファイルなどの適切なSIMバイナリ格子パターンを生成します。
- 3等間隔の位相シフトを有する3パターンの向きごと:2D / TIRF-SIMの場合、9バイナリ格子一連の画像を生成します。その後、二値画像を生成するために閾値化、適用される位相オフセットと回転した2D正弦波から(例えばMATLABを使用して)数値的にこれらを生成します。例のコードのために補足コードファイルを参照してください。
- alignmenのためトンの目的は、また、ウィンドウ位置合わせ格子が外部トリガする必要はありません。 図2に示すように、3方位のそれぞれについて、小さな円形開口によってウィンドウ化された格子パターンを生成するが、手動を介してユーザーが切り替えることができますSLMのソフトウェア。
注:最適な回転角度の議論と格子パターン生成コード16,20の例については、参考文献を参照してください。
- (例えばMetroCon用)メーカーのソフトウェアを使用して、SLMへのビットマップ画像をアップロードします。
- SLM制御ソフトウェアをロードし、「接続」をクリックします。
- 「レパートリー」タブでは、レパートリーのファイルを開き、ファイルに含まれている受注の実行の数を確認するには、「ロード」をクリックします。与えられた例レパートリーファイルでは5実行受注があります。
- SLMにレパートリーファイルをアップロードするには、「取締役会に送信」をクリックします。
- ビットマップ画像をアップロードするのを待ち自動的に再起動するデバイスのためのND。
注:格子ビットマップ画像と順序を定義するファイルが含まれている例レパートリーファイルには、補足コードファイルとして含まれています。 「.repz」ファイルは、ZIPファイルアーカイバソフトを使用して開くことができます。
- (例えば、0°のための)最初のオリエンテーションのためにSLMに格子窓付きアラインメントを表示します。
- SLM制御ソフトウェアでは、「ステータス」タブを選択し、実行順序(例えば、ファイルの場合には、これは順序「1」を実行されている)の数を入力します。
- アライメント格子への実行順序を変更するには、「選択」をクリックします。
注:これは、試料面に小さな円形の領域を点灯します。 SLM面が正しく試料面に結合している場合は、この領域のエッジが焦点に鋭くなります。格子パターンは、L3の焦点に複数の回折次数を生成します:ゼロ次反射の反射バックプレーンからSLM、-1およびSLMデバイスに固有の内部素子の回折から生じる格子、また弱い高次に対応する1オーダー( 例えば 、画素エッジでのSLMピクセルと凹凸の内部配線の反射) 。すべてが、-1と1の受注をろ過する必要があります。
- 空間マスク(SM)を挿入L3の焦点位置にビーム経路にX、Yステージに搭載されており、唯一の希望の最初の注文が渡されるように光軸に対してその位置を翻訳します。直接空間フィルタの後に、2つだけの円形のビームが表示されます。
注:空間マスクは、針を用いてアルミホイルに6穴を打ち抜いて製造されます。穴は、全てのレーザの波長のための第一次ビームを通過するのに十分大きくなければなりません。空間マスクの詳細な分析は、参照20で与えられます。 - 再び次のアライメント格子の向き(60°、実行順序2)とを表示必要な場合にのみ、最初の注文は、その位置を調整し、空間的なマスクを通過させていることを確認してください。
- 最終的な方位(120度、実行順序3)に対して繰り返します。
- カメラの蛍光ビーズ層の画像を確認してください。 図2に示されるように、2つの円形のビームが重なっていない場合、反復対物レンズとカメラの位置を調整することにより、試料面の位置を変更します。
- 焦点外像をもたらす二つのビームをオーバーラップすることを目的位置を調整します。フォーカス微調整に戻す二つの円がまだ表示されている場合には目的をイメージを持ってカメラを再配置します。二つのビームが重なると、単一の円形領域にフォーカスがあるまで、このプロセスを繰り返します。
- 試料面の位置が設定された後、固定された目標位置に保ちます。
- TIRF照明、画像、蛍光色素の溶液を確認するために、488 nmの励起波長のために、例えば、10の溶液を使用し81; Mローダミン6G。
- 焦点に色素サンプルを持参してください。二つのビームが正しいTIRF角で入射している場合は、単一の分子は高いバックグラウンドなしで表示されます、と円形開口の縁部が焦点になります。整列して位置がずれTIRFビームの例については、 図2B-Dを参照してください。
- 今度は、窓格子の各方向を表示し、すべての3つの向きがTIRF照明を提供することを2つのビームを試料面に重なっていることを確認してください。ビームの位置の微調整は、ダイクロイックミラーDM3を調整することによって作製することができます。
注:異なる波長の色収差を軸方向に起因するわずかに異なる位置に焦点を合わせているが、これは重要ではなく、一定の第二の波長で励起する前のサンプル位置に、Zオフセットを適用することにより補正することができます。
4.システムの同期とキャリブレーション
- ビーズ単層Sを配置します客観的に十分とフォーカスに持ち込みます。
- 第1パターン方向(0°)のために、今度は3位相シフト画像のそれぞれを表示するための制御ソフトウェアを使用してプログラムSLM。
- SLM制御ソフトウェアを使用して、例のレパートリーの順序4の実行に切り替えます。
- グローバル露光期間中に1つの正と1つの負のTTLトリガ信号:出力2の信号に(例えばHCImage用)買収のソフトウェアを使用して、カメラを設定します。カメラのソフトウェアでは、「高度なカメラのプロパティ」で、「露出」に出力トリガ種類1と2を設定し、出力トリガ極性1と2をそれぞれ「ポジティブ」と「ネガティブ」へ。
- 同軸ケーブルを使用して、それぞれ「トリガー」とSLMの「完了」入力に出力1とカメラの2を接続します。 SLMは現在、カメラに同期されます。
- 3一連の画像を取得します。
- 「シーケンス」ペインで、選択"スキャンタイプとしてハードディスク録画」、および3にフレーム数を設定します。
- 3フレームを取得するために、「スタート」をクリックしてください。 SLMパターンは、各露光時に変更されます。画像内の蛍光ビーズは、3画像のそれぞれの間にオンとオフを点滅するように見えます。点滅の量は、正弦波照明パターンの変調コントラストの読み出されます。
- 方位偏光と与えられたパターンの向きのために、したがって、最も高い変調コントラストを達成するために、カスタムソフトウェアを使用してLCVRと励起レーザの偏光を回転させます。
- LCVRのキャリブレーションソフトウェアをロードします。
- それぞれの最小値と最大値の電圧は0と8を入力します。
- 偏光を回転させるために「LCVR電圧をスイープ」をクリックします。
注:LCVR燃性は、温度の関数であり、均一な温度制御と日々をドリフトすることができます。このステップでは、最適な方位偏光はsweepiによって経験的に発見されましたサンプルにおける偏光入射を回転させる効果を有し、その最小値と最大電圧との間に印加される電圧をngの。変調コントラストは、各電圧25について計算されたピークのコントラストを達成する電圧は、次のステップで使用されています。 - 完了するために、キャリブレーション処理を待ち、および測定された電圧を書き留め。
- 残りの2つのパターンの向き(60°、120°)と励起波長ごとに、このキャリブレーションプロセスを繰り返します。
- LCVR、レーザー、発光フィルタホイールとピエゾZステージ26と、カメラの露出を同期します。これを達成するために、システムのマスタクロックソースとして、高速データ収集(DAQ)ボードを使用し、SLMのは、レーザを変調するために出力信号を有効にLED使用( 図3B参照)。
注:特定の実装が使用されているコンポーネントに依存しますが、デジタルトライのための高速DAQボードを使用することですgger同期およびソフトウェアを介して制御されたアナログ電圧を、使用してLCVRの制御は、推奨されます。このプロトコルで使用される制御ソフトウェアは、リクエストに応じて入手可能です。 - 軸上色収差に、波長ごとに、また、z軸オフセットサンプルステージに適用します。
- その後、第二の( 例えば 、640 nm)に切り替える第1の波長で多色ビーズ単層サンプルに着目して実験的にオフセット( 例えば 、488 nm)を決定します。ビーズは現在、焦点外となります。
- ビーズを再集束し、必要に応じたzの位置の変化を測定します。これは、次に、ピエゾZステージに励起波長が変更されるたびに適用することができるオフセット。
- SLM制御ソフトウェアを使用して、TIRF-SIMに必要な9バイナリ格子画像の全シリーズにSLMの実行順序を切り替えます。これは、例えばレパートリーで注文0を実行しています。
- カメラ制御ソフトウェアを使用して、ビーズ試料9の画像を取得します。
- カメラソフトウェアの「シーケンス」ペインで、スキャンタイプとして「ハードディスク録画」を選択し、9にフレーム数を変更します。
- 画像を取得するために、「スタート」をクリックしてください。
- 「保存バッファ・イメージ」ウィンドウ内の画像タイプとして「TIFF」を選択し、[OK]をクリックして、TIFFファイルとして取得した画像を保存します。
- 標準TIRFを超える解像度の改善を検証するために商用またはカスタムソフトウェアを使用して、生のTIFF画像から超解像画像を再構成します。
注意:私たちの顕微鏡のために我々は復興コードが社内にし、リン博士シャオ27の両方によって開発されたカスタムを使用します。
結果
多色100nmの直径の蛍光ビーズはTIRF-SIMに標準TIRFを比較して、横方向の解像度( - B 図4A)で達成可能な改善を定量化するために画像化しました。超解像への生フレームの再構築は、文献27,28に概説されるように、標準的なアルゴリズムを使用して行きました。 TIRF-SIMが明確TIRFと比較して有意に高い横分解能を有することが分かります。顕微鏡の点広がり関数(PSF)がよく、したがってPSFと分解能は波長毎に個別のビーズに2次元ガウス関数をフィッティングすることによって定量することができる、単一のサブ回折サイズの蛍光ビーズの画像で近似します。半値全幅(FWHM)の平均値に基づいて、顕微鏡の推定分解能は488と640それぞれNM TIRF-SIM( 図4C)89 nmおよび116 nmです。これは、2倍インプロに対応します理論的な回折限界の場合に比べて、両方の波長のための横方向の解像度でvement。蛍光標識されたアミロイド線維も2倍の解像度( 図4D)を実証するための優れた試験サンプルです。アミロイド線維は、1週間10%のローダミン誘導体の色素(488 nm励起)で標識されたβアミロイドをインキュベートし、続いてTIRF-SIMで撮像することによって、in vitroで形成されました。詳細については、12を参照して参照してください。
このようなemGFPなどコントラストの高い細胞内構造は、微小管( 図5B、G)またはLifeAct-GFP( 図5D)TIRF-SIMイメージングのための理想的で、高コントラストの超解像画像を得標識。このプロトコルで詳述セットアップを使用してTIRF-SIMイメージングは、基底細胞皮質の近傍に位置する微小管の亜集団の観察を可能にし、微小管の重合と脱重合は、bはでき時間をかけて見た電子(アニメーション図1)。すべてのサンプルは、離散構造とすることなく、特定の、コントラストの低いサンプルに、TIRF-SIMで画像化するために適しているわけではありません。サイトゾルGFPを発現する細胞は、原形質膜( 図5F、Hおよびアニメーション図2)の縁部には別に、高解像度の情報を欠いている、得られた再構成は、基本的にアーティファクトを重ねTIRF像であるとしてTIRF-SIMイメージングのために、従って次善です。このような試料では、コントラストの増加は、多くの場合、再構成アルゴリズムのデコンボリューション工程に起因し得ます。
高い変調コントラストが成功したSIMのイメージングのために不可欠です。フーリエ変換再構成画像の変換SIM光学伝達関数(OTF)( 図6A、挿入図)の可視化を可能にします。極性方位角を確保することによって、各方向の変調コントラストを最大化することなく、偏光回転子を持つ化は、SIM通過帯域における低信号対雑音比をもたらす試料中の高解像度の情報の非常に少ない変調があります。単にSIMの通過帯域内のノイズを増幅し、本質的に六角形(または「ハニカム」)を重ね標準TIRF画像である画像が得られます標準ウィナーフィルタのアプローチを使用して再構成アルゴリズムリンギングアーチファクト( 図6A、右パネル)。可能な拡張機能は、試料の種類に応じて、これらのアーチファクトを低減するために、反復29,30またはブラインド再構成アルゴリズム31,32の使用であるかもしれません。私たちは、復興33前後のSIMデータの品質をチェックするためのImageJのプラグインSIMcheckの使用をお勧めします。
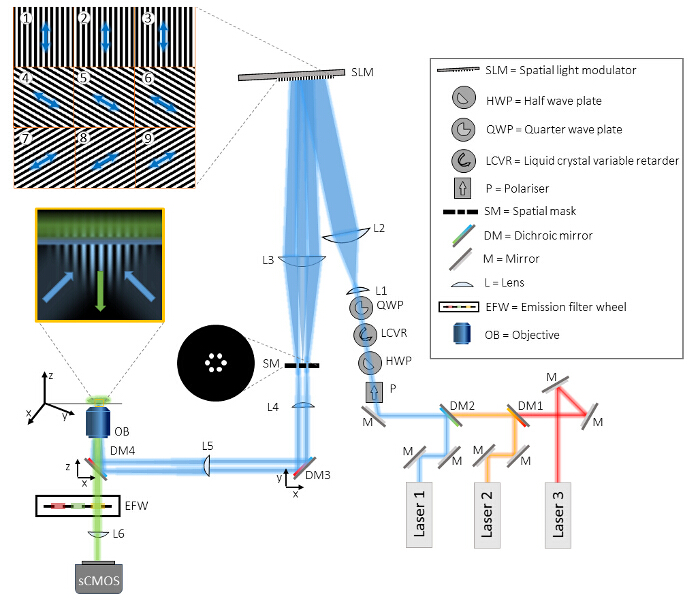
図1:マルチカラーTIRF-SIMのセットアップのレイアウト TIRF-SIM mi です。croscopeは、3つの主要部、ビーム生成部、パターン投影部と、検出部から構成されています。ビーム生成部において3つの異なるレーザは、ダイクロイックミラー(DM1及びDM2)を介して同一の光路に整列され、偏光制御用の4つの光学素子を通して導か。まず、偏光子(P)は、レーザビームのそれぞれの直線偏光状態の純度を保証します。以下の3つの光学素子は、本文中に詳細に記載されるように、高速で自動化された方法で偏光を回転させるために必要とされます。その後、望遠鏡構成の2つのレンズ(L1及びL2)は、空間光変調器(SLM)の活性表面に一致するようにビームを拡大し、SLMの投影された二進格子パターンによる三のビームレットに回折されている(例は、タイル1-に示されています9)。 SLMパターンに照明光に対する偏光状態は、矢印で示されています。第二望遠鏡(L3およびL4)は、パターンをデ拡大し、目へのアクセスを提供していますSLMパターンの電子フーリエ面。この面では、空間マスク(SM)は、SLMのピクセル化構造とその内部配線から中心的なコンポーネントや他の不要な回折成分を除去するために使用されます。残りの2つのビームを集光レンズ(L5)を介して対物レンズ(OB)の後焦点面上に集束される前に、2つのダイクロイックミラー(DM3及びDM4)がセットアップに含まれています。 DM4は、出射光からの照明を分離するために、蛍光顕微鏡で、従来のダイクロイックミラーとして機能します。しかし、このミラーは不可避DM3、DM4のような理想的には同じバッチからのダイクロイックミラーによって補償することができ、照明光の偏光状態の楕円率を誘導します。油浸TIRFの目的は、直接、完全に反映されているカバーガラス上に2つの逆伝播波を起動し、カバーガラスで構造化されたエバネッセント場を生じさせるために十分な大きさのNAを持っています。試料をXYZ移動ステージ上に搭載されています。検出はPERFです送信で同じ目的及びDM4を通じてormed、プラスバンドパス発光フィルタによる追加のフィルタリングは、コンピュータ制御フィルタホイール(EFW)に搭載されました。最後に、撮影した画像内蔵顕微鏡管レンズ(L6)によるsCMOSカメラに投影されている。 この図の拡大版をご覧になるにはこちらをクリックしてください。

図2:円形の開口とウィンドウ表示の重複梁の整列 (A)SLM格子パターンは、位置合わせのために有用です。 2非重複ビームは(左)カメラ上に表示された場合は、試料面の位置(右)反復的に単一の円形照明スポットを与えるために、対物レンズとカメラの軸方向の位置を調整することにより、再配置されなければなりません。ビームは、オードで重複しなければなりませんrはTIRF-SIMに必要な正弦波の励磁パターンを生成します。ビームが完全に重複していない場合、これは干渉縞が形成された視野を減少させます。 (B及びC)のビームの入射の正確な角度は、TIRF-SIMのために重要です。角度が正しくない場合、ビームの一方は、TIRFのために必要な角度にされず、蛍光色素溶液を撮影する場合、これは簡単に見えています。一方のビームは、円形スポットを生成し、他にはない、(B)の画像の左側の明るい縞をもたらす臨界角よりも大きな入射角を有します。 (D)ミラーDM3の角度を調整するには、両方のビームは同じ角度で入射していることを保証し、これは客観的なデフォーカスすることによって検証することができます:正しく整列場合、蛍光色素サンプルのzスタックのXZ投影は、2つの対称的に交差示すべきですで無視できる背景を持つビーム焦点を当てています。 この図の拡大版をご覧になるにはこちらをクリックしてください。
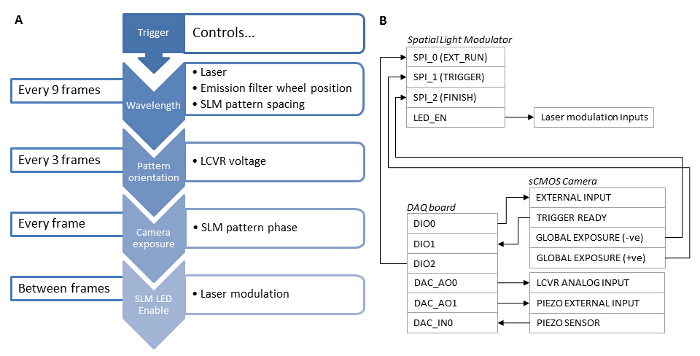
図3:異なるシステムコンポーネントの同期依存性 (A)高速SIM取得のためには、ハードウェアベースのソリューションを使用して、システム構成要素の同期化が必須です。 (B)データ収集ボード(DAQ)は、マスタトリガとして使用されるべきです。 DAQボードからのTTL信号はsCMOS外部入力に送られ、カメラの露出をトリガするために使用されます。カメラグローバル露光の出力が格子パターンを表示するSLMをトリガし、SLMの出力を有効にLEDをデジタルSLMピクセルが「オン」状態にあるときのレーザのみ放出されるようなレーザー励起を変調するために使用されます。露出がcompleされた後TE、カメラグローバル露光の出力が次の位相格子または角度のSLMパターンを前進させるために使用されます。 DAQボードは、照明光の直線偏光状態を制御するLCVRコントローラへのアナログ電圧を出力します。この電圧は、各パターンの角3の位相画像の取得後に切り替えられます。単一波長のための9の画像を取得した後、DAQボードは、発光フィルタホイールコントローラに信号を出力し、次の波長に切り替わります。 DAQボードはまた、z軸のオフセットzステージのピエゾコントローラにアナログ電圧を出力することにより、試料に適用されます。 この図の拡大版をご覧になるにはこちらをクリックしてください。
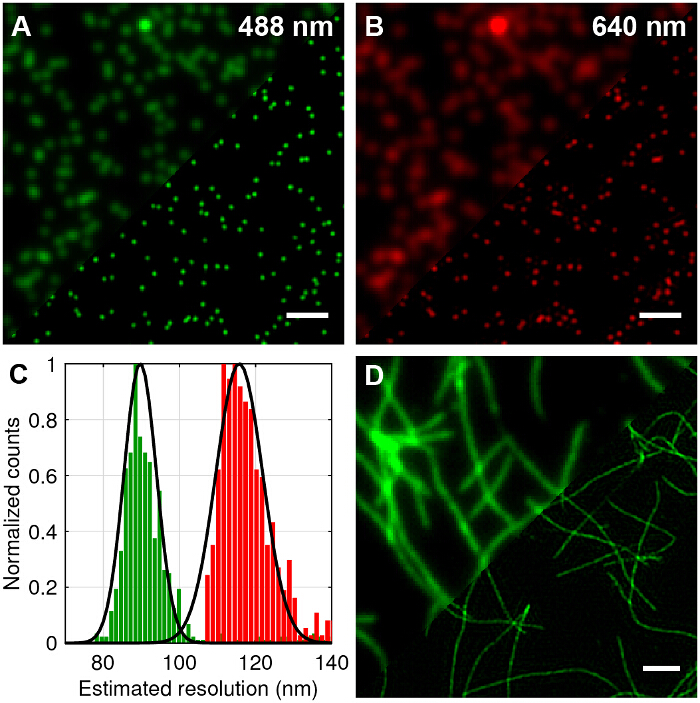
図4:100 nmのマルチカラービーズや蛍光Lの試験サンプルのTIRF-SIMイメージングabelledアミロイド線維。(A及びB)標準TIRFの比較488 nmおよび640 nmの励起用TIRF-SIMの再構成に比べて。 (C)ガウスの半値全幅(FWHM)のヒストグラムは、予想される解像度の改善を示すTIRF-SIMビーズにフィットします。 (D)10%のローダミン誘導体の色素(488 nm励起)で標識されたβアミロイド線維のTIRF-SIM対TIRF。スケールバー=1μmである。 この図の拡大版をご覧になるにはこちらをクリックしてください。
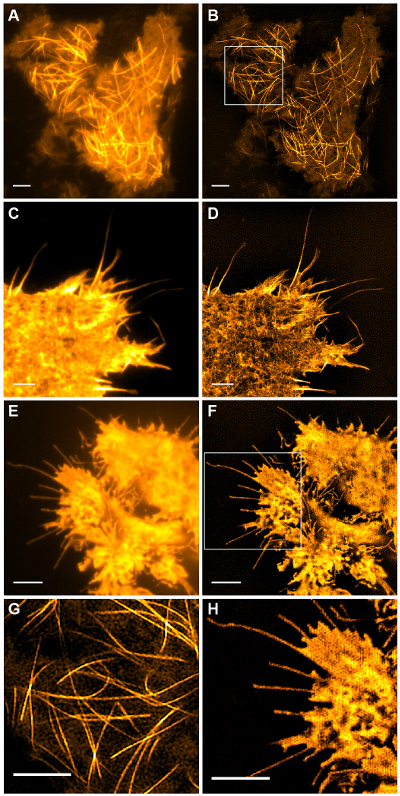
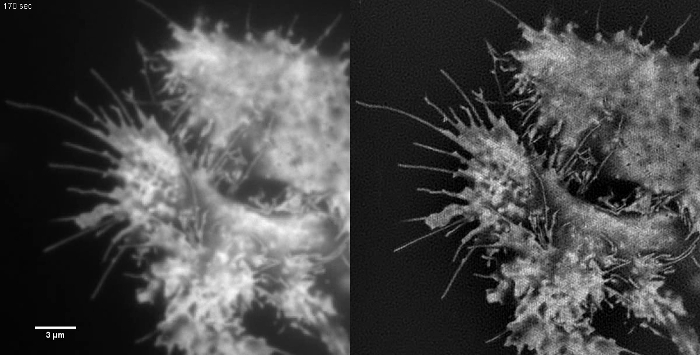
図5:HEK293細胞における(A、B)微小管(emGFPチューブリン)の生細胞TIRF-SIM従来のTIRFのイメージング比較とTIRF-SIM画像、(C、D )繊維状アクチンCOS-7細胞における(LifeAct-GFP)及び(E、F)HEK293細胞における細胞質ゾルGFP。 BとFの画像は映画から単一の時間点です。四角で囲まれた領域は(G、H)に拡大して示されています。スケールバー= 3ミクロン。 この図の拡大版をご覧になるにはこちらをクリックしてください。
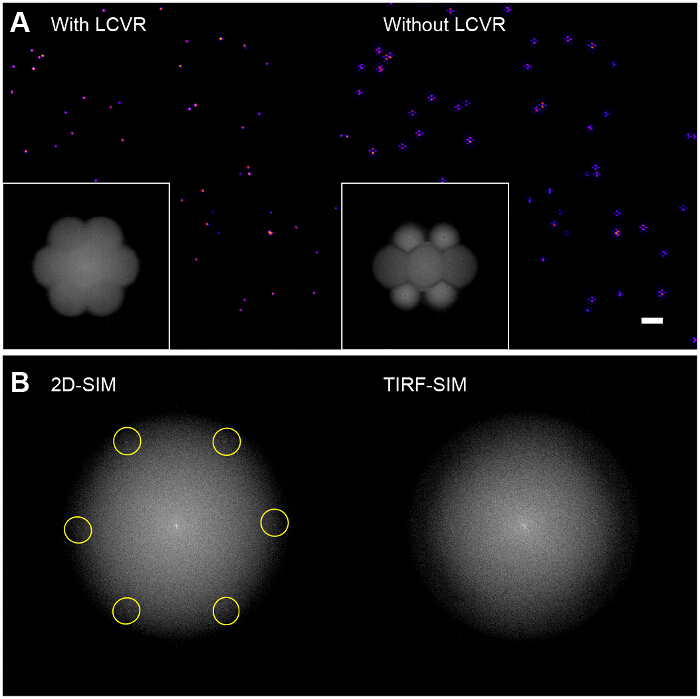
図6:再構成ビーズ画像上の偏光ローテータの影響 (A)などLCVRなどの偏光回転子を使用しない、SIMの通過帯域内の信号対雑音比は、再構成されたSIMの特性六角形のアーティファクトをもたらす低いです2D-SIMでの画像(右)、(B)、構造化照明パターンは、フーリエ変換に直接表示されます彼らは、発光OTFのサポートの半径内に収まるように、生の画像(左、励起空間周波数が強調表示)の変換、しかしTIRF-SIMで、彼らは(右)は、可視OTFサポート外であり、それゆえではありません。この場合、パターン変調コントラストは、プロトコルで概説されるように、まばらなビーズ単層を用いて評価する必要があります。 この図の拡大版をご覧になるにはこちらをクリックしてください。
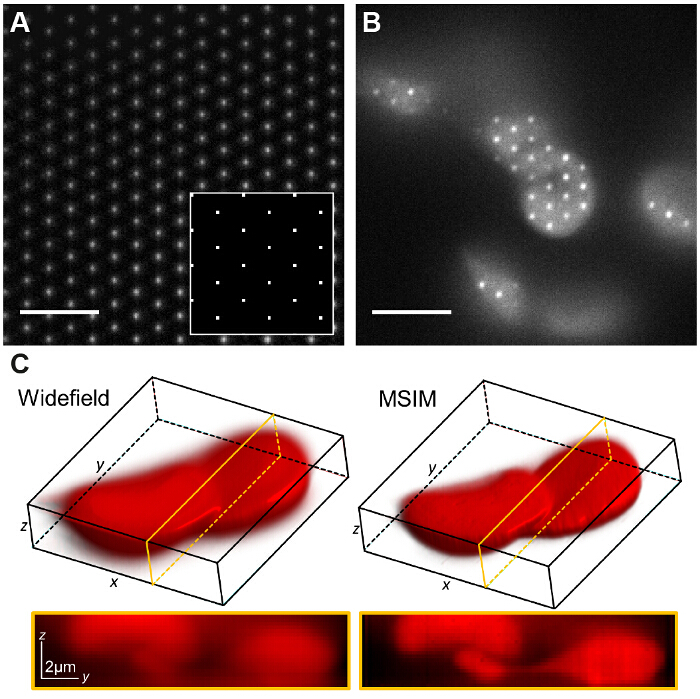
図7:空間光変調器ベースのパターン生成がこのような多焦点SIMのような他のイメージングモダリティの実施を可能にします (A)MSIMでは、正方形の格子は、SLM(挿入図)にpointsdisplayedは、像面での回折限界焦点の格子が得られます。低濃度のローダミン6Gの薄層がvisuaに結像されます病巣を平安大町。パターンは、試料(B)を横切って変換され、取得された原画像のzスタックは、アウト・オブ・フォーカス光(C)を縮小した画像を生成するように再構成される。スケールバー=5μmである。 この図の拡大版をご覧になるにはこちらをクリックしてください。
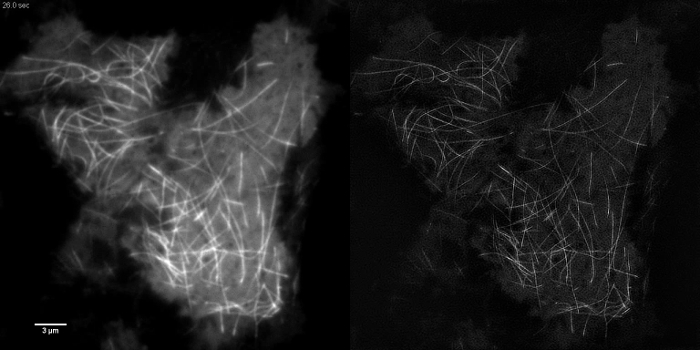
アニメーション図1:HEK293細胞におけるEmGFP-チューブリンの時系列の映画 emGFPの急速な重合と脱重合は、微小管は、TIRF-SIMを使用して観察することができる標識されました。画像は、0.5秒の間隔で配置(SIMフレーム当たり450ミリ秒)の生フレーム当たり50ミリ秒の露光時間を用いて取得しました。使用される露光時間がないカメラやSLMの速度によって、蛍光体の明るさによって制限されていました。 3988movie1.mov "ターゲット=" _空白 ">このビデオを見るにはこちらをクリックしてください。
アニメーション図2:HEK293細胞における細胞質GFPの時系列ムービーこのようなコントラストの低い試料は、TIRF-SIMイメージングのための理想的なサンプルではありません。逆行性膜の流れはTIRF画像で見ることができますが、TIRF-SIMは、セル端での別に任意の追加情報を提供していません。 TIRF-SIMの画像は5秒の間隔で配置生フレーム(SIMフレームあたり450ミリ秒)ごとに50ミリ秒の露光時間を用いて得た。 このビデオを見るにはこちらをクリックしてください。
補足コードファイル:例SLMレパートリーファイル(48449_300us_1-bit_Balanced.seq3)。D / 53988 / 48449_300us_1-bit_Balanced.seq3 ">このファイルをダウンロードするにはこちらをクリックしてください。
補足コードファイル:例SLMレパートリーファイル(period9_001.bmp) このファイルをダウンロードするにはこちらをクリックしてください。
補足コードファイル:例SLMレパートリーファイル(period9_002.bmp) このファイルをダウンロードするにはこちらをクリックしてください。
補足コードファイル:例SLMレパートリーファイル(period9_003.bmp) このファイルをダウンロードするにはこちらをクリックしてください。
補足コードファイル:例SLM repertoiファイル(period9_004.bmp)再。 このファイルをダウンロードするにはこちらをクリックしてください。
補足コードファイル:例SLMレパートリーファイル(period9_005.bmp) このファイルをダウンロードするにはこちらをクリックしてください。
補足コードファイル:例SLMレパートリーファイル(period9_006.bmp) このファイルをダウンロードするにはこちらをクリックしてください。
補足コードファイル:例SLMレパートリーファイル(period9_007.bmp) このファイルをダウンロードするにはこちらをクリックしてください。
補足コードファイル:例SLMレパートリーファイル(period9_008.bmp) このファイルをダウンロードするにはこちらをクリックしてください。
補足コードファイル:例SLMレパートリーファイル(period9_009.bmp) このファイルをダウンロードするにはこちらをクリックしてください。
補足コードファイル:例SLMレパートリーファイル(period9_mask_1.bmp) このファイルをダウンロードするにはこちらをクリックしてください。
補足コードファイル:例SLMレパートリーファイル(period9_mask_2.bmp) このファイルをダウンロードするにはこちらをクリックしてください。 >
補足コードファイル:例SLMレパートリーファイル(period9_mask_3.bmp) このファイルをダウンロードするにはこちらをクリックしてください。
補足コードファイル:例SLMレパートリーファイル(TIRF-SIM_example.rep) このファイルをダウンロードするにはこちらをクリックしてください。
補足コードファイル:例格子生成コード(2の1)(generate_gratings.m) このファイルをダウンロードするにはこちらをクリックしてください。
補足コードファイル:例格子生成コード(2の2)(circular_mask.m)。= "https://www.jove.com/files/ftp_upload/53988/circular_mask.m">このファイルをダウンロードするにはこちらをクリックしてください。
補足コードファイル:変調コントラスト(calculate_contrast.m)を計算するためのサンプルコードこのファイルをダウンロードするにはこちらをクリックしてください。
ディスカッション
例えば、このプロトコルで詳述設定として特注TIRF-SIMシステムは、市販の顕微鏡に比べて高速で多色超解像度イメージングが可能です。超解像技術としてSIMの固有の利点は、単一分子局在顕微鏡(SMLM)、または誘導放出の枯渇顕微鏡(ある点走査法などの他の方法に比べて、時間分解能は、フルオロフォアの光物理によって限定されるものではないということですSTED)。多色イメージングが簡単であるように、これらの他の技術とは異なり、SIMはphotoswitchableまたは枯渇蛍光団を必要としません。ここで報告された2倍の改善とは対照的に、SIMおよび多焦点SIMを区画などの光などの非TIRF-SIMシステムは、通常、実際には1.7倍以下の解像度の向上を達成することができ、および商用システムは、システムよりも頻繁に遅く、あまり柔軟性がありますこのプロトコルで提示。
">この技術を実装する2つの主要な困難は、まずSIMが高いパターンのコントラストを生成するために、第二光学アライメント手順を消費労力と時間を必要とする目的の背面開口部のTIRゾーン内梁6の正確な位置決めのために必要ですサンプルにおいて、偏光回転は、低NA 2D-SIMシステムでは、偏光回転を直線偏光の向きを注意深く選択することによって回避することができる。必須であるが、これはTIRF-SIM 25は不可能になる。高速多色画像化のために、電気光の偏光制御が必要であり、これは、システムの複雑さおよび費用を増加させます。技術の制限事項
TIRF-SIMは、従来のTIRFように、自然に生物学的構造とエバネッセント場の150-200 nmの侵入深さによって照明することができる基底細胞膜に位置するプロセスの観察に制限されています。同時にSIMは、多くの場合、STEDまたはSMLMのいずれかよりも細胞に対してよりphotodamagingものとして引用され、横方向の解像度の倍増は、依然として従来のTIRF顕微鏡と比較して少なくとも4倍5により光子の必要数を増やすん。短い露光時間で高フレームレートで撮影するために、この光子の増加は、増加した照明強度の使用を必要とします。任意のフルオロフォアが固定または低速で移動サンプルのSIMイメージングのために使用することができるが、強化された光安定性と高輝度蛍光タンパク質または次世代合成染料は、生細胞イメージングのために推奨されています。
この実装では、20ヘルツを超えるSIMフレームレートで、単一の色を撮像することができるが、提示システムにおける多色画像は電動発光フィルタホイールのスイッチング時間により制限されます。 sCMOSカメラチップのサイズが大きいため、多帯域発光フィルターと画像分割光学系の使用が可能であると同時に私を可能にしますなしスピードペナルティで複数の波長でmaging。別の可能性は、異なる励起レーザを交互に励起光を拒絶するためにマルチバンドノッチフィルタを使用することです。この実装ではバイナリ強誘電体SLMの使用も最適ではありません。そのようなSLMの回折効率は非常に低いので、入射光の大部分は、空間マスクによってフィルタリングされたゼロ次反射です。非常に高いフレームレートを必要とするアプリケーションの場合、イメージング速度は、従って、レーザダイオードの出力パワーによって制限されます。 SLMはまた、離れた画素はとして理想的な半波長板を動作させてください550 nmの設計波長からの波長に対する偏光のいくつかの楕円率を導入しています。この追加のLCVRを使用することによって補償することができるが、理想的な解決策は、パターン発生器などのデジタルマイクロミラーデバイス(DMD)を使用することができます。
可能な修飾
セットアップpresaの複数形ここnted柔軟性があり、より簡単に修正された市販の装置よりも、このような3D-SIM、高速2D-SIMように、他の画像診断法、多焦点SIM(MSIM)および非線形SIM(NL-SIM)は21,34,35を実装することができます。
2D-SIMは、末梢小胞体などの比較的平坦な、動きの速い構造を画像化するのに適しすることができます。周辺ERは、TIRFエバネッセント場を使用して照明することができるが、原因で、そのフラットな構造に無視できるピンボケ背景に、標準的な2D-SIMを使用して画像化することができるよりも細胞内の深くにあります。さらに、改良された光学セクショニング再構成アルゴリズムの使用は、光が光学的に厚いサンプルは、いえ軸方向分解能倍増が21必要とされないため、2D-SIMの使用を拡張するピンボケ抑制することができます。
MSIMでは、サンプルは、励起焦点36の疎な格子によって照明されます。この様式は、SM(単に空間マスクを除去することによって実現することができます)と偏光子によってそれを置き換えます。 SLMは現在、振幅変調器として動作します。 SLM上に表示されたバイナリSIM格子像面における回折限界の焦点の大きさに等しくなるように選択されたスポットのサイズが、スポットの2次元格子で置き換えることができます。 図7Aでは、4×4ピクセルの正方形の格子は13.62ミクロンの物理的なSLMのピクセルサイズを考えると、試料上に縮小時150×150nmの回折限界の焦点を生成するSLM(挿入図)に表示されます。励起の焦点は、次に、SLM上の格子パターンをシフトすることによって変換することができ、これは、視野全体を照明するために複数回繰り返されます。画像は各翻訳パターン位置とスタックのために取得されている倍までの解像度向上と再構成画像を得るために、ポスト処理され、  そして、同等の広視野画像と比較して、アウト・オブ・フォーカス光減少30。取得時間を伴う生フレームの数が多いに増加させるが、この様式は、例えば、染色された赤血球( 図7C)のような低コントラスト構造を標準SIMは不向きであるため厚く、高密度のサンプルを撮像するために有用であり得ます(この場合はN = 168)の視野ごとに必要。
そして、同等の広視野画像と比較して、アウト・オブ・フォーカス光減少30。取得時間を伴う生フレームの数が多いに増加させるが、この様式は、例えば、染色された赤血球( 図7C)のような低コントラスト構造を標準SIMは不向きであるため厚く、高密度のサンプルを撮像するために有用であり得ます(この場合はN = 168)の視野ごとに必要。
Li らによって最近提示最後に、セットアップは、高NAリニアTIRF-SIMまたはパターン化された活性化非線形SIM(PA NL-SIM)のいずれかを有効にするように変更することができる。、超高1.7 NAの客観的または付加を使用することによって405 nmの光活性化レーザとSLM格子パターン35の慎重な最適化。
将来の応用
SIMはまだ急速に進化技術であり、生命科学の多くのアプリケーションは、将来的に有効になります。技術のスピード、解像度、コントラストの強化と標準フルオロフォアメートルを使用する能力バイオイメージングのために、SIMは、例えば、共焦点及び広視野プラットフォームのような従来の多くの顕微鏡システムを置き換えるために設定されているEAN。商業用SIMシステムが決定的に、彼らは分野の最新の研究開発を実施するように変更し、開発される柔軟性がない、しかし、彼らは多くの研究機関の財務範囲を超えている、優れた技術仕様で、すでに今日利用可能である、と。彼らはまた、「手元の実験のために適合させる」ために必須の能力、エッジ生命科学研究を切削しばしば重大なボトルネックを欠いています。ここで説明するシステムは、再構成された二層系のインビトロ研究、材料、物理科学、表面の化学的性質を研究するために、 例えば 、細胞表面の近くに動的プロセスを研究するために特によく適しているであろう。 2Dの材料、および他の多くのアプリケーション。
開示事項
The authors have nothing to disclose.
謝辞
この作品はLeverhulmeトラスト、工学物理科学研究会議からの助成金によってサポートされていました[EP / H018301 / 1、EP / G037221 / 1];アルツハイマー病研究UK [ARUK-EG2012A-1];ウェルカム・トラスト[089703 / Z / 09 / Z]および医学研究審議会[MR / K015850 / 1、MR / K02292X / 1]。我々は、HEK293培養物の調製のために、それぞれLifeAct-GFPのトランスフェクションおよび細胞質-GFP細胞のためのE. AvezovとM.呂に感謝し、そしてW.陳。また、有益な議論や提案のための顕微鏡の設計の支援のためのK. O'Holleranに感謝し、そしてL.シャオとR. Heintzmann。
資料
| Name | Company | Catalog Number | Comments |
| 488 nm laser | Toptica | iBeam SMART | with digital modulation |
| 561 nm laser | Coherent | OBIS LS | with digital modulation |
| 640 nm laser | Cobolt | MLD | with digital modulation |
| Long-pass dichroic mirrors | Thorlabs | for combining excitation beams | |
| Quad band dichroic mirror | Chroma | ZT405/488/561/640rpc | 3 mm thick, TIRF imaging flat, mounted in Olympus BX filter cube |
| Quad band dichroic mirror | Chroma | ZT405/488/561/640rpc | From same batch as above, 25 x 25 mm |
| 1" square kinematic mount | Edmund Optics | 58-860 | |
| Glan-Taylor calcite polarizers | Thorlabs | GT5-A | For alignment of LCVR |
| Glan-Taylor mount | Thorlabs | SM05PM5 | |
| Achromatic half wave plate | Thorlabs | AHWP05M-600 | 400-800 nm |
| Rotation cage mount | Thorlabs | CRM1/M | For HWP |
| Liquid Crystal Variable Retarder | Meadowlark Optics | SWIFT | Custom built to provide full wave retardance over the range 488 to 640 nm. |
| LCVR controller | Meadowlark Optics | D3060HV | Two channel high voltage controller for liquid crystal retarders |
| Achromatic quarter wave plate | Meadowlark Optics | AQM-100-0545 | |
| Rotation cage mount | Thorlabs | CRM1P/M | For QWP |
| 10 mm achromatic doublet | Thorlabs | AC080-010-A-ML | For beam expander |
| 200 mm achromatic doublet | Thorlabs | AC254-200-A-ML | For beam expander |
| Cage XY Translators | Thorlabs | CXY1 | |
| Ferroelectric spatial light modulator | Forth Dimension Displays | M0787-00249 | SXGA-3DM (IFF) Microdisplay Type M249, 1,280 x 1,024 pixels, with driver board |
| SLM mounting frame | Forth Dimension Displays | M0787-10014 | Fixed to custom built aluminium mount |
| Ø50.8 mm Gimbal Mirror Mount | Thorlabs | GM200/M | For SLM mounting |
| Two-Axis Linear Translation Stage with Rotating Platform | Thorlabs | XYR1/M | For SLM mounting |
| Rail carrier | Newport | M-PRC-3 | For SLM mounting |
| Precision Optical Rail | Newport | PRL-6 | For SLM mounting |
| 300 mm achromatic doublet lens | Qioptiq | G322 273 322 | f = 300 mm, 31.5 mm diameter |
| 140 mm achromatic doublet lens | Qioptiq | G322 239 322 | f = 140 mm, 31.5 mm diameter |
| Precision XY Translation Mounts | Thorlabs | LM2XY | |
| Lens Mounting Adapters | Thorlabs | SM2AD32 | For mounting 31.5 mm lenses in 2" mounts |
| Translation stages | Comar | 12XT65 | Dovetail, side drive |
| XY Translator with Differential Drives | Thorlabs | ST1XY-D/M | for spatial filter |
| Rotation cage mount | Thorlabs | CRM1/M | for spatial filter |
| 300 mm achromatic doublet | Thorlabs | AC508-300-A-ML | Excitation tube lens |
| Automated XY stage with Z-piezo top plate | ASI | PZ-2150-XYFT-PZ-IX71 | with MS-2000 controller |
| Inverted microscope frame | Olympus | IX-71 | |
| Objective lens | Olympus | UAPON100XOTIRF | 100X/1.49NA |
| High speed filter wheel | Prior Scientific | HF110A | with Prior ProScan III controller |
| Bandpass emission filters | Semrock | FF01-525/30, FF01-676/29 | |
| sCMOS camera | Hamamatsu | ORCA Flash v4.0 | |
| Stage top incubator | OKO Lab | H301-K-FRAME | For live cell imaging, with Bold Line temperature and CO2 controllers |
| Stainless steel optical posts | Thorlabs | TR series | for mounting optical components |
| Post holders | Thorlabs | PH series | for mounting optical components |
| Kinematic mirror mounts | Thorlabs | KM100 | for mounting 1" mirrors |
| Shearing interferometer | Thorlabs | SI100 | |
| 100 nm fluorescent microspheres | Life Technologies | T-7279 | Tetraspeck |
| Rhodamine 6G | Sigma Aldrich | 83697-250MG | |
| 8 well glass bottom dishes | ibidi | 80827 | with #1.5 coverglass |
| Nunc Lab-Tek II Chambered Coverglass | Thermo Fisher Scientific | 155409 | with #1.5 coverglass |
| 0.01 mm microscope reticle slide | EMS | 68039-22 | |
| CellLight Tubulin-GFP, BacMam 2.0 | Thermo Fisher Scientific | C10613 |
参考文献
- Heintzmann, R., Cremer, C. G. Laterally modulated excitation microscopy: improvement of resolution by using a diffraction grating. BiOS Eur. 3568, 185-196 (1999).
- Gustafsson, M. G. L. Surpassing the lateral resolution limit by a factor of two using structured illumination microscopy. J. Microsc. 198 (2), 82-87 (2000).
- Shim, S. H., et al. Super-resolution fluorescence imaging of organelles in live cells with photoswitchable membrane probes. Proc. Natl. Acad. Sci. U. S. A. 109 (35), 13978-13983 (2012).
- Urban, N. T., Willig, K. I., Hell, S. W., Nägerl, U. V. STED Nanoscopy of Actin Dynamics in Synapses Deep Inside Living Brain Slices. Biophys. J. 101 (5), 1277-1284 (2011).
- Liu, Z., Lavis, L. D., Betzig, E. Imaging Live-Cell Dynamics and Structure at the Single-Molecule Level. Mol. Cell. 58 (4), 644-659 (2015).
- Westphal, V., et al. Video-Rate Far-Field Optical Nanoscopy Dissects Synaptic Vesicle Movement. Science. 320 (5873), 246-249 (2008).
- Davies, T., et al. CYK4 Promotes Antiparallel Microtubule Bundling by Optimizing MKLP1 Neck Conformation. PLOS Biol. 13 (4), e1002121 (2015).
- Laine, R. F., et al. Structural analysis of herpes simplex virus by optical super-resolution imaging. Nat. Commun. 6, 5980 (2015).
- Pinotsi, D., et al. Direct observation of heterogeneous amyloid fibril growth kinetics via two-color super-resolution microscopy. Nano Lett. 14 (1), 339-345 (2014).
- Esbjörner, E. K., et al. Direct observations of amyloid β Self-assembly in live cells provide insights into differences in the kinetics of Aβ(1-40) and Aβ(1-42) aggregation. Chem. Biol. 21 (6), 732-742 (2014).
- Michel, C. H., et al. Extracellular monomeric tau protein is sufficient to initiate the spread of tau protein pathology. J. Biol. Chem. 289 (2), 956-967 (2014).
- Pinotsi, D., Kaminski Schierle, G. S., Kaminski, C. F. Optical Super-Resolution Imaging of β-Amyloid Aggregation In Vitro and In Vivo: Method and Techniques. Syst. Biol. Alzheimer's Dis. SE - 6. 1303, 125-141 (2016).
- Axelrod, D. Cell-substrate contacts illuminated by total internal reflection fluorescence. J. Cell Biol. 89 (1), 141-145 (1981).
- Cragg, G. E., So, P. T. Lateral resolution enhancement with standing evanescent waves. Opt. Lett. 25 (1), 46-48 (2000).
- Chung, E., Kim, D., So, P. T. Extended resolution wide-field optical imaging: objective-launched standing-wave total internal reflection fluorescence microscopy. Opt. Lett. 31 (7), 945 (2006).
- Kner, P., Chhun, B. B., Griffis, E. R., Winoto, L., Gustafsson, M. G. L. Super-resolution video microscopy of live cells by structured illumination. Nat. Methods. 6 (5), 339-342 (2009).
- Fiolka, R., Shao, L., Rego, E. H., Davidson, M. W., Gustafsson, M. G. L. Time-lapse two-color 3D imaging of live cells with doubled resolution using structured illumination. Proc. Natl. Acad. Sci. U. S. A. 109 (14), 5311-5315 (2012).
- Brunstein, M., Wicker, K., Hérault, K., Heintzmann, R., Oheim, M. Full-field dual-color 100-nm super-resolution imaging reveals organization and dynamics of mitochondrial and ER networks. Opt. Express. 21 (22), 26162-26173 (2013).
- Förster, R., et al. Simple structured illumination microscope setup with high acquisition speed by using a spatial light modulator. Opt. Express. 22 (17), 20663 (2014).
- Lu-Walther, H. W., et al. fastSIM: a practical implementation of fast structured illumination microscopy. Methods Appl. Fluoresc. 3, 014001 (2015).
- Shaw, M., Zajiczek, L., O'Holleran, K. High speed structured illumination microscopy in optically thick samples. Methods. , (2015).
- von Olshausen, P. . Total internal reflection microscopy: super-resolution imaging of bacterial dynamics and dark field imaging. , (2012).
- Gustafsson, M. G. L., et al. Three-dimensional resolution doubling in wide-field fluorescence microscopy by structured illumination. Biophys. J. 94 (12), 4957-4970 (2008).
- Meadowlark Optics Inc. . Basic Polarization Techniques and Devices. , (2005).
- O'Holleran, K., Shaw, M. Polarization effects on contrast in structured illumination microscopy. Opt. Lett. 37 (22), 4603 (2012).
- Brankner, S. Z., Hobson, M. . Synchronization and Triggering with the ORCA-Flash4.0 Scientific CMOS Camera. , (2013).
- Gustafsson, M. G. L., et al. Three-dimensional resolution doubling in wide-field fluorescence microscopy by structured illumination. Biophys. J. 94 (12), 4957-4970 (2008).
- Wicker, K. Non-iterative determination of pattern phase in structured illumination microscopy using auto-correlations in Fourier space. Opt. Express. 21 (21), 24692 (2013).
- Boulanger, J., Pustelnik, N., Condat, L. Non-smooth convex optimization for an efficient reconstruction in structured illumination microscopy. 2014 IEEE 11th Int. Symp. Biomed. Imaging. 3 (1), 995-998 (2014).
- Ströhl, F., Kaminski, C. F. A joint Richardson-Lucy deconvolution algorithm for the reconstruction of multifocal structured illumination microscopy data. Methods Appl. Fluoresc. 3 (1), 014002 (2015).
- Mudry, E., et al. Structured illumination microscopy using unknown speckle patterns. Nat. Photonics. 6 (5), 312-315 (2012).
- Ayuk, R., et al. Structured illumination fluorescence microscopy with distorted excitations using a filtered blind-SIM algorithm. Opt. Lett. 38 (22), 4723 (2013).
- Ball, G., et al. SIMcheck: a Toolbox for Successful Super-resolution Structured Illumination Microscopy. Sci. Rep. 5, 15915 (2015).
- York, A. G., et al. Resolution doubling in live, multicellular organisms via multifocal structured illumination microscopy. Nat. Methods. 9 (7), 749-754 (2012).
- Li, D., et al. Extended-resolution structured illumination imaging of endocytic and cytoskeletal dynamics. Science. 349 (6251), (2015).
- York, A. G., et al. Resolution doubling in live, multicellular organisms via multifocal structured illumination microscopy. Nat. Methods. 9 (7), 749-754 (2012).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved