需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
共价结合的抗体,以纤维素纸光盘及其裸眼比色法免疫分析应用
摘要
In this manuscript, periodate oxidation and glutaraldehyde cross-linking methods for covalent immobilization of antibodies on paper discs are presented. The binding activity of immobilized antibodies was evaluated. Based on these results, a glutaraldehyde cross-linking method was used to develop a novel paper-based immunoassay for immunoglobulin G (IgG) detection.
摘要
该报告提出了捕获抗体对纤维素滤纸级第1号(中流动滤纸)光盘和品位第113号(快流过滤纸)盘共价固定两种方法。这些纤维素纸圆片通过硅烷偶联技术与胺官能团接枝分别固定在它们之前的抗体。高碘酸盐氧化和戊二醛交联方法被用来接枝的纤维素纸光盘捕获抗体。为了确保捕获抗体与固定后其目标的最大结合容量,不同浓度的高碘酸钠,戊二醛,和纸张的盘的表面上的捕获抗体的效果进行了研究。相比于高碘酸氧化法时通过戊二醛交联剂涂布在胺官能化的纤维素纸的光盘,该抗体显示增强对目标结合活性。 IgG抗体(小鼠参考血清)用作参考目标在这项研究中,通过戊二醛测试共价固定化抗体的应用。一种新的纸质,酶联免疫吸附测定(ELISA)已成功开发和验证用于检测IgG抗体。此方法不需要设备,它可以检测100纳克/毫升的IgG。快速流滤纸比介质流滤纸更敏感。这个实验的潜伏期很短,所需的小样本量。这种裸眼,比色免疫测定可以扩展,以检测与常规的ELISA确定的其他目标。
引言
在床边血糖检测(POCT)诊断性研究是对新战略的发展疗法,个性化医疗和家庭护理1重要。纤维素论文被广泛应用于免疫作为平台,因为它们价格便宜,方便,并为用户所熟悉2。此外,纤维素纸的多孔结构具有以驱动液体流动没有额外的能量冲击力。纸基生物分析的记录可早在20 世纪 ,当纸层析最初发明于1952年,最普遍的例子是免疫测试3,如妊娠糖尿病试纸发现。这些测试提供了相对快速的检测时间和廉价的分析4。由于其简单性,这些常规纸带试验已广泛应用于POCT诊断5。
检测方法包括色度6,电化学7,和电化学发光8的方法已被报道用于测量生物样品中的目标。除了这些定量方法,用于固定在纤维素纸的抗体的可靠方法也是诊断设备的开发非常重要。具体的非吸附是用于修改纸基装置9,10的表面上的抗体,以确保固定后最大结合容量到其目标的主要策略。然而,先前的研究中 表明,被吸附到纤维素纸抗体可以通过40%从纤维11解吸。因此,直接吸附抗体的纤维素上可能不会提供可重复的结果12。被纸张表面上的接枝的抗体的共价固定是开发有效的纸基生物分析13的另一种方法。各种方法已被报道用于纤维素14,15的变形。理想情况下,抗体应该保持固定12日后其原有功能。羰基与1-氰基-4- dimethylaminopyridinium四氟硼酸16相结合;通过紫外线基于激活策略17,18 1-氟-2-硝基-4- azidobenzene;基于木聚糖改性19酶法战略; 1,4- phenylenediisothiocyanate连接剂20;杂氧化21点击化学22;和阳离子卟啉23已被用于共价固定在纤维素纸的生物分子。脱乙酰壳多糖改性的纸张已被用于开发基于纸张immunodevices 24-26,因为它是丰富的,生物相容的27。壳聚糖是阳离子,并强烈坚持的阴离子纤维素27。捕捉抗体被固定在通过壳聚糖涂层和戊二醛交联的纸。碘酸氧化是嫁接上尉的另一种方法在纤维素纸28 URE抗体。在该方法中,高碘酸钠点样在纸上直接转换1,2-二羟基(乙二醇)基团在纤维素到醛基。然后醛基被用于形成多糖和抗体28之间形成共价键。虽然制造很简单,它是很难完全洗出高碘酸钠。未洗涤的高碘酸钠可引起该被固定在纤维素纸的抗体的进一步氧化,影响抗体的活性和稳定性N - (3-二甲氨基丙基) - N -ethylcarbodiimide盐酸盐和N-羟基交联剂也可用于共价固定化于基于纳米纤维的测定29的显影静电纺丝聚L-乳酸和醋酸纤维素纳米纤维的抗体。
在这项研究中,硅烷耦合技术用于嫁接cellulos胺官能团Ë纸片。这种技术有助于保留原孔隙尺寸,芯吸和纤维素滤纸的过滤速度,从而最大垂直流过在免疫测定。硅烷偶技术已广泛应用于生物传感器官能与仲胺基基材表面,接着进一步修饰使用的生物分子。胺基的基质表面上接枝包括有机官能硅烷试剂的-OH基团和矩阵基板30之间的缩合反应。纤维素纸圆片至3-丙基三甲氧基硅烷(APS)31与由硅烷偶胺基官能化。其次,通过使用两种不同的方法共价固定化的捕获抗体。第一种方法涉及到胺功能纤维素纸碟碘酸氧化捕获抗体结合。第二种方法使用戊二醛作为交联剂附着捕获antibodi下载到胺基团官能化的纤维素纸的光盘。捕获抗体的存在用兔抗人IgG-异硫氰酸荧光素(FITC)证实,使用荧光分子成像仪。到山羊抗兔IgG兔抗人IgG-FITC的结合活性也通过过氧化物酶底物进行评价。各种浓度的高碘酸钠,戊二醛,和捕捉抗体的效果进行了研究。通过检测的IgG血清的混合物成功地进行了固定的捕获抗体的应用试验。
研究方案
1.纤维素纸片嫁接胺功能团
- 准备一块方形纸用的使用打孔器1厘米* 1厘米,和100纸片从1级号纤维素纸用直径为6.0毫米(中流量滤纸)制成的尺寸。
- 以导出在纸张盘-NH 2基团,在50毫升的玻璃瓶中通风柜混合1毫升APS和10毫升丙酮。纸张盘添加到新鲜制备的APS试剂混合物中,并孵育5小时,在室温下32轨道搅拌(200rpm)。
注意:处理APS和丙酮在通风柜。 - 从倒出50毫升的玻璃酒瓶多余的溶液成一个有机废弃物容器中。
- 10ml丙酮加入玻璃瓶,拌匀完全倒出,以消除任何未反应的APS和其他杂质。重复此步骤两次。
- 铺在纸巾和地点纸片在110℃烘箱中3小时。允许纸片冷却。在室温下储存在50ml离心管中的光盘。
- 使用傅立叶变换红外光谱(FTIR)来检查纤维素正方形纸胺基的接枝,如下所述( 图3A)。
- 打开电脑,打开红外光谱仪。
- 打开红外光谱的软件。
- 进入"测量→初始化"。对于"BS:溴化钾"矩形"灯:红外线"和"激光"会当初始化完成后变为绿色。
- 选择"数据"矩形下方,并选择"%透光度','HAPP-Genzel','45','4.0'和'最小:400,最大:4000"代表"测量模式","变迹","没有。的扫描","分辨率"和"范围(-1)'。
- 点击"措施"。
- 选择"数据文件"的背景资料。写下来的意见。
- 点击"BKG"能为背景的基线。
- 固定在膜样品保持器的正方形的纸张。
- 选择"数据文件'的样本数据。写下意见。
- 点击"样本",以获得样品的光谱。
- 关闭红外光谱应用和关闭计算机。
- 重复上述步骤(步骤1.1-1.6)以制备胺-官能化级113号纤维素正方形纸和光盘(快流滤纸),将获得的FTIR光谱的113级号正方形纸( 图3B)。
抗体对胺官能化纤维素纸影碟2.共价固定化
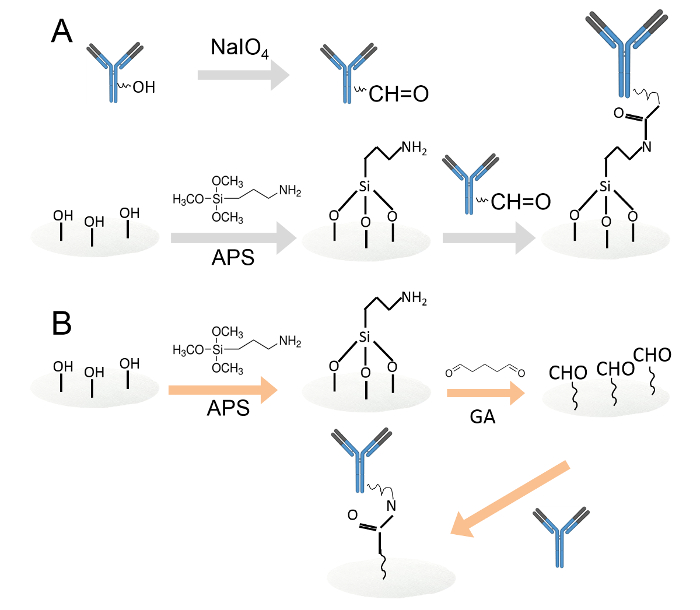
由两种不同的方法图1.抗体的共价固定。一,固定在通过高碘酸氧化胺官能化的纤维素纸碟抗体。所述碳水化合物残基被高碘酸钠氧化,产生醛官能团。然后,被氧化的抗体加载到胺官能纤维素纸盘; B。然后将抗体固定于通过戊二醛胺官能纤维素纸光盘。该胺官能化纤维素纸圆片浸入0.05%戊二醛溶液引入醛基,以在纸的光盘。清洗后,抗体抬上醛功能化的纸片。 请点击此处查看该图的放大版本。
- 固定在通过高碘酸盐氧化( 图1A)胺官能纤维素纸光盘抗体。
- 将1微升2.5毫米perioda钠德与2微升的0.1毫克/毫升的兔抗人IgG-FITC和7微升100mM pH5.5的在1.5ml管醋酸缓冲液中,并孵育在黑暗中的混合物30分钟。
注:按照此体积比,如果必要准备更氧化的抗体。改变的体积比,以优化高碘酸钠和兔抗人IgG-FITC的浓度。 - (; pH为7.4的PBS),以40微升的最终体积的50mM磷酸盐缓冲液30微升稀释上述抗体溶液中。
- 准备三胺官能介质流滤纸盘和三个胺官能快流纸盘(如在第1节中所述)。
- 负载5微升高碘酸钠氧化的兔抗人IgG-FITC的在每个介质流滤纸盘和8微升到每个快流滤纸光盘。保持这些纸片在黑暗中在室温下1小时。
- 用0.2ml洗涤迷洗各纸盘尔(50mM Tris缓冲液用0.15M NaCl和0.05%表面活性剂,pH值7.4)。重复洗涤三次。
- 通过荧光分子成像器拍摄的荧光图像,以确定每个纤维素纸圆盘32上的抗体的存在。使用空白纸张光盘(在没有高碘酸钠的相同浓度的抗体处理的)作为对照( 图S1至图S3)。
注:对于实验优化,改变需要被优化,并固定其他参数的浓度一个参数的浓度。高荧光强度增加了被固定在纤维素纸圆盘捕捉抗体的量。
- 将1微升2.5毫米perioda钠德与2微升的0.1毫克/毫升的兔抗人IgG-FITC和7微升100mM pH5.5的在1.5ml管醋酸缓冲液中,并孵育在黑暗中的混合物30分钟。
- 通过戊二醛( 图1B)固定在胺官能化纤维素纸光盘抗体。
- 添加三APS处理介质流滤纸盘和三个快速流滤纸盘(宫cribed在第1)至2ml含有0.05%戊二醛1小时,在室温下用轨道搅拌的50mM PBS(pH 7.4)中的。
注意:在通风柜拉手戊二醛。 - 将每个三个盘在2个1.5 ml离心管中。将1ml的去离子(DI)水添加至每个管并摇动试管10秒。通过用移液管抽吸除去水。重复两次以除去任何未反应的戊二醛。
- 负载5微升25微克/毫升的兔抗人IgG-FITC(捕获抗体)到每个醛官能介质流滤纸盘的,并加入8微升到每个醛官能快流滤纸光盘。孵育在黑暗中在室温下大约20分钟。然后,添加10微升的50mM PBS(pH 7.4)中,以各文件盘的不除去抗体并孵育40分钟,胺醛反应。
- 用纸巾上的顶部0.2毫升洗涤缓冲液洗纸光盘。重复洗两次。
- 通过荧光分子成像仪拍摄的荧光图像检查抗体的每个纤维素纸盘33的存在。使用空白纸片作为对照。
注意:在图4中 ,'0'表示该用在没有戊二醛FITC的抗体的相同的浓度处理的空白纸张的光盘;在图5A中 ,空白纸圆片用戊二醛处理过,但没有FITC的抗体加载到纸张光盘。
- 添加三APS处理介质流滤纸盘和三个快速流滤纸盘(宫cribed在第1)至2ml含有0.05%戊二醛1小时,在室温下用轨道搅拌的50mM PBS(pH 7.4)中的。
- 干燥在37℃的纸张盘(从2.1和2.2节)10分钟。
- 方框15微升封闭缓冲液的纸盘(10%脱脂奶粉在50mM Tris缓冲液,pH 7.4,用0.15M NaCl)中,在室温下10分钟。
- 负载5微升并在PBS 8微升过氧化物酶缀合的山羊抗兔IgG(1:10,000)到中流量和快速流滤纸光盘,分别孵育在室温下暗30分钟。
- 用纸巾上的顶部0.2毫升洗涤缓冲液洗纸光盘。重复洗涤三次。
注意:这是没有必要以除去洗涤缓冲液作为结果不会受到缓冲。 - 加载3,3',5,5'-四甲基联苯胺(TMB)和过氧化氢溶液的10微升混合物到每个盘。
- 采取用数码相机或智能电话的纸张盘的图像孵育5分钟后。
注意:在图5B中 ,"0"表示该用戊二醛处理过的纸张的光盘,随后装载抗体-HRP(辣根过氧化物酶)偶联物在不存在的FITC抗体。
3.纸张为基础的ELISA IgG的检测
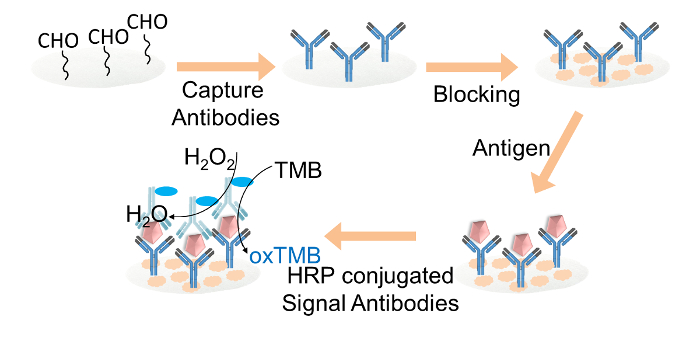
图2.纸张基于ELISA FO的示意图řIgG的检测。捕获抗体共价固定在通过戊二醛的醛官能纤维素纸光盘。纤维素纸圆片用封闭缓冲液。然后目标的IgG加入到该光盘,随后HRP-缀合的信号的抗体的加载。最后,TMB和过氧化氢混合溶液装入每个纸片的颜色显示。 请点击此处查看该图的放大版本。
- 溶于5ml 0.05%戊二醛溶液(在50mM PBS缓冲液,pH 7.4制备)添加到20ml的玻璃瓶中。浸泡在该溶液中15胺官能介质流滤纸盘和保持1小时,在室温下摇动。
- 同时,重复步骤3.1准备另外15醛功能化的快速流动滤纸片上。
注意事项:在通风处理戊二醛引擎盖。
- 同时,重复步骤3.1准备另外15醛功能化的快速流动滤纸片上。
- 从纸片中除去未反应的戊二醛,放置在一个15毫升的离心管中的15个中流量滤纸光盘,和15快流滤纸盘在另一15ml离心管。 5毫升DI水添加到每个管并摇动试管10秒。通过用移液管抽吸除去水。重复两次以除去任何未反应的戊二醛。
- 干燥在37℃的烘箱纸张光盘。
- 加入5微升和8微升0.025毫克/毫升小鼠IgG-Fc片段的抗体的每个中流量和快速流滤纸光盘,分别的,并孵育20分钟。
- 添加10微升的50mM PBS(pH 7.4)中,以各文件盘的不除去抗体并孵育40分钟,胺醛反应。
- 用纸巾上的顶部0.2毫升洗涤缓冲液洗纸光盘。重复洗涤三次。
- 干燥烘箱中的纸片在37℃。
- 块纸片W¯¯第i个15微升,在室温下10分钟阻断缓冲液中。
- 洗每个纸片用纸巾上的顶部0.2毫升洗涤缓冲液中。重复洗涤三次。
- 运行的IgG标准。
- 负载10微升各种IgG的浓度( 例如 ,0,10,125,250,和500在PBS纳克/毫升)上一式三份每个盘。孵育在室温下1小时。
- 用纸巾上的顶部0.2毫升洗涤缓冲液洗纸光盘。重复洗涤三次。
- 负载10微升HRP缀合的小鼠IgG-Fc片段抗体(1:10,000,10毫的PBS,pH 7.4)中,并孵育在室温下1小时。
- 用纸巾上的顶部0.2毫升洗涤缓冲液洗纸光盘。重复洗涤三次。
注意:这是没有必要以除去洗涤缓冲液作为结果不受缓冲剂的存在。 - 加载TMB的10微升混合物和过氧化氢在每个光盘上。
- ŧ所有纸的光盘AKE图片包含有5分钟温育后的数字照相机或智能电话。
注意:在图6A中 ,"0"表示用捕捉抗体的固定化处理过的纸的光盘,并且没有IgG的血清抗体-辣根过氧化物酶/ TMB溶液。 - 分析每个文件盘的强度按图J.图像中
- 转换步骤3.15'的.tif"格式拍摄的图像。
- 打开"图片J'的软件。
- 转到"文件→打开",选择图像进行分析。
- 选择形状按钮,"椭圆形"。
- 进入"图像→类型→32位"。
- 进入"编辑→反相"。
- 转到"分析→测量"。
- 复制并在电子表格进行数据分析。
结果
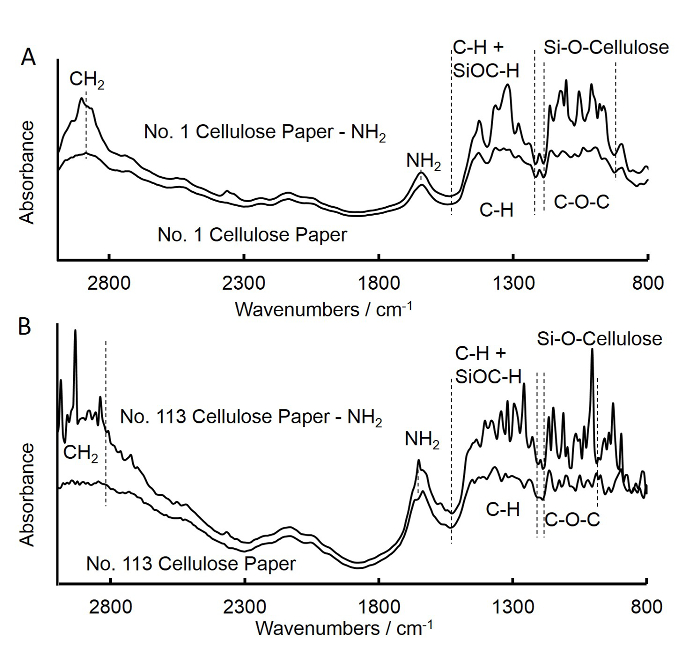
图3. 傅立叶变换未处理和APS处理的介质流过滤器正方形纸(A)和快速流过滤器正方形纸(B)A的红外(FTIR)光谱 。对于未处理的介质流过滤器正方形纸谱是相似的APS处理介质流过滤器正方形纸。在902-1,170 -1和1,210-1,500厘米-1为APS处理方纸乐队中强度的增加分别属于SiO...
讨论
进行亲和纯化的山羊抗小鼠IgG-Fc的捕获上未修饰的纤维素纸光盘抗体的直接涂覆,以检测的IgG的浓度。结果表明,在捕捉抗体的进一步固定需要重复性。硅烷技术被成功地用于引入胺官能团的纤维素纸的光盘34。 APS的浓度会影响抗体的固定。因此,APS的丙酮的量也进行了优化。在10ml丙酮1毫升的APS是用于通过戊二醛交联剂接枝抗体的固定化的胺基团的最佳浓度。抗体嫁接用高碘酸氧化和戊...
披露声明
The authors have nothing to disclose.
致谢
This work was financially supported by the Ministry of Education, Singapore through the Translational and Innovation Grant (MOE2012-TIF-2-G-009).
材料
| Name | Company | Catalog Number | Comments |
| Cellulose filter paper, Grade 1 (medium flow filter paper) | GE Healthcare Pte Ltd Singapore | 1001 110 | |
| Cellulose filter paper, Grade 113 (Fast flow filter paper) | Sigma-Aldrich, Singapore | 1113-320 | |
| Glutaraldehyde | Sigma-Aldrich, Singapore | G6257 | Grade II, 25% in H2O |
| Surfactant | Tween-20, Sigma-Aldrich, Singapore | P2287 | |
| Bovine serum album | Sigma-Aldrich, Singapore | A2153 | |
| Skimmed milk powder | Louis François | Packed by Kitchen Capers, Singapore | |
| Tris base | Promega | H5135 | |
| Sodium periodate | Merck | 106597 | |
| Na2HPO4 | Merck | 106585 | |
| KH2PO4 | Merck | 104873 | |
| NaCl | CALBIOCHEM | 567441 | |
| NaOH | Merck | 106462 | |
| HCl | Merck | 100317 | |
| phosphate buffer saline (PBS) | N/A | N/A | PBS, containing 137 mmol/L NaCl, 2.7 mmol/L KCl, 8.0 mmol/L Na2HPO4 and 1.5 mmol/L KH2PO4, is prepared with water and adjusted to pH 7.4 with 0.1 mol/L NaOH or 0.1 mol/L HCl |
| Acetone | Tee Hai Chem Pte Ltd Singapore | 9005-68 | |
| Mixture of TMB and hydrogen peroxide solution | 1-Step ultra TMB-ELISA solution , Thermo Scientific Pierce | 34029 | 1 L |
| Rabbit anti-human IgG-FITC | TWC/Bio Pte Ltd Singapore | sc-2278 | |
| Peroxidase conjugated goat anti-rabbit IgG | TWC/Bio Pte Ltd Singapore | sc-2030 | |
| Affinity purified goat anti-Mouse IgG-Fc coating antibody | Bethyl Laboratories, Inc | A90-131A | |
| Mouse reference serum | Bethyl Laboratories, Inc | RS10-101-5 | 9.5 mg/ml |
| HRP conjugated goat anti-mouse IgG-Fc detection antibody | Bethyl Laboratories, Inc | A90-131P | |
| Equipment | |||
| Fourier transform infrared spectrophotometer | Shimadzu IR Prestige-21 | N/A | |
| Fluorescence molecular imager | Pharos FXTM plus molecular imager, Bio-Rad, Singapore | N/A | |
| Oven | NUVE FN500 | N/A | |
| Turbo mixer VM-2000 | MYC LTD | N/A | |
| ImageJ | RGB, free download | N/A |
参考文献
- Curtis, K. A., Rudolph, D. L., Owen, S. M. Rapid detection of HIV-1 by reverse-transcription, loop-mediated isothermal amplification (RT-LAMP). J. Virol. Methods. 151 (2), 264-270 (2008).
- Martinez, A. W., Phillips, S. T., Carrilho, E., Thomas, S. W., Sindi, H., Whitesides, G. M. Simple telemedicine for developing regions: camera phones and paper-based microfluidic devices for real-time, off-site diagnosis. Anal. Chem. 80 (10), 3699-3707 (2008).
- Lode, P. V. Point-of-care immunotesting: approaching the analytical performance of central laboratory methods. Clin. Biochem. 38 (7), 591-606 (2005).
- Posthuma-Trumpie, G. A., Amerongen, A. V., Korf, J., Berkel, W. J. V. Perspectives for on-site monitoring of progesterone. Trends Biotechnol. 27 (11), 652-660 (2009).
- Lim, D. V., Simpson, J. M., Kearns, E. A., Kramer, M. F. Current and developing technologies for monitoring agents of bioterrorism and biowarfare. Clin. Microbiol. Rev. 18 (4), 583-607 (2005).
- Li, X., Tian, J., Shen, W. Progress in patterned paper sizing for fabrication of paperbased microfluidic sensors. Cellulose. 17 (3), 649-659 (2010).
- Nie, Z., et al. Electrochemical sensing in paper-based microfluidic devices. Lab Chip. 10, 477-483 (2010).
- Delaney, J. L., Hogan, C. F., Tian, J., Shen, W. Electrogenerated chemiluminescence detection in paper-based microfluidic sensors. Anal. Chem. 83 (4), 1300-1306 (2011).
- Oh, Y. K., Joung, H. A., Kim, S., Kim, M. G. Vertical flow immunoassay (VFA) biosensor for a rapid one-step immunoassay. Lab Chip. 13 (5), 768-772 (2013).
- Cheng, C. M., et al. Paper-based ELISA. Angew. Chem. 122 (28), 4881-4884 (2010).
- Jarujamrus, P., Tian, J., Li, X., Siripinyanond, A., Shiowatana, J., Shen, W. Mechanisms of red blood cells agglutination in antibody-treated paper. Analyst. 137 (9), 2205-2210 (2012).
- Credou, J., Volland, H., Dano, J., Berthelot, T. A one-step and biocompatible cellulose functionalization for covalent antibody immobilization on immunoassay membranes. J. Mat. Chem. B. 1, 3277-3286 (2013).
- Kong, F., Hu, Y. F. Biomolecule immobilization techniques for bioactive paper fabrication. Anal. Bioanal. Chem. 403, 7-13 (2012).
- Orelma, H., Teerinen, T., Johansson, L. S., Holappa, S., Laine, J. CMC-modified cellulose biointerface for antibody conjugation. Biomacromolecules. 13, 1051-1058 (2013).
- Yu, A., et al. Biofunctional paper via covalent modification of cellulose. Langmuir. 28 (30), 11265-11273 (2012).
- Stollner, D., Scheller, F. W., Warsinke, A. Activation of cellulose membranes with 1,1′-carbonyldiimidazole or 1-cyano-4-dimethylaminopyridinium tetrafluoroborate as a basis for the development of immunosensors. Anal Biochem. 304 (2), 157-165 (2002).
- Bora, U., Sharma, P., Kannan, K., Nahar, P. Photoreactive cellulose membrane - a novel matrix for covalent immobilization of biomolecules. J. Biotechnol. 126 (2), 220-229 (2006).
- Sharma, P., Basir, S. F., Nahar, P. Photoimmobilization of unmodified carbohydrates on activated surface. J Colloid Interface Sci. 342 (1), 202-204 (2010).
- Brumer, H., Zhou, Q., Baumann, M. J., Carlsson, K., Teeri, T. T. Activation of crystalline cellulose surfaces through the chemoenzymatic modification of xyloglucan. J. Am. Chem. Soc. 126 (18), 5715-5721 (2004).
- Araujo, A. C., Song, Y., Lundeberg, J., Stahl, P. L., Brumer, H. Activated paper surfaces for the rapid hybridization of DNA through capillary transport. Anal Chem. 84 (7), 3311-3317 (2012).
- Xu, C., Spadiut, O., Araujo, A. C., Nakhai, A., Brumer, H. Chemo-enzymatic Assembly of Clickable Cellulose Surfaces via Multivalent Polysaccharides. ChemSusChem. 5 (4), 661-665 (2012).
- Filpponen, I., et al. Generic method for modular surface modification of cellulosic materials in aqueous medium by sequential "click" reaction and adsorption. Biomacromolecules. 13 (3), 736-742 (2012).
- Feese, E., Sadeghifar, H., Gracz, H. S., Argyropoulos, D. S., Ghiladi, R. A. Photobactericidal porphyrin-cellulose nanocrystals: synthesis, characterization, and antimicrobial properties. Biomacromolecules. 12 (10), 3528-3539 (2011).
- Zang, D., Ge, L., Yan, M., Song, X., Yu, J. Electrochemical immunoassay on a 3D microfluidic paper-based device. Chem. Commun. 48 (39), 4683-4685 (2012).
- Ge, L., Yan, J. X., Song, X. R., Yan, M., Ge, S. J., Yu, J. H. Three-dimensional paper-based electrochemiluminescence immunodevice for multiplexed measurement of biomarkers and point-of-care testing. Biomaterials. 33 (4), 1024-1031 (2012).
- Wang, S., et al. Paper-based chemiluminescence ELISA: lab-on-paper based on chitosan modified paper device and wax-screen-printing. Biosens. Bioelectron. 31 (1), 212-218 (2012).
- Koev, S. T., et al. Chitosan: an integrative biomaterial for lab-on-a-chip devices. Lab Chip. 10, 3026-3042 (2010).
- Wang, S. M., et al. Simple and covalent fabrication of a paper device and its application in sensitive chemiluminescence immunoassay. Analyst. 137 (16), 3821-3827 (2012).
- Sadira, S., Prabhakaranc, M. P., Wicaksonob, D. H. B., Ramakrishna, S. Fiber based enzyme-linked immunosorbent assay for C-reactive protein. Sensor Actuat B-Chem. 205, 50-60 (2014).
- Koga, H., Kitaoka, T., Isogai, A. In situ modification of cellulose paper with amino groups for catalytic applications. J. Mater. Chem. 21, 9356-9361 (2011).
- Klemm, D., Heublein, B., Fink, H. P., Bohn, A. Cellulose: fascinating biopolymer and sustainable raw material. Angew. Chem., Int. Ed. 44 (22), 3358-3393 (2005).
- Fernandes, S. C. M., et al. Bioinspired antimicrobial and biocompatible bacterial cellulose membranes obtained by surface functionalization with aminoalkyl groups. ACS Appl. Mater. Interfaces. 5 (8), 3290-3297 (2013).
- . . Pharos FX plus molecular imager instructions, Catalog Number 170-9460. , (2005).
- Tee, Y. B., Talib, R. A., Abdan, K., Chin, N. L., Basha, R. K., Yunos, K. F. M. Aminosilane-grafted cellulose. BioResourses. 8 (3), 4468-4483 (2013).
- Xing, Y., et al. Bioconjugated quantum dots for multiplexed and quantitative immunohistochemistry. Nat Protoc. 2, 1152-1165 (2007).
- Guidi, A., Laricchia-Robbio, L., Gianfaldoni, D., Revoltella, R., Del Bono, G. Comparison of a conventional immunoassay (ELISA) with a surface plasmon resonance-based biosensor for IGF-1 detection in cows' milk. Biosens Bioelectron. 16, 971-977 (2001).
- Ahmed, S., Bui, M. N., Abbas, A. Paper-based chemical and biological sensors: Engineering aspects. Biosens Bioelectron. 77, 249-263 (2016).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。