A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
קשר הקוולנטי של נוגדני דיסקי נייר תאיים ואת היישומים שלהם ב Immunoassays מדד-צבע Naked-עין
In This Article
Summary
In this manuscript, periodate oxidation and glutaraldehyde cross-linking methods for covalent immobilization of antibodies on paper discs are presented. The binding activity of immobilized antibodies was evaluated. Based on these results, a glutaraldehyde cross-linking method was used to develop a novel paper-based immunoassay for immunoglobulin G (IgG) detection.
Abstract
דוח זה מציג שני שיטות הקיבוע קוולנטי של נוגדנים לכידים על כיתת נייר תאי מסנן מס '1 (נייר סינון בינוני זרימה) דיסקים ו כיתת מס' 113 (נייר סינון מהיר זרימה) דיסקים. דיסקי נייר התאיים אלה היו מורכבים עם קבוצות פונקציונליות אמינות באמצעות טכניקת צימוד silane לפני הנוגדנים היו משותקים עליהם. חמצון glutaraldehyde periodate צולב מקשרי שיטות שמשו שתל נוגדנים לכידים על דיסקי נייר התאי. על מנת להבטיח את קיבולת מחייב המקסימלי של הנוגדנים הלכידים לייעדם לאחר קיבוע, את ההשפעות של ריכוזים שונים של נתרן periodate, glutaraldehyde, ונוגדנים ללכוד על פני השטח של דיסקי נייר נחקרו. הנוגדנים שהיו מצופים על דיסקי נייר תאי פונקציונלי האמינים באמצעות סוכן glutaraldehyde cross-linking הראו משופרת פעילות מחייבת את היעד כשמשווה את שיטת חמצון periodate. IgG (בסרום עכבר הפניה) שמש כיעד התייחסות במחקר זה לבחון את היישום של נוגדנים משותקים קוולנטית דרך glutaraldehyde. Assay immunosorbent חדש המבוסס על נייר, enzyme-linked (ELISA) פותח בהצלחה ומאומת לצורך זיהוי של IgG. שיטה זו אינה דורשת ציוד, והוא יכול לזהות 100 ng / ml של IgG. העיתון מסנן במהירות הזרימה היה יותר רגיש מאשר נייר הסינון הבינוני-זרימה. תקופת הדגירה של assay זה היה קצר נדרש כרכים מדגם קטן. בעין בלתי מזוינת זה, ניתן להאריך immunoassay colorimetric לזהות מטרות אחרות המזוהות עם קונבנציונאלי ELISA.
Introduction
הבדיקות בנקודת הטיפול (POCT) מחקר אבחון חשוב לפיתוח אסטרטגיות חדשות עבור תרופות, רפואה אישית, ואת הטיפול הביתי 1. ניירות תאיות נמצאות בשימוש נרחב כמו פלטפורמות ב immunoassays, כפי שהם זולים, נגישים, ומוכר למשתמשים 2. בנוסף, המבנה הנקבובי של נייר תאי בעל הכח לנהוג זרימת נוזל ללא השפעת אנרגיה נוספת. רשום של bioanalysis מבוסס נייר ניתן למצוא מוקדם ככל המאה ה -20, כאשר כרומטוגרפיה נייר הומצא ראשון בשנת 1952. הדוגמא הנפוצה ביותר היא בדיקות immunochromatographic 3, כגון רצועות בדיקת הריון וסוכרת. בדיקות אלה מספקים פעמי assay מהירות יחסית וניתוח זול 4. בשל הפשטות שלהם, בדיקות רצועת נייר הרגילות אלה כבר בשימוש נרחב אבחון POCT 5.
שיטות איתור לרבות אלקטרו colorimetric 6,כימי 7, ו electrochemiluminescence 8 שיטות דווחו למדוד מטרות דגימות ביולוגיות. בנוסף שיטות כמותיות אלה, שיטה אמינה עבור משתק נוגדנים על נייר תאי חשובה גם לפיתוח מכשירים לאבחון. ספיחה שאינו ספציפי היא האסטרטגיה העיקרית שינוי לנוגדנים על פני השטח של מכשירים מבוססי נייר 9, 10 על מנת להבטיח קיבולת מחייב המקסימלי ליעדם לאחר קיבוע. עם זאת, מחקר קודם נוגדנים הראה כי הם נספגים על נייר תאי יכולים desorb מהסיבי 11 ב -40%. לכן, ספיחה ישירה של נוגדנים על תאית לא יכולה לספק תוצאות לשחזור 12. קוולנטיים וקיבוע של נוגדנים כי הם מורכבים על משטחי נייר הוא שיטה חלופית לפתח bioassays מבוסס נייר שנכנס לתוקף ב -13. שיטות שונות דווחו על השינוי של תאית 14, 15 . באופן אידיאלי, נוגדנים צריכים לשמור על פונקציונליות המקורית שלהם לאחר קיבוע 12. Carbonyldiimidazole בשילוב עם 1-cyano-4-dimethylaminopyridinium tetrafluoroborate 16; 1-fluoro-2-נטר-4-azidobenzene באמצעות אסטרטגית הפעלה מבוססת-UV 17, 18; אסטרטגיה chemoenzymatic מבוסס על 19 שינוי xyloglucan; סוכן מקשר 1,4-phenylenediisothiocyanate 20; חמצון 21 heteropolysaccharide כימיה לחץ 22; ו פורפירינים קטיוני 23 שימשו כדי לשתק ביומולקולות קוולנטית על נייר תאית. Chitosan שונה נייר נעשה שימוש כדי לפתח בסיס נייר immunodevices 24-26 שכן הוא שופע ביולוגי 27. Chitosan הוא קטיוני דבק בתוקף תאית anionic 27. הנוגדנים הלכידים הם משותקים על הנייר באמצעות ציפוי chitosan ו glutaraldehyde cross-linking. חמצון periodate שיטה אחרת עבור השתלת קפטנוגדנים יור על הנייר התאי 28. בשיטה זו, periodate נתרן הוא הבחין על הנייר להמיר קבוצות 1,2-dihydroxyl (גליקול) תאית ישירות לקבוצות אלדהיד. קבוצות אלדהיד משמשות ליצירת קשרים קוולנטיים בין סוכרים ונוגדנים 28. למרות הייצור הוא פשוט, קשה לשטוף periodate נתרן לחלוטין. Periodate נתרן הרחוץ יכול לגרום התחמצנות נוספת של הנוגדנים הם משותקים על הנייר התאי, המשפיע על הפעילות ויציבות של הנוגדנים N -. (3-dimethylaminopropyl) - N hydrochloride -ethylcarbodiimide ו- N linkers צלב -hydroxysuccinimide משמש גם כדי קוולנטית לשתק נוגדנים על nanofibers יצטט תאית והחומצה פולי- L- לקטית electrospun לפיתוח מבחנים מבוסס nanofiber 29.
במחקר זה, טכניקת צימוד silane שמשה שתל קבוצות פונקציונליות אמינות על cellulosדיסקי נייר דואר. טכניקה זו מסייעת לשמור על הגודל הנקבובי המקורי, פתילה, וסינון שיעור של ניירות לסנן תאית, מה שמאפשר immunoassays זרימה דרך אנכי מרבי. טכניקת צימוד silane כבר בשימוש נרחב biosensors כדי functionalize משטחי מצע עם קבוצות אמין משניות, ואחריו ביומולקולות באמצעות שינויים נוספים. ההשתלה של קבוצות אמינות על פני שטח מטריקס מהווה תגובת דחיסה בין קבוצות -OH של סוכני מצע מטריקס silane organofunctional 30. דיסקי הנייר התאיים היו פונקציונליים עם קבוצות אמינות על ידי צימוד silane באמצעות 3-aminopropyltrimethoxysilane (APS) 31. זאת בעקבות נוגדנים לכידת משתק קוולנטית באמצעות שתי שיטות שונות. השיטה הראשונה מעורבת מחייב של נוגדנים לכידים periodate מתחמצנים ל דיסקי נייר תאי פונקציונלי האמינים. השיטה השנייה השתמשו glutaraldehyde כסוכן cross-linking לצרף את לכידת antibodies את דיסקי נייר תאית קבוצה פונקציונלית האמינים. נוכחות נוגדנים לכידת אושרה על ידי isothiocyanate אנטי אנושי ארנב IgG-והעמסת (FITC), באמצעות תרמי מולקולרי פלואורסצנטי. הפעילות מחייבת שפן אנטי אנושי IgG-FITC כדי עז IgG נגד הארנב גם הוערכה על ידי מצע peroxidase. ההשפעות של ריכוזים שונים של נתרן periodate, glutaraldehyde, ונוגדנים ללכוד נחקרו. מבחן היישום של הנוגדן ללכוד משותקת בוצע בהצלחה באמצעות זיהוי של סרום IgG.
Protocol
1. קבוצות הארכת אמינים פונקציונליות על דיסקי נייר תאיים
- הכן פיסת נייר מרובע עם מימד של 1 ס"מ × 1 ס"מ, 100 דיסקים נייר עשויים מנייר תאית כיתה מס '1 בקוטר של 6.0 מ"מ (נייר סינון בינוני זרימה) באמצעות אגרוף חור.
- לגזור -NH 2 קבוצות על דיסקים נייר, לערבב 1 APS מ"ל ו -10 מ"ל אצטון בתוך בקבוק זכוכית 50 מ"ל ב למכסה המנוע קטר. להוסיף דיסקים נייר לתערובת מגיב מוכן טרי APS, דגירה במשך 5 שעות עם ערבוב מסלולית (200 סל"ד) בטמפרטורת החדר 32.
זהירות: טפל APS ואצטון למכסת מנוע הקטר. - למזוג פתרון עודף מהבקבוק זכוכית 50 מ"ל לתוך מיכל פסולת אורגנית.
- הוסף 10 מ"ל של אצטון לבקבוק זכוכית, מערבבים היטב למזוג לחלוטין להסיר כל APS unreacted וזיהומים אחרים. חזור על פעולה זו פעמיים.
- מורחים את הדיסקים נייר על מגבת נייר ומניחים בתנור C 110 מעלות במשך 3 שעות. אפשרדיסקי נייר לצינון. לאחסן את התקליטורים שפופרת 50 מ"ל צנטריפוגות בטמפרטורת החדר.
- השתמש ספקטרוסקופיית פורה (FTIR) כדי לבדוק את השתלת קבוצות האמינו על הנייר המרובע התאי, כמתואר להלן (איור 3 א).
- הפעל את המחשב ולפתוח את המכשיר ספקטרוסקופיה FTIR.
- פתח את תוכנת ספקטרוסקופיה FTIR.
- עבור אל 'מדידת → האתחול'. המלבנים עבור 'BS: KBR', 'מנורה: אינפרא אדום' ו 'לייזר' יהפוך לירוק כאשר אתחול נגמר.
- בחר "נתונים" מתחת מלבנים, ובחר '% העברה', 'Happ-גנזל', '45', '4.0', ו 'Min: 400, מקס: 4000' עבור 'מצב מדידה "," אפודיציה', ' לא. סריקות ',' החלטה ', ו' הטווח (סנטימטר-1) ".
- לחץ על 'מדוד'.
- בחר "קובץ נתונים 'עבור נתוני רקע. לִכתוֹבבמורד התגובות.
- לחץ על 'BKG' כדי לקבל את הבסיס עבור הרקע.
- תקן את הנייר המרובע על בעל מדגם סרט.
- בחר "קובץ נתונים 'עבור נתוני המדגם. רשום את ההערות.
- לחץ על 'מדגם' להשיג את הספקטרום למדגם.
- סגור את יישום ספקטרוסקופיה FTIR ולכבות את המחשב.
- חזור על השלבים לעיל (שלבי 1.1 עד 1.6) כדי להכין 113 מס 'כיתה אמינה-פונקציונלי נייר תאי מרובע ודיסקים (נייר סינון מהיר זרימה), ולקבל את ספקטרום FTIR עבור נייר מרובע כיתת מס' 113 (איור 3).
2. קוולנטיים קיבוע של נוגדנים על דיסקי נייר תאיים האמין פונקציונליים
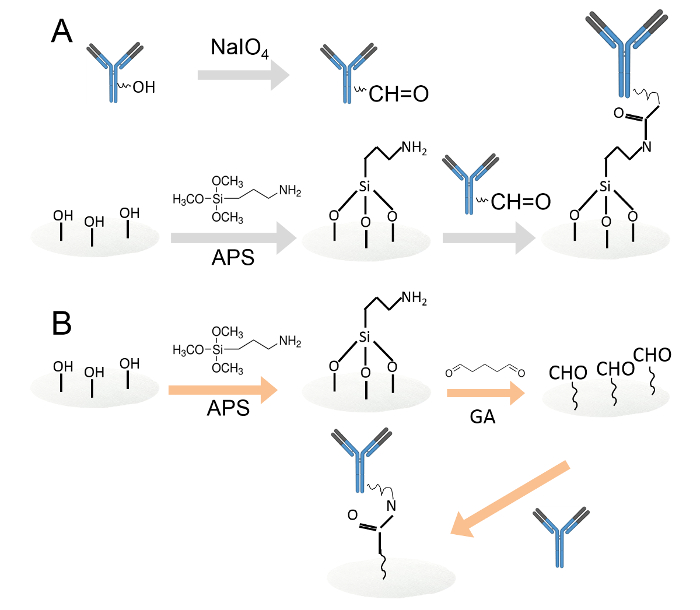
איור 1. קוולנטיים וקיבוע של נוגדנים על ידי שתי שיטות שונות.א. נוגדנים משותקים על דיסקי נייר תאיים אמינים פונקציונלי באמצעות חמצון periodate. שאריות הפחמימות היו חמצון על ידי נתרן periodate לייצר קבוצות פונקציונליות אלדהיד. לאחר מכן, נוגדני החמצון הועמסו דיסקי נייר תאיים פונקציונלי אמינים. B. הנוגדנים היו משותקים ואילך דיסקי נייר תאי פונקציונלי אמינים דרך glutaraldehyde. דיסקי הנייר התאיים פונקציונלי האמינים הושרו בתמיסת glutaraldehyde 0.05% להכניס קבוצות אלדהיד את דיסקי נייר. לאחר כביסה, נוגדנים הועמסו על דיסקי נייר פונקציונלי אלדהיד. אנא לחץ כאן כדי לצפות בגרסה גדולה יותר של דמות זו.
- לשתק נוגדנים על דיסקי נייר תאיים פונקציונלי אמינים באמצעות חמצון periodate (איור 1 א).
- מערבבים 1 μl של 2.5 מ"מ נתרן periodate עם 2 μl של 0.1 מ"ג / מ"ל ארנב אנטי אנושי IgG-FITC ו -7 μl של 100 מ"מ pH 5.5 חיץ אצטט צינור 1.5 מ"ל, ו דגירה תערובת בחושך במשך 30 דקות.
הערה: בצע יחס נפח זה להכין נוגדנים מושחרים יותר במידת צורך. שינוי יחס נפח כדי לייעל את הריכוז של periodate נתרן אנטי אנושי IgG-FITC ארנב. - לדלל את הפתרון נוגדן מעל עם 30 μl של 50 מ"מ חיץ מלוחים פוספט (PBS; pH 7.4) לנפח סופי של 40 μl.
- להכין שלושה דיסקים אמינים פונקציונליים בינוני זרימת מסנן נייר ושלושה פונקציונליים-אמין דיסקי נייר מהר-זרימה (כמתואר בסעיף 1).
- טען 5 μl של הארנב נתרן periodate חמצון אנטי אנושי IgG-FITC על כל דיסק בינוני זרימה מסנן נייר 8 μl על כל דיסק נייר סינון מהיר זרימה. שמור דיסקים נייר אלה בחושך במשך שעה אחת בטמפרטורת החדר.
- לשטוף כל דיסק נייר עם 0.2 מיליליטר של חובב כביסהאה (50 מ"מ טריס חיץ עם 0.15 M NaCl ו 0.05 פעילי שטח%, pH 7.4). חזור על לשטוף שלוש פעמים.
- צלם את תמונות הקרינה באמצעות תרמי מולקולרי פלואורסצנטי לזהות הנוכחות של נוגדנים בכל דיסק נייר תאי 32. להשתמש בתקליטורי נייר ריק (שטופלו באותו ריכוז של נוגדנים בהעדר periodate נתרן) כביקורת (איור S1 איור S3).
הערה: לקבלת אופטימיזציה ניסיון, לשנות את הריכוז של פרמטר אחד כי צריך להיות מותאמים ולתקן הריכוזים של כל פרמטרים האחרים. עוצמת קרינה גבוהה מגדילה את כמות הנוגדנים לכידים כי הם משותקים על דיסקי נייר התאי.
- מערבבים 1 μl של 2.5 מ"מ נתרן periodate עם 2 μl של 0.1 מ"ג / מ"ל ארנב אנטי אנושי IgG-FITC ו -7 μl של 100 מ"מ pH 5.5 חיץ אצטט צינור 1.5 מ"ל, ו דגירה תערובת בחושך במשך 30 דקות.
- לשתק נוגדנים על דיסקי נייר תאי פונקציונליים אמינים דרך glutaraldehyde (האיור 1B).
- מוסיף את הדיסקים בינוני זרימה מסננת פיסת נייר מיוחדת השלושה APS ואת דיסקי נייר סינון השלושה מהר-זרימה (described בסעיף 1) 2 מ"ל של 50 מ"מ PBS (pH 7.4) המכיל glutaraldehyde 0.05% במשך שעה 1, עם ערבוב מסלולית בטמפרטורת החדר.
זהירות: טפל glutaraldehyde למכסת מנוע הקטר. - מניחים שלושה דיסקים בכל בשני צינורות 1.5 מ"ל צנטריפוגות. הוסף 1 מ"ל של deionized (DI) מים על צינור אחד ולנער צינורות במשך 10 שניות. הסר את המים על ידי aspirating עם טפטפת. חזור פעמיים נוספות כדי להסיר כל glutaraldehyde unreacted.
- טען 5 μl של 25 מיקרוגרם / מיליליטר ארנב נגד לנוגדנים אנושיים-FITC (נוגדן ללכוד) על כל דיסק נייר סינון בינוני זרימה פונקציונלית-אלדהיד, ולהוסיף 8 μl על כל דיסק נייר סינון אלדהיד פונקציונלי במהירות זרימה. דגירה בחושך במשך כ 20 דקות בטמפרטורת החדר. לאחר מכן, להוסיף 10 μl של 50 מ"מ PBS (pH 7.4) לכל דיסק נייר מבלי להסיר את הנוגדנים ו דגירה של 40 דקות עבור התגובה אלדהיד אמין.
- לשטוף את הדיסקים נייר עם 0.2 מ"ל של חיץ הכביסה על גבי מגבת נייר. חזור עללשטוף פעמיים.
- צלם את תמונות הקרינה באמצעות תרמי מולקולרי פלואורסצנטי כדי לבדוק את הימצאותם של נוגדנים בכל דיסק נייר תאי 33. להשתמש בתקליטורי נייר ריקים כביקורת.
הערה: באיור 4, '0' מייצג את הדיסק נייר ריק וטופל ריכוז זהה של FITC-נוגדן בהעדר glutaraldehyde; באיור 5A, את דיסקי נייר הריקים טופלו glutaraldehyde, אבל אף נוגדני FITC הועמסו על דיסקי נייר.
- מוסיף את הדיסקים בינוני זרימה מסננת פיסת נייר מיוחדת השלושה APS ואת דיסקי נייר סינון השלושה מהר-זרימה (described בסעיף 1) 2 מ"ל של 50 מ"מ PBS (pH 7.4) המכיל glutaraldehyde 0.05% במשך שעה 1, עם ערבוב מסלולית בטמפרטורת החדר.
- יבש את הדיסקים נייר (מ בסעיפים 2.1 ו -2.2) בשעה 37 מעלות צלזיוס במשך 10 דקות.
- חסום את הדיסקים נייר עם 15 μl של חיץ חסימת (10% ברפרוף אבקת חלב ב 50 מ"מ טריס חיץ, pH 7.4, עם 0.15 M NaCl) במשך 10 דקות בטמפרטורת החדר.
- טען 5 μl ו -8 μl של מצומדות peroxidase IgG נגד ארנב עז ב PBS (1: 10,000) על זרימת בינוני ודיסקים נייר סינון מהיר זרימה, בהתאמה. דגירה30 דקות בחושך בטמפרטורת החדר.
- לשטוף את הדיסקים נייר עם 0.2 מ"ל של חיץ הכביסה על גבי מגבת נייר. חזור על לשטוף שלוש פעמים.
הערה: אין צורך להסיר את חיץ הכביסה כמו התוצאות אינן מושפעות למאגר. - טען תערובת 10 μl של 3,3 ', 5,5'-tetramethylbenzidine (TMB) פתרון מי חמצן על כל דיסק.
- קח תמונות של דיסקי נייר עם מצלמה דיגיטלית או טלפון חכם לאחר 5 דקות של דגירה.
הערה: איור 5 ב, '0' מייצג את הדיסקים נייר טופלו glutaraldehyde, ואחריו טעינת נוגדן-HRP (peroxidase צנון סוס) המצומד בהעדר FITC-נוגדן.
3. נייר מבוסס ELISA עבור IgG איתור
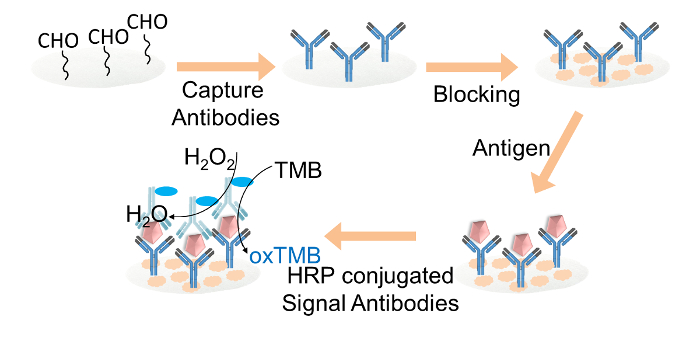
איור 2. ייצוג סכמטי של ELISA מבוסס נייר FOזיהוי r IgG. לכידת נוגדנים היו משותקים קוולנטית על דיסקי נייר תאי פונקציונלי-אלדהיד דרך glutaraldehyde. דיסקי הנייר התאיים נחסמו עם חסימת חיץ. יעד IgG נוספה אז את הדיסקים, ואחריו את הטעינה של HRP-מצומדות נוגדני אות. לבסוף, את תערובת חמצן ומימן TMB הפתרון הועמס כל דיסק נייר את הודעת הצבע. אנא לחץ כאן כדי לצפות בגרסה גדולה יותר של דמות זו.
- הוסף 5 מ"ל של תמיסת glutaraldehyde 0.05% (מוכן 50 חיץ מ"מ PBS, pH 7.4) על בקבוק זכוכית 20 מ"ל. לטבול 15 דיסקי נייר סינון אמינים פונקציונלי בינוני זרימה בפתרון זה ולשמור במשך שעה 1 עם רעד בטמפרטורת חדר.
- במקביל, חזור על שלב 3.1 להכין עוד 15 דיסקי נייר סינון פונקציונליים אלדהיד במהירות זרימה.
זהירות: טפל glutaraldehyde של קטרמכסה מנוע.
- במקביל, חזור על שלב 3.1 להכין עוד 15 דיסקי נייר סינון פונקציונליים אלדהיד במהירות זרימה.
- כדי להסיר glutaraldehyde unreacted מתקליטורי הנייר, הנח 15 הדיסקים בינוני זרימה מסנן נייר צינור צנטריפוגות 15 מ"ל, ו -15 דיסקים במהירות זרימת מסנן הנייר עוד 15 צינור צנטריפוגות מ"ל. הוסף 5 מ"ל מים DI צינור אחד ולנער צינורות במשך 10 שניות. הסר את המים על ידי aspirating עם טפטפת. חזור פעמיים כדי להסיר כל glutaraldehyde unreacted.
- ייבש את דיסקי נייר בתנור 37 מעלות צלזיוס.
- הוסף 5 μl ו -8 μl של 0.025 מ"ג / מ"ל נוגדנים שבר העכבר IgG-Fc לכל אחד הדיסקים בינוני זרימה מהירה זרימת מסנן נייר, בהתאמה, ו דגירה במשך 20 דקות.
- הוסף 10 μl של 50 מ"מ PBS (pH 7.4) לכל דיסק נייר מבלי להסיר את הנוגדנים ו דגירה של 40 דקות עבור התגובה אלדהיד אמין.
- לשטוף את הדיסקים נייר עם 0.2 מ"ל של חיץ הכביסה על גבי מגבת נייר. חזור על לשטוף שלוש פעמים.
- ייבש את דיסקי נייר בתנור על 37 מעלות צלזיוס.
- חסום את הדיסקים נייר wה- i 15 μl של חיץ חסימת במשך 10 דקות בטמפרטורת החדר.
- לשטוף כל דיסק נייר עם 0.2 מ"ל של חיץ הכביסה על גבי מגבת נייר. חזור על לשטוף שלוש פעמים.
- הפעל סטנדרטי IgG.
- טען 10 μl של ריכוזי IgG שונים (למשל, 0, 10, 125, 250, ו -500 ng / ml ב PBS) על כל דיסק בשלושה עותקים. דגירה עבור שעה 1 בטמפרטורת החדר.
- לשטוף את הדיסקים נייר עם 0.2 מ"ל של חיץ הכביסה על גבי מגבת נייר. חזור על לשטוף שלוש פעמים.
- טען 10 μl של העכבר מצומדות HRP IgG-Fc נוגדנים שבר (1: 10,000, 10 מ"מ PBS, pH 7.4), ו דגירה במשך שעה 1 בטמפרטורת החדר.
- לשטוף את הדיסקים נייר עם 0.2 מ"ל של חיץ הכביסה על גבי מגבת נייר. חזור על לשטוף שלוש פעמים.
הערה: אין צורך להסיר את חיץ הכביסה כמו התוצאות אינן מושפעות על ידי הנוכחות של מאגר. - טען תערובת 10 μl של TMB ואת מי חמצן על כל דיסק.
- Tתמונות אקה של כל הדיסקים נייר עם מצלמה דיגיטלית או טלפון חכם לאחר 5 דקות של דגירה.
הערה: באיור 6A, '0' עומד דיסקים פיסת נייר מיוחד עם קיבוע נוגדן ללכוד, והפתרון נוגדן-HRP / TMB ללא סרום IgG. - לנתח את העוצמה של כל דיסק נייר בתמונה לפי תמונות J.
- המר את התמונות שצולמו בשלב 3.15 לפורמט '.tif'.
- התוכנה פותחת את 'תמונת J'.
- עבור אל 'קובץ → פתח ", לבחור את התמונה כדי לנתח.
- בחר את לחצן הצורה 'הסגלגל ".
- עבור אל '→ תמונה סוג → 32 ביט ".
- עבור אל 'הפוך → ערוך'.
- עבור אל 'נתח → מדוד'.
- העתק ולנתח את הנתונים בגיליון אלקטרוני.
תוצאות
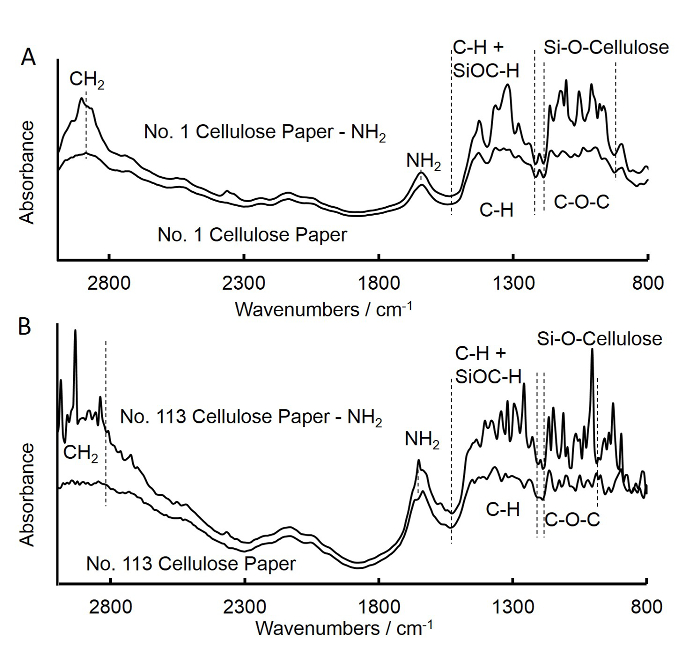
פורה איור 3. להפוך ספקטרום אינפרא אדום (FTIR) נייר מרובע מסנן בינוני זרימת מטופל APS שטופל (א) ונייר כיכר במהירות זרימת המסנן (B). א. הספקטרום עבור נייר מרובע מסנן בינוני זרימת מט?...
Discussion
ציפוי ישיר של נוגדן ללכוד IgG-Fc אנטי העכבר עז מטוהרת זיקה על דיסקי נייר תאיים ללא שינוי בוצע כדי לזהות ריכוזי IgG. התוצאות הצביעו על כך, קיבעון נוסף של הנוגדנים הלכידים נדרש עבור שחזור. טכניקת silane שמשה בהצלחה להציג קבוצות פונקציונליות אמינות אל הדיסקים התאיים נייר 34.
Disclosures
The authors have nothing to disclose.
Acknowledgements
This work was financially supported by the Ministry of Education, Singapore through the Translational and Innovation Grant (MOE2012-TIF-2-G-009).
Materials
| Name | Company | Catalog Number | Comments |
| Cellulose filter paper, Grade 1 (medium flow filter paper) | GE Healthcare Pte Ltd Singapore | 1001 110 | |
| Cellulose filter paper, Grade 113 (Fast flow filter paper) | Sigma-Aldrich, Singapore | 1113-320 | |
| Glutaraldehyde | Sigma-Aldrich, Singapore | G6257 | Grade II, 25% in H2O |
| Surfactant | Tween-20, Sigma-Aldrich, Singapore | P2287 | |
| Bovine serum album | Sigma-Aldrich, Singapore | A2153 | |
| Skimmed milk powder | Louis François | Packed by Kitchen Capers, Singapore | |
| Tris base | Promega | H5135 | |
| Sodium periodate | Merck | 106597 | |
| Na2HPO4 | Merck | 106585 | |
| KH2PO4 | Merck | 104873 | |
| NaCl | CALBIOCHEM | 567441 | |
| NaOH | Merck | 106462 | |
| HCl | Merck | 100317 | |
| phosphate buffer saline (PBS) | N/A | N/A | PBS, containing 137 mmol/L NaCl, 2.7 mmol/L KCl, 8.0 mmol/L Na2HPO4 and 1.5 mmol/L KH2PO4, is prepared with water and adjusted to pH 7.4 with 0.1 mol/L NaOH or 0.1 mol/L HCl |
| Acetone | Tee Hai Chem Pte Ltd Singapore | 9005-68 | |
| Mixture of TMB and hydrogen peroxide solution | 1-Step ultra TMB-ELISA solution , Thermo Scientific Pierce | 34029 | 1 L |
| Rabbit anti-human IgG-FITC | TWC/Bio Pte Ltd Singapore | sc-2278 | |
| Peroxidase conjugated goat anti-rabbit IgG | TWC/Bio Pte Ltd Singapore | sc-2030 | |
| Affinity purified goat anti-Mouse IgG-Fc coating antibody | Bethyl Laboratories, Inc | A90-131A | |
| Mouse reference serum | Bethyl Laboratories, Inc | RS10-101-5 | 9.5 mg/ml |
| HRP conjugated goat anti-mouse IgG-Fc detection antibody | Bethyl Laboratories, Inc | A90-131P | |
| Equipment | |||
| Fourier transform infrared spectrophotometer | Shimadzu IR Prestige-21 | N/A | |
| Fluorescence molecular imager | Pharos FXTM plus molecular imager, Bio-Rad, Singapore | N/A | |
| Oven | NUVE FN500 | N/A | |
| Turbo mixer VM-2000 | MYC LTD | N/A | |
| ImageJ | RGB, free download | N/A |
References
- Curtis, K. A., Rudolph, D. L., Owen, S. M. Rapid detection of HIV-1 by reverse-transcription, loop-mediated isothermal amplification (RT-LAMP). J. Virol. Methods. 151 (2), 264-270 (2008).
- Martinez, A. W., Phillips, S. T., Carrilho, E., Thomas, S. W., Sindi, H., Whitesides, G. M. Simple telemedicine for developing regions: camera phones and paper-based microfluidic devices for real-time, off-site diagnosis. Anal. Chem. 80 (10), 3699-3707 (2008).
- Lode, P. V. Point-of-care immunotesting: approaching the analytical performance of central laboratory methods. Clin. Biochem. 38 (7), 591-606 (2005).
- Posthuma-Trumpie, G. A., Amerongen, A. V., Korf, J., Berkel, W. J. V. Perspectives for on-site monitoring of progesterone. Trends Biotechnol. 27 (11), 652-660 (2009).
- Lim, D. V., Simpson, J. M., Kearns, E. A., Kramer, M. F. Current and developing technologies for monitoring agents of bioterrorism and biowarfare. Clin. Microbiol. Rev. 18 (4), 583-607 (2005).
- Li, X., Tian, J., Shen, W. Progress in patterned paper sizing for fabrication of paperbased microfluidic sensors. Cellulose. 17 (3), 649-659 (2010).
- Nie, Z., et al. Electrochemical sensing in paper-based microfluidic devices. Lab Chip. 10, 477-483 (2010).
- Delaney, J. L., Hogan, C. F., Tian, J., Shen, W. Electrogenerated chemiluminescence detection in paper-based microfluidic sensors. Anal. Chem. 83 (4), 1300-1306 (2011).
- Oh, Y. K., Joung, H. A., Kim, S., Kim, M. G. Vertical flow immunoassay (VFA) biosensor for a rapid one-step immunoassay. Lab Chip. 13 (5), 768-772 (2013).
- Cheng, C. M., et al. Paper-based ELISA. Angew. Chem. 122 (28), 4881-4884 (2010).
- Jarujamrus, P., Tian, J., Li, X., Siripinyanond, A., Shiowatana, J., Shen, W. Mechanisms of red blood cells agglutination in antibody-treated paper. Analyst. 137 (9), 2205-2210 (2012).
- Credou, J., Volland, H., Dano, J., Berthelot, T. A one-step and biocompatible cellulose functionalization for covalent antibody immobilization on immunoassay membranes. J. Mat. Chem. B. 1, 3277-3286 (2013).
- Kong, F., Hu, Y. F. Biomolecule immobilization techniques for bioactive paper fabrication. Anal. Bioanal. Chem. 403, 7-13 (2012).
- Orelma, H., Teerinen, T., Johansson, L. S., Holappa, S., Laine, J. CMC-modified cellulose biointerface for antibody conjugation. Biomacromolecules. 13, 1051-1058 (2013).
- Yu, A., et al. Biofunctional paper via covalent modification of cellulose. Langmuir. 28 (30), 11265-11273 (2012).
- Stollner, D., Scheller, F. W., Warsinke, A. Activation of cellulose membranes with 1,1′-carbonyldiimidazole or 1-cyano-4-dimethylaminopyridinium tetrafluoroborate as a basis for the development of immunosensors. Anal Biochem. 304 (2), 157-165 (2002).
- Bora, U., Sharma, P., Kannan, K., Nahar, P. Photoreactive cellulose membrane - a novel matrix for covalent immobilization of biomolecules. J. Biotechnol. 126 (2), 220-229 (2006).
- Sharma, P., Basir, S. F., Nahar, P. Photoimmobilization of unmodified carbohydrates on activated surface. J Colloid Interface Sci. 342 (1), 202-204 (2010).
- Brumer, H., Zhou, Q., Baumann, M. J., Carlsson, K., Teeri, T. T. Activation of crystalline cellulose surfaces through the chemoenzymatic modification of xyloglucan. J. Am. Chem. Soc. 126 (18), 5715-5721 (2004).
- Araujo, A. C., Song, Y., Lundeberg, J., Stahl, P. L., Brumer, H. Activated paper surfaces for the rapid hybridization of DNA through capillary transport. Anal Chem. 84 (7), 3311-3317 (2012).
- Xu, C., Spadiut, O., Araujo, A. C., Nakhai, A., Brumer, H. Chemo-enzymatic Assembly of Clickable Cellulose Surfaces via Multivalent Polysaccharides. ChemSusChem. 5 (4), 661-665 (2012).
- Filpponen, I., et al. Generic method for modular surface modification of cellulosic materials in aqueous medium by sequential "click" reaction and adsorption. Biomacromolecules. 13 (3), 736-742 (2012).
- Feese, E., Sadeghifar, H., Gracz, H. S., Argyropoulos, D. S., Ghiladi, R. A. Photobactericidal porphyrin-cellulose nanocrystals: synthesis, characterization, and antimicrobial properties. Biomacromolecules. 12 (10), 3528-3539 (2011).
- Zang, D., Ge, L., Yan, M., Song, X., Yu, J. Electrochemical immunoassay on a 3D microfluidic paper-based device. Chem. Commun. 48 (39), 4683-4685 (2012).
- Ge, L., Yan, J. X., Song, X. R., Yan, M., Ge, S. J., Yu, J. H. Three-dimensional paper-based electrochemiluminescence immunodevice for multiplexed measurement of biomarkers and point-of-care testing. Biomaterials. 33 (4), 1024-1031 (2012).
- Wang, S., et al. Paper-based chemiluminescence ELISA: lab-on-paper based on chitosan modified paper device and wax-screen-printing. Biosens. Bioelectron. 31 (1), 212-218 (2012).
- Koev, S. T., et al. Chitosan: an integrative biomaterial for lab-on-a-chip devices. Lab Chip. 10, 3026-3042 (2010).
- Wang, S. M., et al. Simple and covalent fabrication of a paper device and its application in sensitive chemiluminescence immunoassay. Analyst. 137 (16), 3821-3827 (2012).
- Sadira, S., Prabhakaranc, M. P., Wicaksonob, D. H. B., Ramakrishna, S. Fiber based enzyme-linked immunosorbent assay for C-reactive protein. Sensor Actuat B-Chem. 205, 50-60 (2014).
- Koga, H., Kitaoka, T., Isogai, A. In situ modification of cellulose paper with amino groups for catalytic applications. J. Mater. Chem. 21, 9356-9361 (2011).
- Klemm, D., Heublein, B., Fink, H. P., Bohn, A. Cellulose: fascinating biopolymer and sustainable raw material. Angew. Chem., Int. Ed. 44 (22), 3358-3393 (2005).
- Fernandes, S. C. M., et al. Bioinspired antimicrobial and biocompatible bacterial cellulose membranes obtained by surface functionalization with aminoalkyl groups. ACS Appl. Mater. Interfaces. 5 (8), 3290-3297 (2013).
- . . Pharos FX plus molecular imager instructions, Catalog Number 170-9460. , (2005).
- Tee, Y. B., Talib, R. A., Abdan, K., Chin, N. L., Basha, R. K., Yunos, K. F. M. Aminosilane-grafted cellulose. BioResourses. 8 (3), 4468-4483 (2013).
- Xing, Y., et al. Bioconjugated quantum dots for multiplexed and quantitative immunohistochemistry. Nat Protoc. 2, 1152-1165 (2007).
- Guidi, A., Laricchia-Robbio, L., Gianfaldoni, D., Revoltella, R., Del Bono, G. Comparison of a conventional immunoassay (ELISA) with a surface plasmon resonance-based biosensor for IGF-1 detection in cows' milk. Biosens Bioelectron. 16, 971-977 (2001).
- Ahmed, S., Bui, M. N., Abbas, A. Paper-based chemical and biological sensors: Engineering aspects. Biosens Bioelectron. 77, 249-263 (2016).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved