Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
Selüloz Kağıt Diskler ve Çıplak göz Kolorimetrik İmmüno Onların Uygulamaları antikorların bağlama Kovalent
Bu Makalede
Özet
In this manuscript, periodate oxidation and glutaraldehyde cross-linking methods for covalent immobilization of antibodies on paper discs are presented. The binding activity of immobilized antibodies was evaluated. Based on these results, a glutaraldehyde cross-linking method was used to develop a novel paper-based immunoassay for immunoglobulin G (IgG) detection.
Özet
Bu rapor, selüloz filtre kağıdı notu 1 No'lu (orta akış filtre kağıdı) diskler ve sınıf sayılı 113 (hızlı akış filtre kağıdı) disklerine yakalama antikorların kovalent immobilizasyonu için iki yöntem sunar. antikorlar, bunların üzerinde hareketsiz önce bu selüloz kağıt diskler bir silan birleştirme tekniği ile amin fonksiyonel grubu ile aşılanmıştır. Periodat oksitleme ve glutaraldehid çapraz bağlama yöntemleri selüloz kağıt diskler üzerinde yakalama antikorları graft için kullanılmıştır. immobilizasyon sonra hedeflere antikorlarla maksimum bağlama kapasitesini sağlamak için, sodyum periodat, glutaraldehid ve kağıt diskler yüzeyi üzerinde antikorlarla çeşitli konsantrasyonlarda etkisi araştırılmıştır. periodat oksitleme yöntemine göre bir glutaraldehid çapraz bağlama maddesi yoluyla amin fonksiyonlu selüloz kağıt diskler üzerinde kaplanmıştır antikorlar hedef bağlanma aktivitesi geliştirilmiş gösterdi. (Fare referans serumda) IgG glutaraldehit yoluyla kovalent olarak hareketsizleştirilmiş antikor uygulamasını test etmek için bu çalışmada referans hedef olarak kullanıldı. Yeni bir kağıt bazlı, enzime bağlı immünosorbent deneyi (ELISA), başarılı bir şekilde geliştirilmiştir ve IgG saptanması için doğrulanmıştır. Bu yöntem, ekipman gerektirmez ve IgG 100 ng / ml algılayabilir. Hızlı akışlı filtre kağıdı orta akış filtre kağıdı daha duyarlıydı. Bu testin kuluçka süresi kısa ve küçük bir örnek hacimleri gerekli. Bu çıplak gözle, kolorimetrik immunoassay geleneksel ELISA ile tespit edilir diğer hedefleri tespit etmek için uzatılabilir.
Giriş
Nokta-bakım testi (POCT) tanı çalışma tedavi için yeni stratejilerin geliştirilmesi, kişiselleştirilmiş tıp ve ev bakımı 1 için çok önemlidir. Onlar, ucuz erişilebilir ve kullanıcılara 2 tanıdık gibi selüloz kağıtları yaygın bağışıklık platformlarda olarak kullanılır. Buna ek olarak, selüloz kağıt gözenekli yapısı ek enerji etkisi olmadan sıvı akışını sürücü güce sahip. Kağıt tabanlı biyo analizler kayıtları gibi erken en yaygın örneği hamilelik ve diyabet test şeritleri olarak immünokromatografik testleri 3, 1952 yılında kağıt kromatografisi ilk icat edildi 20. yüzyılın olarak bulunabilir. Bu testler nispeten hızlı tahlil süreleri ve ucuz analizi 4 sağlamaktadır. Nedeniyle bunların basitliği, bu geleneksel kağıt şerit testler yaygın POCT teşhis 5 kullanılmıştır.
Kolorimetrik 6, elektro dahil saptama yöntemleriKimyasal 7 ve elektrokemiluminesans 8 Yöntem biyolojik numunelerde hedeflerini ölçmek için rapor edilmiştir. Bu sayısal yöntemlere ek olarak, selüloz kağıt üzerindeki antikorların hareketsiz tutmak için güvenilir bir yöntem, aynı zamanda teşhis cihazları geliştirilmesi için önemlidir. Non-spesifik adsorpsiyon immobilizasyon sonra hedeflerine azami bağlama kapasitesini sağlamak için kağıt tabanlı cihazlar 9, 10 yüzeyindeki antikorların değiştirmek için ana stratejisidir. Ancak, bir önceki çalışma Selüloz kağıt üzerine adsorbe edilir antikorlar% 40 elyaf 11 desorbe göstermiştir. Böylece, selüloz üzerine antikorların direkt adsorpsiyonu tekrarlanabilir sonuçlar 12 sağlayamayabilir. Kağıt yüzeylere aşılanmış antikorların kovalent immobilizasyon etkili bir kağıt bazlı biyo-tahliller 13 gelişmekte olan alternatif bir yöntemdir. Çeşitli yöntemler selüloz 14, 15 modifikasyonu için bildirilmiştir . İdeal olarak, antikorlar immobilizasyon 12 sonra kendi özgün işlevlerini korumak gerekir. Karbonildiimidazol 1-siyano-4-dimetilaminopiridinyum tetrafloroborat 16 ile birleştirilir; 18. UV-bazlı aktivasyon strateji 17, 1 ile-floro-2-nitro-4-azidobenzene; ksiloglukan değişiklik 19 dayanan bir chemoenzymatic strateji; bir 1,4-fenilendiizotiyosiyanat bağlayıcı madde 20; heteropolisakarit oksidasyon 21 tıklama kimyası 22; ve katyonik porfirinler 23 kovalent selüloz kağıt üzerinde biyomoleküllerin immobilize etmek için kullanılmıştır. Kitosan modifiye Kağıdı bol ve 27 biyouyumlu olduğu kağıt tabanlı immunodevices 24-26 geliştirmek için kullanılır olmuştur. Kitosan katyonik ve anyonik selüloz 27 kuvvetle yapışır. yakalama antikorları kitosan kaplama ve glutaraldehid çapraz bağlama yoluyla kağıt üzerinde immobilize edilir. Periodat oksitleme Yüzbaşı aşılama için başka bir yöntemdirselüloz kağıdından 28 ure antikorlar. Bu yöntemde, sodyum periodat aldehid gruplarına doğrudan selüloz 1,2-dihidroksi (glikol) gruplarına dönüştürmek için kağıt üzerinde fark edilir. Aldehit grupları daha sonra polisakkaritler ve antikorlar 28 arasında kovalent bağlar oluşturmak için kullanılırlar. imalat basit olmasına rağmen, tamamen, sodyum periodat yıkamak zordur. Yıkanmamış sodyum periodat antikorların etkinliğini ve stabilitesini etkileyen, selüloz kağıt üzerinde immobilize edilir antikorların daha oksidasyona neden olabilir N -. (3-dimetilaminopropil) - etilkarbodiimid hidroklorür ve N-hidroksisukinimid çapraz bağlayıcılar ayrıca kullanılan kovalent nano bazlı deneylerde 29 geliştirilmesi için electrospun poli-L-laktik asit ve selüloz asetat nanoliflerde antikor hareketsiz hale getirir.
Bu çalışmada, bir silan birleştirme tekniği SELÜLOZDEN ilgili amin fonksiyonel grupları graft için kullanılane kağıt diskler. Bu teknik, maksimum dikey akış yoluyla immün sağlayan orijinal gözenek boyutu, esneklik ve selüloz filtre kağıdı filtrasyon hızını korumak için yardımcı olur. silan birleştirme tekniği çok fazla modifikasyonu kullanılarak biyomoleküllerin ardından ikincil amin grubu ile alt-tabaka yüzeyleri işlevselleştirilmesi biyosensör kullanılmıştır. Matris yüzeyinin üzerine amin gruplarının eklenme -OH organofonksiyonel silan maddelerin grupları ve matriks substrat 30 ile bir yoğunlaştırma reaksiyonu ihtiva eder. Selüloz kağıt diskler 3-aminopropihrimetoksisilanı (APS) ile 31 silan bağlama ile amin gruplarıyla beraber çalışan bulundu. Bu iki farklı yöntem kullanarak kovalent hareketsizleştirici antikorlarla izledi. İlk yöntem, bir amin işlevselleştirilmiş selüloz kağıt diskler periodat oksidize antikorlarla bağlanması içeriyordu. İkinci yöntem yakalama antibodi takmak için bir çapraz bağlama maddesi olarak glutaraldehid kullanılanamin grubu işlevselleştirilmiş selüloz kağıt diskler es. Yakalama antikorlarının varlığı bir floresan molekül bir görüntü cihazını kullanarak, tavşan anti-insan IgG-floresin izotiyosiyanat (FITC) ile teyit edilmiştir. anti-tavşan IgG keçi, tavşan anti-insan IgG-FITC bağlanma aktivitesi, peroksidaz substrat ile değerlendirildi. sodyum periodat, glutaraldehid ve yakalama çeşitli antikor konsantrasyonları etkileri incelenmiştir. immobilize yakalama antikor uygulama testi başarıyla IgG serum tespiti yoluyla gerçekleştirilmiştir.
Protokol
Selüloz Kağıt Diskleri 1. Aşılama Amin Fonksiyonel Gruplar
- bir delik ile 6,0 mm (orta akış filtre kağıdı) bir çapı olan Cinsi No. 1, selüloz kağıdından yapılmış 1 cm x 1 cm ve 100 kağıdı diskler bir boyuta sahip kare bir parça kağıt hazırlayın.
- Kağıt diskler üzerinde -NH2 gruplarını elde davlumbaz 50 ml'lik bir cam şişeye 1 mi APS ve 10 mi aseton karıştırın. Taze hazırlanmış APS reajanı kanşımına kağıdı diskler ekleyin ve oda sıcaklığında 32 orbital karıştırılarak (200 rpm) ile 5 saat boyunca inkübe edilir.
Dikkat: davlumbaz APS ve aseton tutun. - organik atık kabı içine 50 ml cam şişe aşırı çözüm süzün.
- Cam şişeye 10 ml aseton ekleyin karıştırın ve reaksiyona girmemiş APS ve diğer yabancı maddeleri çıkarmak için tam süzün. Bu adımı iki kez tekrarlayın.
- 3 saat için 110 ° C fırında kağıt havlu ve yerde kağıt diskleri yayıldı. izin vermekKağıt diskleri soğutmak için. Oda sıcaklığında, 50 ml santrifüj tüpüne diskleri saklayın.
- Aşağıdaki (Şekil 3A) tarif edildiği gibi selüloz kare kağıt üzerindeki amin gruplarından aşılama kontrol etmek için kızılötesi spektroskopisi (FTIR) kullanın.
- Bilgisayarı açın ve FTIR spektroskopisi aleti açın.
- FTIR spektroskopisi için yazılımı açın.
- 'Ölçüm → başlat' gidin. 'BS: KBr' için dikdörtgenler,: başlatma bittiğinde 'Lamba Kızılötesi' ve 'Lazer' yeşile döner.
- dikdörtgenler altında 'Veri' seçin ve '% Geçirgenlik', 'Happ-Genzel', '45', '4.0' ve 'Min: 400, Maks: 4000' seçeneğini 'Ölçüm Mode' için, 'apodizasyonlu', ' Yok hayır. Taramalar ',' Karar 've' Range (cm-1) 'evi.
- 'Tedbir' tıklayın.
- Arka plan verileri için 'Veri dosyası' seçeneğini seçin. YazmakYorumlar aşağı.
- arka plan için temel almak için 'BKG tıklayın.
- Film numune tutucu kare kağıt sabitleyin.
- örnek veriler için 'Veri dosyası' seçeneğini seçin. Yorum yazın.
- numune için spektrumları elde etmek için 'örnek' tıklayın.
- FTIR spektroskopi uygulamasını kapatın ve bilgisayarı kapatın.
- Yukarıdaki adımları (1.6 1.1 adımlar) amin işlevselleştirilmiş dereceli No 113 selüloz kare kağıt ve diskleri (hızlı akış filtre kağıdı) hazırlamak için tekrarlayın ve sınıf sayılı 113 metrekare kağıt (Şekil 3B) için FTIR spektrumları elde.
Amin fonksiyonlu Selüloz Kağıt Disklerinde Antikorların 2. Kovalent İmmobilizasyonu
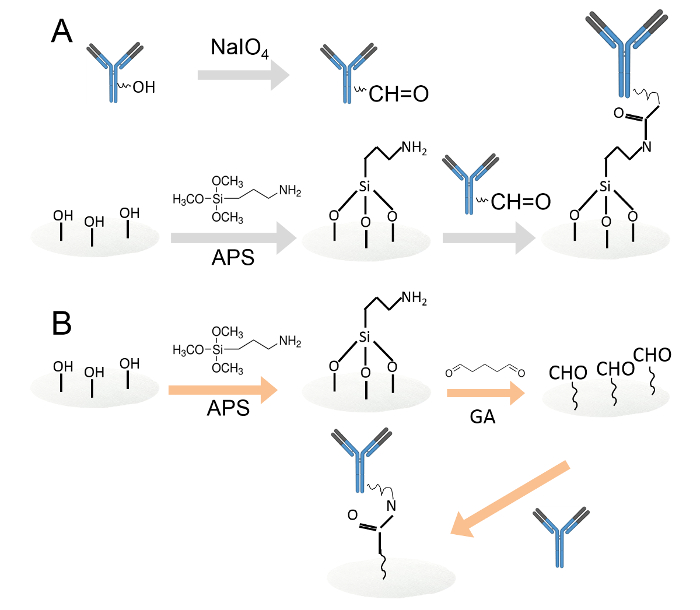
İki farklı yöntemle antikorların 1. Kovalent immobilizasyon Şekil.Bir. Periyodat oksidasyon yoluyla amin fonksiyonlu selüloz kağıt diskler üzerinde hareketsiz Antikorlar. karbohidrat kalıntıları aldehid fonksiyonel grupları üretmek üzere sodyum periodat ile yükseltgenmiştir. Daha sonra, okside antikorlar amin işlevselleştirilmiş selüloz kağıt diskler üzerine yüklendi. B. antikorlar, daha sonra, glutaraldehid ile amin işlevselleştirilmiş selüloz kağıt diskler üzerinde hareketsizleştirildi. Amin işlevselleştirilmiş selüloz kağıt diskler kağıt diskler aldehid gruplarını eklemek için,% 0.05 glutaraldehid çözeltisi içine daldırılmıştır. Yıkandıktan sonra, antikorlar aldehit fonksiyonlaşmış kağıt diskler üzerine yüklendi. Bu rakamın büyük halini görmek için lütfen buraya tıklayınız.
- Periodat oksidasyon (Şekil 1A) ile amin işlevselleştirilmiş selüloz kağıt diskler üzerinde antikorların hareketsiz.
- 2.5 mM sodyum Süresiâ 1 ul karıştırın0.1 mg'lık 2 ul TE / ml tavşan IgG-FITC, anti-insan bir 1.5 ml'lik bir tüp içinde 100 mM pH 5.5 asetat tamponu 7 ul, ve 30 dakika boyunca karanlıkta karışımı inkübe edin.
NOT: Gerekirse daha yükseltgenmiş antikorlar hazırlamak için bu hacim oranı izleyin. sodyum periodat ve tavşan anti-insan IgG-FITC konsantrasyonunun optimize etmek için hacim oranı olarak değiştirin. - (PH 7.4 PBS) 40 ul'lik nihai bir hacme kadar 50 mM fosfat tamponu tuz 30 ul yukarıdaki antikor çözeltisi ile seyreltilir.
- Üç-amin işlevselleştirilmiş orta akış filtre kağıdı diskleri (Bölüm 1 'de tarif edildiği gibi), üç amin işlevselleştirilmiş hızlı akış kağıdı diskler hazırlayın.
- Yük her ortam akış filtre kağıdı diski üzerine sodyum periodat oksidize tavşan anti-insan IgG-FITC 5 ul ve her bir hızlı akış filtre kağıdı diski üzerine 8 ul. Oda sıcaklığında bir saat boyunca karanlıkta bu kağıt diskler tutun.
- Yıkama devetüyü 0.2 ml kağıt diskin her yıkamaER (50 mM Tris, 0.15 M NaCl ve% 0.05 yüzey aktif madde, pH 7.4 ile tampon A). yıkandıkları üç kez tekrarlayın.
- Her selüloz kağıt disk 32 antikorların varlığını belirlemek için bir floresan moleküler kamera ile floresan görüntüleri fotoğraflamak. (S3 Şekil Şekil S1) bir kontrol olarak (sodyum periodat yokluğunda antikorların aynı konsantrasyonda muamele edilmiş) boş kağıt diskler kullanın.
NOT: Deneysel optimizasyonu için, optimize edilmiş ve tüm diğer parametreler konsantrasyonlarını düzeltmek gerekiyor bir parametrenin konsantrasyonunu değiştirir. Yüksek floresan yoğunluğu selüloz kağıt diskler üzerinde immobilize edilir antikorlarla miktarını artırır.
- 2.5 mM sodyum Süresiâ 1 ul karıştırın0.1 mg'lık 2 ul TE / ml tavşan IgG-FITC, anti-insan bir 1.5 ml'lik bir tüp içinde 100 mM pH 5.5 asetat tamponu 7 ul, ve 30 dakika boyunca karanlıkta karışımı inkübe edin.
- Glutaraldehid (Şekil 1B) yoluyla amin işlevselleştirilmiş selüloz kağıt diskler üzerinde antikorların hareketsiz.
- Üç APS tedavi orta akış filtre kağıdı diskleri ve üç hızlı akış filtresi kağıdı diskleri ekleyin (desoda sıcaklığında orbital bir karıştırma ile 1 saat süreyle% 0.05 glutaraldehit içeren 50 mM PBS (pH 7.4), 2 ml Kısım 1) 'de açıklanan şekilde.
Dikkat: davlumbaz glutaraldehit işleyin. - iki adet 1,5 ml santrifüj tüplerine üç diskleri her koyun. Her tüpe deiyonize (Di) su, 1 ml ilave edilir ve 10 saniye boyunca tüpleri çalkalanır. bir pipet ile aspire su çıkarmak. herhangi bir reaksiyona girmemiş glutaraldehit kaldırmak için iki kez daha tekrarlayın.
- Yük 5, her aldehit işlevselleştirilmiş orta akış filtre kağıdı diski üzerine 25 ug / ml tavşan anti-insan IgG-FITC (yakalama antikoru) ul ve her aldehit fonksiyonalize hızlı akış filtre kağıdı diski üzerine 8 ul ilave edin. oda sıcaklığında yaklaşık 20 dakika süreyle karanlıkta inkübe edilir. Daha sonra, antikorlar çıkarmadan, her bir kağıt disk 50 mM, PBS (pH 7.4) 10 ul ve amin aldehid reaksiyon için 40 dakika boyunca inkübe edin.
- bir kağıt havlu üzerine yıkama tamponu 0.2 ml kağıdı diskler yıkayın. Tekrarlaiki kez yıkayın.
- Her selüloz kağıt disk 33 antikorların varlığı kontrol etmek için bir floresan moleküler kamera ile floresan görüntüleri fotoğraflamak. Bir kontrol olarak boş kağıt diskler kullanın.
Not: Şekil 4'te, '0' glutaraldehit yokluğunda FITC antikoru aynı konsantrasyonda ile muamele edildi boş kağıt diski temsil eder; Şekil 5A'da, boş kağıt diskler glutaraldehid ile muamele edildi, ancak FITC antikorlar kağıdı diskler üzerine yüklendi.
- Üç APS tedavi orta akış filtre kağıdı diskleri ve üç hızlı akış filtresi kağıdı diskleri ekleyin (desoda sıcaklığında orbital bir karıştırma ile 1 saat süreyle% 0.05 glutaraldehit içeren 50 mM PBS (pH 7.4), 2 ml Kısım 1) 'de açıklanan şekilde.
- 10 dakika için 37 ° C 'de (Bölüm 2.1 ve 2.2 arasında) kağıt diskler kurutun.
- blokaj tamponu 15 ul kağıdı diskler bloke oda sıcaklığında 10 dakika süre ile (% 10, 0.15 M NaCI ile, 50 mM Tris tamponu, pH 7.4 içinde yağsız süt tozu).
- Yük 5 ul PBS içinde peroksidaz konjuge keçi anti-tavşan IgG 8 ul (1: 10,000), sırasıyla, orta akış ve hızlı akış filtre kağıdı diskler üzerine. inkübeOda sıcaklığında karanlıkta 30 dakika.
- bir kağıt havlu üzerine yıkama tamponu 0.2 ml kağıdı diskler yıkayın. yıkandıkları üç kez tekrarlayın.
NOT: Bu sonuçlar tampon etkilenmez olarak yıkama tampon kaldırmak için gerekli değildir. - Her bir disk üzerine 3,3 ', 5,5'-tetrametilbenzidin (TMB) ve hidrojen peroksit çözeltisinin bir 10 ul karıştırılmalıdır.
- inkübasyon 5 dakika sonra bir dijital kamera ya da akıllı telefon ile kağıt diskler görüntüleri çekin.
Not: Şekil 5B'de ise, '0' antikor-HRP (yaban turpu peroksidazı) FITC antikoru yokluğunda konjügatı yükleme ardından glutaraldehid ile muamele edildi kağıdı diskler, anlamına gelir.
3. IgG Algılama için ELISA Paper-based
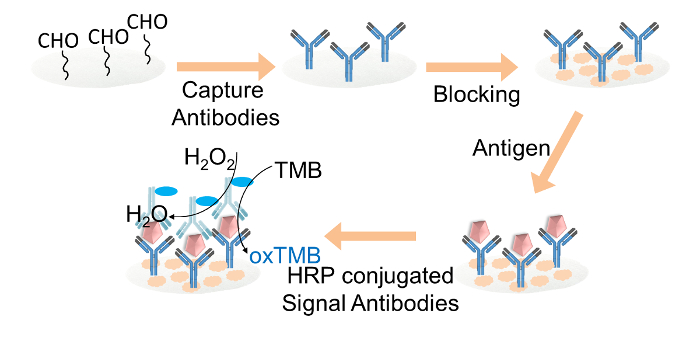
Kağıt tabanlı ELISA fo Şekil 2. şematikR IgG tespiti. antikorlarla kovalent glutaraldehid ile aldehit işlevselleştirilmiş selüloz kağıt diskler üzerinde hareketsizleştirildi. selüloz kağıt diskler bloklama tamponu ile bloke edildi. Hedef IgG daha sonra HRP ile konjüge edilmiş sinyal antikor yükleme, ardından diskler için ilave edildi. Son olarak, TMB ve hidrojen peroksit karışımı çözüm renk okuma için her kağıt diske yüklendi. Bu rakamın büyük halini görmek için lütfen buraya tıklayınız.
- 20 ml'lik bir cam şişeye (50 mM PBS, pH 7.4 içinde hazırlanmıştır)% 0.05 glutaraldehid çözeltisi 5 ml. Bu çözeltiye 15 amin işlevselleştirilmiş orta akış filtre kağıdı diskler daldırın ve oda sıcaklığında çalkalanarak 1 saat boyunca devam edin.
- Aynı zamanda, tekrar Adım 3.1 başka bir 15 aldehit fonksiyonlaşmış hızlı akış filtre kağıdı diskleri hazırlamak.
Dikkat: duman içinde glutaraldehit Koludavlumbaz.
- Aynı zamanda, tekrar Adım 3.1 başka bir 15 aldehit fonksiyonlaşmış hızlı akış filtre kağıdı diskleri hazırlamak.
- kağıdı diskler, reaksiyona girmemiş glutaraldehid kaldırmak için başka bir 15 ml santrifüj tüpü içinde 15 ml santrifüj tüpü içinde 15 orta akış filtre kağıdı diskler, 15, hızlı akışlı filtre kağıdı diskleri yerleştirin. Her tüpe DI suyun 5 ml ilave edilir ve 10 saniye boyunca tüpleri çalkalanır. bir pipet ile aspire su çıkarmak. reaksiyona girmemiş glutaraldehid çıkarmak için iki kez tekrarlanır.
- 37 ° C fırın içinde kağıdı diskler kurutun.
- 5 ul sırasıyla orta akış ve hızlı akışlı filtre kağıdı diskler, her bir 0.025 mg / ml fare IgG-Fc fragmanı antikorların 8 ul ekleyin ve 20 dakika boyunca inkübe edin.
- antikorlar çıkarmadan, her bir kağıt disk 50 mM, PBS (pH 7.4) 10 ul ekle ve amin aldehid reaksiyon için 40 dakika boyunca inkübe edin.
- bir kağıt havlu üzerine yıkama tamponu 0.2 ml kağıdı diskler yıkayın. yıkandıkları üç kez tekrarlayın.
- 37 ° C'de bir fırın içinde kağıdı diskler kurutun.
- w kağıt diskleri engelleOda sıcaklığında 10 dakika süre ile blokaj tamponu içinde i 15 ul.
- bir kağıt havlu üzerine yıkama tamponu 0.2 ml, her bir kağıt diski yıkayın. yıkandıkları üç kez tekrarlayın.
- IgG standartlarını çalıştırın.
- Yük, çeşitli IgG konsantrasyonları 10 ul (örneğin, 0, 10, 125, 250 ve 500 ng / ml'lik son yoğunluğa seyreltildi) üç kopya halinde her bir diske. Oda sıcaklığında 1 saat inkübe edin.
- bir kağıt havlu üzerine yıkama tamponu 0.2 ml kağıdı diskler yıkayın. yıkandıkları üç kez tekrarlayın.
- Yük 10 HRP ile konjüge edilmiş bir fare IgG-Fc fragmanı antikorları (1: 10,000, 10 mM PBS, pH 7.4) ul, ve oda sıcaklığında 1 saat boyunca inkübe edilir.
- bir kağıt havlu üzerine yıkama tamponu 0.2 ml kağıdı diskler yıkayın. yıkandıkları üç kez tekrarlayın.
NOT: Bu sonuçlar tampon maddesi etkilenmez çamaşır tampon kaldırmak için gerekli değildir. - Her diske bir TMB 10 ul karışımı ve hidrojen peroksit yükleyin.
- Tinkübasyon 5 dakika sonra bir dijital fotoğraf makinesi veya akıllı telefon ile tüm kağıt disklerin AKE görüntüler.
Not: Şekil 6A'da, '0' yakalama antikoru immobilizasyon ile muamele kağıdı diskler anlamına gelir ve IgG serum olmadan, antikor-HRP / TMB çözeltisi. - Görüntü J. görüntüdeki her kağıt diskin yoğunluğunu analiz
- 'Tif' formatına adım 3.15 alınan görüntüleri dönüştürün.
- Aç 'Görüntü J' yazılım.
- 'Dosya → Aç' git analiz resim seçin.
- şekil düğmesini 'Oval' seçin.
- 'Görüntü → Tipi → 32 bit' gidin.
- 'Düzen → Invert' gidin.
- '→ ölçün Analiz' gidin.
- Kopyala ve bir e-tablodaki verileri analiz eder.
Sonuçlar
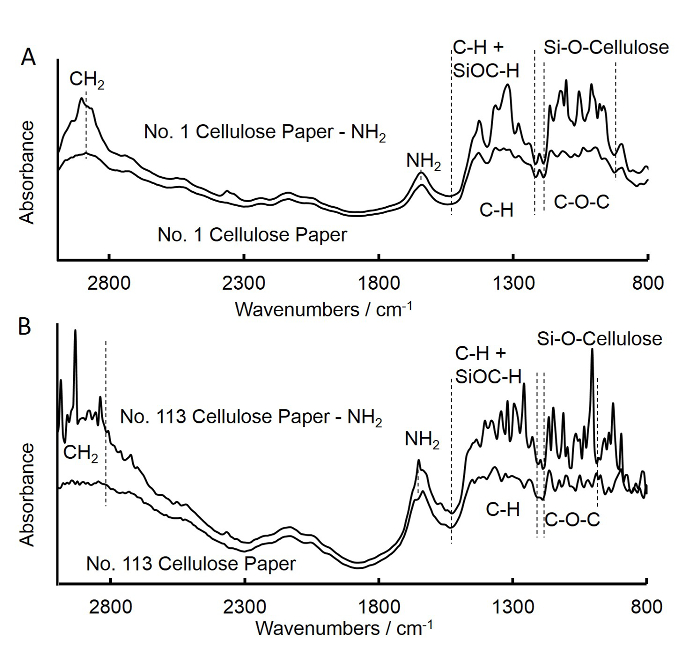
Şekil 3. Fourier işlenmemiş ve APS-tedavi orta akış filtresi kare kağıt (A) ve hızlı akış filtresi kare kağıt (B). A kızılötesi (FTIR) spektrumları dönüşümü. muamele edilmemiş orta akış filtresi kare kağıt spektrumu APS muamele edilmiş orta akış filtresi kare kağıt edilene benzerdi. 902-1,170 cm-1 ve 1,210-1,500 cm-1
Tartışmalar
modifiye edilmemiş selüloz kağıt diskler üzerinde afinite saflaştırması yapılmış keçi anti-fare IgG-Fc yakalama antikoru doğrudan kaplama IgG konsantrasyonları tespit etmek için yapılmıştır. Sonuçlar antikorlarla daha sabitleme tekrarlanabilirliği için gerekli olan, ortaya koymuştur. Silan tekniğin başarılı selüloz kağıt diskler 34 amin fonksiyonel gruplarının eklenmesi için kullanıldı. APS konsantrasyonu antikor hareketsiz hale etkiler. Bu nedenle, aseton içinde APS miktar...
Açıklamalar
The authors have nothing to disclose.
Teşekkürler
This work was financially supported by the Ministry of Education, Singapore through the Translational and Innovation Grant (MOE2012-TIF-2-G-009).
Malzemeler
| Name | Company | Catalog Number | Comments |
| Cellulose filter paper, Grade 1 (medium flow filter paper) | GE Healthcare Pte Ltd Singapore | 1001 110 | |
| Cellulose filter paper, Grade 113 (Fast flow filter paper) | Sigma-Aldrich, Singapore | 1113-320 | |
| Glutaraldehyde | Sigma-Aldrich, Singapore | G6257 | Grade II, 25% in H2O |
| Surfactant | Tween-20, Sigma-Aldrich, Singapore | P2287 | |
| Bovine serum album | Sigma-Aldrich, Singapore | A2153 | |
| Skimmed milk powder | Louis François | Packed by Kitchen Capers, Singapore | |
| Tris base | Promega | H5135 | |
| Sodium periodate | Merck | 106597 | |
| Na2HPO4 | Merck | 106585 | |
| KH2PO4 | Merck | 104873 | |
| NaCl | CALBIOCHEM | 567441 | |
| NaOH | Merck | 106462 | |
| HCl | Merck | 100317 | |
| phosphate buffer saline (PBS) | N/A | N/A | PBS, containing 137 mmol/L NaCl, 2.7 mmol/L KCl, 8.0 mmol/L Na2HPO4 and 1.5 mmol/L KH2PO4, is prepared with water and adjusted to pH 7.4 with 0.1 mol/L NaOH or 0.1 mol/L HCl |
| Acetone | Tee Hai Chem Pte Ltd Singapore | 9005-68 | |
| Mixture of TMB and hydrogen peroxide solution | 1-Step ultra TMB-ELISA solution , Thermo Scientific Pierce | 34029 | 1 L |
| Rabbit anti-human IgG-FITC | TWC/Bio Pte Ltd Singapore | sc-2278 | |
| Peroxidase conjugated goat anti-rabbit IgG | TWC/Bio Pte Ltd Singapore | sc-2030 | |
| Affinity purified goat anti-Mouse IgG-Fc coating antibody | Bethyl Laboratories, Inc | A90-131A | |
| Mouse reference serum | Bethyl Laboratories, Inc | RS10-101-5 | 9.5 mg/ml |
| HRP conjugated goat anti-mouse IgG-Fc detection antibody | Bethyl Laboratories, Inc | A90-131P | |
| Equipment | |||
| Fourier transform infrared spectrophotometer | Shimadzu IR Prestige-21 | N/A | |
| Fluorescence molecular imager | Pharos FXTM plus molecular imager, Bio-Rad, Singapore | N/A | |
| Oven | NUVE FN500 | N/A | |
| Turbo mixer VM-2000 | MYC LTD | N/A | |
| ImageJ | RGB, free download | N/A |
Referanslar
- Curtis, K. A., Rudolph, D. L., Owen, S. M. Rapid detection of HIV-1 by reverse-transcription, loop-mediated isothermal amplification (RT-LAMP). J. Virol. Methods. 151 (2), 264-270 (2008).
- Martinez, A. W., Phillips, S. T., Carrilho, E., Thomas, S. W., Sindi, H., Whitesides, G. M. Simple telemedicine for developing regions: camera phones and paper-based microfluidic devices for real-time, off-site diagnosis. Anal. Chem. 80 (10), 3699-3707 (2008).
- Lode, P. V. Point-of-care immunotesting: approaching the analytical performance of central laboratory methods. Clin. Biochem. 38 (7), 591-606 (2005).
- Posthuma-Trumpie, G. A., Amerongen, A. V., Korf, J., Berkel, W. J. V. Perspectives for on-site monitoring of progesterone. Trends Biotechnol. 27 (11), 652-660 (2009).
- Lim, D. V., Simpson, J. M., Kearns, E. A., Kramer, M. F. Current and developing technologies for monitoring agents of bioterrorism and biowarfare. Clin. Microbiol. Rev. 18 (4), 583-607 (2005).
- Li, X., Tian, J., Shen, W. Progress in patterned paper sizing for fabrication of paperbased microfluidic sensors. Cellulose. 17 (3), 649-659 (2010).
- Nie, Z., et al. Electrochemical sensing in paper-based microfluidic devices. Lab Chip. 10, 477-483 (2010).
- Delaney, J. L., Hogan, C. F., Tian, J., Shen, W. Electrogenerated chemiluminescence detection in paper-based microfluidic sensors. Anal. Chem. 83 (4), 1300-1306 (2011).
- Oh, Y. K., Joung, H. A., Kim, S., Kim, M. G. Vertical flow immunoassay (VFA) biosensor for a rapid one-step immunoassay. Lab Chip. 13 (5), 768-772 (2013).
- Cheng, C. M., et al. Paper-based ELISA. Angew. Chem. 122 (28), 4881-4884 (2010).
- Jarujamrus, P., Tian, J., Li, X., Siripinyanond, A., Shiowatana, J., Shen, W. Mechanisms of red blood cells agglutination in antibody-treated paper. Analyst. 137 (9), 2205-2210 (2012).
- Credou, J., Volland, H., Dano, J., Berthelot, T. A one-step and biocompatible cellulose functionalization for covalent antibody immobilization on immunoassay membranes. J. Mat. Chem. B. 1, 3277-3286 (2013).
- Kong, F., Hu, Y. F. Biomolecule immobilization techniques for bioactive paper fabrication. Anal. Bioanal. Chem. 403, 7-13 (2012).
- Orelma, H., Teerinen, T., Johansson, L. S., Holappa, S., Laine, J. CMC-modified cellulose biointerface for antibody conjugation. Biomacromolecules. 13, 1051-1058 (2013).
- Yu, A., et al. Biofunctional paper via covalent modification of cellulose. Langmuir. 28 (30), 11265-11273 (2012).
- Stollner, D., Scheller, F. W., Warsinke, A. Activation of cellulose membranes with 1,1′-carbonyldiimidazole or 1-cyano-4-dimethylaminopyridinium tetrafluoroborate as a basis for the development of immunosensors. Anal Biochem. 304 (2), 157-165 (2002).
- Bora, U., Sharma, P., Kannan, K., Nahar, P. Photoreactive cellulose membrane - a novel matrix for covalent immobilization of biomolecules. J. Biotechnol. 126 (2), 220-229 (2006).
- Sharma, P., Basir, S. F., Nahar, P. Photoimmobilization of unmodified carbohydrates on activated surface. J Colloid Interface Sci. 342 (1), 202-204 (2010).
- Brumer, H., Zhou, Q., Baumann, M. J., Carlsson, K., Teeri, T. T. Activation of crystalline cellulose surfaces through the chemoenzymatic modification of xyloglucan. J. Am. Chem. Soc. 126 (18), 5715-5721 (2004).
- Araujo, A. C., Song, Y., Lundeberg, J., Stahl, P. L., Brumer, H. Activated paper surfaces for the rapid hybridization of DNA through capillary transport. Anal Chem. 84 (7), 3311-3317 (2012).
- Xu, C., Spadiut, O., Araujo, A. C., Nakhai, A., Brumer, H. Chemo-enzymatic Assembly of Clickable Cellulose Surfaces via Multivalent Polysaccharides. ChemSusChem. 5 (4), 661-665 (2012).
- Filpponen, I., et al. Generic method for modular surface modification of cellulosic materials in aqueous medium by sequential "click" reaction and adsorption. Biomacromolecules. 13 (3), 736-742 (2012).
- Feese, E., Sadeghifar, H., Gracz, H. S., Argyropoulos, D. S., Ghiladi, R. A. Photobactericidal porphyrin-cellulose nanocrystals: synthesis, characterization, and antimicrobial properties. Biomacromolecules. 12 (10), 3528-3539 (2011).
- Zang, D., Ge, L., Yan, M., Song, X., Yu, J. Electrochemical immunoassay on a 3D microfluidic paper-based device. Chem. Commun. 48 (39), 4683-4685 (2012).
- Ge, L., Yan, J. X., Song, X. R., Yan, M., Ge, S. J., Yu, J. H. Three-dimensional paper-based electrochemiluminescence immunodevice for multiplexed measurement of biomarkers and point-of-care testing. Biomaterials. 33 (4), 1024-1031 (2012).
- Wang, S., et al. Paper-based chemiluminescence ELISA: lab-on-paper based on chitosan modified paper device and wax-screen-printing. Biosens. Bioelectron. 31 (1), 212-218 (2012).
- Koev, S. T., et al. Chitosan: an integrative biomaterial for lab-on-a-chip devices. Lab Chip. 10, 3026-3042 (2010).
- Wang, S. M., et al. Simple and covalent fabrication of a paper device and its application in sensitive chemiluminescence immunoassay. Analyst. 137 (16), 3821-3827 (2012).
- Sadira, S., Prabhakaranc, M. P., Wicaksonob, D. H. B., Ramakrishna, S. Fiber based enzyme-linked immunosorbent assay for C-reactive protein. Sensor Actuat B-Chem. 205, 50-60 (2014).
- Koga, H., Kitaoka, T., Isogai, A. In situ modification of cellulose paper with amino groups for catalytic applications. J. Mater. Chem. 21, 9356-9361 (2011).
- Klemm, D., Heublein, B., Fink, H. P., Bohn, A. Cellulose: fascinating biopolymer and sustainable raw material. Angew. Chem., Int. Ed. 44 (22), 3358-3393 (2005).
- Fernandes, S. C. M., et al. Bioinspired antimicrobial and biocompatible bacterial cellulose membranes obtained by surface functionalization with aminoalkyl groups. ACS Appl. Mater. Interfaces. 5 (8), 3290-3297 (2013).
- . . Pharos FX plus molecular imager instructions, Catalog Number 170-9460. , (2005).
- Tee, Y. B., Talib, R. A., Abdan, K., Chin, N. L., Basha, R. K., Yunos, K. F. M. Aminosilane-grafted cellulose. BioResourses. 8 (3), 4468-4483 (2013).
- Xing, Y., et al. Bioconjugated quantum dots for multiplexed and quantitative immunohistochemistry. Nat Protoc. 2, 1152-1165 (2007).
- Guidi, A., Laricchia-Robbio, L., Gianfaldoni, D., Revoltella, R., Del Bono, G. Comparison of a conventional immunoassay (ELISA) with a surface plasmon resonance-based biosensor for IGF-1 detection in cows' milk. Biosens Bioelectron. 16, 971-977 (2001).
- Ahmed, S., Bui, M. N., Abbas, A. Paper-based chemical and biological sensors: Engineering aspects. Biosens Bioelectron. 77, 249-263 (2016).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır