Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Covalent liaison des anticorps à la cellulose de papier disques et leurs applications dans l'œil nu colorimétriques immunoessais
Dans cet article
Résumé
In this manuscript, periodate oxidation and glutaraldehyde cross-linking methods for covalent immobilization of antibodies on paper discs are presented. The binding activity of immobilized antibodies was evaluated. Based on these results, a glutaraldehyde cross-linking method was used to develop a novel paper-based immunoassay for immunoglobulin G (IgG) detection.
Résumé
Ce rapport présente deux méthodes pour l'immobilisation covalente des anticorps de capture sur le filtre de cellulose de qualité de papier n ° 1 (papier filtre à moyen débit) disques et de grade n ° 113 (papier filtre à écoulement rapide) disques. Ces disques de papier de cellulose ont été greffées avec des groupes fonctionnels amine par l'intermédiaire d'une technique de couplage du type silane avant que les anticorps sont immobilisés sur eux. les méthodes de reticulation glutaraldéhyde oxydation et de periodate ont été utilisés pour greffer les anticorps de capture sur les disques de papier de cellulose. Afin de garantir la capacité maximale de liaison des anticorps de capture à leurs cibles après l'immobilisation, les effets de diverses concentrations de périodate de sodium, le glutaraldéhyde, et des anticorps de capture sur la surface des disques de papier ont été étudiés. Les anticorps qui ont été revêtus sur des disques de papier cellulosique à fonction amine par un agent de réticulation glutaraldéhyde ont montré une activité accrue de liaison à la cible par rapport au procédé d'oxydation du periodate. IgG (dans le sérum de référence de la souris) a été utilisé comme une cible de référence dans cette étude pour tester l'application des anticorps immobilisés de manière covalente par le glutaraldéhyde. Un nouveau papier, enzyme-linked immunosorbent assay (ELISA) a été développé et validé avec succès pour la détection des IgG. Cette méthode ne nécessite pas d'équipements, et il peut détecter 100 ng / ml d'IgG. Le papier filtre à écoulement rapide était plus sensible que le papier filtre à moyen débit. La période d'incubation de ce test était courte et nécessaire de petits volumes d'échantillons. Cet oeil nu, immuno-essai colorimétrique peut être étendu pour détecter d'autres cibles qui sont identifiés par la méthode ELISA classique.
Introduction
L'étude des tests de point de soins (POCT) de diagnostic est important pour le développement de nouvelles stratégies pour la thérapeutique, la médecine personnalisée, et soins à domicile 1. Papiers de cellulose sont largement utilisés comme plates - formes dans les immunoessais, car ils ne coûtent pas cher, accessible et familier aux utilisateurs 2. En outre, la structure poreuse du papier cellulosique possède la puissance pour entraîner l'écoulement du liquide sans impact énergétique supplémentaire. Actes de la bioanalyse sur papier peuvent être trouvés dès le 20 e siècle, quand la chromatographie sur papier a été inventé en 1952. L'exemple le plus répandu est des tests immunochromatographiques 3, tels que la grossesse et de test du diabète bandes. Ces tests fournissent des temps d'analyse relativement rapide et peu coûteuse analyse 4. En raison de leur simplicité, ces tests de bandes de papier classiques ont été largement utilisés dans le diagnostic ADBD 5.
Les méthodes de détection , y compris colorimétriques 6, électrochimiques 7 et 8 électrochimiluminescence méthodes ont été rapportées pour mesurer des cibles dans des échantillons biologiques. En plus de ces méthodes quantitatives, une méthode fiable pour immobiliser des anticorps sur du papier de cellulose est également importante pour le développement de dispositifs de diagnostic. Adsorption non spécifique est la principale stratégie pour la modification des anticorps sur la surface des dispositifs à base de papier 9, 10 pour garantir une capacité de liaison maximale à leurs cibles après l' immobilisation. Cependant, une étude précédente ont montré que les anticorps qui sont adsorbés sur du papier de cellulose peuvent désorber des fibres 11 de 40%. Ainsi, l' adsorption directe d'anticorps sur la cellulose ne peut pas fournir des résultats reproductibles 12. Covalent immobilisation des anticorps qui sont greffés sur les surfaces de papier est une méthode alternative de développement bioessais sur papier efficaces 13. Divers procédés ont été rapportés pour la modification de la cellulose 14, 15 . Idéalement, les anticorps doivent maintenir leur fonctionnalité initiale après immobilisation 12. Carbonyldiimidazole combiné avec du 1-cyano-4-diméthylaminopyridinium tétrafluoroborate 16; 1-fluoro-2-nitro-4-azidobenzene grâce à une stratégie d'activation à base d'UV 17, 18; une stratégie chimioenzymatique basé sur 19 modification xyloglucane; un 1,4-phenylenediisothiocyanate agent de liaison 20; hétéropolysaccharide oxydation 21 click chemistry 22; et 23 porphyrines cationiques ont été utilisés pour immobiliser de manière covalente de biomolécules sur du papier de cellulose. Chitosan papier modifié a été utilisé pour développer immunodevices à base de papier 24-26 car elle est abondante et biocompatible 27. Le chitosane est cationique et adhère fortement à la cellulose anionique 27. Les anticorps de capture sont immobilisés sur le papier par revêtement de chitosane et de reticulation par le glutaraldéhyde. oxydation periodate est un autre procédé de greffage de la captanticorps ure sur le papier de cellulose 28. Dans ce procédé, le periodate de sodium est repéré sur le papier pour convertir le 1,2-dihydroxylé (glycol), les groupes de cellulose directement à des groupes aldéhyde. Les groupes aldéhyde sont ensuite utilisés pour former des liaisons covalentes entre les polysaccharides et les anticorps 28. Bien que la fabrication est simple, il est difficile de se laver complètement periodate de sodium. Le periodate de sodium non lavé peut provoquer une oxydation supplémentaire des anticorps qui sont immobilisés sur le papier de cellulose, ce qui affecte l'activité et la stabilité des anticorps N -. (3-diméthylaminopropyl) - N chlorhydrate -ethylcarbodiimide et N linkers croisées hydroxysuccinimide sont également utilisés pour immobiliser de façon covalente à des anticorps électrofilage d' acide et d' acétate de cellulose , des nanofibres de poly-l-lactique pour le développement de dosages à base de nanofibres-29.
Dans cette étude, une technique de couplage de type silane a été utilisé pour greffer des groupes fonctionnels amine sur cellulose des disques de papier. Cette technique permet de conserver la taille d'origine des pores, mèche, et le taux des papiers filtres de cellulose de filtration, ce qui permet un maximum vertical immunoessais accréditives dans. La technique de couplage à base de silane a été largement utilisé dans des biocapteurs pour fonctionnaliser des surfaces de substrats avec des groupes amine secondaire, suivie d'une modification supplémentaire à l'aide de biomolécules. Le greffage de groupes amine sur la surface de la matrice comprend une réaction de condensation entre des groupes -OH des agents de silane organofonctionnel et d'une matrice 30 substrat. Les disques de papier de cellulose ont été fonctionnalisés par des groupes amine par couplage à base de silane par le 3-aminopropyltriméthoxysilane (APS) 31. Ceci a été suivi par l'anticorps de capture de manière covalente immobilisant à l'aide de deux méthodes différentes. Le premier procédé implique la liaison des anticorps de capture oxydé au periodate des disques de papier de cellulose à fonctionnalité amine. La deuxième méthode utilise le glutaraldéhyde comme agent de reticulation pour fixer la capture Antibodies aux disques de papier de cellulose fonctionnalisée groupe-amine. La présence d'anticorps de capture a été confirmée par une IgG de lapin isothiocyanate de fluorescéine anti-humain (FITC), en utilisant un système d'imagerie moléculaire par fluorescence. L'activité de liaison des anticorps de lapin anti-IgG humaine-FITC de chèvre à l'IgG anti-lapin a également été évaluée par le substrat de la peroxydase. Les effets de diverses concentrations de périodate de sodium, le glutaraldéhyde, et des anticorps de capture ont été étudiés. Le test de l'anticorps de capture immobilisé d'application a été réalisée avec succès grâce à la détection de sérum IgG.
Protocole
1. Intensification groupes fonctionnels amine sur cellulose de papier Disques
- Préparer un morceau de papier carré avec une dimension de 1 cm x 1 cm, et 100 disques de papier fabriqués à partir de la catégorie no 1 papier de cellulose avec un diamètre de 6,0 mm (papier filtre à moyen débit) à l'aide d'un poinçon.
- Pour tirer -NH 2 groupes sur les disques de papier, mélanger 1 ml APS et 10 ml d' acétone dans un flacon en verre de 50 ml dans la hotte. Ajouter des disques de papier au mélange réactif APS fraîchement préparé, et on incube pendant 5 heures sous agitation orbitale (200 rpm) à température ambiante 32.
Attention: Manipuler APS et de l'acétone dans la hotte. - Décanter excès de solution de la bouteille de 50 ml en verre dans un récipient de déchets organiques.
- Ajouter 10 ml d'acétone à la bouteille en verre, bien mélanger et décanter complètement pour éliminer toutes les APS pas réagi et d'autres impuretés. Répétez cette étape deux fois.
- Répartir les disques de papier sur la serviette en papier et le placer dans un four à 110 ° pendant 3 heures. Laisser ledes disques de papier pour refroidir. Stocker les disques dans un tube de centrifugation de 50 ml à la température ambiante.
- Utilisez Fourier spectroscopie infrarouge à transformée (FTIR) pour vérifier le greffage de groupes amine sur le papier carré de cellulose, comme décrit ci - dessous (figure 3A).
- Allumez l'ordinateur et ouvrez l'instrument de spectroscopie FTIR.
- Ouvrez le logiciel pour la spectroscopie FTIR.
- Aller à 'Measurement → Initialize'. Les rectangles pour 'BS: KBr', 'Lampe: Infrarouge »et« Laser »devient vert lorsque l'initialisation est terminée.
- Choisissez «Données» ci-dessous les rectangles, et sélectionnez '% Transmittance', 'Happ-Genzel', '45', '4.0', et 'min: 400, Max: 4000' pour 'Mode de mesure', 'apodisation', ' Non. des Scans »,« Résolution »et« Range (cm-1).
- Cliquez sur "Mesure".
- Sélectionnez 'Fichier de données »pour les données de base. Écrirebas les commentaires.
- Cliquez sur 'BKG' pour obtenir la ligne de base pour le fond.
- Fixer le papier carré sur le porte-échantillon de film.
- Sélectionnez 'Fichier de données' pour les données de l'échantillon. Notez les commentaires.
- Cliquez sur 'échantillon' pour obtenir les spectres de l'échantillon.
- Fermez l'application de la spectroscopie FTIR et éteindre l'ordinateur.
- Répétez les étapes ci - dessus (étapes 1.1 à 1.6) pour préparer la catégorie no 113 cellulose du papier et des disques (papier de filtre à écoulement rapide) carré amine-fonctionnalisés, et d' obtenir les spectres FTIR pour le grade n ° 113 papier carré (figure 3B).
2. Covalent Immobilisation d'anticorps sur Amine-fonctionnalisés Cellulose Papier Disques
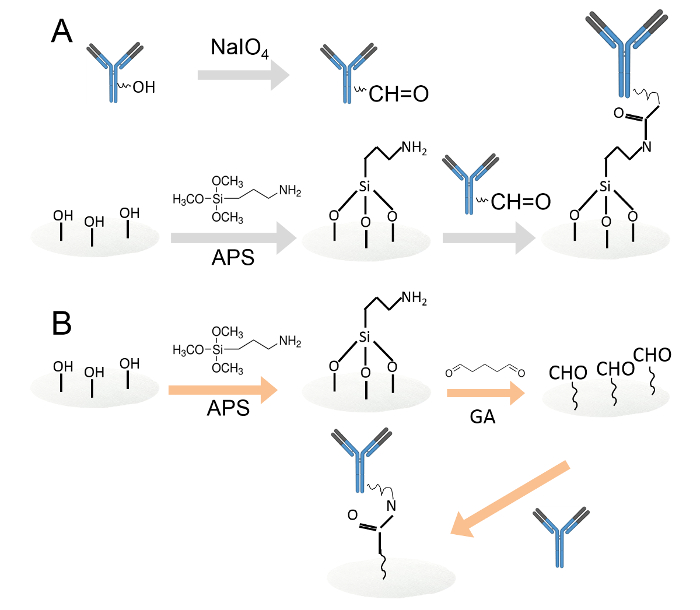
Figure 1. immobilisation covalente d'anticorps par deux méthodes différentes.Un. Les anticorps immobilisés sur des disques de papier de cellulose amine fonctionnalisée par oxydation au periodate. Les résidus d'hydrates de carbone ont été oxydés par le periodate de sodium pour produire des groupes fonctionnels aldéhyde. Ensuite, les anticorps oxydés ont été chargés sur des disques de papier cellulose à fonction amine. B. Les anticorps ont ensuite été immobilisés sur des disques de papier cellulosique à fonction amine par l'intermédiaire du glutaraldéhyde. Les disques de papier de cellulose à fonctionnalité amine ont été immergées dans une solution de glutaraldéhyde à 0,05% pour introduire des groupes aldéhydes aux disques de papier. Après le lavage, les anticorps ont été chargés sur les disques de papier d'aldéhydes fonctionnalisés. S'il vous plaît cliquer ici pour voir une version plus grande de cette figure.
- Immobiliser des anticorps sur la cellulose des disques de papier à fonction amine par oxydation au periodate (figure 1A).
- Mélanger 1 pi de perioda de sodium à 2,5 mMte avec 2 ul de 0,1 mg / ml d'anticorps de lapin anti-IgG humaine-FITC et 7 ul de 100 mM, pH 5,5 tampon acétate dans un tube de 1,5 ml, et on incube le mélange dans l'obscurité pendant 30 min.
REMARQUE: Suivez ce rapport en volume pour préparer des anticorps plus oxydés si nécessaire. Changer le rapport de volume afin d'optimiser la concentration de periodate de sodium et de l'IgG de lapin-FITC anti-humaine. - Diluer la solution d'anticorps ci-dessus avec 30 pl de 50 mM de solution saline tamponnée au phosphate (PBS; pH 7,4) jusqu'à un volume final de 40 ul.
- Préparer trois disques de papier filtre à moyen débit amine-fonctionnalisés et trois disques de papier rapide flux à fonction amine (comme décrit à la section 1).
- Charge 5 ul du periodate de sodium oxydé lapin IgG anti-humain-FITC une sur l'disque de papier filtre à moyen débit et 8 ul de chaque disque ONTO papier filtre à écoulement rapide. Gardez ces disques de papier dans l'obscurité pendant une heure à température ambiante.
- Laver chacun des disques de papier avec 0,2 ml de lavage chamoiser (tampon Tris 50 mM avec 0,15 M de NaCl et 0,05% d'agent tensioactif, pH 7,4). Répétez le lavage trois fois.
- Photographier les images de fluorescence grâce à un système d' imagerie moléculaire par fluorescence pour identifier la présence d'anticorps sur la cellulose chaque disque de papier 32. Utiliser des disques de papier vierges (traités avec la même concentration d'anticorps en l'absence de periodate de sodium) en tant que témoin (figure S1 à la figure S3).
NOTE: Pour l'optimisation expérimentale, modifier la concentration d'un paramètre qui doit être optimisé et fixer les concentrations de tous les autres paramètres. Une intensité de fluorescence élevée augmente la quantité d'anticorps de capture qui sont immobilisés sur des disques en papier de cellulose.
- Mélanger 1 pi de perioda de sodium à 2,5 mMte avec 2 ul de 0,1 mg / ml d'anticorps de lapin anti-IgG humaine-FITC et 7 ul de 100 mM, pH 5,5 tampon acétate dans un tube de 1,5 ml, et on incube le mélange dans l'obscurité pendant 30 min.
- Immobiliser anticorps sur des disques de papier de cellulose fonctionnalisés amine par glutaraldéhyde (figure 1B).
- Ajouter les trois APS moyen débit traité disques de papier filtre et les trois disques de papier filtre rapide débit (described dans la section 1) à 2 ml de PBS à 50 mM (pH 7,4) contenant 0,05% de glutaraldéhyde pendant 1 heure, sous agitation orbitale à température ambiante.
Attention: Manipuler glutaraldéhyde dans la hotte. - Placez trois disques chacun dans deux tubes de 1,5 ml de centrifugeuse. Ajouter 1 ml de désionisée (DI) à chaque tube et agiter les tubes pendant 10 secondes. Éliminer l'eau par aspiration avec une pipette. Répétez deux fois pour éliminer toute glutaraldéhyde qui n'a pas réagi.
- Charge 5 ul de 25 ug d'IgG-FITC (anticorps de capture) anti-humain / lapin ml sur chaque support d'écoulement disque de papier filtre aldéhyde fonctionnalisé, et ajouter 8 pi sur chaque flux rapide disque de papier filtre aldéhyde fonctionnalisé. Laisser incuber dans l'obscurité pendant environ 20 min à température ambiante. Ensuite, ajouter 10 pi de PBS à 50 mM (pH 7,4) à chaque disque de papier sans enlever les anticorps et on incube pendant 40 minutes pour la réaction de l'aminé aldéhyde.
- Laver les disques de papier avec 0,2 ml de tampon de lavage sur le dessus d'une serviette en papier. Répétez lalaver deux fois.
- Photographier les images de fluorescence grâce à un imageur moléculaire de fluorescence pour vérifier la présence d'anticorps sur chaque disque de papier cellulose 33. Utilisez des disques de papier blanc comme témoin.
REMARQUE: Dans la figure 4, «0» représente le disque de papier vierge qui a été traité avec la même concentration de FITC-anticorps en l'absence de glutaraldéhyde; sur la figure 5A, les disques de papier vierges ont été traités avec du glutaraldéhyde, mais sans FITC-anticorps ont été chargés sur des disques de papier.
- Ajouter les trois APS moyen débit traité disques de papier filtre et les trois disques de papier filtre rapide débit (described dans la section 1) à 2 ml de PBS à 50 mM (pH 7,4) contenant 0,05% de glutaraldéhyde pendant 1 heure, sous agitation orbitale à température ambiante.
- Sécher les disques de papier (de sections 2.1 et 2.2) à 37 ° C pendant 10 min.
- Bloquer les disques en papier avec 15 pi de tampon de blocage (10% de lait écrémé en poudre dans du tampon Tris 50 mM, pH 7,4, avec 0,15 M de NaCl) pendant 10 min à température ambiante.
- Charge 5 pi et 8 pi de conjugué à la peroxydase de chèvre anti-IgG de lapin dans du PBS (1: 10000) sur un milieu d'écoulement et des disques de papier filtre à écoulement rapide, respectivement. Incuber30 min dans l'obscurité à la température ambiante.
- Laver les disques de papier avec 0,2 ml de tampon de lavage sur le dessus d'une serviette en papier. Répétez le lavage trois fois.
NOTE: Il est nécessaire de retirer le tampon de lavage que les résultats ne sont pas affectés par le tampon. - Charger un mélange de 10 ul de 3,3 ', 5,5'-tétraméthylbenzidine (TMB) et d'une solution de peroxyde d'hydrogène sur chaque disque.
- Prenez des images des disques de papier avec un appareil photo numérique ou un téléphone intelligent après 5 min d'incubation.
REMARQUE: Dans la figure 5B, «0» représente les disques de papier qui ont été traités avec du glutaraldéhyde, puis en chargeant un anticorps HRP (peroxydase de raifort) conjugué en l'absence de FITC-anticorps.
3. Papier à base ELISA pour la détection des IgG
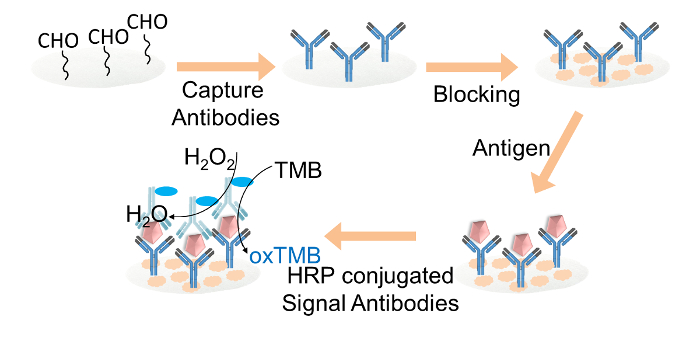
Figure 2. Représentation schématique de l'ELISA à base de papier-foles anticorps de détection. capture r IgG ont été immobilisés de manière covalente sur les disques de papier de cellulose fonctionnalisée par le biais de l' aldéhyde du glutaraldéhyde. Les disques de papier de cellulose ont été bloquées avec un tampon de blocage. Cible d'IgG a ensuite été ajouté aux disques, suivi par le chargement d'anticorps de signal HRP-conjugué. Enfin, la solution TMB et le mélange de peroxyde d'hydrogène a été chargé sur chaque disque de papier pour la lecture de la couleur. S'il vous plaît cliquer ici pour voir une version plus grande de cette figure.
- Ajouter 5 ml de solution de glutaraldéhyde à 0,05% (préparé dans un tampon de 50 mM de PBS, pH 7,4) dans un flacon en verre de 20 ml. Immergez 15 moyen d'écoulement des disques de papier filtre à fonction amine dans cette solution et maintenir pendant 1 heure en agitant à la température ambiante.
- En même temps, répétez l'étape 3.1 pour préparer un autre 15 aldéhyde disques de papier filtre rapide flux fonctionnalisés.
Attention: Manipuler glutaraldéhyde dans les fuméescapuche.
- En même temps, répétez l'étape 3.1 pour préparer un autre 15 aldéhyde disques de papier filtre rapide flux fonctionnalisés.
- Pour supprimer glutaraldéhyde n'a pas réagi à partir des disques de papier, placez les 15 moyen d'écoulement des disques de papier filtre dans un tube de 15 ml de centrifugation, et les disques de papier filtre 15 fast-flux dans un autre tube de 15 ml de centrifugeuse. Ajouter 5 ml d'eau DI à chaque tube et agiter les tubes pendant 10 secondes. Éliminer l'eau par aspiration avec une pipette. Répétez deux fois pour éliminer toute glutaraldéhyde qui n'a pas réagi.
- Sécher les disques de papier dans un four à 37 °.
- Ajouter 5 pi et 8 pi de ml d'anticorps de fragments de 0,025 mg / souris IgG-Fc à chacun des moyens d'écoulement et de papier filtre à écoulement rapide des disques, respectivement, et incuber pendant 20 min.
- Ajouter 10 pi de PBS à 50 mM (pH 7,4) à chaque disque de papier sans enlever les anticorps et on incube pendant 40 minutes pour la réaction de l'aminé aldéhyde.
- Laver les disques de papier avec 0,2 ml de tampon de lavage sur le dessus d'une serviette en papier. Répétez le lavage trois fois.
- Sécher les disques de papier dans un four à 37 ° C.
- Bloquer les disques de papier wvec 15 pi de tampon de blocage pendant 10 min à température ambiante.
- Laver chaque disque de papier avec 0,2 ml de tampon de lavage sur le dessus d'une serviette en papier. Répétez le lavage trois fois.
- Exécutez les normes IgG.
- Charge 10 ul de diverses concentrations d' IgG (par exemple, 0, 10, 125, 250 et 500 ng / ml dans le PBS) sur chaque disque en trois exemplaires. Incuber pendant 1 heure à température ambiante.
- Laver les disques de papier avec 0,2 ml de tampon de lavage sur le dessus d'une serviette en papier. Répétez le lavage trois fois.
- Charge 10 pi d'anticorps de souris conjugué à HRP d'IgG fragment Fc (1: 10 000, 10 mM de PBS, pH 7,4) et incuber pendant 1 heure à température ambiante.
- Laver les disques de papier avec 0,2 ml de tampon de lavage sur le dessus d'une serviette en papier. Répétez le lavage trois fois.
NOTE: Il est nécessaire de retirer le tampon de lavage que les résultats ne sont pas affectés par la présence de tampon. - Charger un mélange de 10 pi de TMB et du peroxyde d'hydrogène sur chaque disque.
- Timages ake de tous les disques de papier avec un appareil photo numérique ou un téléphone intelligent après 5 min d'incubation.
REMARQUE: Dans la figure 6A, «0» représente des disques en papier traités avec des anticorps de capture immobilisation et la solution d' anticorps-HRP / TMB sans sérum IgG. - Analyser l'intensité de chaque disque de papier dans l'image par J. Image
- Convertir les images prises à l'étape 3.15 au format «.tif».
- Ouvrez le logiciel «Image J».
- Aller à 'Fichier → Ouvrir', choisir l'image à analyser.
- Cliquez sur le bouton de forme 'Oval'.
- Aller à 'image → Type → 32 bits.
- Allez sur 'Modifier → Invert'.
- Allez sur 'Analyser → Mesure.
- Copier et analyser les données dans un tableur.
Résultats
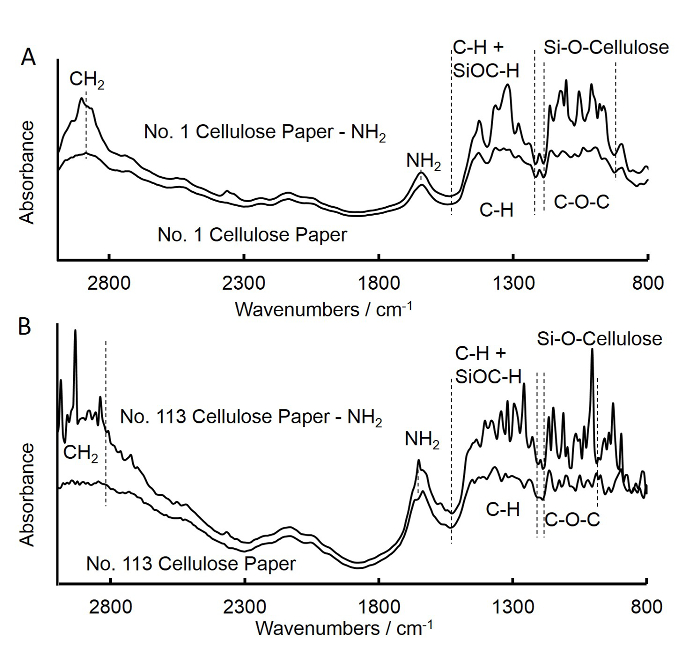
Transformer Figure 3. Fourier infrarouge (FTIR) de papier filtre à moyen débit non traité et APS-traité carré (A) et le filtre à écoulement rapide papier carré (B). A. Les spectres pour le filtre à moyen écoulement brut papier carré était similaire à celle de l'APS filtre à moyen débit traité papi...
Discussion
le revêtement direct de chèvre purifié par affinité anti-Souris IgG-Fc de l'anticorps de capture sur des disques de papier de cellulose non modifié a été réalisée pour détecter les concentrations d'IgG. Les résultats indiquent que, outre la fixation des anticorps de capture est nécessaire pour la reproductibilité. La technique de silane a été utilisé avec succès pour introduire des groupes fonctionnels amine sur les disques de papier de cellulose 34. La concentration de l'APS affe...
Déclarations de divulgation
The authors have nothing to disclose.
Remerciements
This work was financially supported by the Ministry of Education, Singapore through the Translational and Innovation Grant (MOE2012-TIF-2-G-009).
matériels
| Name | Company | Catalog Number | Comments |
| Cellulose filter paper, Grade 1 (medium flow filter paper) | GE Healthcare Pte Ltd Singapore | 1001 110 | |
| Cellulose filter paper, Grade 113 (Fast flow filter paper) | Sigma-Aldrich, Singapore | 1113-320 | |
| Glutaraldehyde | Sigma-Aldrich, Singapore | G6257 | Grade II, 25% in H2O |
| Surfactant | Tween-20, Sigma-Aldrich, Singapore | P2287 | |
| Bovine serum album | Sigma-Aldrich, Singapore | A2153 | |
| Skimmed milk powder | Louis François | Packed by Kitchen Capers, Singapore | |
| Tris base | Promega | H5135 | |
| Sodium periodate | Merck | 106597 | |
| Na2HPO4 | Merck | 106585 | |
| KH2PO4 | Merck | 104873 | |
| NaCl | CALBIOCHEM | 567441 | |
| NaOH | Merck | 106462 | |
| HCl | Merck | 100317 | |
| phosphate buffer saline (PBS) | N/A | N/A | PBS, containing 137 mmol/L NaCl, 2.7 mmol/L KCl, 8.0 mmol/L Na2HPO4 and 1.5 mmol/L KH2PO4, is prepared with water and adjusted to pH 7.4 with 0.1 mol/L NaOH or 0.1 mol/L HCl |
| Acetone | Tee Hai Chem Pte Ltd Singapore | 9005-68 | |
| Mixture of TMB and hydrogen peroxide solution | 1-Step ultra TMB-ELISA solution , Thermo Scientific Pierce | 34029 | 1 L |
| Rabbit anti-human IgG-FITC | TWC/Bio Pte Ltd Singapore | sc-2278 | |
| Peroxidase conjugated goat anti-rabbit IgG | TWC/Bio Pte Ltd Singapore | sc-2030 | |
| Affinity purified goat anti-Mouse IgG-Fc coating antibody | Bethyl Laboratories, Inc | A90-131A | |
| Mouse reference serum | Bethyl Laboratories, Inc | RS10-101-5 | 9.5 mg/ml |
| HRP conjugated goat anti-mouse IgG-Fc detection antibody | Bethyl Laboratories, Inc | A90-131P | |
| Equipment | |||
| Fourier transform infrared spectrophotometer | Shimadzu IR Prestige-21 | N/A | |
| Fluorescence molecular imager | Pharos FXTM plus molecular imager, Bio-Rad, Singapore | N/A | |
| Oven | NUVE FN500 | N/A | |
| Turbo mixer VM-2000 | MYC LTD | N/A | |
| ImageJ | RGB, free download | N/A |
Références
- Curtis, K. A., Rudolph, D. L., Owen, S. M. Rapid detection of HIV-1 by reverse-transcription, loop-mediated isothermal amplification (RT-LAMP). J. Virol. Methods. 151 (2), 264-270 (2008).
- Martinez, A. W., Phillips, S. T., Carrilho, E., Thomas, S. W., Sindi, H., Whitesides, G. M. Simple telemedicine for developing regions: camera phones and paper-based microfluidic devices for real-time, off-site diagnosis. Anal. Chem. 80 (10), 3699-3707 (2008).
- Lode, P. V. Point-of-care immunotesting: approaching the analytical performance of central laboratory methods. Clin. Biochem. 38 (7), 591-606 (2005).
- Posthuma-Trumpie, G. A., Amerongen, A. V., Korf, J., Berkel, W. J. V. Perspectives for on-site monitoring of progesterone. Trends Biotechnol. 27 (11), 652-660 (2009).
- Lim, D. V., Simpson, J. M., Kearns, E. A., Kramer, M. F. Current and developing technologies for monitoring agents of bioterrorism and biowarfare. Clin. Microbiol. Rev. 18 (4), 583-607 (2005).
- Li, X., Tian, J., Shen, W. Progress in patterned paper sizing for fabrication of paperbased microfluidic sensors. Cellulose. 17 (3), 649-659 (2010).
- Nie, Z., et al. Electrochemical sensing in paper-based microfluidic devices. Lab Chip. 10, 477-483 (2010).
- Delaney, J. L., Hogan, C. F., Tian, J., Shen, W. Electrogenerated chemiluminescence detection in paper-based microfluidic sensors. Anal. Chem. 83 (4), 1300-1306 (2011).
- Oh, Y. K., Joung, H. A., Kim, S., Kim, M. G. Vertical flow immunoassay (VFA) biosensor for a rapid one-step immunoassay. Lab Chip. 13 (5), 768-772 (2013).
- Cheng, C. M., et al. Paper-based ELISA. Angew. Chem. 122 (28), 4881-4884 (2010).
- Jarujamrus, P., Tian, J., Li, X., Siripinyanond, A., Shiowatana, J., Shen, W. Mechanisms of red blood cells agglutination in antibody-treated paper. Analyst. 137 (9), 2205-2210 (2012).
- Credou, J., Volland, H., Dano, J., Berthelot, T. A one-step and biocompatible cellulose functionalization for covalent antibody immobilization on immunoassay membranes. J. Mat. Chem. B. 1, 3277-3286 (2013).
- Kong, F., Hu, Y. F. Biomolecule immobilization techniques for bioactive paper fabrication. Anal. Bioanal. Chem. 403, 7-13 (2012).
- Orelma, H., Teerinen, T., Johansson, L. S., Holappa, S., Laine, J. CMC-modified cellulose biointerface for antibody conjugation. Biomacromolecules. 13, 1051-1058 (2013).
- Yu, A., et al. Biofunctional paper via covalent modification of cellulose. Langmuir. 28 (30), 11265-11273 (2012).
- Stollner, D., Scheller, F. W., Warsinke, A. Activation of cellulose membranes with 1,1′-carbonyldiimidazole or 1-cyano-4-dimethylaminopyridinium tetrafluoroborate as a basis for the development of immunosensors. Anal Biochem. 304 (2), 157-165 (2002).
- Bora, U., Sharma, P., Kannan, K., Nahar, P. Photoreactive cellulose membrane - a novel matrix for covalent immobilization of biomolecules. J. Biotechnol. 126 (2), 220-229 (2006).
- Sharma, P., Basir, S. F., Nahar, P. Photoimmobilization of unmodified carbohydrates on activated surface. J Colloid Interface Sci. 342 (1), 202-204 (2010).
- Brumer, H., Zhou, Q., Baumann, M. J., Carlsson, K., Teeri, T. T. Activation of crystalline cellulose surfaces through the chemoenzymatic modification of xyloglucan. J. Am. Chem. Soc. 126 (18), 5715-5721 (2004).
- Araujo, A. C., Song, Y., Lundeberg, J., Stahl, P. L., Brumer, H. Activated paper surfaces for the rapid hybridization of DNA through capillary transport. Anal Chem. 84 (7), 3311-3317 (2012).
- Xu, C., Spadiut, O., Araujo, A. C., Nakhai, A., Brumer, H. Chemo-enzymatic Assembly of Clickable Cellulose Surfaces via Multivalent Polysaccharides. ChemSusChem. 5 (4), 661-665 (2012).
- Filpponen, I., et al. Generic method for modular surface modification of cellulosic materials in aqueous medium by sequential "click" reaction and adsorption. Biomacromolecules. 13 (3), 736-742 (2012).
- Feese, E., Sadeghifar, H., Gracz, H. S., Argyropoulos, D. S., Ghiladi, R. A. Photobactericidal porphyrin-cellulose nanocrystals: synthesis, characterization, and antimicrobial properties. Biomacromolecules. 12 (10), 3528-3539 (2011).
- Zang, D., Ge, L., Yan, M., Song, X., Yu, J. Electrochemical immunoassay on a 3D microfluidic paper-based device. Chem. Commun. 48 (39), 4683-4685 (2012).
- Ge, L., Yan, J. X., Song, X. R., Yan, M., Ge, S. J., Yu, J. H. Three-dimensional paper-based electrochemiluminescence immunodevice for multiplexed measurement of biomarkers and point-of-care testing. Biomaterials. 33 (4), 1024-1031 (2012).
- Wang, S., et al. Paper-based chemiluminescence ELISA: lab-on-paper based on chitosan modified paper device and wax-screen-printing. Biosens. Bioelectron. 31 (1), 212-218 (2012).
- Koev, S. T., et al. Chitosan: an integrative biomaterial for lab-on-a-chip devices. Lab Chip. 10, 3026-3042 (2010).
- Wang, S. M., et al. Simple and covalent fabrication of a paper device and its application in sensitive chemiluminescence immunoassay. Analyst. 137 (16), 3821-3827 (2012).
- Sadira, S., Prabhakaranc, M. P., Wicaksonob, D. H. B., Ramakrishna, S. Fiber based enzyme-linked immunosorbent assay for C-reactive protein. Sensor Actuat B-Chem. 205, 50-60 (2014).
- Koga, H., Kitaoka, T., Isogai, A. In situ modification of cellulose paper with amino groups for catalytic applications. J. Mater. Chem. 21, 9356-9361 (2011).
- Klemm, D., Heublein, B., Fink, H. P., Bohn, A. Cellulose: fascinating biopolymer and sustainable raw material. Angew. Chem., Int. Ed. 44 (22), 3358-3393 (2005).
- Fernandes, S. C. M., et al. Bioinspired antimicrobial and biocompatible bacterial cellulose membranes obtained by surface functionalization with aminoalkyl groups. ACS Appl. Mater. Interfaces. 5 (8), 3290-3297 (2013).
- . . Pharos FX plus molecular imager instructions, Catalog Number 170-9460. , (2005).
- Tee, Y. B., Talib, R. A., Abdan, K., Chin, N. L., Basha, R. K., Yunos, K. F. M. Aminosilane-grafted cellulose. BioResourses. 8 (3), 4468-4483 (2013).
- Xing, Y., et al. Bioconjugated quantum dots for multiplexed and quantitative immunohistochemistry. Nat Protoc. 2, 1152-1165 (2007).
- Guidi, A., Laricchia-Robbio, L., Gianfaldoni, D., Revoltella, R., Del Bono, G. Comparison of a conventional immunoassay (ELISA) with a surface plasmon resonance-based biosensor for IGF-1 detection in cows' milk. Biosens Bioelectron. 16, 971-977 (2001).
- Ahmed, S., Bui, M. N., Abbas, A. Paper-based chemical and biological sensors: Engineering aspects. Biosens Bioelectron. 77, 249-263 (2016).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon