Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Kovalente Bindung von Antikörpern an Cellulose Papierscheiben und ihre Anwendungen in der Naked-Augen Kolorimetrische Immunoassays
In diesem Artikel
Zusammenfassung
In this manuscript, periodate oxidation and glutaraldehyde cross-linking methods for covalent immobilization of antibodies on paper discs are presented. The binding activity of immobilized antibodies was evaluated. Based on these results, a glutaraldehyde cross-linking method was used to develop a novel paper-based immunoassay for immunoglobulin G (IgG) detection.
Zusammenfassung
Dieser Bericht stellt zwei Methoden für die kovalente Immobilisierung von Fänger-Antikörper auf Zellulosefilterpapierqualität No. 1 (mittel-Flow-Filterpapier) Scheiben und Qualität Nr 113 (Fast-Flow-Filterpapier) Discs. Diese Cellulosepapierscheiben wurden gepfropft mit funktionellen Amingruppen durch eine Silan-Kopplungstechnik bevor die Antikörper auf ihnen immobilisiert wurden. Periodat-Oxidation und Glutaraldehyd-Vernetzungsverfahren wurden verwendet, Capture-Antikörper auf den Cellulosepapierscheiben zu pfropfen. Um die maximale Bindungskapazität der Einfang-Antikörper an ihre Ziele nach der Immobilisierung wurden die Wirkungen verschiedener Konzentrationen von Natriumperiodat, Glutaraldehyd und Capture-Antikörper auf der Oberfläche der Papierscheiben wurden, um sicherzustellen, untersucht. Die Antikörper, die an den Amin-funktionalisierte Cellulose-Papierscheiben durch eine Glutaraldehyd-Vernetzungsmittel beschichtet wurden, zeigten Bindungsaktivität an die Ziel verbessert, wenn an die Periodat-Oxidationsverfahren im Vergleich. IgG (in Maus-Referenzserum) wurde als Referenzziel in dieser Studie verwendet, um die Anwendung der kovalent immobilisierte Antikörper durch Glutaraldehyd zu testen. Eine neue Papierbasis, enzyme-linked immunosorbent assay (ELISA) wurde für den Nachweis von IgG erfolgreich entwickelt und validiert. Dieses Verfahren erfordert keine Ausrüstung, und es kann 100 ng / ml IgG erkennen. Der Fast-Flow-Filterpapier war empfindlicher als die mittlere Stromfilterpapier. Die Inkubationszeit dieses Tests war kurz und benötigt kleine Probenvolumina. Diese mit bloßem Auge kann colorimetrischen Immunoassays erweitert werden, um andere Ziele zu erkennen, die mit konventionellen ELISA identifiziert werden.
Einleitung
Die Point-of-Care - Tests (POCT) diagnostische Studie ist wichtig für die Entwicklung neuer Strategien für die Therapie, personalisierte Medizin und Pflege zu Hause 1. Cellulose Papiere werden als Plattformen in Immunoassays weit verbreitet, da sie billig sind, zugänglich, und den Nutzern vertraut 2. Darüber hinaus besitzt die poröse Struktur von Cellulose-Papier die Leistung Flüssigkeitsstrom ohne zusätzliche Energieeinwirkung zu fahren. Aufzeichnungen von papierbasierten Bioanalytik kann bereits im 20. Jahrhundert gefunden werden, wenn das Papier Chromatographie zuerst im Jahr 1952. Die am weitesten verbreitete Beispiel ist immunchromatographischen Tests 3, wie Schwangerschaft und Diabetes erfunden wurde Teststreifen. Diese Tests liefern relativ schnelle Assayzeiten und kostengünstige Analyse 4. Aufgrund ihrer Einfachheit sind diese herkömmlichen Papierstreifentests wurden 5 in POCT Diagnostik weit verbreitet.
Nachweismethoden einschließlich farbmetrischen 6, elektro7 chemischen und Elektrochemilumineszenz 8 Methoden wurden Ziele zu messen , in biologischen Proben berichtet. Zusätzlich zu diesen quantitativen Verfahren, ein zuverlässiges Verfahren zum Nachweis von Antikörpern auf Cellulosepapier immobilisiert ist auch wichtig für die Entwicklung von Diagnostika. Unspezifische Adsorption ist die Hauptstrategie für die Antikörper auf der Oberfläche der papierbasierten Vorrichtungen 9, 10 , um sicherzustellen , maximale Bindungskapazität an ihre Ziele nach der Immobilisierung zu modifizieren. Allerdings ist eine vorherige Studie zeigten , dass Antikörper , die aus den Fasern auf Zellulosepapier adsorbiert werden , 11 um 40% desorbieren kann. Somit kann eine direkte Adsorption von Antikörpern auf Cellulose nicht reproduzierbare Ergebnisse 12 liefern. Kovalente Immobilisierung von Antikörpern, die auf den Papieroberflächen gepfropft werden , ist eine alternative Methode der Entwicklung wirksamer papierbasierten Bioassays 13. Es wurden verschiedene Verfahren zur Modifikation von Cellulose 14, 15 berichtet . Im Idealfall sollten Antikörper ihre ursprüngliche Funktionalität nach 12 Immobilisierung erhalten. Carbonyldiimidazol in Kombination mit 1-cyano-4-dimethylaminopyridinium Tetrafluoroborat 16; 1-Fluor-2-nitro-4-azidobenzene durch eine UV-basierte Aktivierungsstrategie 17, 18; eine chemoenzymatischen Strategie auf Xyloglucan Modifikation 19 basiert; eine 1,4-Phenylendiisothiocyanat Verknüpfungsmittel 20; Heteropolysaccharid Oxidation 21 Klick - Chemie 22; und kationische Porphyrine 23 verwendet wurden , um kovalent Biomoleküle auf Cellulosepapier zu immobilisieren. Chitosan modifizierte Papier wurde verwendet , um auf Papierbasis immunodevices 24-26 entwickeln , da es reichlich und biokompatibel ist 27. Chitosan ist kationisch und haftet stark an anionischen Cellulose 27. Die Capture-Antikörper sind auf dem Papier durch Beschichtung Chitosan und Glutaraldehyd Vernetzung immobilisiert. Periodat-Oxidation ist eine weitere Methode, um die capt zum Pfropfenure Antikörper auf der Zellulosepapier 28. In diesem Verfahren wird Natriumperiodat auf dem Papier getüpfelt 1,2-dihydroxyl (Glykol) Gruppen in Cellulose zu Aldehydgruppen direkt zu konvertieren. Die Aldehydgruppen werden dann verwendet , 28 kovalenten Bindungen zwischen Polysacchariden und Antikörper zu bilden. Obwohl die Herstellung einfach ist, ist es schwierig, Natriumperiodat vollständig auszuwaschen. Das ungewaschene Natriumperiodat kann eine weitere Oxidation der Antikörper führen, die auf dem Cellulosepapier immobilisiert sind, die Aktivität und die Stabilität der Antikörper beeinflussen N -. (3-dimethylaminopropyl) - N -ethylcarbodiimide Hydrochlorid und N - Hydroxysuccinimid Vernetzer werden auch verwendet , um kovalent Antikörper auf elektrogesponnen poly-L-Milchsäure und Celluloseacetat - Nanofasern für die Entwicklung von Nanofaser basierenden Tests 29 zu immobilisieren.
In dieser Studie wurde ein Silan-Kupplungstechnik verwendet funktionelle Amingruppen auf cellulos aufzupfropfene Papierscheiben. Diese Technik hilft, die ursprüngliche Porengröße, Feuchtigkeitsregulierung, und Filtrationsrate der Zellulosefilterpapiere, so dass maximale vertikale Durchströmung in Immunoassays zu behalten. Das Silan-Kopplungstechnik wurde in Biosensoren zu funktionalisieren Substratoberflächen mit sekundären Amingruppen, gefolgt von einer weiteren Modifikation unter Verwendung von Biomolekülen verwendet. Das Pfropfen von Amingruppen auf der Matrixoberfläche umfaßt eine Kondensationsreaktion zwischen OH - Gruppen des organofunktionellen Silans Mittel und Matrixsubstrat 30. Die Cellulosepapierscheiben wurden durch 3-Aminopropyltrimethoxysilan (APS) 31 mit Amingruppen durch Silan - Kupplungs funktionalisiert. Dies wurde durch kovalente Immobilisieren Fänger-Antikörper, gefolgt mit zwei verschiedenen Methoden. Das erste Verfahren beteiligt Bindung von Periodat oxidierten Fänger-Antikörper an die Amincellulosepapierscheiben funktionalisiert. Das zweite Verfahren verwendet Glutaraldehyd als Vernetzungsmittel die Erfassung Antibodi anhängenes zu den Amingruppen funktionalisierten Zellulosepapierscheiben. Die Anwesenheit von Capture-Antikörper wurde von Kaninchen-anti-human IgG-Fluorescein-Isothiocyanat (FITC) bestätigt wird, eine Fluoreszenz Molecular Imager verwendet. Die Bindungsaktivität von Kaninchen-anti-human-IgG-FITC an Ziege-IgG-Anti-Kaninchen wurde auch von Peroxidase-Substrat ausgewertet. Die Wirkungen verschiedener Konzentrationen von Natriumperiodat, Glutaraldehyd und Einfang-Antikörper untersucht. Anwendungstest der immobilisierten Einfang-Antikörper wurde erfolgreich durch den Nachweis von IgG-Serum durchgeführt.
Protokoll
1. Verpflanzen funktionellen Amingruppen auf Cellulose Papierscheiben
- Bereiten Sie ein Stück Quadrat Papier mit einer Abmessung von 1 cm × 1 cm und 100 Papierscheiben aus Qualität Nr 1 Zellulosepapier mit einem Durchmesser von 6,0 mm (mittel-Flow-Filterpapier) mit einem Lochdurchschlag.
- Zur Ableitung NH2 - Gruppen auf den Papierscheiben, mischen Sie 1 ml APS und 10 ml Aceton in einem 50 ml - Glasflasche in der Abzugshaube. In Papierscheiben mit dem frisch APS Reagenz - Mischung hergestellt, und Inkubation für 5 Stunden mit Orbital Rühren (200 UpM) bei Raumtemperatur 32.
Vorsicht: Behandeln Sie APS und Aceton in der Abzugshaube. - Dekantieren überschüssige Lösung aus dem 50-ml-Glasflasche in einem organischen Abfallbehälter.
- In 10 ml Aceton zu der Glasflasche, gut mischen und dekantieren vollständig alle nicht umgesetzten APS und andere Verunreinigungen zu entfernen. Wiederholen Sie diesen Schritt zweimal.
- Verbreiten Sie die Papierscheiben auf dem Papiertuch und in einem 110 ° C heißen Ofen für 3 Stunden. Lassen Sie diePapierscheiben zu kühlen. Speichern der Scheiben in einer 50 ml-Zentrifugenröhrchen bei Raumtemperatur.
- Verwenden Sie Fourier - Transformations - Infrarot - Spektroskopie (FTIR) das Pfropfen von Amingruppen auf der Cellulose - Quadrat Papier zu überprüfen, wie weiter unten (3A) beschrieben.
- Schalten Sie den Computer und öffnen Sie die FTIR-Spektroskopie Instrument.
- Öffnen Sie die Software für FTIR-Spektroskopie.
- Gehen Sie zu 'Messung → Initialisieren ". Die Rechtecke für 'BS: KBr', 'Lampe: Infrarot "und" Laser "wird grün, wenn die Initialisierung abgeschlossen ist.
- Wählen Sie "Daten" unter den Rechtecke, und wählen Sie "% Transmission", "Happ-Genzel ',' 45 ',' 4.0 'und' Min: 400, Max: 4000" für "Messmodus", "Apodization ',' Nein. von Scans "," Auflösung "und" Range (cm-1) '.
- Klicken Sie auf "Messen".
- Wählen Sie "Datendatei" für die Hintergrunddaten. Schreibenunten die Kommentare.
- Klicken Sie auf "BKG", um die Basis für den Hintergrund zu erhalten.
- Befestigen Sie das Quadrat Papier auf dem Filmprobenhalter.
- Wählen Sie "Datendatei" für die Beispieldaten. Schreiben Sie die Kommentare unten.
- Klicken Sie auf "Probe", um die Spektren für die Probe zu erhalten.
- Schließen Sie die FTIR-Spektroskopie Anwendung und schalten Sie den Computer aus.
- Wiederholen Sie die Schritte (Schritte 1.1 bis 1.6) Amin-funktionalisierte Qualität Nr 113 Cellulose - Quadrat Papier und Scheiben (Fast-Flow - Filterpapier), die Vorbereitung und die FTIR - Spektren für die Qualität Nr 113 Quadrat Papier (3B) erhalten.
2. Kovalente Immobilisierung von Antikörpern auf Amin-funktionalisierte Cellulose Papierscheiben
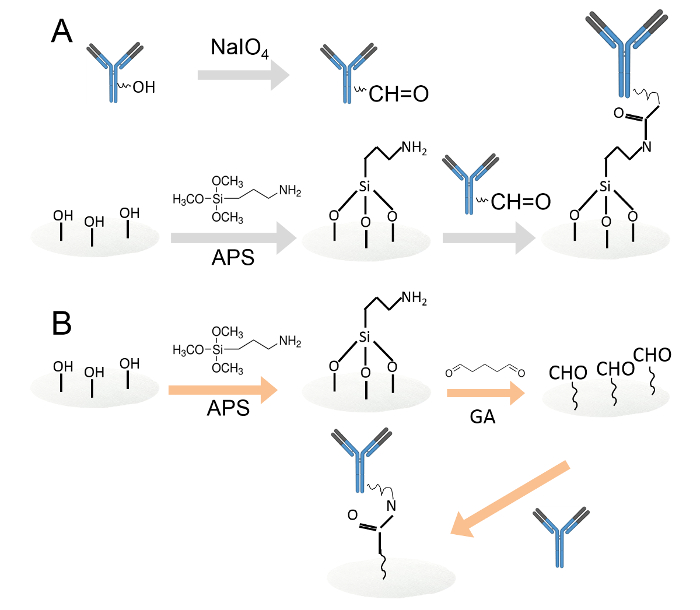
Abbildung 1. Kovalente Immobilisierung von Antikörpern durch zwei verschiedene Methoden.A. Immobilisiert Antikörper auf Amin-funktionalisierten Zellulosepapierscheiben durch Periodat - Oxidation. Die Kohlenhydratreste wurden durch Natriumperiodat oxidiert, um Aldehydfunktionen erzeugen. Dann wurden die oxidierten Antikörpern beladen auf Amin-funktionalisierten Zellulosepapierscheiben. B. Die Antikörper wurden dann auf Amin-funktionalisierten Zellulosepapierscheiben durch Glutaraldehyd immobilisiert. Die Amin-funktionalisierten Zellulosepapierscheiben wurden in 0,05% Glutaraldehyd-Lösung getaucht, um Aldehydgruppen zu den Papierscheiben einzuführen. Nach dem Waschen wurden auf den Aldehyd funktionalisiert Papierscheiben geladen Antikörper. Bitte hier klicken , um eine größere Version dieser Figur zu sehen.
- Immobilisieren Antikörper auf Amin-funktionalisierte Cellulose - Papierscheiben durch Periodat - Oxidation (1A).
- Mischen Sie 1 ul 2,5 mM Natrium periodate mit 2 ul 0,1 mg / ml Kaninchen-anti-human-IgG-FITC und 7 & mgr; l 100 mM pH 5,5 Acetatpuffer in einem 1,5-ml-Röhrchen, und die Mischung im Dunkeln für 30 min inkubieren.
HINWEIS: Dieses Volumenverhältnis mehr oxidierter Antikörper bei Bedarf herzustellen. Verändern des Volumenverhältnisses der Konzentration von Natriumperiodat und Kaninchen-anti-human-IgG-FITC zu optimieren. - Verdünne die obigen Antikörperlösung mit 30 ul 50 mM Phosphatpuffersalzlösung (PBS; pH 7,4) auf ein Endvolumen von 40 & mgr; l.
- Bereiten Sie drei Amin-funktionalisierte Medium-Flow Filterpapierscheiben und drei Amin-funktionalisierte Fast-Flow Papierscheiben (wie in Abschnitt 1 beschrieben).
- Last 5 ul des Natriumperiodat oxidiert Kaninchen-anti-human-IgG-FITC auf jedes Medium Stromfilterpapierscheibe und 8 & mgr; l auf jeden schnellen Stromfilterpapierscheibe. Bewahren Sie diese Papierscheiben im Dunkeln für eine Stunde bei Raumtemperatur.
- Waschen jeder der Papierscheibe mit 0,2 ml Wasch Schwabbelscheibeer (50 mM Tris-Puffer mit 0,15 M NaCl und 0,05% Tensid, pH 7,4). Wiederholen Sie die Wäsche dreimal.
- Fotografieren die Fluoreszenzbilder durch ein Fluoreszenz Molecular Imager 32 , um die Anwesenheit von Antikörpern auf jedem Cellulosepapierscheibe zu identifizieren. Verwenden Sie leere Papierscheiben (mit der gleichen Konzentration von Antikörpern in Abwesenheit von Natriumperiodat behandelt) als Kontrolle (Abbildung S1 S3 Abbildung).
HINWEIS: Für experimentelle Optimierung, um die Konzentration von einem Parameter zu ändern, die optimiert werden muss, und die Konzentrationen aller anderen Parameter fixieren. Eine hohe Fluoreszenzintensität erhöht die Menge an Fänger-Antikörper, der auf den Cellulosepapierscheiben immobilisiert sind.
- Mischen Sie 1 ul 2,5 mM Natrium periodate mit 2 ul 0,1 mg / ml Kaninchen-anti-human-IgG-FITC und 7 & mgr; l 100 mM pH 5,5 Acetatpuffer in einem 1,5-ml-Röhrchen, und die Mischung im Dunkeln für 30 min inkubieren.
- Unbeweglichkeitseffekt Antikörper auf Amin funktionalisierten Zellulosepapierscheiben durch Glutaraldehyd (1B).
- Fügen Sie die drei APS behandelte Medium-Flow-Filterpapierscheiben und die drei schnellen Stromfilterpapierscheiben (described in Abschnitt 1) zu 2 ml 50 mM PBS (pH 7,4), die 0,05% Glutaraldehyd für 1 h enthält, mit orbital Rühren bei Raumtemperatur.
Vorsicht: Behandeln Sie Glutaraldehyd in der Abzugshaube. - Legen Sie drei Scheiben jeweils in zwei 1,5 ml Zentrifugenröhrchen. 1 ml deionisiertem (DI) Wasser zu jedem Röhrchen und schütteln die Röhrchen für 10 Sekunden. Entfernen Sie das Wasser, indem sie mit einer Pipette abgesaugt. Wiederholen Sie zwei weitere Male nicht umgesetztem Glutaraldehyd zu entfernen.
- Last 5 ul von 25 ug / ml Kaninchen-anti-human-IgG-FITC (Fänger-Antikörper) auf jedes Aldehyd-funktionalisierten Mittelströmungsfilterpapierscheibe, und fügen 8 ul auf jedes Aldehyd-funktionalisierten schnellen Stromfilterpapierscheibe. im Dunkeln inkubieren etwa 20 min bei Raumtemperatur. Dann werden 10 ul 50 mM PBS (pH 7,4) zu jeder Papierscheibe, ohne die Antikörper zu entfernen und für 40 min für die Amin Aldehydreaktion inkubieren.
- Waschen Sie die Papierscheiben mit 0,2 ml Waschpuffer auf einem Papiertuch. Wiederholen Sie diewaschen zweimal.
- Fotografieren die Fluoreszenzbilder durch ein Fluoreszenz Molecular Imager auf die Anwesenheit von Antikörpern auf jeder Zellulosepapierscheibe 33 zu überprüfen. Verwenden Sie leere Papierscheiben als Kontrolle.
HINWEIS: In 4 "0" steht für die leeren Papierscheibe , die mit der gleichen Konzentration von FITC-Antikörper in der Abwesenheit von Glutaraldehyd behandelt wurde; in 5A wurden die leere Papierscheiben mit Glutaraldehyd behandelt, aber keine FITC-Antikörper wurden auf die Papierscheiben geladen.
- Fügen Sie die drei APS behandelte Medium-Flow-Filterpapierscheiben und die drei schnellen Stromfilterpapierscheiben (described in Abschnitt 1) zu 2 ml 50 mM PBS (pH 7,4), die 0,05% Glutaraldehyd für 1 h enthält, mit orbital Rühren bei Raumtemperatur.
- Trocknen Sie die Papierscheiben (aus den Abschnitten 2.1 und 2.2) bei 37 ° C für 10 min.
- Blockieren die Papierscheiben mit 15 & mgr; l Blockierungspuffer (10% Magermilchpulver in 50 mM Tris-Puffer, pH 7,4, mit 0,15 M NaCl) für 10 min bei Raumtemperatur.
- Last 5 ul und 8 ul Peroxidase-konjugiertes Ziege-anti-Kaninchen-IgG in PBS (1: 10.000) auf Mittelströmung und schnelle Stromfilterpapierscheiben, respectively. inkubieren30 min im Dunkeln bei Raumtemperatur.
- Waschen Sie die Papierscheiben mit 0,2 ml Waschpuffer auf einem Papiertuch. Wiederholen Sie die Wäsche dreimal.
HINWEIS: Es ist nicht notwendig, die Waschpuffer, da die Ergebnisse durch den Puffer betroffen sind nicht zu entfernen. - Legen Sie eine 10 ul Gemisch aus 3,3 ', 5,5'-Tetramethylbenzidin (TMB) und Wasserstoffperoxid-Lösung auf jeder Scheibe.
- Nehmen Sie Bilder der Papierscheiben mit einer Digitalkamera oder Smartphone nach 5 min Inkubation.
HINWEIS: In 5B, "0" steht für die Papierscheiben , die mit Glutaraldehyd behandelt wurden, gefolgt durch Laden Antikörper-HRP (Meerrettichperoxidase) Konjugat in Abwesenheit von FITC-Antikörper.
3. Papier-basierten ELISA für IgG-Nachweis
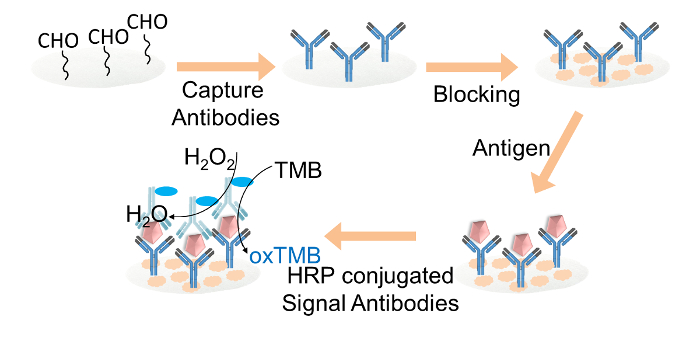
Abbildung 2. Schematische Darstellung der Papier-basierten ELISA for IgG - Nachweis. Fänger - Antikörper wurden auf den Aldehyd-funktionalisierten Zellulosepapierscheiben durch Glutaraldehyd kovalent immobilisiert. Die Cellulosepapierscheiben wurden mit Blockierungspuffer blockiert. Target IgG wurde dann zu den Scheiben gegeben, gefolgt von der Beladung von HRP-konjugiertem Antikörper Signal. Schließlich wurde das TMB und Wasserstoffperoxid - Mischung Lösung auf jede Papierscheibe für die Farbanzeige geladen. Bitte hier klicken , um eine größere Version dieser Figur zu sehen.
- 5 ml 0,05% Glutaraldehyd-Lösung (hergestellt in 50 mM PBS-Puffer, pH 7,4) auf eine 20 ml Glasflasche. Tauchen 15 aminfunktionalisierten Medium Stromfilterpapierscheiben in dieser Lösung und halten für 1 h mit Schütteln bei Raumtemperatur.
- Gleichzeitig wiederholen Sie Schritt 3,1 bis 15 weitere Aldehyd funktionalisiert schnell Stromfilterpapierscheiben herzustellen.
Vorsicht: Behandeln Sie Glutaraldehyd im RauchHaube.
- Gleichzeitig wiederholen Sie Schritt 3,1 bis 15 weitere Aldehyd funktionalisiert schnell Stromfilterpapierscheiben herzustellen.
- Zur Entfernung von nicht umgesetztem Glutaraldehyd aus den Papierscheiben, legen Sie die 15-Medium-Flow-Filterpapierscheiben in einem 15 ml Zentrifugenröhrchen, und die 15 schnellen Stromfilterpapierscheiben in einem anderen 15 ml Zentrifugenröhrchen. 5 ml DI-Wasser zu jedem Röhrchen und schütteln die Röhrchen für 10 Sekunden. Entfernen Sie das Wasser, indem sie mit einer Pipette abgesaugt. Wiederholen Sie zweimal nicht umgesetztes Glutaraldehyd zu entfernen.
- Trocknen Sie die Papierscheiben in einem 37 ° C-Ofen.
- Werden 5 ul und 8 ul 0,025 mg / ml Maus-IgG-Fc-Fragment, Antikörper gegen jede der Mittelströmung und schnellen Stromfilterpapierscheiben bzw. und für 20 min inkubieren.
- Zugabe von 10 ul 50 mM PBS (pH 7,4) zu jeder Papierscheibe, ohne die Antikörper zu entfernen und Inkubation für 40 min für die Amin Aldehydreaktion.
- Waschen Sie die Papierscheiben mit 0,2 ml Waschpuffer auf einem Papiertuch. Wiederholen Sie die Wäsche dreimal.
- Trocknen Sie die Papierscheiben in einem Ofen bei 37 ° C.
- Blockieren Sie die Papierscheiben with 15 ul Puffer für 10 min bei Raumtemperatur blockiert.
- Waschen Sie jeden Papierscheibe mit 0,2 ml Waschpuffer auf einem Papiertuch. Wiederholen Sie die Wäsche dreimal.
- Führen Sie IgG-Standards.
- Last 10 ul verschiedener IgG - Konzentrationen (beispielsweise 0, 10, 125, 250 und 500 ng / ml in PBS) auf jeder Scheibe in dreifacher Ausführung. Inkubieren für 1 h bei Raumtemperatur.
- Waschen Sie die Papierscheiben mit 0,2 ml Waschpuffer auf einem Papiertuch. Wiederholen Sie die Wäsche dreimal.
- Last 10 ul HRP konjugierten Maus-IgG-Fc-Fragment-Antikörper (1: 10.000, 10 mM PBS, pH 7,4) und bei Raumtemperatur für 1 Stunde inkubiert.
- Waschen Sie die Papierscheiben mit 0,2 ml Waschpuffer auf einem Papiertuch. Wiederholen Sie die Wäsche dreimal.
HINWEIS: Es ist nicht notwendig, die Waschpuffer, da die Ergebnisse durch die Anwesenheit von Puffer betroffen sind nicht zu entfernen. - Legen Sie eine 10 & mgr; l Mischung von TMB und Wasserstoffperoxid auf jeder Scheibe.
- Take Bilder aller Papierscheiben mit einer Digitalkamera oder Smartphone nach 5 min Inkubation.
HINWEIS: In 6A '0' steht für Papierscheiben mit Fänger - Antikörper Immobilisierung behandelt, und die Antikörper-HRP / TMB - Lösung ohne IgG - Serum. - Analysieren Sie die Intensität der einzelnen Papierscheibe im Bild durch Bild J.
- Konvertieren Sie die aufgenommenen Bilder in Schritt 3,15 bis '.tif' Format.
- Open 'Bild J' Software.
- Gehen Sie zu 'Datei → Öffnen ", wählen Sie das Bild zu analysieren.
- Wählen Sie die Form Schaltfläche "Oval".
- Gehen Sie zu 'Bild → Typ → 32 Bit ".
- Gehen Sie zu 'Bearbeiten → Invert ".
- Gehen Sie zu 'Analysieren → Messen ".
- Kopieren und die Daten in einer Tabelle zu analysieren.
Ergebnisse
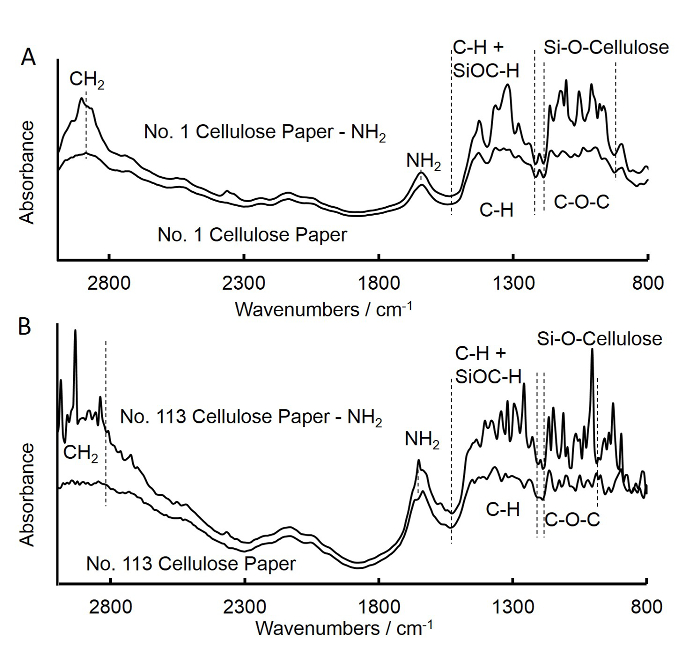
Abbildung 3. Fourier - Transformations - Infrarot (FTIR) Spektren von unbehandeltem und mittleren Stromfilter quadratischem Papier (A)-APS behandelt und schnelle Stromfilter quadratischem Papier (B). A. Die Spektren für unbehandeltes Medium-Flow-Filter quadratischem Papier war ähnlich dem von APS behandelte Medium-Flow-Filter quadra...
Diskussion
Direktbeschichtung von affinitätsgereinigtem Ziege-anti-Maus-IgG-Fc-Capture-Antikörper auf unmodifizierten Cellulosepapierscheiben wurde durchgeführt, um IgG-Konzentrationen nachzuweisen. Die Ergebnisse zeigten, dass es zur weiteren Fixierung der Fänger-Antikörper ist für die Reproduzierbarkeit erforderlich. Das Silan - Technik wurde erfolgreich einzuführen Amin - funktionellen Gruppen zu den Cellulosepapierscheiben 34 eingesetzt. Die Konzentration der APS betrifft die Immobilisierung von Antikörpern....
Offenlegungen
The authors have nothing to disclose.
Danksagungen
This work was financially supported by the Ministry of Education, Singapore through the Translational and Innovation Grant (MOE2012-TIF-2-G-009).
Materialien
| Name | Company | Catalog Number | Comments |
| Cellulose filter paper, Grade 1 (medium flow filter paper) | GE Healthcare Pte Ltd Singapore | 1001 110 | |
| Cellulose filter paper, Grade 113 (Fast flow filter paper) | Sigma-Aldrich, Singapore | 1113-320 | |
| Glutaraldehyde | Sigma-Aldrich, Singapore | G6257 | Grade II, 25% in H2O |
| Surfactant | Tween-20, Sigma-Aldrich, Singapore | P2287 | |
| Bovine serum album | Sigma-Aldrich, Singapore | A2153 | |
| Skimmed milk powder | Louis François | Packed by Kitchen Capers, Singapore | |
| Tris base | Promega | H5135 | |
| Sodium periodate | Merck | 106597 | |
| Na2HPO4 | Merck | 106585 | |
| KH2PO4 | Merck | 104873 | |
| NaCl | CALBIOCHEM | 567441 | |
| NaOH | Merck | 106462 | |
| HCl | Merck | 100317 | |
| phosphate buffer saline (PBS) | N/A | N/A | PBS, containing 137 mmol/L NaCl, 2.7 mmol/L KCl, 8.0 mmol/L Na2HPO4 and 1.5 mmol/L KH2PO4, is prepared with water and adjusted to pH 7.4 with 0.1 mol/L NaOH or 0.1 mol/L HCl |
| Acetone | Tee Hai Chem Pte Ltd Singapore | 9005-68 | |
| Mixture of TMB and hydrogen peroxide solution | 1-Step ultra TMB-ELISA solution , Thermo Scientific Pierce | 34029 | 1 L |
| Rabbit anti-human IgG-FITC | TWC/Bio Pte Ltd Singapore | sc-2278 | |
| Peroxidase conjugated goat anti-rabbit IgG | TWC/Bio Pte Ltd Singapore | sc-2030 | |
| Affinity purified goat anti-Mouse IgG-Fc coating antibody | Bethyl Laboratories, Inc | A90-131A | |
| Mouse reference serum | Bethyl Laboratories, Inc | RS10-101-5 | 9.5 mg/ml |
| HRP conjugated goat anti-mouse IgG-Fc detection antibody | Bethyl Laboratories, Inc | A90-131P | |
| Equipment | |||
| Fourier transform infrared spectrophotometer | Shimadzu IR Prestige-21 | N/A | |
| Fluorescence molecular imager | Pharos FXTM plus molecular imager, Bio-Rad, Singapore | N/A | |
| Oven | NUVE FN500 | N/A | |
| Turbo mixer VM-2000 | MYC LTD | N/A | |
| ImageJ | RGB, free download | N/A |
Referenzen
- Curtis, K. A., Rudolph, D. L., Owen, S. M. Rapid detection of HIV-1 by reverse-transcription, loop-mediated isothermal amplification (RT-LAMP). J. Virol. Methods. 151 (2), 264-270 (2008).
- Martinez, A. W., Phillips, S. T., Carrilho, E., Thomas, S. W., Sindi, H., Whitesides, G. M. Simple telemedicine for developing regions: camera phones and paper-based microfluidic devices for real-time, off-site diagnosis. Anal. Chem. 80 (10), 3699-3707 (2008).
- Lode, P. V. Point-of-care immunotesting: approaching the analytical performance of central laboratory methods. Clin. Biochem. 38 (7), 591-606 (2005).
- Posthuma-Trumpie, G. A., Amerongen, A. V., Korf, J., Berkel, W. J. V. Perspectives for on-site monitoring of progesterone. Trends Biotechnol. 27 (11), 652-660 (2009).
- Lim, D. V., Simpson, J. M., Kearns, E. A., Kramer, M. F. Current and developing technologies for monitoring agents of bioterrorism and biowarfare. Clin. Microbiol. Rev. 18 (4), 583-607 (2005).
- Li, X., Tian, J., Shen, W. Progress in patterned paper sizing for fabrication of paperbased microfluidic sensors. Cellulose. 17 (3), 649-659 (2010).
- Nie, Z., et al. Electrochemical sensing in paper-based microfluidic devices. Lab Chip. 10, 477-483 (2010).
- Delaney, J. L., Hogan, C. F., Tian, J., Shen, W. Electrogenerated chemiluminescence detection in paper-based microfluidic sensors. Anal. Chem. 83 (4), 1300-1306 (2011).
- Oh, Y. K., Joung, H. A., Kim, S., Kim, M. G. Vertical flow immunoassay (VFA) biosensor for a rapid one-step immunoassay. Lab Chip. 13 (5), 768-772 (2013).
- Cheng, C. M., et al. Paper-based ELISA. Angew. Chem. 122 (28), 4881-4884 (2010).
- Jarujamrus, P., Tian, J., Li, X., Siripinyanond, A., Shiowatana, J., Shen, W. Mechanisms of red blood cells agglutination in antibody-treated paper. Analyst. 137 (9), 2205-2210 (2012).
- Credou, J., Volland, H., Dano, J., Berthelot, T. A one-step and biocompatible cellulose functionalization for covalent antibody immobilization on immunoassay membranes. J. Mat. Chem. B. 1, 3277-3286 (2013).
- Kong, F., Hu, Y. F. Biomolecule immobilization techniques for bioactive paper fabrication. Anal. Bioanal. Chem. 403, 7-13 (2012).
- Orelma, H., Teerinen, T., Johansson, L. S., Holappa, S., Laine, J. CMC-modified cellulose biointerface for antibody conjugation. Biomacromolecules. 13, 1051-1058 (2013).
- Yu, A., et al. Biofunctional paper via covalent modification of cellulose. Langmuir. 28 (30), 11265-11273 (2012).
- Stollner, D., Scheller, F. W., Warsinke, A. Activation of cellulose membranes with 1,1′-carbonyldiimidazole or 1-cyano-4-dimethylaminopyridinium tetrafluoroborate as a basis for the development of immunosensors. Anal Biochem. 304 (2), 157-165 (2002).
- Bora, U., Sharma, P., Kannan, K., Nahar, P. Photoreactive cellulose membrane - a novel matrix for covalent immobilization of biomolecules. J. Biotechnol. 126 (2), 220-229 (2006).
- Sharma, P., Basir, S. F., Nahar, P. Photoimmobilization of unmodified carbohydrates on activated surface. J Colloid Interface Sci. 342 (1), 202-204 (2010).
- Brumer, H., Zhou, Q., Baumann, M. J., Carlsson, K., Teeri, T. T. Activation of crystalline cellulose surfaces through the chemoenzymatic modification of xyloglucan. J. Am. Chem. Soc. 126 (18), 5715-5721 (2004).
- Araujo, A. C., Song, Y., Lundeberg, J., Stahl, P. L., Brumer, H. Activated paper surfaces for the rapid hybridization of DNA through capillary transport. Anal Chem. 84 (7), 3311-3317 (2012).
- Xu, C., Spadiut, O., Araujo, A. C., Nakhai, A., Brumer, H. Chemo-enzymatic Assembly of Clickable Cellulose Surfaces via Multivalent Polysaccharides. ChemSusChem. 5 (4), 661-665 (2012).
- Filpponen, I., et al. Generic method for modular surface modification of cellulosic materials in aqueous medium by sequential "click" reaction and adsorption. Biomacromolecules. 13 (3), 736-742 (2012).
- Feese, E., Sadeghifar, H., Gracz, H. S., Argyropoulos, D. S., Ghiladi, R. A. Photobactericidal porphyrin-cellulose nanocrystals: synthesis, characterization, and antimicrobial properties. Biomacromolecules. 12 (10), 3528-3539 (2011).
- Zang, D., Ge, L., Yan, M., Song, X., Yu, J. Electrochemical immunoassay on a 3D microfluidic paper-based device. Chem. Commun. 48 (39), 4683-4685 (2012).
- Ge, L., Yan, J. X., Song, X. R., Yan, M., Ge, S. J., Yu, J. H. Three-dimensional paper-based electrochemiluminescence immunodevice for multiplexed measurement of biomarkers and point-of-care testing. Biomaterials. 33 (4), 1024-1031 (2012).
- Wang, S., et al. Paper-based chemiluminescence ELISA: lab-on-paper based on chitosan modified paper device and wax-screen-printing. Biosens. Bioelectron. 31 (1), 212-218 (2012).
- Koev, S. T., et al. Chitosan: an integrative biomaterial for lab-on-a-chip devices. Lab Chip. 10, 3026-3042 (2010).
- Wang, S. M., et al. Simple and covalent fabrication of a paper device and its application in sensitive chemiluminescence immunoassay. Analyst. 137 (16), 3821-3827 (2012).
- Sadira, S., Prabhakaranc, M. P., Wicaksonob, D. H. B., Ramakrishna, S. Fiber based enzyme-linked immunosorbent assay for C-reactive protein. Sensor Actuat B-Chem. 205, 50-60 (2014).
- Koga, H., Kitaoka, T., Isogai, A. In situ modification of cellulose paper with amino groups for catalytic applications. J. Mater. Chem. 21, 9356-9361 (2011).
- Klemm, D., Heublein, B., Fink, H. P., Bohn, A. Cellulose: fascinating biopolymer and sustainable raw material. Angew. Chem., Int. Ed. 44 (22), 3358-3393 (2005).
- Fernandes, S. C. M., et al. Bioinspired antimicrobial and biocompatible bacterial cellulose membranes obtained by surface functionalization with aminoalkyl groups. ACS Appl. Mater. Interfaces. 5 (8), 3290-3297 (2013).
- . . Pharos FX plus molecular imager instructions, Catalog Number 170-9460. , (2005).
- Tee, Y. B., Talib, R. A., Abdan, K., Chin, N. L., Basha, R. K., Yunos, K. F. M. Aminosilane-grafted cellulose. BioResourses. 8 (3), 4468-4483 (2013).
- Xing, Y., et al. Bioconjugated quantum dots for multiplexed and quantitative immunohistochemistry. Nat Protoc. 2, 1152-1165 (2007).
- Guidi, A., Laricchia-Robbio, L., Gianfaldoni, D., Revoltella, R., Del Bono, G. Comparison of a conventional immunoassay (ELISA) with a surface plasmon resonance-based biosensor for IGF-1 detection in cows' milk. Biosens Bioelectron. 16, 971-977 (2001).
- Ahmed, S., Bui, M. N., Abbas, A. Paper-based chemical and biological sensors: Engineering aspects. Biosens Bioelectron. 77, 249-263 (2016).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten