Method Article
小鼠胚胎Hemogenic内皮细胞的分离
* 这些作者具有相同的贡献
摘要
造血干细胞和祖细胞(HSPC)的发展过程中从专门(hemogenic)内皮细胞衍生,还知之甚少由一些内皮细胞指定成为血液形成的过程。我们展示了一个流式细胞仪为基础的方法,允许从鼠胚胎组织hemogenic内皮细胞和HSPC的同时分离。
摘要
从胚胎血管内皮hemogenic内皮细胞的规格在不同组织中短暂的发展时期发生,并且是必要的权威性HSPC从鼠额外的胚胎卵黄囊,胎盘,脐带血管和胚胎主动脉 - 性腺 - 中肾的出现( AGM)地区。该细胞群的瞬时性质和小尺寸使得其小心量化和实验应用再现的隔离技术上困难。我们已经在在卵黄囊和AGM的峰值生成时间建立了荧光激活细胞分选(FACS)的协议为hemogenic内皮细胞和HSPC的同时分离。我们演示了卵黄囊和从小鼠胚胎AGM组织解剖方法,以及我们提出之前通过流式细胞仪识别和检索最大细胞存活优化组织消化和抗体偶联条件。代表FACS ANA裂解图所示标识的hemogenic内皮细胞和表型HSPC,并描述基于甲基纤维素法对克隆水平评估其造血的潜力。
引言
一个功能循环系统需要血管和血细胞的并行开发。在血液开发(原始造血)的最初阶段,红细胞的起源仍然热烈讨论1。相反,在血细胞发育(永久造血)的后期阶段,它已成为越来越清楚,多系HSPC从卵黄囊,胎盘内获得造血潜力(hemogenic内皮细胞)专门血管内皮细胞和AGM出现2-5,以及在卵黄和脐带血管,胚胎心内膜6和头部脉管7。 hemogenic内皮细胞的这些不同组织中的规范发生在发育的特定阶段;例如,在〜E8.25卵黄囊内,并在〜E10 8-12的AGM内。然而,即使在这些特定发育窗,hemogenic远藤人口thelial细胞代表所有的内皮细胞的一小部分- 11,12(1卵黄囊和AGM内皮细胞的3%)。 hemogenic内皮细胞"规范"的过程是鼠关键的,以及人类,造血功能。造血细胞已经显示从卵黄囊血管的内皮细胞,并在人类胚胎13主动脉芽,和几个实验室已经证明,从人多能干细胞的血细胞的生产需要中间体14-16内皮细胞。因此,限定鼠hemogenic内皮细胞的表型和理解,导致其在该动物模型的开发应有助于追求用于产生自人多能干细胞hemogenic内皮细胞的体外技术的分子事件。反过来,用于大规模产生从多谱系HSPC分化血细胞类型的方法的最终发展 - 本身DERI经由生理相关hemogenic内皮细胞中间VED从人多能干细胞 - 将对血液,肿瘤学和再生医学难以置信的治疗潜力。为了实现这一目标,我们已经定义hemogenic内皮细胞的表型,在克隆水平,鼠卵黄囊11和AGM 12,二胚胎发生过程中确定的HSPC生产主要场所内。像成人骨髓17,胚胎hemogenic内皮细胞和HSPC展览Hoechst的染料流出属性内HSPC,因此出现了"侧群"中在FACS曲线图5,11,12( 如图3所示)的细胞(SP)。此外,我们还表明,hemogenic内皮细胞表达两种内皮标志物和干细胞(分别的Flk1和CKIT,),但是不表达造血谱系标记,CD45 5,11,12。因此,hemogenic内皮细胞可以是IDENT指明分数,并通过FACS分离的Flk1 + / CKIT + / CD45 - SP细胞,我们已经表明,这些细胞给予包含卵黄囊和AGM细胞5,11,12的Flk1- / CKIT + / CD45 + SP级分中产生HSPC。 Hemogenic内皮细胞和HSPC可以识别和从卵黄囊或从任一新鲜安乐死胚胎收获的AGM组织中分离出,或者从在体外胚胎培养长达48小时(如在图1中描绘)中培养胚胎。 体外培养允许选择性个别胚与药理学试剂的前处理,并且还允许所希望的转基因( 即,通过慢病毒转导)的瞬时表达。 hemogenic内皮细胞和HSPC通过本文描述的方法的FACS鉴定可以用作在遗传操作的小鼠模型确定的造血发育的定量量度;也可以用于随后的实验应用,包括血液佛检索到的细胞中最差测定,表达分析,和移植。
动物主题:用途和伦理问题
越来越多的文献机构已建立hemogenic内皮细胞形成HSPC期间胚胎发育的决定性阶段造血的重要贡献。然而,在生理条件和信号促进内皮细胞的一个亚群的规格朝向hemogenic命运仍然知之甚少,因此还不能在体外设置来模拟。事实上,在本文中描述的技术是目前在由我们实验室和其它基团,可改善其hematovascular发展,使得用于离体 hemogenic内皮细胞说明书和HSPC生产办法可能有一天会开发领域的理解。直到这样的时间,但是,该领域仍然依赖于从野生型初级组织(与基因角度讲修改)小鼠胚胎来获得指定hemogenic内皮细胞和HSPC进一步研究。 Hemogenic内皮细胞和HSPC可以可靠地识别和从任一E8.5分离(10 - 12体节对)卵黄囊或E10.5(35 - 40体节对)的AGM 11,12。由于hemogenic内皮细胞的相对稀缺(通常占1 -总内皮细胞11,12-这些组织内的3%),从多个组织的池(〜8 - 10)同窝成一个单一的样品强烈,以便建议获得足够的细胞用于后续实验。核实hemogenic内皮细胞和HSPC已成功鉴定和分离可以通过检索细胞培养诱导造血细胞分化的条件下完成的。在这些条件下,hemogenic内皮细胞和HSPC将表现出多谱系造血细胞分化,导致在含有红霉素菌落的外观- 甲状腺祖细胞(BFU-E),粒细胞和巨噬细胞祖细胞(CFU-GM),和粒细胞,红细胞,巨噬细胞,巨核细胞祖集落(CFU-GEMM)。
研究方案
伦理声明:下文概述的协议已被审查,是符合的,耶鲁大学的机构动物护理和使用委员会的指导方针。
1.全胚胎前V 龙腾文化为卵黄囊研究(可选)
- 在E7.0安乐死怀孕水坝 - E7.5,并在无菌条件下取出子宫角,如更详细描述的下面(步骤2.4 - 2.7)。
- 独立整个胚胎(与卵黄囊完整12)周围的蜕膜,并暂停在50毫升聚苯乙烯管50毫升整个大鼠血清。
- 3分钟,用5% 的 CO 2气体胚胎瓶立即如前所述12,18。 48小时 - 如果培养的胚胎24在24小时时重复此步骤。
- 孵育在轧制37℃培养长达48小时。
注:胚胎可以治疗体外用药剂( 即缺口抑制剂DAP。Ť12)或可溶性蛋白质( 即,纤连蛋白19)通过含有这样的因素胚胎长达2小时的培养液中的预温育,或通过加入这些因素为体外培养的整个长度的轧制培养基期。基因表达可以通过用最优滴定慢病毒胚胎预孵育胚胎2小时12被操纵。卵黄囊血管和造血发展可以实时使用转基因报告小鼠和光学成像技术来监测。
2.从小鼠胚胎卵黄囊(YS),或主动脉 - 性腺 - 中肾(AGM)的解剖
- 通过喷雾和擦拭所有表面用70%的乙醇,以降低在随后的细胞培养物污染消毒实验室工作台。放在实验台上表面吸水底垫。
- 消毒用70%乙醇手术器械。建议手术器械是两个#5战力PS,和一个8.5厘米直剪刀。
- 如果从体外培养的胚胎工作,精心为50毫升猎鹰管去除整个胚胎,并立即进行步骤2.8。否则,跳过此步骤并继续执行步骤2.4。
- 在适当的胚龄安乐死怀孕坝(E8.5如果收获YS; E10.5如果收获AGM)。
注意:所描述的技术采用了一种双方法安乐死方法 - 的挥发性麻醉剂,随后通过机械颈椎脱位的致死剂量 - 最小化动物的疼痛和痛苦,并确保动物对象的微创和人道终止。通过培训,掌握调查(时间:2013年版的动物的安乐死AVMA准则)执行时由美国兽医协会建议小型啮齿动物安乐死这种结合的技术。- 5分钟-用异氟醚致死剂量(>的O 2 5%)3麻醉鼠标。 (CAUTION:异氟醚是一种有毒的吸入;适当的呼吸个人防护装备化学通风柜下使用。)
- 以下小鼠暴露于异氟醚,检查麻醉剂水平的至少三种标志 - 翻正反射的丧失,脚趾捏反射的损失,并减少呼吸率 - 以确保受试者已经事先用机械安乐死继续取得了深麻醉平面。
- 与颈部脱臼坝迅速引起死亡。
- 广场上焊安乐死大坝平卧并自由喷雾下腹部用70%乙醇。
- 使沿下腹壁的中线垂直切口。作出额外的〜1寸横切口,右侧延伸,并从纵切口的中点离开,并剖析远离腹壁充分暴露左,右子宫角各包含多个孕育的胚胎。
- 使用镊子,保持两个子宫角之一并用剪刀把它从系膜及分离。放置在无菌Hank氏平衡盐溶液(HBSS)中冰解剖子宫在60毫米的聚苯乙烯组织培养板中。重复其他子宫角。
- 在一个标准的光解剖显微镜,用钳子绝尘而去囊子宫肌层,露出底层的孕囊及蜕膜。轻轻除去从封闭的胚胎囊隔离YS( 图2A)。从胚胎在卵黄血管的胚胎起源适当删除YS组织。
- 为了隔离股东周年大会,取出YS和横切心脏下方和前肢的水平胚胎和丢弃胸部和头部区域。接着,横切胚胎略低于后肢的水平和取出并丢弃尾部组织。从剩余的部分,它包含了股东周年大会( 图2B)拆下后肢和多余的腹部组织。
- 来自多个胚胎和存储池YS或AGM组织关于在HBSS +冰在一个干净的1.5毫升管(HBSS补充有10%(体积/体积)胎牛血清和100U / ml的青霉素,100微克/毫升链霉素和0.3毫克/毫升的L-谷氨酰胺)。
3.消化原代成单细胞悬液
- 含有收获YS或AGM组织为5分钟,在2000 xg离心在4℃下离心管中。
- 在1ml的任0.05%(为YS)或0.2%(为AGM)在HBSS +稀释胶原酶II型除去上清,重悬组织。孵育在37℃下在水浴30分钟,倒相管每隔5分钟以混合。
- 轻轻地通过一个吸管P1000样品经过10次机械分离组织。如果使用具有难度吸气部分消化组织,枪头孔可以通过切断〜5毫米尖端用剪刀的变宽。
- 在2000 xg离心在4℃下5分钟的离心样品。在1ml冰冷的HBSS +除去上清,重悬。
- 经过70样品合格#956; M细胞过滤器。
- 算使用手动或自动的血球细胞。
- 在2000 xg离心在4℃下5分钟的离心样品。在DMEM重悬样品+(4.5克/升葡萄糖的Dulbecco改良的Eagle培养基补充有10%(体积/体积)胎牛血清和100U / ml的青霉素,100微克/毫升链霉素和0.3毫克/毫升L-谷氨酰胺)预温热至37℃,使得细胞以1×10 6个细胞/ ml的终浓度。
4.核酸染料和标签用荧光标记的抗体细胞治疗
- 等分试样的至少100微升样品(1×10 5个细胞)至新的1.5毫升管抗体孵育。
- 包括下面的示例和必要的控制管:未染色的;只有CKIT-APC;只有CD45-FITC;只有CD31-PE;唯一的Flk1-PECy7;赫斯特33342只;赫斯特33342只+维拉帕米;样品(接收所有的颜色,将不会收到异搏定)。使用至少1×10 5单元100微升控制管。
注:细胞的较大的体积可以在相同的浓度被加入到样品管最大化排序Hemogenic EC和HSPC的产率。 - 加入维拉帕米稀释在95%的乙醇(见讨论为理)以"的Hoechst 33342只+维拉帕米"控制管50μM的终浓度。孵育5分钟所有管在37℃。 ( 注意:维拉帕米是一种强效钙通道阻断剂和剧毒带手套处理)。
- 添加的Hoechst 33342的"的Hoechst 33342只"控制,向赫斯特33342 +维拉帕米仅控制,并以"样品"管的5微克/毫升的最终浓度。孵育所有试管在37℃下1小时,避光。轻轻颠倒每15分钟搅拌。 ( 注意:赫斯特33342是一种有毒的核染料,应带手套处理)。
- 离心机所有SAMP莱斯在2000 xg离心在4℃下5分钟。除去上清液并在冷的HBSS + A 1×10 5个细胞/ ml的浓度重悬细胞沉淀。
- 添加荧光标记的抗体,以适当的唯一抗体对照管,并以"样品"管的2微克/毫升的最终浓度。在冰上孵育30分钟,避光。
- 离心机在4℃下以2000 xg离心所有试管5分钟。除去上清液并在500微升冰冷的HBSS悬浮细胞沉淀。通过5毫升圆底聚苯乙烯FACS管并储存在冰上,避光,立即FACS网状过滤器盖应变样本。
5.确定和Hemogenic内皮细胞的分离和HSPC用流式细胞仪
注意:此协议是使用装有100毫瓦355纳米的紫外激光的BD FACSAria 5-激光系统,一个200毫瓦405纳米的紫色激光,一个200毫瓦488纳米的蓝色激光,一个200毫瓦532纳米的绿色激光进行了优化,和一个150兆瓦637毫微米红激光。细胞在无菌PBS中分类为鞘流体和在无菌条件下,并通过100微米的喷嘴与流量设定为样品压力使得最多1500 1 - 2000事件每秒获取以最小化细胞应激。
- 根据上述这些设置,可以使用"未染色的"与单色控制管以优化的FACS细胞分选仪的激光强度,并根据制造商的说明进行多彩色光谱补偿控制。使用前向和侧向散射进行活细胞和双峰从总的歧视事件(详情请参阅生产商的说明)。
注意:此协议通常导致〜70% - 80%的活细胞。如果与低细胞存活率所遇到的问题,确保组织最初在冰冷媒体迅速解剖,并且除了那些指定否则所有步骤都在冰上进行,轻轻移液以最小化剪切和细胞死亡(见讨论,有更详细的维护细胞活力)。 - 使用赫斯特红与赫斯特蓝色荧光差分线性刻度图来识别侧群(SP)事件( 图 3A)。使用"赫斯特33342只+维拉帕米"控制为阴性对照,以确认门是正确绘制的样本。 SP将显示为一个肩部到非SP细胞的左侧,并且将在维拉帕米处理的对照降低。非SP人口将用于识别非hemogenic EC( 图3B)。
- 创建其他差异荧光图(对数刻度坐标轴),并绘制SP识别hemogenic内皮细胞( 图3C-E)的女儿大门。
注意:Hemogenic内皮细胞异型为的Flk1 + / CKIT + / CD45 - SP细胞( 图3D),并HSPC是Flk1- / CKIT + / CD45 + SP细胞( 图 3E)。 Hemogenic内皮Ç厄尔可以并行与非hemogenic内皮细胞,这是在该方法中作为CD31 + / CD45 -的非SP细胞( 图 3B)确定进行分析。 - 检索hemogenic内皮细胞或HSPC馏分到含有平板造血培养甲基纤维素(见下文),或成用于后续处理和分析其它缓冲液。
6.造血分化文化
- 加入0.5毫升(135微升/厘米2)基于甲基纤维素造血培养基在室温下在24孔组织培养板的孔中的期望数量。加入0.5毫升无菌水成未使用的孔,以尽量减少蒸发。准备新鲜的,并保持在室温下直至使用。
- 排序1 - 10细胞克隆分析,或至多1000 hemogenic内皮细胞(的Flk1 + / CKIT + / CD45 - SP细胞)或HSPC(Flk1- / CKIT + / CD45 + SP细胞),用于散装扩张和分化直接进入的每个孔含有甲基纤维素板。 20% - 集落形成在大约10被检测到。
- 在无菌组织培养罩,使用带有修剪扩大其孔中的尖端的P1000尖,轻轻悬浮种子甲基媒体的各孔2 - 3次,注意避免气泡的产生。这确保了分选的细胞的悬浮液成用于最佳生长的半固体甲基纤维素。
- 在37℃孵育板,用5% 的 CO 2达2周。
- 监视用于形成分化的造血细胞集落的随时间( 图4)的单细胞培养物。在天1,3,7人评分的数和分化的造血集落类型的井,并通过在步骤6.7下面概述的方法(多个)14。
- 第1天比分板,以确认选细胞的融合和持续经营能力。
- 第3天,检查早期形成粘附hemogenic内皮细胞集落与"鹅卵石调"形态(见戈尔迪等人 11和马塞洛等人 12日对3形态表示)。
- 通过天5 - 7,检查形成的圆形HSPC集群包含分类hemogenic EC井。 HSPC应观察相邻扁平hemogenic EC显示"鹅卵石"内皮细胞形态。
注意:Hemogenic内皮细胞应该形成造血集落(由造血集落数来确定),并且应当表现出多谱系分化的能力(由多个集落类型的观测从一个单细胞测定)。之前我们已经观察到,由〜FACS检索hemogenic EC或HSPC的20%存活,形成差异化和甲基11增殖造血集落。
- 以评估相差显微镜集落形成:
- 可视化和计数,低倍率UND菌落器的相位光镜,以及识别BFU-E,CFU-GM,和CFU-GEMM的菌落通过菌落形态,如由戈尔迪等人所述。11。
- 为了评估通过细胞形态学的集落形成:
- 从甲基纤维素表面抽吸单个菌落与端P1000的尖修整,以扩大孔。这有利于粘性甲基纤维素介质的愿望,并确保殖民地的成功检索。
- 悬浮用cytocentrifuge拾取菌落入200ml的HBSS和旋转到载玻片在28×g离心5分钟。
- 固定在100%甲醇的幻灯片5分钟( 注意:甲醇是有毒的,应该只在化学罩与适当的通风和个人防护设备使用)。
- 淹没在0.04%姬姆萨染色幻灯片20分钟( 注意:姬姆萨染色含有甲醇用在化学罩与适当的通风和人人保护设备)。
- 用去离子水冲洗幻灯片。
- 滑山与标准光学显微镜下盖玻片和图像在高放大倍率,细胞形态比较,在从成人骨髓是在甲基纤维素培养基中进行培养造血干细胞经典观察。有关示例,请参阅生产商的说明。
- 为了评估通过流式细胞仪造血系标记细胞表达集落形成:
- 加2ml的HBSS含菌落上0.5毫升甲基纤维素培养一个24孔板的每个孔中( 即,稀释市售的库存甲基1:4)。吸管上下混合,并转移到新的管(多个)。
- 使用标准台式微量在4℃2000×g离心5分钟离心样品。
- 在1毫升HBSS +除去上清,重悬细胞沉淀(S),汇集样品如果需要的话。
- Centrifu在2000 XG在4℃下5分钟GE样本。
- 在400微升HBSS +删除上清,悬浮细胞沉淀(S)。
- 分装样品放入4节1.5毫升管如下:未染色的;只有B220-FITC; GR-1-FITC仅;只有TER119-FITC。
- 荧光结合的抗体,以适当的管加入2微克/毫升的最终浓度。孵育在37℃下15分钟。
- 在2000 XG在4°C 5 min离心样本。除去上清液,在冰冷0.5毫升HBSS重悬细胞沉淀。
- 分析通过FACS各样品每个造血谱系标志物的表达:B220标记B细胞20; GR-1马克髓样细胞21; TER119标志着红系细胞22。
注意:指定其它造血谱系标记物的其他抗体可以结合到该方法中,如果需要的话。
结果
从胚胎YS或AGM hemogenic内皮细胞和HSPC将由前向和侧向散射(未示出)产生相似于图3。提出的具有代表性的图以下标准活细胞和双峰歧视FACS散点图的成功标记,侧群(SP)从多数的(非SP)的事件( 图3A)事件在没有维拉帕米作为"肩"的直的Hoechst红与Hoechst的蓝色差情节可视左移。当SP栅极正确绘制,SP细胞将代表大约1 - 总活菌YS细胞的3%,3 - 总活菌AGM事件的5%。维拉帕米治疗应该导致SP事件在> 50%的抑制,无论组织来源( 图3A,上图)的。我们先前已经决定,出现在SP肩的外面,但也阻止维拉帕米其他人群是TER119阳性erythr因此,州,和被排除在我们的SP人口5。
相比于SP,非SP细胞被识别为邻近于SP的"肩"( 图3A)的细胞的稠密群集。这一人群包含非Hemogenic乳油其可以使用的CD31-PE与CD45-FITC女儿图( 图3B)进行区分,因为CD31 + / CD45 -的事件。非Hemogenic乳油通常2 -从AGM( 图3B)或卵黄囊( 未示出 ),并且这些细胞的高数量的非SP细胞的5%的可排序背面相对容易。
<( 未示出 )在两个AGM( 图3C)或YS事件总数的20%,为HSPC和Hemogenic EC中识别,女儿栅极从SP级分拉伸,识别CD45 +和CD45 -细胞,其中CD45 +细胞通常是。 Hemogenic EC随后从CD45 - 细胞识别在差CKIT-APC与的Flk1-PECy7女儿p大量作为双阳性事件,并且通常代表1 -从任一的AGM( 图 3 D)或YS分离时CD45 -事件的3%( 未示出 )。 HSPC从CD45 +级分确定了一个单独的CKIT-APC与的Flk1-PECy7女儿情节作为Flk1- / CKIT +细胞,并且通常还代表约25 -从任YS(获得不当的CD45 +细胞的小群体的30% 显示 )或AGM( 图3 E)。因此,无论Hemogenic EC和HSPC是非常罕见(〜总细胞事件的0.01%),这是典型的这个协议返回即使当从多个胚胎组织汇集各细胞类型的几百个。在女儿地块栅极应参考阴性对照组被建立。为了特异性和非特异性抗体染色来区分,栅极最初应绘制在参照两个未染色对照( 图3( 未示出 )C)中,以及样本已经与荧光缀合的同种型匹配(IgG2a的或的IgG2b)对照抗体处理。这后一种控制已经证明,非特异性染色是由这个协议最小,因此虽然我们建议同种型匹配对照抗体( 例如 ,的IgG2a-PE或的IgG2b-FITC)在最初用于优化的FACS分拣设定,并确定门边界我们还发现,未染色的控制是足够在常规的FACS分选,以验证栅极边界和试验质量。如果门是正确绘制,最小正分散,应在单或双阳性门从未染色或同型匹配的对照记录时发现。
从股东周年大会及HSPC Hemogenic内皮细胞发生在甲基纤维素( 图4A)在培养14天后造血细胞分化。菌落类型的相对比例通常在这些观察文化是取决于组织来源。在E8.5-E9.5产生BFU-E,CFU-GM,很少CFU-GEMM 5卵黄囊组织中分离出Hemogenic内皮细胞,而来自E10.5 AGM隔离hemogenic内皮细胞产生主要CFU -GEMM 12,尽管其它谱系仍然观察到, 如图4B(左上面板)。 HSPC从E10.5 AGM分离还得到主要上升到的CFU-GEMM在培养中的甲基纤维素( 图4B,顶部中间面板),尽管这些细胞也将分化成其它造血集落类型为好。非hemogenic内皮细胞(CD31 + / CD45 -的非SP)也被镀( 图4B,右上面板)。这些细胞表现出后14天造血培养无生长。
的单个表面标志物表达的细胞类型的造血能力,包括具有和不具有造血一个表达细胞测定法ND内皮标志CD31,的Flk1,的c-Kit,VE-CAD,CD41和CD45在E10.5股东周年大会的SP分数内已经完成并展示在E10.5 AGM是多系集落形成的活性受到限制以CD31 +,VE钙粘蛋白+,C-套装+,CD41 +和CD45 + SP细胞12。有趣的是,菌落形成活性注意到两者的Flk-1 +和的Flk-1 SP细胞,但只的Flk1 +的c-Kit + CD45- SP细胞通过内皮细胞单层中间特点是既"鹅卵石引起了多系集落"内皮细胞形态( 图4B,底部左侧面板),并通过语-AcLDL摄取12。此外,C-Kit的表达是必要的AGM SP细胞12的造血活性。
虽然已经表明,相比hemogenic内皮细胞时一些髓系祖细胞具有相似的形态学特征,骨髓祖细胞表达CD45和不能生成多谱系菌落体外。 HSPC还产生多谱系集落,但是尽管这些细胞的CD45,他们缺乏的Flk-1的表达12,23并产生圆形细胞簇没有底层内皮细胞单层( 图4B,底部右面板)。因此,人口我们定义为hemogenic内皮(或,的Flk-1 + /的c-Kit + / CD45-SP细胞)代表的内皮细胞与造血潜能和健壮hematoendothelial基因表达,包括GATA-1/2,LMO2,SCL /塔尔-1,RUNX-1,的c-Kit,CD34,CD41,和CD45 11是从造血干细胞和祖细胞,以及它们的非hemogenic内皮细胞的对应不同。
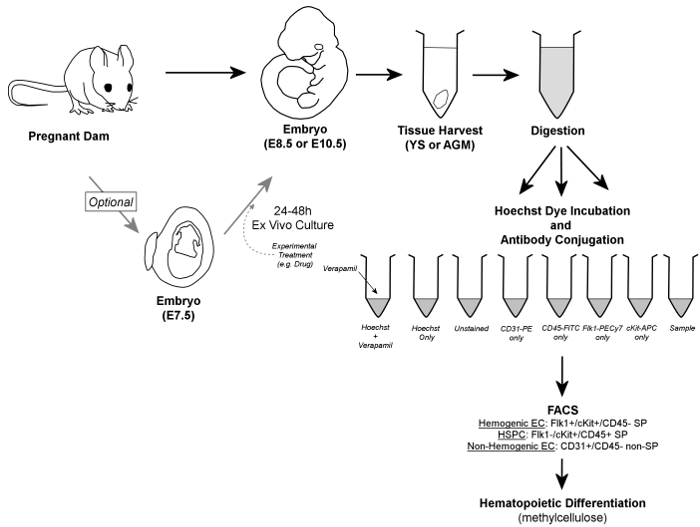
图1. 总体流程。简单地说,胚胎从怀孕的水坝拆除和YS或AGM组织收获。胚胎可以任选2中培养 4 - 48小时体外之前组织的收获。收获YS或AGM组织被消化成单细胞悬浮液,等分入对照和样品管,并在Hoechst的染料和/或荧光标记的抗体的存在下温育。维拉帕米,钙通道抑制剂,也是用于产生一个负控制为SP级分的精确门控的验证是必不可少的。 Hemogenic内皮细胞通过FACS鉴定为的Flk1 + / CKIT + / CD45 - SP细胞,而HSPC包含细胞的Flk1- / CKIT + / CD45 + SP级分中;两种细胞类型被分类到甲基纤维素为hemogenic潜在的确认。此外,非hemogenic内皮细胞可以识别(和检索,如果需要的话)为CD31 + / CD45-非SP细胞。 请点击此处查看该图的放大版本。
igure 2"SRC ="/文件/ ftp_upload / 54150 / 54150fig2.jpg"/>
图2. 解剖YS和AGM组织的。 A)将YS从E8.5胚胎解剖了,并置于整个入无菌HBSS +后续消化。B)E10.5胚胎的主干是通过以下两个前肢及后肢芽水平削减隔离。本次股东大会然后从肢芽腹用组织钳分开。C)明视场图像显示从E10.5胚胎(比例= 1毫米)都YS和AGM的清扫。 请点击此处查看大图这个数字。
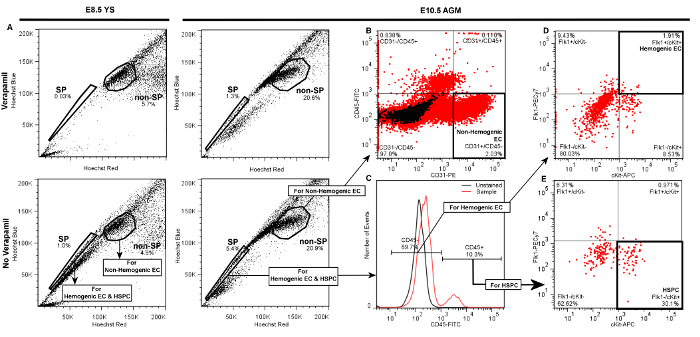
图3. 具有代表性的 图门示范层次歧视从E8.5 YS Hemogenic内皮细胞 秒(的Flk1 + / CKIT + / CD45 - SP细胞),HSPC(Flk1- / CKIT + / CD45 + SP细胞),和非hemogenic内皮细胞(CD31 + / CD45 -的非SP)通过FACS 的 或E10.5 AGM 继从任YS(左图)或AGM(右面板)通过向前细胞的活细胞和双峰歧视和侧向散射( 未示出 )中的A)的侧群(SP)栅极被绘制并且确认通过在维拉帕米处理阴性对照的SP级分的显著下降。非SP人口被确定为相邻的SP细胞的稠密群集。在每个所呈现的地块显示20000事件B)的非hemogenic内皮细胞被识别作为非SP级分中的CD31 + / CD45 -细胞,且代表2 -是否从AGM所得的非SP细胞的5%(示)或YS( 未示出 )。要discriminate Hemogenic EC或HSPC,C)的女儿栅极从SP级分吸引到识别的CD45 +和CD45 -细胞。D)对于从任AGM(示出)或YS( 未示出 ),附加的女儿栅极绘制识别hemogenic内皮细胞的从CD45 - 馏分区分CKIT +(相对于cKit-)和的Flk1 +(相对于Flk1-)细胞。无论从YS或AGM Hemogenic EC通常〜1 - 3 E)HSPC从CD45 +分数为CKIT +和Flk1-鉴定,并通常代表20 CD45-事件% - CD45 +细胞是否从股东大会来分类的30%(如图所示)或YS( 未显示 )。 请点击此处查看该图的放大版本。
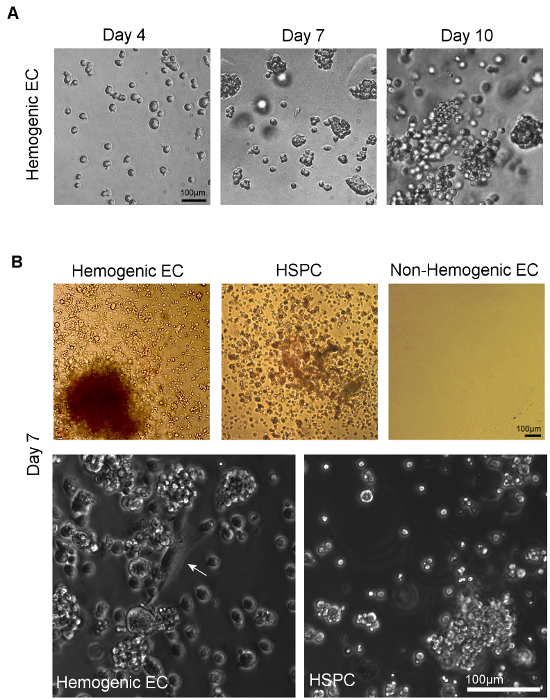
图4. Visua造血分化的补肾中药对 甲基纤维素 。A)来自于7天内铺板到甲基纤维素排序的单个细胞集落形式下Hemogenic内皮细胞的培养和 HSPC。多谱系造血潜能可通过多种造血细胞集落类型的观察来确认,由不同的菌落形态11。B)的排序hemogenic EC和HSPC从AGM(或YS的相位显微成像, 未示出 )示出了多谱系造血的评估确定后在甲基纤维素培养基中培养7天后的集落形成。从AGM非hemogenic乳油(或YS, 未示出 )没有表现出在这些条件下生长。在更高的放大倍率,以经典"鹅卵石"内皮细胞形态(白色箭头)贴壁细胞可以看出引起在小路造血细胞群hemogenic EC的Tures的;没有这样的内皮细胞有序HSPC(规模为100微米)的文化得到遵守。 请点击此处查看该图的放大版本。
讨论
有留在hematovascular发展领域的许多悬而未决的问题 - 这是尚处于起步阶段现场,由于在研究过程中具体的发展窗户,只有出现短暂的小细胞群所固有的技术难题。上面列出的技术通过允许从hemogenic内皮细胞甚至单个细胞和HSPC种群在使用试剂和设备通常是在大多数实验室可用的关键发育时间点胚胎组织的隔离改善许多的这些困难。我们的协议还允许从YS和AGM非hemogenic内皮细胞级分,其可以被用于独立的分析,或作为对照用于随后的分析的hemogenic内皮细胞级分的平行隔离。
在使用这种多色基于FACS的方法hemogenic内皮细胞的分离的一个关键点是适当的光谱合作mpensation和单色门精确的绘制。因此,强烈建议在未染色和单色彩控制包括在所有的实验运行,他们 - 与同型匹配的对照抗体治疗的样品一起 - 可以用来初步建立适当的光谱补偿和门的图。然而,非特异性染色由这个协议中,因而未染色和单色控制是足够的栅极的例行核查一次的FACS分拣设定已优化是最小的。
绘制不准确门SP与本报告中所描述的方法特别的关注。以前的研究已经表明,多潜能干细胞表现出的Hoechst红17的优惠流出,形成用于通过FACS其在SP外观的生理基础。我们已经表明,hemogenic内皮细胞和HSPC被SP的细胞级分5,11内类似地找到。药物如在钙通道维拉帕米抑制因子通过各种跨膜多药耐药转运堵塞阻断SP细胞此赫斯特染料外排的行为。在造血干细胞和祖细胞,这主要发生经由ABCG2 / BCRP1转运24。通常维拉帕米诱导> 50%的SP堵塞,但是,Hoechst的流出看到的整体程度及其随后堵塞由维拉帕米已经显示由发育时间受到影响,这可能是由于改变多种多药耐药转运体类型的表达与差Hoechst的流出的能力,和敏感性维拉帕米5。因此,强烈建议维拉帕米处理赫斯特染色阴性对照被标准地纳入以确保正确的SP门:如果SP门正确绘制,在SP细胞的数量显着减少应该在用Hoechst染色的样品被检测存在维拉帕米。
之前我们已经表明,分类从小鼠E9.5卵黄囊SP细胞有80〜 -相比于普通E9.5的匹配数量时,基于甲基纤维素造血文化产生HSPC 90倍的更大的能力,非赫斯特染色全YS组织细胞5。 SP的进一步表征表明,在早期造血,在E8.0血管发育过程中的鼠卵黄囊,存在VE-钙粘蛋白和的Flk-1的明显的表达,但干(的c-Kit)和造血标记物的低表达(CD45)。因此,在这个时间点的发育,原始(非hemogenic)乳油,定义为的Flk-1 + / CD31 + / CD45-非SP细胞占主导地位。这种表达谱移内皮标志物表达降低和CD45和c-Kit表达的增加,伴随着在 E9.5和E11.5 5之间体外生成HSPC增加的能力。这表明YS组织的造血活性包含在SP中,成为E9.5和E11.5,和occurr之间最明显ING通过内皮细胞的特点和逐步收购造血能力定时损失。这样,多药耐药转运该给SP的表型产生的表达是hemogenic内皮5的重要表型标记;事实上,从AGM非SP细胞不表现出造血潜能12。因此,通过在两个YS和AGM Hoechst染色的SP成功分离确保了细胞将来自该馏分内的给定组织的造血干细胞区室,和细胞的后续抗体染色进行排序将允许hemogenic歧视(的Flk -1 + /的c-Kit + / CD45-)与HSPC(Flk1- / C-KIT + / CD45 +)的人口5,11,12。此外,先前已指出,卵黄囊和AGM组织的SP内的CD41 +细胞是能够多谱系集落形成的基于甲基纤维素培养11,12。我们定义hemogenic内皮细胞的Flk1 +的c-Kit + CD45-细胞SPS按使用CD45作为造血系统的指定标志,而不是CD41给了我们寻找的Flk1和CD45的表达几乎是相互排斥的5,11。这允许同时具有内皮在SP内信元的纯隔离(的Flk-1)和茎必要内皮特性(的c-Kit)造血过渡但尚未经过了这种变化,因为在这些情况下的CD45确定细胞。考虑HSPC人口的分分离,定义为的Flk-1 / C-套装+ / CD45 + / SP细胞,成CSF1R +(组织巨噬细胞)和Csf1r-(HSC)分数,将是有益最近由戈麦斯和他的同事报告25,因为这将提供与组织的巨噬细胞祖细胞种群的真实HSPC的更大的分辨率,但这不应影响hemogenic内皮细胞级分,其隔离自从CSF1R我们提出是巨噬细胞祖细胞26的标记物的完整性。
HemogENIC内皮细胞在两种YS和AGM(包括1 - 内皮细胞的3%)一个罕见亚群,因此在他们的研究中的一个主要挑战是用于随后应用不足细胞产量。该协议通常导致通过排序的时间,和典型hemogenic内皮细胞从汇集组织从多个胚胎获得排序剩余的活细胞的70-80%可以产生仅几百细胞,即使在最佳条件下,只有10%-20%检索到嵌入甲基产生的菌落细胞。为了最大限度地提高分选的细胞数量,所以强烈建议研究者采取措施,以确保整个过程的每一个步骤组织及细胞活力:组织应迅速解剖汇集,以及样品应保持在冰上,只要有可能。样品应立即FACS分选前准备新鲜,并分成含药血清含量高,或直接进入甲基纤维素文化描述收集管d以上。如果生存问题仍然存在,收集管也可以预涂血清,以进一步提高分选细胞的存活。如果hemogenic内皮细胞产量仍然很低,可用于代替本文所述的胚胎组织衍生的单色控制的频谱补偿成人骨髓或市售的荧光团共轭珠。如果分选的细胞被用于培养,hemogenic内皮细胞和HSPC应直接分类到组织培养孔中。如果分选的细胞被用于DNA或RNA相关的基因表达分析,hemogenic和非hemogenic内皮细胞和HSPC可以直接排序到含有样品的裂解缓冲液以最小化细胞损失收集管。
概述的技术允许从相同胚胎组织hemogenic和非hemogenic内皮细胞的成功(和同时)隔离,以及HSPC和成熟的血细胞级分。这种方法可以进一步螺柱发生的内皮细胞生成血液的临界转变的分子基础的年。从这些发育研究中获得的分析可以被用于从多能干优化人力hemogenic内皮细胞和HSPC后代的产生,和潜在的自体,茎为流行造血功能障碍的治疗中的细胞。
披露声明
这项工作是byNIH资助HL128064支持,HL096360,EB017103和CT创新给予15元 - 耶鲁-04,到竹脚妇幼医院和NICHD / NIH T32HD007094。
致谢
作者宣称,他们没有竞争的经济利益。
材料
| Name | Company | Catalog Number | Comments |
| DAPT (N-[N-(3,5-Difluorophenacetyl)-L-alanyl]-S-phenylglycine t-butyl ester) | Sigma | D5942 | TOXIC irritant: Wear eye protection, mask, and gloves when handling. |
| Absorbent bench underpad | Covidien | 7134 | |
| #5 Straight Forceps | Fine Science Tools | 11251-20 | |
| 8.5 cm straight scissors | Fine Science Tools | 14090-09 | |
| Isoflurane (Isothesia) | Henry Schein | 50033 | TOXIC inhalant: Use in fume hood. |
| 100x Penicillin Streptomycin Glutamine (10,000 U/ml Penicillin, 10,000 mg/ml Streptomycin, 29.2 mg/ml L-glutamine) | Invitrogen | 10378016 | |
| Type II Collagenase | Worthington | LS004174 | |
| Falcon 70 μM nylon cell strainer | Corning | CLS431751 | |
| Anti-Mouse CD45-FITC | eBioscience | 11-0451-81 | |
| Anti-Mouse CD31 - PE | eBioscience | 12-0311-81 | |
| Anti-Mouse Flk-1 PE-Cy7 | BD Pharmingen | 561259 | |
| Hoechst 33342 (bisBenzimide H 33342 trihydrochloride) | Sigma | 14533 | TOXIC: irritant. Wear eye protection and gloves when handling. Prepare stock solution of 25 mg/ml in distilled H2O, store aliquots at -20 °C until ready for use. |
| Verapamil Hydrochloride | Sigma | 1711202 | TOXIC: irritant. Wear eye protection, mask, and gloves when handling. Prepare stock solution of 5 mM (100x) in 95% ethanol. Store at -20 °C until ready for use |
| Falcon 5 ml Round Bottom Polystyrene Test Tube, with Cell Strainer Snap Cap | Corning | 352235 | |
| MethoCult GF M3434 | Stem Cell Technologies | 3434 | Thaw and aliquot per manufacturer's instructions |
| Modified Giemsa Stain | Sigma | GS500 | TOXIC: Contains Methanol - use in fume hood and wear gloves with handling. Dilute in distilled water to 0.02% solution. |
| Cytospin Centrifuge | Thermo Scientific | A78300003 | |
| Clipped Funnel Starter Kit | Thermo Scientific | 3120110 | Includes cytofunnels, filter paper, cytoslides, and cytoclips for use with Cytospin centrifuge |
| Anti-Mouse B-220 - FITC | BD Pharmingen | 553088 | |
| Anti-Mouse Gr-1-FITC | eBioscience | 11-5931-85 | |
| Anti-Mouse Ter-119-FITC | eBioscience | 11-5921-85 | |
| Gibco Fetal Bovine Serum | Thermo Scientific | 10437-077 | |
| Dulbecco's Modified Eagle Medium (4.5 g/L) | Life Technologies | 11965-092 | |
| Hank's Buffered Salt Solution | Life Technologies | 14175-095 | |
| Fibronectin-coated 24-well tissue culture plate | EMD Millipore | PIFB24P05 | |
| IgG2A-PE | BD Pharmingen | 553930 | |
| IgG2B-FITC | BD Pharmingen | 556923 |
参考文献
- Hirschi, K. K. Hemogenic endothelium during development and beyond. Blood. 119 (21), 4823-4827 (2012).
- Boisset, J. C., et al. et al. In vivo imaging of haematopoietic cells emerging from the mouse aortic endothelium. Nature. 464 (7285), 116-120 (2010).
- Bertrand, J. Y., et al. Haematopoietic stem cells derive directly from aortic endothelium during development. Nature. 464 (7285), 108-111 (2010).
- Kissa, K., Herbomel, P. Blood stem cells emerge from aortic endothelium by a novel type of cell transition. Nature. 464 (7285), 112-115 (2010).
- Nadin, B. M., Goodell, M. A., Hirschi, K. K. Phenotype and hematopoietic potential of side population cells throughout embryonic development. Blood. 102 (7), 2436-2443 (2003).
- Nakano, H., et al. Haemogenic endocardium contributes to transient definitive haematopoiesis. Nat Commun. 4, 1564 (2013).
- Li, Z., et al. Mouse embryonic head as a site for hematopoietic stem cell development. Cell Stem Cell. 11 (5), 663-675 (2012).
- Medvinsky, A., Dzierzak, E. Definitive hematopoiesis is autonomously initiated by the AGM region. Cell. 86 (6), 897-906 (1996).
- Palis, J., Robertson, S., Kennedy, M., Wall, C., Keller, G. Development of erythroid and myeloid progenitors in the yolk sac and embryo proper of the mouse. Development. 126 (22), 5073-5084 (1999).
- de Bruijn, M. F., Speck, N. A., Peeters, M. C., Dzierzak, E. Definitive hematopoietic stem cells first develop within the major arterial regions of the mouse embryo. Embo J. 19 (11), 2465-2474 (2000).
- Goldie, L. C., Lucitti, J. L., Dickinson, M. E., Hirschi, K. K. Cell signaling directing the formation and function of hemogenic endothelium during murine embryogenesis. Blood. 112 (8), 3194-3204 (2008).
- Marcelo, K. L., et al. Hemogenic endothelial cell specification requires c-Kit, Notch signaling, and p27-mediated cell-cycle control. Dev Cell. 27 (5), 504-515 (2013).
- Tavian, M., et al. Aorta-associated CD34+ hematopoietic cells in the early human embryo. Blood. 87 (1), 67-72 (1996).
- Wang, L., et al. Endothelial and hematopoietic cell fate of human embryonic stem cells originates from primitive endothelium with hemangioblastic properties. Immunity. 21 (1), 31-41 (2004).
- Kelly, M. A., Hirschi, K. K. Signaling Hierarchy Regulating Human Endothelial Cell Development. Arterioscler Thromb Vasc Biol. 29 (5), 718-724 (2009).
- Kennedy, M., et al. T lymphocyte potential marks the emergence of definitive hematopoietic progenitors in human pluripotent stem cell differentiation cultures. Cell Rep. 2 (6), 1722-1735 (2012).
- Goodell, M. A., Brose, K., Paradis, G., Conner, A. S., Mulligan, R. C. Isolation and functional properties of murine hematopoietic stem cells that are replicating in vivo. J Exp Med. 183 (4), 1797-1806 (1996).
- Takahashi, M., Osumi, N. The method of rodent whole embryo culture using the rotator-type bottle culture system. J Vis Exp. (42), (2010).
- Bohnsack, B. L., Lai, L., Dolle, P., Hirschi, K. K. Signaling hierarchy downstream of retinoic acid that independently regulates vascular remodeling and endothelial cell proliferation. Genes Dev. 18 (11), 1345-1358 (2004).
- Coffman, R. L., Weissman, I. L. B220: a B cell-specific member of the T200 glycoprotein family. Nature. 289 (5799), 681-683 (1981).
- Fleming, T. J., Fleming, M. L., Malek, T. R. Selective expression of Ly-6G on myeloid lineage cells in mouse bone marrow. RB6-8C5 mAb to granulocyte-differentiation antigen (Gr-1) detects members of the Ly-6 family. J Immunol. 151 (5), 2399-2408 (1993).
- Kina, T., et al. The monoclonal antibody TER-119 recognizes a molecule associated with glycophorin A and specifically marks the late stages of murine erythroid lineage. British Journal of Haematology. 109 (2), 280-287 (2000).
- Jackson, K. A., et al. Regeneration of ischemic cardiac muscle and vascular endothelium by adult stem cells. J Clin Invest. 107 (11), 1395-1402 (2001).
- Scharenberg, C. W., Harkey, M. A., Torok-Storb, B. The ABCG2 transporter is an efficient Hoechst 33342 efflux pump and is preferentially expressed by immature human hematopoietic progenitors. Blood. 99 (2), 507-512 (2002).
- Gomez Perdiguero, ., E, , et al. Tissue-resident macrophages originate from yolk-sac-derived erythro-myeloid progenitors. Nature. 518 (7540), 547-551 (2015).
- Murray, P. J., Wynn, T. A. Protective and pathogenic functions of macrophage subsets. Nat Rev Immunol. 11 (11), 723-737 (2011).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。