Method Article
マウス胚性造血内皮細胞の単離
* これらの著者は同等に貢献しました
要約
造血幹細胞および前駆細胞(HSPC)は、まだ少しはいくつかの内皮細胞は、血液が形成になることを指定するプロセスについて知られている、開発中に特殊な(造血)内皮細胞に由来します。我々は、マウス胚組織から造血内皮細胞およびHSPCの同時分離を可能にするフローサイトメトリーベースの方法を示しています。
要約
胚の血管内皮からの造血内皮細胞の仕様が明確な組織内の短い発達期間中に発生し、マウスの胚体外の卵黄嚢、胎盤、臍帯血管、および胚の大動脈 - 生殖腺 - 中腎(から決定的なHSPCの出現のために必要ですAGM)領域。この細胞集団の一時的な性質および小さいサイズは慎重に定量化し、実験的な用途のために、その再現性の分離が技術的に困難にします。私たちは、卵黄嚢とAGMにおけるそれらのピーク発生時間中に造血内皮細胞およびHSPCの同時単離するための蛍光活性化セルソーティング(FACS)ベースのプロトコルを確立しました。我々は、マウス胚から卵黄嚢とAGM組織の切開のための方法を実証する、と私たちは前にFACSを介して識別と検索に最大細胞生存のために最適化された組織消化および抗体共役条件を提示します。代表的FACS ANA溶解プロットは、それは造血内皮細胞およびHSPCの表現型を特定し、クローンレベルで彼らの血形成の可能性を評価するためのメチルセルロースベースのアッセイを記載して示されています。
概要
機能的な循環系は、血管や血液細胞の並行開発が必要となります。血液の開発(原始造血)の初期段階では、赤芽球の起源を激しく1を議論まま。これとは対照的に、血液細胞の発達(決定的な造血)の後期段階で、それは卵黄嚢、胎盤、およびAGM内で多系列HSPCは、潜在的な(造血内皮細胞)を形成し、血液を取得する特殊な血管内皮細胞から生じることが次第に明らかになってきました2-5と同様に、卵黄と臍帯血管、胚性心内膜6、および頭部血管系7インチこれらの異なる組織内造血の内皮細胞の仕様は、開発の特定の段階で発生します。例えば、〜E8.25で卵黄嚢内と〜E10 8-12でAGM内。それにもかかわらず、あってもこれらの特定の発生の窓、造血エンドの人口中11,12 - (卵黄嚢とAGMの内皮細胞の3%1)thelial細胞は、すべての内皮細胞の小さな割合を表します。造血内皮細胞「仕様」のプロセスは、マウス、ならびにヒト、造血のために重要です。造血細胞は、卵黄嚢の血管の内皮細胞およびヒト胚13における大動脈から出芽することが示されており、いくつかの研究室は、ヒト多能性幹細胞からの血液細胞産生は14-16中間内皮細胞が必要であることを実証しました。このように、マウスの造血内皮細胞の表現型を定義し、ヒト多能性幹細胞から造血内皮細胞の生成のためのin vitro技術の追求を促進すべきであるこの動物モデルでの開発につながる分子事象を理解します。今度は、多系列HSPCから分化した血液細胞型の大規模な生成のためのアプローチの最終的な開発 - 自体はDERI中間生理学的に関連する造血内皮細胞を介したヒト多能性幹細胞からVEDは - 血液学、腫瘍学および再生医療のための信じられないほどの治療可能性を持っているでしょう。この目標に向かって、我々は、マウスの卵黄嚢11とAGM 12、胚発生の間に決定的なHSPC生産の2の主要なサイト内で、クローンレベルで、造血内皮細胞の表現型を定義しています。 HSPCのような成人の骨髄17、胚性造血内皮細胞およびHSPCの展示内のヘキスト染料流出特性、したがって、FACSプロット5,11,12上の細胞の「サイドポピュレーション」(SP)( 図3に示すように)内に表示されます。また、我々はまた、造血内皮細胞が両方の内皮細胞のマーカーを発現し、(それぞれのFlk1とCKIT、)幹細胞が示されているが、造血系マーカー、CD45 5,11,12を発現しません 。したがって、造血内皮細胞は、identをすることができますifiedとのFlk1 + / CKIT + / CD45 - SP細胞としてFACSによって単離し、そして我々は、これらの細胞が卵黄嚢とAGM細胞5,11,12のFlk1- / CKIT + / CD45 + SP画分内に含まれるHSPCを生じさせることが示されています。造血内皮細胞およびHSPCは、または( 図1に示されるように)ex vivoでの胚培養で最大48時間培養した胚から同定され、卵黄嚢や新鮮に安楽死させた胚のいずれかから収穫AGM組織から単離することができる。 エクスビボ文化が選択可能になります薬理学的薬剤との個々の胚の前処理は、そしてまた、所望の導入遺伝子( すなわち、レンチウイルス形質導入によって)の一過性発現を可能にします。本明細書に記載の方法により造血、内皮細胞およびHSPCのFACS同定は、遺伝子操作マウスモデルにおける決定的造血発達の定量的尺度として使用することができます。細胞は、血液-FOを含むその後の実験的なアプリケーションのために取得することができますrmingアッセイ、発現解析、および移植。
動物対象:を使用して倫理的配慮
文学の成長体は、胚発生の決定的な造血段階中HSPC形成に対する造血内皮細胞の重要な貢献を確立しています。しかし、造血運命に向かって内皮細胞の亜集団の仕様を促進する生理的条件及び信号はよくわかっていないままであり、したがって、まだインビトロの設定で模倣することはできません。実際、この論文に記載された技術は、ex vivo造血内皮細胞の仕様とHSPCの生産のためのアプローチは、1日が開発されるかもしれないようにhematovascular開発の分野の理解を改善するための我々の研究室や他のグループによって現在使用されています。そのような時まで、ただし、フィールドは、プライマリ、野生型由来の組織(および遺伝子に依存したままtically修正された)マウス胚は、さらなる研究のために造血内皮細胞およびHSPCを指定し得ました。造血内皮細胞およびHSPCを確実に識別し、いずれかE8.5から単離することができる(10から12体節対)卵黄嚢またはE10.5(35から40体節対)11,12 AGM。複数の組織のプール- (これらの組織内の総内皮細胞11,12の3%、典型的には1を表す)造血内皮細胞の相対的な希少性のために(〜8から10)は、単一のサンプルに同腹子強くするために推奨されますその後の実験のために十分な細胞を得ます。造血内皮細胞およびHSPCが正しく同定され単離されたことを検証は、造血分化を誘導する条件下で取得された細胞を培養することによって達成することができます。これらの条件下では、造血の内皮細胞及びHSPCはERYを含むコロニーの出現をもたらす、多系統の造血性分化を示すことになりますthroid前駆細胞(BFU-E)、顆粒球およびマクロファージ前駆細胞(CFU-GM)、および顆粒球、赤血球、マクロファージ、巨核球前駆細胞コロニー(CFU-GEMM)。
プロトコル
倫理声明:以下に概説プロトコルはによりレビュー、およびエール大学の施設内動物管理使用委員会のガイドラインに準拠しているされています。
1.全胚卵黄嚢研究例V IVO文化(オプション)
- E7.0で妊娠中のダムを安楽死させる - E7.5、および(2.4ステップ - 2.7)を以下に詳細に説明するように、無菌条件下で子宮角を除去します。
- 別々の胚全体(12無傷の卵黄嚢と)脱落膜を周囲から、そして50ミリリットルに50ミリリットルポリスチレンチューブ内の全ラ ット血清を一時停止します。
- 5%CO 2で3分間ガス胚ボトルはすぐ先12,18について説明しました 。 48時間 - 24のための胚を培養する場合は24時間で、この手順を繰り返します。
- 最大48時間、37℃で培養液をロールでインキュベートします。
注:胚は(薬理学的物質でex vivoで処理することができる、すなわち 、ノッチ阻害剤DAP。このような因子を含む培地中で最大2時間、またはex vivo培養の全体の長さの圧延培養培地へのこれらの因子の添加を介して胚のプレインキュベーションを介してT 12)、または可溶性タンパク質( 例えば、フィブロネクチン19)期間。遺伝子発現は、2時間12最適滴定レンチウイルスで胚のプレインキュベーションによって胚で操作することができます。卵黄嚢の血管及び造血発生は、トランスジェニックレポーターマウスおよび光イメージング技術を使用してリアルタイムでモニターすることができます。
マウス胚から卵黄嚢(YS)または大動脈 - 生殖腺 - 中腎(AGM)の2解剖
- 噴霧およびその後の細胞培養物の汚染を減少させるために70%エタノールで全ての表面を拭くことにより、実験台を滅菌。実験台の表面上の吸収性アンダーパッドを配置します。
- 70%エタノールで手術器具を滅菌します。推奨手術器具は、2#5ストレート力ですpsの、そして1 8.5センチメートルストレートはさみ。
- ex vivoでの培養物からの胚を操作する場合は、慎重に50ミリリットルファルコンチューブから胚全体を削除し、2.8すぐにステップ進みます。それ以外の場合は、このステップをスキップし、2.4に進みます。
- 適切な胚歳で妊娠中のダムを安楽死させる(E8.5収穫YS場合、E10.5収穫AGM場合)。
注:記載された技術は、デュアル方式の安楽死のアプローチ採用 - 機械頸椎脱臼に続いて揮発性麻酔薬の致死量 - 動物の痛みや苦痛を最小限にするため、および動物被験体の低侵襲性と人間的な終結を確実にするために。訓練を受け、熟練した研究者(:2013年版動物の安楽死のためのAVMAガイドライン)によって実行されたとき、小さなげっ歯類の安楽死のためのこの組み合わせ技術は、米国獣医師会によって推奨されています。- 5分- 3のためのイソフルランの致死量(O 2中> 5%)を用いて、マウスを麻酔。 (CAUTION:イソフルランは有毒吸入剤です。適切な呼吸保護具との化学ヒュームフードの下で使用しています。)
- 立ち直り反射の消失、つま先ピンチ反射の消失、および呼吸数の減少 - - イソフルランへのマウスの曝露後、麻酔レベルの少なくとも3兆候チェックの被験者を確保するための機械的安楽死に進む前に、深い麻酔の平面を達成しています。
- Cervically急速に死を誘導するためにダムを脱臼。
- アンダーパッド上で安楽死させダム仰臥位を置き、自由に70%エタノールで下腹部をスプレー。
- 下腹部壁の正中線に沿って縦切開を行います。縦切開の途中から左右に伸びる追加〜1インチ、横切開を行い、完全に左右の子宮角に胚を妊娠し、それぞれ含む複数を公開するために腹壁を離れて解剖。
- ピンセットを使用して、2つの子宮角のいずれかを保持しますそして、子宮間膜からそれを分離するためにハサミを使用しています。 60ミリメートルポリスチレン組織培養プレートに滅菌ハンクス平衡塩溶液(HBSS)中で氷上で解剖子宮を置きます。他の子宮角のために繰り返します。
- 標準の光解剖顕微鏡下では、基礎となる胎嚢と脱落膜を明らかにするために子宮嚢の筋層を引き離すために鉗子を使用しています。静かに囲まれた胚から嚢を除去することにより、YS( 図2A)を分離します。卵黄血管の胚起源で適切な胚からYS組織を削除します。
- AGMを単離するために、YSを削除して、心と前肢のレベル以下の胚を横断し、胸部と頭部領域を捨てます。次に、ちょうど後肢のレベルの下胚を横断し、尾の組織を除去し、廃棄します。 AGM( 図2B)が含まれ、残りの部分から、後肢および過剰腹側組織を削除します。
- 複数の胚およびストアからプールYSまたはAGM組織HBSS +中に氷上で清浄な1.5mlチューブに(HBSS、10%(v / v)のウシ胎児血清および100 U / mlペニシリン、100μg/ mlのストレプトマイシン、および0.3 mg / mlとL-グルタミンを補充しました)。
単一細胞懸濁液への一次組織の3消化
- 4℃、2,000×gで5分間、収穫YSまたはAGM組織を含む遠心チューブ。
- 1mlのいずれか(YS用)0.05%HBSS +で希釈したコラゲナーゼタイプII(AGM用)0.2%で上清と再懸濁組織を削除します。混合するために5分ごとにチューブを反転、37℃の水浴中で30分間インキュベートします。
- 穏やかに機械的にP1000ピペットを介して試料を10回通過させることにより、組織を解離します。難易部分的に消化された組織を吸引した場合は、ピペットチップの穴がハサミで先端の〜5ミリメートルを切断することによって広げることがあります。
- 4℃で2000×gで5分間遠心サンプル。 1ミリリットルの氷冷HBSS +で上清と再懸濁を削除します。
- 70を介してサンプルを渡し#956; m個のセルストレーナー。
- 手動または自動血球計数器を用いて細胞を数えます。
- 4℃で2000×gで5分間遠心サンプル。 DMEM中で再懸濁した試料は、+プレ(4.5グラム/ Lのグルコースのダルベッコ改変イーグル培地、10%(v / v)のウシ胎児血清および100 U / mlのペニシリン、100μg/ mlのストレプトマイシン、および0.3 mg / mlとL-グルタミンを補充しました)細胞を1×10 6細胞/ mlの最終濃度になるように37℃に温めました。
蛍光標識抗体と核酸色素とラベリングを有する細胞の4.治療
- 抗体インキュベーションのための新しい1.5mlチューブに小分けしたサンプルの少なくとも100μlの(1×10 5個の細胞)。
- 次のサンプルや必要な制御チューブ含める:未染色を、 CKIT-APCのみ。 CD45-FITCのみ。 CD31-PEのみ。 Flk1-PECy7のみ。ヘキスト33342のみ。唯一のベラパミルを+ヘキスト33342;サンプル(すべての色を受け取り、ベラパミルを受信しません)。 1×10の最小値を使用しますコントロールチューブ用100μl中5細胞。
注:細胞の大容量をソート造血EC及びHSPCの収率を最大にするために、同じ濃度のサンプル管に添加してもよいです。 - "のみ+ベラパミルヘキスト33342」コントロールチューブ、50μMの最終濃度を95%エタノールで希釈したベラパミル(根拠のための説明を参照)を追加します。 37℃で5分間、すべてのチューブをインキュベートします。 ( 注意:ベラパミルは強力なカルシウムチャネル遮断剤であり、非常に毒性が手袋をして取り扱ってください。)。
- 5μg/ mlの最終濃度にヘキスト33342 +ベラパミルのみのコントロールに、「ヘキスト33342のみ」コントロールにヘキスト33342を追加し、「サンプル」チューブに。光から保護し、37℃で1時間、のためにすべてのチューブをインキュベートします。ゆっくり15分毎に転倒混和。 ( 注意:ヘキスト33342は、毒性の核色素であり、手袋で処理する必要があります)。
- 遠心分離すべてのSAMPレ4℃で2000×gで5分間。上清を除去し、冷HBSS +で1×10 5細胞/ mlの濃度で細胞ペレットを再懸濁します。
- 2μg/ mlの最終濃度に適切な抗体のみの対照管に、および「サンプル」の管に蛍光標識抗体を追加します。光から保護して30分間、氷上でインキュベートします。
- 4℃で2000×gで5分間遠心分離はすべてのチューブ。上清を除去し、500μlの氷冷HBSSで細胞ペレットを再懸濁します。即時FACS用の光から保護氷上で5ミリリットルのメッシュフィルターキャップ丸底ポリスチレンFACSチューブや店舗を通じてひずみサンプル、。
FACS 5.同定および造血内皮細胞の単離およびHSPC
注:このプロトコルは、100 MW 355 nmのUVレーザーを搭載したBD FACSARIA 5-レーザーシステム、200 MW 405nmの青紫色レーザ、200 MW 488nmの青色レーザー、200 MW 532nmのグリーンレーザを用いた最適化された、としました。 150 MW 637 nmのレッドレーザ。細胞が、シース流体として無菌条件下で滅菌PBSにソートし、そしてサンプルの圧力に設定流量で100μmのノズル1〜1,500の最大よう - 2,000イベントが細胞ストレスを最小にするために毎秒取得されます。
- 上記のこれらの設定の下では、FACSセルソーターのレーザー強度を最適化し、製造業者の説明書に従って、マルチカラースペクトル補償制御を実行するために、「未染色」と単色制御管を使用しています。 (詳細については、製造元の手順を参照してください)総イベントから生細胞とダブレット差別を実行するために、前方使用および側方散乱。
注:このプロトコルは、通常、〜70になる - 80%生存細胞。問題は、低細胞生存率で発生した場合は、組織が最初に氷冷メディアに迅速に解剖されていることを確認し、そうでない場合は指定するものを除くすべてのステップは、せん断および細胞死を最小限にするために穏やかにピペッティングして、氷上で行われていること(細胞生存率を維持する上で、より詳細のための議論を参照してください)。 - サイドポピュレーション(SP)イベント( 図 3A)を識別するためにヘキストブルー蛍光対ヘキストレッドの差動リニアスケールのプロットを使用してください。ゲートが適切にサンプルのために描かれていることを確認するために、陰性対照として「ヘキスト33342のみ+ベラパミル」コントロールを使用します。 SPは、非SP細胞の左に肩のように表示され、ベラパミル処理の対照に減少するであろう。非SP集団は、非造血EC( 図3B)を識別するために使用されます。
- 追加の微分蛍光プロット(対数スケールを軸)を作成し、造血内皮細胞( 図3C-E)を識別するために、SPの娘ゲートを描きます。
注:造血内皮細胞はのFlk1 + / CKIT + / CD45 - SP細胞( 図3D)として、プロファイル、およびHSPCはFlk1- / CKIT + / CD45 + SP細胞( 図 3E)されています。造血内皮CellsはCD31 + / CD45-非SP細胞( 図 3B)、このアプローチで同定される非造血内皮細胞と並行して分析することができます。 - (下記参照)造血培養のためのプレートを含むメチルセルロース上に造血内皮細胞またはHSPC画分を取得し、又はその後の処理および分析のために他のバッファへ。
文化6.造血分化
- 室温で24ウェル組織培養プレートのウェルの所望の数の0.5ミリリットル(135μL/ cmの2)メチルセルロース系造血培地を加えます。蒸発を最小限に抑えるために、未使用のウェルに0.5ミリリットルに滅菌水を追加します。新鮮な準備、使用するまで室温で保管してください。
- ソート1から10の細胞クローン解析のために、または最大1,000造血内皮細胞(のFlk1 + / CKIT + / CD45 - SP細胞)の各ウェルに直接バルクの拡大と分化のためまたはHSPC(Flk1- / CKIT + / CD45 + SP細胞)メチルセルロースを含むプレート。 20% - コロニー形成は、約10で検出されます。
- 泡の生成を避けるように注意しながら、3回 - 滅菌組織培養フードでは、静かにシードされたメチルセルロースメディアの2を、各ウェルを再懸濁し、その穴を広げるためにトリミングされた先端を有するP1000チップを使用します。これは、最適な成長のための半固体メチルセルロースにソート細胞の懸濁液を保証します。
- 2週間まで、5%CO 2、37℃でプレートをインキュベートします。
- 時間をかけて、分化した造血細胞コロニーの形成( 図4)のための単一の細胞培養物を監視します。 1日目、3、7で数および分化した造血コロニーのタイプのための井戸をスコアし、ステップ6.7で以下に概説する方法(複数可)による14。
- 1日目にスコアプレートは、選別された細胞の密集度と継続的な生存能力を確認しました。
- 3日目では、「丸石との接着性造血内皮細胞コロニーの早期形成をチェックトーン」形態(一日3形態の表現のためのゴールディら 11とマルセロら 。12を参照してください)。
- 日5によって - 7、ソートされた造血ECを含むウェルに丸みを帯びたHSPCクラスターの形成のために確認してください。 HSPCは「丸石」内皮細胞の形態を示す造血ECを平坦化するために、隣接する観察されるはずです。
注:造血内皮細胞(造血コロニー数によって決定される)、造血コロニーを形成すべきである、と(単一の細胞から複数のコロニータイプの観察により決定)多系列分化能を実証する必要があります。我々は以前、FACSによって取得造血ECまたはHSPCの〜20%がメチルセルロース11における造血コロニーを分化し、増殖して形成するために生き残ることを観察しました。
- 位相差顕微鏡によるコロニー形成を評価するには:
- 視覚化し、低倍率ウントでコロニーを数えます位相光顕微鏡えー、とゴールディら 11によって記載されているように、コロニー形態によりBFU-E、CFU-GM、およびCFU-GEMMコロニーを識別します。
- 細胞の形態によるコロニー形成を評価するには:
- 端とP1000の先端にメチルセルロース表面から吸引し、個々のコロニーを、穴を広げるようにトリミング。これは、粘性メチルセルロース培地の吸引を容易にし、コロニーの正常な取得を保証します。
- 再懸濁し、5分間、28×gで細胞遠心を使用して、スライドガラス上に200ミリリットルのHBSSとスピンにコロニーを選びました。
- 5分間、100%メタノール中でスライドを修正しました。( 注意:メタノールは有毒であり、唯一の適切な換気と個人用保護具と化学フード内で使用する必要があります)。
- 20分( 注意のために0.04%ギムザ染色でスライドを浸し:ギムザ染色はメタノールを含む適切な換気と人との化学フード内で使用してくださいアル保護具)。
- 脱イオン水でスライドを洗浄します。
- マウントは、古典的メチルセルロース培地中で培養され、成人の骨髄から造血細胞で観察されたものと細胞の形態を比較すると、標準的な光学顕微鏡の下で高倍率でカバースリップ、および画像とスライド。例については、製造元の指示を参照してください。
- FACSによって造血系統マーカーの細胞発現によりコロニー形成を評価します:
- 0.5 mlのメチルセルロースに培養されたコロニーを含む24ウェルプレートの各ウェルに、HBSS 2 mlを加え( すなわち、商業的に入手可能な在庫メチルセルロース1を希釈:4)。アップピペットとミックスダウンすると、新しいチューブ(単数または複数)に移します。
- 標準的な卓上型マイクロ遠心を用いて、4℃で5分間、2000×gで遠心分離サンプル。
- 上清を除去し、1ミリリットルHBSS +で細胞ペレット(複数可)を再懸濁し、必要に応じてサンプルをプールします。
- Centrifu4℃で5分間、2000×gでGEサンプル。
- 上清を除去し、400μlのHBSS +で細胞ペレット(複数可)を再懸濁します。
- 4 1.5ミリリットルチューブにアリコート試料を次のように未染色を、 B220-FITCのみ。 GR-1-FITCのみ。 TER119-FITCのみ。
- 2μg/ mlの最終濃度になるように適切な管に蛍光標識抗体を加えます。 15分間37℃でインキュベートします。
- 4℃で5分間、2000×gで遠心分離サンプル。上清を除去し、氷冷0.5ミリリットルHBSSで細胞ペレットを再懸濁します。
- 各造血系マーカーの発現についてFACSにより各サンプルを分析:B220はB細胞20をマーク。 GR-1マーク骨髄細胞21。 TER119は、赤血球細胞22をマークします。
注:必要に応じて他の造血系統マーカーを標的とする追加の抗体は、このアプローチに組み込むことができます。
結果
成功した胚YSまたはAGMからの造血内皮細胞およびHSPCのラベリング、図3に示す代表的なプロットと類似のFACS散布図を生成しますが。(図示せず)が、前方および側方散乱によって標準生細胞とダブレット差別に続いて、サイドポピュレーション(SP)イベントは「肩」としてベラパミル非存在下での線形ヘキストレッドヘキスト対ブルー差プロットで可視化されている(非SP)イベント( 図3A)の過半数から左にシフト。総生存YS細胞の3%3 - - 総生存AGMイベントの5%SPゲートが正しく描画されたときに、SP細胞は、約1を表します。ベラパミルの処理にかかわらず、組織源のSPイベントの> 50%阻害( 図3A、上部パネル)をもたらすはずです。我々は以前のSP肩の外に現れるだけでなく、ベラパミルによってブロックされている他の集団は、TER119陽性erythrであることを決定しましたoblasts、およびしたがって、当社のSP人口5から除外されています。
SPと比較して、非SP細胞は、SP「肩」( 図3A)に隣接するセルの密集クラスタとして識別されます。この集団は、CD31 + / CD45 -イベントとして、CD45-FITCの娘プロット( 図3B)対CD31-PEを使用して区別することができる非造血ECが含まれています。バック比較的容易に選別することができるAGM( 図3B)または卵黄嚢( 図示せず )、およびこれらの細胞の高い数から非SP細胞の5% -非造血ECは、典型的には2です。
HSPCおよび造血ECの同定のために、娘のゲートは、CD45 +およびCD45 -細胞を同定、SP画分から描かれている。ここで、CD45 +細胞は、<通常、AGM( 図3C)またはYS( 図示せず )の両方における全イベントの20%です。造血ECは、その後のFlk1-PECy7の娘のp対の差動CKIT-APCでCD45 - 細胞から同定されています多くの二重陽性事象として、典型的には1表す- AGM( 図 3 D)またはYSのいずれかから単離された場合CD45-事象の3%( 図示せず )。 HSPCはFlk1- / CKIT +細胞としてのFlk1-PECy7娘プロット対別々 CKIT-APCでCD45 +画分から同定され、また、典型的には約25表している-のいずれかYSから得られたとき(CD45 +細胞の小集団の30%をありません示されている )またはAGM( 図3 E)。したがって、造血EC及びHSPCの両方が(全細胞事象の〜0.01%)、非常にまれであり、このプロトコルは、複数の胚からの組織をプールした場合でも、各細胞型の数百を返すことが典型的です。娘プロットでゲイツは、陰性対照群を参照して確立されるべきです。特異的および非特異的抗体染色を区別するために、ゲートが最初に両方の非染色コントロール( 図3を参照して描画します蛍光コンジュゲートアイソタイプ一致(のIgG2aまたはIgG2bの)コントロール抗体( 図示せず )で処理されたC)、ならびにサンプル。この後者の制御は、非特異的な染色は、我々はアイソタイプ適合対照抗体( 例えば 、IgG2aの-PEまたはIgG2bの-FITC)は、最初にFACSソーター設定を最適化し、ゲートの境界を決定するために使用することをお勧めします、したがってながら、このプロトコルによって最小限であることを示しました、我々はまた、未染色のコントロールがソートルーチンFACS時にゲート境界と実験の品質を確認するのに十分であることがわかります。ゲートが適切に描画される場合は、未染色またはアイソタイプ適合対照から録音するとき、最小の正の散布は、単一または二重陽性ゲートで観察する必要があります。
AGMとHSPCから造血内皮細胞はメチルセルロース( 図4A)での培養の14日間の造血分化を受けます。コロニータイプの相対的な割合は、典型的には、これらの中で観察され培養物を組織源に依存します。 E10.5 AGMから単離された造血内皮細胞は、主にCFUを生じるのに対し、BFU-EにE8.5-E9.5の所与の上昇、CFU-GM、およびいくつかのCFU-GEMM 5で卵黄嚢組織から単離された造血内皮細胞-GEMM 12、 図4B(左上のパネル)に示すように、他の系統はまだ観察されているが。 HSPCは、これらの細胞はまた、同様に他の造血コロニー型に分化するが、また、メチルセルロース培養の際にCFU-GEMMに主に上昇する( 図4B、上部中央のパネル)を得E10.5 AGMから単離されました。非造血内皮細胞(CD31 + / CD45 -非SP)も( 図4B、右上のパネル)メッキされています。これらの細胞は、14日後の造血文化の中で全く成長を示しません。
造血aの発現をせずに細胞を含む細胞型を発現する個々の表面マーカーの造血能力のアッセイ、ND内皮マーカーはCD31、のFlk1、C-Kitは、VE-CAD E10.5でのAGMのSP画分内で、CD41、およびCD45を制限されて実行され、E10.5 AGMでその多系列コロニー形成活性を実証されてきましたCD31 +に、VEカドヘリン+、c-キット+、CD41 +およびCD45 + SP細胞の12。興味深いことに、コロニー形成活性は、両方のFlk-1 +およびFLK-1 - SP細胞で認められたが、唯一のFlk1 +ののc-kit + CD45 - SP細胞は、両方の「石畳によって特徴づけ中間内皮単層を介して、多系列コロニーを生じさせました「内皮細胞の形態( 図4B、左下パネル)とのDil-AcLDLの取り込み12による。また、C-kitの発現はAGM SPセル12の造血活性のために必要です。
造血の内皮細胞と比較した場合、いくつかの骨髄前駆細胞に類似した形態学的特性を有することが示されているが、骨髄性前駆細胞がCD45を発現し、多系列コロニーを生成することができません。 HSPCはまた、多系列コロニーを生成しますが、これらの細胞が、CD45は、彼らがFLK-1発現12,23を欠き、根本的な内皮単層( 図4B、右下のパネル)することなく、丸みを帯びた細胞クラスターを生じます。したがって、人口は我々は、SCLのよう造血内皮を定義する(または、FLK-1 + /のc-kit + / CD45-SP細胞)血液はGATA-1/2、LMO2含む可能性と堅牢hematoendothelial遺伝子発現を、形成して内皮細胞を表します/造血幹細胞および前駆細胞、ならびにそれらの非造血内皮細胞の対応は異なっているタル-1、ランクス-1、C-キット、CD34、CD41、およびCD45 11。
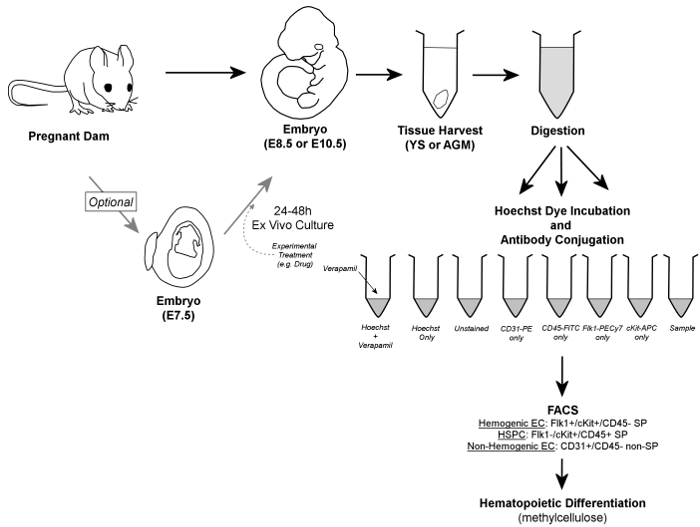
図1. ワークフロー全体を。簡単に言えば、胚は妊娠中のダムから除去され、YSまたはAGM組織が 収穫されます。胚は、オプション2のために培養することができます 4から48時間のex vivoでの組織の収穫の前に。収穫YSまたはAGM組織は、対照およびサンプルチューブに分注し、単一細胞懸濁液に消化し、Hoechst色素および/または蛍光標識抗体の存在下でインキュベートされます。ベラパミル、カルシウムチャネル阻害剤は、また、SP画分の正確なゲーティングの検証のための本質的なネガティブコントロールを生成するために使用されます。造血内皮細胞をFACSによって識別されているようなのFlk1 + / CKIT + / CD45 - SP細胞、HSPCは、細胞のFlk1- / CKIT + / CD45 + SP画分の中に含まれている間、両方の細胞型は、造血ポテンシャルの確認のためメチルセルロース上にソートされています。 (必要であれば、検索された)また、非造血内皮細胞は、CD31 + / CD45 -非SP細胞と識別することができます。 この図の拡大版をご覧になるにはこちらをクリックしてください。
igure 2 "SRC =" /ファイル/ ftp_upload / 54150 / 54150fig2.jpg "/>
YSおよびAGM組織の 図2. 解剖。 A)YSは、E10.5胚のトランクの両方前肢及び後肢芽下水平カットすることによって単離される)E8.5胚から離れて切開、およびその後の消化。Bのための無菌のHBSS +中に全体が配置されます。 AGMは、その後、肢芽や鉗子を使用して、腹側の組織から分離されている。C)明視野画像は、E10.5胚= 1ミリメートル(スケール)からYSとAGMの両方の解剖を示す。 の拡大版をご覧になるにはこちらをクリックしてください。この図。
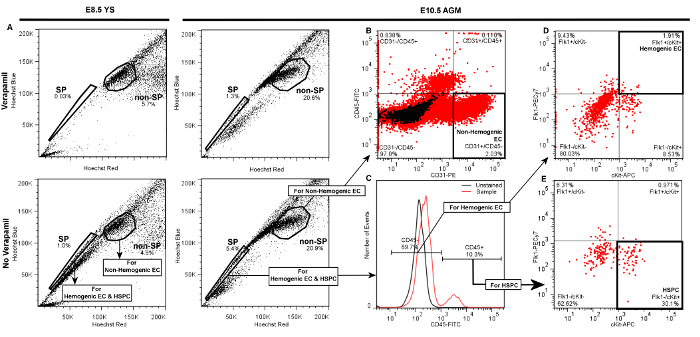
差別 のためのゲートの階層を実証する 図3. 代表的 プロットE8.5 YSから FACSによる 造血内皮細胞 の(のFlk1 + / CKIT + / CD45 - SP細胞)、HSPC(Flk1- / CKIT + / CD45 + SP細胞)、および非造血内皮細胞(CD31 + / CD45 -非SP) の またはE10.5 AGM。( 図示せず )、前方および側方散乱によってYS(左パネル)またはAGM(右パネル)のいずれかからの細胞の生細胞とダブレット差別に続いて、A)サイドポピュレーション(SP)ゲートが描かれ、検証されますベラパミル処理したネガティブコントロールでSP画分の有意な減少によって。非SP集団は、SPに隣接するセルの密集クラスタとして識別されます。 20,000のイベントが表示されている提示プロットの各B)非造血の内皮細胞は、非SP画分内CD31 + / CD45-細胞として同定され、そして2表す- AGMから得られたかどうか、非SP細胞の5%(図示)またはYS( 図示せず )。 discriへminate造血ECまたはHSPC、C)娘ゲートは、CD45 +およびCD45-細胞を同定するために、SP画分から引き出されている。D)AGM(図示)またはYS( 図示せず )のいずれかからの造血の内皮細胞の同定のためには、追加のドーターゲートが描かれていますCD45-画分からCKIT +(cKit-対)及び(Flk1-対)のFlk1 +細胞を区別するために。 YSまたはAGMのいずれかから造血EC通常、〜1である- 。CD45-イベントの3%E)HSPCはCKIT +とFlk1-としてCD45 +画分から同定され、そして典型的には20表している- AGMから選別するかどうかをCD45 +細胞の30%を(図示します)またはYS( 図示せず )。 この図の拡大版をご覧になるにはこちらをクリックしてください。
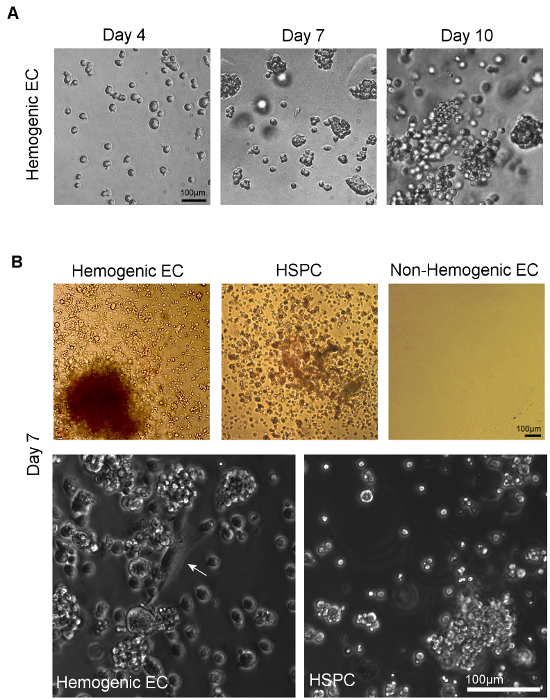
図4. Visuaメチルセルロース 。A)メチルセルロース上にメッキの7日以内にソートされた個々の細胞からコロニーをフォーム上の造血内皮細胞の培養および HSPCを以下の造血分化のlization。多系統の造血の可能性は明確なコロニーの形態11の評価によって識別され、複数の造血コロニーの種類を観察することにより確認することができる。 図示していない AGM(またはYSからソートされた造血ECおよびHSPCのB)位相顕微鏡イメージング、)多系列の造血を表示メチルセルロース培地中での培養の7日後にコロニー形成。 ( 図示していないか、YS、)AGMから非造血ECは、これらの条件下で成長を示すものではありません。より高い倍率では、古典的な「丸石」内皮細胞の形態(白矢印)を有する接着細胞をCULに造血細胞のクラスターを生じる分かります造血ECのトゥーレス。そのような内皮細胞がソートされたHSPC(スケール= 100ミクロン)の培養で観察されない。 この図の拡大版をご覧になるにはこちらをクリックしてください。
ディスカッション
特定の発達の窓の間にのみ出現する一過性および小細胞集団を研究に固有の技術的な問題に起因まだ揺籃期にあるフィールド - hematovascular開発の分野で多くの未解決の問題が残っています。上記で概説した技術は、ほとんどのラボで一般的に利用可能である試薬や機器を使用して、重要な発達の時点で胚組織における造血内皮細胞およびHSPC集団からでも単一細胞の単離を可能にすることにより、これらの問題の多くを改善します。我々のプロトコルは、独立した分析のために使用することができるYSおよびAGM由来の非造血内皮細胞分画の並列単離を可能にする、またはその後の分析における造血内皮細胞分画のためのコントロールとして。
この多色FACSベースの方法を用いて、造血内皮細胞の単離のキーポイントは、適切なスペクトル共同でmpensationと単色ゲートの正確な描画。このように、強く染色されていないと、単一色のコントロールは、すべての実験試行中に含まれることが推奨され、それらはこと - に沿ってアイソタイプ適合対照抗体で処理したサンプルと - 最初に適切なスペクトル補償及びゲートの図面を確立するために使用すること。しかし、非特異的な染色は、このように染色されていないと単色コントロールはFACS選別機の設定が最適化された後、ゲートの日常的検証のために十分であるこのプロトコルにより、最小限です。
不正確に描かれたSPのゲートは、このレポートに記載されたアプローチと特に懸念しています。以前の研究は、多能性幹細胞は、FACSによってSPにおけるそれらの出現のための生理学的基礎を形成する、ヘキスト赤色17の優先的な流出を示すことが示されています。我々は、造血、内皮細胞およびHSPCも同様SP細胞画分5,11内に見出されることが示されています。そのような中でカルシウムチャネルなどの薬物hibitorベラパミルは、膜貫通多剤耐性トランスポーターの様々な閉塞を経由してSP細胞におけるこのヘキスト染料流出の動作をブロックします。造血幹細胞および前駆細胞では、これは主に、ABCG2 / BCRP1トランス24を介して起こります。典型的には、ベラパミルSPの> 50%の閉塞を誘発する、しかし、見ベラパミルによってヘキスト流出の全体的な程度とその後の閉塞は、おそらく、差動ヘキストで複数の多剤耐性トランスポータータイプの発現を変化させることに、発生のタイミングによって影響されることが示されています流出能力、およびベラパミル5に対する感度。したがって、強くベラパミル処置することが推奨され、ヘキスト染色陰性対照標準的に適切なSPゲーティングを確実にするために含まれる:SPゲートが正しく描画されている場合、SP細胞の数の顕著な減少がでヘキストで染色した試料中に検出されるべきベラパミルの存在。
我々は以前にソートすることが示されていますE9.5のマウス卵黄嚢からのSP細胞は〜80持っている- E9.5未分画の一致した数と比較した場合、メチルセルロースベースの造血培養でHSPCを生成するために90倍高い能力を、非ヘキストは全体YS組織細胞5を染色しました。 SPのさらなる特徴付けは、とのFlk-1 VE-カドヘリンE8.0で初期造血および血管発生時のマウス卵黄嚢で、かなりの表現があることが示されているが、幹の低発現(C-キット)および造血マーカー(CD45)。したがって、この発達時点、原始(非造血)EC、であるFlk-1 + / CD31 + / CD45 - 非SP細胞が優勢のように定義されました。内皮マーカーの発現は減少し、CD45およびc-kitの発現が増加し、E9.5とE11.5 5との間の in vitroで HSPCを生成するために増加する能力との併用としてこの発現プロファイル移行します。これはE9.5とE11.5の間で最も顕著になって、YS組織の造血活性は、SP内に含まれていることを示唆している、と回の出現内皮特性の時限損失および造血能力の段階的な買収を通じてる。このように、SP表現型を生じる多剤耐性輸送体の発現は、造血内皮5の重要な表現型マーカーです。実際には、AGMからの非SP細胞は、血液形成の可能性12を示しません。ヘキスト染色を経由してSPのこのように、成功した分離YSおよびAGMの両方は、細胞が与えられた組織の造血幹細胞区画から選別され、この分画内の細胞のその後の抗体染色は、造血の差別(のFlkできるようになることを保証するには-1 + /のc-kit + / CD45 - )HSPC(Flk1- /のc-kit + / CD45 +)集団5,11,12対。また、以前になって卵黄嚢とAGM組織のSP内のCD41 +細胞は、メチルセルロースベースの培地11,12に多系列コロニー形成することができることを指摘しています。私たちは、のFlk1 +ののc-kit + CD45 - SP細胞などの造血内皮細胞を定義しますFlk1およびCD45の発現は5,11事実上相互に排他的であることを私たちの発見与えむしろCD41よりも、造血系の指定されたマーカーとしてCD45を使用しての。これは、両方の内皮細胞(FLK-1)を持つSP内の細胞の純粋な単離を可能にし、造血への遷移内皮のために必要な特性(C-Kit)を幹が、これらにCD45が存在しないことによって決定されるようにまだ、この変更を受けていないいます細胞。最近ゴメスらによって報告されたように、CSF1R +へのFlk-1 - /のc-kit + / CD45 + / SP細胞、(組織マクロファージ)とCsf1r-(HSC)割合として定義され、HSPC人口のサブ分画を考慮することが有用であろう25、これは組織マクロファージ前駆細胞集団に対する真のHSPCのより高い解像度を提供するであろうが、これは分離我々がCSF1R以来概説しているマクロファージ前駆細胞26のマーカーである造血内皮細胞画分の完全性に影響を与えるべきではないとして。
HemogENIC内皮細胞は、(1含ん - 内皮細胞の3%)YSおよびAGMの両方において稀亜集団であり、従って、それらの研究における大きな課題は、その後の用途のために不十分な細胞収率です。このプロトコルは、通常、10〜20%のみであっても最適な条件の下でわずか数百の細胞を生じ得るソートの時間、および複数の胚から得られたプールされた組織からの代表的な造血の内皮細胞ソートによって実行可能な残りのセル70〜80%において結果メチルセルロースの製造コロニーの中に埋め込まれた細胞を取り出しました。組織が急速に解剖し、プールされるべきであり、サンプルは可能な限り氷上に維持する必要があります。ソートされた細胞数を最大化するために、強く研究者は手順のすべてのステップを通して組織および細胞生存率を確保するための措置をとることをお勧めします。サンプルは、直前にFACSソーティングに新たに調製し、説明するようメチルセルロース文化に直接高血清コンテンツ、またはを含むコレクションチューブにソートしておく必要があります上記日間。生存能力の問題が解消されない場合は、収集管は、さらにソートされた細胞の生存を強化するために、血清で予めコーティングすることができます。造血内皮細胞の収率が低いままの場合、成人骨髄または市販のフルオロフォアコンジュゲートビーズは、本明細書に記載の胚組織由来の単一カラーコントロールの代わりにスペクトル補正のために使用することができます。選別された細胞を培養することを意図している場合は、造血内皮細胞およびHSPCは、組織培養ウェルに直接ソートしておく必要があります。選別された細胞は、DNAまたはRNAに関連する遺伝子発現解析のために意図されている場合は、造血および非造血、内皮細胞およびHSPC細胞の損失を最小限にするために、試料溶解緩衝液を含むコレクションチューブに直接にソートすることができます。
概説技術は成功した(と同時)造血および非造血内皮細胞の単離、ならびにHSPCと同じ胚組織から成熟血液細胞分画を可能にします。このアプローチは、別のスタッドを可能にします内皮細胞は、血液を生成するように発生する重要な遷移の分子基盤のy座標。洞察は、優勢な造血障害の治療のための幹細胞を、潜在的に自己次に多能性のヒト造血の内皮細胞及びHSPC子孫の生成を最適化するために使用することができ、これらの発達の研究から得られた、と。
開示事項
この作品は、助成金HL128064 byNIHサポートされていた、HL096360、EB017103、およびCTのイノベーションは、15 RMB-YALE-04 KKHに、およびNICHD / NIH T32HD007094を付与します。
謝辞
著者は、彼らが競合する金融利害関係を持たないことを宣言します。
資料
| Name | Company | Catalog Number | Comments |
| DAPT (N-[N-(3,5-Difluorophenacetyl)-L-alanyl]-S-phenylglycine t-butyl ester) | Sigma | D5942 | TOXIC irritant: Wear eye protection, mask, and gloves when handling. |
| Absorbent bench underpad | Covidien | 7134 | |
| #5 Straight Forceps | Fine Science Tools | 11251-20 | |
| 8.5 cm straight scissors | Fine Science Tools | 14090-09 | |
| Isoflurane (Isothesia) | Henry Schein | 50033 | TOXIC inhalant: Use in fume hood. |
| 100x Penicillin Streptomycin Glutamine (10,000 U/ml Penicillin, 10,000 mg/ml Streptomycin, 29.2 mg/ml L-glutamine) | Invitrogen | 10378016 | |
| Type II Collagenase | Worthington | LS004174 | |
| Falcon 70 μM nylon cell strainer | Corning | CLS431751 | |
| Anti-Mouse CD45-FITC | eBioscience | 11-0451-81 | |
| Anti-Mouse CD31 - PE | eBioscience | 12-0311-81 | |
| Anti-Mouse Flk-1 PE-Cy7 | BD Pharmingen | 561259 | |
| Hoechst 33342 (bisBenzimide H 33342 trihydrochloride) | Sigma | 14533 | TOXIC: irritant. Wear eye protection and gloves when handling. Prepare stock solution of 25 mg/ml in distilled H2O, store aliquots at -20 °C until ready for use. |
| Verapamil Hydrochloride | Sigma | 1711202 | TOXIC: irritant. Wear eye protection, mask, and gloves when handling. Prepare stock solution of 5 mM (100x) in 95% ethanol. Store at -20 °C until ready for use |
| Falcon 5 ml Round Bottom Polystyrene Test Tube, with Cell Strainer Snap Cap | Corning | 352235 | |
| MethoCult GF M3434 | Stem Cell Technologies | 3434 | Thaw and aliquot per manufacturer's instructions |
| Modified Giemsa Stain | Sigma | GS500 | TOXIC: Contains Methanol - use in fume hood and wear gloves with handling. Dilute in distilled water to 0.02% solution. |
| Cytospin Centrifuge | Thermo Scientific | A78300003 | |
| Clipped Funnel Starter Kit | Thermo Scientific | 3120110 | Includes cytofunnels, filter paper, cytoslides, and cytoclips for use with Cytospin centrifuge |
| Anti-Mouse B-220 - FITC | BD Pharmingen | 553088 | |
| Anti-Mouse Gr-1-FITC | eBioscience | 11-5931-85 | |
| Anti-Mouse Ter-119-FITC | eBioscience | 11-5921-85 | |
| Gibco Fetal Bovine Serum | Thermo Scientific | 10437-077 | |
| Dulbecco's Modified Eagle Medium (4.5 g/L) | Life Technologies | 11965-092 | |
| Hank's Buffered Salt Solution | Life Technologies | 14175-095 | |
| Fibronectin-coated 24-well tissue culture plate | EMD Millipore | PIFB24P05 | |
| IgG2A-PE | BD Pharmingen | 553930 | |
| IgG2B-FITC | BD Pharmingen | 556923 |
参考文献
- Hirschi, K. K. Hemogenic endothelium during development and beyond. Blood. 119 (21), 4823-4827 (2012).
- Boisset, J. C., et al. et al. In vivo imaging of haematopoietic cells emerging from the mouse aortic endothelium. Nature. 464 (7285), 116-120 (2010).
- Bertrand, J. Y., et al. Haematopoietic stem cells derive directly from aortic endothelium during development. Nature. 464 (7285), 108-111 (2010).
- Kissa, K., Herbomel, P. Blood stem cells emerge from aortic endothelium by a novel type of cell transition. Nature. 464 (7285), 112-115 (2010).
- Nadin, B. M., Goodell, M. A., Hirschi, K. K. Phenotype and hematopoietic potential of side population cells throughout embryonic development. Blood. 102 (7), 2436-2443 (2003).
- Nakano, H., et al. Haemogenic endocardium contributes to transient definitive haematopoiesis. Nat Commun. 4, 1564 (2013).
- Li, Z., et al. Mouse embryonic head as a site for hematopoietic stem cell development. Cell Stem Cell. 11 (5), 663-675 (2012).
- Medvinsky, A., Dzierzak, E. Definitive hematopoiesis is autonomously initiated by the AGM region. Cell. 86 (6), 897-906 (1996).
- Palis, J., Robertson, S., Kennedy, M., Wall, C., Keller, G. Development of erythroid and myeloid progenitors in the yolk sac and embryo proper of the mouse. Development. 126 (22), 5073-5084 (1999).
- de Bruijn, M. F., Speck, N. A., Peeters, M. C., Dzierzak, E. Definitive hematopoietic stem cells first develop within the major arterial regions of the mouse embryo. Embo J. 19 (11), 2465-2474 (2000).
- Goldie, L. C., Lucitti, J. L., Dickinson, M. E., Hirschi, K. K. Cell signaling directing the formation and function of hemogenic endothelium during murine embryogenesis. Blood. 112 (8), 3194-3204 (2008).
- Marcelo, K. L., et al. Hemogenic endothelial cell specification requires c-Kit, Notch signaling, and p27-mediated cell-cycle control. Dev Cell. 27 (5), 504-515 (2013).
- Tavian, M., et al. Aorta-associated CD34+ hematopoietic cells in the early human embryo. Blood. 87 (1), 67-72 (1996).
- Wang, L., et al. Endothelial and hematopoietic cell fate of human embryonic stem cells originates from primitive endothelium with hemangioblastic properties. Immunity. 21 (1), 31-41 (2004).
- Kelly, M. A., Hirschi, K. K. Signaling Hierarchy Regulating Human Endothelial Cell Development. Arterioscler Thromb Vasc Biol. 29 (5), 718-724 (2009).
- Kennedy, M., et al. T lymphocyte potential marks the emergence of definitive hematopoietic progenitors in human pluripotent stem cell differentiation cultures. Cell Rep. 2 (6), 1722-1735 (2012).
- Goodell, M. A., Brose, K., Paradis, G., Conner, A. S., Mulligan, R. C. Isolation and functional properties of murine hematopoietic stem cells that are replicating in vivo. J Exp Med. 183 (4), 1797-1806 (1996).
- Takahashi, M., Osumi, N. The method of rodent whole embryo culture using the rotator-type bottle culture system. J Vis Exp. (42), (2010).
- Bohnsack, B. L., Lai, L., Dolle, P., Hirschi, K. K. Signaling hierarchy downstream of retinoic acid that independently regulates vascular remodeling and endothelial cell proliferation. Genes Dev. 18 (11), 1345-1358 (2004).
- Coffman, R. L., Weissman, I. L. B220: a B cell-specific member of the T200 glycoprotein family. Nature. 289 (5799), 681-683 (1981).
- Fleming, T. J., Fleming, M. L., Malek, T. R. Selective expression of Ly-6G on myeloid lineage cells in mouse bone marrow. RB6-8C5 mAb to granulocyte-differentiation antigen (Gr-1) detects members of the Ly-6 family. J Immunol. 151 (5), 2399-2408 (1993).
- Kina, T., et al. The monoclonal antibody TER-119 recognizes a molecule associated with glycophorin A and specifically marks the late stages of murine erythroid lineage. British Journal of Haematology. 109 (2), 280-287 (2000).
- Jackson, K. A., et al. Regeneration of ischemic cardiac muscle and vascular endothelium by adult stem cells. J Clin Invest. 107 (11), 1395-1402 (2001).
- Scharenberg, C. W., Harkey, M. A., Torok-Storb, B. The ABCG2 transporter is an efficient Hoechst 33342 efflux pump and is preferentially expressed by immature human hematopoietic progenitors. Blood. 99 (2), 507-512 (2002).
- Gomez Perdiguero, ., E, , et al. Tissue-resident macrophages originate from yolk-sac-derived erythro-myeloid progenitors. Nature. 518 (7540), 547-551 (2015).
- Murray, P. J., Wynn, T. A. Protective and pathogenic functions of macrophage subsets. Nat Rev Immunol. 11 (11), 723-737 (2011).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved