Method Article
Isolamento de células embrionárias de murino hegemônicos endoteliais
* Estes autores contribuíram igualmente
Neste Artigo
Resumo
células-tronco e progenitoras hematopoiéticas (HSPC) derivam de células endoteliais especializadas (hegemônicos) durante o desenvolvimento, mas pouco se sabe sobre o processo pelo qual algumas células endoteliais especificar a tornar-se sangue formando. Nós demonstramos um método baseado citometria de fluxo que permite o isolamento de células endoteliais em simultâneo hegemônicos e HSPC de tecidos embrionários de murídeo.
Resumo
A especificação de células endoteliais hegemônicos do endotélio vascular embrionária ocorre durante breves períodos de desenvolvimento dentro dos tecidos distintos, e é necessário para o surgimento de HSPC definitiva a partir do saco murino adicional embrionária gema, placenta, vasos umbilicais, ea aorta-gônadas-mesonephros embrionárias ( AGM) região. A natureza transitória e pequeno tamanho desta população de células torna o seu isolamento reprodutível para quantificação cuidadosa e aplicações experimentais tecnicamente difícil. Nós estabelecemos uma célula activada por fluorescência (FACS) protocolo baseado para o isolamento simultâneo de células endoteliais hegemônicos e HSPC durante os horários de pico de geração no saco vitelino e AGM. Nós demonstramos métodos para dissecção do saco vitelino e tecidos AGM de embriões de ratos, e nós apresentamos condições de digestão do tecido e de conjugação de anticorpos otimizados para a sobrevivência da célula máxima antes da identificação e recuperação via FACS. Representante FACS anaparcelas de lise são mostrados que identificar a célula endotelial hegemônicos e fenótipos HSPC, e descrevem um ensaio baseado em metilcelulose para avaliar o seu potencial de formação de sangue a um nível clonal.
Introdução
Um sistema circulatório funcional exige o desenvolvimento paralelo de vasos sanguíneos e células do sangue. Nos primeiros estágios de desenvolvimento no sangue (hematopoiese primitiva), a origem de eritroblastos permanece vigorosamente debatidos 1. Em contraste, em fases posteriores do desenvolvimento de células do sangue (hematopoiese definitiva), tornou-se cada vez mais claro que a multi-linhagem HSPC surgir a partir de células especializadas vasculares endoteliais que adquirem formação de sangue (células endoteliais hegemônicos) potenciais dentro do saco vitelino, placenta, e AGM 2-5, assim como no vitelina e vasos umbilicais, o endocárdio embrionário 6, e 7 cabeça vasculatura. A especificação de células endoteliais hegemônicos dentro destes tecidos distintos ocorre em fases específicas do desenvolvimento; Por exemplo, dentro do saco vitelino em ~ E8.25 e dentro do AGM em ~ E10 8-12. No entanto, mesmo durante essas janelas específicas do desenvolvimento, a população de endo hegemônicoscélulas Thelial representa uma pequena fracção de todas as células endoteliais (1-3% do saco vitelino e células endoteliais AGM) 11,12. O processo de "especificação" hegemônicos célula endotelial é crítico para a murina, assim como humana, a hematopoiese. As células hematopoiéticas foram mostrados a brotar a partir do endotélio dos vasos do saco vitelino e da aorta em embriões humanos 13, e vários laboratórios têm demonstrado que a produção de células de sangue a partir de células estaminais pluripotentes humanas requer uma célula endotelial intermediário 14-16. Assim, a definição do fenótipo de células endoteliais hegemônicos murinos e compreensão dos eventos moleculares que levam ao seu desenvolvimento neste modelo animal deve facilitar a busca de tecnologias para a produção in vitro de células endoteliais hegemônicos de células estaminais pluripotentes humanas. Por sua vez, o eventual desenvolvimento de uma abordagem para a geração de grande escala de tipos de células diferenciadas a partir de HSPC sangue multi-linhagem --se derived a partir de células-tronco pluripotentes humanas através de uma célula endotelial hegemônicos fisiologicamente relevante intermediário - teria incrível potencial terapêutico para hematológicas, oncológicas e medicina regenerativa. Para atingir este objetivo, definimos o fenótipo de células endoteliais hegemônicos, em um nível clonal, dentro da gema de murino sac 11 e AGM 12, dois principais locais de produção HSPC definitiva durante a embriogênese. Como HSPC dentro da medula óssea adulta 17, células endoteliais hegemônicos embrionárias e HSPC exibem propriedades corante Hoechst efluxo e, portanto, aparece dentro da "população lado" (SP) de células de uma trama de FACS 5,11,12 (como mostrado na Figura 3). Além disso, também têm demonstrado que as células endoteliais expressam marcadores de hegemônicos tanto células endoteliais e (Flk1 e c-kit, respectivamente) do caule, mas não expressam o marcador de linhagem hematopoiética, CD45 5,11,12. Assim, as células endoteliais hegemônicos pode ser identficada e isolados por FACS como células Flk1 + / c-kit + / CD45- SP, e que têm demonstrado que estas células dão origem a HSPC contido dentro da / c-kit + / CD45 + SP Flk1- fracção de células do saco vitelino e AGM 5,11,12. Células endoteliais hegemônicos e HSPC pode ser identificado e isolado a partir do saco vitelino ou tecidos AGM colhidas a partir de qualquer embriões recentemente sacrificados, ou a partir de embriões em cultura durante até 48 horas em ex vivo, a cultura de embriões (como representado na Figura 1). Ex vivo cultura permite selectiva pré-tratamento de embriões individuais com agentes farmacológicos, e também permite a expressão transiente dos transgenes desejados (isto é, através de transdução lentiviral). identificação de FACS de células endoteliais e hegemônicos HSPC pelo método aqui descrito pode ser usado como uma medida quantitativa de desenvolvimento hematopoiético definitiva em modelos de ratos geneticamente manipulados; As células também podem ser recuperados para aplicações experimentais subsequentes, incluindo sangue-FOensaios rmando, análise de expressão, e transplante.
Os indivíduos com animais: Usos e Considerações éticas
Um crescente corpo de literatura estabeleceu a importante contribuição das células endoteliais hegemônicos a formação HSPC durante a fase de hematopoiese definitiva do desenvolvimento embrionário. No entanto, as condições fisiológicas e sinais que promovem a especificação de uma subpopulação de células endoteliais no sentido de um destino hegemônicos permanecem pouco compreendidos, e, por conseguinte, ainda não pode ser mimetizado num ambiente in vitro. Na verdade, as técnicas descritas neste documento estão atualmente em uso por nosso laboratório e outros grupos para melhorar a compreensão do campo do desenvolvimento hematovascular, de tal modo que uma abordagem para a especificação de células ex vivo hegemônicos endotelial e produção HSPC pode ser desenvolvido um dia. Até essa altura, no entanto, o campo permanece dependente de tecidos primários de tipo selvagem (e geneticamente modificados) embriões de camundongos para obter especificado células endoteliais hegemônicos e HSPC para um estudo mais aprofundado. Células endoteliais hegemônicos e HSPC podem ser identificados de forma confiável e isolados a partir de qualquer E8.5 (10 - 12 pares somite) saco vitelino ou E10.5 (35 - 40 pares somite) AGM 11,12. Devido à escassez relativa de células endoteliais hegemônicos (tipicamente representando 1-3% de células endoteliais total de 11,12 dentro destes tecidos) de agrupamento dos tecidos de múltipla (~ 8 - 10) ninhada em uma única amostra é fortemente recomendado, a fim de obter células suficientes para a experimentação subsequente. A verificação de que as células endoteliais e hegemônicos HSPC têm sido identificados e isolados com sucesso pode ser realizada por cultura de células recuperadas em condições que induzem a diferenciação hematopoiética. Sob estas condições, as células endoteliais e hegemônicos HSPC exibirão multi-linhagem diferenciação hematopoiética, resultando no aparecimento de colónias contendo eryprogenitores Throid (BFU-E), de granulócitos e macrófagos progenitores (CFU-GM) e granulócitos, eritrócitos, macrófagos, colônias megacari�itos progenitoras (CFU-GEMM).
Protocolo
Declaração de Ética: O protocolo descrito a seguir foi revisado por, e está em conformidade com as diretrizes do, Animal Care Institucional da Universidade de Yale e do Comitê Use.
1. Embrião Whole Ex V ivo Cultura de Estudos saco vitelino (Opcional)
- Eutanásia barragens grávidas em E7.0 - E7.5, e remover cornos uterinos sob condições estéreis, como descrito em maior detalhe abaixo (passos 2,4-2,7).
- Embriões separados inteiros (com saco vitelino intacta 12) a partir decídua circundante, e suspender em 50 ml de soro de rato inteiro em tubos de 50 ml de poliestireno.
- Garrafas de embrião de gás durante 3 min com 5% de CO 2 imediatamente como descrito anteriormente 12,18. Repita este passo às 24 horas, se a cultura de embriões para 24-48 horas.
- Incubar em cultura de rolamento 37 ° C durante até 48 h.
Nota: Os embriões pode ser tratada ex vivo com agentes farmacológicos (isto é, inibidor DAP Notch.T 12) ou solúveis em proteínas (isto é, fibronectina 19) através de pré-incubação de embriões de até 2 horas no meio de cultura contendo factores tais, ou através da adição destes elementos para o meio de cultura de rolamento durante toda a duração da cultura ex vivo período. A expressão do gene pode ser manipulada em embriões de pré-incubação de embriões com lentivírus optimamente titulado durante 2 h 12. Yolk vascular sac e desenvolvimento hematopoiético pode ser monitorado em tempo real, utilizando camundongos transgênicos repórter e técnicas de imagem óptica.
2. Dissecção da gema Sac (YS) ou na aorta-gônadas-mesonephros (AGM) a partir de embriões de camundongos
- Esterilizar bancada do laboratório por pulverização e limpando todas as superfícies com 70% de etanol para reduzir a contaminação em culturas de células subseqüentes. Colocar um resguardo absorvente na superfície bancada do laboratório.
- Esterilizar instrumentos cirúrgicos com 70% de etanol. instrumentos cirúrgicos recomendados são dois # 5 força retaps, e uma tesoura de 8,5 cm retas.
- Se trabalhar com embriões de cultura ex vivo, remova cuidadosamente embriões inteiros a partir de 50 ml tubos Falcon e prosseguir imediatamente para a etapa 2.8. Caso contrário, ignore esta etapa e vá para a etapa 2.4.
- Eutanásia barragem grávida na idade embrionária apropriado (E8.5 se YS colheita; E10.5 se a colheita AGM).
Nota: A técnica descrita emprega uma abordagem a eutanásia de método duplo - dose letal de um anestésico volátil seguido por deslocamento cervical mecânica - para minimizar a dor dos animais e aflição, e para garantir a cessação minimamente invasivo e humano dos indivíduos animais. Esta técnica combinada para pequenas eutanásia roedor é recomendado pela American Veterinary Medical Association quando realizado por um investigador treinado e proficiente (Orientações AVMA para a eutanásia de animais: 2013 Edition).- Anestesiar rato utilizando uma dose letal de isoflurano (> 5% em O 2) 3 - 5 min. (CAUTION: O isoflurano é um inalantes tóxicos; usar sob uma coifa química com equipamento de protecção pessoal respiratória apropriada.)
- Após a exposição de ratos ao isoflurano, verifique pelo menos três sinais de nível anestésico - perda do reflexo de endireitamento, perda do reflexo toe pitada, e redução da frequência respiratória - garantir indivíduos conseguiram um plano anestésico profundo antes de prosseguir com a eutanásia mecânica.
- Cervical deslocar barragem para induzir rapidamente a morte.
- Coloque supina barragem sacrificados em underpad e liberalmente spray de abdômen inferior, com 70% de etanol.
- Adicione uma incisão vertical na linha média da parede abdominal inferior. Fazer incisões horizontais adicionais ~ 1 polegada que se estende direita e à esquerda do ponto médio da incisão vertical, e dissecar afastado da parede abdominal para expor totalmente cornos uterinos direito e esquerdo cada uma contendo vários embriões em gestação.
- Utilizando uma pinça, segure um dos dois cornos uterinose usar uma tesoura para separá-lo do mesométrio. Coloque útero dissecados em gelo em Solução Salina Equilibrada de Hank estéril de (HBSS) em uma placa de cultura de tecidos de poliestireno de 60 mm. Repita o procedimento para outro corno uterino.
- Sob um microscópio de luz de dissecação padrão, utilize uma pinça para se afastar da camada muscular do útero sac para revelar o saco gestacional subjacente e decídua. Isolar YS (Figura 2A), removendo cuidadosamente o saco a partir do embrião fechado. Remover o tecido YS do embrião propriamente dito na origem embrionária dos vasos vitelínicas.
- Para isolar o AGM, remova o YS e transecto o embrião abaixo do nível do coração e membros anteriores e descarte região do tórax e cabeça. Em seguida, transecção do embrião, logo abaixo do nível dos membros posteriores e remover e descartar o tecido da cauda. Remover os membros posteriores e excesso de tecido ventral a partir da parte restante, que contém o AGM (Figura 2B).
- tecidos piscina YS ou AGM de vários embriões e lojaem gelo em HBSS + (HBSS suplementado com 10% (v) de soro v / fetal de bovino e 100 U / mL de penicilina, 100 ug / ml de estreptomicina, e 0,3 mg / ml de L-glutamina) em um tubo de 1,5 ml limpo.
3. A digestão do tecido primário em uma suspensão de células individuais
- tubo de centrífuga contendo YS colhidas ou tecidos AGM durante 5 min a 2000 xg, a 4 ° C.
- Remover o sobrenadante e ressuspender o tecido em 1 ml de 0,05% (por YS) ou 0,2% (para AGM) de colagenase tipo II diluído em HBSS +. Incubar por 30 min em banho de água a 37 ° C, invertendo o tubo a cada 5 minutos para misturar.
- Gentilmente mecanicamente dissociar o tecido passando amostra de 10 vezes através de uma pipeta P1000. Se ter dificuldade aspiração do tecido parcialmente digerido, pipeta furo ponta pode ser alargado cortando ~ 5 milímetros de ponta com um par de tesouras.
- amostra Centrifugar durante 5 min a 2000 xg, a 4 ° C. Remover o sobrenadante e ressuspender em 1 ml de HBSS arrefecido com gelo +.
- Passe amostra através de um 70 &# 956; filtro de células m.
- Contagem de células utilizando um hemocitómetro manual ou automatizado.
- amostra Centrifugar durante 5 min a 2000 xg, a 4 ° C. amostra Ressuspender em DMEM + (4,5 g / L de glucose de Dulbecco Modified Eagle Médium suplementado com 10% (v) de soro v / fetal de bovino e 100 U / mL de penicilina, 100 ug / ml de estreptomicina, e 0,3 mg / ml de L-glutamina) pré- aquecido a 37 ° C, de modo que as células estão a uma concentração final de 1 x 10 6 células / ml.
4. Tratamento de células com corante de Ácido Nucleico e etiquetagem fluorescente com anticorpos conjugados
- Aliquota, pelo menos, 100 ul de amostra (1 x 10 5 células) em tubos de 1,5 ml fresco para a incubação do anticorpo.
- Inclua a seguinte amostra e tubos de controlo necessários: Unstained; única c-kit-APC; única CD45-FITC; única CD31-PE; única Flk1-PECy7; Hoechst 33342 única; Hoechst 33342 única + verapamil; Amostra (recebe todas as cores, não receberá Verapamil). Usar um mínimo de 1 x 10 5 células em 100 uL para tubos de controlo.
Nota: Um volume maior de células pode ser adicionado ao tubo de amostra com a mesma concentração para maximizar o rendimento de classificados hegemônicos CE e HSPC. - Adicionar Verapamil diluído em etanol a 95% (ver a discussão de lógica) para o "Hoechst 33342 única + Verapamil" tubo de controlo a uma concentração final de 50 uM. Incubar todos os tubos durante 5 min a 37 ° C. (ATENÇÃO: Verapamil é um agente bloqueador dos canais de cálcio potente e é extremamente tóxico Manusear com luvas.).
- Adicionar a Hoechst 33342 para o "Hoechst 33342 único" controlo, para o único controle Hoechst 33342 + verapamil, e para o tubo "Amostra" a uma concentração final de 5 ug / ml. Incubar todos os tubos durante 1 hora a 37 ° C, protegida da luz. Delicadamente misture invertendo a cada 15 minutos. (ATENÇÃO: Hoechst 33342 é um corante nuclear tóxico e deve ser manuseado com luvas).
- Centrífuga todos samples durante 5 min a 2000 xg, a 4 ° C. Remover o sobrenadante e ressuspender peletes de células a uma concentração de 1 x 10 5 culas / ml em HBSS frio +.
- Adicionar anticorpos conjugados com fluorescência para tubos de controlo só de anticorpos adequados, e para o tubo "Amostra" a uma concentração final de 2 ug / ml. Incubar em gelo durante 30 minutos, ao abrigo da luz.
- Centrifugar todos os tubos durante 5 min a 2000 xg, a 4 ° C. Remover o sobrenadante e ressuspender sedimento celular em HBSS 500 ul gelada. amostras de tensão através de tampa de filtro de malha de 5 ml de tubos de fundo redondo de poliestireno FACS e armazenar no gelo, protegido da luz, por FACS imediatos.
5. identificação e isolamento de células endoteliais e hegemônicos HSPC por FACS
Nota: Este protocolo foi otimizado usando um sistema BD FACSAria 5 a laser equipado com um 100 mw laser UV 355 nm, a 200 mw 405 nm do laser violeta, a 200 mw 488 nm do laser azul, a 200 mw 532 laser verde nm, e uma 150 mw 637 nm vermelholaser. As células foram classificadas em PBS estéril como fluido de revestimento e sob condições assépticas, e através de um bico de 100 um com uma taxa de fluxo ajustado para uma pressão de uma amostra de tal modo que um máximo de 1.500 - 2.000 eventos são adquiridos por segundo para minimizar o stress celular.
- Nestas configurações descritas acima, utilizar "não coradas" e simples tubos de controlo de cor para optimizar intensidades de laser classificador de células FACS e executar multi-controlo de compensação de cor espectral de acordo com as instruções do fabricante. Use dispersão frontal e lateral para executar células vivas e doublet discriminação de eventos totais (veja as instruções do fabricante para mais detalhes).
Nota: Este protocolo resulta tipicamente em ~ 70 - células viáveis 80%. Se forem encontrados problemas com a viabilidade celular baixa, assegurar que os tecidos são inicialmente dissecadas rapidamente em meios gelada, e que todas as etapas, exceto aqueles especificando caso contrário, são realizadas em gelo, com pipetagem suave para minimizar corte e morte celular(Veja a discussão para maiores detalhes sobre a preservação da viabilidade celular). - Use um gráfico diferencial escala linear de Hoechst Vermelho contra Hoechst azul fluorescência para identificar a população lateral (SP) eventos (Figura 3A). Use controlo "Hoechst 33342 única + Verapamil", como um controlo negativo para verificar que portões são adequadamente desenhado para a amostra. SP aparece como um ressalto para o lado esquerdo das células não-SP, e vai ser diminuída no controlo tratado com verapamil. A população não-SP será usado para identificar não-hegemônicos CE (Figura 3B).
- Criar parcelas de fluorescência diferencial adicionais (eixos log-escala) e desenhar portões filha do SP para identificar células endoteliais hegemônicos (Figura 3C-E).
Nota: células endoteliais hegemônicos estão perfiladas como células Flk1 + / c-kit + / CD45- SP (Figura 3D), e HSPC são Flk1- / c-kit + / células SP (Figura 3E) CD45 +. Hegemônicos endotelial cells podem ser analisados em paralelo com as células endoteliais não-hegemônicos, que são identificados nesta abordagem, as células não-SP CD31 + / CD45- (Figura 3B). - Recuperar célula endotelial hegemônicos ou fracção HSPC em metilcelulose contendo placas de cultura hematopoiéticas (veja abaixo), ou em outros buffers para processamento e posterior análise.
6. hematopoéticas Diferenciação em Cultura
- Adicionar 0,5 ml (135 ul / cm2) hematopoiético meio de cultura à base de metilcelulose a quantidade desejada de cavidades de uma placa de cultura de tecidos de 24 cavidades, à temperatura ambiente. Adicionar 0,5 ml de água estéril para os poços não utilizados para minimizar a evaporação. Prepare fresco e manter a temperatura ambiente até à utilização.
- Ordenar 1 - 10 células para análise clonal, ou até 1.000 células endoteliais hegemônicos (Flk1 + / c-kit + / células CD45- SP) ou (células Flk1- / c-kit + / CD45 + SP) HSPC para expansão em massa e diferenciação directamente em cada uma das cavidades daplaca contendo metilcelulose. A formação de colónias é detectada em aproximadamente 10 - 20%.
- Em uma capa de cultura de tecidos estéreis, use uma ponta P1000 com a ponta cortada para alargar o seu furo, para voltar a suspender suavemente cada poço da mídia metilcelulose semeados 2 - 3 vezes, tendo o cuidado de evitar a criação de bolhas. Isto assegura a suspensão das células separadas no metilcelulose semi-sólida para o crescimento óptimo.
- Incubar a placa a 37 ° C com 5% de CO 2 durante até 2 semanas.
- Monitorar culturas de células individuais de formação de colónias de células hematopoiéticas diferenciadas, ao longo do tempo (Figura 4). Pontuação poços para número e tipo de colónias hematopoiéticas diferenciadas nos dias 1, 3, 7, e 14 pelo método (s) descrito abaixo no passo 6.7.
- placas de pontuação no dia 1 para confirmar confluência e viabilidade das células classificadas.
- De dia 3, verificar para a formação inicial de colônias de células endoteliais hegemônicos aderentes com "pedrastom "morfologia (veja Goldie et al. 11 e Marcelo et al. 12 para a representação da morfologia dia 3).
- Por dias 5 - 7, verifique se há formação de clusters HSPC arredondados em poços contendo classificadas CE hegemônicos. HSPC deve ser observada adjacente ao achatada hegemônicos CE exibindo uma morfologia de células endoteliais "Cobblestone".
Nota: As células endoteliais hegemônicos deve formar colónias hematopoiéticas (determinado pelo número de colónias hematopoiéticas), e devem demonstrar a capacidade de diferenciação multi-linhagem (determinada por observação de vários tipos de colónias a partir de uma única célula). Nós já observamos que ~ 20% do hegemônicos CE ou HSPC recuperado por FACS sobreviver para formar diferenciar e proliferar colónias hematopoiéticas em metilcelulose 11.
- Para avaliar a formação de colónias por microscopia de fase:
- Visualize e contar colônias em baixa und ampliaçãoer um microscópio de luz fase, e identificar BFU-E, CFU-GM e CFU-GEMM colónias por morfologia das colónias, como descrito por Goldie et al. 11.
- Para avaliar a formação de colónias por morfologia celular:
- Aspirar colónias individuais de superfície metilcelulose em uma ponta P1000 com o fim aparado de alargar furo. Isto facilita a aspiração do meio de metilcelulose viscoso e assegura recuperação bem-sucedida da colónia.
- Ressuspender colhidos colónias em 200 ml de HBSS e centrifugação sobre uma lâmina de vidro usando uma citocentrífuga a 28 xg durante 5 min.
- Fixar as lâminas em metanol a 100% durante 5 min (ATENÇÃO: O metanol é tóxico e só deve ser usado em uma capa química com ventilação adequada e equipamento de protecção individual).
- Submergir slides em 0,04% Giemsa por 20 min (ATENÇÃO:. Giemsa contém metanol Use em uma capa química com ventilação e pessoa adequadaal equipamento de protecção).
- Lavar as lâminas em água deionizada.
- Mount slides com lamelas e imagem em alta ampliação sob um microscópio de luz padrão, comparando a morfologia das células para que classicamente observado em células hematopoiéticas da medula óssea de adultos que são cultivadas em meios de metilcelulose. Para exemplos, consulte as instruções do fabricante.
- Para avaliar a formação de colónias de células por expressão de marcadores de linhagem hematopoiéticas por FACS:
- Adicionar 2 ml de HBSS a cada poço de uma placa de 24 poços contendo colónias cultivadas em 0,5 ml de metilcelulose (isto é, diluir comercialmente disponível metilcelulose estoque 1: 4). Pipeta cima e para baixo para misturar e transferir para tubo novo (s).
- Centrifuga-se a amostra 2000 xg durante 5 min a 4 ° C usando uma microcentrifugadora de bancada padrão.
- Remover o sobrenadante e pellet (s) de células ressuspender em 1 ml HBSS +, reunindo amostras, se assim o desejar.
- CentrifuGE amostra a 2.000 xg durante 5 min a 4 ° C.
- Remover o sobrenadante e pellet (s) de células ressuspender em 400 mL HBSS +.
- alíquota em quatro tubos de 1,5 ml como se segue: não corado; única B220-FITC; GR-1-FITC única; Ter119-FITC única.
- Adicionar anticorpo fluorescente conjugada ao tubo apropriado para uma concentração final de 2 ug / ml. Incubar a 37 ° C durante 15 min.
- Centrifuga-se a amostra 2000 xg durante 5 min a 4 ° C. Remover o sobrenadante e ressuspender sedimento celular em gelada de 0,5 mL de HBSS.
- Analise cada amostra por FACS para a expressão de cada marcador de linhagem hematopoiética: B220 marca as células B 20; GR-1 marcas células mielóides 21; Ter119 marca células eritróides 22.
Nota: anticorpos adicionais destinados a outros marcadores de linhagem hematopoiética pode ser incorporada nesta abordagem, se assim for desejado.
Resultados
Rotulagem bem sucedida de células endoteliais hegemônicos e HSPC de YS embrionárias ou AGM renderão FACS diagramas de dispersão semelhantes aos lotes representativos apresentados na Figura 3. Seguindo células vivas padrão e discriminação dupleto por dispersão frontal e lateral (não mostrado), a população lateral (SP) eventos são visualizados num Hoechst vermelha vs. Hoechst gráfico linear azul diferencial na ausência de verapamil como um "ombro" deixou-se moveu a partir da maioria dos eventos (não-SP) (Figura 3A). Quando a porta é adequadamente desenhada SP, SP células representará cerca de 1-3% do total de células viáveis YS e 3-5% do total de eventos AGM viáveis. Verapamil tratamento deve resultar em> 50% de inibição de eventos SP independentemente da fonte de tecido (Figura 3A, painéis superiores). Nós determinamos previamente que outras populações que aparecem fora do ombro SP, mas também são bloqueados pelo verapamil são erythr Ter119-positivosoblasts, e são, portanto, excluídos da nossa população SP 5.
Em comparação com o SP, SP células não são identificados como o conjunto denso de células adjacentes ao SP "ombro" (Figura 3A). Esta população contém não-hegemônicos CE, que podem ser distinguidos utilizando um CD31-PE vs. filha CD45-FITC (Figura 3B), como CD31 + / CD45- eventos. Não hegemônicos CE são tipicamente 2-5% de células não-SP de AGM (Figura 3B) ou saco vitelino (não mostrado), e um elevado número destas células podem ser ordenados costas com relativa facilidade.
Para a identificação de HSPC e hegemônicos CE, portões filha são desenhados a partir da fracção SP, a identificação de células CD45 + e CD45-, onde CD45 + células são tipicamente <20% do total de eventos em ambas AGM (Figura 3C) ou YS (não mostrado). Hegemônicos CE são subsequentemente identificadas a partir de células CD45- num diferencial de c-kit-APC vs. Flk1-PECy7 filha Plote como eventos de dupla positiva, e geralmente representam 1-3% de eventos CD45- quando isolado a partir de qualquer AGM (Figura 3 D) ou YS (não mostrado). HSPC são identificados a partir da fracção CD45 + em uma separada c-kit-APC vs. filha Flk1-PECy7 como células Flk1- / c-kit +, e também representam normalmente cerca de 25 - 30% de a pequena população de células CD45 + quando obtido a partir de qualquer YS (não mostrado) ou AGM (Figura 3E). Assim, tanto hegemônicos CE e HSPC são excepcionalmente raros (~ 0,01% de eventos celulares totais), e é típico para este protocolo para voltar a algumas centenas de cada tipo de célula, mesmo quando o tecido a partir de múltiplos embriões são reunidas. Gates, em parcelas filha deve ser estabelecido com referência aos grupos de controlo negativo. A fim de distinguir entre coloração do anticorpo específico e não específico, as portas devem ser inicialmente desenhado em referência a ambos os controlos não coradas (Figura 3C), bem como as amostras que foram tratadas com anticorpos de controlo fluorescentemente conjugados do mesmo isotipo (IgG2A ou IgG2b) (não mostrado). Este último controlo demonstrou que a coloração não específica é mínima por este protocolo, portanto, ao mesmo tempo, recomendamos que os anticorpos de controlo do mesmo isotipo (por exemplo., IgG2a-PE ou IgG2b-FITC) ser inicialmente utilizada para otimizar as configurações de classificador FACS e determinar limites portão , encontramos também que os controles não coradas são suficientes para verificar limites portão e qualidade experimental durante FACS rotina de triagem. Se portas estão devidamente elaborado, mínimo de dispersão positivo deve ser observado em portas simples ou dupla positivo quando gravar a partir de controles não coradas ou mesmo isotipo.
Células endoteliais hegemônicos do AGM e HSPC sofrer diferenciação hematopoiética mais de 14 dias de cultura em metilcelulose (Figura 4A). A proporção relativa dos tipos de colónias tipicamente observadas nestesculturas depende da fonte de tecido. Células endoteliais hegemônicos isoladas de tecidos do saco vitelino em E8.5-E9.5 dão origem a BFU-E, CFU-GM, e poucos CFU-GEMM 5, enquanto que as células endoteliais hegemônicos isolados do E10.5 AGM dão origem a predominantemente CFU -GEMM 12, embora outras linhagens são ainda observados, como mostrado na Figura 4B (painel superior esquerdo). Isolado a partir de HSPC E10.5 AGM também dar origem predominantemente a CFU-GEMM após cultura em metilcelulose (Figura 4B, painel superior do meio), embora estas células também irá diferenciar em outros tipos de colónias hematopoéticas, bem. As células endoteliais não-hegemônicos (CD31 + / CD45- não-SP) também foram plaqueadas (Figura 4B, painel superior direito). Estas células demonstrar nenhum crescimento em cultura hematopoiética após 14 dias.
Os ensaios de capacidade hematopoiética de tipos de células que expressam marcadores de superfície individuais, incluindo as células com e sem expressão de uma hematopoiéticasnd marcadores endoteliais CD31, Flk1, c-Kit, VE-cad, CD41 e CD45 na fração SP da AGM em E10.5 foram realizados e demonstram que a atividade multi-linhagem formadoras de colônia na E10.5 AGM é restrito a CD31 +, VE-caderina células CD41 + e CD45 + SP 12 +, c-Kit +,. Curiosamente, a actividade de formação de colónias foi observado em ambas as células + e Flk-1- SP Flk-1, mas apenas células Flk1 + c-kit + CD45- SP deu origem a colónias de multi-linhagem através de uma monocamada endotelial intermédia caracteriza-se por tanto "Cobblestone "morfologia de células endoteliais (Figura 4B, painel inferior esquerdo) e por Dil-AcLDL absorção 12. Além disso, a expressão de c-kit é necessária para a actividade hematopoiética de células SP 12 AGO.
Embora tenha sido demonstrado que alguns progenitores mielóides têm características morfológicas semelhantes quando comparadas com as células endoteliais hegemônicos, as células progenitoras mielóides expressam CD45 e não pode gerar colónias de multi-linhagem in vitro. HSPC também gerar colónias de várias linhagens, mas apesar dessas células CD45, falta-lhes o Flk-1 e expressão 12,23 dar origem a agrupamentos de células arredondadas sem uma monocamada endotelial subjacente (Figura 4B, painel inferior direito). Por conseguinte, a população definimos endotélio como hegemônicos (ou, células do Flk-1 + / c-kit + / CD45-SP) representam células endoteliais com a formação de expressão potencial e robusta gene hematoendothelial sangue, incluindo GATA-1/2, LMO2, SCL / Tal-1, Runx-1, c-Kit, CD34, CD41, CD45 e 11, que são distintas a partir de células estaminais e progenitoras hematopoiéticas, bem como os seus homólogos celulares endoteliais não-hegemônicos.
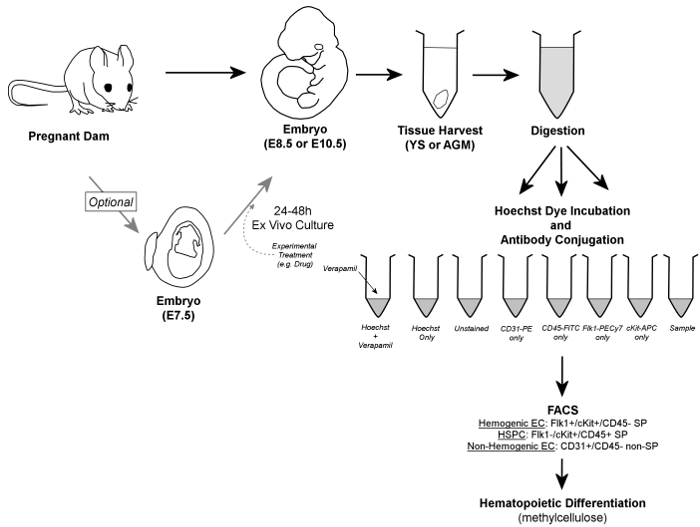
Figura 1. No geral Workflow. Em resumo, os embriões são removidos de vacas prenhes, e YS ou tecidos AGM são colhidas. Os embriões podem ser opcionalmente cultivadas durante dois 4-48 h ex vivo antes da colheita de tecido. YS colhidos ou tecidos AGM são digeridas a uma suspensão de célula única, divididas em alíquotas para tubos de controlo e de amostra, e incubadas na presença de corante Hoechst e / ou anticorpos conjugados com fluorescência. O verapamil, um inibidor dos canais de cálcio, também é utilizado para gerar um controlo negativo indispensável para a verificação de gating precisos da fracção de SP. células endoteliais hegemônicos são identificadas por FACS como Flk1 + / c-kit + / CD45- SP células, enquanto HSPC estão contidos dentro da fracção Flk1- / c-kit + / CD45 + das células SP; Ambos os tipos de células são classificadas em metilcelulose para a confirmação do potencial hegemônicos. Além disso, as células endoteliais não-hegemônicos pode ser discriminado (e recuperados, se assim o desejar) como CD31 + / CD45- células não-SP. Por favor clique aqui para ver uma versão maior desta figura.
igura 2 "src =" / files / ftp_upload / 54150 / 54150fig2.jpg "/>
Figura 2. Dissecção da YS e AGM tecidos. A) O YS é dissecada longe de embriões E8.5, e colocou todo em estéril HBSS + para posterior digestão. B) O tronco de embriões E10.5 é isolado fazendo cortes horizontais abaixo ambas as papilas membros anteriores e dos membros posteriores. A AGM é então separado dos brotos dos membros e do tecido usando uma pinça ventral. C) imagens de campo brilhante mostrar dissecação de ambos os YS e AGM de um embrião E10.5 (escala = 1 mm). Por favor clique aqui para ver uma versão maior esta figura.
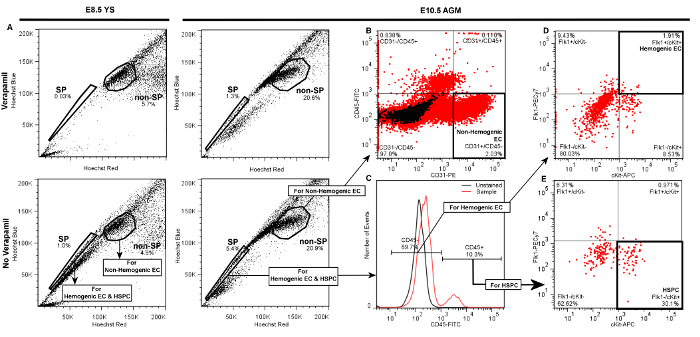
Figura 3. Terrenos representativos que demonstram Portão Hierarquia de Discriminaçãode hegemônicos endotelial celular s (Flk1 + / c-kit + / células CD45- SP), de HSPC (Flk1- / c-kit + / células CD45 + SP), e as células endoteliais não-hegemônicos (CD31 + / CD45- não-SP) por FACS de E8.5 YS ou E10.5 AGM. Seguindo a discriminação de células vivas e dupleto de células a partir de qualquer YS (painéis da esquerda) ou AGM (painéis da direita) por dispersão frontal e lateral (não mostrado), a) a população lateral (SP) controlo é obtido e verificou por uma diminuição significativa da fracção de SP no controlo negativo tratado com verapamil. A população não-SP é identificado como o conjunto denso de células adjacentes ao SP. Em cada um dos gráficos apresentados 20000 eventos são apresentados B), as células endoteliais não-hegemônicos são identificadas como células CD31 + / CD45- na fracção não-SP, e representam 2 -. 5% de células não-SP quer obtidos a partir de AGM (mostrado ) ou YS (não mostrado). para DISCRIminate hegemônicos CE ou HSPC, C) portões filha são desenhados a partir da fracção SP para identificar as células CD45 + e CD45-. D) Para a identificação de células endoteliais hegemônicos a partir de qualquer AGM (mostrado) ou YS (não mostrado), portas filha adicionais são desenhados a partir da fracção CD45- para distinguir células c-kit + (vs. cKit-) e Flk1 + (vs. Flk1-). Hegemônicos CE a partir de qualquer YS ou AGM são tipicamente ~ 1 - 3% de eventos CD45- E) HSPC são identificados a partir de CD45 + fracção como c-kit + e Flk1-, e geralmente representam 20 -. 30% das células CD45 + se ordenados de AGM (mostrado ) ou YS (não mostrado). por favor clique aqui para ver uma versão maior desta figura.
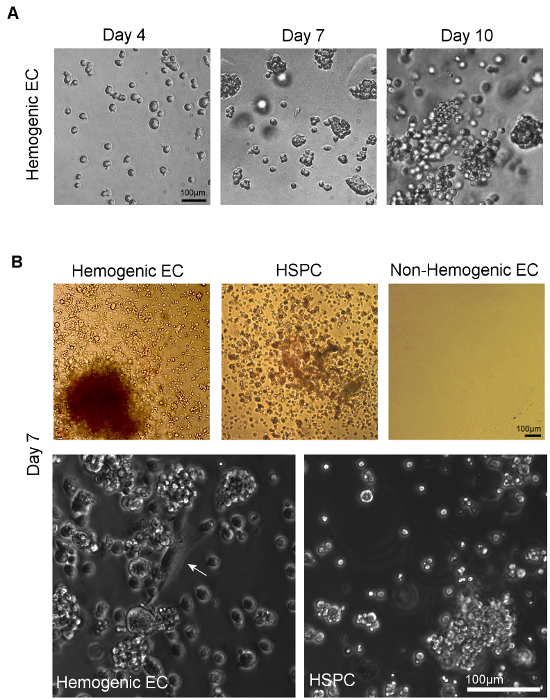
Figura 4. Visualização de hematopoéticas Diferenciação seguinte Cultura da hegemônicos células endoteliais e HSPC em metilcelulose. A) formam colônias de células individuais classificados a menos de 7 dias de plaqueamento em metilcelulose. Multi-linhagem potencial hematopoiéticas pode ser confirmada pela observação de vários tipos de colónias hematopoiéticas, identificado por análise de morfologias de colónias distintas 11. B) Fase de imagem microscópica da classificados CE hegemônicos e HSPC de AGM (ou YS, não mostrado) mostrar multi-linhagem hematopoiética a formação de colónias depois de 7 dias de cultura em meio de cultura de metilcelulose. Não hegemônicos CE de AGM (YS ou, não mostrado) não demonstram o crescimento sob estas condições. Na maior ampliação, as células aderentes com morfologia de células endoteliais clássica "Cobblestone" (seta branca) pode ser visto dando origem a aglomerados de células hematopoiéticas em culturas de hegemônicos CE; nenhuma dessas células endoteliais são observados em culturas de HSPC ordenada (escala = 100 mm). Por favor clique aqui para ver uma versão maior desta figura.
Discussão
Restam muitas perguntas sem resposta no domínio do desenvolvimento hematovascular - um campo que ainda está em sua infância, devido às dificuldades técnicas inerentes a estudar populações de células transitórios e pequenas que surgem apenas durante janelas específicas de desenvolvimento. As técnicas descritas acima melhorar muitas destas dificuldades, permitindo o isolamento de células, mesmo individuais da célula endotelial hegemônicos e populações HSPC em tecidos embrionários em momentos críticos do desenvolvimento, utilizando reagentes e equipamentos que estão normalmente disponíveis na maioria dos laboratórios. Nosso protocolo também permite o isolamento paralela de fracções de células endoteliais não-hegemônicos da YS e AGM, que podem ser utilizados para análises independentes, ou como controlos para a fracção de células endoteliais hegemônicos em análises subsequentes.
Um ponto-chave no isolamento das células endoteliais hegemônicos usando este método baseado em FACS multicolor é apropriado co espectralmpensation e desenho preciso de portões de uma só cor. Como tal, é fortemente recomendado que controles sem manchas e com uma única cor ser incluído em todas as corridas experimentais, e que - juntamente com amostras tratadas com anticorpos de controlo do mesmo isotipo - ser usado para estabelecer inicialmente compensação espectral adequada e desenho de portas. No entanto, a coloração não específica é mínima por este protocolo, assim, os controles não coradas e com uma única cor são suficientes para verificação de rotina dos portões uma vez configurações classificador FACS foram otimizados.
portões SP Inaccurately desenhadas são uma preocupação especial com a abordagem descrita neste relatório. Estudos anteriores demonstraram que as células estaminais multipotentes exibem efluxo preferencial da Hoechst vermelho 17, formando a base fisiológica para a sua aparição no SP por FACS. Mostrámos que as células endoteliais e hegemônicos HSPC são igualmente encontrados dentro da fracção de célula de SP 5,11. As drogas tais como o canal de cálcio emhibitor Verapamil bloquear este comportamento efluxo de corante Hoechst em células SP através do bloqueio de uma variedade de transportadores de resistência a múltiplas drogas transmembranar. Em células estaminais e progenitoras hematopoiéticas, isto ocorre principalmente via o transportador ABCG2 / BCRP1 24. Tipicamente verapamil induz> 50% de bloqueio do SP, no entanto, o grau global de Hoechst efluxo e seu bloqueio subsequente por Verapamil visto tem sido mostrado a ser afectado pelo tempo de desenvolvimento, presumivelmente devido à mudança de expressão de tipos de transportadores resistentes a múltiplas multidrogas com diferencial Hoechst capacidade de efluxo, e sensibilidade para Verapamil 5. Assim, é altamente recomendável que Verapamil-tratados Hoechst-manchado controle negativo ser standardly incluídos para garantir gating SP adequada: se um portão de SP está devidamente elaborado, uma notável redução no número de células SP devem ser detectados em amostras coradas com Hoechst em a presença de verapamil.
Temos demonstrado anteriormente que a classificadasCélulas SP a partir do saco de gema de E9.5 murino tem uma ~ 80 - 90 vezes maior capacidade para gerar HSPC em cultura hematopoiética à base de metilcelulose, quando comparado com um número correspondente de E9.5 não fraccionada, não-coradas Hoechst células do tecido YS todo 5. A caracterização adicional do SP tem mostrado que, no saco vitelino de murídeo durante hematopoéticas e o desenvolvimento vascular em E8.0, existe expressão significativa da VE-caderina e Flk-1, mas a baixa expressão da haste (c-kit) e marcadores hematopoiéticas (CD45). Assim, neste ponto de tempo do desenvolvimento primordial, (não-hegemônicos) CE, definida como Flk-1 + / CD31 + / CD45- células não SP predominam. Isso muda perfil de expressão como expressão do marcador endotelial diminui e CD45 e c-Kit expressão aumenta, concomitante com uma capacidade crescente para gerar HSPC in vitro entre E9.5 e E11.5 5. Isto sugere actividade hematopoiética de tecido YS está contido dentro do SP, a tornar-se mais aparente entre E9.5 e E11.5, e Ocorreming através de uma perda cronometrado de características endoteliais e aquisição gradual da capacidade hematopoiética. Como tal, a expressão dos transportadores de resistência a múltiplos fármacos que originam o fenótipo SP são um importante marcador fenotípico de endotélio hegemônicos 5; Na verdade, as células não-SP do AGM não exibem potencial 12 de formação do sangue. Assim, o isolamento bem sucedido do SP através de coloração Hoechst, tanto no YS e AGM assegura que as células serão classificadas a partir do compartimento hematopoiético de células estaminais de um dado tecido, e subsequente coloração com anticorpo de células dentro desta fracção permitirá discriminação da hegemônicos (Flk -1 + / c-kit + / CD45-) versus HSPC (Flk1- / c-kit + / CD45 +) populações 5,11,12. Além disso, tem sido observado anteriormente que CD41 + células dentro da SP do saco vitelino e dos tecidos AGM são capazes de formação de colónias de multi-linhagem em cultura com base metilcelulose 11,12. Definimos células endoteliais hegemônicos como Flk1 + c-Kit + células CD45- SPs usando CD45 como um marcador designado de linhagem hematopoiética, em vez de CD41 dada a nossa constatação de que a expressão de CD45 Flk1 e é virtualmente excluem mutuamente 5,11. Isto permite um isolamento pura de células dentro do SP que tem tanto endotelial (Flk-1) e da haste características (c-Kit) necessárias para endoteliais a transição hematopoiéticas, mas que ainda não tenham sido submetidos a esta alteração, tal como determinado pela ausência de CD45 nestas células. Seria útil considerar a sub-fraccionamento da população HSPC, definida como as células do Flk-1 / C-kit + / CD45 + / SP, em Csf1r + (macrófagos de tecido) e fracção Csf1r- (HSC) tal como foi recentemente relatado por Gomez e colegas 25, pois isso iria proporcionar uma maior resolução do verdadeiro HSPC contra populações de macrófagos de tecidos progenitoras, mas isso não deve afetar a integridade da fração de células endoteliais hegemônicos cujo isolamento temos delineado desde Csf1r é um marcador de células progenitoras de macrófagos 26.
Hemogcélulas endoteliais ENIC são uma subpopulação rara em ambos YS e AGM (compreendendo 1-3% de células endoteliais), e, portanto, um grande desafio em seu estudo é rendimento celular insuficiente para aplicações subseqüentes. Este protocolo resulta geralmente em 70-80% das células restantes viável no momento da triagem, e um tipo de célula típico hegemônicos endoteliais dos tecidos reunidos obtidos a partir de vários embriões pode render apenas algumas centenas de células, mesmo sob condições ideais, com apenas 10-20% células de colónias em metilcelulose incorporados produzir recuperado. Para maximizar o número de células ordenada, é altamente recomendável que os investigadores tomem medidas que assegurem tecidos e viabilidade celular durante todas as etapas do processo: tecidos devem ser rapidamente dissecado e combinados, e as amostras devem ser mantidas em gelo sempre que possível. As amostras devem ser preparadas imediatamente antes da separação por FACS, e classificados em tubos de colheita com conteúdo soro elevado, ou diretamente na cultura metilcelulose como descreverd acima. Se problemas de viabilidade persistirem, tubos de coleta também podem ser pré-revestidas com soro para aumentar ainda mais a sobrevivência das células de classificação. Se o rendimento de células endoteliais hegemônicos continua a ser baixa, da medula óssea adulta ou grânulos fluoróforos disponíveis comercialmente podem ser utilizados para a compensação espectral em vez de os controlos única cor derivada de tecidos embrionários aqui descritos. Se as células escolhidas são destinados para a cultura, as células endoteliais e hegemônicos HSPC devem ser classificados directamente em poços de cultura de tecidos. Se as células escolhidas são destinados para análise de ADN ou expressão de genes de ARN relacionado, as células endoteliais e não-hegemônicos hegemônicos e HSPC podem ser classificados directamente para tubos de colheita contendo tampão de lise da amostra para minimizar a perda de células.
A técnica descrita permite bem sucedida (e simultânea) isolamento de células endoteliais hegemônicos e não-hegemônicos, assim como fracções de HSPC e de células sanguíneas maduras a partir dos mesmos tecidos embrionários. Esta abordagem permite ainda parafuso prisioneiroy das bases moleculares das transições críticas que ocorrem como células endoteliais gerar sangue. Os conhecimentos obtidos a partir destes estudos de desenvolvimento pode, então, ser utilizados para optimizar a geração de células endoteliais humanas e hegemônicos HSPC progenitura de pluripotentes, e potencialmente autólogo, as células para o tratamento de desordens hematopoiéticas estaminais prevalentes.
Divulgações
Este trabalho foi apoiado byNIH subsídios HL128064, Innovations HL096360, EB017103, e CT conceder 15 RMB-YALE-04, a KKH, e NICHD / NIH T32HD007094.
Agradecimentos
Os autores declaram que não têm interesses financeiros concorrentes.
Materiais
| Name | Company | Catalog Number | Comments |
| DAPT (N-[N-(3,5-Difluorophenacetyl)-L-alanyl]-S-phenylglycine t-butyl ester) | Sigma | D5942 | TOXIC irritant: Wear eye protection, mask, and gloves when handling. |
| Absorbent bench underpad | Covidien | 7134 | |
| #5 Straight Forceps | Fine Science Tools | 11251-20 | |
| 8.5 cm straight scissors | Fine Science Tools | 14090-09 | |
| Isoflurane (Isothesia) | Henry Schein | 50033 | TOXIC inhalant: Use in fume hood. |
| 100x Penicillin Streptomycin Glutamine (10,000 U/ml Penicillin, 10,000 mg/ml Streptomycin, 29.2 mg/ml L-glutamine) | Invitrogen | 10378016 | |
| Type II Collagenase | Worthington | LS004174 | |
| Falcon 70 μM nylon cell strainer | Corning | CLS431751 | |
| Anti-Mouse CD45-FITC | eBioscience | 11-0451-81 | |
| Anti-Mouse CD31 - PE | eBioscience | 12-0311-81 | |
| Anti-Mouse Flk-1 PE-Cy7 | BD Pharmingen | 561259 | |
| Hoechst 33342 (bisBenzimide H 33342 trihydrochloride) | Sigma | 14533 | TOXIC: irritant. Wear eye protection and gloves when handling. Prepare stock solution of 25 mg/ml in distilled H2O, store aliquots at -20 °C until ready for use. |
| Verapamil Hydrochloride | Sigma | 1711202 | TOXIC: irritant. Wear eye protection, mask, and gloves when handling. Prepare stock solution of 5 mM (100x) in 95% ethanol. Store at -20 °C until ready for use |
| Falcon 5 ml Round Bottom Polystyrene Test Tube, with Cell Strainer Snap Cap | Corning | 352235 | |
| MethoCult GF M3434 | Stem Cell Technologies | 3434 | Thaw and aliquot per manufacturer's instructions |
| Modified Giemsa Stain | Sigma | GS500 | TOXIC: Contains Methanol - use in fume hood and wear gloves with handling. Dilute in distilled water to 0.02% solution. |
| Cytospin Centrifuge | Thermo Scientific | A78300003 | |
| Clipped Funnel Starter Kit | Thermo Scientific | 3120110 | Includes cytofunnels, filter paper, cytoslides, and cytoclips for use with Cytospin centrifuge |
| Anti-Mouse B-220 - FITC | BD Pharmingen | 553088 | |
| Anti-Mouse Gr-1-FITC | eBioscience | 11-5931-85 | |
| Anti-Mouse Ter-119-FITC | eBioscience | 11-5921-85 | |
| Gibco Fetal Bovine Serum | Thermo Scientific | 10437-077 | |
| Dulbecco's Modified Eagle Medium (4.5 g/L) | Life Technologies | 11965-092 | |
| Hank's Buffered Salt Solution | Life Technologies | 14175-095 | |
| Fibronectin-coated 24-well tissue culture plate | EMD Millipore | PIFB24P05 | |
| IgG2A-PE | BD Pharmingen | 553930 | |
| IgG2B-FITC | BD Pharmingen | 556923 |
Referências
- Hirschi, K. K. Hemogenic endothelium during development and beyond. Blood. 119 (21), 4823-4827 (2012).
- Boisset, J. C., et al. et al. In vivo imaging of haematopoietic cells emerging from the mouse aortic endothelium. Nature. 464 (7285), 116-120 (2010).
- Bertrand, J. Y., et al. Haematopoietic stem cells derive directly from aortic endothelium during development. Nature. 464 (7285), 108-111 (2010).
- Kissa, K., Herbomel, P. Blood stem cells emerge from aortic endothelium by a novel type of cell transition. Nature. 464 (7285), 112-115 (2010).
- Nadin, B. M., Goodell, M. A., Hirschi, K. K. Phenotype and hematopoietic potential of side population cells throughout embryonic development. Blood. 102 (7), 2436-2443 (2003).
- Nakano, H., et al. Haemogenic endocardium contributes to transient definitive haematopoiesis. Nat Commun. 4, 1564 (2013).
- Li, Z., et al. Mouse embryonic head as a site for hematopoietic stem cell development. Cell Stem Cell. 11 (5), 663-675 (2012).
- Medvinsky, A., Dzierzak, E. Definitive hematopoiesis is autonomously initiated by the AGM region. Cell. 86 (6), 897-906 (1996).
- Palis, J., Robertson, S., Kennedy, M., Wall, C., Keller, G. Development of erythroid and myeloid progenitors in the yolk sac and embryo proper of the mouse. Development. 126 (22), 5073-5084 (1999).
- de Bruijn, M. F., Speck, N. A., Peeters, M. C., Dzierzak, E. Definitive hematopoietic stem cells first develop within the major arterial regions of the mouse embryo. Embo J. 19 (11), 2465-2474 (2000).
- Goldie, L. C., Lucitti, J. L., Dickinson, M. E., Hirschi, K. K. Cell signaling directing the formation and function of hemogenic endothelium during murine embryogenesis. Blood. 112 (8), 3194-3204 (2008).
- Marcelo, K. L., et al. Hemogenic endothelial cell specification requires c-Kit, Notch signaling, and p27-mediated cell-cycle control. Dev Cell. 27 (5), 504-515 (2013).
- Tavian, M., et al. Aorta-associated CD34+ hematopoietic cells in the early human embryo. Blood. 87 (1), 67-72 (1996).
- Wang, L., et al. Endothelial and hematopoietic cell fate of human embryonic stem cells originates from primitive endothelium with hemangioblastic properties. Immunity. 21 (1), 31-41 (2004).
- Kelly, M. A., Hirschi, K. K. Signaling Hierarchy Regulating Human Endothelial Cell Development. Arterioscler Thromb Vasc Biol. 29 (5), 718-724 (2009).
- Kennedy, M., et al. T lymphocyte potential marks the emergence of definitive hematopoietic progenitors in human pluripotent stem cell differentiation cultures. Cell Rep. 2 (6), 1722-1735 (2012).
- Goodell, M. A., Brose, K., Paradis, G., Conner, A. S., Mulligan, R. C. Isolation and functional properties of murine hematopoietic stem cells that are replicating in vivo. J Exp Med. 183 (4), 1797-1806 (1996).
- Takahashi, M., Osumi, N. The method of rodent whole embryo culture using the rotator-type bottle culture system. J Vis Exp. (42), (2010).
- Bohnsack, B. L., Lai, L., Dolle, P., Hirschi, K. K. Signaling hierarchy downstream of retinoic acid that independently regulates vascular remodeling and endothelial cell proliferation. Genes Dev. 18 (11), 1345-1358 (2004).
- Coffman, R. L., Weissman, I. L. B220: a B cell-specific member of the T200 glycoprotein family. Nature. 289 (5799), 681-683 (1981).
- Fleming, T. J., Fleming, M. L., Malek, T. R. Selective expression of Ly-6G on myeloid lineage cells in mouse bone marrow. RB6-8C5 mAb to granulocyte-differentiation antigen (Gr-1) detects members of the Ly-6 family. J Immunol. 151 (5), 2399-2408 (1993).
- Kina, T., et al. The monoclonal antibody TER-119 recognizes a molecule associated with glycophorin A and specifically marks the late stages of murine erythroid lineage. British Journal of Haematology. 109 (2), 280-287 (2000).
- Jackson, K. A., et al. Regeneration of ischemic cardiac muscle and vascular endothelium by adult stem cells. J Clin Invest. 107 (11), 1395-1402 (2001).
- Scharenberg, C. W., Harkey, M. A., Torok-Storb, B. The ABCG2 transporter is an efficient Hoechst 33342 efflux pump and is preferentially expressed by immature human hematopoietic progenitors. Blood. 99 (2), 507-512 (2002).
- Gomez Perdiguero, ., E, , et al. Tissue-resident macrophages originate from yolk-sac-derived erythro-myeloid progenitors. Nature. 518 (7540), 547-551 (2015).
- Murray, P. J., Wynn, T. A. Protective and pathogenic functions of macrophage subsets. Nat Rev Immunol. 11 (11), 723-737 (2011).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados