Method Article
Isolement des cellules embryonnaires murines Hemogenic endothéliales
* Ces auteurs ont contribué à parts égales
Dans cet article
Résumé
cellules souches et progénitrices hématopoïétiques (HSPC) proviennent de (hemogenic) des cellules endothéliales spécialisées au cours du développement, mais on sait peu sur le processus par lequel certaines cellules endothéliales spécifient pour devenir la formation du sang. Nous démontrons une méthode basée sur la cytométrie de flux permettant l'isolement simultané des cellules endothéliales hemogenic et HSPC de tissus embryonnaires murines.
Résumé
La spécification des cellules endothéliales hemogenic de l'endothélium vasculaire embryonnaire se produit pendant de brèves périodes de développement dans les tissus distincts, et est nécessaire pour l'émergence de HSPC définitive du sac murine supplémentaire embryonnaire jaune, le placenta, les vaisseaux ombilicaux, et l'aorte-gonades-mésonéphros embryonnaires ( région AGM). La nature transitoire et la petite taille de cette population cellulaire rend son isolement reproductible pour la quantification soigneuse et des applications expérimentales techniquement difficile. Nous avons établi une cellule activé par fluorescence (FACS) protocole à base pour l'isolement simultané des cellules endothéliales hemogenic et HSPC pendant leurs temps de génération de pointe dans le sac vitellin et AGM. Nous démontrons méthodes de dissection du sac vitellin et les tissus AGM à partir d'embryons de souris, et nous présentons optimisés digestion des tissus et de conjugaison d'anticorps conditions pour la survie cellulaire maximale avant l'identification et la récupération via FACS. Représentant FACS anaparcelles de lyse sont présentés qui identifient la cellule endothéliale hemogenic et phénotypes HSPC, et décrivent un dosage à base de méthylcellulose pour évaluer leur sang potentiel de formation à un niveau clonal.
Introduction
Un système de circulation fonctionnelle requiert le développement parallèle des vaisseaux sanguins et des cellules sanguines. Aux premiers stades du développement de sang (hématopoïèse primitive), l'origine des érythroblastes reste débattue vigoureusement 1. En revanche, à des stades ultérieurs du développement des cellules sanguines (hématopoïèse définitive), il est devenu de plus en plus clair que multi-lignage HSPC proviennent de cellules spécialisées vasculaires endothéliales qui acquièrent hématopoïétiques (cellules hemogenic endothéliales) potentiels dans le sac vitellin, le placenta, et AGM 2-5, ainsi que dans la vitelline et vaisseaux ombilicaux, l'endocarde embryonnaire 6, et la tête vasculature 7. La spécification des cellules endothéliales hemogenic au sein de ces tissus distincts se produit à des stades spécifiques du développement; par exemple, dans la vésicule ombilicale à ~ E8.25 et dans l'assemblée générale annuelle à ~ E10 8-12. Néanmoins, même au cours de ces fenêtres de développement spécifiques, la population de endo hemogeniccellules thelial représente une petite fraction de toutes les cellules endothéliales (1 - 3% du sac vitellin et les cellules endothéliales AGM) 11,12. Le processus de la cellule "spécification" endothéliale hemogenic est critique pour murin, ainsi que l'homme, de l'hématopoïèse. Les cellules hématopoïétiques ont été représentés à bourgeonner à partir de l'endothélium des vaisseaux du sac vitellin et l'aorte d'embryons humains 13 et plusieurs laboratoires ont montré que la production de cellules sanguines à partir de cellules souches pluripotentes humaines exige une cellule endothéliale intermédiaire 14-16. Ainsi, la définition du phénotype des cellules endothéliales murines hemogenic et la compréhension des événements moléculaires qui mènent à leur développement dans ce modèle animal devrait faciliter la poursuite des technologies in vitro pour la production de cellules endothéliales hemogenic à partir de cellules souches pluripotentes humaines. À son tour, le développement éventuel d'une approche pour la production à grande échelle de types de cellules sanguines différenciées de multi-lignée HSPC - se derived à partir de cellules souches pluripotentes humaines par l'intermédiaire d'une cellule endothéliale hemogenic physiologiquement pertinente intermédiaire - aurait un potentiel thérapeutique incroyable pour hématologique, oncologique et la médecine régénérative. Pour atteindre cet objectif, nous avons défini le phénotype des cellules endothéliales hemogenic, à un niveau clonal, dans le jaune murin sac 11 et AGM 12, deux sites majeurs de production HSPC définitive au cours de l' embryogenèse. Comme HSPC dans les adultes de la moelle osseuse 17, les cellules endothéliales hemogenic embryonnaires et HSPC exposition Hoechst propriétés colorant d'efflux et donc apparaître dans la «population de côté» (SP) des cellules sur un terrain FACS 5,11,12 (comme le montre la figure 3). En outre, nous avons également montré que les cellules endothéliales hemogenic expriment des marqueurs des deux endothéliales et les cellules souches (et Flk1 CKIT, respectivement), mais n'expriment le marqueur de lignée hématopoïétique CD45 5,11,12. Ainsi, les cellules endothéliales hemogenic peuvent être identified et isolés par FACS comme cellules Flk1 + / cKit + / CD45- SP, et nous avons montré que ces cellules donnent naissance à des HSPC contenu dans la / cKit + / CD45 + SP fraction Flk1- du sac vitellin et les cellules AGM 5,11,12. Les cellules endothéliales Hemogenic et HSPC peuvent être identifiés et isolés du sac jaune ou tissus AGM récoltées à partir soit des embryons fraîchement euthanasiés, ou à partir d' embryons cultivés pendant 48 heures en culture ex vivo de l' embryon (comme représenté sur la figure 1). La culture ex vivo permet sélective pré-traitement des embryons individuels avec des agents pharmacologiques, et permet également l' expression transitoire de transgènes souhaités ( par exemple, par transduction lentivirale). l'identification FACS des cellules endothéliales et hemogenic HSPC par le procédé décrit ici peut être utilisé comme une mesure quantitative du développement hématopoïétique définitif dans des modèles murins génétiquement modifiés; les cellules peuvent également être récupérées pour des applications expérimentales ultérieures, y compris le sang-foessais rmer, analyse de l'expression, et la transplantation.
Matières animales: Usages et considérations éthiques
Un nombre croissant d'études a établi la contribution importante des cellules endothéliales hemogenic à la formation HSPC pendant la phase de l'hématopoïèse définitive du développement embryonnaire. Pourtant, les conditions physiologiques et des signaux qui favorisent la spécification d'une sous - population de cellules endothéliales vers un destin hemogenic restent mal connus, et donc ne peuvent pas encore être imitées dans un cadre in vitro. En effet, les techniques décrites dans le présent document sont actuellement utilisées par notre laboratoire et d' autres groupes afin d' améliorer la compréhension du domaine du développement hematovascular, telles qu'une approche pour la spécification des cellules ex vivo hemogenic endothéliales et la production HSPC pourrait être développé un jour. Jusqu'à ce moment, cependant, le champ reste dépendant de tissus primaires de type sauvage (et gène) des embryons de souris tiquement modifiés pour obtenir spécifiées cellules endothéliales hemogenic et HSPC pour une étude plus approfondie. Les cellules endothéliales Hemogenic et HSPC peuvent être identifiés de façon fiable et isolés soit E8.5 (10 - 12 paires de somites) jaune sac ou E10.5 (35 - 40 paires de somites) AGM 11,12. En raison de la rareté relative des cellules endothéliales hemogenic (représentant typiquement 1 - 3% du nombre total de cellules endothéliales 11,12 au sein de ces tissus) , la mise en commun des tissus provenant de multiples (~ 8 - 10) littermates dans un seul échantillon est fortement recommandé afin de obtenir suffisamment de cellules pour une expérimentation ultérieure. Vérifier que les cellules endothéliales et hemogenic HSPC ont été identifiés et isolés avec succès peut être réalisée par culture de cellules récupérées dans des conditions qui induisent la différenciation hématopoïétique. Dans ces conditions, les cellules endothéliales et hemogenic HSPC présenteront une différenciation hématopoïétique lignées multiples, ce qui entraîne l'apparition de colonies contenant eryprogéniteurs Throid (BFU-E), granulocytes et de macrophages progéniteurs (CFU-GM), et granulocytes, érythrocytes, macrophage, colonies de mégacaryocytes progénitrices (CFU-GEMM).
Protocole
Déclaration d' éthique: Le protocole décrit ci - dessous a été examiné par, et est en conformité avec les directives de, Institutional Animal Care de l' Université de Yale et l' utilisation du Comité.
1. Whole Embryo Ex V ivo Culture pour Yolk Sac études (Facultatif)
- Euthanasier barrages enceintes à E7.0 - E7.5, et enlever les cornes utérines dans des conditions stériles, comme décrit plus en détail ci-dessous (étapes 02/04 à 02/07).
- Embryons séparés entiers (avec le jaune sac intact 12) decidua environnante, et suspendre dans 50 ml de sérum de rat entier dans 50 ml tubes de polystyrène.
- Les bouteilles d'embryons de gaz pendant 3 min avec 5% de CO 2 comme précédemment décrit immédiatement 12,18. Répétez cette étape à 24 h, si la culture d'embryons pour 24-48 h.
- Incuber dans la culture de laminage C à 37 ° C pendant jusqu'à 48 heures.
Remarque: Les embryons peuvent être traitées ex vivo avec des agents pharmacologiques ( par exemple, un inhibiteur de Notch DAP.T 12) ou solubles des protéines ( par exemple, la fibronectine 19) à travers une pré-incubation des embryons jusqu'à 2 h dans un milieu de culture contenant de tels éléments, ou par addition de ces éléments dans le milieu de culture de roulement pendant toute la durée de la culture ex vivo période. L' expression génique peut être manipulé dans des embryons de pré-incubation des embryons avec des lentivirus optimale titrés pendant 2 heures 12. Yolk sac vasculaire et le développement hématopoïétique peuvent être surveillés en temps réel en utilisant des souris transgéniques rapporteurs et des techniques d'imagerie optique.
2. Dissection de Yolk Sac (YS) ou Aorte-gonades-mésonéphros (AGA) de Mouse Embryons
- Stériliser paillasse par pulvérisation et essuyer toutes les surfaces avec 70% d'éthanol pour réduire la contamination dans les cultures cellulaires ultérieures. Placer une alaise absorbante sur la surface du banc de laboratoire.
- Stériliser les instruments chirurgicaux avec 70% d'éthanol. instruments chirurgicaux recommandés sont deux # 5 vigueur droiteps, et une paire de ciseaux 8,5 cm droites.
- Si vous travaillez avec des embryons de culture ex vivo, retirer soigneusement les embryons entiers de 50 ml tubes Falcon et procéder immédiatement à l' étape 2.8. Sinon, ignorez cette étape et passez à l'étape 2.4.
- Euthanasier barrage enceinte à l'âge embryonnaire approprié (E8.5 si YS de récolte; E10.5 si la récolte AGM).
Remarque: La technique décrite utilise une approche de l'euthanasie méthode double - dose létale d'un anesthésique volatil suivi par dislocation cervicale mécanique - pour minimiser la douleur et de la détresse animale, et d'assurer la terminaison mini-invasive et humaine des sujets animaux. Cette technique combinée pour les petites euthanasie des rongeurs est recommandé par l'American Veterinary Medical Association lorsqu'elle est effectuée par un enquêteur qualifié et compétent (Directives AVMA pour l'euthanasie des animaux: 2013 Edition).- Anesthésier la souris avec une dose létale de l' isoflurane (> 5% de O 2) pendant 3 - 5 min. (CautiON: L'isoflurane est un inhalant toxique; utiliser sous une hotte chimique avec des équipements de protection individuelle respiratoire appropriée.)
- Après l'exposition des souris à l'isoflurane, vérifier au moins trois signes de niveau anesthésique - perte du réflexe de redressement, la perte de pincement de l'orteil réflexe, et de réduction de la fréquence respiratoire - pour assurer des sujets ont atteint un plan d'anesthésie profonde avant de procéder à l'euthanasie mécanique.
- Cervical disloquer barrage pour induire rapidement la mort.
- Placer euthanasiés décubitus barrage sur underpad et vaporiser généreusement abdomen inférieur avec 70% d'éthanol.
- Faire une incision verticale le long de la ligne médiane de la paroi abdominale inférieure. Faire des incisions horizontales 1 pouce supplémentaires ~ étendant droite et à gauche à partir du milieu de l'incision verticale et dissèquent loin de la paroi abdominale pour exposer pleinement droite et à gauche cornes utérines chacun contenant plusieurs embryons gestantes.
- En utilisant des pinces, maintenez une des deux cornes utérineset utiliser des ciseaux pour le séparer de la mésomètre. Placer l'utérus disséqué sur la glace dans une solution saline équilibrée de Hank stérile (HBSS) dans une plaque de culture de tissu en polystyrène de 60 mm. Répétez l'opération pour l'autre corne utérine.
- Sous un microscope optique à dissection standard, utilisez une pince pour arracher la couche musculaire de l'utérus sac pour révéler le sac gestationnel sous-jacent et decidua. Isolât YS (figure 2A) en retirant doucement le sac de l'embryon fermé. Retirer le tissu YS de l'embryon proprement à l'origine embryonnaire des vaisseaux vitellins.
- Pour isoler l'AGA, retirez le YS et sectionner l'embryon en dessous du niveau du cœur et forelimbs et jeter la région du thorax et de la tête. Ensuite, sectionner l'embryon juste en dessous du niveau des hindlimbs et enlever et jeter le tissu de la queue. Retirez les hindlimbs et excès de tissu ventral de la section restante, qui contient l'AGA (figure 2B).
- tissus Piscine YS ou AGM de plusieurs embryons et magasinsur de la glace dans HBSS + (HBSS additionné de 10% (en volume) de sérum / bovin foetal et 100 UI / ml de pénicilline, 100 pg / ml de streptomycine et 0,3 mg / ml de L-glutamine) dans un tube de 1,5 ml propre.
3. Digestion du tissu primaire dans une suspension cellulaire unique
- Tube à centrifuger contenant YS récoltés ou tissus AGM pendant 5 min à 2000 xg à 4 ° C.
- Retirer le surnageant et remettre en suspension le tissu dans 1 ml de soit 0,05% (pour YS) ou 0,2% (pour les AGM) collagénase de type II dilué dans HBSS +. Incuber pendant 30 min au bain-marie à 37 ° C, le tube d'inversion toutes les 5 minutes pour mélanger.
- Doucement dissocier mécaniquement le tissu en passant l'échantillon 10 fois à travers une pipette P1000. Si la difficulté à aspirer le tissu partiellement digérés, embout de pipette alésage peut être élargi en coupant ~ 5 mm de la pointe avec une paire de ciseaux.
- échantillon Centrifugeuse pendant 5 min à 2000 xg à 4 ° C. Retirer le surnageant et remettre en suspension dans 1 ml glacée HBSS +.
- Passer à travers un échantillon de 70 &# 956; m cellules crépine.
- Compter les cellules en utilisant un hémocytomètre manuel ou automatisé.
- échantillon Centrifugeuse pendant 5 min à 2000 xg à 4 ° C. Extrait Remettre en suspension dans du DMEM + (4,5 g / L de glucose de Dulbecco Modified Eagle Medium additionné de 10% (en volume) de sérum / bovin foetal et 100 UI / ml de pénicilline, 100 pg / ml de streptomycine et 0,3 mg / ml de L-glutamine) pré chauffé à 37 ° C de telle sorte que les cellules sont à une concentration finale de 1 x 10 6 cellules / ml.
4. Traitement des cellules avec des acides nucléiques Dye et marquage avec des anticorps par fluorescence Conjugués
- Aliquoter au moins 100 pi d'échantillon (1 x 10 5 cellules) en frais tubes de 1,5 ml pour anticorps incubation.
- Inclure l'exemple suivant et les tubes de contrôle nécessaires: non coloré; cKit-APC seulement; CD45-FITC seul; CD31-PE uniquement; Flk1-PECy7 uniquement; Hoechst 33342 seulement; Hoechst 33342 seulement + vérapamil; Sample (reçoit toutes les couleurs, ne recevra pas vérapamil). Utiliser un minimum de 1 x 10 5 cellules dans 100 ul pour les tubes témoins.
Note: Un volume plus important de cellules peut être ajoutée au tube d'échantillon à la même concentration pour maximiser le rendement du tri Hemogenic CE et de HSPC. - Ajouter Verapamil dilué dans 95% d' éthanol (voir Discussion pour la justification) à la «Hoechst 33342 seulement + vérapamil" Tube de commande à une concentration finale de 50 uM. Incuber tous les tubes pendant 5 min à 37 ° C. (ATTENTION: Verapamil est un puissant agent de blocage des canaux calciques et est extrêmement toxique Manipuler avec des gants.).
- Ajouter Hoechst 33342 à la «Hoechst 33342 seulement», à la + vérapamil seul contrôle Hoechst 33342, et le tube "échantillon" à une concentration finale de 5 ug / ml. Incuber tous les tubes pendant 1 heure à 37 ° C, à l'abri de la lumière. Mélanger doucement en inversant toutes les 15 min. (ATTENTION: Hoechst 33342 est un colorant nucléaire toxique et doit être manipulé avec des gants).
- Centrifugeuse tout samples pendant 5 min à 2000 xg à 4 ° C. Retirer le surnageant et remettre en suspension les culots cellulaires à une concentration de 1 x 10 5 cellules / ml dans du HBSS froid +.
- Ajouter des anticorps conjugués à fluorescence tubes témoins d'anticorps seulement approprié, et le tube "échantillon" à une concentration finale de 2 pg / ml. Incuber sur la glace pendant 30 min, à l'abri de la lumière.
- Centrifuger tous les tubes pendant 5 min à 2000 xg à 4 ° C. Retirer le surnageant et remettre le culot cellulaire dans 500 pi de HBSS glacé. échantillons de contrainte par maille filtre bouchon de 5 ml à fond rond tube polystyrène FACS et de stocker sur la glace, à l'abri de la lumière, pour FACS immédiats.
5. Identification et isolement des cellules endothéliales et Hemogenic HSPC par FACS
Remarque: Ce protocole a été optimisé à l'aide d'un système BD FACSAria 5 laser équipé d'un 100 mw 355 nm laser UV, 200 mw 405 nm laser Violet, un nm Bleu laser 200 mw 488, un nm laser vert 200 mw 532, et un 150 mw 637 nm Rougelaser. Les cellules ont été triées dans du PBS stérile en tant que fluide de gaine et dans des conditions aseptiques, et à travers une buse de 100 pm avec un débit réglé à une pression de l'échantillon 1 de telle sorte qu'un maximum de 1.500 - 2.000 événements sont acquises par seconde pour minimiser le stress cellulaire.
- Dans ces paramètres décrits ci-dessus, utiliser des tubes de contrôle des couleurs "non colorées" et simples pour optimiser FACS trieuse de cellules intensités laser et effectuer multi-couleurs commande de compensation spectrale selon les instructions du fabricant. Utilisez l'avant et la diffusion latérale pour effectuer des cellules vivantes et doublet discrimination d'événements au total (voir les instructions du fabricant pour plus de détails).
Remarque: Ce protocole se traduit généralement par ~ 70 - 80% de cellules viables. En cas de problème avec une faible viabilité des cellules, veiller à ce que les tissus sont d'abord disséqués rapidement dans la glace médias froid, et que toutes les mesures, sauf celles spécifiant autrement sont effectuées sur la glace, avec pipetage doux pour réduire au minimum le cisaillement et la mort cellulaire(Voir discussion pour plus de détails sur la préservation de la viabilité des cellules). - Utilisez une parcelle différentielle linéaire échelle de Hoechst Red vs. Hoechst Bleu fluorescence pour identifier la population latérale (SP) des événements (Figure 3A). Utilisez le contrôle "Hoechst 33342 seulement + vérapamil" comme témoin négatif pour vérifier que les portes sont bien établis pour l'échantillon. SP apparaît comme une épaule à la gauche des cellules non-SP, et sera diminué dans le contrôle Verapamil traité. La population non-SP sera utilisé pour identifier non-hemogenic CE (figure 3B).
- Créer des parcelles de fluorescence différentielle supplémentaires (axes log-échelle) et d'en tirer les portes de la fille de la SP pour identifier les cellules endothéliales hemogenic (figure 3C-E).
Remarque: les cellules endothéliales Hemogenic sont profilées comme des cellules Flk1 + / cKit + / CD45- SP (Figure 3D), et HSPC sont Flk1- / cKit + / CD45 + cellules SP (Figure 3E). Hemogenic endothéliale caunes peuvent être analysés en parallèle avec les cellules endothéliales non-hemogenic, qui sont identifiés dans cette approche comme CD31 + / CD45- cellules non-SP (figure 3B). - Récupérer cellule hemogenic endothéliale ou fraction HSPC sur méthylcellulose contenant des plaques pour la culture hématopoïétique (voir ci-dessous), ou dans d'autres tampons pour le traitement et l'analyse ultérieure.
6. hématopoïétique Différenciation Culture
- Ajouter 0,5 ml (135 pl / cm2) hématopoïétique milieu de culture à base de méthylcellulose à nombre désiré de puits d'une plaque à 24 puits de culture tissulaire à la température ambiante. Ajouter 0,5 ml d'eau stérile dans des puits non utilisés pour minimiser l'évaporation. Préparer et la maintenir à la température ambiante jusqu'à utilisation.
- Classer 1 - 10 cellules pour l'analyse clonale, ou jusqu'à 1000 cellules endothéliales hemogenic (Flk1 + / cKit + / cellules CD45- SP) ou HSPC (cellules Flk1- / cKit + / CD45 + SP) pour l'expansion en vrac et la différenciation directement dans chaque puits de laplaque contenant de la méthylcellulose. La formation de colonies est détecté dans environ 10 - 20%.
- Dans une hotte de culture de tissus stériles, utiliser une pointe de P1000 avec la pointe taillée pour élargir son alésage, pour remettre en suspension doucement chaque puits des médias méthylcellulose ensemencées 2 - 3 fois, en prenant soin d'éviter la création de bulles. Ceci assure la suspension des cellules triées dans la méthylcellulose semi-solide pour une croissance optimale.
- Laisser incuber la plaque à 37 ° C avec 5% de CO 2 pendant jusqu'à 2 semaines.
- Surveiller les cultures de cellules isolées pour la formation de colonies de cellules hématopoïétiques différenciées au cours du temps (figure 4). Note des puits pour le nombre et le type de colonies hématopoïétiques différenciées aux jours 1, 3, 7, et 14 par la méthode (s) décrit ci-dessous à l'étape 6.7.
- Score plaques le jour 1 pour confirmer et confluence viabilité des cellules triées.
- Au jour 3, vérifier pour la formation précoce des colonies adhérentes de cellules endothéliales hemogenic avec des "pavéston "morphologie (voir Goldie et al. 11 et Marcelo et al. 12 pour la représentation du jour 3 morphologie).
- Par jours 5 - 7, vérifier la formation de grappes HSPC arrondis dans les puits contenant triés CE hemogenic. HSPC doit être observée aplatie adjacente à hemogenic CE affichant un "pavé" la morphologie de la cellule endothéliale.
Nota: Les cellules endothéliales Hemogenic devraient former des colonies hématopoïétiques (déterminé par le nombre de colonies hématopoïétiques) et devraient démontrer la capacité de différenciation de lignées multiples (déterminée par l'observation des types de colonies multiples à partir d'une seule cellule). Nous avons déjà observé que ~ 20% des CE hemogenic ou HSPC récupéré par FACS survivre pour former la différenciation et la prolifération des colonies hématopoïétiques dans la méthylcellulose 11.
- Pour évaluer la formation de colonies par microscopie de phase:
- Visualiser et compter les colonies à faible grossissement under un microscope optique de phase, et d' identifier les BFU-E, CFU-GM et CFU-GEMM colonies par la morphologie des colonies, comme décrit par Goldie et al. 11.
- Pour évaluer la formation de colonies par la morphologie cellulaire:
- Aspirer colonies individuelles de surface méthylcellulose dans une pointe de P1000 avec l'extrémité rognées pour élargir l'alésage. Ceci facilite l'aspiration du milieu visqueux méthylcellulose et assure la récupération réussie de la colonie.
- Resuspendre choisi colonies dans 200 ml de HBSS et de spin sur une lame de verre en utilisant un cytocentrifugeuse à 28 xg pendant 5 min.
- Fixer les lames à 100% de méthanol pendant 5 min (ATTENTION: Le méthanol est toxique et ne doit être utilisé dans une hotte chimique avec ventilation appropriée et de l' équipement de protection individuelle).
- Immerger les lames dans 0,04% de Giemsa pendant 20 min (ATTENTION:. Giemsa contient du méthanol Utiliser dans une hotte chimique avec ventilation et personne appropriéeal de l'équipement de protection).
- Rincer les lames dans de l'eau déminéralisée.
- Mont glisse avec des lamelles, et de l'image à fort grossissement sous un microscope optique standard, en comparant la morphologie des cellules à celle observée classiquement dans les cellules hématopoïétiques de la moelle osseuse adulte qui sont cultivées dans des milieux de méthylcellulose. Pour des exemples, s'il vous plaît voir les instructions du fabricant.
- Pour évaluer la formation de colonies de cellules par l' expression de marqueurs de lignée hématopoïétique par FACS:
- Ajouter 2 ml de HBSS à chaque puits d'une plaque de 24 puits contenant des colonies cultivées sur 0,5 ml de méthylcellulose (ie, diluer le commerce stock disponible méthylcellulose 1: 4). Pipeter haut et en bas pour mélanger, et transfert à tube (s) fraîche.
- échantillon Centrifuger à 2000 xg pendant 5 min à 4 ° C en utilisant une microcentrifugeuse de table standard.
- Retirer le surnageant et le culot (s) de cellules de remettre en suspension dans 1 ml de HBSS +, mise en commun des échantillons, si on le souhaite.
- centrifuéchantillon ge à 2000 xg pendant 5 min à 4 ° C.
- Retirer le surnageant et le culot (s) de cellules de remettre en suspension dans 400 ul HBSS +.
- échantillon aliquote en quatre tubes de 1,5 ml comme suit: non marqué; B220-FITC seul; GR-1-FITC seul; Ter119-FITC seul.
- Ajouter un anticorps conjugué fluorescent au tube approprié à une concentration finale de 2 pg / ml. Incuber à 37 ° C pendant 15 min.
- échantillon Centrifugeuse à 2000 xg pendant 5 min à 4 ° C. Retirer le surnageant et remettre le culot cellulaire dans glacée 0,5 ml de HBSS.
- Analyser chaque échantillon par FACS pour l' expression de chaque marqueur de lignée hématopoïétique: B220 marque cellules B 20; GR-1 marques cellules myéloïdes 21; Ter119 marque cellules érythroïdes 22.
Remarque: des anticorps supplémentaires ciblant d'autres marqueurs de la lignée hématopoïétique peuvent être incorporés dans cette approche, si on le souhaite.
Résultats
Étiquetage réussie des cellules endothéliales hemogenic et HSPC de YS embryonnaires ou AGM donneront FACS scatter parcelles similaires aux parcelles représentatives présentées dans la figure 3. Après cellules vivantes standard et la discrimination doublet par l' avant et la diffusion latérale (non représenté), la population de côté (SP) les événements sont visualisés dans un Hoechst Red vs. Hoechst terrain différentiel Bleu linéaire en l'absence de vérapamil comme un "épaule" gauche décalée de la majorité des (non-SP) événements (Figure 3A). Lorsque la porte de la SP est correctement établi, les cellules SP représenteront environ 1-3% du nombre total de cellules viables et YS 3 - 5% du nombre total d'événements AGM viables. Le traitement de vérapamil devrait aboutir à> 50% d' inhibition des événements SP indépendamment de la source tissulaire (figure 3A, les panneaux supérieurs). Nous avons déjà déterminé que d'autres populations qui apparaissent en dehors de l'épaule de SP, mais sont également bloqués par le vérapamil sont erythr Ter119 positifoblasts, et sont donc exclues de notre population SP 5.
Par rapport à la SP, les cellules non-SP sont identifiées comme étant la grappe dense de cellules adjacentes à la SP "épaulement" (figure 3A). Cette population contient non-Hemogenic CE qui peut être distingué en utilisant un CD31-PE vs CD45-FITC fille parcelle (figure 3B), comme CD31 + / CD45- événements. Non-Hemogenic CE sont généralement 2-5% des cellules non-SP de AGM (figure 3B) ou jaune sac (non représenté), et un nombre élevé de ces cellules peuvent être triés en arrière avec une relative facilité.
Pour l' identification des HSPC et Hemogenic CE, portes filles sont tirées de la fraction de SP, l' identification des cellules CD45 + et CD45-, où cellules CD45 + sont typiquement <20% du nombre total d' événements dans les deux AGM (figure 3C) ou YS (non représenté). Hemogenic CE sont ensuite identifié à partir de cellules CD45- dans un différentiel cKit-APC vs Flk1-PECy7 fille pbeaucoup comme des événements doubles positifs, et représentent généralement 1 à 3% des événements CD45- lorsqu'il est isolé à partir soit AGM (Figure 3 D) ou YS (non représenté). HSPC sont identifiés à partir de la fraction CD45 + dans un cKit-APC séparée vs. Flk1-PECy7 terrain fille comme Flk1- / CKIT + cellules, et aussi représentent généralement environ 25 - 30% de la petite population de cellules CD45 + lorsqu'ils sont obtenus à partir soit YS (non représenté) ou AGM (Figure 3 E). Ainsi, les deux Hemogenic CE et HSPC sont exceptionnellement rares (~ 0,01% des événements cellulaires totaux), et il est typique pour ce protocole pour revenir quelques centaines de chaque type de cellule, même lorsque le tissu à partir de plusieurs embryons sont mis en commun. Portes dans les parcelles filles devraient être établies en référence aux groupes témoins négatifs. Afin de faire la distinction entre coloration spécifique et non spécifique d' anticorps, les portes doivent être initialement établis en référence à la fois les contrôles non marqués (Figure 3C) ainsi que des échantillons qui ont été traités avec (IgG2A IgG2b) ou de contrôle d'isotype apparié par fluorescence conjugué (non représenté). Ce dernier contrôle a montré que la coloration non spécifique est minime par ce protocole, donc pendant que nous recommandons que les anticorps de contrôle isotype (par exemple., IgG2a-PE ou IgG2B-FITC) être initialement utilisés pour optimiser les réglages de trieur FACS et déterminer les limites de grille , nous constatons également que les contrôles sont non colorées suffisant pour vérifier les limites de grille et la qualité expérimentale pendant FACS de routine de tri. Si les portes sont bien dessinés, scatter positif minimal doit être observée dans des portes simples ou doubles-positifs lors de l'enregistrement des contrôles ou non colorés isotype.
Les cellules endothéliales Hemogenic de l'AGA et HSPC subissent une différenciation hématopoïétique plus de 14 jours de culture dans de la méthylcellulose (figure 4A). La proportion relative des types de colonies typiquement observée dans cesles cultures dépendent de la source tissulaire. Les cellules endothéliales Hemogenic isolées à partir de tissus jaune de sac à E8.5-E9.5 donnent lieu à BFU-E, CFU-GM, et peu CFU-GEMM 5, tandis que les cellules endothéliales hemogenic isolées du E10.5 AGM donnent lieu à prédominance CFU -GEMM 12, bien que d' autres lignées sont encore observées, comme le montre la figure 4B (panneau en haut à gauche). HSPC isolé à partir de E10.5 AGM donnent également lieu principalement à CFU-GEMM sur la culture dans de la méthylcellulose (figure 4B, le panneau supérieur du milieu), bien que ces cellules seront également se différencier en d' autres types de colonies hématopoïétiques ainsi. Cellules endothéliales non-hemogenic (CD31 + / CD45- non PS) ont également été plaqué (figure 4B, en haut à droite). Ces cellules montrent pas de croissance hématopoïétique dans la culture au bout de 14 jours.
Les dosages de la capacité hématopoïétique de types cellulaires marqueur de surface individuelles exprimant, y compris des cellules avec et sans expression d'une hématopoïétiquend marqueurs endothéliaux CD31, Flk1, c-Kit, VE-cad, CD41 et CD45 au sein de la fraction de SP de l'AGM à E10.5 ont été effectuées et démontrer que l'activité multi-lignage formant colonie dans le E10.5 AGM est restreint à CD31 +, VE-cadhérine +, c-Kit +, CD41 + et CD45 + SP 12 cellules. Fait intéressant, l'activité des colonies formant a été noté dans les deux cellules Flk-1 + et Flk-1- SP, mais seulement des cellules Flk1 + c-Kit + CD45- SP a donné naissance à des colonies multi-lignée via une monocouche endothéliale intermédiaire caractérisé à la fois par "pavé "morphologie des cellules endothéliales (figure 4B, le panneau en bas à gauche) et par Dil-AcLDL absorption 12. En outre, l' expression de c-Kit est nécessaire pour l' activité hématopoïétique de cellules AGM SP 12.
Bien qu'il ait été montré que certains précurseurs myéloïdes présentent des caractéristiques morphologiques similaires par rapport à des cellules endothéliales hemogenic, les cellules progénitrices myéloïdes expriment CD45 et ne peut pas générer des colonies de lignées multiples in vitro. HSPC génèrent également des colonies multi-lignée, mais bien que ces cellules CD45, ils manquent de Flk-1 expression 12,23 et donner lieu à des amas de cellules arrondies sans monocouche endothéliale sous - jacente (figure 4B, le panneau en bas à droite). Par conséquent, la population nous définissons endothélium hemogenic (ou des cellules Flk-1 + / c-Kit + / CD45-SP) représentent des cellules endothéliales avec hématopoïétiques l'expression du gène potentiel et robuste hematoendothelial, y compris GATA-1/2, LMO2, SCL / Tal-1, Runx-1, c-Kit, CD34, CD41 et CD45 11 qui sont distinctes de cellules souches et progénitrices hématopoïétiques, ainsi que leurs homologues des cellules endothéliales non-hemogenic.
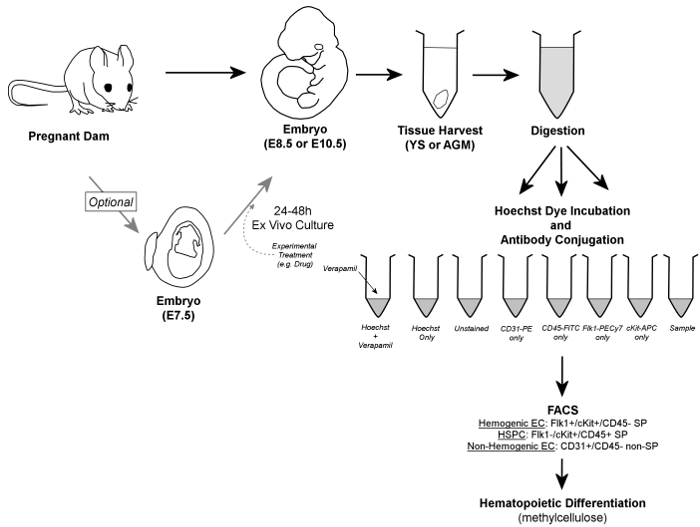
Figure 1. Dans l' ensemble Workflow. En bref, les embryons sont retirés de barrages enceintes, et YS ou tissus AGM sont récoltés. Embryons peuvent éventuellement être cultivées pendant 2 4-48 h ex vivo avant la récolte des tissus. YS ou des tissus prélevés AGM sont digérées à une suspension cellulaire unique, aliquoté dans des tubes de contrôle et de l'échantillon, et on fait incuber en présence de colorant Hoechst et / ou des anticorps conjugués à fluorescence. Verapamil, un inhibiteur du canal calcium, est également utilisé pour générer un contrôle négatif essentiel pour la vérification de déclenchement précis de la fraction SP. les cellules endothéliales Hemogenic sont identifiés par FACS comme Flk1 + / cKit + / CD45- des cellules SP, tandis que HSPC sont contenus dans la fraction Flk1- / cKit + / CD45 + SP de cellules; les deux types de cellules sont triées sur méthylcellulose pour la confirmation d'un potentiel hemogenic. En outre, les cellules endothéliales non-hemogenic peuvent être victimes de discrimination (et récupérés, si on le souhaite) que CD31 + / CD45- cellules non-SP. S'il vous plaît cliquer ici pour voir une version plus grande de cette figure.
igure 2 "src =" / files / ftp_upload / 54150 / 54150fig2.jpg "/>
Figure 2. Dissection de YS et AGM Tissues. A) Le YS est disséquée à partir d' embryons E8.5, et placé tout dans stérile HBSS + pour la suite digestion. B) Le tronc d'embryons E10.5 est isolé en effectuant des coupes horizontales ci - dessous les deux membres antérieurs et postérieurs bourgeons. L'AGA est ensuite séparé des bourgeons des membres et des pinces de tissus en utilisant ventrales. C) images Bright-terrain montrent la dissection des deux YS et AGM à partir d' un embryon E10.5 (échelle = 1 mm). S'il vous plaît cliquer ici pour voir une version plus grande cette figure.
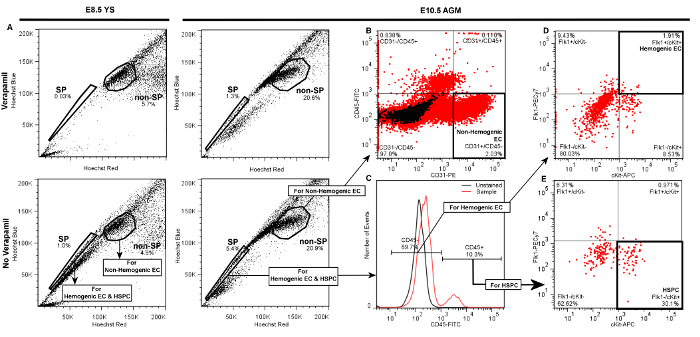
Figure 3. Emplacements représentatifs Démontrant Porte hiérarchie pour discriminationde Hemogenic cellules endothéliales s (Flk1 + / CKIT + / Les cellules CD45- SP), HSPC (Flk1- / CKIT + / Les cellules CD45 + SP), et les cellules endothéliales non-hemogenic (CD31 + / CD45- non-SP) par FACS de E8.5 YS ou E10.5 AGM. Après cellule et doublet discrimination en direct de cellules provenant soit YS (panneaux de gauche) ou AGM (panneaux de droite) par l' avant et la diffusion latérale (non représenté), A) la population latérale (SP) porte est établi et vérifié par une diminution significative de la fraction SP dans le contrôle négatif traité vérapamil. La population non-SP est identifié comme étant le cluster dense de cellules adjacentes à la SP. Dans chacune des parcelles présentées 20.000 événements sont affichés B) , les cellules endothéliales non hemogenic sont identifiées comme étant des cellules CD31 + / CD45- au sein de la fraction non-SP et représentent 2. - 5% de cellules non-SP , qu'ils soient obtenus à partir de AGM (représentés ) ou YS (non représenté). Pour dISCRIMINATE Hemogenic CE ou HSPC, C) portes filles sont tirées de la fraction de SP pour identifier CD45 + et CD45- cellules. D) Pour l' identification des cellules endothéliales hemogenic soit de AGM (illustré) ou YS (non représenté), portes filles supplémentaires sont tirées de la fraction CD45- distinguer CKIT cellules + (vs. cKit-) et Flk1 + (vs. Flk1-). Hemogenic CE soit YS ou AGM sont généralement environ 1 - 3% des événements CD45- E) HSPC sont identifiés à partir de la CD45 + fraction comme cKit + et Flk1-, et représentent généralement 20 -. 30% de CD45 + cellules si triées de AGM (représenté ) ou YS (non représenté). S'il vous plaît cliquer ici pour voir une version plus grande de cette figure.
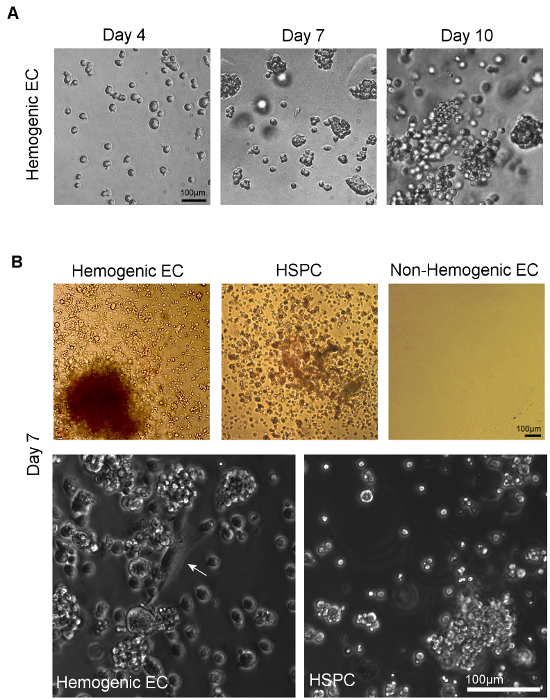
Figure 4 Visualisation de Différenciation Hématopoïétique suivante Culture de Hemogenic cellules endothéliales et HSPC sur méthylcellulose. A) forment des colonies de cellules individuelles triées dans les 7 jours de placage sur méthylcellulose. Multi-lignage potentiel hématopoïétique peut être confirmée par l' observation de plusieurs types de colonies hématopoïétiques, identifié par l' évaluation des morphologies de colonies distinctes 11. B) Phase d'imagerie microscopique trié CE hemogenic et HSPC de AGM (ou YS, non représenté) montrent multi-lignée hématopoïétique la formation de colonies au bout de 7 jours de culture en milieu de culture méthylcellulose. Non-hemogenic CE AGM (ou YS, non représenté) ne démontrent pas la croissance dans ces conditions. A plus fort grossissement, les cellules adhérentes avec la morphologie des cellules endothéliales classique "pavé" (flèche blanche) peut être vu donnant lieu à des amas de cellules hématopoïétiques en cultures de hemogenic CE; pas de telles cellules endothéliales sont observées dans des cultures de tri HSPC (échelle = 100 um). S'il vous plaît cliquer ici pour voir une version plus grande de cette figure.
Discussion
Il reste de nombreuses questions sans réponse dans le domaine du développement hematovascular - un domaine qui est encore à ses débuts en raison des difficultés techniques inhérentes à l'étude des populations cellulaires transitoires et petits qui émergent seulement pendant des périodes de développement spécifiques. Les techniques décrites ci-dessus améliorent beaucoup de ces difficultés en permettant l'isolement des cellules, même simples à partir de la cellule endothéliale hemogenic et populations HSPC dans les tissus embryonnaires à des moments critiques du développement en utilisant des réactifs et du matériel qui sont généralement disponibles dans la plupart des laboratoires. Notre protocole permet également l'isolement parallèle de non-hemogenic fractions de cellules endothéliales de la YS et AGM, qui peuvent être utilisées pour des analyses indépendantes, soit en tant que témoins pour la fraction de cellules endothéliales hemogenic dans les analyses ultérieures.
Un point clé dans l'isolement des cellules endothéliales hemogenic utilisant cette méthode à base de FACS-multicolor est co spectrale appropriéempensation et dessin précis des portes d'une seule couleur. En tant que tel, il est fortement recommandé que les contrôles de couleur simple unstained et être inclus dans tous les essais expérimentaux, et qu'ils - ainsi que des échantillons traités avec des anticorps de contrôle isotype - être utilisé pour établir d'abord une compensation spectrale appropriée et le dessin des portes. Cependant, la coloration non spécifique est minime par ce protocole, donc les contrôles non colorées et une seule couleur sont suffisantes pour la vérification de routine des portes une fois les paramètres de trieur FACS ont été optimisés.
portes SP inexactement tirées sont une préoccupation particulière à l'approche décrite dans le présent rapport. Des études antérieures ont montré que des cellules souches multipotentes présentent efflux préférentielle de Hoechst rouge 17, formant la base physiologique de leur apparition dans le PS par FACS. Nous avons montré que les cellules endothéliales hemogenic et HSPC se trouvent de même au sein de la fraction de cellules SP 5,11. Des médicaments tels que le canal de calciumhibitor vérapamil bloquer ce comportement colorant Hoechst efflux dans des cellules SP par l'intermédiaire d'un blocage d'une variété de transporteurs transmembranaires multirésistantes de résistance. Dans les cellules souches et progénitrices hématopoïétiques, cela se produit principalement par le transporteur ABCG2 / BCRP1 24. Typiquement induit vérapamil> 50% blocage de la SP, cependant, le degré global de Hoechst efflux et son blocage ultérieur par vérapamil vu a été montré pour être affecté par le calendrier de développement, probablement en raison de changer l'expression de types de transporteurs multirésistantes multiple avec différentiel Hoechst la capacité d'efflux, et la sensibilité à Verapamil 5. Ainsi, il est fortement recommandé que le vérapamil-traité Hoechst teinté contrôle négatif être en standard inclus pour assurer gating SP bon: si une porte de SP est bien établi, une réduction notable du nombre de cellules SP doit être détecté dans des échantillons colorés avec Hoechst en la présence de vérapamil.
Nous avons précédemment montré que triéCellules SP du sac E9.5 murin de jaune d'œuf ont ~ 80-90 fois plus grande capacité à générer HSPC dans une culture hématopoïétique à base de méthylcellulose, par rapport à un nombre adapté de E9.5 non fractionnée, non Hoechst colorées des cellules de tissu YS ensemble 5. Une caractérisation plus poussée du PS a montré que dans la vésicule ombilicale de souris pendant hématopoïétique précoce et le développement vasculaire à E8.0, il y a expression appréciable de la VE-cadhérine et Flk-1, mais une faible expression de tige (c-Kit) et des marqueurs hématopoïétiques (CD45). Ainsi, à ce point de temps de développement, primordiale (non hemogenic) CE, définie comme étant Flk-1 + / CD31 + / CD45- des cellules non SP prédominent. Ce profil d'expression des changements que l' expression du marqueur endothélial diminue et CD45 et c-Kit expression augmente, concomitante avec une capacité croissante à générer HSPC in vitro entre E9.5 et E11.5 5. Ceci suggère une activité hématopoïétique de tissu YS est contenu dans le SP, devenant ainsi la plus apparente entre E9.5 et E11.5, et se déclareraitment par une perte temporisée des caractéristiques endothéliales et l'acquisition progressive de la capacité hématopoïétique. En tant que tel, l' expression des transporteurs de multirésistance qui donnent naissance au phénotype SP sont un élément important marqueur phénotypique de l' endothélium hemogenic 5; en fait, les cellules non-SP de l'AGA ne présentent pas de sang potentiel de formation 12. Ainsi, l'isolement réussi de la SP par coloration de Hoechst dans les deux YS et AGA en sorte que les cellules seront triées de hématopoïétique compartiment des cellules souches d'un tissu donné, et après la coloration d'anticorps de cellules au sein de cette fraction permettant la discrimination de l'hemogenic (Flk -1 + / c-kit + / CD45-) versus HSPC (Flk1- / c-kit + / CD45 +) populations 5,11,12. En outre, il a été noté précédemment que CD41 + cellules du SP du sac vitellin et les tissus AGM sont capables de former des colonies de lignées multiples dans de la méthylcellulose culture à base 11,12. Nous définissons les cellules endothéliales hemogenic comme Flk1 + c-Kit + cellules CD45- SPs en utilisant CD45 comme marqueur désigné de la lignée hématopoïétique plutôt que CD41 donné notre constatation que l' expression de Flk1 et CD45 est pratiquement mutuellement exclusifs 5,11. Cela permet à un pur isolement de cellules au sein de la SP qui ont tous deux endothéliale (Flk-1) et la tige caractéristiques (c-Kit) nécessaires à l'endothélium de transition hématopoïétique mais qui n'ont pas encore fait l'objet de ce changement, tel que déterminé par l'absence de CD45 dans ces cellules. Il serait utile d'envisager de sous-fractionnement de la population HSPC, définie comme cellules Flk-1- / c-Kit + / CD45 + / SP, en CSF1R + (de macrophage tissulaire) et Csf1r- (HSC) fraction récemment rapporté par Gomez et ses collègues 25, car cela offrirait une plus grande résolution de la véritable HSPC contre les populations macrophage tissulaire progénitrices, mais cela ne devrait pas affecter l'intégrité de la fraction des cellules endothéliales hemogenic dont l' isolement , nous avons décrit depuis CSF1R est un marqueur de progéniteurs macrophage 26.
Hemogles cellules endothéliales ENIC sont une sous-population rare dans les deux YS et AGM (comprenant: 1 - 3% des cellules endothéliales), et donc un défi majeur dans leur étude est le rendement cellulaire insuffisante pour des applications ultérieures. Ce protocole se traduit généralement par 70-80% des cellules restantes viables au moment du tri, et une sorte de cellule typique hemogenic endothéliales à partir de tissus obtenus à partir de mises en commun plusieurs embryons peut donner seulement quelques centaines de cellules, même dans des conditions optimales avec seulement 10-20% des cellules incorporées dans des colonies produisant de méthylcellulose récupérées. Afin de maximiser le nombre de cellules triées, il est fortement recommandé que les enquêteurs prennent des mesures pour assurer le tissu et la viabilité des cellules à travers toutes les étapes de la procédure: les tissus doivent être disséqués rapidement et mis en commun, et les échantillons doivent être conservés dans la glace chaque fois que possible. Les échantillons doivent être préparées immédiatement avant tri FACS, et triées dans des tubes de collecte contenant le contenu sérique élevé, ou directement dans la culture de la méthylcellulose comme décritd ci-dessus. Si des problèmes de viabilité persistent, les tubes de prélèvement peuvent également être pré-revêtues avec du sérum pour améliorer encore la survie des cellules triées. Si le rendement des cellules endothéliales hemogenic reste faible, de l'os adulte disponibles dans le commerce des perles de fluorophores conjugués moelle osseuse ou peuvent être utilisés pour une compensation spectrale au lieu des commandes de couleur unique dérivées du tissu embryonnaire décrits ici. Si les cellules triées sont destinés à la culture, les cellules endothéliales hemogenic et HSPC doivent être triés directement dans des puits de culture de tissu. Si les cellules triées sont destinées à l'ADN ou le gène analyse de l'expression liée à l'ARN, les cellules endothéliales et non hemogenic hemogenic et HSPC peuvent être triés directement dans les tubes de prélèvement contenant des échantillons de tampon de lyse pour réduire la perte cellulaire.
La technique décrite permet de succès (et simultanée) l'isolement des cellules endothéliales et non hemogenic hemogenic, ainsi que HSPC et de cellules sanguines matures à partir des mêmes fractions des tissus embryonnaires. Cette approche permet en outre study des fondements moléculaires des transitions critiques qui se produisent comme les cellules endothéliales produisent du sang. Enseignements tirés de ces études sur le développement peuvent ensuite être utilisées pour optimiser la génération de cellules endothéliales humaines et de HSPC hemogenic descendance de pluripotentes et potentiellement autologue, des cellules souches pour le traitement des troubles hématopoïétiques courants.
Déclarations de divulgation
Ce travail a été soutenu byNIH subventions HL128064, HL096360, EB017103 et CT Innovations accordent 15 RMB-YALE-04, à KKH, et NICHD / NIH T32HD007094.
Remerciements
Les auteurs déclarent qu'ils ont aucun intérêt financier concurrents.
matériels
| Name | Company | Catalog Number | Comments |
| DAPT (N-[N-(3,5-Difluorophenacetyl)-L-alanyl]-S-phenylglycine t-butyl ester) | Sigma | D5942 | TOXIC irritant: Wear eye protection, mask, and gloves when handling. |
| Absorbent bench underpad | Covidien | 7134 | |
| #5 Straight Forceps | Fine Science Tools | 11251-20 | |
| 8.5 cm straight scissors | Fine Science Tools | 14090-09 | |
| Isoflurane (Isothesia) | Henry Schein | 50033 | TOXIC inhalant: Use in fume hood. |
| 100x Penicillin Streptomycin Glutamine (10,000 U/ml Penicillin, 10,000 mg/ml Streptomycin, 29.2 mg/ml L-glutamine) | Invitrogen | 10378016 | |
| Type II Collagenase | Worthington | LS004174 | |
| Falcon 70 μM nylon cell strainer | Corning | CLS431751 | |
| Anti-Mouse CD45-FITC | eBioscience | 11-0451-81 | |
| Anti-Mouse CD31 - PE | eBioscience | 12-0311-81 | |
| Anti-Mouse Flk-1 PE-Cy7 | BD Pharmingen | 561259 | |
| Hoechst 33342 (bisBenzimide H 33342 trihydrochloride) | Sigma | 14533 | TOXIC: irritant. Wear eye protection and gloves when handling. Prepare stock solution of 25 mg/ml in distilled H2O, store aliquots at -20 °C until ready for use. |
| Verapamil Hydrochloride | Sigma | 1711202 | TOXIC: irritant. Wear eye protection, mask, and gloves when handling. Prepare stock solution of 5 mM (100x) in 95% ethanol. Store at -20 °C until ready for use |
| Falcon 5 ml Round Bottom Polystyrene Test Tube, with Cell Strainer Snap Cap | Corning | 352235 | |
| MethoCult GF M3434 | Stem Cell Technologies | 3434 | Thaw and aliquot per manufacturer's instructions |
| Modified Giemsa Stain | Sigma | GS500 | TOXIC: Contains Methanol - use in fume hood and wear gloves with handling. Dilute in distilled water to 0.02% solution. |
| Cytospin Centrifuge | Thermo Scientific | A78300003 | |
| Clipped Funnel Starter Kit | Thermo Scientific | 3120110 | Includes cytofunnels, filter paper, cytoslides, and cytoclips for use with Cytospin centrifuge |
| Anti-Mouse B-220 - FITC | BD Pharmingen | 553088 | |
| Anti-Mouse Gr-1-FITC | eBioscience | 11-5931-85 | |
| Anti-Mouse Ter-119-FITC | eBioscience | 11-5921-85 | |
| Gibco Fetal Bovine Serum | Thermo Scientific | 10437-077 | |
| Dulbecco's Modified Eagle Medium (4.5 g/L) | Life Technologies | 11965-092 | |
| Hank's Buffered Salt Solution | Life Technologies | 14175-095 | |
| Fibronectin-coated 24-well tissue culture plate | EMD Millipore | PIFB24P05 | |
| IgG2A-PE | BD Pharmingen | 553930 | |
| IgG2B-FITC | BD Pharmingen | 556923 |
Références
- Hirschi, K. K. Hemogenic endothelium during development and beyond. Blood. 119 (21), 4823-4827 (2012).
- Boisset, J. C., et al. et al. In vivo imaging of haematopoietic cells emerging from the mouse aortic endothelium. Nature. 464 (7285), 116-120 (2010).
- Bertrand, J. Y., et al. Haematopoietic stem cells derive directly from aortic endothelium during development. Nature. 464 (7285), 108-111 (2010).
- Kissa, K., Herbomel, P. Blood stem cells emerge from aortic endothelium by a novel type of cell transition. Nature. 464 (7285), 112-115 (2010).
- Nadin, B. M., Goodell, M. A., Hirschi, K. K. Phenotype and hematopoietic potential of side population cells throughout embryonic development. Blood. 102 (7), 2436-2443 (2003).
- Nakano, H., et al. Haemogenic endocardium contributes to transient definitive haematopoiesis. Nat Commun. 4, 1564 (2013).
- Li, Z., et al. Mouse embryonic head as a site for hematopoietic stem cell development. Cell Stem Cell. 11 (5), 663-675 (2012).
- Medvinsky, A., Dzierzak, E. Definitive hematopoiesis is autonomously initiated by the AGM region. Cell. 86 (6), 897-906 (1996).
- Palis, J., Robertson, S., Kennedy, M., Wall, C., Keller, G. Development of erythroid and myeloid progenitors in the yolk sac and embryo proper of the mouse. Development. 126 (22), 5073-5084 (1999).
- de Bruijn, M. F., Speck, N. A., Peeters, M. C., Dzierzak, E. Definitive hematopoietic stem cells first develop within the major arterial regions of the mouse embryo. Embo J. 19 (11), 2465-2474 (2000).
- Goldie, L. C., Lucitti, J. L., Dickinson, M. E., Hirschi, K. K. Cell signaling directing the formation and function of hemogenic endothelium during murine embryogenesis. Blood. 112 (8), 3194-3204 (2008).
- Marcelo, K. L., et al. Hemogenic endothelial cell specification requires c-Kit, Notch signaling, and p27-mediated cell-cycle control. Dev Cell. 27 (5), 504-515 (2013).
- Tavian, M., et al. Aorta-associated CD34+ hematopoietic cells in the early human embryo. Blood. 87 (1), 67-72 (1996).
- Wang, L., et al. Endothelial and hematopoietic cell fate of human embryonic stem cells originates from primitive endothelium with hemangioblastic properties. Immunity. 21 (1), 31-41 (2004).
- Kelly, M. A., Hirschi, K. K. Signaling Hierarchy Regulating Human Endothelial Cell Development. Arterioscler Thromb Vasc Biol. 29 (5), 718-724 (2009).
- Kennedy, M., et al. T lymphocyte potential marks the emergence of definitive hematopoietic progenitors in human pluripotent stem cell differentiation cultures. Cell Rep. 2 (6), 1722-1735 (2012).
- Goodell, M. A., Brose, K., Paradis, G., Conner, A. S., Mulligan, R. C. Isolation and functional properties of murine hematopoietic stem cells that are replicating in vivo. J Exp Med. 183 (4), 1797-1806 (1996).
- Takahashi, M., Osumi, N. The method of rodent whole embryo culture using the rotator-type bottle culture system. J Vis Exp. (42), (2010).
- Bohnsack, B. L., Lai, L., Dolle, P., Hirschi, K. K. Signaling hierarchy downstream of retinoic acid that independently regulates vascular remodeling and endothelial cell proliferation. Genes Dev. 18 (11), 1345-1358 (2004).
- Coffman, R. L., Weissman, I. L. B220: a B cell-specific member of the T200 glycoprotein family. Nature. 289 (5799), 681-683 (1981).
- Fleming, T. J., Fleming, M. L., Malek, T. R. Selective expression of Ly-6G on myeloid lineage cells in mouse bone marrow. RB6-8C5 mAb to granulocyte-differentiation antigen (Gr-1) detects members of the Ly-6 family. J Immunol. 151 (5), 2399-2408 (1993).
- Kina, T., et al. The monoclonal antibody TER-119 recognizes a molecule associated with glycophorin A and specifically marks the late stages of murine erythroid lineage. British Journal of Haematology. 109 (2), 280-287 (2000).
- Jackson, K. A., et al. Regeneration of ischemic cardiac muscle and vascular endothelium by adult stem cells. J Clin Invest. 107 (11), 1395-1402 (2001).
- Scharenberg, C. W., Harkey, M. A., Torok-Storb, B. The ABCG2 transporter is an efficient Hoechst 33342 efflux pump and is preferentially expressed by immature human hematopoietic progenitors. Blood. 99 (2), 507-512 (2002).
- Gomez Perdiguero, ., E, , et al. Tissue-resident macrophages originate from yolk-sac-derived erythro-myeloid progenitors. Nature. 518 (7540), 547-551 (2015).
- Murray, P. J., Wynn, T. A. Protective and pathogenic functions of macrophage subsets. Nat Rev Immunol. 11 (11), 723-737 (2011).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon