需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
对急性和亚急性鼠下肢缺血的方法
摘要
Surgical induction of hindlimb ischemia in the mouse is useful to examine angiogenesis, however this is compromised in certain inbred mouse strains that display marked ischemia-induced tissue necrosis. Methods are described to induce subacute limb ischemia using ameroid constrictors to circumvent this problem through the induction of gradual arterial occlusion.
摘要
外周动脉疾病(PAD)是心血管发病率和在发达国家死亡率,和动物模型可靠地再现人类疾病是需要开发新的治疗这种疾病的一个主要原因。小鼠后肢缺血模型已广泛用于这一目的,但通过股动脉结扎诱导急性肢体缺血的标准做法可能会导致大量的组织坏死,损害研究者的研究血管和骨骼肌组织反应缺血能力。另一种方法,以股动脉结扎是渐进的股动脉闭塞,通过使用AMEROID蟒蛇的诱导。当在如股动脉结扎的位点相同或不同的位置周围放置股动脉,这些装置阻塞动脉用1 - 3天,导致更渐进的,亚急性缺血。这导致更少实质性骨骼肌组织坏死,WHICH可能更接近地模拟人类的PAD看到的响应。由于遗传背景的影响在这两个急性和亚急性缺血模型成果,考虑到小鼠品系正在研究是选择最好的模型非常重要的。本文介绍了适当的程序和鼠标股动脉结扎或AMEROID蟒蛇解剖位置,以引起亚急性或急性下肢缺血的鼠标。
引言
外周动脉疾病(PAD)是心血管发病率和死亡率在发达国家1的主要原因。 PAD结果从外周动脉,导致肢体缺血与产生劳累或休息痛,偶尔不愈合使得需要截肢溃疡和坏疽的动脉粥样硬化阻塞。针对PAD疗法涉及主要针对血管内2或血管重建手术3,本质上是没有有效的药物治疗存在4。
不幸的是,血管重建术往往有限的好处是,由于旁路移植具有高失败率(可达50%5年内)5,其在某些人群( 如吸烟者,妇女,非隐静脉移植)6,7-更糟。血管内的方法,如血管成形术和支架置入术,也被高再狭窄率受到影响(超过50%,1年内),我格外ñ股腘疾病8,虽然使用药物洗脱球囊和支架有所提高9-11的结果。为了开发新的治疗的PAD它是开发的动物模型能可靠地再现人类疾病至关重要。
迄今为止,PAD的最常见的模式是后肢缺血模型(HLI),其在小鼠中12,13最常进行的。在其最常见的表现,该模型引起该近端和远端股骨动脉的手术结扎并随后在容器的切除其居间侧分支,从而导致血流和急性肢体缺血诱导的闭塞。 HLI已主要用来研究在周肢体肌肉组织中的血管生成和动脉生成反应和各种疗法( 例如 ,药物,基因递送,干细胞)对这些反应的影响。最近,我们的团队已经用这个模型来研究骨骼肌细胞的作用,我n个回应肢体缺血和对结果的14遗传差异的影响。
该HLI模型促进了我们目前的理解是,血管和肌肉响应缺血取决于遗传学( 即 ,近交系)15,16岁,及其它疾病或相关的动脉粥样硬化的条件,包括糖尿病17和存在或不存在高胆固醇血症18。然而,传统的挡拆模型的一个重要的弱点是,它是急性肢体缺血12,13的典范,而人PAD引起慢性缺血作为外周动脉闭塞性动脉粥样硬化的逐步发展的结果。
在试图绕过这个弱点,唐和他的同事最初开发利用AMEROID蟒蛇逐渐19股动脉闭塞的大鼠模型,同组随后ðeveloped类似的小鼠模型20。 AMEROID蟒蛇是在慢性心肌缺血21,22的犬最初描述20世纪50年代。这些设备有一个外金属套包围吸湿材料的内层,通常是酪蛋白,并且当周围放置一个动脉它们诱导逐渐血管闭塞,因为它们吸收来自周围组织的水分。在他们的模型中的修饰,Yang等放置在近端和在类似于手术结扎网站的网站远侧股动脉都蟒蛇,和它们连接的股动脉的侧分支,如在传统模式。相比急性HLI,AMEROID缩诱导缺血导致炎症和剪切应力依赖性的基因的低表达,降低血流量恢复4 -第5周后,可操作地,少肌坏死20。根据这些意见,有人认为,渐进的动脉闭塞可能提供P的模型广告更贴近人类疾病。
值得注意的是,在原有的报告中,只在C57BL / 6小鼠19,这是对缺血诱导的肌肉坏死15相对耐审查AMEROID缩引起缺血的效果。我们最近修改的逐渐缺血模型进一步探索和其在缺血更为敏感的BALB / c小鼠品系23的效果。在该模型的第一表现,我们放置在近端和股骨远端动脉既蟒蛇但留下的所有侧分支完好。在第二,较温和的变形例中,我们只放在近端股动脉单缩并再次左动脉的所有侧设有分公司完好无损。在该模型中的两个变型,我们发现,BALB / c小鼠,但不C57BL / 6小鼠,尽管具有相似的血流和血管密度显示显著肌肉坏死。类似我们以前的研究14,这些研究结果表明,肢体肌肉伤不仅仅由血流的影响,但是部分取决于遗传背景。此外,我们发现,肢体血流3天之内下降到最低点,因此该模型似乎更'亚急性',而不是渐进的肢体缺血之一。
根据这些以前的研究,似乎明显,用于诱导后肢缺血一个单一的方法可能不适合于所有情况。因为各种条件( 例如 ,遗传差异和存在或不存在的共同病态条件)影响既血管和骨骼肌肉特异性反应,调查可能发现需要修改慢性和/或后肢缺血的最好的严重性适合自己的目的。此外,该模型的现有描述通常缺乏合适的解剖学界标,以促进技术的可靠-研究者间重现性。在本文中,在小鼠诱导的急性或亚急性下肢缺血的方法被描述,并提供精确的解剖标志。
研究方案
所有动物实验根据由杜克机构动物护理和使用委员会批准的方案进行。作为研究的科学目的指示在这项研究中雄性小鼠使用,虽然任一性别可以使用。
1.脱毛
- 前麻醉诱导,建立由设定在37℃的覆盖加热垫和连接到异氟醚的连续流鼻锥口的手术前准备区。
- 放置在麻醉诱导室鼠标。将O 2流量计1升/分和异氟醚设置为1 - 3%。
注:麻醉通常诱导将25g小鼠用2%异氟醚。 - 检查轻摇室和观察缺乏翻正反射鼠标的刺激反应。
- 同花顺O 2室以清除在打开之前的异氟醚。迅速将鼠标移动到加热p广告并通过鼻锥连接到异氟醚。
- 调节异氟烷1.5%。检查由踏板反射(趾捏)刺激反应。
- 宽松应用眼科润滑剂双眼,以避免手术过程中干燥。
- 刮胡子使用小型电动微调从两个后肢的头发。保持剃须时避免划破皮肤绷紧皮肤。
- 应用预热的脱毛膏,让坐1分钟。轻轻擦去用湿纱布垫。
- 对于以后的外科手术,关闭异氟醚和鼠标移动到空纸巾内衬回收笼,保证了鼠标不吸笼床上用品。监测动物,直到它能够保持胸骨斜卧。否则,将鼠标移动到手术台。
注:脱毛过程会刺激皮肤,影响灌注测量。建议等待1 - P前去除动物的毛发后第2天erforming预外科灌注扫描或执行手术。
2.术前准备
- 在此过程中使用以下工具;小直手术剪,2细尖钳成角,小镊子格雷夫,针驱动镊子,拉钩3,小弹簧剪刀和细尖的棉签。
- 用消毒手术前的启动高压釜的所有工具。之前和每个外科手术过程之间使用热珠灭菌,最多5只动物。对于大于5组手术消毒额外的手术工具包。
- 准备一个无菌手术领域包括盖加热垫和异氟醚端口。 10立体声解剖显微镜下完成所有的工作。
- 麻醉和步骤1.1〜1.5的介绍准备鼠标。
- 检查鼠标完全镇静并放入上手术台仰卧位置。安全使用医用胶带双腿。
- 如果使用温度控制的加热垫,附加温度探针和将它固定到用外科胶带,以确保它不会意外在手术过程中拔出外科平台的基础。
- 清洁用3交替碘伏和酒精擦拭切口部位。用无菌手术单动物切一个洞,露出切口部位。
3.肢体缺血诱导
- 使用手术刀进行初始切口沿着大腿内侧的中心,从朝腹部膝盖运行,并且延长切口约1cm细剪刀( 图1A)。
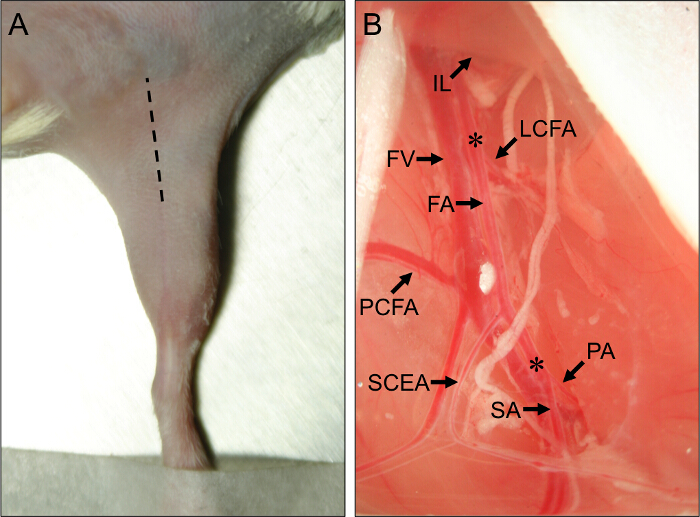
图1.手术部位及血管解剖标志的鼠标后肢缺血手术。(A)的外观图鼠标在仰卧位后肢。的阴影线表示切口部位适当地进行下肢缺血的程序。(B)近端鼠标后肢血管观。股动脉(FA)的近端源于腹股沟韧带(IL)的下方。在FA的前端位于其分叉成腘动脉(PA)和隐动脉(SA)。主要的侧支动脉关闭的FA是旋股外侧动脉(LCFA),近侧尾股动脉(PCFA)和浅尾腹壁动脉(SCEA)。股静脉(FV)运行邻近于FA,和静脉分支可以看出平行于主动脉分支。星号(*)表示用于AMEROID蟒蛇或结扎的放置的近端和远端站点,这取决于亚急性或急性缺血是否会被诱导。 请CLI这里完蛋查看此图的放大版本。
- 使用镊子,打开切口暴露覆盖腹股沟脂肪组织(IFT)膜。
- 使用封闭镊子,刺穿膜进入IFT和腹部之间的分离。轻轻松开钳压向IFT从腹部肌肉分开,露出下面的神经血管束。观察近端和肤浅的尾鳍分支作为重要解剖标志( 图1B)。
- 插入的牵开器和近侧拉动腹部组织以暴露近端AMEROID缩或结扎部位,只是近端旋股外侧动脉( 图1B)。横向回旋支位于约5毫米近端近端和肤浅的尾动脉。
- 插入两个更多牵开器插入切口的远端部分,一是内侧和一个横向,拉IFT从远侧远手术部位扩大手术视野。
- 用两个细钳去除最外面的覆盖膜神经血管束。轻轻地插入静脉和动脉之间的细镊子尖的一半,结合在一起的膜下滑动钳尖。关闭镊子轻轻撕掉膜。
- 插入静脉和动脉之间的闭合钳子的前端,并通过在钳子释放压力创建它们之间的间隙。重复此技术来创建动脉和神经之间的间隙。
- 亚急性肢体缺血,放置在近端股动脉( 图2)的AMEROID缩。
- 安装近侧AMEROID缩,股动脉下滑动的钳子的前端,使其与神经血管束隔离。使用第二组angled-镊子夹住缩的边缘和引导它股动脉之下。
- 莱股动脉成S很多大蟒。重复远侧缩,它定位立即近端股动脉的分岔进腘动脉和隐动脉( 图2)。
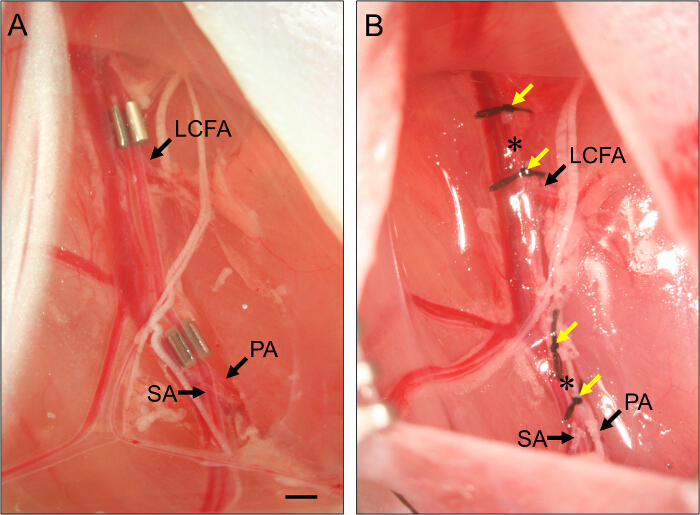
图2.放置AMEROID蟒蛇和连字。(A)放置在股动脉引起亚急性下肢缺血2 AMEROID蟒蛇的例子。近侧缩放置只是近端旋股外侧动脉(长链脂肪酸)。远端缩放置刚好接近腘(PA)和隐动脉(SA)的分支。蟒蛇中装朝上,以保证动脉槽被适当缩内。(B)的股动脉结扎的实施例,以诱发急性后肢缺血。 LigaturES(黄色箭头)被放置成使得它们侧翼蟒蛇在面板(B)中的位置,并在股动脉被各组两个连字(星号)之间切断。酒吧,1毫米。 请点击此处查看该图的放大版本。
- 对于急性肢体缺血,结扎和横切股骨近端动脉。
- 向横切股动脉,螺纹7 - 动脉刚好接近近侧缩的位置的输入输出缝合(参照步骤3.7)和结扎。扎约1mm远离第一第二结扎。
- 用弹簧剪刀横切两间结扎动脉。对于远端动脉横断,重复这些步骤,将1毫米左右2连字拆开,只是近端股动脉分叉处到腘动脉和隐动脉,但要确保他们远离肤浅caud人腹壁下动脉( 见图1)
- 关闭切口用中断5 - Ø薇乔缝线。
4.灌注成像
- 将鼠标移动到设定的激光多普勒血流灌注成像仪(LDPI)下37℃加热垫,并通过鼻锥连接到异氟醚源。如果没有温度显示器可用,允许5分钟的鼠标温热至37℃。
- 打开相机并启动图像捕捉软件。
- 点击"新建单幅图像"图标,打开"扫描仪设置"窗口。将"扫描尺寸"到"大"和"扫描速度"到"4毫秒/像素"。由"扫描区域(单位)"窗格下改变x和y值设定扫描区域。
- 点击"视频和距离"选项卡,查看视频输入信号,并安排鼠标适合红框所示的扫描区域。点击"自动距离"校准从激光到对象的距离。点击"下一步",打开"主题详细信息"窗口。
- 输入主题信息和任何相关评论。点击"下一步"按钮以进入扫描窗口。
- 点击"开始测试"按钮,打开"确认或重写扫描距离"对话框。点击'确定'以确认扫描距离。观察扫描过程开始并运行4 - 根据扫描区的大小8分钟。
- 扫描完成后,观察"另存为"窗口。为文件命名并保存。
- 关闭异氟醚和鼠标移动到一个空笼子的恢复和监控,直到动物能够保持胸骨斜卧。切勿将鼠标从麻醉恢复与其他老鼠的笼子。
- 打开的图像分析软件。点击"打开"图标,浏览和打开图像文件进行分析。在文件窗口,观察流量,鼠标的照片,和彩色图像。
- 为了纪念通量图像感兴趣区域(ROI)的区域,单击"显示投资回报率"图标。接下来,单击"添加多边形"按钮,拖动光标周围的非手术肢体得出投资回报率。右键单击关闭的形状。再次选择"添加多边形"周围画了手术肢体匹配的投资回报率。
- 点击"统计信息"图标,打开"图像的ROI统计结果(PU)"窗口。注意在"流量%"列在不断变化的百分比差异。
注意:画将作为参考的第一个投资回报率。
注:为每个后续灌注扫描之前按照第1节概述麻醉鼠标的步骤和步骤4.1至4.11图像动物。
结果
鼠标后肢血管的正确识别是确保的技术重现诱导两种亚急性和急性下肢缺血,如这里所描述的关键。除了 在动物研究中所固有的变型中,其他因素可以在激光多普勒灌注成像(LDPI)引入可变性,包括麻醉的类型,(俯卧仰卧对 )的动物的位置,和体温( 见图3)。此外,亚急性后肢缺血模型依赖于AMEROID蟒蛇,它可以在给定批次内广泛地变化的质?...
讨论
或许在此过程中的最具挑战性的步骤是从股静脉股动脉的分离。的较大直径和相比,这些动脉的股静脉的壁更薄提高其敏感性穿刺和手术操作过程中撕裂。可以通过使用用PBS浸湿的无菌拭子保持伤口湿润减少破坏静脉的可能性。同样重要的是,以确保所有的钳子削尖,对齐,并且为了使血管和周围组织的精确操纵自由断裂。在该出血确实发生的情况下,直到出血停止施加压力的区域用无菌纱布。?...
披露声明
The authors have no conflicts of interest to disclose.
致谢
This study was supported by NIH grants R21HL118661, R56HL124444, and R01HL124444 to CDK, and by NIH grants R00HL103797 and R01HL125695 to JMM.
材料
| Name | Company | Catalog Number | Comments |
| Dumont #5/45 Forceps | Fine Science Tools | 11251-35 | Dumoxel |
| Dumont Style 5 Mini Forceps | Fine Science Tools | 11200-14 | Inox |
| Extra Fine Bonn Scissors | Fine Science Tools | 14084-08 | |
| 7 - 0 Silk Suture | Sharpoint | DA-2527N | |
| 5 - 0 Coated Vicryl Suture | Ethicon | J463G | |
| Graefe Forceps | Fine Science Tools | 11053-10 | |
| Vannas Spring Scissors | Fine Science Tools | 15000-03 | |
| Artifical Tears Ointment | Rugby Laboratories | 0536-6550-91 | |
| Surgical Tape | 3M | 1530-0 | |
| Fine Cotton Swabs | Contec | SC-4 | |
| Temperature Controller | Physitemp | TCAT-2DF | |
| Ameroid Constrictors | Research Instruments SW | MMC-0.25 x 1.00-SS | |
| Hot Bead Sterilizer | |||
| Deltaphase Isothermal Pad | Braintree Scientific | 39DP | |
| Needle Driver | Fine Science Tools | ||
| Phosphate Buffered Saline | Gibco | 10010-023 | |
| Moor LDPI | Moor Instruments | moorLDI2 | |
| moorLDI Measurement software | Moor Instruments | v. 6.0 | |
| Hair Removal Cream | Nair |
参考文献
- Criqui, M. H., Aboyans, V. Epidemiology of peripheral artery disease. Circ. Res. 116, 1509-1526 (2015).
- Thukkani, A. K., Kinlay, S. Endovascular intervention for peripheral artery disease. Circ. Res. 116, 1599-1613 (2015).
- Vartanian, S. M., Conte, M. S. Surgical intervention for peripheral arterial disease. Circ. Res. 116, 1614-1628 (2015).
- Bonaca, M. P., Creager, M. A. Pharmacological treatment and current management of peripheral artery disease. Circ. Res. 116, 1579-1598 (2015).
- Conte, M. S., et al. Design and rationale of the PREVENT III clinical trial: edifoligide for the prevention of infrainguinal vein graft failure. Vasc Endovascular Surg. 39, 15-23 (2005).
- Pomposelli, F. B., et al. A decade of experience with dorsalis pedis artery bypass: analysis of outcome in more than 1000 cases. J. Vasc. Surg. 37, 307-315 (2003).
- Willigendael, E. M., et al. Smoking and the patency of lower extremity bypass grafts: a meta-analysis. J. Vasc. Surg. 42, 67-74 (2005).
- Schillinger, M., et al. Balloon angioplasty versus implantation of nitinol stents in the superficial femoral artery. N. Engl. J. Med. 354, 1879-1888 (2006).
- Marmagkiolis, K., et al. 12-month primary patency rates of contemporary endovascular device therapy for femoro-popliteal occlusive disease in 6,024 patients: beyond balloon angioplasty. Catheter. Cardiovasc. Interv. 84, 555-564 (2014).
- Rosenfield, K., et al. Trial of a Paclitaxel-Coated Balloon for Femoropopliteal Artery Disease. N. Engl. J. Med. 373, 145-153 (2015).
- Tepe, G., et al. Drug-coated balloon versus standard percutaneous transluminal angioplasty for the treatment of superficial femoral and popliteal peripheral artery disease: 12-month results from the IN.PACT SFA randomized trial. Circulation. 131, 495-502 (2015).
- Couffinhal, T., et al. Mouse model of angiogenesis. Am. J. Pathol. 152, 1667-1679 (1998).
- Niiyama, H., Huang, N. F., Rollins, M. D., Cooke, J. P. Murine model of hindlimb ischemia. J Vis Exp. , (2009).
- McClung, J. M., et al. Skeletal muscle-specific genetic determinants contribute to the differential strain-dependent effects of hindlimb ischemia in mice. Am. J. Pathol. 180, 2156-2169 (2012).
- Dokun, A. O., et al. A quantitative trait locus (LSq-1) on mouse chromosome 7 is linked to the absence of tissue loss after surgical hindlimb ischemia. Circulation. 117, 1207-1215 (2008).
- Rivard, A., et al. Age-dependent impairment of angiogenesis. Circulation. 99, 111-120 (1999).
- Hazarika, S., et al. Impaired angiogenesis after hindlimb ischemia in type 2 diabetes mellitus: differential regulation of vascular endothelial growth factor receptor 1 and soluble vascular endothelial growth factor receptor 1. Circ. Res. 101, 948-956 (2007).
- Couffinhal, T., et al. Impaired collateral vessel development associated with reduced expression of vascular endothelial growth factor in ApoE-/- mice. Circulation. 99, 3188-3198 (1999).
- Tang, G. L., Chang, D. S., Sarkar, R., Wang, R., Messina, L. M. The effect of gradual or acute arterial occlusion on skeletal muscle blood flow, arteriogenesis, and inflammation in rat hindlimb ischemia. J. Vasc. Surg. 41, 312-320 (2005).
- Yang, Y., et al. Cellular and molecular mechanism regulating blood flow recovery in acute versus gradual femoral artery occlusion are distinct in the mouse. J. Vasc. Surg. 48, 1546-1558 (2008).
- Litvak, J., Siderides, L. E., Vineberg, A. M. The experimental production of coronary artery insufficiency and occlusion. Am. Heart J. 53, 505-518 (1957).
- Bredee, J. J. An improved ameroid constrictor. Preliminary communication. J. Surg. Res. 9, 107-112 (1969).
- McClung, J. M., et al. Subacute limb ischemia induces skeletal muscle injury in genetically susceptible mice independent of vascular density. J. Vasc. Surg. , (2015).
- Hellingman, A. A., et al. Variations in surgical procedures for hind limb ischaemia mouse models result in differences in collateral formation. Eur. J. Vasc. Endovasc. Surg. 40, 796-803 (2010).
- Kochi, T., et al. Characterization of the arterial anatomy of the murine hindlimb: functional role in the design and understanding of ischemia models. PloS one. 8, e84047 (2013).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。