JoVE 비디오를 활용하시려면 도서관을 통한 기관 구독이 필요합니다. 전체 비디오를 보시려면 로그인하거나 무료 트라이얼을 시작하세요.
Method Article
급성 및 아 급성 쥐 뒷다리 국소 빈혈하는 방법
요약
Surgical induction of hindlimb ischemia in the mouse is useful to examine angiogenesis, however this is compromised in certain inbred mouse strains that display marked ischemia-induced tissue necrosis. Methods are described to induce subacute limb ischemia using ameroid constrictors to circumvent this problem through the induction of gradual arterial occlusion.
초록
말초 동맥 질환 (PAD)는 신뢰성이 질병에 대한 새로운 치료 개발에 필요한 인간 질병을 재현 심혈관 질병률과 사망률 선진국 및 동물 모델의 주요 원인이다. 마우스 뒷다리 허혈 모델은 광범위 이러한 목적을 위해 사용 되었으나, 대퇴 동맥 결찰에 의해 급성 사지 허혈을 유도하는 표준 방법은 허혈, 혈관 및 골격 근육 조직 반응을 연구하는 연구자의 능력을 손상 실질적인 조직 괴사 될 수 . 대퇴부 동맥 결찰 다른 방법은 아메 로이드 constrictors의 사용을 통해 점진적 대퇴 동맥 폐쇄의 유도이다. 완만, 급성 허혈 결과, 3 일 - 대퇴 동맥 결찰의 위치와 동일하거나 상이한 위치에서 대퇴 동맥 주위에 배치 될 경우,이 장치는 하나 이상 동맥 폐색. 이 w는, 이하 실질적인 골격근 조직 괴사를 초래HICH 더 밀접하게, 인간에서 본 PAD 응답을 모방 할 수있다. 유전 적 배경에 영향 모두 급성 및 아 급성 허혈 모델에서 성과 때문에 마우스 균주 고려 최상의 모델을 선택하는 중요한 연구되고있다. 이 논문은 마우스에서 아 급성 또는 급성 사지 허혈을 유도하는 적절한 절차와 마우스 대퇴 동맥에 합자 또는 아메 로이드 constrictors의 해부학 적 위치를 설명합니다.
서문
주변 동맥 질환 (PAD)은 선진국 (1) 심혈 관계 이환율과 사망률의 주요 원인이다. 결과 운동시 또는 휴식 고통과 때때로 사지 절단을 필요로 궤양과 괴저 비 치료와 사지 허혈에 이르게 주변 동맥의 동맥 경화 방해에서 PAD 결과. 기본적으로 효과적인 의료 치료 4 존재하지 않기 때문에 PAD를 대상으로 치료는 주로 혈관이 또는 외과 적 재관류 3으로 연결됩니다.
바이 패스 이식 일부 집단 (예를 들어, 흡연자, 여성, 비 복재 정맥 이식편) 6,7에 더 나쁘다 5 (5 년 이내 50 %까지) 높은 실패율이 불행하게도, 재관류 술은 종종 제한된 혜택입니다. 이러한 혈관 성형술 및 스텐트 삽입술과 같은 혈관 접근 방법은,도 (1 년 이내 50 % 초과) 높은 재 협착 비율에 의해 손상되어, 내가 서 특히약물 방출 풍선과 스텐트의 사용이 다소 9-11 성과를 개선했지만, N, 질병 8 대퇴 슬와. PAD 새로운 치료제를 개발하기 위해서는 확실하게 인간의 질병을 재현 동물 모델을 개발하는 것이 필수적이다.
현재까지, PAD의 가장 일반적인 모델 자주 마우스 (12, 13)에서 수행되는 사지 허혈 모델 (HLI)이다. 가장 흔한 증상에서, 모델은 근위 및 원위 대퇴 동맥 수술 결찰을 수반하고 그 중간 측 분기 혈류 급성 사지 허혈 유도 교합의 결과로 용기의 절제 하였다. HLI 말초 사지 근육 조직에서의 혈관 신생 및 동맥 신생 반응 및 이들 반응에 대한 다양한 치료 (예를 들면, 약물, 유전자 전달은, 줄기 세포)의 효과를 연구하기 위해 주로 사용되어왔다. 최근 우리 그룹 골격근 세포의 역할을 조사하기 위해 모델을 사용한 전해당 반응은 허혈 및 결과 (14)에 유전 적 차이의 영향을 사지.
HLI 모델은 현재 허혈, 혈관 근육 응답 유전자 (즉, 근친 주) (15)에 의존 이해 16 세, 당뇨병 (17)을 포함하는 다른 질환 또는 동맥 경화증 관련 조건의 유무를 촉진했다 고 콜레스테롤 혈증 18. 그러나, 전통적인 HLI 모델의 중요한 약점은 인간 PAD는 말초 동맥 폐색 성 동맥 경화성 병변의 점진적인 발전의 결과로서 만성 허혈을 야기하는 반면이 급성 사지 허혈 (12, 13)의 모델이라는 것이다.
이 약점을 회피하기위한 시도로, 당과 동료들은 초기 constrictors 아메 로이드 (19)를 사용하여 점진적으로 대퇴 동맥 폐색의 쥐 모델,이어서 D 동일한기를 개발유사한 마우스 모델 (20) eveloped. 아메 로이드 constrictors 만성 심근 허혈 (21, 22)의 개 모델에서 1950 년대에 처음 기술되었다. 이러한 장치는 일반적으로 카제인, 흡습성 물질의 내부 층을 감싸는 외측 금속 슬리브를 가지며, 동맥 주위에 배치 할 때의 주위의 조직으로부터 수분을 흡수대로 점진적 혈관 폐색을 유도한다. 모델들의 변형에서, 양 등의 Al을. 근위 및 외과 용 결찰 사이트 유사 사이트의 원위 대퇴 동맥 모두 constrictors 배치, 이들은 전통적인 모델에서와 같이, 대퇴 동맥의 곁가지를 결찰. 수술 후 5주, 적은 근육 괴사 20 - 급성 HLI에 비해 아메 로이드 뱀 허혈 유발 염증 및 전단 응력 의존성 유전자의 낮은 발현 낮은 혈류 복구 4 결과. 이러한 관찰에 기초하여, 그 완만 한 동맥 폐색 P의 모델을 제공 할 수 느꼈다인간의 질병에 관련성 AD.
특히, 원래의 보고서에서, 아메 로이드 뱀에 의한 허혈의 효과는 허혈에 의한 근육의 괴사 (15)에 상대적으로 내성 C57BL / 6 마우스 (19)에 조사 하였다. 우리는 최근에 더 점진적 허혈 모델을 수정하고 더 허혈 취약 BALB / C 마우스 스트레인 (23)에 미치는 영향을 탐구. 모델의 첫 번째 표현에서 우리는 근위 및 원위 대퇴 동맥에 모두 constrictors을 배치하지만 그대로 모든 측면 가지를 떠났다. 두 번째, 온화한 변형에서, 우리는 근위 대퇴 동맥에 하나의 뱀을 넣고 다시 그대로 동맥의 모든 측면로 분기를 떠났습니다. 이 모델의 두 변형에서, 우리는 해당 BALB / c 마우스가 아닌 C57BL / 6 쥐를 발견 유사한 혈류 및 혈관 밀도에도 불구하고 상당한 근육의 괴사를 표시. 우리의 이전 연구 (14)와 마찬가지로, 이러한 연구 결과는 사지 근육을 보여 주었다부상은 전적으로 혈액의 흐름에 영향을하지만, 일부 유전 적 배경에 의존하지 않습니다. 또한, 우리는 사지 혈류 따라서 모델이 더 한 '아 급성'보다는 점진적인 사지 허혈의이 나타납니다, 3 일 이내에 그 최저점으로 떨어졌습니다 것을 발견했다.
이러한 종래의 연구에 기초하여, 뒷다리 허혈을 유도하기위한 하나의 방법은 모든 경우에 적합하지 않을 수 있음을 분명히 나타난다. 조건 (예를 들면, 유전 적 차이와 존재 또는 공동 병적 상태의 유무) 영향 혈관 및 골격 근육 별 반응 모두의 다양한 연구자 찾을 수 있기 때문에이 필요한 만성 및 / 또는 최선을 사지 허혈의 정도를 수정 자신의 목적에 맞게. 또한, 모델의 사전 설명은 일반적으로 기술의 신뢰성 간 연구자 재현성을 용이하게하기 위해 적당한 해부학 부족. 본 논문에서는, 마우스에 급성 또는 아 급성 중 하나 사지 허혈을 유도하는 방법설명하고, 정확한 해부학 적 랜드 마크가 제공된다.
프로토콜
모든 동물 실험은 공작 기관 동물 관리 및 사용위원회에 의해 승인 된 프로토콜에 따라 수행 하였다. 성별에 사용할 수 있지만, 본 연구의 과학적 목적 바와 같이 수컷 마우스가 본 연구에 사용 하였다.
1. 머리 제거
- 37 ° C로 설정 덮여 가열 패드 및 이소 플루 란의 연속적인 흐름으로 연결된 노즈콘 포트 이루어진 수술 전 준비 영역을 설정 마취 유도에 앞서.
- 마취 유도 챔버에서 마우스를 놓습니다. 3 % - 1 1 L / 분, 이소 플루 란에 O 2 유량계를 설정합니다.
주 : 마취 보통 2 % 이소 플루 란과 함께 25g 마우스에서 유도된다. - 부드럽게 챔버 락과 복원력 반사의 부족을 관찰하여 마우스의 자극 반응을 확인합니다.
- 개방 이전의 이소 플루 란을 취소 O 2 챔버를 플래시합니다. 빠르게 가열 (P)에 마우스를 움직광고 및 원추형 두부를 통해 이소 플루 란에 연결합니다.
- 1.5 %로 이소 플루 란을 조정합니다. 페달 반사 (발가락 핀치)에 의한 자극 반응을 확인합니다.
- 수술 중 건조를 방지하기 위해 두 눈에 자유롭게 안과 윤활제를 적용합니다.
- 작은 전기 트리머를 사용하여 두 뒷다리의 머리를 면도. 피부를 lacerating 피하기 위해 면도하는 동안 팽팽하게 피부를 잡아.
- 미리 예열 머리 제거 크림을 적용하고 1 분 동안 앉아 보자. 부드럽게 젖은 거즈 패드를 사용하여 닦아.
- 나중에 수술의 경우, 이소 플루 란을 끄고 케이지 침대를 대기음하지 않는 마우스를 보장하기 위해 빈 종이 타월 늘어선 복구 케이지에 마우스를 이동합니다. 이 흉골 드러 누움을 유지할 수있을 때까지 동물을 모니터한다. 그렇지 않으면, 수술 테이블에 마우스를 이동합니다.
주 : 제모 방법은 피부를 자극하고 혈류 측정에 영향을 미칠 수있다. 페이지 전에 동물의 털을 제거한 후 이일 - 일을 기다려야하는 것이 좋습니다미리 수술 관류 스캔을 erforming 또는 수술을 수행.
2. 수술 전 준비
- 이 절차를 수행하는 동안 다음과 같은 도구를 사용하여; 작은 직선 수술 가위, 2 뾰족한 각도 집게, 작은 Graefe 씨 집게, 바늘 드라이버 집게, 3 견인기, 작은 봄 가위와 뾰족한 면봉.
- 수술 개시전 오토 클레이브를 사용하여 모든 도구를 소독. 최대 5 동물, 각 수술 전에 사이에 뜨거운 비드 살균기를 사용합니다. 5보다 큰 그룹의 실용 추가적인 수술 도구 패킷을 소독.
- 덮여 가열 패드와 이소 플루 란 포트로 구성된 무균 수술 부위를 준비합니다. 10 스테레오 해부 현미경으로 모든 작업을 수행합니다.
- 마취 및 단계 1.5-1.1에 설명 된대로 마우스를 준비합니다.
- 마우스가 완전히 진정되어 있는지 확인하고 수술 테이블에 앙와위로 배치합니다. 수술 테이프를 사용하여 두 다리를 고정합니다.
- 온도 제어 된 가열 패드를 사용하는 경우, 온도 센서를 부착하고이 과정 중에 실수로 인출되지 않도록 외과 테이프를 사용하여 수술 플랫폼의베이스에 고정.
- 3 교대 포비돈 - 요오드와 알코올 잎사귀를 사용하여 절개 부위를 청소합니다. 무균 수술 드레이프와 동물을 커버하고 절개 부위를 노출 구멍을 잘라.
사지 허혈 3. 유도
- 복부를 향해 무릎에서 실행, 내측 허벅지의 중심을 따라 초기 절개를하고, 미세 가위 (그림 1A)와 약 1cm에 절개를 연장하기 위해 메스를 사용합니다.
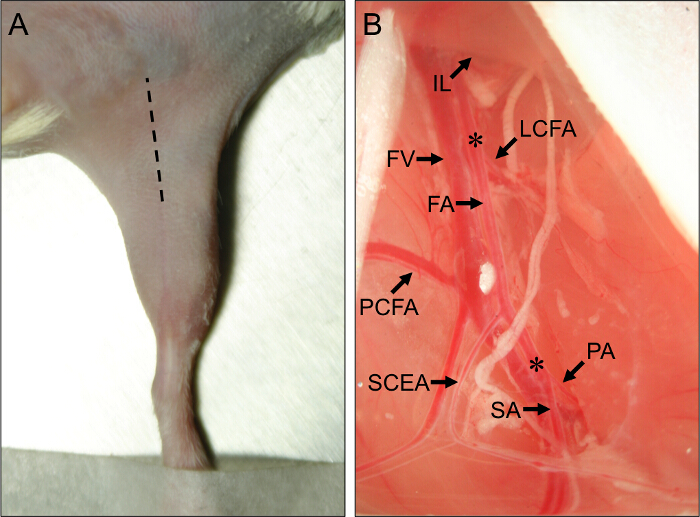
그림 1. 수술 부위와 마우스 뒷다리 국소 빈혈 외과 혈관 해부학 적 랜드 마크. (A)의 외부보기앙와위에서 마우스의 뒷다리. 해칭 선 적절히 사지 허혈 절차를 수행하기 위해 절개 부위를 나타낸다. 근위 마우스 뒷다리 혈관의 (B)보기. 대퇴 동맥 (FA)의 기단부는 사타구니 인대 (IL) 아래에서 생긴다. FA의 선단은 슬와 동맥 (PA) 및 복재 동맥 (SA)에 그 분기점에 위치해 있습니다. FA 오프 주요 측부 동맥 측면 곡절 대퇴 동맥 (LCFA), 근위 꼬리 대퇴 동맥 (PCFA) 및 표면 꼬리 상복부 동맥 (SCEA)입니다. 대퇴 정맥 (FV)은 FA에 인접하여 실행하고, 정맥 가지 주요 동맥 가지 평행 알 수있다. 별표 (*)., 아메 로이드 constrictors 또는 합자의 배치 근위 및 원위 사이트를 나타낸다 아 급성 또는 급성 허혈이 유발되는지 여부에 따라 주십시오 CLI이 그림의 더 큰 버전을 보려면 여기를 (CK).
- 집게를 사용하여 절개를 열고 사타구니 지방층 (IFT)를 피복하는 막을 노출.
- 피어스 IFT와 복부 사이의 분리에 막을 통해 폐쇄 집게를 사용. 조심스럽게 아래에있는 신경 혈관 다발을 노출, 복부 근육에서 IFT를 분리하기 위해 집게에 압력을 놓습니다. 중요한 해부학 적 랜드 마크 (그림 1B)와 근위 및 표면 꼬리 가지를 관찰한다.
- 트랙터를 삽입하고 근위 아메 로이드의 뱀 또는 결찰 사이트, 측면 곡절 대퇴 동맥 (그림 1B)에 바로 인접를 노출 근위 복부 조직을 당깁니다. 측면 곡절 동맥의 근위부 및 표면 꼬리 동맥에 약 5mm의 근위 자리 잡고 있습니다.
- , 절개의 말단 부분에 두 개 더 견인기, 하나의 내측과 외측을 삽입 말단 거리에서 IFT를 당겨수술 부위는 수술 부위를 확대합니다.
- 신경 혈관 다발을 덮고있는 가장 바깥 쪽 막을 제거하기 위해 두 개의 미세 집게를 사용합니다. 부드럽게 그들을 함께 결합 막 아래에있는 집게 팁을 슬라이딩, 정맥과 동맥의 미세 집게 팁의 절반을 삽입합니다. 포셉을 닫고 부드럽게 막을 떨어져 눈물.
- 정맥과 동맥 사이의 닫힌 집게의 끝을 삽입하고 집게에 압력을 해제하여 그들 사이의 틈을 만들 수 있습니다. 동맥과 신경 사이의 갭을 만들려면이 방법을 반복합니다.
- 아 급성 사지 허혈의 경우, 근위 대퇴 동맥 (그림 2)에 아메 로이드 뱀을 배치합니다.
- 근위 아메 로이드의 뱀을 설치하려면 신경 혈관 다발에서 격리하기 위해 대퇴 동맥 아래 집게의 끝을 밀어 넣습니다. 그립에 뱀의 가장자리를 angled- 집게의 두 번째 세트를 사용하고 대퇴 동맥 아래로 안내합니다.
- 의 S에 대퇴 동맥을 놓는다뱀에 많이합니다. 슬와 동맥과 복재 동맥 (그림 2)에 대퇴 동맥의 분기점에 즉시 근위 위치, 말초 뱀을 반복합니다.
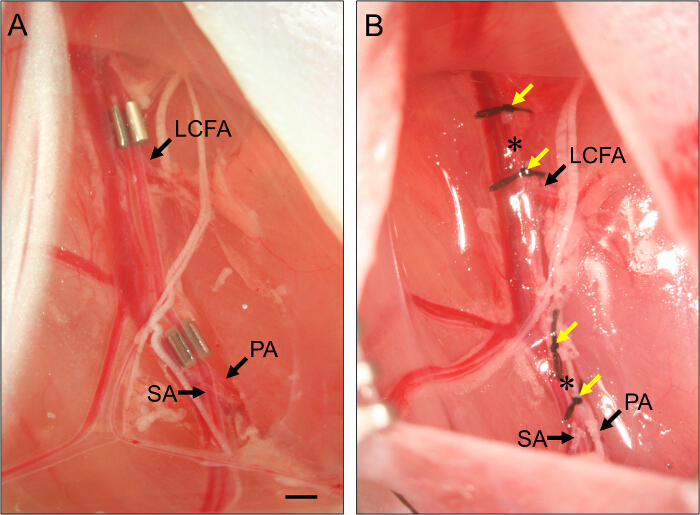
아메 로이드 Constrictors과 합자 그림 2. 배치. 아 급성 사지 허혈을 유도하기 위해 대퇴 동맥에 배치이 아메 로이드 constrictors의 (A) 예. 근위의 뱀은 측면 곡절 대퇴 동맥 (LCFA)에 바로 인접 배치됩니다. 말단 뱀은 슬와 (PA) 및 복재 동맥 (SA)의 분기점에 바로 인접 배치됩니다. Constrictors은 동맥을 보장하기 위해이 위를 향하도록 슬롯이 제대로 뱀 내에서 설정되어 설치됩니다. 급성 사지 허혈을 유도 할 수있는 대퇴 동맥의 합자의 (B) 예. LigaturES는 (노란 화살표)가 패널 (B)의 constrictors의 측면에 위치하도록 배치하고, 대퇴 동맥 두 합자 (별표)의 각 세트 사이에 횡단된다. 바, 1mm. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
- 급성 사지 허혈의 경우, 결찰 및 근위 대퇴 동맥을 가로로 쪼개다.
- 대퇴 동맥을 가로로 쪼개다하려면 스레드 (7) - 근위의 뱀의 위치로 바로 근위 동맥에서 O 봉합은 및 결찰 (단계 3.7 참조). 처음에 1mm의 말단에 대해 두 번째 합자 타이.
- 두 합자 사이의 동맥을 가로로 쪼개다 봄 가위를 사용합니다. 말초 동맥 절개를 들어, 슬와 동맥과 복재 동맥에 대퇴 동맥의 분기점에 떨어져 바로 인접 1mm 약 2 합자를 배치하지만 그들은 표면 caud에 말단 있다는 보장이 단계를 반복알 상복부 동맥 (그림 1 참조)
- O의 vicryl 봉합사 - 절개를 닫 사용하여 5를 중단.
4. 관류 영상
- 레이저 도플러 관류 이미 저 (LDPI) 아래 설정 37 ° C 가열 패드에 마우스를 이동하고 이소 플루 란 소스에 원추형 두부를 통해 연결합니다. 어떤 온도 모니터를 사용할 수없는 경우, 마우스가 37 ℃까지 가온을 위해 5 분을 허용한다.
- 이미 저를 켜고 이미지 캡처 소프트웨어를 실행합니다.
- '스캐너 설정'창을 엽니 다 '새 단일 이미지'아이콘을 클릭합니다. '4 MS / 픽셀'에 '큰'와 '스캔 속도'에 '스캔 크기'를 설정합니다. '스캔 영역 (단위)'창에서 x와 y 값을 변경하여 스캔 영역을 설정합니다.
- 비디오 피드를 볼 수있는 '비디오 및 거리'탭을 클릭하고 빨간색 테두리로 표시된 스캔 영역에 맞게 마우스를 정렬합니다. 교정 '자동 거리'를 클릭피사체 레이저의 거리. '제목 세부 정보'창을 엽니 다 '다음'을 클릭합니다.
- 대상 정보 및 모든 관련 설명을 입력합니다. 스캔 창으로 이동하는 '다음'버튼을 클릭합니다.
- '확인 또는 스캔 거리 무시'열기 대화 상자를 위해 '시작 측정'버튼을 클릭합니다. 스캔 거리를 확인하는 '확인'을 클릭합니다. 스캔 영역의 크기에 따라 8 분 - 스캐닝 프로세스를 시작하고 4 실행 관찰한다.
- 스캔이 완료되면 '저장'창을 관찰합니다. 파일 이름을 지정하고 저장합니다.
- 이소 플루 란을 차단하고 빈 복구 케이지에 마우스를 이동하고 동물 흉골 드러 누움을 유지 할 수있을 때까지 모니터링 할 수 있습니다. 다른 마우스와 케이지에 마취에서 회복 마우스를 놓지 마십시오.
- 이미지 분석 소프트웨어를 엽니 다. '열기'아이콘을 클릭하고 찾아 분석을 위해 이미지 파일을 엽니 다. 파일 창에서 플럭스를 관찰,마우스의 사진, 색상 이미지.
- 플럭스 이미지에 대한이자 (ROI)의 영역을 표시하려면 '쇼 로아'아이콘을 클릭합니다. 다음 '추가 다각형'버튼을 클릭하고 투자 수익 (ROI)을 그립니다 비 외과 사지 주위에 커서를 끕니다. 모양을 닫으려면 마우스 오른쪽 버튼으로 클릭합니다. 선택 다시 '다각형 추가'및 수술 사지 주위에 일치하는 투자 수익 (ROI)을 그립니다.
- '이미지 로아 통계 결과 (PU)'창을 엽니 다 '통계'아이콘을 클릭합니다. '플럭스 %'열의 플럭스의 %의 차이를 관찰한다.
참고 : 참고가 될 것입니다 그린 최초의 ROI.
참고 : 각각의 후속 관류 스캔하기 전에 마우스를 마취하는 제 1 절에 설명 된 단계를 따라 단계 이미지 4.11-4.1 동물이다.
결과
마우스 뒷다리 혈관의 정확한 식별은 여기에 설명 된 바와 같이, 급성 및 급성 사지 허혈 모두를 유도하는 기술의 재현성을 보장하는 데 중요하다. 동물 연구에서 본래의 변동뿐만 아니라, 다른 요인은 마취 유형, 동물의 위치 (앙와위 대 경향), 체온 (도 3 참조)을 포함하여, 레이저 도플러 관류 영상 (LDPI)에 변화를 도입 할 수있다. 또한, 아 급성 사지 허...
토론
아마도이 과정에서 가장 어려운 단계는 대퇴 정맥의 대퇴 동맥의 분리이다. 큰 직경 및 동맥와 비교 대퇴 정맥의 얇은 벽은 천공의 감수성을 증가시키고 수술 조작시 찢어. 정맥을 방해의 가능성은 PBS에 적신 멸균 면봉을 사용하여 습윤 상처를 유지함으로써 감소 될 수있다. 모든 집게가, 날카롭게 정렬 및 혈관과 주변 조직의 정확한 조작을 허용하기 위해 휴식을 무료로되어 있는지 확인하는 것?...
공개
The authors have no conflicts of interest to disclose.
감사의 말
This study was supported by NIH grants R21HL118661, R56HL124444, and R01HL124444 to CDK, and by NIH grants R00HL103797 and R01HL125695 to JMM.
자료
| Name | Company | Catalog Number | Comments |
| Dumont #5/45 Forceps | Fine Science Tools | 11251-35 | Dumoxel |
| Dumont Style 5 Mini Forceps | Fine Science Tools | 11200-14 | Inox |
| Extra Fine Bonn Scissors | Fine Science Tools | 14084-08 | |
| 7 - 0 Silk Suture | Sharpoint | DA-2527N | |
| 5 - 0 Coated Vicryl Suture | Ethicon | J463G | |
| Graefe Forceps | Fine Science Tools | 11053-10 | |
| Vannas Spring Scissors | Fine Science Tools | 15000-03 | |
| Artifical Tears Ointment | Rugby Laboratories | 0536-6550-91 | |
| Surgical Tape | 3M | 1530-0 | |
| Fine Cotton Swabs | Contec | SC-4 | |
| Temperature Controller | Physitemp | TCAT-2DF | |
| Ameroid Constrictors | Research Instruments SW | MMC-0.25 x 1.00-SS | |
| Hot Bead Sterilizer | |||
| Deltaphase Isothermal Pad | Braintree Scientific | 39DP | |
| Needle Driver | Fine Science Tools | ||
| Phosphate Buffered Saline | Gibco | 10010-023 | |
| Moor LDPI | Moor Instruments | moorLDI2 | |
| moorLDI Measurement software | Moor Instruments | v. 6.0 | |
| Hair Removal Cream | Nair |
참고문헌
- Criqui, M. H., Aboyans, V. Epidemiology of peripheral artery disease. Circ. Res. 116, 1509-1526 (2015).
- Thukkani, A. K., Kinlay, S. Endovascular intervention for peripheral artery disease. Circ. Res. 116, 1599-1613 (2015).
- Vartanian, S. M., Conte, M. S. Surgical intervention for peripheral arterial disease. Circ. Res. 116, 1614-1628 (2015).
- Bonaca, M. P., Creager, M. A. Pharmacological treatment and current management of peripheral artery disease. Circ. Res. 116, 1579-1598 (2015).
- Conte, M. S., et al. Design and rationale of the PREVENT III clinical trial: edifoligide for the prevention of infrainguinal vein graft failure. Vasc Endovascular Surg. 39, 15-23 (2005).
- Pomposelli, F. B., et al. A decade of experience with dorsalis pedis artery bypass: analysis of outcome in more than 1000 cases. J. Vasc. Surg. 37, 307-315 (2003).
- Willigendael, E. M., et al. Smoking and the patency of lower extremity bypass grafts: a meta-analysis. J. Vasc. Surg. 42, 67-74 (2005).
- Schillinger, M., et al. Balloon angioplasty versus implantation of nitinol stents in the superficial femoral artery. N. Engl. J. Med. 354, 1879-1888 (2006).
- Marmagkiolis, K., et al. 12-month primary patency rates of contemporary endovascular device therapy for femoro-popliteal occlusive disease in 6,024 patients: beyond balloon angioplasty. Catheter. Cardiovasc. Interv. 84, 555-564 (2014).
- Rosenfield, K., et al. Trial of a Paclitaxel-Coated Balloon for Femoropopliteal Artery Disease. N. Engl. J. Med. 373, 145-153 (2015).
- Tepe, G., et al. Drug-coated balloon versus standard percutaneous transluminal angioplasty for the treatment of superficial femoral and popliteal peripheral artery disease: 12-month results from the IN.PACT SFA randomized trial. Circulation. 131, 495-502 (2015).
- Couffinhal, T., et al. Mouse model of angiogenesis. Am. J. Pathol. 152, 1667-1679 (1998).
- Niiyama, H., Huang, N. F., Rollins, M. D., Cooke, J. P. Murine model of hindlimb ischemia. J Vis Exp. , (2009).
- McClung, J. M., et al. Skeletal muscle-specific genetic determinants contribute to the differential strain-dependent effects of hindlimb ischemia in mice. Am. J. Pathol. 180, 2156-2169 (2012).
- Dokun, A. O., et al. A quantitative trait locus (LSq-1) on mouse chromosome 7 is linked to the absence of tissue loss after surgical hindlimb ischemia. Circulation. 117, 1207-1215 (2008).
- Rivard, A., et al. Age-dependent impairment of angiogenesis. Circulation. 99, 111-120 (1999).
- Hazarika, S., et al. Impaired angiogenesis after hindlimb ischemia in type 2 diabetes mellitus: differential regulation of vascular endothelial growth factor receptor 1 and soluble vascular endothelial growth factor receptor 1. Circ. Res. 101, 948-956 (2007).
- Couffinhal, T., et al. Impaired collateral vessel development associated with reduced expression of vascular endothelial growth factor in ApoE-/- mice. Circulation. 99, 3188-3198 (1999).
- Tang, G. L., Chang, D. S., Sarkar, R., Wang, R., Messina, L. M. The effect of gradual or acute arterial occlusion on skeletal muscle blood flow, arteriogenesis, and inflammation in rat hindlimb ischemia. J. Vasc. Surg. 41, 312-320 (2005).
- Yang, Y., et al. Cellular and molecular mechanism regulating blood flow recovery in acute versus gradual femoral artery occlusion are distinct in the mouse. J. Vasc. Surg. 48, 1546-1558 (2008).
- Litvak, J., Siderides, L. E., Vineberg, A. M. The experimental production of coronary artery insufficiency and occlusion. Am. Heart J. 53, 505-518 (1957).
- Bredee, J. J. An improved ameroid constrictor. Preliminary communication. J. Surg. Res. 9, 107-112 (1969).
- McClung, J. M., et al. Subacute limb ischemia induces skeletal muscle injury in genetically susceptible mice independent of vascular density. J. Vasc. Surg. , (2015).
- Hellingman, A. A., et al. Variations in surgical procedures for hind limb ischaemia mouse models result in differences in collateral formation. Eur. J. Vasc. Endovasc. Surg. 40, 796-803 (2010).
- Kochi, T., et al. Characterization of the arterial anatomy of the murine hindlimb: functional role in the design and understanding of ischemia models. PloS one. 8, e84047 (2013).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유