È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Metodi di acuta e subacuta murino arti posteriori ischemia
In questo articolo
Riepilogo
Surgical induction of hindlimb ischemia in the mouse is useful to examine angiogenesis, however this is compromised in certain inbred mouse strains that display marked ischemia-induced tissue necrosis. Methods are described to induce subacute limb ischemia using ameroid constrictors to circumvent this problem through the induction of gradual arterial occlusion.
Abstract
malattia periferica arteriosa (PAD) è una delle principali cause di morbilità e mortalità cardiovascolare nei paesi sviluppati, e modelli animali che riproducono in modo affidabile la malattia umana sono necessarie per lo sviluppo di nuove terapie per questa malattia. Il modello di topo hindlimb ischemia è stato ampiamente utilizzato per questo scopo, ma la pratica standard di indurre ischemia dell'arto acuta mediante legatura dell'arteria femorale può provocare la necrosi tissutale sostanziale, compromettere la capacità degli investigatori di studiare le risposte vascolari e tessuto muscolare scheletrico all'ischemia . Un approccio alternativo alla legatura dell'arteria femorale è l'induzione di progressiva occlusione dell'arteria femorale attraverso l'uso di costrittori AMEROID. Quando posizionato intorno femorale uguali o differenti posizioni come i siti di legatura dell'arteria femorale, questi dispositivi occludono l'arteria più di 1 - 3 giorni con conseguente più graduale, subacuta ischemia. Ciò si traduce in meno consistente necrosi dei tessuti muscolo scheletrico, which può imitare più da vicino le risposte visto in PAD umana. Perché background genetico influenze esiti in entrambi i modelli di ischemia acuta e subacuta, considerazione del ceppo di topi in fase di studio è importante nella scelta del modello migliore. Questo documento descrive la procedura corretto posizionamento anatomico di legature o costrittori AMEROID sul mouse arteria femorale per indurre subacuta o ischemia degli arti posteriori acuta nel topo.
Introduzione
Malattia periferica arteriosa (PAD) è una delle principali cause di morbilità e mortalità cardiovascolare nei paesi sviluppati 1. risultati PAD da ostruzione aterosclerotica delle arterie periferiche che porta a ischemia con conseguente dolore da sforzo o di riposo e, occasionalmente, ulcere e cancrena che necessitano di amputazione degli arti non-guarigione. Terapie mirate PAD sono dirette principalmente verso endovascolare 2 o rivascolarizzazione chirurgica 3, come essenzialmente terapie mediche efficaci esistono 4.
Purtroppo, la rivascolarizzazione è spesso di beneficio limitato, come bypass hanno alti tassi di fallimento (fino al 50% entro 5 anni) 5 che sono peggio in alcune popolazioni (ad esempio, per fumatori, le donne, non vena safena innesti) 6,7. approcci endovascolari, come angioplastica e stenting, sono anche compromesse da elevati tassi di restenosi (superiore al 50% in 1 anno), particolarmente in femoropoplitea malattia 8, anche se l'uso di palloncini e stent medicati ha migliorato i risultati un po '9-11. Al fine di sviluppare nuovi trattamenti per la PAD è essenziale sviluppare modelli animali che riproducono in modo affidabile la malattia umana.
Fino ad oggi, il modello più comune della PAD è il modello degli arti posteriori ischemia (HLI), che viene più frequentemente eseguita nei topi 12,13. Nella sua manifestazione più comune, il modello comporta legatura chirurgica dell'arteria femorale prossimale e distale e suoi intermedi rami laterali seguita da escissione della nave, con conseguente occlusione del flusso sanguigno e induzione di ischemia dell'arto acuta. HLI è stato utilizzato principalmente per studiare le risposte angiogeniche e arteriogenic nel tessuto muscolare degli arti periferici e gli effetti di varie terapie (ad esempio, la droga, la consegna del gene, le cellule staminali) su queste risposte. Più di recente, il nostro gruppo ha utilizzato questo modello per esaminare il ruolo delle cellule del muscolo scheletrico in la risposta alla ischemia e gli effetti delle differenze genetiche sui risultati 14.
Il modello HLI ha facilitato la nostra comprensione corrente che le risposte vascolari e muscolari all'ischemia dipendono genetica (cioè, ceppo inbred) 15, 16 anni, e la presenza o assenza di altre malattie o condizioni pertinenti ad aterosclerosi, compreso il diabete mellito 17 e ipercolesterolemia 18. Tuttavia, un importante debolezza del modello tradizionale HLI è che è un modello di ischemia acuta 12,13, mentre PAD umana provoca ischemia cronica a seguito del progressivo sviluppo di lesioni aterosclerotiche occlusive nelle arterie periferiche.
Nel tentativo di aggirare questa debolezza, Tang e colleghi hanno inizialmente sviluppato un modello murino di graduale occlusione arteriosa femorale utilizzando constrictor AMEROID 19, e lo stesso gruppo poi developed un modello di topo simile 20. Costrittori AMEROID sono stati descritti inizialmente nel 1950 in un modello canino di ischemia miocardica cronica 21,22. Questi dispositivi hanno un manicotto metallico esterno che racchiude uno strato interno di un materiale igroscopico, di solito di caseina, e quando disposto intorno un'arteria inducono progressiva occlusione di vasi che assorbono l'umidità dai tessuti circostanti. Nella modifica del modello, Yang et al. Costrittori posizionato su entrambi prossimale e distale femorale in siti analoghi ai siti legatura chirurgica, e ligato i rami laterali dell'arteria femorale, come nel modello tradizionale. Rispetto al HLI acuta, ischemia AMEROID constrictor indotta portato a bassa espressione di geni infiammatori e di taglio di stress-dipendente, più bassa di recupero il flusso di sangue 4 - 5 settimane dopo l'intervento, e meno necrosi muscolare 20. Sulla base di queste osservazioni, si è ritenuto che progressiva occlusione arteriosa potrebbe fornire un modello di PAD più rilevante per la malattia umana.
In particolare, nel rapporto originale, effetti di AMEROID ischemia indotta constrictor sono stati esaminati solo in topi C57BL / 6 19, che sono relativamente resistenti alla ischemia indotta necrosi muscolare 15. Recentemente abbiamo modificato il modello di ischemia graduale ulteriormente e esplorato i suoi effetti nel più ischemia-sensibili BALB / c del mouse ceppo 23. Nella prima manifestazione del modello, abbiamo messo constrictor sia prossimale e distale femorale ma lasciato intatti tutti rami laterali. In un secondo, modifica mite, abbiamo posizionato un singolo costrittore solo sulla arteria femorale prossimale e ancora lasciato tutti collaterali rami dell'arteria intatta. In entrambe le modifiche di questo modello, abbiamo scoperto che i topi BALB / c, ma non C57BL / 6 topi, visualizzata significativa necrosi muscolare pur avendo simile flusso di sangue e la densità vascolare. Simile al nostro precedente studio 14, questi risultati hanno dimostrato che il muscolo degli artipregiudizio non è solo influenzata dal flusso di sangue, ma è in parte dipendente background genetico. Inoltre, abbiamo scoperto che il flusso di sangue arto è sceso al suo nadir entro 3 giorni, così il modello sembra essere più uno dei 'subacuta' piuttosto che graduale ischemia degli arti.
Sulla base di questi studi precedenti, appare chiaro che un singolo metodo per indurre hindlimb ischemia può non essere adatto in tutti i casi. A causa di una varietà di condizioni (ad esempio, le differenze genetiche e la presenza o assenza di condizioni di co-morbidità) influenza sia il vascolare e le risposte specifiche del muscolo scheletrico, gli investigatori potrebbe essere necessario modificare la cronicità e / o la gravità delle arti posteriori ischemia al meglio soddisfare i loro scopi. Inoltre, precedenti descrizioni del modello tipicamente mancavano punti di riferimento anatomici idonee ad agevolare affidabile inter-investigatore riproducibilità della tecnica. In questo lavoro, i metodi per indurre ischemia degli arti posteriori acuta o subacuta nel toposono descritti, e punti di riferimento anatomici precisi sono forniti.
Protocollo
Tutti gli esperimenti sugli animali sono stati eseguiti secondo il protocollo approvato dal Comitato cura e l'uso Duke Istituzionale Animal. topi maschi sono stati utilizzati in questo studio, anche se entrambi i sessi può essere utilizzato come indicato ai fini scientifica dello studio.
1. Depilazione
- Prima di induzione di anestesia, impostare una zona di preparazione pre-chirurgica consiste di una piastra elettrica coperta a 37 ° C e una porta nosecone connesso al flusso continuo di isoflurano.
- Posizionare il mouse nella camera di induzione dell'anestesia. Impostare il flussometro O 2 a 1 L / min e isoflurano per 1 - 3%.
NOTA: L'anestesia è tipicamente indotta in 25 g mouse con 2% isoflurano. - Controllare la risposta di stimolo del mouse delicatamente a dondolo della camera e osservando la mancanza di un riflesso di raddrizzamento.
- Lavare la camera con 2 O per cancellare l'isoflurano prima dell'apertura. spostare rapidamente il mouse per il riscaldamento pannuncio e collegarlo al isoflurano attraverso il musetto.
- Regolare il isoflurano al 1,5%. Controllare la risposta di stimolo da parte del pedale riflesso (pinch tep).
- Applicare il lubrificante oftalmica liberamente in entrambi gli occhi per evitare l'essiccamento durante l'intervento chirurgico.
- Radere i capelli da entrambi gli arti posteriori con un piccolo trimmer elettrico. Tenere la pelle tesa durante la rasatura per evitare di lacerare la pelle.
- Applicare pre-riscaldato crema depilatoria e lasciate riposare per 1 min. Delicatamente spazzare via con un tampone di garza inumidito.
- Per la procedura chirurgica in un secondo momento, disattivare l'isoflurano e spostare il mouse a un asciugamano foderata gabbia di recupero di carta vuoto per garantire il mouse non aspirare il assestamento gabbia. Monitorare l'animale fino a quando è in grado di mantenere decubito sternale. In caso contrario, spostare il mouse al tavolo operatorio.
NOTA: Il processo di rimozione dei capelli può irritare la pelle e influire sulle misurazioni della perfusione. Si consiglia di attendere 1 - 2 giorni dopo la rimozione dei peli dell'animale prima di performing una scansione perfusione pre-chirurgica o l'esecuzione di un intervento chirurgico.
Preparazione 2. Pre-chirurgica
- Utilizzare i seguenti strumenti durante questa procedura; piccole forbici chirurgiche rette, 2 punta fine pinze ad angolo, piccole pinze Graefe, ago pinze driver, 3 divaricatori, forbici piccola sorgente, e tamponi di cotone punta fine.
- Sterilizzare tutti gli strumenti utilizzando un autoclave prima dell'inizio della chirurgia. Utilizzare uno sterilizzatore a caldo tallone prima e tra ogni intervento chirurgico, per un massimo di 5 animali. Sterilizzare ulteriori pacchetti di strumento chirurgico per la chirurgia di gruppi superiori a 5.
- Preparare un campo chirurgico sterile, costituita da una piastra elettrica coperta e una porta isoflurano. Eseguire tutti i lavori sotto un microscopio dissezione 10 stereo.
- Anestetizzare e preparare il mouse come descritto nei punti da 1.1 a 1.5.
- Controllare che il mouse è completamente sedato e posto in posizione supina sul tavolo operatorio. Fissare entrambe le gambe con nastro chirurgico.
- Se si utilizza una piastra elettrica a temperatura controllata, fissare la sonda di temperatura e fissarlo alla base della piattaforma chirurgica con nastro chirurgica per garantire che non venga accidentalmente estratta durante la procedura.
- Pulire il sito di incisione con 3 alternati iodopovidone e alcool salviette. Coprire l'animale con un telo chirurgico sterile e un foro per esporre il sito di incisione.
3. L'induzione di ischemia degli arti
- Utilizzare un bisturi per fare una incisione iniziale lungo il centro della coscia mediale, che va dal ginocchio verso l'addome, ed allungare l'incisione per circa 1 cm con forbici sottili (Figura 1A).
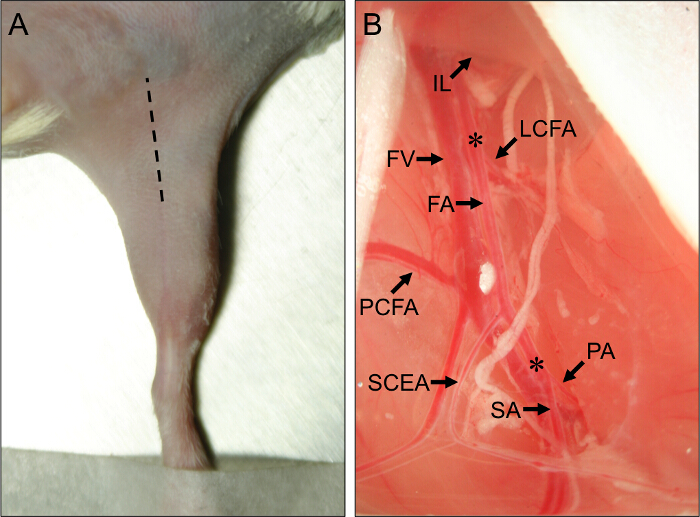
Figura 1. sito chirurgico e vascolari anatomici Luoghi di interesse per la chirurgia degli arti posteriori del mouse ischemia. (A) Vista esternal'arti posteriori di un mouse in posizione supina. La linea tratteggiata indica il sito di incisione per eseguire correttamente le procedure degli arti posteriori ischemia. (B) Veduta del prossimale vascolarizzazione degli arti posteriori del mouse. L'estremità prossimale dell'arteria femorale (FA) deriva da sotto del legamento inguinale (IL). L'estremità distale della FA si trova a sua biforcazione nell'arteria poplitea (PA) e l'arteria safena (SA). Le principali arterie collaterali al largo della FA sono l'arteria femorale laterale circonflessa (LCFA), il prossimale femorale caudale (PCFA), e il superficiale dell'arteria epigastrica caudale (SCEA). La vena femorale (FV) corre adiacente alla FA e rami venosi può essere visto parallelamente ai principali rami arteriosi. Gli asterischi (*) indicano i siti prossimale e distale per il posizionamento dei costrittori AMEROID o legature, a seconda che saranno indotte subacuta o ischemia acuta. Si prega click qui per vedere una versione più grande di questa figura.
- Utilizzando pinze, aprire l'incisione ed esporre la membrana che copre il tessuto adiposo inguinale (IFT).
- Utilizzando chiuse-pinze, forare attraverso la membrana nella separazione tra IFT e l'addome. Delicatamente rilasciare pressione sulle pinze per separare il IFT dai muscoli addominali, esponendo il fascio neurovascolare sotto. Osservare il prossimale e rami caudali superficiali come importanti punti di riferimento anatomici (Figura 1B).
- Inserire un divaricatore e tirare il tessuto addominale prossimale per esporre il AMEROID constrictor o legatura sito prossimale, proprio in prossimità del laterale circonflessa femorale (Figura 1B). L'arteria circonflessa laterale si trova circa 5 mm prossimale al prossimale e arterie caudale superficiali.
- Inserire due divaricatori nella parte distale dell'incisione, uno mediale e l'altra laterale, di tirare il IFT distalmente dalsito chirurgico per allargare il campo chirurgico.
- Utilizzare due pinza sottile per rimuovere la membrana più esterna che copre il fascio neurovascolare. Inserire delicatamente la metà della punta pinza sottile tra la vena e arteria, scorrere la punta pinza sotto la membrana che li unisce. Chiudere la pinza e delicatamente strappare la membrana.
- Inserire la punta di una pinza chiuse tra la vena e arteria e creare un divario tra loro rilasciando la pressione sulle pinze. Ripetere questa tecnica per creare un divario tra l'arteria e il nervo.
- Per subacuta ischemia, posizionare un costrittore AMEROID sull'arteria femorale prossimale (Figura 2).
- Per installare il costrittore AMEROID prossimale, far scorrere la punta di una pinza sotto l'arteria femorale per isolarlo dal fascio neurovascolare. Utilizzare una seconda serie di pinze angled- per afferrare il bordo del costrittore e guidare sotto l'arteria femorale.
- Posare l'arteria femorale nelle smolto nel constrictor. Ripetere per costrittore distale, posizionandolo immediatamente prossimale alla biforcazione dell'arteria femorale nell'arteria poplitea e arteria safena (Figura 2).
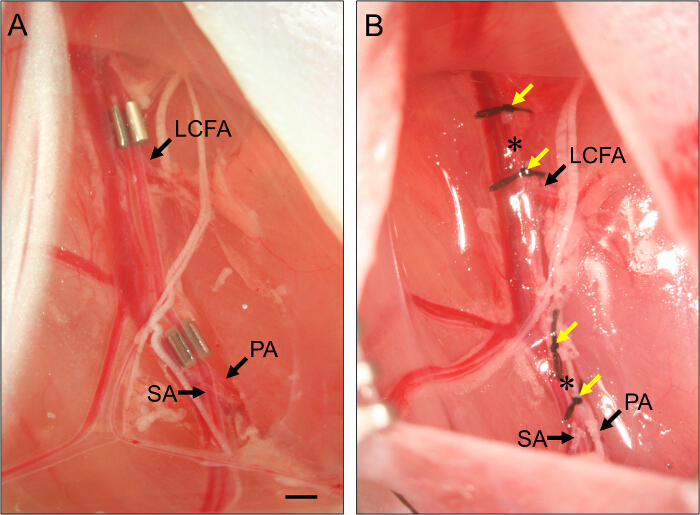
Figura 2. Collocamento di AMEROID costrittori e Legature. (A) Esempio di due costrittori AMEROID immessi sul arteria femorale per indurre subacuta degli arti posteriori ischemia. Il constrictor prossimale si trova appena prossimale al femorale circonflessa laterale (LCFA). Il constrictor distale si trova appena prossimale alla biforcazione del popliteo (PA) e le arterie safena (SA). Costrittori sono installati con la scanalatura rivolta verso l'alto al fine di garantire l'arteria è impostato correttamente all'interno del constrictor. (B) Esempio di legature dell'arteria femorale per indurre ischemia degli arti posteriori acuta. Ligatures (frecce gialle) sono posizionati in modo tale che fiancheggiano la posizione dei costrittori pannello (B), e l'arteria femorale viene transected tra ciascun gruppo di due legature (asterischi). Bar, 1 mm. Clicca qui per vedere una versione più grande di questa figura.
- Per ischemia degli arti acuta, legare e transetto l'arteria femorale prossimale.
- Per transetto l'arteria femorale, filo 7 - O sutura sotto l'arteria appena prossimale alla posizione del costrittore prossimale (vedi punto 3.7) e legare. Tie una seconda legatura circa 1 mm distalmente alla prima.
- Usare le forbici a molla al transetto l'arteria tra le due legature. Per la transection arteriosa distale, ripetere questi passaggi, mettendo due legature di circa 1 mm l'una dall'altra, proprio prossimali alla biforcazione dell'arteria femorale in arteria poplitea e l'arteria safena, ma assicurando che essi sono distale al caud superficialiAl arteria epigastrica (vedi Figura 1)
- Chiudere l'incisione utilizzando interrotto 5 - punti di sutura Vicryl O.
4. Perfusion Imaging
- Muovi il mouse per un 37 ° piastra elettrica C impostare sotto l'imager laser doppler perfusione (LDPI) e collegare tramite un nosecone alla fonte isoflurano. Se nessun controllo della temperatura è disponibile, per consentire 5 min per il mouse per riscaldare fino a 37 ° C.
- Accendere l'imager e lanciare il software di acquisizione delle immagini.
- Fare clic sull'icona 'Nuova Immagine singolo' per aprire la finestra 'Setup Scanner'. Impostare il 'Formato scansione' per 'Large' e la 'velocità di scansione' a '4 ms / pixel'. Impostare l'area di scansione modificando i valori X e Y sotto il 'Area di scansione (unità)' riquadro.
- Fare clic sulla scheda 'Video e Distanza' per visualizzare il feed video, e di organizzare il mouse per adattarsi l'area di scansione indicata da un contorno rosso. Fare clic su 'Auto Distanza' per calibrarela distanza dal laser al soggetto. Fare clic su 'Next' per aprire la finestra il "soggetto Dettagli.
- Inserire le informazioni oggetto e eventuali commenti. Fare clic sul pulsante 'Avanti' per passare alla finestra di scansione.
- Fare clic sul pulsante 'Start misura' per aprire il 'Confermare o Override Scan Distanza' di dialogo. Fare clic su 'OK' per confermare la distanza di scansione. Osservare il processo di scansione inizia e correre per 4 - 8 min a seconda delle dimensioni dell'area di scansione.
- Dopo la scansione, di osservare la finestra 'Salva con nome'. Assegnare un nome al file e salvarlo.
- Spegnere il isoflurano e spostare il mouse per una gabbia di recupero vuoto e monitorare fino a quando l'animale è in grado di mantenere decubito sternale. Non mettere mai un mouse recupero dall'anestesia in una gabbia con altri topi.
- Aprire il software di analisi delle immagini. Fare clic sull'icona 'Open' e individuare e aprire il file immagine per l'analisi. Nella finestra del file, osservare il cambiamento continuo,foto, e immagini a colori del mouse.
- Per celebrare la regione di interesse (ROI) sull'immagine di flusso, fare clic sull'icona 'Mostra ROI. Avanti fare clic sul pulsante 'Aggiungi poligono' e trascinare il cursore intorno all'arto non chirurgica per disegnare il ROI. Tasto destro del mouse per chiudere la forma. Seleziona 'Aggiungi poligono' di nuovo e di tracciare un ROI corrispondente intorno all'arto chirurgica.
- Fare clic sull'icona 'statistiche' per aprire la finestra 'ROI statistici Risultati (PU) Immagine'. Osservare la differenza percentuale in continuo mutamento nella colonna 'Flux%'.
NOTA: La prima ROI disegnato servirà da riferimento.
NOTA: Prima di ogni successiva scansione perfusione seguire la procedura descritta nella Sezione 1 per anestetizzare il mouse e in passi da 4.1 a 4.11 per l'immagine dell'animale.
Risultati
La corretta identificazione del sistema vascolare del mouse arti posteriori è fondamentale per garantire la riproducibilità delle tecniche per indurre sia subacuta e ischemia degli arti posteriori acuta, come descritto qui. Oltre alla variazione intrinseca in studi sugli animali, altri fattori possono introdurre variabilità laser Doppler perfusione (LDPI), compreso il tipo di anestesia, la posizione dell'animale (vs supina prona), e la temperatura corporea (vedere
Discussione
Forse il passo più difficile in questa procedura è la separazione dell'arteria femorale dalla vena femorale. Il diametro maggiore e pareti più sottili della vena femorale rispetto a quelli dell'arteria aumentano la suscettibilità alle perforazioni e strappi durante la manipolazione chirurgica. La probabilità di interferire vena può essere ridotto mantenendo la ferita umida utilizzando un tampone sterile inumidito con PBS. È altresì importante garantire che tutti pinze sono affilate, allineate, e priva di...
Divulgazioni
The authors have no conflicts of interest to disclose.
Riconoscimenti
This study was supported by NIH grants R21HL118661, R56HL124444, and R01HL124444 to CDK, and by NIH grants R00HL103797 and R01HL125695 to JMM.
Materiali
| Name | Company | Catalog Number | Comments |
| Dumont #5/45 Forceps | Fine Science Tools | 11251-35 | Dumoxel |
| Dumont Style 5 Mini Forceps | Fine Science Tools | 11200-14 | Inox |
| Extra Fine Bonn Scissors | Fine Science Tools | 14084-08 | |
| 7 - 0 Silk Suture | Sharpoint | DA-2527N | |
| 5 - 0 Coated Vicryl Suture | Ethicon | J463G | |
| Graefe Forceps | Fine Science Tools | 11053-10 | |
| Vannas Spring Scissors | Fine Science Tools | 15000-03 | |
| Artifical Tears Ointment | Rugby Laboratories | 0536-6550-91 | |
| Surgical Tape | 3M | 1530-0 | |
| Fine Cotton Swabs | Contec | SC-4 | |
| Temperature Controller | Physitemp | TCAT-2DF | |
| Ameroid Constrictors | Research Instruments SW | MMC-0.25 x 1.00-SS | |
| Hot Bead Sterilizer | |||
| Deltaphase Isothermal Pad | Braintree Scientific | 39DP | |
| Needle Driver | Fine Science Tools | ||
| Phosphate Buffered Saline | Gibco | 10010-023 | |
| Moor LDPI | Moor Instruments | moorLDI2 | |
| moorLDI Measurement software | Moor Instruments | v. 6.0 | |
| Hair Removal Cream | Nair |
Riferimenti
- Criqui, M. H., Aboyans, V. Epidemiology of peripheral artery disease. Circ. Res. 116, 1509-1526 (2015).
- Thukkani, A. K., Kinlay, S. Endovascular intervention for peripheral artery disease. Circ. Res. 116, 1599-1613 (2015).
- Vartanian, S. M., Conte, M. S. Surgical intervention for peripheral arterial disease. Circ. Res. 116, 1614-1628 (2015).
- Bonaca, M. P., Creager, M. A. Pharmacological treatment and current management of peripheral artery disease. Circ. Res. 116, 1579-1598 (2015).
- Conte, M. S., et al. Design and rationale of the PREVENT III clinical trial: edifoligide for the prevention of infrainguinal vein graft failure. Vasc Endovascular Surg. 39, 15-23 (2005).
- Pomposelli, F. B., et al. A decade of experience with dorsalis pedis artery bypass: analysis of outcome in more than 1000 cases. J. Vasc. Surg. 37, 307-315 (2003).
- Willigendael, E. M., et al. Smoking and the patency of lower extremity bypass grafts: a meta-analysis. J. Vasc. Surg. 42, 67-74 (2005).
- Schillinger, M., et al. Balloon angioplasty versus implantation of nitinol stents in the superficial femoral artery. N. Engl. J. Med. 354, 1879-1888 (2006).
- Marmagkiolis, K., et al. 12-month primary patency rates of contemporary endovascular device therapy for femoro-popliteal occlusive disease in 6,024 patients: beyond balloon angioplasty. Catheter. Cardiovasc. Interv. 84, 555-564 (2014).
- Rosenfield, K., et al. Trial of a Paclitaxel-Coated Balloon for Femoropopliteal Artery Disease. N. Engl. J. Med. 373, 145-153 (2015).
- Tepe, G., et al. Drug-coated balloon versus standard percutaneous transluminal angioplasty for the treatment of superficial femoral and popliteal peripheral artery disease: 12-month results from the IN.PACT SFA randomized trial. Circulation. 131, 495-502 (2015).
- Couffinhal, T., et al. Mouse model of angiogenesis. Am. J. Pathol. 152, 1667-1679 (1998).
- Niiyama, H., Huang, N. F., Rollins, M. D., Cooke, J. P. Murine model of hindlimb ischemia. J Vis Exp. , (2009).
- McClung, J. M., et al. Skeletal muscle-specific genetic determinants contribute to the differential strain-dependent effects of hindlimb ischemia in mice. Am. J. Pathol. 180, 2156-2169 (2012).
- Dokun, A. O., et al. A quantitative trait locus (LSq-1) on mouse chromosome 7 is linked to the absence of tissue loss after surgical hindlimb ischemia. Circulation. 117, 1207-1215 (2008).
- Rivard, A., et al. Age-dependent impairment of angiogenesis. Circulation. 99, 111-120 (1999).
- Hazarika, S., et al. Impaired angiogenesis after hindlimb ischemia in type 2 diabetes mellitus: differential regulation of vascular endothelial growth factor receptor 1 and soluble vascular endothelial growth factor receptor 1. Circ. Res. 101, 948-956 (2007).
- Couffinhal, T., et al. Impaired collateral vessel development associated with reduced expression of vascular endothelial growth factor in ApoE-/- mice. Circulation. 99, 3188-3198 (1999).
- Tang, G. L., Chang, D. S., Sarkar, R., Wang, R., Messina, L. M. The effect of gradual or acute arterial occlusion on skeletal muscle blood flow, arteriogenesis, and inflammation in rat hindlimb ischemia. J. Vasc. Surg. 41, 312-320 (2005).
- Yang, Y., et al. Cellular and molecular mechanism regulating blood flow recovery in acute versus gradual femoral artery occlusion are distinct in the mouse. J. Vasc. Surg. 48, 1546-1558 (2008).
- Litvak, J., Siderides, L. E., Vineberg, A. M. The experimental production of coronary artery insufficiency and occlusion. Am. Heart J. 53, 505-518 (1957).
- Bredee, J. J. An improved ameroid constrictor. Preliminary communication. J. Surg. Res. 9, 107-112 (1969).
- McClung, J. M., et al. Subacute limb ischemia induces skeletal muscle injury in genetically susceptible mice independent of vascular density. J. Vasc. Surg. , (2015).
- Hellingman, A. A., et al. Variations in surgical procedures for hind limb ischaemia mouse models result in differences in collateral formation. Eur. J. Vasc. Endovasc. Surg. 40, 796-803 (2010).
- Kochi, T., et al. Characterization of the arterial anatomy of the murine hindlimb: functional role in the design and understanding of ischemia models. PloS one. 8, e84047 (2013).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon