É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Métodos para aguda e subaguda Murino dos membros posteriores Isquemia
Neste Artigo
Resumo
Surgical induction of hindlimb ischemia in the mouse is useful to examine angiogenesis, however this is compromised in certain inbred mouse strains that display marked ischemia-induced tissue necrosis. Methods are described to induce subacute limb ischemia using ameroid constrictors to circumvent this problem through the induction of gradual arterial occlusion.
Resumo
doença arterial periférica (DAP) é uma das principais causas de morbilidade e mortalidade cardiovascular em países desenvolvidos, e modelos animais que reproduzem de forma fiável a doença humana são necessários para desenvolver novas terapias para esta doença. O modelo do rato de membro posterior isquemia tem sido amplamente utilizado para este fim, mas a prática padrão de indução de isquemia aguda por ligação da artéria femoral pode resultar em necrose do tecido substancial, comprometer a capacidade de os investigadores a estudar as respostas vasculares e dos tecidos do músculo esquelético para isquemia . Uma abordagem alternativa para a ligação da artéria femoral é a indução de oclusão da artéria femural gradual através da utilização de constritores AMEROID. Quando colocado em torno da artéria femoral na mesma ou em diferentes locais, como os locais de ligação da artéria femoral, estes dispositivos de oclusão da artéria mais de 1 - 3 dias, resultando em mais gradual, isquemia subaguda. Isto resulta em necrose do tecido muscular esquelético menos substancial, Which pode imitar mais de perto as respostas observadas nos PAD humano. Porque genéticos influências fundo resultados em ambos os modelos de isquemia aguda e subaguda, a consideração da estirpe de ratinhos em estudo é importante na escolha do melhor modelo. Este artigo descreve o procedimento adequado e colocação anatômica de ligaduras ou constrictors AMEROID na artéria femoral do rato para induzir subaguda ou isquemia dos membros posteriores aguda no mouse.
Introdução
Doença arterial periférica (DAP) é uma das principais causas de morbidade e mortalidade cardiovascular em países desenvolvidos 1. resultados Pad de obstrução aterosclerótica das artérias periféricas, que leva a isquemia de membros com a dor de esforço ou de descanso resultante e, ocasionalmente, úlceras e gangrena que necessitam de amputação do membro não-cura. Terapias enfocadas PAD são essencialmente direccionado para endovascular 2 ou revascularização cirúrgica 3, como essencialmente não existem terapias médicas eficazes 4.
Infelizmente, a revascularização é muitas vezes de benefício limitado, como enxertos têm elevadas taxas de insucesso (até 50% dentro de 5 anos) 5 que são piores em algumas populações (por exemplo, fumantes, mulheres, enxertos de veia safena não) 6,7. abordagens endovasculares, como a angioplastia e colocação de stent, também estão comprometidos por elevadas taxas de restenose (em excesso de 50% a 1 ano), especialmente in femoropoplítea doença 8, embora o uso de balões e stents farmacológicos melhorou resultados pouco 9-11. A fim de desenvolver novos tratamentos para a DAP é essencial para desenvolver modelos animais que reproduzem de forma fiável a doença humana.
Até à data, o modelo mais comum de DAP é o modelo da pata traseira isquemia (HLI), que é mais frequentemente realizada em ratos 12,13. Na sua manifestação mais comum, o modelo envolve a ligadura cirúrgica da artéria femoral proximal e distai e os seus intervenientes ramos laterais seguida por excisão do vaso, resultando na oclusão do fluxo sanguíneo e a indução de isquemia aguda. HLI tem sido principalmente utilizado para estudar as respostas angiogénicas e arteriogénica no tecido muscular do membro periférico e os efeitos de várias terapias (por exemplo, drogas, a entrega do gene, as células estaminais) sobre essas respostas. Mais recentemente, o nosso grupo utilizou este modelo para examinar o papel das células do músculo esquelético in a resposta à isquemia e os efeitos das diferenças genéticas sobre os resultados 14.
O modelo HLI tem facilitado a nossa compreensão actual que as respostas vasculares e dos músculos a isquemia são dependentes genética (isto é, estirpe consanguínea) 15, 16 anos de idade, e a presença ou ausência de outras doenças ou condições relevantes para a aterosclerose, incluindo a diabetes mellitus 17 e hipercolesterolemia 18. No entanto, um ponto fraco importante do modelo tradicional HLI é que é um modelo de isquemia aguda 12,13, enquanto DAP humana provoca isquemia crónica, como resultado do desenvolvimento progressivo de lesões ateroscleróticas oclusivas nas artérias periféricas.
Em uma tentativa de contornar essa fraqueza, Tang e seus colegas inicialmente desenvolvido um modelo de rato da oclusão arterial femoral gradual usando constrictors AMEROID 19, e do mesmo grupo posteriormente developed um rato modelo semelhante 20. Constrictors AMEROID foram descritos inicialmente na década de 1950 em um modelo canino de isquemia miocárdica crônica 21,22. Estes dispositivos têm uma manga de metal externo envolvendo uma camada interior de um material higroscópico, geralmente caseína, e quando colocado em torno de uma artéria que induzir a oclusão progressiva vaso à medida que absorvem humidade a partir dos tecidos circundantes. Na sua modificação do modelo, Yang et al. Constritores colocado em ambas as extremidades proximal e distai artéria femoral em locais análogos aos locais de ligação cirúrgica, e eles ligado aos ramos laterais da artéria femoral, como no modelo tradicional. Comparado a HLI aguda, isquemia induzida pelo constrictor ameróide resultou em menor expressão de genes inflamatórios e cisalhamento dependentes de tensão, menor recuperação do fluxo sanguíneo 4 - 5 semanas após a cirurgia, e menos necrose muscular 20. Com base nestas observações, considerou-se que a oclusão arterial gradual pode fornecer um modelo de PAD mais relevante para a doença humana.
Notavelmente, no relatório original, foram examinados os efeitos de isquemia induzida por constritor ameróide apenas em ratinhos C57BL / 6 19, que são relativamente resistentes à necrose do músculo induzida por isquemia 15. Nós recentemente modificou o modelo de isquemia gradual mais e explorou seus efeitos no mais isquemia e suscetíveis BALB / c do mouse estirpe 23. Na primeira manifestação do modelo, colocado constrictors tanto no proximal e artéria femoral distal, mas deixou todos os ramos laterais intacta. Em uma segunda modificação, mais suave, colocamos um único constrictor apenas na artéria femoral proximal e novamente à esquerda todos os colaterais ramos da artéria intacta. Em ambas as modificações deste modelo, descobrimos que os ratos BALB / c, mas não camundongos C57BL / 6, exibido necrose muscular significativa, apesar de ter o fluxo sanguíneo semelhante e densidade vascular. Semelhante ao nosso estudo anterior 14, estes resultados demonstraram que muscular de membroso prejuízo não é apenas influenciado pelo fluxo sanguíneo, mas é em parte dependente de fundo genético. Além disso, descobrimos que o fluxo sanguíneo do membro caiu para seu ponto mais baixo dentro de 3 dias, assim, o modelo parece ser mais um dos "subaguda" em vez de isquemia gradual.
Com base nestes estudos prévios, parece claro que um método único para a indução de isquemia dos membros posteriores pode não ser adequado em todos os casos. Por causa de uma variedade de condições (por exemplo, diferenças genéticas e a presença ou ausência de condições co-mórbidas) influenciam tanto a vascular e respostas específicas do músculo esquelético, os investigadores podem encontrar-se necessário modificar a cronicidade e / ou a gravidade de isquemia dos membros posteriores de melhor atender às suas finalidades. Além disso, as descrições anteriores do modelo normalmente faltava marcos anatômicos adequados para facilitar confiável reprodutibilidade inter-examinador da técnica. Neste trabalho, métodos para induzir isquemia dos membros posteriores aguda ou subaguda em ratossão descritos, e as estruturas anatómicas precisos são fornecidos.
Protocolo
Todos os experimentos com animais foram realizados de acordo com o protocolo aprovado pelo Comitê de Cuidado e Uso do Duque Institucional Animal. ratos machos foram utilizados neste estudo, apesar de ambos os sexos, pode ser utilizado como indicado para o objectivo científico do estudo.
1. Remoção do cabelo
- Antes da indução da anestesia, configurar uma área de preparação de pré-cirúrgico constituído por uma almofada de aquecimento coberto fixada em 37 ° C e uma porta de nariz cónico ligado ao fluxo contínuo de isoflurano.
- Posicione o mouse na câmara de indução da anestesia. Ajuste o medidor de fluxo de O2 a 1 L / min e isoflurano a 1 - 3%.
NOTA: A anestesia é tipicamente induzido em um rato de 25 g com isoflurano a 2%. - Verificar a resposta de estímulo do rato-o suavemente a câmara e observando a falta de um reflexo de endireitamento.
- Lavar a câmara com O2 para limpar o isoflurano antes da abertura. mova rapidamente o mouse para o aquecimento panúncio e conectá-lo ao isoflurano via o cone do nariz.
- Ajustar o isoflurano a 1,5%. Verifique a resposta ao estímulo por pedal reflex (pitada tep).
- Aplique lubrificante oftálmica liberalmente a ambos os olhos para evitar a secagem durante a cirurgia.
- Raspar o cabelo de ambos os membros posteriores utilizando um pequeno aparador elétrico. Segure a pele firmemente enquanto barbear para evitar lacerar a pele.
- Aplique o creme de depilação a pré-aquecido e deixe descansar por 1 min. Limpe suavemente com uma gaze umedecida.
- Para o procedimento cirúrgico em um momento posterior, desligue o isoflurano e mova o mouse para uma gaiola de recuperação forrado de papel toalha vazio para garantir o mouse não aspirar a roupa de cama gaiola. Monitorar o animal até que ele é capaz de manter decúbito esternal. Caso contrário, mova o mouse para a mesa cirúrgica.
NOTA: O processo de remoção de cabelo pode irritar a pele e afetar as medições de perfusão. Recomenda-se que esperar 1 - 2 dias após a remoção de pêlos do animal antes de performing uma varredura de perfusão pré-cirúrgica ou realização de cirurgia.
Preparação 2. Pré-Cirúrgica
- Use as seguintes ferramentas durante o processo; pequenas tesouras retas cirúrgicos, 2 de ponta fina pinças anguladas, pequenas pinças Graefe, fórceps motorista agulha, 3 afastadores, tesoura pequena mola, e cotonetes de ponta fina.
- Esterilizar todas as ferramentas, utilizando uma autoclave antes do início da cirurgia. Use um esterilizador talão quente antes e entre cada procedimento cirúrgico, para até 5 animais. Esterilizar pacotes adicionais de ferramentas cirúrgicas para cirurgias de grupos superiores a 5.
- Preparar um campo cirúrgico estéril que consiste numa almofada de aquecimento coberto e uma porta de isoflurano. Executar todo o trabalho sob um microscópio de dissecção 10 estéreo.
- Anestesiar e preparar o rato, tal como descrito nas etapas 1.1 a 1.5.
- Verifique se o mouse está totalmente sedado e coloque em uma posição supina na mesa cirúrgica. Prenda as duas pernas com fita cirúrgica.
- Se estiver usando uma temperatura controlada almofada de aquecimento, coloque a sonda de temperatura e fixá-lo à base da plataforma cirúrgica usando fita cirúrgica para garantir que ele não será acidentalmente puxado para fora durante o procedimento.
- Limpar o local da incisão usando 3 alternadas iodopovidona e álcool toalhetes. Cobrir o animal com um penso cirúrgico estéril e cortar um furo para expor o local da incisão.
3. Indução de isquemia
- Usar um bisturi para fazer uma incisão inicial ao longo do centro da coxa medial, correndo a partir do joelho para o abdómen, e alongar a incisão de cerca de 1 cm com uma tesoura fina (Figura 1A).
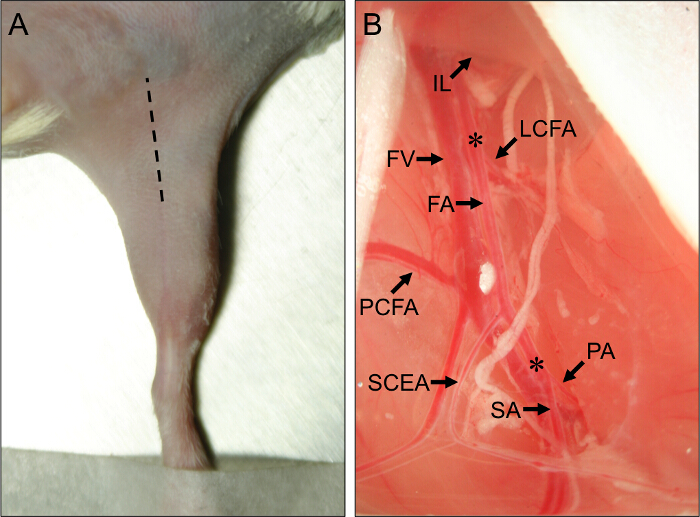
Figura 1. Sítio Cirúrgico e vasculares anatômicas Marcos para Cirurgia Rato dos membros posteriores isquemia. (A) Visão externa dao membro posterior de um rato em decúbito dorsal. A linha chocado indica o local da incisão para executar corretamente os procedimentos hindlimb isquemia. (B) Vista do proximal vasculatura do mouse hindlimb. A extremidade proximal da artéria femoral (AF) se coloca por baixo do ligamento inguinal (IL). A extremidade distal do FA está localizado na sua bifurcação para a artéria popliteal (PA) e a artéria safena (SA). Os principais artérias colaterais fora da FA são a artéria lateral do circunflexo femoral (AGCL), o proximal caudal da artéria femoral (pCFA), ea artéria epigástrica caudal superficial (SCEA). A veia femoral (FV) corre ao lado da FA, e ramos venosos pode ser visto em paralelo às principais ramos arteriais. Os asteriscos (*) indicam os locais proximal e distal para a colocação de constrictors AMEROID ou ligaduras, dependendo se será induzida subaguda ou isquemia aguda. Por favor, click aqui para ver uma versão maior desta figura.
- Utilizando uma pinça, abrir a incisão e expor a membrana que cobre o tecido de gordura inguinal (IFT).
- Utilizando-forceps fechadas, perfure através da membrana para a separação entre o IFT eo abdômen. Suavemente libertar a pressão sobre a pinça para separar a IFT dos músculos abdominais, expondo o feixe neurovascular por baixo. Observe a proximal e ramos caudais superficiais como marcos anatômicos importantes (Figura 1B).
- Inserir um retractor e puxar o tecido abdominal proximal para expor o constritor ameróide ou ligadura local proximal, imediatamente proximal à artéria femural circunflexa lateral (Figura 1B). A artéria circunflexa lateral situa-se cerca de 5 mm proximal ao proximal e artérias caudais superficiais.
- Inserir mais de dois afastadores para a parte distal da incisão, medial e lateral, para puxar a IFT distalmente longe dolocal da cirurgia para alargar o campo cirúrgico.
- Use duas pinça fina para remover a membrana mais externa que abrange o feixe neurovascular. Insira com cuidado metade da ponta da pinça fina entre a veia e artéria, deslizando a ponta fórceps sob a membrana que os une. Feche a pinça e gentilmente rasgar a membrana.
- Inserir a ponta de uma pinça fechadas entre a veia e a artéria e criar uma folga entre eles pela libertação da pressão sobre a pinça. Repita esta técnica para criar um fosso entre a artéria e nervo.
- Para subaguda isquemia, colocar um constritor ameróide na artéria femoral proximal (Figura 2).
- Para instalar o constrictor ameróide proximal, deslize a ponta de uma pinça sob a artéria femoral para o isolar o feixe neurovascular. Usar um segundo conjunto de pinças angled- para prender a borda do constrictor e guiá-lo sob a artéria femoral.
- Coloque a artéria femoral para as smuito no constrictor. Repetir para o constritor distal, posicionando-o imediatamente proximal à bifurcação da artéria femoral para a artéria popliteal e artéria safena (Figura 2).
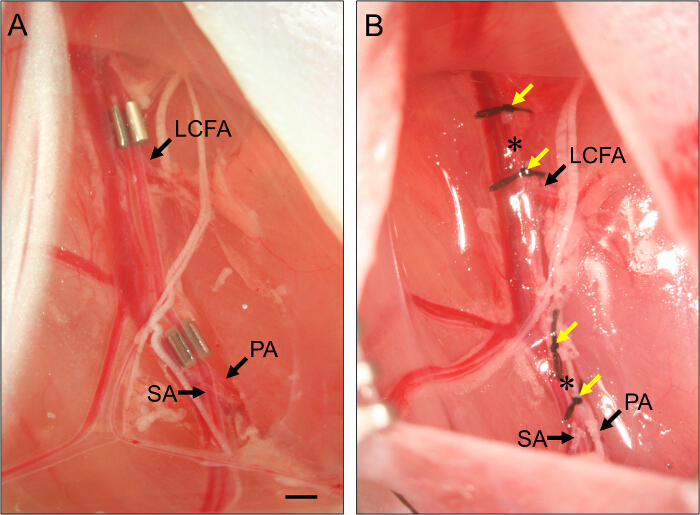
Figura 2. Colocação de AMEROID Constrictors e ligaduras. (A) Exemplo de dois constrictors AMEROID colocados na artéria femoral para induzir subaguda hindlimb isquemia. O constritor proximal é colocada imediatamente proximal à artéria femural circunflexa lateral (AGCL). O constrictor distal é colocada imediatamente proximal à bifurcação da poplítea (PA) e as artérias safena (SA). Constrictors são instalados com a ranhura voltada para cima para garantir a artéria está devidamente definido dentro do constrictor. (B) Exemplo de ligaduras de artéria femoral para induzir isquemia dos membros posteriores aguda. LigaturES (setas amarelas) são colocadas de tal forma que eles flanquear a posição dos constritores no painel (B), e a artéria femoral é seccionado entre cada conjunto de duas ligaduras (asteriscos). Bar, 1 mm. Por favor clique aqui para ver uma versão maior desta figura.
- Para isquemia aguda, ligar e transecto a artéria femoral proximal.
- Para transecção da artéria femoral, linha 7 - O fio de sutura sob a artéria imediatamente proximal à posição do constrictor proximal (ver Passo 3.7) e ligar. Amarrar uma segunda ligadura cerca de 1 mm distai em relação à primeira.
- Use uma tesoura de mola para transecto a artéria entre as duas ligaduras. Para a transecção arterial distal, repita essas etapas, colocando duas ligaduras cerca de 1 mm, apenas proximal à bifurcação da artéria femoral para a artéria poplítea ea artéria safena, mas garantindo que eles são distal ao CAUD superficialal artéria epigástrica (ver Figura 1)
- Fechar a incisão utilizando interrompido 5 - suturas Vicryl S.
4. Perfusão de imagem
- Mova o mouse para a 37 ° C de aquecimento pad definido sob o imager laser Doppler perfusão (LDPI) e se conectar através de um cone do nariz para a fonte de isoflurano. Se não está disponível monitor de temperatura, permitir que 5 min para o ratinho se aquecer até 37 ° C.
- Ligue o gerador de imagens e lançar o software de captura de imagem.
- Clique no ícone 'Nova Imagem Única "para abrir a janela" Configuração do scanner'. Defina o "Tamanho de Leitura 'para' Grande 'e' Speed Scan 'para' 4 ms / pixel '. Definir a área de digitalização, alterando os valores x e y no âmbito da "Área de Digitalização (unidades) 'painel.
- Clique na guia 'Video and Distance' para ver o vídeo, e organizar o mouse para encaixar na área de digitalização indicado por um contorno vermelho. Clique em 'Auto Distance' para calibrara distância entre o laser para o sujeito. Clique em "Avançar" para abrir a janela dos detalhes sujeito ".
- Insira as informações de assunto e quaisquer observações pertinentes. Clique no botão 'Seguinte' para avançar para a janela de digitalização.
- Clique no botão "Iniciar medição 'para abrir o' Confirmar ou Ignorar Verificação Distance 'diálogo. Clique em "OK" para confirmar a distância de varredura. Observe o processo de digitalização começar e correr para 4-8 min, dependendo do tamanho da área de digitalização.
- Após a digitalização estiver concluída, observe a janela "Salvar como". Nomeie o arquivo e salvá-lo.
- Desligue o isoflurano e mova o mouse para uma gaiola de recuperação vazia e monitorar até que o animal é capaz de manter decúbito esternal. Nunca coloque um rato a recuperar da anestesia em uma gaiola com outros ratos.
- Abra o software de análise de imagem. Clique no ícone 'Open' e procurar e abrir o arquivo de imagem para análise. Na janela do arquivo, observe o fluxo,fotografias, e imagens coloridas do mouse.
- Para marcar a região de interesse (ROI) na imagem fluxo, clique no ícone 'Mostrar ROIs'. Em seguida, clique no botão "Adicionar Polígono 'e arraste o cursor em torno do membro não-cirúrgico para desenhar o ROI. Botão direito do mouse para fechar a forma. Escolha 'Adicionar Polígono' novamente e desenhe um ROI de correspondência em torno do membro cirúrgica.
- Clique no ícone 'Estatísticas' para abrir o 'Imagem Resultados ROIs Estatística (PU)' janela. Observe a diferença percentual em fluxo na coluna 'Flux%'.
NOTA: A primeira ROI elaborado servirá como referência.
NOTA: Antes de cada cintilografia de perfusão subsequente siga os passos descritos na Seção 1 para anestesiar o rato e nos passos 4.1 a 4.11 para a imagem do animal.
Resultados
identificação adequada da vasculatura do mouse hindlimb é fundamental para garantir a reprodutibilidade das técnicas para induzir tanto subaguda e isquemia dos membros posteriores aguda, conforme descrito aqui. Além da variação inerente em estudos com animais, outros factores podem introduzir variabilidade na imagiologia de perfusão de Doppler a laser (LDPI), incluindo o tipo de anestesia, a posição do animal (comparada propenso supina), e a temperatura do corpo (ver <...
Discussão
Talvez o passo mais desafiadora no presente processo é a separação da artéria femoral a partir da veia femoral. O maior diâmetro e mais finas paredes da veia femoral em comparação com aqueles da artéria aumentar a sua susceptibilidade para perfurar e rasgar durante a manipulação cirúrgica. A probabilidade de perturbar a veia pode ser reduzido, mantendo a ferida húmida utilizando uma zaragatoa estéril humedecida com PBS. É também importante para garantir que todos os fórceps são afiadas, alinhados, e liv...
Divulgações
The authors have no conflicts of interest to disclose.
Agradecimentos
This study was supported by NIH grants R21HL118661, R56HL124444, and R01HL124444 to CDK, and by NIH grants R00HL103797 and R01HL125695 to JMM.
Materiais
| Name | Company | Catalog Number | Comments |
| Dumont #5/45 Forceps | Fine Science Tools | 11251-35 | Dumoxel |
| Dumont Style 5 Mini Forceps | Fine Science Tools | 11200-14 | Inox |
| Extra Fine Bonn Scissors | Fine Science Tools | 14084-08 | |
| 7 - 0 Silk Suture | Sharpoint | DA-2527N | |
| 5 - 0 Coated Vicryl Suture | Ethicon | J463G | |
| Graefe Forceps | Fine Science Tools | 11053-10 | |
| Vannas Spring Scissors | Fine Science Tools | 15000-03 | |
| Artifical Tears Ointment | Rugby Laboratories | 0536-6550-91 | |
| Surgical Tape | 3M | 1530-0 | |
| Fine Cotton Swabs | Contec | SC-4 | |
| Temperature Controller | Physitemp | TCAT-2DF | |
| Ameroid Constrictors | Research Instruments SW | MMC-0.25 x 1.00-SS | |
| Hot Bead Sterilizer | |||
| Deltaphase Isothermal Pad | Braintree Scientific | 39DP | |
| Needle Driver | Fine Science Tools | ||
| Phosphate Buffered Saline | Gibco | 10010-023 | |
| Moor LDPI | Moor Instruments | moorLDI2 | |
| moorLDI Measurement software | Moor Instruments | v. 6.0 | |
| Hair Removal Cream | Nair |
Referências
- Criqui, M. H., Aboyans, V. Epidemiology of peripheral artery disease. Circ. Res. 116, 1509-1526 (2015).
- Thukkani, A. K., Kinlay, S. Endovascular intervention for peripheral artery disease. Circ. Res. 116, 1599-1613 (2015).
- Vartanian, S. M., Conte, M. S. Surgical intervention for peripheral arterial disease. Circ. Res. 116, 1614-1628 (2015).
- Bonaca, M. P., Creager, M. A. Pharmacological treatment and current management of peripheral artery disease. Circ. Res. 116, 1579-1598 (2015).
- Conte, M. S., et al. Design and rationale of the PREVENT III clinical trial: edifoligide for the prevention of infrainguinal vein graft failure. Vasc Endovascular Surg. 39, 15-23 (2005).
- Pomposelli, F. B., et al. A decade of experience with dorsalis pedis artery bypass: analysis of outcome in more than 1000 cases. J. Vasc. Surg. 37, 307-315 (2003).
- Willigendael, E. M., et al. Smoking and the patency of lower extremity bypass grafts: a meta-analysis. J. Vasc. Surg. 42, 67-74 (2005).
- Schillinger, M., et al. Balloon angioplasty versus implantation of nitinol stents in the superficial femoral artery. N. Engl. J. Med. 354, 1879-1888 (2006).
- Marmagkiolis, K., et al. 12-month primary patency rates of contemporary endovascular device therapy for femoro-popliteal occlusive disease in 6,024 patients: beyond balloon angioplasty. Catheter. Cardiovasc. Interv. 84, 555-564 (2014).
- Rosenfield, K., et al. Trial of a Paclitaxel-Coated Balloon for Femoropopliteal Artery Disease. N. Engl. J. Med. 373, 145-153 (2015).
- Tepe, G., et al. Drug-coated balloon versus standard percutaneous transluminal angioplasty for the treatment of superficial femoral and popliteal peripheral artery disease: 12-month results from the IN.PACT SFA randomized trial. Circulation. 131, 495-502 (2015).
- Couffinhal, T., et al. Mouse model of angiogenesis. Am. J. Pathol. 152, 1667-1679 (1998).
- Niiyama, H., Huang, N. F., Rollins, M. D., Cooke, J. P. Murine model of hindlimb ischemia. J Vis Exp. , (2009).
- McClung, J. M., et al. Skeletal muscle-specific genetic determinants contribute to the differential strain-dependent effects of hindlimb ischemia in mice. Am. J. Pathol. 180, 2156-2169 (2012).
- Dokun, A. O., et al. A quantitative trait locus (LSq-1) on mouse chromosome 7 is linked to the absence of tissue loss after surgical hindlimb ischemia. Circulation. 117, 1207-1215 (2008).
- Rivard, A., et al. Age-dependent impairment of angiogenesis. Circulation. 99, 111-120 (1999).
- Hazarika, S., et al. Impaired angiogenesis after hindlimb ischemia in type 2 diabetes mellitus: differential regulation of vascular endothelial growth factor receptor 1 and soluble vascular endothelial growth factor receptor 1. Circ. Res. 101, 948-956 (2007).
- Couffinhal, T., et al. Impaired collateral vessel development associated with reduced expression of vascular endothelial growth factor in ApoE-/- mice. Circulation. 99, 3188-3198 (1999).
- Tang, G. L., Chang, D. S., Sarkar, R., Wang, R., Messina, L. M. The effect of gradual or acute arterial occlusion on skeletal muscle blood flow, arteriogenesis, and inflammation in rat hindlimb ischemia. J. Vasc. Surg. 41, 312-320 (2005).
- Yang, Y., et al. Cellular and molecular mechanism regulating blood flow recovery in acute versus gradual femoral artery occlusion are distinct in the mouse. J. Vasc. Surg. 48, 1546-1558 (2008).
- Litvak, J., Siderides, L. E., Vineberg, A. M. The experimental production of coronary artery insufficiency and occlusion. Am. Heart J. 53, 505-518 (1957).
- Bredee, J. J. An improved ameroid constrictor. Preliminary communication. J. Surg. Res. 9, 107-112 (1969).
- McClung, J. M., et al. Subacute limb ischemia induces skeletal muscle injury in genetically susceptible mice independent of vascular density. J. Vasc. Surg. , (2015).
- Hellingman, A. A., et al. Variations in surgical procedures for hind limb ischaemia mouse models result in differences in collateral formation. Eur. J. Vasc. Endovasc. Surg. 40, 796-803 (2010).
- Kochi, T., et al. Characterization of the arterial anatomy of the murine hindlimb: functional role in the design and understanding of ischemia models. PloS one. 8, e84047 (2013).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados