需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
了解溶解有机物生物地球化学通过
摘要
溶解有机物提供能量和营养流生态系统的一个重要来源。在这里,我们展示了一个基于现场的方式,通过很容易复制的营养脉冲操纵原位溶解有机物环境池。
摘要
Dissolved organic matter (DOM) is a highly diverse mixture of molecules providing one of the largest sources of energy and nutrients to stream ecosystems. Yet the in situ study of DOM is difficult as the molecular complexity of the DOM pool cannot be easily reproduced for experimental purposes. Nutrient additions to streams however, have been shown to repeatedly alter the in situ and ambient DOM pool. Here we demonstrate an easily replicable field-based method for manipulating the ambient pool of DOM at the ecosystem scale. During nutrient pulse experiments changes in the concentration of both dissolved organic carbon and dissolved organic nitrogen can be examined across a wide-range of nutrient concentrations. This method allows researchers to examine the controls on the DOM pool and make inferences regarding the role and function that certain fractions of the DOM pool play within ecosystems. We advocate the use of this method as a technique to help develop a deeper understanding of DOM biogeochemistry and how it interacts with nutrients. With further development this method may help elucidate the dynamics of DOM in other ecosystems.
引言
溶解有机物质(DOM)提供了一个重要的能量和营养源的淡水的生态系统和被定义为通过0.7微米的过滤器通过有机物。在水生生态系统,DOM也能影响光衰减和金属络合。 DOM是具有各种官能团的有机化合物,以及必需的营养物质,如氮(N)和磷(P)的高度多样化和不均匀混合物。而"DOM"介绍,包括其C,N和P分量整个池,其浓度作为溶解有机碳(DOC)测定。在DOM池固有的复杂分子然而,造成其研究的挑战。例如,有测量由有机营养物如溶于有机氮(DON)和可溶性有机磷(DOP)的总的DOM池的分数没有直接的方法。相反,有机营养的浓度必须通过差来确定( 如:[DON] = [总溶解氮] - [无机氮])。
添加一个现实的DOM修正案到流是困难的,因为环境的DOM池的多样性。以前的研究已经加入单一碳源( 如葡萄糖,尿素1) 或如落叶层渗滤液2特定源来操纵在外地的浓度。不过,这些来源不是特别有代表性的环境DOM池。试图缩小或集中用于随后的实验环境的DOM也造成了困难,包括某些馏分( 如高度不稳定分量)的处理过程中的损失。其结果是,它是很难理解的周围的DOM池对照,因为我们目前不具备任何方法直接操作环境的DOM池。然而,由于DOM的生物地球化学被链接到在环境中常见的营养物质( 例如尼特率[NO 3 - 3),我们可以添加其他溶质流生态系统和测量DOM池这些操作的响应。通过检查DOM池如何响应广泛的实验实行营养浓度,我们希望能够更加深入地了解DOM如何应对波动的环境条件。
在流生物地球化学常用的一种方法是在营养物添加方法。营养除了实验历来被用来理解吸收动力学或添加溶质4,5,6,7的命运。营养增补可以是对小时6天标尺4,或长期操作过的多个年8过程的短期。营养增补还可以包括同位素标记的营养素( 例如 ,15 N-NO 3 - )通过生物地球化学反应来跟踪添加营养素。然而,基于同位素研究往往EXPEnsive并要求多个底栖车厢,其中同位素标记的营养素可以保留的具有挑战性的分析( 如消化)。最近的实验揭示了短期脉冲营养素的效用阐明非加和环境溶质,如DOM 9,10对照,揭示由检查原位生物地球化学反应实时的新方法。在这里,我们描述和证明密钥的方法步骤,以了解C,N及具体的控制的耦合生物地球化学的高度多样化的DOM池的目标进行短期养分脉冲。此容易再现方法包括添加营养脉冲的实验流达到并测量在这两个操纵溶质和感兴趣的响应变量( 如 DOC,DON,DOP)的浓度变化。 通过原位直接操纵营养物浓度,我们能够间接改变DOM游泳池和检查跨越营养浓度10的动态范围DOM浓度如何变化的。
研究方案
1.识别和表征的理想的实验流达到
- 确保实验流达到足够长,以促进溶质11和足够长的时间可以发生生物吸收的完全混合。河段长度可流和实验而异。在小一阶水源流,达到的长度可以从20〜150米(或更长,如果系统需要它),这取决于放电和流的其他物理特性而变化。
- 从实验达到排除大池,因为它们阻止溶质,最小流部分,并且该稀释加入溶液支流的下游移动。低排放的时间可能需要缩短到达长度,同时更高的放电可能需要更长的范围。
- 在实验流达到一浅滩上方的顶部确定的位置,以促进加入的溶质的混合。这将是除部位。在实验流的底部到达,查明流被收缩和代表性的总流量的约90%( 图1)的位置。这将是样品收集点。

图1:下游采样点为例理想的采样点是大部分流量是收缩,无流道和底栖生物的扰动很方便。在这里,木材碎片堕落一块创造了一个小的一级水源流这个采样点。 请点击此处查看该图的放大版本。
- 获得感兴趣之前实验溶质的流量测量和背景营养物浓度,以计算所需的MANIP溶质的质量ulations。请参阅步骤2.2.1计算。
- 得到背景浓度数据进行操纵的目标溶质( 例如 NO 3 - )和氯(Cl -的),它经常被用作示踪剂。使用保守示踪剂在这些实验中的情况下,跟踪于电导率的变化,这表明营养脉冲在采样到站并且其中脉冲穿过速率。电导率或电导率,是在保守的示踪剂浓度的原地变化的替代品。
- 通过收集辅助数据,如覆盖宽度和深度,温度,pH和溶解氧表征实验达到的生理化学性质。
- 执行无法与使用环境探测器( 例如宽度和深度),一天中的之前或以尽量减少任何底栖ö实验后立即进行的测量流道R内的化学紊乱。划分在等距横断面实验距离( 例如,每10米),其中宽度和至少3个深度测量可评估( 例如 ,右行,深谷底线和左行)。这些数据是有价值的连接流到生物地球化学测量的物理性质,并且如果研究者也有兴趣在计算养分摄取动力学和参数6。
2.准备实验
- 确定使用下面的概述的方程操纵所需溶质的质量(kg)。
注意:以下示例适用于基于硝酸盐实验NO 3 -在硝酸钠的形式(纳米3),并假定3倍的上述背景有针对性的增加(公式是基于这些基尔帕特里克和科布12)。在本实施例以下假设已与水库面面观背景条件:排放量= 10升/秒; [CL] = 10毫克/升; [NO 3 - ] = 50微克N / L。由于实验中的变化,调整所需的输入数据。- 计算目标增加(等式1):
目标[NO 3 -微克N / L]增加=预计背景[NO 3 -微克N / L] *有针对性的增加
150微克N / L = 50微克N / L * 3 - 计算总原子质量通量(式2):
总原子质量通量(NO 3 -微克N)= 30分钟* 60秒* Q(L /秒)*针对性[NO 3 -微克N / L]增加
其中,30分钟溶质峰12的假设持续时间和Q是放电
2 700 000微克N = 30分钟* 60秒* 10升/秒* 150微克N / L - 计算总分子质量通量(等式3):
总分子质量通量(NO 3 -微克N)=总原子质量通量(NO 3 -微克N)/原子质量(14)*分子,我们飞行(85)
其中,原子质量指N和分子量指的NaNO 3。
16,392,857.14微克N = 270万微克N /(14 * 85) - 计算质量增加(方程4):
大众加(G)=总分子量通量(NO 3 -微克N)1 / 1000000-克/微克
16.39克硝酸钠 = 16,392,857.14微克N /百万克/微克
注意:按照上述计算任何其他溶质,包括保守示踪剂( 如氯化钠)。确保调整原子和分子群众利益的溶质。
- 计算目标增加(等式1):
- 准备前一天现场实验的所有溶质。掂量出足够的溶质,以提高这两个生物示踪剂和示踪剂的环境浓度的三倍(或期望的量)以上的背景。重要的是,加入的溶质的量将导致上述背景浓度的可测量变化足以创建AWIDE动态范围,增加营养浓度。
- 称重使用分析天平溶质,并随后在适当的标签清洁酸洗高密度聚乙烯瓶储存。生物示踪剂的实例包括:NO 3 - :硝酸钠(纳米3); NH + 4:氯化铵(NH 4 Cl)的; PO 4 -3:磷酸钾(K 2 HPO 4)。然而,生物示踪剂的选择将是被要求的生物地球化学问题的功能。保守示踪剂选项包括氯化钠(NaCl)和溴化钠(溴化钠)。
- 收集剩余材料:现场的书,标签胶带和钢笔,现场卷尺,冷却器,电导率仪,〜20升桶和大型搅拌棒( 如啤酒桨,螺纹钢,大棒),约50清洁和酸洗125毫升高-density聚乙烯瓶。标签125 ml瓶装#1-50。
注释:LESS大于50个样品,可采取每次实验和背景样本包括在50总瓶。 - 可选:根据现场人员的数量,进行现场采样滤波(见#5)。如果选择此选项,带来50清洁,预标记和酸洗60毫升高密度聚乙烯瓶进入该领域。标签上的60毫升瓶#1-50匹配125 ml收集瓶。
3.设置的天
- 部署在收集现场实地电导率仪。将上游的仪器,其中样品将被采取因此样本采集不仪器读数干扰(约0.5〜1.0米)。仪器会保持在原位整个实验。字段电导率仪是最好的,因为它提供了实时的电导率读数,这是必需的,以确定在采样率(参见步骤5.2)和过滤和分析顺序(步骤5.3和6.1)。
- 收集125毫升背景SAMPLES在在添加位点,一式三份,并在之前加入该溶液的实验触及的收集站。这些数据将被用于验证环境浓度日,并确定在沿流达到溶质浓度变化。这些数据也有价值连接环境流化学: -对感兴趣的生物地球化学测量( 如 DOC NO 3比13)。
- 记录收集的背景样本的时间和电导率。
- 记录数据流的背景电导另外的解决方案之前。
4.添加溶质
- 倒入所有试剂(16.39克硝酸钠3号和第1483克氯化钠),成为一个大的容器( 如 20升桶),并补充足够的溪水完全溶解溶质。冲洗试剂容器用三次附加流水,倒到冲洗液容器。跟踪的水量增加。
- 例如,使用500毫升一瓶河水倒入容器中。搅拌溶液,直到所有的试剂已经被完全溶解。
- 收集60毫升等分加液。远离所有其他样品这种高度浓缩的样品中分离( 如拉链锁袋),以尽量减少交叉污染。这些样品是重要的,如果计算养分摄取动力学6是该研究项目的另外的目标,因为这些样品可被用于确定加入溶质的精确质量。
- 倒入溶液倒入另外的网站。浇解决方案顺利和快速的动作,尽量减少出行滞后时间和飞溅能够降低加试剂的量做到这一点。冲洗除了保证所有试剂已被添加到流后,立即在容器和搅拌棒的流中三次。
- 记录溶液中加入时间:小时:分:秒。
- 记录示踪剂增加群众( 如 硝酸钠和氯化钠)。
- 该解决方案已经被添加后,不打扰流。确保沿流的所有旅行对银行发生,以确保流底栖生物和溶液本身不受到干扰。
5.现场取样
- 按升序排列顺序采样瓶,等待解决到达采样位置。旅行时间将放电的功能,并达到长度,并且可以提前确定(一天之前)或者用NaCl仅注射或若丹明染料(可用于建立行程时间14)。
注意:如果在DON为主题的项目时,应避免使用罗丹明,因为它是一种DON,因此将改变环境DON池,如果在研究中达成任何遗迹。

图2:溶质穿透曲线的实施例示意图(BTC)。一个BTC表示随时间的溶质浓度的变化,并且可以用来解释示踪剂的转运和生物地球化学循环流中。抓斗采样应在整个BTC可以采取,让平等代表权的上升和BTC降四肢都的频率。 请点击此处查看该图的放大版本。
- 样品采集
注:涵盖范围广泛的样本采集的目的,就是通过曲线(BTC)( 图2),以充分代表沿断裂的肢体上升和下降的溶质浓度的变化。- 在该溶液(通过增加导电率检测)的到来,通过保持125毫升瓶入水在取样点处的主流收集在整个BTC125毫升瓶样品。快LY冲洗瓶子用溪水和丢弃冲洗下游再取样品。帽样品并放入凉。
- 记录时间(小时:分钟:秒)和电导率沿BTC取入字段书( 表1)每个样品的。
- 收集基于时间( 例如 1分钟的间隔),或者基于所述速率电导率的变化的样品。例如,如果电导率变化很快,采样每30-60秒直到在导电性缓慢的变化,在哪些时间样本可采取每次5-10分钟。对于基于导电率的时间间隔,取样品每15-30单位根据是在电导率变化率。
- 样品电导率,直到返回到后台或背景条件5μS/ cm的范围内。样品收集的时间间隔可在实验过程中,只要BTC在抓取样品中公表示进行调整。
| 瓶子 # | 电导率 | 时间 | 笔记 |
| 1 | 小时:分:秒 | 例如,背景(下游) | |
| 2 | 例如,背景(下游) | ||
| 3 | |||
| 4 | |||
| 五 | 如在高峰电导样本 | ||
| 。 | |||
| 。 | |||
| 。 | |||
| 最高瓶# |
表1PField书:示例Page从实验室簿和所需信息
- 样品过滤
注:样品的过滤可以在现场或在返回到实验室进行。- 从上升肢体筛选样品中上升的电导率,直至电导率峰值顺序。等待实验结束了,过滤器的样品从电导率的升序肢体下降( 即开始与最后的采样,向峰值比电导率向后工作)。
注:样品的这种顺序减少样品间的交叉污染,并允许对于相同的过滤器,注射器,和过滤器保持器,只要被用作过滤器时,注射器和过滤器保持器在每个样品之间被适当冲洗(见步骤5.3.2- 5.3.4)。 - 从60毫升注射器,然后关闭止水栓取出活塞。倒入约10毫升的样品到注射器中,并返回柱塞注射器。摇动注射器使样品冲洗注射器的内部的壁。附注射器,过滤架和开放式止水栓。通过推过滤架样品和丢弃冲洗。
- 拆下柱塞和关闭止水栓。倒入约30毫升的样品到注射器中,并返回柱塞注射器。开放式股票型公鸡排出通过〜10毫升过滤架和进60毫升取样瓶。盖上瓶子,用滤液漩涡并丢弃。重复此步骤,共3漂洗。这将确保任何杂质已从上的60毫升样品瓶中取出,该壁涂有样本。
- 拆下柱塞和关闭止水栓。倒〜60 mL样品到注射器中,并返回柱塞注射器。通过过滤器保持器并进入上的60毫升样品瓶推样品。灌装瓶到肩膀,以防止结冰时瓶子开裂。盖瓶并放入凉。
- 重复步骤5.3.2-5.3.4所有剩余的样品。改变上升和下降的肢体样本,以尽量减少污染的过滤器。
- 运输样本回在同一天,在冰上的实验室。
- 从上升肢体筛选样品中上升的电导率,直至电导率峰值顺序。等待实验结束了,过滤器的样品从电导率的升序肢体下降( 即开始与最后的采样,向峰值比电导率向后工作)。
6.准备实验室分析
- 如果样品的过滤是在实验室发生,按照协议,如第5.3.1所述。从升,并在提高电导率的顺序降的BTC四肢两个滤波器采样。改变上升肢和下降沿肢样本之间的过滤器。
- 在-20℃下直到分析冷冻过滤的样品。
- 确保分析设施配备,以处理高浓度的样品。
注意:有些实验室不具备运行高度浓缩的样品,因此,应注意。合并准备的标准,即捕获预计溶质浓度较高端。高浓度的标准将有助于确保捕获操纵溶质浓度的预期范围内的标准曲线。 - 样本分析从低到所有的分析仪器高导电性。从低订购样品到高电导率高盐/营养样防止低盐/营养样品的污染。这意味着从四肢的上升和下降的样品将参照序列进行混合。
- 分析总溶解的有机碳,总溶解氮,硝酸盐和铵的样品,虽然溶质分析的确切组合将是所研究的问题的一个功能(参见Wymore 等人 10为例)。
7.数据分析
- 分析使用简单线性回归的数据。独立变量是所添加的营养物的浓度和因变量是DOM浓度无论是作为DOC或DON。图上的每一个点代表从突破曲线和样品的养分和DOC / DON浓度中品尝样品。
结果
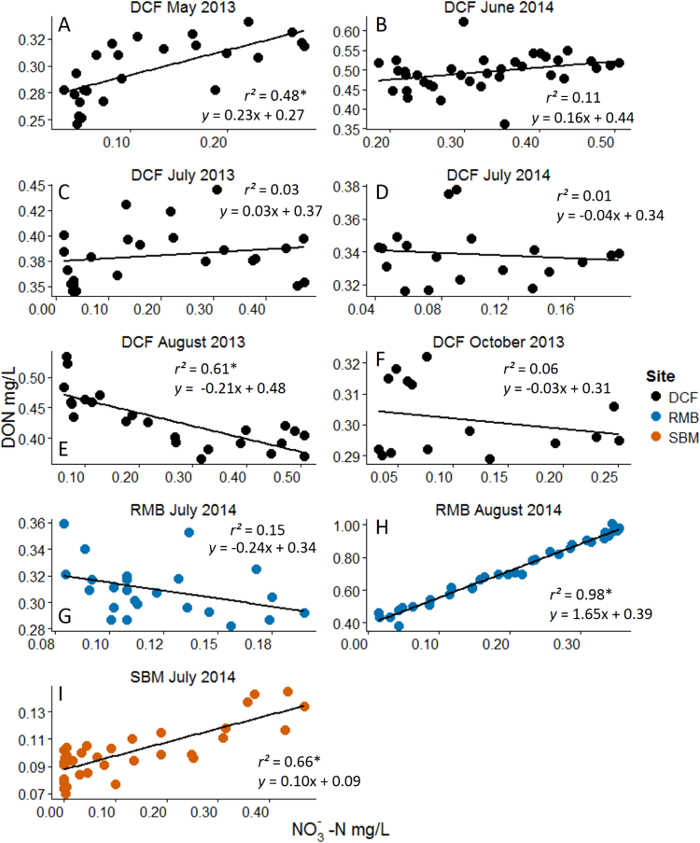
图 3: 硝酸结果示例(NO 3 - )溶解有机氮(DON)为应变量附加的分析是线性回归。星号代表在α= 0.05的统计学意义。注意NO 3的动态范围-即用营养脉冲方法来实现的浓度。不同的面板代表整个月和站点不同的实验。站点缩写指三个实验的流...
讨论
营养脉冲方法的目的,如这里提出,是表征和量化环境流水DOM的高度多样化池的两端一个附加的无机养分的动态范围的响应。如果添加溶质充分提高了反应溶质的浓度,大的推理空间可以创建理解DOM的生物地球化学循环如何链接到营养浓度。这种营养脉冲的方法是理想的,因为它涉及无用高原式加成相关联的机械的( 例如蠕动泵),并且不涉及昂贵同位素技术。这些操作是容易复制和多种...
披露声明
The authors have nothing to disclose.
致谢
The authors acknowledge the Water Quality Analysis Laboratory at the University of New Hampshire for assistance with sample analysis. The authors also thank two anonymous reviewers whose comments have helped to improve the manuscript. This work is funded by the National Science Foundation (DEB-1556603). Partial funding was also provided by the EPSCoR Ecosystems and Society Project (NSF EPS-1101245), New Hampshire Agricultural Experiment Station (Scientific Contribution #2662, USDA National Institute of Food and Agriculture (McIntire-Stennis) Project (1006760), the University of New Hampshire Graduate School, and the New Hampshire Water Resources Research Center.
材料
| Name | Company | Catalog Number | Comments |
| Sodium Nitrate | Any | Any | |
| Sodium Chloride | Any | Any | Store purchased table salt can be used as well, however, it does contain trace levels of impurities |
| Whatman GFF glass-fiber filters | Any | Any | |
| BD Filtering Syringe | Any | Any | |
| EMD Millipore Swinnex Filter Holders | Any | Any | |
| Syringe stop-cock | Any | Any | |
| YSI Multi-parameter probe | Yellow Springs International | 556-01 | |
| Wide mouth HDPE 125 ml bottles | Any | Any | |
| 60 ml HDPE bottles | Any | Any | |
| 20 L bucket | Any | Any | |
| Field measuring tape | Any | Any | |
| Lab labeling tape | Any | Any | |
| Stir stick | Any | Any | |
| Cooler | Any | Any | |
| Sharpie pen | Any | Any | |
| Field notebook | Any | Any | |
| Tweezers | Any | Any | |
| Zip-lock bags | Any | Any |
参考文献
- Brookshire, E. N. J., Valett, H. M., Thomas, S. A., Webster, J. R. Atmospheric N deposition increases organic N loss from temperate forests. Ecosystems. 10 (2), 252-262 (2007).
- Bernhardt, E. S., McDowell, W. H. Twenty years apart: Comparisons of DOM uptake during leaf leachate releases to Hubbard Brook Valley streams in 1979 and 2000. J Geophys Res. 113, G03032 (2008).
- Taylor, P. G., Townsend, A. R. Stoichiometric control of organic carbon-nitrate relationships from soils to sea. Nature. 464, 1178-1181 (2010).
- Mulholland, P. J., et al. Stream denitrification across biomes and its response to anthropogenic nitrate loading. Nature. 452, 202-205 (2008).
- Tank, J. L., Rosi-Marshall, E. J., Baker, M. A., Hall, R. O. Are rivers just big streams? A pulse method to quantify nitrogen demand in a large river. Ecology. 89 (10), 2935-2945 (2008).
- Covino, T. P., McGlynn, B. L., McNamara, R. A. Tracer additions for spiraling curve characterization (TASCC): quantifying stream nutrient uptake kinetics from ambient to saturation. Limnol Oceanogr. 8, 484-498 (2010).
- Johnson, L. T., et al. Quantifying the production of dissolved organic nitrogen in headwater streams using 15 N tracer additions. Limnol Oceanogr. 58 (4), 1271-1285 (2013).
- Rosemond, A. D., et al. Experimental nutrient additions accelerate terrestrial carbon loss from stream ecosystems. Science. 347 (6226), 1142-1145 (2015).
- Diemer, L. A., McDowell, W. H., Wymore, A. S., Prokushkin, A. S. Nutrient uptake along a fire gradient in boreal streams of Central Siberia. Freshwater Sci. 34 (4), 1443-1456 (2015).
- Wymore, A. S., Rodríguez-Cardona, B., McDowell, W. H. Direct response of dissolved organic nitrogen to nitrate availability in headwater streams. Biogeochemistry. 126 (1), 1-10 (2015).
- Stream Solute Workshop. Concepts and methods for assessing solute dynamics in stream ecosystems. J N Am Benthol Soc. 9 (2), 95-119 (1990).
- Kilpatrick, F. A., Cobb, E. D. . Measurement of discharge using tracers: U.S Geological Survey Techniques of Water-Resources Investigations. , (1985).
- Rodríguez-Cardona, B., Wymore, A. S., McDowell, W. H. DOC: NO3- and NO3- uptake in forested headwater streams. J Geophys Res - Biogeo. 121, (2016).
- Kilpatrick, F. A., Wilson, J. F. Book 3 Chapter A9, Measurement of time of travel in streams by dye tracing. Techniques of Water-Resources Investigations of the United States Geological Survey. , (1989).
- Lutz, B. D., Bernhardt, E. S., Roberts, B. J., Mulholland, P. J. Examining the coupling of carbon and nitrogen cycles in Appalachian streams: the role of dissolved organic nitrogen. Ecology. 92 (3), 720-732 (2011).
- Michalzik, B., Matzner, E. Dynamics of dissolved organic nitrogen and carbon in a Central European Norway spruce ecosystem. Eur J Soil Sci. 50 (4), 579-590 (1990).
- Solinger, S., Kalbitz, K., Matzner, E. Controls on the dynamics of dissolved organic carbon and nitrogen in a Central European deciduous forest. Biogeochemistry. 55 (3), 327-349 (2001).
- Kaushal, S. S., Lewis, W. M. Patterns in chemical fractionation of organic nitrogen in Rocky Mountain streams. Ecosystems. 6 (5), 483-492 (2003).
- Kaushal, S. S., Lewis, W. M. Fate and transport of organic nitrogen in minimally disturbed montane streams of Colorado, USA. Biogeochemistry. 74 (3), 303-321 (2005).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。