Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Понимание растворенное органическое вещество биогеохимии Через
В этой статье
Резюме
Растворенное органическое вещество является важным источником энергии и питательных веществ для потоковой экосистемы. Здесь мы показываем метод полевой основе манипулировать окружающий бассейн растворенного органического вещества на месте через легко тиражируемых импульсов питательных.
Аннотация
Dissolved organic matter (DOM) is a highly diverse mixture of molecules providing one of the largest sources of energy and nutrients to stream ecosystems. Yet the in situ study of DOM is difficult as the molecular complexity of the DOM pool cannot be easily reproduced for experimental purposes. Nutrient additions to streams however, have been shown to repeatedly alter the in situ and ambient DOM pool. Here we demonstrate an easily replicable field-based method for manipulating the ambient pool of DOM at the ecosystem scale. During nutrient pulse experiments changes in the concentration of both dissolved organic carbon and dissolved organic nitrogen can be examined across a wide-range of nutrient concentrations. This method allows researchers to examine the controls on the DOM pool and make inferences regarding the role and function that certain fractions of the DOM pool play within ecosystems. We advocate the use of this method as a technique to help develop a deeper understanding of DOM biogeochemistry and how it interacts with nutrients. With further development this method may help elucidate the dynamics of DOM in other ecosystems.
Введение
Растворенное органическое вещество (DOM), обеспечивает существенную экономию энергии и питательных веществ источник пресноводных экосистем, а также определяется как органическое вещество, которое проходит через фильтр 0,7 мкм. В водных экосистемах, DOM также может влиять на ослабление света и комплексообразование металла. DOM является весьма разнообразны и гетерогенную смесь органических соединений с различными функциональными группами, а также основных питательных веществ, таких как азот (N) и фосфора (Р). Хотя термин "DOM" описывает весь пул, включая его C, N и Р компонентов, его концентрация измеряется в виде растворенного органического углерода (DOC). Присущая молекулярная сложность DOM пула, однако, создает проблемы для ее изучения. Например, нет никакого прямого способа измерить долю общего пула DOM, состоящего из органических питательных веществ, таких как растворенного органического азота (ДОН) и растворенных органических фосфора (DOP). Вместо того, чтобы концентрация органических питательных веществ должна определяться разностью ( например , [ДОН] = [всего растворенного азота] - [растворенный неорганический азот]).
Добавление реалистичной поправки DOM в поток затруднено из-за разнообразия окружающего DOM бассейна. Предыдущие исследования добавили единичные источники углерода (например , глюкоза, мочевина 1) или конкретный источник , такой как листовой опад фильтрате 2 манипулировать концентрацией в области. Тем не менее, эти источники не являются особенно представителем окружающего DOM бассейна. Попытка уточнить или сосредоточиться окружающей среды DOM для последующего эксперимента также кованого с трудностями , включая потерю некоторых фракций (например , весьма лабильных компонентов) во время обработки. В результате, это трудно понять элементы управления на окружающий DOM бассейна, как мы в настоящее время не обладают какой-либо метод, чтобы непосредственно манипулировать окружающей среды DOM бассейн. Тем не менее, так как Биогеохимия DOM связан с питательными веществами , обычно встречается в окружающей среде (например , нитСкорость [NO 3 -] 3), мы можем добавить другие растворенные вещества для потоковой экосистемы и измерить отклик DOM пула этих манипуляций. Рассматривая, как DOM бассейн реагирует на широкий спектр экспериментально введенных концентраций питательных веществ, которые мы надеемся получить более полное представление о том, как DOM реагирует на колебания условий окружающей среды.
Один метод, обычно используемый в потоке биогеохимией является питательным веществом метод добавок. Питательные эксперименты дополнение традиционно использовались , чтобы понять поглощение кинетики или судьбу добавленного растворенного вещества 4,5,6,7. Питательные добавки могут быть краткосрочными на 6 часов в день масштабе 4 или более долгосрочных манипуляций на протяжении нескольких лет 8. Питательные добавки могут также включать в себя меченные изотопами питательных веществ (например , 15 N-NO 3 -) , чтобы проследить добавленный питательных веществ через биогеохимических реакций. Однако изотопные на основе исследования часто EXPEонительных и требуют сложных анализов (например , усваивание) из множества донными отсеков , где меченные изотопами питательные вещества могут быть сохранены. Недавние эксперименты показали , полезность краткосрочных импульсов питательных выяснить элементы управления на без добавок и окружающих растворенных веществ , таких как DOM 9,10, открывая новый способ с помощью которого можно исследовать в реальном времени на месте биогеохимических реакций. Здесь мы описываем и продемонстрировать основные методологические шаги к проведению краткосрочных импульсов питательных веществ с целью понимания в сочетании биогеохимии C и N и, в частности управления на многообразной DOM бассейна. Это легко воспроизводимый метод включает добавление питательных веществ импульс экспериментального потока досягаемости и измерения изменений в концентрации как манипулируют растворенного вещества и переменной отклика интересов (например , DOC, ДОН, DOP). За счет прямого манипулирования концентрации питательных веществ на месте , мы можем косвенно изменить DOMбассейн и изучить , как изменения концентрации РОМ через динамический диапазон концентраций питательных веществ 10.
протокол
1. Выявление и Характеризуя идеальной экспериментальной поток Reach
- Убедитесь в том, что экспериментальные поток достигает достаточно долго , чтобы способствовать полному смешиванию растворенных веществ 11 и достаточно долго , где может происходить биологическое поглощение. Длина Reach может меняться в зависимости от потоков и экспериментов. В небольших верховьях ручьев первого порядка, достигают длины может варьироваться от 20-150 м (или дольше, если система требует) в зависимости от разряда и других физических свойств потока.
- Исключить большие бассейны из экспериментальных течения, так как они тормозят движение вниз по течению растворенных веществ, минимальных сечений потока и притоков, которые разбавить -ного раствора. Времена низкого разряда может потребовать уменьшения длины досягаемости в то время как выше разряд может потребоваться больше охват.
- Определить местоположение в верхней части экспериментальной досягаемости потока над винтовке, чтобы облегчить перемешивание добавленных растворенные вещества. Это будет сайт дополнением. В нижней части экспериментального потокадостижения, определить место , где поток сужен и репрезентативную около 90% от общего потока (рисунок 1). Это будет местом сбора образцов.

Рисунок 1:. Пример ниже по течению отбора проб идеальное место выборки , где большинство потока стягивается и легко доступны без нарушения потока канала и бентоса. Здесь падший кусок дерева мусора создал эту точку выборки в небольшом потоке верховьях рек первого порядка. Пожалуйста , нажмите здесь , чтобы посмотреть увеличенную версию этой фигуры.
- Получить концентрации измерения расхода воды и питательных веществ фон растворенных веществ, представляющих интерес до экспериментов, чтобы вычислить массу растворенных веществ, необходимых для Manipленностей. Пожалуйста, смотрите расчеты в шаге 2.2.1.
- Получить данные о концентрации фона для целевого растворенного вещества манипулирования (например , NO 3 -) и хлорид (Cl -) , который часто используется в качестве консервативного трассера. Используйте консервативный трассирующими в контексте этих экспериментов, чтобы проследить изменения в проводимости, которые указывают на приход питательных веществ импульса на станции отбора проб и скорость, в которой импульс проходит. Проводимость, или удельная проводимость, является суррогатом в месте изменения концентрации консервативного трассера.
- Охарактеризуйте физико-химические свойства экспериментальной досягаемости путем сбора вспомогательных данных, таких как ширина вылет и глубину, температуру, рН и растворенного кислорода.
- Провести измерения , которые не могут быть сделаны с использованием экологического зонда (например , ширины и глубины), за день до или сразу после эксперимента, чтобы минимизировать любой бентический Oг химического возмущения в канале потока. Разделите экспериментальную охват в равноудаленных разрезах (например , через каждые 10 м) , где можно оценить ширину и по меньшей мере 3 глубины измерения (например , правый берег, тальвег, и левый берег). Эти данные имеют важное значение для подключения физических свойств потока к биогеохимических измерений и если исследователи также заинтересованы в расчете кинетики и параметров 6 поглощения питательных веществ.
2. Подготовка к эксперименту
- Определяют массу (кг) растворенного вещества, необходимого для манипуляций с помощью изложенных ниже уравнений.
Примечание: В приведенном ниже примере применяется к эксперименту нитратной основе с NO 3 - в виде нитрата натрия (NaNO 3) и предполагает целенаправленное увеличение 3x выше фона (уравнения основаны на тех Килпатрик и Кобб 12). В этом примере следующие предположения были сделаны с РезPECT в фоновых условиях: разряд = 10 л / с; [Cl] = 10 мг / л; [NO 3 -] = 50 мкг N / L. Из-за различий между экспериментами, корректировать необходимые входные данные.- Вычислить Целенаправленное увеличение (уравнение 1):
Целевые [NO 3 - мкг N / L] = ожидаемый рост фона [NO 3 - мкг N / L] * запланированное увеличение
150 мкг N / L = 50 мкг N / L * 3 - Вычислить суммарный поток атомной массы (уравнение 2):
Общий поток атомная масса (NO 3 - мкг N) не = 30 мин * 60 сек * Q (л / с) * мишенью [NO 3 - мкг N / L] увеличение
Где 30 минут это предполагаемая длительность пика растворенного вещества 12 и Q является сброс
2 700 000 мкг N = 30 мин * 60 с * 10 л / с * 150 мкг N / L - Вычислить суммарный поток молекулярной массой (уравнение 3):
Общая молекулярная масса потока (NO 3 - мкг N) = общий поток атомная масса (NO 3 - мкг N) / атомная масса (14) * молекулярное мыIGHT (85)
Там , где атомная масса относится к N и молекулярный вес относится к NaNO 3.
16,392,857.14 мкг N = 2700000 мкг N / (14 * 85) - Вычислить массу, чтобы добавить (уравнение 4):
Массовое добавление (г) = общий поток молекулярной массой (NO 3 - мкг N) / 1000000 г / мкг
16,39 г NaNO 3 = 16,392,857.14 мкг N / 1000000 г / мкг
Примечание: Следуйте вышеуказанные расчеты для любых других растворенных веществ , в том числе консервативного трассера (например , хлорид натрия). Убедитесь в том, чтобы регулировать атомные и молекулярные массы для растворенного вещества, представляющего интерес.
- Вычислить Целенаправленное увеличение (уравнение 1):
- Подготовьте все растворенные за один день до полевых экспериментов. Взвесить достаточное количество растворенных веществ, чтобы повысить концентрацию окружающей среды как биологического трассирующими и консервативного трассера три раза (или желаемое количество) выше фона. Важно, что количество добавленных растворенные вещества вызывает изменение измеримым выше фоновой концентрации, достаточной для создания AWязь динамический диапазон в концентрации добавленного питательных веществ.
- Взвесьте растворенные вещества, используя аналитические весы, а затем хранить в кислых промытую полиэтилена высокой плотности бутылки чистые с соответствующими этикетками. Примеры биологических индикаторов включают в себя: NO 3 -: нитрат натрия (NaNO 3); NH + 4: хлорид аммония (NH 4 Cl); PO 4 -3: фосфат калия (K 2 HPO 4). Тем не менее, выбор биологического индикатора будет являться функцией биогеохимическом нами вопроса. Варианты консервативных трассеров включают хлорид натрия (NaCl) и бромид натрия (NaBr).
- Соберите оставшиеся материалы: поле книги, маркировка ленты и перо, поле измерительная лента, охладитель, кондуктометр, ~ 20 л ведро и большой стержень мешалки (например , пиво весло, арматурный, большая палка), около 50 чистых и кислотоупорные промывают 125 мл высокой -плотности полиэтиленовые бутылки. Добавьте 125 мл бутылки # 1-50.
Примечание: LESS, чем 50 образцов могут быть взяты за эксперимент и фоновые образцы включены в 50-х полных бутылок. - Дополнительно: В зависимости от численности персонала на местах, выполнять фильтрацию проб на месте (смотрите раздел № 5). Если выбран этот вариант, принести 50 чистые, предварительно промаркированы и кислотно-промывают 60 мл полиэтилена высокой плотности бутылки в поле. Добавьте 60 мл бутылки # 1-50, чтобы соответствовать 125 бутылок для сбора мл.
3. День Set Up
- Развертывание кондуктометр поля на месте сбора. Поместите инструмент вверх по течению (примерно 0,5-1,0 м), где образцы будут приняты таким образом для сбора проб не мешает показаний прибора. Счетчик будет оставаться на месте в течение всего эксперимента. Измеритель поля проводимости лучше, поскольку она обеспечивает показания проводимости в режиме реального времени, которые необходимы для определения частоты дискретизации (см шаг 5.2) и фильтрацию и порядок анализа (шаги 5.3 и 6.1).
- Собрать 125 мл фона SAMPLэс в трех экземплярах на месте сложения и на месте сбора экспериментальной досягаемости перед добавлением раствора. Эти данные будут использованы для проверки изо дня в окружающей концентрации и определить изменение в концентрации растворенного вещества вдоль потока досягаемости. Эти данные не являются также ценным для подключения химии окружающей среды потока: - биогеохимической измерений интерес (например , DOC NO 3 отношения 13.).
- Запишите время и проводимость фоновых проб, собранных.
- Записывают фоновой проводимости потока перед добавлением растворов.
4. Добавление растворенных веществ
- Залить все реагенты (16,39 г NaNO 3 и 1483 г NaCl) в большой контейнер (например , 20 л ведро) и добавить достаточно струей воды , чтобы полностью растворить растворенные вещества. Промыть сосуды реагентов трижды с дополнительным потоком воды и вылить прополощите в контейнер раствором. Следите за количеством добавленной воды.
- Например, можно использовать бутылку емкостью 500 мл, чтобы вылить поток воды в контейнер. Перемешать раствор, пока все реагенты были полностью растворены.
- Сбор 60 мл аликвоты капельную раствора. Держите это высококонцентрированный образец отдельный (например , сумка на молнии замок) от всех других образцов , чтобы свести к минимуму перекрестного загрязнения. Такие образцы имеют большое значение , если кинетика поглощения питательных расчета 6 является дополнительной задачей научно- исследовательского проекта , поскольку эти образцы могут быть использованы для определения точной массы растворенных веществ добавлены.
- Налейте раствор в капельную сайт. Сделайте это путем заливки раствора в гладкой и быстрым движением, чтобы минимизировать время поездки задержки и разбрызгивание, которые могли бы уменьшить количество реагентов, добавленных. Ополосните контейнер и размешать придерживаться три раза в потоке сразу после добавления, чтобы гарантировать все реагенты были добавлены к потоку.
- Запишите время был добавлен раствор: час: мин: сек.
- Запись массы трассеров добавлены(Например , NaNO 3 и NaCl).
- После добавления раствор, не нарушают поток. Убедитесь, что все перемещаются вдоль потока происходит на берегу, чтобы гарантировать, что поток бентос и само решение не нарушается.
5. Поле выборки
- Заказать батометров в порядке возрастания, ожидая решения, чтобы прибыть к месту отбора проб. Время в пути будет функцией сброса и достигают длины и может быть определена заранее (один день до) либо с NaCl , только для инъекций или родамина красителя (который может быть использован для установления времени в пути 14).
Примечание: При работе на ДОН тематикой проекта, избегайте использования родамина красителя, так как это тип ДОН и, следовательно, будет изменять окружающий DON бассейн, если какие-либо остается в исследовании досягаемости.

Фигура 2:Пример Схема осмотически Прорыва кривой (BTC). BTC представляет изменения в концентрации растворенного вещества с течением времени и может быть использована для объяснения транзита и биохимического круговорот трассера в потоке. Образцы Grab должны быть приняты по BTC с частотой , которая дает равное представительство как к восходящих и нисходящих конечностей BTC. Пожалуйста , нажмите здесь , чтобы посмотреть увеличенную версию этой фигуры.
- Сбор образцов
Примечание: всеохватывающего цель сбора образцов, чтобы адекватно представлять изменения в концентрации растворенного вещества вдоль обоих роста и падения конечностей прорыва кривой (BTC) (Рисунок 2).- По прибытии раствора (обнаруженного с помощью увеличения проводимости), собирают образцы в 125 мл флаконах по всему BTC, держа бутылку 125 мл, в основной поток воды в точке отбора пробы. БыстроLY ополоснуть бутылку струей воды и выбросить ополаскивать вниз по течению, а затем взять пробу. образец Cap и место в охладитель.
- Запишите время (час: мин: сек) и проводимость каждого образца , взятого по BTC в полевой книге (таблица 1).
- Сбор образцов в зависимости от времени (например , 1 мин интервалы) или основанные на скорости , при которой изменения проводимости. Например, если проводимость быстро меняется, пока образец каждые 30-60 с до тех пор, изменения в проводимости медленно, при которой отсчеты по времени можно принимать каждые 5-10 мин. Для интервалов на основе проводимости, берут пробы через каждые 15-30 единиц в зависимости от скорости, при которой проводимость изменяется.
- Образец до возвращения проводимости в фоновом режиме или в пределах 5 мкСм / см фоновых условий. Интервалы сбора проб могут быть скорректированы в ходе эксперимента, пока BTC хорошо представлена в образцах грейферных.
| Бутылка # | удельная электропроводность | Время | Заметки |
| 1 | час: мин: сек | например фон (вниз по течению) | |
| 2 | например фон (вниз по течению) | ||
| 3 | |||
| 4 | |||
| 5 | например , образец с максимальной проводимости | ||
| , | |||
| , | |||
| , | |||
| Самая высокая бутылка # |
Таблица 1PFieldКнига: Пример страницы из книги и Lab Необходимая информация
- образец Фильтрация
Примечание: Фильтрация образцов может происходить либо в поле или по возвращении в лабораторию.- Образцы фильтров из восходящего конечности в порядке не по возрастанию удельную проводимость до пика удельной проводимости. Подождите , пока эксперимент , чтобы быть более и образцы фильтров от падающего конечности в порядке возрастания удельной электропроводности (т.е. начиная с последней выборки и работать в обратном направлении в сторону пика удельной проводимости).
Примечание: Этот заказ образцов сводит к минимуму перекрестное загрязнение между образцами и допускает тот же фильтр, шприц, и держатель фильтра для использования до тех пор, как фильтр, шприц и держатель фильтра соответствующим образом ополаскивают между каждой пробе (см шаги 5.3.2- 5.3.4). - Удалите поршень из шприца 60 мл, а затем закройте стоп-краном. Налейте ~ 10 мл образца в шприц и возвращают поршень шприца. Встряхнуть шприц таким образом, чтобы образецополаскиватели внутренние стенки шприца. Прикрепленный шприц держатель фильтра и открытый запорный кран. Нажмите образец через держатель фильтра и выбросьте прополоскать.
- Снять поршень и закрыть запорный кран. Налейте ~ 30 мл образца в шприц и возвращают поршень шприца. Открытое акционерное кран и выдворить ~ 10 мл через фильтр-держатель и в 60 мл бутылки для отбора проб. Закройте бутылку, вихрем фильтратом и выбросьте. Повторите этот шаг для в общей сложности 3 полосканий. Это будет гарантировать, любые примеси были удалены из бутылки образца 60 мл и, что стенки покрыты образцом.
- Снять поршень и закрыть запорный кран. Налейте ~ 60 мл образца в шприц и возвращают поршень шприца. Нажмите на образец через держатель фильтра и в бутылку образца 60 мл. Заполните бутылки до плеча, чтобы предотвратить образование трещин бутылок при замораживании. Cap бутылки и место в охладитель.
- Повторите шаги 5.3.2-5.3.4 для всех остальных образцов. Изменение фильтра между восходящей и нисходящей образцов конечностей, чтобы свести к минимуму загрязнение.
- Транспорт образцы обратно в лабораторию в тот же день и на льду.
- Образцы фильтров из восходящего конечности в порядке не по возрастанию удельную проводимость до пика удельной проводимости. Подождите , пока эксперимент , чтобы быть более и образцы фильтров от падающего конечности в порядке возрастания удельной электропроводности (т.е. начиная с последней выборки и работать в обратном направлении в сторону пика удельной проводимости).
6. Подготовка лабораторного анализа
- Если фильтрация проб должна происходить в лаборатории, следовать протоколу, как описано в разделе 5.3.1. Образцы фильтров из обоих восходящих и нисходящих конечности БТД в порядке возрастания проводимости. Изменение фильтра между ростом конечности и падающих образцов конечностей.
- Замораживание отфильтрованных выборок при -20 ° С до анализа.
- Убедитесь в том, что аналитические средства оборудованы для обработки высококонцентрированных образцов.
Примечание: Некоторые лаборатории не оборудованы для запуска высококонцентрированные образцы и , таким образом , следует позаботиться. Включать подготовленные стандарты, которые фиксируют, что более высокий конец ожидаемых концентраций растворенного вещества. Высокие стандарты концентрации поможет обеспечить стандартную кривую, которая отражает ожидаемый диапазон концентраций растворенного вещества манипулируют. - Анализ образцовот низкой к высокой проводимости на всех аналитических приборов. Заказ образцов от низкой до высокой удельной проводимости предотвращает загрязнение образцов соли низких / питательных высокими образцами соли / питательных веществ. Это означает, что образцы из роста и падения конечностей будут смешаны в отношении последовательности.
- Анализ образцов для общего содержания растворенного органического углерода, общего растворенного азота, нитратов и аммония, хотя точное сочетание анализа растворенного вещества будет зависеть от вопроса исследования (см Wymore и др. 10, например).
7. Анализ данных
- Анализ данных с использованием простой линейной регрессии. Независимой переменной концентрации добавленного питательных веществ и зависимой переменной является концентрация DOM либо как DOC или DON. Каждая точка на рисунке представляет собой один образец захвата с кривой прорыва и питательных веществ, что образец и DOC концентрации / DON.
Результаты
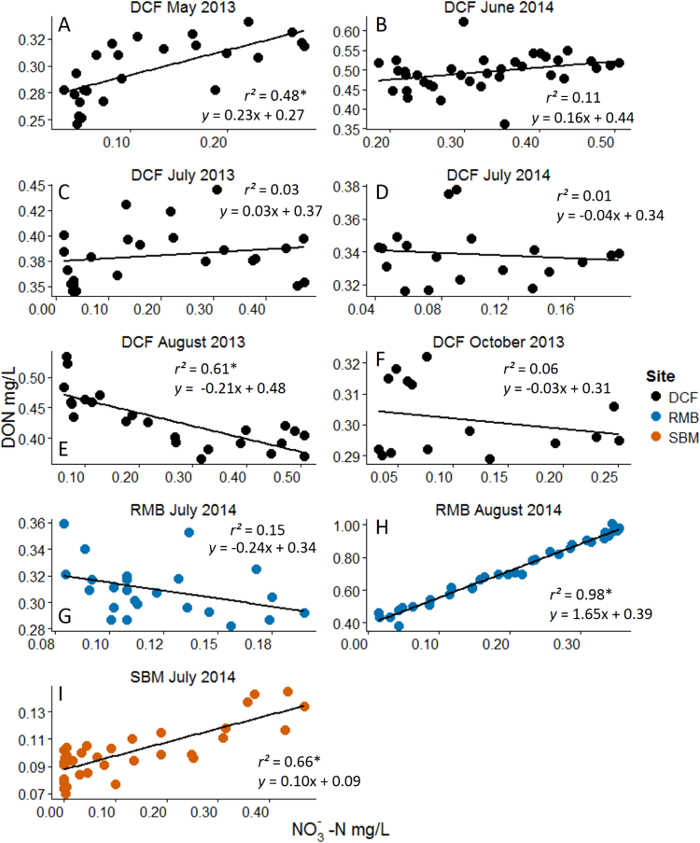
Рисунок 3: Результаты. Пример из нитратных (NO 3 -) Добавки с растворенным органического азота (ДОН) в качестве переменной отклика Анализы линейной регрессии. Звездочки представл?...
Обсуждение
Цель метода импульсного питательного, как представлено здесь, чтобы охарактеризовать и количественно определить отклик многообразной пула окружающего DOM поток воды через динамический диапазон добавленного неорганического питательного вещества. Если добавленное растворенного веще...
Раскрытие информации
The authors have nothing to disclose.
Благодарности
The authors acknowledge the Water Quality Analysis Laboratory at the University of New Hampshire for assistance with sample analysis. The authors also thank two anonymous reviewers whose comments have helped to improve the manuscript. This work is funded by the National Science Foundation (DEB-1556603). Partial funding was also provided by the EPSCoR Ecosystems and Society Project (NSF EPS-1101245), New Hampshire Agricultural Experiment Station (Scientific Contribution #2662, USDA National Institute of Food and Agriculture (McIntire-Stennis) Project (1006760), the University of New Hampshire Graduate School, and the New Hampshire Water Resources Research Center.
Материалы
| Name | Company | Catalog Number | Comments |
| Sodium Nitrate | Any | Any | |
| Sodium Chloride | Any | Any | Store purchased table salt can be used as well, however, it does contain trace levels of impurities |
| Whatman GFF glass-fiber filters | Any | Any | |
| BD Filtering Syringe | Any | Any | |
| EMD Millipore Swinnex Filter Holders | Any | Any | |
| Syringe stop-cock | Any | Any | |
| YSI Multi-parameter probe | Yellow Springs International | 556-01 | |
| Wide mouth HDPE 125 ml bottles | Any | Any | |
| 60 ml HDPE bottles | Any | Any | |
| 20 L bucket | Any | Any | |
| Field measuring tape | Any | Any | |
| Lab labeling tape | Any | Any | |
| Stir stick | Any | Any | |
| Cooler | Any | Any | |
| Sharpie pen | Any | Any | |
| Field notebook | Any | Any | |
| Tweezers | Any | Any | |
| Zip-lock bags | Any | Any |
Ссылки
- Brookshire, E. N. J., Valett, H. M., Thomas, S. A., Webster, J. R. Atmospheric N deposition increases organic N loss from temperate forests. Ecosystems. 10 (2), 252-262 (2007).
- Bernhardt, E. S., McDowell, W. H. Twenty years apart: Comparisons of DOM uptake during leaf leachate releases to Hubbard Brook Valley streams in 1979 and 2000. J Geophys Res. 113, G03032 (2008).
- Taylor, P. G., Townsend, A. R. Stoichiometric control of organic carbon-nitrate relationships from soils to sea. Nature. 464, 1178-1181 (2010).
- Mulholland, P. J., et al. Stream denitrification across biomes and its response to anthropogenic nitrate loading. Nature. 452, 202-205 (2008).
- Tank, J. L., Rosi-Marshall, E. J., Baker, M. A., Hall, R. O. Are rivers just big streams? A pulse method to quantify nitrogen demand in a large river. Ecology. 89 (10), 2935-2945 (2008).
- Covino, T. P., McGlynn, B. L., McNamara, R. A. Tracer additions for spiraling curve characterization (TASCC): quantifying stream nutrient uptake kinetics from ambient to saturation. Limnol Oceanogr. 8, 484-498 (2010).
- Johnson, L. T., et al. Quantifying the production of dissolved organic nitrogen in headwater streams using 15 N tracer additions. Limnol Oceanogr. 58 (4), 1271-1285 (2013).
- Rosemond, A. D., et al. Experimental nutrient additions accelerate terrestrial carbon loss from stream ecosystems. Science. 347 (6226), 1142-1145 (2015).
- Diemer, L. A., McDowell, W. H., Wymore, A. S., Prokushkin, A. S. Nutrient uptake along a fire gradient in boreal streams of Central Siberia. Freshwater Sci. 34 (4), 1443-1456 (2015).
- Wymore, A. S., Rodríguez-Cardona, B., McDowell, W. H. Direct response of dissolved organic nitrogen to nitrate availability in headwater streams. Biogeochemistry. 126 (1), 1-10 (2015).
- Stream Solute Workshop. Concepts and methods for assessing solute dynamics in stream ecosystems. J N Am Benthol Soc. 9 (2), 95-119 (1990).
- Kilpatrick, F. A., Cobb, E. D. . Measurement of discharge using tracers: U.S Geological Survey Techniques of Water-Resources Investigations. , (1985).
- Rodríguez-Cardona, B., Wymore, A. S., McDowell, W. H. DOC: NO3- and NO3- uptake in forested headwater streams. J Geophys Res - Biogeo. 121, (2016).
- Kilpatrick, F. A., Wilson, J. F. Book 3 Chapter A9, Measurement of time of travel in streams by dye tracing. Techniques of Water-Resources Investigations of the United States Geological Survey. , (1989).
- Lutz, B. D., Bernhardt, E. S., Roberts, B. J., Mulholland, P. J. Examining the coupling of carbon and nitrogen cycles in Appalachian streams: the role of dissolved organic nitrogen. Ecology. 92 (3), 720-732 (2011).
- Michalzik, B., Matzner, E. Dynamics of dissolved organic nitrogen and carbon in a Central European Norway spruce ecosystem. Eur J Soil Sci. 50 (4), 579-590 (1990).
- Solinger, S., Kalbitz, K., Matzner, E. Controls on the dynamics of dissolved organic carbon and nitrogen in a Central European deciduous forest. Biogeochemistry. 55 (3), 327-349 (2001).
- Kaushal, S. S., Lewis, W. M. Patterns in chemical fractionation of organic nitrogen in Rocky Mountain streams. Ecosystems. 6 (5), 483-492 (2003).
- Kaushal, S. S., Lewis, W. M. Fate and transport of organic nitrogen in minimally disturbed montane streams of Colorado, USA. Biogeochemistry. 74 (3), 303-321 (2005).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены