Method Article
从详细的空间表达图谱的动态表达数据的时间排序
摘要
The segmentation clock drives oscillatory gene expression across the pre-somitic mesoderm (PSM). Dynamic Notch activity is key to this process. We use imaging and computational analyses to extract temporal dynamics from spatial expression data to demonstrate that Delta ligand and Notch receptor expression oscillate in the vertebrate PSM.
摘要
During somitogenesis, pairs of epithelial somites form in a progressive manner, budding off from the anterior end of the pre-somitic mesoderm (PSM) with a strict species-specific periodicity. The periodicity of the process is regulated by a molecular oscillator, known as the "segmentation clock," acting in the PSM cells. This clock drives the oscillatory patterns of gene expression across the PSM in a posterior-anterior direction. These so-called clock genes are key components of three signaling pathways: Wnt, Notch, and fibroblast growth factor (FGF). In addition, Notch signaling is essential for synchronizing intracellular oscillations in neighboring cells. We recently gained insight into how this may be mechanistically regulated. Upon ligand activation, the Notch receptor is cleaved, releasing the intracellular domain (NICD), which moves to the nucleus and regulates gene expression. NICD is highly labile, and its phosphorylation-dependent turnover acts to restrict Notch signaling. The profile of NICD production (and degradation) in the PSM is known to be oscillatory and to resemble that of a clock gene. We recently reported that both the Notch receptor and the Delta ligand, which mediate intercellular coupling, themselves exhibit dynamic expression at both the mRNA and protein levels. In this article, we describe the sensitive detection methods and detailed image analysis tools that we used, in combination with the computational modeling that we designed, to extract and overlay expression data from distinct points in the expression cycle. This allowed us to construct a spatio-temporal picture of the dynamic expression profile for the receptor, the ligand, and the Notch target clock genes throughout an oscillation cycle. Here, we describe the protocols used to generate and culture the PSM explants, as well as the procedure to stain for the mRNA or protein. We also explain how the confocal images were subsequently analyzed and temporally ordered computationally to generate ordered sequences of clock expression snapshots, hereafter defined as "kymographs," for the visualization of the spatiotemporal expression of Delta-like1 (Dll1) and Notch1 throughout the PSM.
引言
体节是形成在显影脊椎动物物种的伸长体轴的第一区段并且是脊柱,肋骨的前体,和真皮组织,以及肌肉细胞和内皮细胞的。在体节形成,上皮体节由未分割的presomitic中胚层(PSM)(参考文献1综述)构成。这个过程是由"分割时钟",它由摆动基因和蛋白质的一个网络,大多属于Notch信号传导途径调节。分割时钟由各种负面反馈环,可在单个细胞内2脉动生产缺口活动的(在参考文献综述3 - 6)。而振荡的细胞内的方法是公特征在于,它在很大程度上仍然未知这些振荡是如何跨越PSM组织协调。最近已显示,通过实验和理论研究,这些振荡是ESSENTIAl至体节形成的过程中和所述Notch途径在两个分割和振荡基因表达的7,8的进程中的关键作用。然而,它已被广泛报道,Notch受体1(Notch1的)和Delta样配体(DLL)-1具有在PSM 9,10,11的静态梯度。
我们假设,该PSM分割时钟的缺口依赖性振荡分别取决于主Notch途径受体和配体,Notch1的和DLL1,的周期性激活,横跨鼠标PSM。以往的研究报告认为这些蛋白质的静态喙 - 尾梯度的结论是因为,我们预测,在缺乏免疫技术的敏感性。他们因此无法检测在尾PSM DLL1和Notch1的低级别的波动。
我们有Ë设计了一个方法,更仔细地检查这些因素,实验数据和数学模型相结合,预测由时钟组件的蛋白质的振荡跨越PSM 12的协调机制。
该方法的总的目标是检测并在PSM量化低级别的,动态的蛋白质表达,并根据已知的时钟基因的表达与感兴趣的蛋白质的表达谱映射, 极端分子 (Lfng)。由于在小鼠胚胎分割时钟的一个周期为2小时来完成,各种样品都需要在PSM 1 Lfng振荡期间建立DLL1和Notch1蛋白表达的完整的时空分布。因此,我们已开发了这个协议,以允许高通量检测在整个贴装低水平蛋白质表达,对侧PSM外植体。然而,该技术也可用于研究吨有用帽子旨在可以分割成对侧半部任何胚胎组织中表征低水平蛋白质动力学。
研究方案
所有实验均严格遵守动物(科学程序)1986年法令和实践在科学程序中使用动物的英国内政部代码项目下的车牌号码6004219进行。
1. PSM植解剖
- 获得由野生型(CD1)小鼠13的定时交配而产生的胚胎的尾部组织。简要地说,在天胚胎(E)10.5,安乐死在二氧化碳室中的孕供体小鼠。收获子宫角,将其放入按照内政部许可程序或等效的本地规则1X无菌磷酸盐缓冲液(PBS)的解决方案。转移子宫角到含有新鲜,无菌PBS组织培养皿。执行此解决方案中的所有后续清扫步骤。
- 在立体显微镜,采用弧形剪刀剪开子宫角的肌肉较厚的膜,小心地用细镊子提取每个胚胎。保重以确保该尾组织未在此过程中损坏。采用弧形剪刀和细镊子,解剖远离每个胚胎羊膜囊,注意不要损坏胚胎。
- 使用一个手术针或剪子弯切胚胎后到后肢芽收获每个胚胎的尾部组织。
- 平衡尾组织腹侧面朝下同时使用镊子和针。通过解剖尾组织成沿中线两半生成对从每个胚胎尾部PSM外植体;执行用针轻轻摇动。确保神经管,脊索,和PSM组织也同样在两个植之间进行分配。
- 吸取每对侧的PSM植到35毫米的塑料培养皿盖的下侧在预热(37℃)培养培养基(DMEM-F12 + 0.1%L-谷氨酰胺替代补充有10%胎牛血清的小体积,10nM的人bFGF和1%青霉素/链霉素)。
- 将在盖的顶部的盘,并迅速倒转使得PSM组织从在介质的"悬滴"盖子暂停。培养的PSM植在湿润室中于37℃1 - 2小时。
- PSM外植体转移成对到24孔组织培养板的单独的孔中。孵育在PBS中的4%多聚甲醛在室温(RT)或4°C(O / N)1小时过夜。 注意 :多聚甲醛是有毒的,并用此溶液时,必须采取适当的安全措施。
注:请在24孔培养板所有后续的洗涤和孵化步骤。 - 在RT洗在摇摆平台上在PBS中的样品孔,使用细塑料巴斯德吸管交换对样品的PBS溶液为新鲜的PBS 3 - 4倍。使用免疫组织化学(步骤2),并在对已知的时钟基因原位杂交等使用荧光处理来自每对中的一个的PSM植(STEP 3)。
2. PSM外植体的免疫组化
- 从在2%的Triton X-100在步骤1中生成的在PBS中在RT下在摇摆平台上1小时每胚胎对洗自己PSM外植体,然后在PBS中简单漂洗样品。上用封闭溶液(2%牛血清白蛋白(BSA)和10%正常山羊血清(NGS)在PBS + 0.1%吐温20)和孵育O / N的样品在摇摆平台上更换的PBS于4℃。
注:所有后续洗涤并在本节中孵育步骤必须在RT在摇摆平台上执行,除非另有说明。洗解决方案可通过精尖的塑料或玻璃巴斯德吸管轻易改变。 - 稀释所需的初级抗体/抗体,工作缓冲液(0.1%BSA,0.3%NGS,并在PBS中0.2%的Triton X-100)。在这个例子中,稀释工作缓冲液的DLL1和Notch1的抗体1:25。
注:优化将需要确定在THI所需的适当的稀释因子S步进如果使用另一种抗体。 - 在4℃下在摇摆平台5天 - 孵育3抗体溶液外植体。一定要包括一些样品工作缓冲器不含初级抗体作为第二抗体控制。
- 用移液管回收在1.5毫升存储管的第一抗体溶液,并储存于4℃。
注:回收的第一抗体可以根据所使用的抗体可以多次使用。 - 执行洗涤2次样品的5 - 每10分钟在PBS,随后3次,每次10分钟,2%的Triton X-100的PBS在RT在摇摆平台上。
- 稀释荧光标记的二级抗体/抗体(表位匹配于初级抗体/使用的抗体)在工作缓冲器。任选地,加入20微克/毫升的Hoechst 33342至该溶液到染液细胞核。
注:优化可能需要确定在此步骤所需的适当的稀释因子。在这个电子xample,1:1的稀释因子的:通常使用400。 - 离心10分钟,第二抗体溶液在16 XG防止抗体聚集体的形成。添加250 - 第二抗体溶液,以每个样品井500微升,小心不要用溶液,其可含有抗体聚集体的最后几微升。
- 覆盖锡箔样品板,以减少曝光和在3二次抗体溶液孵育样品 - 第5天,4℃在黑暗中。
- 样品安装,洗净样品两次,每次用PBS(PBST)10分钟,0.1%吐温-20和在RT一次5分钟的PBS在摇摆平台上之前(见步骤4)。
3. 荧光 PSM外植体原位杂交(FISH)
- 如果存储在一个替代容器中,将剩余的对侧PSM植转移到一个24孔组织培养板的单独的孔中。
- 洗样品10分钟,在PBST中的50%的乙醇,然后在RT在摇摆平台上执行洗涤2次10分钟,每次在100%乙醇脱水的组织。
注:所有后续洗涤并在本节中孵育步骤必须在RT在摇摆平台上执行,除非另有说明。 - 再水合通过洗涤的组织中在PBST 50%乙醇10分钟,随后洗涤两次在PBST每次5分钟。
注意:步骤3.2和3.3是这种协议要求必要的固定步骤和不能省略。 - 孵育10微克/毫升的蛋白酶K的试样中的0.1%吐温20的PBS(PBST),用于无需搅拌5分钟。快速去除蛋白酶K和定影后的组织为在PBST 4%甲醛+ 0.1%戊二醛30分钟前简要PBST冲洗样品。 注意:两个甲醛和戊二醛是有毒的,并且与这些解决方案时,必须采取适当的安全措施。
注:以下洗涤和涉及50%和100%的杂交混合物(步骤3.6 - 3.9)孵育步骤应不搅拌进行。 - 洗涤样品两次,每次10分钟,在PBST中后,在50%的杂交混合物洗一次样本(适合内含子探针:50%甲酰胺,5×柠檬酸盐水钠(SSC),5mM的EDTA,50微克/毫升tRNA的, 0.2%吐温-20,0.1%SDS和在PBST 100微克/毫升肝素)在RT制备。孵育在该溶液中10分钟,在65℃下不搅拌的样品。
- 在65℃温育在杂交混合物的样本≥2小时(最多48小时)之前用预温(65℃)杂交混合物冲洗样品两次(较长的温育时间改善得到的信号与噪声的对比度) 。除去来自先前步骤的杂交混合物,并用0.25更换 - 0.5毫升预热的(65℃)含有用地高辛(DIG)标记的反义RNA探针与已知分割时钟分量杂交混合物。
不E:例如,内含子狂人(Lfng(i))的探头以20微升/毫升的浓度用于检测新生Lfng表达。该步骤中使用的稀释是探针依赖性的并且需要优化。 - 密封用胶带以防止蒸发,并在65°C孵育在两晚的探针溶液中的样品板。
- 用细尖塑料巴斯德吸管,收回探头再利用,并将其存储在20°C。在预洗的每个20分钟的样品两次在65℃之前用预温(65℃)杂交后混合物(50%甲酰胺,0.2%吐温20和1×SSC中)冲洗样品两次温热杂交后混合。
- 在Tris-缓冲盐溶液(TBST)在65℃洗涤的样品15分钟,在预热的50%杂交混合物中的0.1%Tween-20的。 30分钟在RT在TBST在摇摆平台上洗涤之前用TBST冲洗样品的两倍。
- 预孵育在一个BLO的植他妈的溶液(TBST + 2%封闭缓冲液试剂(BBR)+ 20%热处理的山羊血清)为至少2小时。更换含1新鲜封闭液此解决方案:辣根过氧化物酶(HRP)的200缀合稀释抗地高辛抗体。孵育样品O / N在4℃。
- 抗体温育后,冲洗样品用TBST 3次在RT,并将它们转移到一个新的24孔组织培养板的各个孔中。用TBST洗涤外植体3次,每次1小时。
- 在这一点上,传输样品到0.5毫升的存储管或48孔组织培养板的各个孔,以减少在下面的步骤中酪胺信号放大(TSA)检测试剂的所需体积。
- 在RT孵育TSA扩增缓冲液(见试剂名单)的样品1分钟,不使用搅拌尽可能小的体积尽可能,确保将样品完全浸没在溶液中。
- 加入TSA试剂(见试剂清单)以1:50的稀释样品扩增缓冲液。迅速混合解决方案,直到TSA试剂均匀分布,覆盖锡箔板或管和孵育样品60 - 在黑暗中90分钟。
- 除去TSA扩增溶液和洗涤样品在TBST 3次,每次5分钟。转移外植回一个24孔组织培养板,以增加洗涤体积和孵化在1%的过氧化氢样品在TBST 1小时。用TBST洗样品3次,每次5分钟,然后两次,每次5分钟用PBST样品安装之前(见步骤4)。
4.样品制备成像
- 通过加入0.12毫米厚的摄像间隔件,其防止样品从通过加入盖玻片被压碎制备用于每个外植体对中的一个的收费粘附载玻片。从隔离物的一个表面上除去粘合剂衬垫,并将其放置粘合剂面朝下到载玻片,按F键irmly以密封垫片的幻灯片。
注:对于其余的步骤,努力保持样品在弱光或黑暗中,以避免光漂白。使用间隔件的中心内的玻璃巴斯德移液管,以确保外植体的解剖侧面滑动吸管植对到一个准备好的滑动。通过安排健侧对植一面。 - 使用玻璃巴斯德吸管除去尽可能多的液体作为从滑动可能和灯芯关闭周围使用了一块折叠低皮棉棉纸的样本的任何残留湿气。
- 允许样品以符合45幻灯片 - 60秒,直到组织开始出现粘透亮。在此期间,使用镊子从间隔除去剩余的粘胶衬里。不要让样品干燥。
- 添加的中心内的大滴双功能封固和清算溶液(0.5%对苯二胺和20毫摩尔Tris,pH值8.8,在90%的甘油),以样品的隔离物。注:允许氧化时,此溶液变为棕/黑色。
- 小心放置的圆形盖玻片(无1.5)穿过样品,确保封固均匀分布和盖玻片的所有边缘使与隔板接触。将外盖滑溜倒到一些低绒纸巾。
- 用力按下以确保盖玻片完全遵守隔离和任何多余的封固被删除。重复,直到没有更多的封固印迹纸。
- 清洁并贴上标签,幻灯片(S)适当,并在黑暗中保存,直到在-20°C成像,短期或在-80℃长期的。除去存储的幻灯片后,让他们映像之前完全解冻。
- 图像使用带有瓷砖采集和高倍率目标的共聚焦显微镜的样品安装。图片使用40X油浸物镜使用488纳米,568纳米和647纳米的激光李植对在4微米的Z-间隔内斯激发绿色,红色和远红色荧光团,分别在本研究12用于蛋白质和mRNA的检测。
注:平铺图像被缝合后采集以形成用于分析的单个图像。
5.收购后图像分析
- 使用图像分析软件对每个实验样品的PSM内定义感兴趣的区域。
- 量化表达水平,减去背景和阈图像之前随后的定量的无主对照样品的水平。限定起点,一个轴,以及每个样本的单位长度。
- 计算荧光强度作为沿归rostro -尾轴为每个M个样本12的位置的函数。正火的强度曲线后,通过边放置强度分布侧,将获得的强度矩阵F(I,J),描述在第i强度个中的第 j 个样本的空间位置。
6.样品的时间上的排序
- 推断一个已知的时钟组件的时间排序,确定其强度矩阵。然后,重新排列的强度矩阵的列,从而获得时间上周期性图案。要做到这一点,定义函数
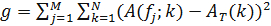
其中,A( 缩略词 ; k)是第 j 个 f和叔的列的自相关函数是一个目标自相关函数,选择执行模式的时间周期,由下式给出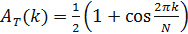
- 使用大都市斯(或其他最小化算法)12,以确定最小化函数g的样品的顺序。因此,确定的顺序M个样本最大化已知时钟分量的时间周期性。
- 使用M个样本的推断时间排序,构造一个有序kymograph在结成伙伴的信道12的表达模式。
结果
这个协议允许的旁边在小鼠PSM 12时钟基因转录目的蛋白质的时空信息的可视化。例如,DLL1( 图1A-C)和Notch1的( 图1D-F)的蛋白的表达被示出为振荡出同步的与所述Notch调节的分割时钟基因Lfng的新生转录。 DLL1的,Notch1的,和Lfng(i)就到PSM( 图1G)的前-后(AP)轴信号强度揭示了这些目标( 图1H-J)明确表达振荡动态量化。 DLL1和Notch1蛋白表达在整个时钟周期的时空分布被清晰地显示并且使用此协议通过高分辨率固定组织的图像数据的采集后图像分析定量。
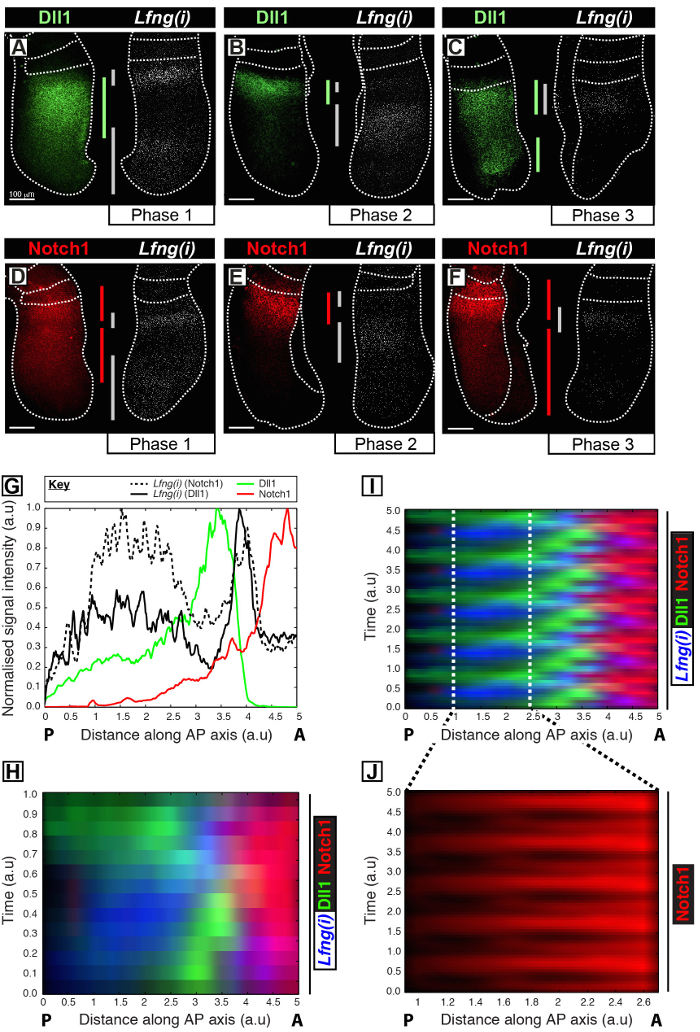
图1:时空可视化和DLL1的定量和Notch1的蛋白表达动力学。 (AF)从六种E10.5胚胎(AF)表示沿着检测DLL1蛋白(AC)或Notch1蛋白(DF)的二分之一的空间分布Lfng前mRNA(Lfng(i))的外植体的双对应每对对侧一半。面板是根据第1阶段(A和D),第2阶段(B和E),以及分割时钟周期的第3阶段(C和F),其布置,如通过Lfng(ⅰ)表达的空间分布来确定。表达结构域对于DLL1(绿),Notch1的(红色),以及Lfng(ⅰ)(灰色)沿PSM的前-后轴线的程度有bEEN由颜色编码条划定。虚线划定最近形成的体节(S),PSM的外边缘,与相邻神经组织(C和E)的位置。比例尺(左下方每个面板,AF)的代表100微米。 (G)的一个例子强度图描绘整个PSM信号强度的轴向变化。的数据是从两个外植体对表示相比,在对侧植Notch1蛋白(红色)(胚胎1),以及Lfng前mRNA(黑色实线)在一个外植体Lfng前mRNA(黑色散列线)标绘另外植体相比,在对侧植(胚2)DLL1蛋白(绿色)。测量的信号强度(y-轴)绘制针对轴向位置(x轴;前壁PSM [A]到右侧和后部的PSM〔P〕到左侧)。 (H)显示DLL1,Notch1的,和Lfng(i)的空间分布的kymograph跨越无数的PSM。所述kymograph的每一行代表一个单独的PSM外植体的信号强度。行按照Lfng前mRNA(Ⅰ)DLL1,Notch1的,和Lfng(I)的通过多个时钟振荡被中所示的数据的周期性扩展模拟的时空分布的时空分布排列在时间序列(H)的,突出DLL1和Notch1的表达动力学的振荡性质。在尾部的PSM(J)的脉动Notch1蛋白表达是通过在(I)中所示的虚拟kymograph划分的区域的放大高亮显示。从参考12.修改请点击此处查看该图的放大版本。

图2:DLL1 和Notch1蛋白表达的时空动态的定量。 (A)的一个例子强度图描绘了整个PSM信号强度的变化轴向。从两个外植体对数据作图表示相对于在从一个半植在对侧植半Notch1蛋白(红色),以及Lfng前mRNA(黑色实线)在一个外植Lfng前mRNA(黑色散列线)第二尾部相比在对侧植一半第二尾部的DLL1蛋白(绿色)。测得的强度(y轴)作图针对轴向位置(x轴;喙[A]向右侧和尾部〔P〕到左侧)。 (BH)Kymographs显示Notch1的,DLL1,NICD和Lfng(一)在众多的PSM的空间分布。 (B和C),镍镉(B)和DLL1(C)在PSM节表达; (D和E)Lfng(I)(D)和DLL1( E)在对侧半植; (F和G)Lfng(I)(F)和Notch1的(G)在对侧植一半。从参考12. 请点击此处查看该图的放大版本。
讨论
该议定书中的关键步骤
本协议描述在E10.5鼠标PSM植执行低级别的蛋白表达和振荡动力学的定量分析的敏感方法。两种免疫组织化学和荧光原位杂交(FISH)的鲁棒协议后跟高分辨率整个安装共焦成像,然后通过图像分析和kymographs的时空分割以产生跨越所述PSM蛋白表达的时空图。高信噪比的蛋白质和mRNA的检测是必要的,以确保该技术的成功。必须小心以彻底在洗涤步骤有效地交换所有的解决方案,并保持65℃洗涤的温度在第3步的相关步骤是最有利的是采取到源对有效的抗体和RNA探针的时间兴趣和目标,以测试这些试剂在彻底开始之前此协议全安装样品。
修改和故障排除
可以执行此协议时可能遇到的主要问题来自贫困信号检测强度和质量产生。这在很大程度上取决于分别用于在协议的免疫组织化学或FISH步骤中,抗体或RNA探针的功效。达到足够的信号检测之前的许多不同的步骤,可能需要优化。为贫困信号检测的一个常见原因是固定不当;当务之急是要么新鲜PFA或PFA储存在4℃下不再超过一周是用来固定样品。固定的长度也可能需要优化,这取决于使用的抗体或RNA探针。对于抗体,建议遵循制造商的说明在可能的情况,而对于RNA探针,我们建议发表的文献的协商。
在本研究中,我们使用特异性检测时钟基因Lfng的前mRNA的RNA探针。由于其相对缺乏丰度,Lfng前mRNA的检测需要孵育在含有5倍柠檬酸盐水钠(SSC)为良好的信号检测杂交混合物探针长时间。相同的条件可以适用于检测弱表达的mRNA其它探针,但在我们的经验,更稳定的mRNA靶的检测可能需要在杂交混合物较短探针杂交步骤和较低的SSC的浓度( 例如,1.3倍SSC)。对于这两种免疫组织化学和荧光原位杂交,该协议必须首先对全胚胎进行了优化,和抗体或探针的最佳浓度,必须根据经验来确定。
该技术的局限性
如上所述,该技术的成功在很大程度上取决于蛋白和mRNA的质量检测。 W¯¯E具有所概述的几个建议如何蛋白和mRNA检测可以得到改善,但在不存在高品质的荧光信号的检测,也没有办法在实验可以继续进行。可在每个组织样品中待分析的靶蛋白的数量由共焦显微镜的光谱分辨率和所使用的抗体的表位的限制。在这项研究中,我们能够对每个样品12使用最多三个表位用于蛋白质检测旁边的DNA染色。这种协议只允许一个mRNA靶的检测,虽然当前备选方法可用于增加本多达三个目标14。
关于到现有/替代方法的技术意义
这里所描述的方法提供了一种灵敏的技术来检测在整个贴装PSM植低水平蛋白质波动。这些动力学的定量是可以通过在相应对侧植已知的生物钟基因进行鱼。产生kymographs的文库,可以通过一个分割时钟周期被组织,突出这个时间范围内所关注的目标的时空表达动力学。在这种技术比别人一个关键的区别是使用的计算自动化,以时间顺序大型数据集,它允许新的时钟组件的时空表达动态带偏见地加以分析。例如,这种技术提供的洞察DLL1和Notch1的蛋白和它们的振荡如何共同被调节的整个PSM。在这种情况下的替代方法也依赖于免疫染色,但他们并没有检测在尾PSM DLL1和Notch1蛋白水平使用这种方法,该方法是显而易见的小的波动。相反,他们报告表达的稳定梯度是最强的前区9 >,10,11。这可能是由于,该协议有一个更长的初级抗体温育期的事实(3 - 5天,而不是过夜),这可能需要检测蛋白质水平较低。作为DLL1和Notch1的表达水平是在延髓PSM相对较高,这可能影响了提交给图像在较低曝光不是设置的试样,有必要检测尾部蛋白的表达。一名潜在的差异源于查普曼等人在研究中使用不固定的组织。 ,其中DLL1和Notch1的在尾部的PSM表达短暂可能已经不太保存完好9。
掌握技术后,未来的应用方向或
一旦这个协议已经掌握,可以在PSM权益的蛋白质进行高通量表达分析。从几个小鼠窝产生的PSM植可以一次处理,以产生所需的用于分析的高取样数。尽管我们仅在这些研究中使用的野生型胚胎,它是可能的,以评估对蛋白表达动力学的一个或多个因素的重要性进行使用转基因胚胎这一分析。超越PSM,该协议可以适于被由两个对侧半部和可用于灵敏地检测低水平蛋白质表达和振荡动力学其他系统。对于此协议可以适于一个例子是在小鼠神经管动态蛋白表达的研究中,由于对侧半部可以产生和培养,和Notch活性被证明是目前和重要的图案15。我们鼓励其他团体,以适应这个协议到其他系统,并为今后的改进提供反馈。
披露声明
The authors have nothing to disclose.
致谢
这项工作是由MRC助学金给RAB,一个MRC助学金给CSLB和WT项目赠款截拳道(WT089357MA)的支持。这项工作也是由惠康基金会战略奖(097945 / Z / 11 / Z)的支持。我们感谢E. Kremmer博士为DLL1抗体和O. Pourquie博士为Lfng RNA探针的一种恩赐。
材料
| Name | Company | Catalog Number | Comments |
| DMEM-F12 | Gibco (ThermoFisher Scientific) | 11320033 | |
| GlutaMAX™-1 (100x) | Gibco (ThermoFisher Scientific) | 35050 | |
| Fetal Bovine Serum, qualified, E.U.-approved, South America origin | Gibco (ThermoFisher Scientific) | 10270106 | |
| Recombinant Human FGF-basic (154 a.a.) | Peprotech | 100-18B | |
| Penicillin/Streptomycin | Gibco (ThermoFisher Scientific) | 15140122 | |
| anti-mouse monoclonal Notch1 antibody^ | BD Pharmingen | 552466 | |
| anti-rat polyclonal Dll1 antibody^* | N/A | N/A | |
| Lfng intronic anti-sense RNA probe^* | N/A | N/A | |
| 16% paraformaldehyde | Pierce (ThermoFischer Scientific) | PI28908 | |
| Proteinase K, recombinant, PCR grade | Roche (Sigma-Aldrich) | 31158 | |
| Phosphate buffered saline (PBS), pH 7.4 | Made in house | N/A | |
| Triton-X 100 | Sigma-Aldrich | T8787 | |
| Bovine serum albumin (BSA) | Sigma-Aldrich | 5470 | |
| Normal goat serum (NGS) (heat-treated) | Gibco (ThermoFisher Scientific) | 16210072 | |
| Hoechst 33342 | ThermoFischer Scientific | H3570 | |
| Tween-20 | Sigma-Aldrich | P9416 | |
| Ethanol | Sigma-Aldrich | 46139 | |
| Glutaraldehyde | Sigma-Aldrich | 340855 | |
| Formamide | Sigma-Aldrich | F9037 | |
| Saline-sodium citrate (SSC) | Sigma-Aldrich | 93017 | |
| EDTA | Sigma-Aldrich | 798681 | |
| tRNA | Roche (Sigma-Aldrich) | 101095 | |
| Heparin | Sigma-Aldrich | H3149 | |
| Tris-buffered saline (TBS) | Made in house | N/A | |
| Blocking Buffer Reagent | Roche (Sigma-Aldrich) | 11096176001 | |
| anti-DIG horseradish peroxidase (HRP) conjugated antibody | Roche (Sigma-Aldrich) | 11207733910 | |
| Tyramide signal amplification (TSA) kit | Perkin Elmer | NEL744001KT | |
| *The Dll1 antibody and RNA probe used in this study are not commercially available. Please see acknowledgements for sources. | |||
| ^Antibodies/RNA probes should be sourced which are applicable to the research interests of the reader. | |||
参考文献
- Oates, A. C., Morelli, L. G., Ares, S. Patterning embryos with oscillations: structure, function and dynamics of the vertebrate segmentation clock. Development. 139 (4), 625-639 (2012).
- Krol, A. J., Roellig, D., et al. Evolutionary plasticity of segmentation clock networks. Development. 138 (13), 2783-2792 (2011).
- Dequéant, M. -. L., Ahnert, S., et al. Comparison of Pattern Detection Methods in Microarray Time Series of the Segmentation Clock. PLoS ONE. 3 (8), 2856 (2008).
- Bailey, C., Dale, K. . Somitogenesis in Vertebrate Development. , 1-15 (2015).
- Maroto, M., Bone, R. A., Somitogenesis Dale, J. K. Somitogenesis. Development. 139 (14), 2453-2456 (2012).
- Kageyama, R., Masamizu, Y., Niwa, Y. Oscillator mechanism of notch pathway in the segmentation clock. Developmental Dynamics. 236 (6), 1403-1409 (2007).
- Ferjentsik, Z., Hayashi, S., et al. Notch Is a Critical Component of the Mouse Somitogenesis Oscillator and Is Essential for the Formation of the Somites. PLoS Genetics. 5 (9), 1000662 (2009).
- Wiedermann, G., Bone, R. A., Silva, J. C., Bjorklund, M., Murray, P. J., Dale, J. K. A balance of positive and negative regulators determines the pace of the segmentation clock. eLife. 4, 05842 (2015).
- Chapman, G., Sparrow, D. B., Kremmer, E., Dunwoodie, S. L. Notch inhibition by the ligand DELTA-LIKE 3 defines the mechanism of abnormal vertebral segmentation in spondylocostal dysostosis. Human Molecular Genetics. 20 (5), 905-916 (2011).
- Sparrow, D. B., Chapman, G., et al. A Mechanism for Gene-Environment Interaction in the Etiology of Congenital Scoliosis. Cell. 149 (2), 295-306 (2012).
- Okubo, Y., Sugawara, T., Abe-Koduka, N., Kanno, J., Kimura, A., Saga, Y. Lfng regulates the synchronized oscillation of the mouse segmentation clock via trans-repression of Notch signalling. Nature communications. 3, 1141 (2012).
- Bone, R. A., Bailey, C. S. L., et al. Spatiotemporal oscillations of Notch1, Dll1 and NICD are coordinated across the mouse PSM. Development. 141 (24), 4806-4816 (2014).
- Shea, K., Geijsen, N. Dissection of 6.5 dpc mouse embryos. Journal of Visualized Experiments. (2), 160 (2007).
- Denkers, N., García-Villalba, P., Rodesch, C. K., Nielson, K. R., Mauch, T. J. FISHing for chick genes: Triple-label whole-mount fluorescence in situ hybridization detects simultaneous and overlapping gene expression in avian embryos. Developmental Dynamics. 229 (3), 651-657 (2004).
- Stasiulewicz, M., Gray, S. D., et al. A conserved role for Notch signaling in priming the cellular response to Shh through ciliary localisation of the key Shh transducer Smo. Development. 142 (13), 2291-2303 (2015).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。