Method Article
基于核糖体 dna 的 RNA 样本 dna 污染评价
摘要
在这里, 我们提出了一个在 RNA 样本中追踪基因组 DNA (gDNA) 污染的协议。所提出的方法利用特定的引物的内部转录间隔区 (其) 的核糖体 DNA (rDNA) 基因。该方法适用于大多数真核生物和原中 DNA 污染的可靠和灵敏检测。
摘要
一种广泛用于量化的基因表达变化和转录丰度的方法是反向转录定量实时 PCR (RT-qPCR)。它提供准确、灵敏、可靠和可重现的结果。影响 qPCR 的敏感性和特异性的因素有多种。残留的基因组 DNA (gDNA) 污染 RNA 样本是其中之一。在基因表达分析中, 非特异性放大由于 gDNA 污染会高估转录水平的丰度, 并会影响 qPCR 结果。一般情况下, gDNA 是通过 qRT PCR 检测到基因区或感兴趣基因的内含子。不幸的是, 在脊椎动物、细菌、原、真菌、植物和无脊椎动物后生物种的所有基因中, 内含子/外显子注释尚不为人所知。
在这里, 我们提出了一个协议, 以检测 gDNA 污染的 RNA 样本利用核糖体 DNA (rDNA) 为基础的引物。该方法是基于 rDNA 的独特特征: 它们的基因性质, 高度保守的序列, 和高频率的基因组。并以禾本科家族的核糖体 DNA (rDNA) 保守区为例, 设计了一套独特的引物。通过熔融曲线分析和琼脂糖凝胶电泳测试了这些引物对的普遍性。虽然我们的方法解释如何 rDNA 基引物可以应用于 gDNA 污染检测在禾本科家族, 它可以很容易地用于其他原和核物种
引言
探索有趣的基因组或信号网络的转录调控对于了解生物事件中涉及的复杂分子机制是非常重要的1。目前, qPCR 分析是最广泛使用的基因表达研究的方法, 可以针对 DNA (基因组) 或 RNA (转录), 允许 methylome 和转录分析, 分别。反向转录 (RT) 后, qPCR 被广泛用于转录分析, 测量基因表达水平的各个领域的生物研究2。与传统的北方杂交, 通过原位杂交、核糖核酸保护分析 (RPA) 和半 rt-pcr PCR 等方法进行组织特异检测, 其准确度、方便性、速度和广泛的动态范围基于 qPCR 的检测是非常显著的3,4。有几个重要的因素, 必须考虑的可靠量化信使 rna (mRNA), 包括质量和数量的 rna 起始材料。此外, 非特异放大、RT qPCR 效率和 PCR 效率必须被认为是5,6。
gDNA 的存在是 rna 提取过程中的一个固有问题, 部分原因是 DNA 和 rna 的类似物理和化学性质的7。由于从 mRNA 样本中提取的 gDNA 和互补 DNA (cDNA) 的序列同一性, 可能发生非特异性放大, 这将影响 qPCR 结果的准确性。其余的 gDNA 将导致高估的目标 mRNA 丰度基因表达分析8。
基本上, 非特异增主要来源于引物-二聚体形成或不背景放大由于 gDNA, 这两者都可以使用适当的控制样品来评估。这些样品没有模板控制 (NTC), 也没有反转录酶控制。由于所研究的样品中的 gDNA 污染程度不同, 对 gDNA 的敏感性在所分析的基因之间有很大的差异, 因此每个样本/化验对都需要对其进行控制。尽管这大大增加了 RT-qPCR 性能分析研究中的成本和人工, 但这些控件是必需的7,9。
处理 gDNA 污染的替代方法包括使用底漆对退火到基因区域或感兴趣的基因的内含子10, 以及使用引物, 要么侧翼大的内含子或跨外显子连接,即退火点在成熟的 mRNA 序列1,4中缺席。然而, 许多脊椎动物、细菌、原、真菌、植物和无脊椎动物后生物种的所有基因的内含子/外显子注释还不得而知。此外, 许多真核生物的基因来自复制事件。此外, 在内含子的引物设计不保证非 gDNA 的放大。由于染色质可及性的基因组区域到dnasei我变化, 建议设计不同的引物对针对不同的染色体10。
真核生物的基因组可以包含多达1000拷贝的 rDNA 基因编码核糖体亚基所需的核糖体形成。这些 rDNA 基因通常组织在单个或串联重复数组11中。Polycistronic rRNAs (图 1) 包括大亚基 (路易斯安那州) 和小亚基 (SSU) 转录的 rna 聚合酶 i (rna)。通过消除两个内部转录间隔区 ITS1 和 ITS2, 进一步处理产生的预 rRNAs。作为最终产品, 三成熟的 rRNAs、17-18S rRNA (SSU)、5.8S 和 25-28S rRNA (路易斯安那州) 都生成12。rDNA 基因是具有高度保守序列的基因家族的典型代表。它们发生在基因组中的高频率, 并可能存在于多个染色体位置13。rRNA 的处理和转录间隔的降解是核仁中的一个快速过程。由于重复的高度, 与低拷贝内含子序列和拼接前体相比, 基因组拷贝数和可检测的未加工 RNA premolecules 比较低。这些特点使 rDNA 基因非常适合可靠和高度敏感的检测 gDNA 污染的大多数真核生物和原3。
本文介绍了一种检测 RNA 样品中 gDNA 污染的新方法。提出了一套基于 rDNA 保守序列的通用引物, 用于几种禾本科的 gDNA 测定。以 DNA 为模板, 用熔融曲线分析法测定了引物的特异性和普遍性。我们的协议不仅适用于禾本科, 而且也很容易适应其他真核和原核物种。
研究方案
注意: 任何组织都可以使用。
1. 核酸提取
- 在2.0 毫升的试管中放入100毫克的组织样本, 添加两个 5 mm 的不锈钢珠子, 并质在 25-30 Hz 的组织在三十年代 (均匀的持续时间和频率取决于组织类型) 的 RNA 和 DNA。
- 根据制造商的说明分离总 RNA。
- 根据制造商的说明分离总 DNA。
- 通过测量260和 280 nm 的吸光度来控制 RNA 样品的纯度和数量。
- 通过测量260和 280 nm 的吸光度来控制 DNA 样品的纯度和数量。
注意: 当核酸吸收波长为260纳米 (A260) 的光时, 波长 280 (A280) 的光吸收量可以用来量化样品中存在的蛋白质和酚的数量。因此, A260/A280 nm 的比值可用于评价从样品中提取的 DNA 和 RNA 的纯度。≥1.8 和 > 2.0 范围内的 A260/280 值通常被认为是 "纯" 的 DNA 和 RNA, 分别。较低的 A260/280 值可能表明蛋白质或有机化学品污染。 - 通过运行0.7% 琼脂糖凝胶电泳检测 DNA 的质量。制备凝胶并在1x 三硼酸 EDTA 缓冲液中运行 (:89 毫米三, 89 毫米硼酸, 2 毫米 EDTA) 在 100 V 为 30 min. 优质 gDNA 出现作为一个锋利, 高分子量 (亚基) 带没有涂片在低分子量 (lmw-gs) 分子范围内。
- 根据制造商的说明, 用硫氰酸胍 () 琼脂糖凝胶电泳或毛细管电泳芯片检查分离的 RNA 在变性条件下的数量、纯度和完整性。
- 在冷却琼脂至60° c 后, 在标准1x 的琼脂糖凝胶中加入 5 mM 的培养基, 以准备好该胶。
注: 本机是有毒的, 所以将其放在通风柜内, 并佩戴适当的个人防护设备。 - 准备 RNA 变性装载缓冲: 95% 甲酰胺, 10 毫米 EDTA pH 8.0, 0.1% 溴蓝色, 0.1% 二甲苯青, 和10µL 溴溴化物。
注: 甲酰胺和溴溴化物是有毒的, 应在油烟罩中配发。 - 负载 1-5 µg 总 rna 在 rna 变性装载缓冲, 加热混合物为5分钟在70° c, 安置它在冰, 在装载它到胶凝体之前, 然后分开的 rna 在被做的在 100 V 为 45 min. 装载脱氧核糖核酸或 rna 分子量标记作为一个标准旁边RNA 样品。
- 用溴溴化物着色凝胶, 并在紫外线照射下使用图像捕捉系统来可视化波段。在真核生物, 完整的 RNA 运行在变性条件下将显示至少两个尖锐和清晰的 rRNA 带 (28S 和 18S) 的2:1 强度比。
- 在冷却琼脂至60° c 后, 在标准1x 的琼脂糖凝胶中加入 5 mM 的培养基, 以准备好该胶。
- 使用 dnasei (dnasei I 核糖核酸-自由) 处理去除 gDNA 的痕迹。添加到一个无核糖核酸管10µL 总体积: 0.1-1 µg 总 RNA, 一个单位的dnasei I, 和1µL 的10x 反应缓冲区与氯化镁2。孵育混合物为30分钟在37° c。终止反应, 加入1µL 50 毫米 EDTA 和孵化在65° c 为10分钟。
- 根据制造商的协议, 使用 dnasei 自由核糖核酸A 删除 gDNA 提取物中的 RNA 踪迹。添加5µL 核糖核酸10毫克/毫升到总 DNA 和孵育在37° c 1 h. 贮存 RNA 和 DNA 提取物在-80 ° c。
2. gDNA 试验 rDNA 区引物设计
注: rDNA 全长序列包含两个区域 (ITS1 和 ITS2), 它们在成熟的 rRNA 分子中被一系列 endonucleolytic 分裂移除, 然后降级 (图 1)。
- 检索的 rDNA 核苷酸序列从 NCBI (http://www.ncbi.nlm.nih.gov) 的物种的兴趣。搜索数据库的最佳关键字是 "内部转录间隔"。
- 输入目标核苷酸序列到一个 BLASTn 搜索寻找内部转录间隔区域 (它), SSU, 和路易斯安那州的保守区域。
- 选择它序列或放大不存在于成熟 rRNA 的它序列的引物。
- 设计引物侧翼的 ITS1 或 ITS2 序列: 对齐不同物种的保守区域由 ClustalW。设计的引物特定于其侧翼区域后, 分类/跨物种分析与 AlleleID 软件。两个引物对放大5.8S 和 5.8S-路易斯安那州增可以设计的基础上的侧翼区域 ITS1 和 ITS2 分别。因为这些增横跨它的区域, 增长度将增加至少 300 bp 在增从 gDNA。这种增加降低了灵敏度。
- 侧翼 ITS1: 选择 SSU 和 5.8S rRNA 序列。选择的底漆为禾本科是: SSU, SF: CGTAACAAGGTTTCCGTAGGTG, R: GGTTCACGGGATTCTGCAAT。本入门对 (SF: 向前和 R: 反向) 放大 SSU 的部分区域, ITS1 的全长, 以及 5.8S rDNA 的部分区域。
- 侧翼 ITS2: 选择5.8S 和路易斯安那州的序列。禾本科的精选引物有: F: ATTGCAGAATCCCGTGAACC 路易斯安那州立会共识序列, LR: TGCTTAAAYTCAGCGGGTAGYC。本入门对放大5.8S 的部分区域, ITS2 的全长, 以及部分区域的路易斯安那州立会 (图 1)。
注: 在基于它侧翼区域的底漆设计的情况下, 确定了 SSU、5.8S 和路易斯安那州的高度保守区域。5.8S rRNA 的正反引物是根据开花植物的保守母题设计的14。根据禾本科的 SSU 和路易斯安那州的保守区域分别设计了正反引物。在表 1中给出了每个物种的 SSU 和路易斯安那州底漆的发散性。
- 引物放大它序列: 在此协议中, 基于獐其序列 (NCBI taxid 编号: 110873) 设计 ITS1 引物。用于底漆, 用途: 向前: GGTATGGCGTCAAGGAACACT, 背面: ATAGCATCGCTGCAAGAGGT。根据增生成的入门对在硅片中, 其大小应范围从60到 200 bp。这也是 qPCR 分析的推荐尺寸。
- 设计引物侧翼的 ITS1 或 ITS2 序列: 对齐不同物种的保守区域由 ClustalW。设计的引物特定于其侧翼区域后, 分类/跨物种分析与 AlleleID 软件。两个引物对放大5.8S 和 5.8S-路易斯安那州增可以设计的基础上的侧翼区域 ITS1 和 ITS2 分别。因为这些增横跨它的区域, 增长度将增加至少 300 bp 在增从 gDNA。这种增加降低了灵敏度。
- 在考虑这些建议时选择底漆: GC 含量:40-60%, 底漆长度:18-23 基, PCR 产品长度:60-160 bp (特别为其底漆), 熔化温度 (tm):60 ° c, 最后 Tm 为两个底漆不不同超过5° c, 和拘谨对自己或合作伙伴引物不补充。
- 检查底漆的特异性和拷贝数。通过底漆-爆炸程序 (https://www.ncbi.nlm.nih.gov/tools/primer-blast/) 对所选底漆序列进行内硅分析。
- 打开底漆-爆炸提交页面。在表单的 "底漆参数" 部分输入两个底漆序列。在底漆对特异性检查参数部分, 输入生物体名称 (或有机体组名称), 并选择基因组数据库。这些设置给出了目标序列和引物参数的特异性信息, 包括产品长度、染色体位置和拷贝数。
3. 执行 qPCR 步骤验证基于 DNA 模板的 rDNA 基引物
注意: 设计的引物的功能应该通过使用 gDNA 作为模板执行 qPCR 来验证。为了执行几个平行的反应和减少移的错误, 建议主混合的准备。对于一个主混合, 准备一卷相当于总数量的反应混合加 ~ 10%。
- 在 PCR 反应管中, 除 DNA 模板外, 将所有反应成分混合, 准备一个主混合。根据需要从一个反应高档准备主组合: 5 µL SYBR 绿色 (SYBR) 主混合 (2x), 0.3 µL 底漆 (0.3 µM 每向前和反向底漆), 并调整最终卷到10µL 与无核糖核酸水。使用大约≤200 ng 在1µL 模板 gDNA 进行分析。
注: 解冻, 组装, 并保持所有的试剂, 成分, 和反应混合物在冰上。 - 分主混合成一个光学96井板。吸管1µL gDNA 每井, 然后用光学板密封膜覆盖。旋转和放置在循环。
- 在以下条件下运行实时热循环的 qPCR 分析:10 min 在95° c 跟随40个周期95° c 为十五年代和60° c 为 1 min. 执行数据获取在60° c 退火或引伸步。
- 在放大过程以后, 所有 PCR 反应对熔化曲线分析与连续的荧光测量从55° c 到95° c。通常, 每个周期收集一个数据点由温度的逐步增量每周期0.5 ° c。
注: 每个入门对主组合至少包含2非模板控件 (NTC)。在至少三复制中执行所有的化验。 - 通过熔体曲线分析确定底漆的特异性。用单阈值周期和减法曲线拟合方法分析曲线。
注意: 一个尖锐的个人峰的外观表明一个统一的个人增。底漆二聚体产品在较低的温度下可以作为单个峰出现。 - 通过琼脂糖凝胶电泳验证每增的大小。
- 将3克琼脂糖与100毫升的缓冲液混合, 制备3% 琼脂糖凝胶 (如:89 毫米三, 89 毫米硼酸, 和2毫米 EDTA)。
- 将 5-10 µL 的 PCR 产物与 DNA 和 1-2 µL 的6x 加载缓冲液混合。在3% 琼脂糖凝胶上的 DNA 阶梯上装载 PCR 产物。在1x 的三硼酸 EDTA 缓冲液中进行电泳分离, 在100伏为45分钟。
- 用溴溴化物或任何其它插剂着色凝胶, 并在紫外线照射下使用图像捕捉系统来可视化波段。
注: DNA 插剂 (例如, 溴溴化物) 是致癌的, 应小心处理, 并单独配发。一个独特的尖锐带的外观 (关于大小和没有底漆-二聚体或人工背景放大) 证实了增的特殊性。
4. gDNA 污染测定程序与 RNA 模板
注: 在治疗后使用dnasei,纯化的 RNA 样品通过 rDNA 特异的底漆进行检测。由于在这些区域用于放大时它的内含子样特征的处理, 在无 DNA RNA 样本中不应检测出放大信号。在此基础上, 如果检测到 qPCR 中的放大信号, 或者在琼脂糖凝胶中观察到预期大小的波段 (通过在硅片中分析估计), 这应该是由于 gDNA 污染造成的。在本节中执行的步骤类似于3节, 只是所有样本的 cDNA 都被用作模板而不是 gDNA。
- 在 PCR 反应管中, 除 RNA 模板外, 将所有反应成分混合, 准备主混合。主混合组合为一反应: 5 µL SYBR 主混合 (2x), 0.3 µL 底漆 (0.3 µM 每前和反向底漆混合), 并调整最终卷到10µL 与核糖核酸-免费水。使用大约 500 ng 模板 RNA 在1µL 容量为分析。
- 分主混合成一个光学96井板。吸管1µL RNA 到每个井, 然后用光学板密封膜覆盖。离心机和地方在循环。
注: 至少包括两个 NTC 控制和两个积极的 gDNA 控制每个化验。在三技术复制中执行所有的化验。 - 在以下条件下运行实时热循环的 qPCR 分析:10 min 在95° c 跟随40个周期95° c 为十五年代和60° c 为 1 min. 执行数据获取在60° c 退火或引伸步。
- 在放大过程以后, 所有 PCR 反应对熔化曲线分析与连续的荧光测量从55° c 到95° c。通常, 每个周期收集一个数据点由温度的逐步增量每周期0.5 ° c。
- 通过3% 琼脂糖凝胶电泳检查所有 PCR 产品。
注意: 在 NTC 反应中任何波段或峰值的出现可能与在熔化曲线的低温下通常看到的底漆-二聚体形成有关, 而在 RNA 样本中任何波段或峰值的存在都是 gDNA 污染的结果。建议首先通过 rDNA 的引物检测所有的 RNA 样本, 然后将非 DNA 污染的样品用于下游应用, 如 cDNA 合成、基因表达分析、等。
5. rt-pcr 技术在 cDNA 合成和 qPCR 分析中的步骤
- 在室温下解冻dnasei处理的 RNA 和 cDNA 合成试剂。解冻后, 旋下试剂。添加1µg 的 RNA 和1µL 的寡糖 (dT) 18 引物到一个核酸自由管。调整12µL 的总体积与无核糖核酸的水, 轻轻混合, 然后储存在冰上。
- 通过在65° c 下孵化反应, 将 RNA 模板的次级结构熔化5分钟, 在冰上旋转并冷却瓶子。
- 准备反应大师组合 (最后容量20µL 为每个反应) 如下: 1 µL 逆转录酶 (200 u/µL), 4 µL 反应缓冲液 (5x), 1 µL 的核糖核酸抑制剂 (20 u/µL) 和2µL 的 dNTP 混合 (10 mM)。在冰上轻轻地混合, 冷却瓶子。将19µL 加入含有 RNA 的准备好的试管中。
- 孵育反应为60分钟在42° c, 然后孵育在70° c 为5分钟终止逆转录酶活动。将 RT 反应置于冰上, 并按常规 qPCR 程序进行基因表达分析 (如3和4节所述)。
结果
我们建议使用 rDNA 基引物来验证叶组织 RNA 样本中无 gDNA 污染的情况。qPCR 分析和 gDNA 污染检测的流程图显示在图 2中。在所提出的协议中, 两种互补策略用于基于 rDNA 的引物设计: 1) 从它序列和 2) 中选择了物种特异性引物, 从它侧翼区域选择了通用底漆。为了验证概念, 我们设计了特定于獐沙参的底漆, 和基于禾本科物种的通用引物, 如协议中所给的。5.8S 前向和反向引物的选择是基于一个保守的14碱基对 (bp) 的主题, 显示开花植物, 苔藓植物和几个订单的藻类和真菌的相似性14。设计的引物的特点在表 2中给出。通过 BLASTn 检查了 SSU、5.8S 和路易斯安那州的底漆的普遍性, 并在图 3中介绍了底漆的同源性结果作为主题徽标。在表 1中给出了同源分析中包含的物种列表以及每个物种的发散引物。底漆的特异性是通过底漆爆破检查。对于整个基因组序列可用的物种, 估计了 rDNA 基因的染色体定位。例如, 在水稻和拟南芥, rDNA 基因位于两个不同的染色体, 并在玉米梅斯在三不同的染色体。
以 DNA 为模板, 利用 ITS1 和 ITS2-flank 增的熔融曲线分析, 对 rDNA 基底漆进行了 qPCR 验证。 如在图 4和 图 5中所示, 入门特异性是通过观察不同禾本科种类的单一尖峰, 而不含底漆-二聚体形成, 包括小麦小麦,大麦大麦,水稻叶, 并在双子叶植物紫花苜蓿,黄瓜,烟草烟草, 红车轴 alexandrinum,蚕豆, 和拟南芥。通过电泳尺寸分离对扩增产物的进一步检测显示出一个独特的波段。如预期的那样, 来自不同物种样本的带区大小各不相同 (图 6A和6B)。有趣的是, 为三禾本科种专门设计的通用引物的使用不仅对其他禾本科物种有用, 而且对其他植物物种如A. 南芥,和内生真菌viz。Piriformospora 籼稻。
使用 gDNA 作为模板的沙参中的 qPCR 也确认了设计的特定底漆 (ITS1) 的有效性。观察到一个无引物-二聚体形成的单峰。令人惊讶的是, a. 沙参ITS1 底漆 (作为特定的底漆) 不仅在a. 沙参中生成了单个锐带, 而且还为所有其他测试物种提供了除烟草烟草和红车轴 alexandrinum,它产生两个频带 (图 6C)。gDNA 污染检测是由其或其侧翼引物在所有 RNA 样本中进行的。在 gDNA 污染检测中, 放大板的示意图表示, 并在图 7中介绍了结果的解释。
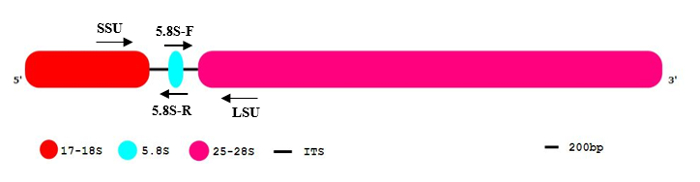
图 1: 真核 rDNA 序列组织的一般模式。
真核 rDNA 段包含 17-18S (红色)、5.8S (蓝色) 和 25-28S rRNA (粉红色)。内部转录间隔 (它) 被表明作为黑线。5´and 3´指示 DNA 分子的方向。请单击此处查看此图的较大版本.
图 2: RT qPCR 和 gDNA 污染检测的工作流.请单击此处查看此图的较大版本.
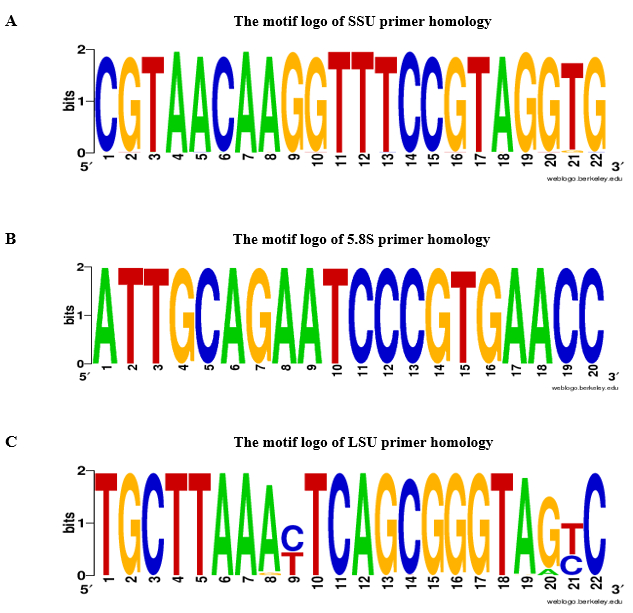
图 3: a. SSU 的主题徽标, B. 5.8S 和 C. 路易斯安那州立的底漆同源性.对于 SSU, 5.8S, 和路易斯安那州立会底漆, 主题标志是由 BLASTn 建立的基础上2000绿色植物记录 (NCBI taxid 数字: 33090) 与一个切断的电子值≤10-10。腺嘌呤, T-嘧啶, G 鸟嘌呤, c-胞嘧啶。请单击此处查看此图的较大版本.
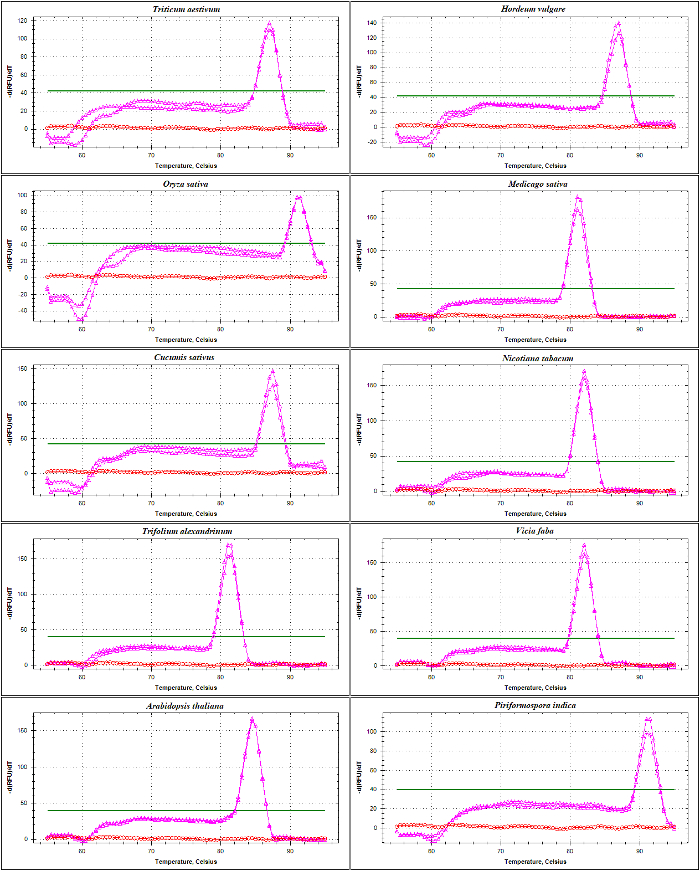
图 4: 不同品种 ITS1-flanking 增的熔融曲线分析。
这增, 由 SSU 和 5.8S-R 引物放大, 包含部分序列从17-18S 编码区域, 整个序列的 ITS1 和部分序列的5.8S。显示的是增生成的 (粉红色) 和 NTC (红色) 从小麦的,大麦大麦,水稻,苜蓿蒺藜,黄瓜,烟草烟草, 的融化曲线红车轴 alexandrinum,蚕豆,拟南芥,和Piriformospora 籼稻。平面粗体线指示基线阈值。请单击此处查看此图的较大版本.
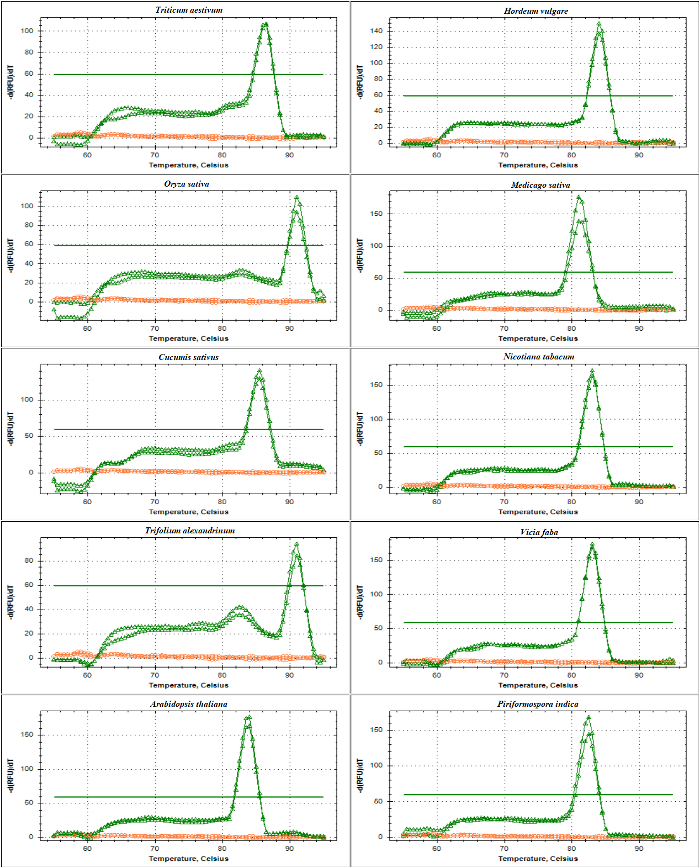
图 5: 不同品种 ITS2-flanking 增的熔融曲线分析。
这种增是由5.8S 和路易斯安那州立的底漆的使用产生的。所描述的增包含 5.8 S 部分的序列、ITS2 的整个序列和25-28S 的部分序列。显示的是增 (绿色) 和 NTC (红色) 的熔融曲线, 由小麦生产,大麦大麦,水稻,苜蓿蒺藜,黄瓜,烟草烟草, 红车轴 alexandrinum,蚕豆,拟南芥和Piriformospora 籼稻。请单击此处查看此图的较大版本.
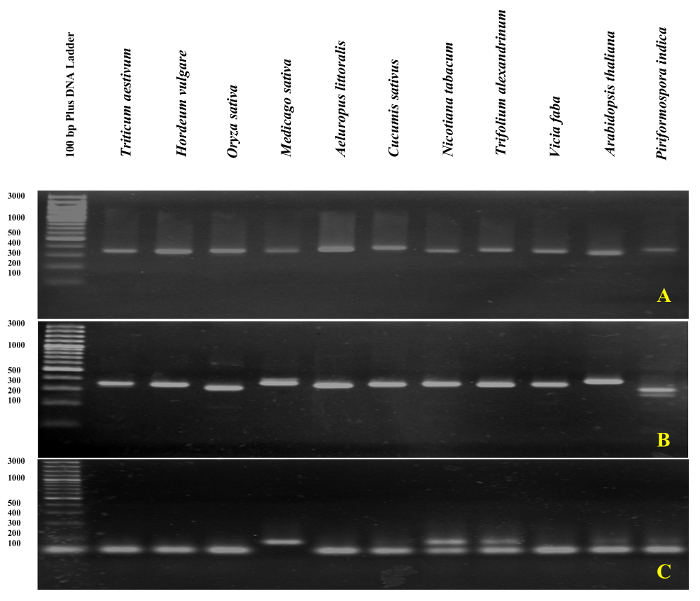
图 6: 基于 rDNA 的 PCR 产品的琼脂糖凝胶分析。
增的 ITS1-flanks (A)、ITS2-flanks (B)、和 ITS1 (C)在3% 琼脂糖凝胶上运行。请单击此处查看此图的较大版本.

图 7: 它的内含子样特征可以被认为是设计可检测 gDNA 污染的引物。
任何峰值或波段的预期大小 qPCR 分析表明 gDNA 污染的 RNA 样本。Unk: 未知样品, pos: 阳性对照, NTC: 非模板控制。请单击此处查看此图的较大版本.
| 底漆 | 属 | Taxid ID | 物种 | 发散底漆 | ||
| ssu | 南 | 3701 | kamchatica、南芥和lyrata | - | ||
| 蚕豆 | 3904 | 白花、美洲、unijuga、amoenane、山、craccamal、伪 orobus、赖、粳稻、ramuliflora和蚕豆 | ||||
| 车轴 | 3898 | alexandrinum、montanum、resupinatum和白三叶草 | - | |||
| 烟草 | 4085 | 烟草、烟、otophora、picilla、海蓬子、palmeri、tomentosiformis、毛白杨、digluta、栲、clevelandii、nesophila、solanifolia、茜草、debneyi、arentsii、thyrsiflora、wigandioides、蛤、中、noctiflora、petunioides, 明子, miersii, pauciflora, 渐狭, 疣, 线形, 薯, 樟子松, rustica和杨 | - | |||
| 黄瓜 | 3655 | anguria、甜瓜和 "对" | CGTAACAAGGTTTCCGTAGGKG | |||
| 獐 | 110873 | - | 未发现底漆 | |||
| 苜蓿 | 3877 | 天蓝、pamphylica、孢、喙、蚌和蒺藜 | - | |||
| 水稻 | 4597 | glumipatula, 稻 barthii 稻点, longistaminata , 鲇, 对于, 鲇和longistaminata | - | |||
| 小麦 | 4564 | 小麦、urartu和染色体 | - | |||
| 大麦 | 4512 | 大麦、bulbosum、marinum、大麦和布顿 | - | |||
| lsu | 南 | 3701 | petraea、南芥和lyrata | TGCTTAAACTCAGCGGGTAATC | ||
| 蚕豆 | 3904 | sylvatica、tetrasperma、苜蓿、粗毛, 柳根, 小, 广,lathyroides, orobus, orobus,bithynica和蚕豆 | TGCTTAAATTCAGCGGGTAGCC | |||
| 车轴 | 3898 | 伪装, 普里沃, resupinatum, 腰果,subterraneum,strictum,ochroleucon, glomeratum,squamosum、ornithopodioides和白三叶草 | TGCTTAAATTCAGCGGGTAGCC | |||
| 烟草 | 4085 | 烟草、烟、otophora、picilla、海蓬子、palmeri、tomentosiformis、毛白杨、digluta、栲、clevelandii、nesophila、solanifolia、茜草、debneyi、arentsii、thyrsiflora、wigandioides、蛤、中、noctiflora、petunioides, 明子, miersii, pauciflora, 渐狭, 疣, 线形, 薯, 樟子松和杨 | TGCTTAAACTCAGCGGGTAGTC | |||
| 黄瓜 | 3655 | 梅洛, ritchiei和胆子 | TGCTTAAACTCAGCGGGTAGTC | |||
| 獐 | 110873 | lagopoide、木姜子和沙参 | TGCTTAAATTCAGCGGGTAATC | |||
| 苜蓿 | 3877 | 蓿、苜蓿、天蓝、阿拉伯咖啡、酵母和最小值 | TGCTTAAATTCAGCGGGTAGCC | |||
| pamphylica、孢、喙和蚌 | TGCTTAAACTCAGCGGGTAGTC | |||||
| 水稻 | 4597 | 仁,glumipatula, 稻,barthiial, 稻,australiensis,australiensis、ridleyi、malampuzhaensis、对于、稻、鲇和longistaminata | TGCTTAAACTCAGCGGGTAGTC | |||
| 小麦 | 4564 | 小麦,spelta, turgidum,野生、petropavlovskyi、urartu和染色体 | TGCTTAAACTCAGCGGGTAGTC | |||
| 大麦 | 4512 | 大麦, bulbosum, murinum,secalinum、大麦和布顿 | TGCTTAAACTCAGCGGGTAGTC | |||
| 一个退化的底漆被定义为核苷酸命名的 IUPAC 系统 | ||||||
表 1: 被考虑用于采摘 rDNA 的引物的种类名单。
与路易斯安那州的结合位点相比, 在给定属上具有更高的序列同源性。
| 增长度 | 放大面积 | 序列 | 底漆名称 | 增 | |
| 332-405 bp | 部分序列的 SSU, 整个序列的 ITS1 和部分序列的5.8S | CGTAACAAGGTTTCCGTAGGTG | ssu | ITS1-flanks | |
| GGTTCACGGGATTCTGCAAT | 5.8S 河 | ||||
| 318-361 bp | 部分序列的 5.8S, 整个序列的 ITS2 和部分序列的路易斯安那州立会 | ATTGCAGAATCCCGTGAACC | 5.8S-F | ITS2-flanks | |
| TGCTTAAAYTCAGCGGGTAGYC | lsu | ||||
| 100-200 bp | ITS1 | GGTATGGCGTCAAGGAACACT | ITS1-F | ITS1 | |
| ATAGCATCGCTGCAAGAGGT | ITS1-R | ||||
表 2: 底漆序列。
讨论
近年来, 定量 PCR 技术在基因表达分析中得到了广泛的应用。这种快速, 成本效益和自动化的方法的主要好处是它的准确和准确的结果。然而, 从这些优势中获得最佳效益需要清楚地了解用于 qPCR 实验的参数的设置。为了在 qPCR 基因表达分析中获得可靠的结果, 必须避免在 RNA 样本3,15中从引物-二聚体或 gDNA 污染中产生的非特异性放大。预计 RNA 转录水平将被高估在 gDNA 污染8。在这里, 一个 rDNA 基因的独特的特点被认为是 gDNA 污染检测的 RNA 样本。
此协议中使用的 rDNA 的基本属性:核糖体基因由两个它, 即 ITS1 和 ITS2, 以及三 rRNA 编码基因, 17-18S, 5.8S 和25-28S 亚基12。它的两个区域不是核糖体亚基编码序列的一部分。它们被至少三酶活性去除, 以处理成熟 rRNA 的前驱体: 切、旋和酶活性。由于核糖体 RNA 转录为 polycistronic 转录, 一个主要产品包含它是肯定存在的。处理速度非常快, 在核仁中发生, 而含有其的可检测的前驱分子的数量低于 qPCR 法的检测限度。因此, 当 ITS1 或 ITS2 被其侧翼引物放大时, 在 RNA 样本中不能检测到放大, 除非存在 gDNA 污染。真核生物基因组中的 rDNA 基因数量估计包括多达1000份, 它们排列在染色体的单或串联阵列上11。在这个协议中, 我们提出了一种替代的方法, 而不是, 以检测 gDNA 污染, 这是在每个反应/化验中使用。
与现有方法有关的优点和限制:通常用于检测准备好的 RNA 样品是否清洁或被 gDNA 污染。由于 gDNA 污染不均匀分布在不同的 RNA 样本之间, 而且对 gDNA 的反应敏感性受所分析的基因影响很大, 每个样本/化验对7,15都需要进行控制。这将极大地增加成本和劳动力同时处理多个示例3,9。文献中记录的其他替代方法包括使用内含子特定的底漆来检测 gDNA, 或者设计引物, 或者在一个内含子或跨外显子结点的旁边。这些方法的局限性源于内含子序列信息的不可用性、内含子/外显子结构的不完全标注, 以及在基因或基因中缺少内含子1,4,10.由于进化, rDNA 基因存在作为基因和高度保守的基因家庭。他们是高度丰富的基因组和目前在不同的染色体13。与其他编码或 nonconding 基因相比, rDNA 基因显示最适合检测 gDNA 污染。在比较组分析中, 不推荐用 rRNA 校验仪对 qPCR 数据进行归一化处理, 如 cDNA 制备 (波利亚启动与随机六启动) 的差异, rRNA 与 mRNA 的丰度差异较大和不同的生物, 可能会产生误导性结果10,16。然而, 我们刚才提到的问题是 gDNA 污染检测的优势。例如, 关于在基因组中更高的靶点, 以及不同染色体上的定位, 基于 rDNA 的引物与现有方法相比, 能显著提高 gDNA 的检测灵敏度。
Versality rDNA-基于其他生物体: rDNA 基因是在大多数生物体中被鉴定出的一个研究良好的基因家族。建议的基于 rDNA 的方法是一个简单, 高度敏感, 经济系统的 gDNA 污染的分析, 可以很容易地适应其他真核和原核生物 (协议 2-5)。作为一个案例研究, 我们在这里展示了这种方法在一些 Poceae 物种中的效用 (图 4和图 5)。使用的引物显示了高的转移率到其他 Poceae 种类由于高度保守的结构 rDNA 亚基在种类之中。当没有足够的基因组序列信息用于底漆设计时, 这个问题就变得更加重要。因此, 为一个物种设计的侧翼引物可用于相关物种。此外, 5.8S-f-/R 底漆是根据一个保守的主题, 显示高相似性在大多数开花植物14。虽然高通量测序技术永久性地增加已知基因组的数量, 但大多数生物体的外显子-内含子注释还没有完成, 因此通常不可能设计引物来跨越外显子边框。我们的方法解释了如何 rDNA 基引物可以应用于 gDNA 污染测定的 qPCR 分析原和真核生物的目标, 消除昂贵的控制在每个化验/底漆组合。
披露声明
作者没有相互竞争的金融利益。
致谢
这项研究得到了 Tabarestan (GABIT)、莎莉农业科学和自然资源大学 (SANRU) 的遗传和农业生物技术研究所的支持。初级研究组非生物应激基因组学由 IZN (Saale), 德国的多学科中心作物研究所资助。我们感谢朗达. 迈尔对手稿的批判性阅读。
材料
| Name | Company | Catalog Number | Comments |
| Maxima SYBR Green / ROX qPCR Master Mix (2X) | Thermo Scientific | K0221 | |
| TissueLyser II | QIAGEN | 85300 | |
| RevertAid H Minus First Strand cDNA Synthesis Kit | Thermo Scientific | K1631 | |
| GeneRuler 100 bp Plus DNA Ladder | Thermo Scientific | SM0321 | |
| 96 well WHT/CLR | Bio-Rad | HSP9601 | |
| Microseal B film | Bio-Rad | MJ-0558 | |
| Low tube strip CLR | Bio-Rad | TLS0801 | |
| Flat cap strips | Bio-Rad | TCS0803 | |
| NanoDrop 2000 | Peqlab | ND-2000 | |
| RNaseZAP | Ambion | 9780 | |
| Centrifuge | Eppendorf | 5810 R | |
| Agilent RNA 6000 Nano Kit | Agilent Technologies | 5067-1511 | |
| 2100 Electrophoresis Bioanalyzer | Agilent Technologies | G2939AA | |
| RNase A, DNase and Protease-free | Thermo Scientific | EN0531 | |
| DNase I, RNase-free | Thermo Scientific | EN0523 | |
| TRIZOL Reagent | Ambion | 15596026 | |
| CFX96 Touch Real-Time PCR Detection System | BIO RAD | 1855195 | |
| PCR tube, 0.2 mL, RNase-free | Stratagene | Z376426 | |
| Guanidine thiocyanate for molecular biology | Sigma-Aldrich | G9277 | |
| Agarose - Nucleic Acid Electrophoresis | Sigma-Aldrich | A9414 | |
| Boric Acid for molecular biology | AppliChem | A2940 | |
| bromophenol blue | AppliChem | A2331 | |
| ethidium bromide | AppliChem | A1151 | |
| Gel documentation system | BIO RAD | Gel Doc 2000 |
参考文献
- Bustin, S. A., Nolan, T. Pitfalls of quantitative real-time reverse-transcription polymerase chain reaction. J Biomol Tech. 15 (3), 155-166 (2004).
- Gutierrez, L., Mauriat, M., Pelloux, J., Bellini, C., Van Wuytswinkel, O. Towards a systematic validation of references in real-time RT-PCR. Plant Cell. 20 (7), 1734-1735 (2008).
- Hashemi, S. H., Nematzadeh, G., Ahmadian, G., Yamchi, A., Kuhlmann, M. Identification and validation of Aeluropus littoralis reference genes for Quantitative Real-Time PCR Normalization. J Biol Res (Thessalon). 23 (1), 18(2016).
- Bustin, S. A. Absolute quantification of mRNA using real-time reverse transcription polymerase chain reaction assays. J. Mol. Endocrinol. 25 (2), 169-193 (2000).
- Andersen, C. L., Jensen, J. L., Orntoft, T. F. Normalization of real-time quantitative reverse transcription-PCR data: a model-based variance estimation approach to identify genes suited for normalization, applied to bladder and colon cancer data sets. Cancer Res. 64 (15), 5245-5250 (2004).
- Bustin, S. A., et al. The MIQE guidelines: minimum information for publication of quantitative real-time PCR experiments. Clin Chem. 55 (4), 611-622 (2009).
- Laurell, H., et al. Correction of RT-qPCR data for genomic DNA-derived signals with ValidPrime. Nucleic Acids Res. 40 (7), e51(2012).
- Galiveti, C. R., Rozhdestvensky, T. S., Brosius, J., Lehrach, H., Konthur, Z. Application of housekeeping npcRNAs for quantitative expression analysis of human transcriptome by real-time PCR. RNA. 16 (2), 450-461 (2010).
- Laurell, H., et al. Correction of RT-qPCR data for genomic DNA-derived signals with ValidPrime. Nucleic Acids Res. 40, e51(2012).
- Caldana, C., Scheible, W. R., Mueller-Roeber, B., Ruzicic, S. A quantitative RT-PCR platform for high-throughput expression profiling of 2500 rice transcription factors. Plant Methods. 3 (1), 7(2007).
- Lawrence, R. J., Pikaard, C. S. Perspectives Chromatin Turn Ons and Turn Offs of Ribosomal RNA Genes. Cell Cycle. 3 (7), 880(2004).
- Boisvert, F. M., van Koningsbruggen, S., Navascues, J., Lamond, A. I. The multifunctional nucleolus. Nat Rev Mol Cell Biol. 8 (7), 574-585 (2007).
- Alvarez, I., Wendel, J. F. Ribosomal ITS sequences and plant phylogenetic inference. Mol Phylogenet Evol. 29 (3), 417-434 (2003).
- Jobes, D. V., Thien, L. B. A conserved motif in the 5.8 S ribosomal RNA (rRNA) gene is a useful diagnostic marker for plant internal transcribed spacer (ITS) sequences. Plant Mol Biol Report. 15 (4), 326-334 (1997).
- Padhi, B. K., Singh, M., Huang, N., Pelletier, G. A PCR-based approach to assess genomic DNA contamination in RNA: Application to rat RNA samples. Anal Biochem. 494, 49-51 (2016).
- Dheda, K., et al. Validation of housekeeping genes for normalizing RNA expression in real-time PCR. Biotechniques. 37 (1), 112-114 (2004).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。