Method Article
DNA kirlenme ribozomal DNA tabanlı RNA örneklerinde değerlendirilmesi
Bu Makalede
Özet
Burada, RNA örneklerinde genomik DNA (gDNA) kirlilik izleme için bir iletişim kuralı mevcut. Sunulan yöntem astar özel ribozomal DNA (rDNA) gen iç kopya etmek spacer bölge (ITS) için kullanır. Yöntem güvenilir ve hassas algılama DNA kirlenme çoğu Ökaryotlar ve prokaryotlar için uygundur.
Özet
Yoğun gen ifade değişiklikleri ve transkript miktar miktar için kullanılan bir ters-transkripsiyon nicel gerçek zamanlı PCR (RT-qPCR) yöntemidir. Doğru hassas, güvenilir ve tekrarlanabilir sonuçlar sağlar. Çeşitli faktörler duyarlılık ve özgüllük RT-qPCR etkileyebilir. RNA örnekleri kirletici kalan genomik DNA (gDNA) onlardan biri. Gen ifade analizi, non-spesifik amplifikasyon gDNA kirlilik nedeniyle transkript düzeyleri bolluk abartma ve RT-qPCR sonuçları etkileyebilir. Genel olarak, gDNA qRT-PCR tarafından algılanır astar kullanarak çiftleri intergenic bölgeler veya bir intron faiz gen tavlama. Ne yazık ki, intron/exon ek açıklamalar tüm genler için omurgalılar, bakteri, protista, mantar, bitki ve omurgasız metazoan türler bilinen henüz değil.
Burada algılama RNA içinde gDNA kirlenme ribozomal DNA (rDNA) kullanarak örnekleri için bir iletişim kuralı mevcut-astar dayalı. Bu yöntem rDNA benzersiz özellikleri üzerinde dayanır: onların multigene doğa, son derece korunmuş dizileri ve yüksek frekans genom içinde. Ayrıca bir vaka çalışması olarak astar benzersiz bir kümesi tasarlanmıştır tabanlı ribozomal DNA (rDNA) buğdaygiller ailesindeki korunmuş bölge. Bu astar çiftleri evrenselliğini eritebilir eğrisi analizi ve özel Jel Elektroforez tarafından test edildi. Her ne kadar bizim yöntem açıklar nasıl rDNA dayalı astar buğdaygiller aile içinde gDNA kirlenme tahlil için uygulanabilir, bu kolayca diğer prokaryotlar ve ökaryot türler için kullanılabilir
Giriş
Gen kümeleri ilginç veya ağları sinyal transkripsiyon yönetmelik keşfetmek karmaşık moleküler mekanizmaları biyolojik olaylar1' de yer alan anlamak önemlidir. Şu anda, qPCR en yaygın yaklaşım analizi, methylome ve transcriptome sırasıyla izni (Genom) DNA veya RNA (transcriptome) hedefleyen gen ifade çalışmaları için kullanılan. analizidir. Ters transkripsiyon (RT) qPCR tarafından takip çeşitli alanlarda Biyolojik araştırma2gen ifade düzeyleri ölçmek transcriptome analiz için yaygın olarak kullanılır. Karşılaştırıldığında diğer gibi geleneksel Kuzey hibridizasyon yöntemleri, doku özel algılama içinde in situ hibridizasyon, ribonükleaz koruma deneyleri (RPA) ve yarı-RT-PCR, doğruluğu, kolaylık, hız ve geniş dinamik alan değerleri üzerinden qPCR tabanlı deneyleri son derece dikkat çekici3,4vardır. Mesajcı RNA (mRNA), kalite ve malzeme başlayan RNA miktarı dahil olmak üzere güvenilir bir miktar için dikkate alınması gereken çeşitli faktörler önemli. Ayrıca, non-spesifik amplifikasyon, RT-qPCR verimliliğini ve PCR verimlilik5,6düşünülmesi gerek.
GDNA içsel bir sorun RNA ayıklama sırasında nedeniyle, kısmen, benzer fiziksel ve kimyasal özellikler DNA ve RNA7için varlığıdır. GDNA ve Tamamlayıcı DNA (cDNA) mRNA örneklerinden elde edilen sıra kimlik nedeniyle, non-spesifik amplifikasyon, hangi RT-qPCR sonuçları doğruluğunu etkiler oluşabilir. Kalan gDNA ve bereket tahmindi için yol açacaktır mRNA gen ifade analiz8' hedef.
Temel olarak, non-spesifik amplicon çoğunlukla astar-dimer oluşumu veya belirsiz arka plan amplifikasyon gDNA, ikisi de uygun kontrol örnekleri kullanarak tespit edilebilir nedeniyle ortaya çıkar. Böyle örnekleri herhangi bir şablon kontrolü (NTC) ve ters transkriptaz kontrol (NRT), sırasıyla vardır. Beri okudu örnekte gDNA kirlenme düzeyleri farklı ve gDNA karşı duyarlılığı, büyük ölçüde analiz genler arasında farklıdır, NRT denetimleri her örnek/tahlil çifti için gereklidir. Bu önemli ölçüde maliyet ve RT-qPCR profil oluşturma çalışmaları sancısı artırır, ancak bu gerekli7,9denetimleridir.
Alternatif yöntemler gDNA kirlenme ile ilgili intergenic bölgeler veya faiz10gen ve büyük bir intron kanattan veya bir exon exon junction, Yani span astar kullanımı bir intron tavlama astar çiftleri kullanımını içerir tavlama siteleri yok olgun mRNA sıra1,4. Ancak, birçok omurgalılar, bakteri, protista, mantar, bitki ve omurgasız metazoan türler tüm genler için intron/exon ek açıklamalar henüz denir. Buna ek olarak, birçok ökaryotik organizmaların psödogenler çoğaltma olaylardan elde var. Ayrıca, astar tasarım intron genelinde sigara-amplifikasyon gDNA garanti etmez. Kromatin olarak erişilebilirliğini Dnaz genomik bölgelere göre değişir, farklı astar çiftleri farklı kromozomlar10hedefleme tasarlamak için önerilir.
Ökaryotik organizmaların genleri ribozomal alt ribozomlara oluşumu için gerekli kodlama rDNA genler kopyalarını bin kadar kapsayacak. Bu rDNA genler kez tek veya tandem tekrar dizi11' düzenlenir. Büyük alt birim (LSU) ve küçük alt birim (SSU) dahil olmak üzere Polycistronic rRNA'lar (şekil 1) RNA polimeraz tarafından transkripsiyonu ben (RNA pol ben). Elde edilen ön rRNA'lar iki iç kopya etmek spacer bölgeleri ITS1 ve ITS2 ortadan kaldırarak daha fazla işlenir. Son ürünler üç olgun rRNA'lar, 17-18 rRNA (SSU), 5.8S ve 25-28S rRNA (LSU) vardır oluşturulan12. rDNA genler tipik son derece korunmuş serileri ile multigene bir aile temsilcileri bulunmaktadır. Onlar genom bir yüksek frekans ile oluşur ve birden fazla kromozom konumu13, potansiyel olarak mevcut. RRNA işlenmesi ve kopya etmek boşluk ekleyiciler bozulması çekirdekçik hızlı bir süreçtir. Repetitiveness yüksek derecede nedeniyle, genomik kopya numarası ve algılanabilir işlenmemiş RNA premolecules oranı olduğunu daha düşük düşük-kopya intron dizileri ve unspliced öncüleri ile karşılaştırıldığında. Bu özellikler rDNA genler de gDNA kirlenme çoğu prokaryot ve Ökaryotlar3güvenilir ve son derece hassas tespiti için uygun olun.
Burada RNA örnekleri içinde gDNA kirlenme tespit için yeni bir yordam açıklanır. Evrensel astar korunmuş rDNA sıralamasına dayanan bir dizi gDNA deneyleri birkaç buğdaygiller türler için sunulur. Özgüllük ve önerilen astar evrenselliğini DNA şablon olarak kullanıp eritebilir eğrisi analizi tarafından test edildi. Bizim iletişim kuralı yalnızca buğdaygiller için geçerli değildir, ama diğer prokaryotik ve ökaryotik türler için de kolayca adapte.
Protokol
Not: Herhangi bir doku kullanılabilir.
1. nükleik asit çıkarma
- Doku örnekleri 100 mg bir 2.0 mL tüp içinde koymak, iki 5 mm paslanmaz çelik boncuk ekleyin ve 25-30 Hz değerinde doku 30 homojenize RNA ve DNA için s (homojenizasyon süresi ve sıklığı doku türüne bağlı olarak).
- Üreticinin yönergelerine göre toplam RNA yalıtmak.
- Üreticinin yönergelerine göre toplam DNA izole et.
- Saflık ve RNA örnekleri miktarı 260 ve 280 nm Absorbans ölçerek kontrol.
- Saflık ve DNA örnekleri miktarı 260 ve 280 nm Absorbans ölçerek kontrol.
Not: Süre nükleik asitler absorbe ışık ile bir dalga boyu 260 nm (A260), (A280) Absorbans ışığın dalga boyu 280 adlı protein miktarını ölçmek için kullanılabilir ve fenoller örnek mevcut. Bu nedenle, A260/A280 nm oranını DNA ve RNA bir örneğinden çıkarılan saflığı değerlendirmek için kullanılabilir. A260/280 değerleri ≥1.8 aralığında ve > 2.0 genellikle sırasıyla "DNA ve RNA, saf" olarak kabul edilir. Daha düşük A260/280 değerleri protein veya organik kimyasal kirlenme gösterebilir. - DNA'ın kalite % 0.7 özel Jel Elektroforez çalıştırarak sınayın. Jel hazırlamak ve 1 x TRIS Borik EDTA-tampon çalıştırmak (TBE: 89 mM Tris, 89 mM Borik asit ve 2 mM EDTA) 100 V 30 dk. yüksek kalite gDNA bir keskin görünür için yüksek molekül ağırlıklı (HMW) grubu yok iftiralar düşük molekül ağırlıklı (LMW) molekülleri aralığında.
- İzole RNA miktarı, saflık ve koşullar bir guanidin thiocyanate (GTC) özel Jel Elektroforez veya kapiller Elektroforez çip, denaturing altında bütünlüğü için üreticinin yönergelerine göre kontrol edin.
- GTC jel agar 60 ° C'ye soğutma sonra bir standart 1 x TBE % 1'özel jel için 5 mM GTC ekleyerek hazırlamak
Not: GTC zehirlidir, bu yüzden bir duman mahallede dağıtmak ve uygun kişisel koruyucu donanımları. - Yükleme arabellek denaturing RNA hazırlamak: % 95'i formamide, 10 mM EDTA faz 8.0, % 0,1 bromophenol mavi, % 0,1 Ksilen cyanole ve 10 µL etidyum bromür.
Not: Formamide ve etidyum bromür zehirlidir ve duman mahallede kalmaması. - Yük 1-5 µg yükleme arabellek, ısı karışımı 70 ° C'de 5 min için denaturing RNA içinde toplam RNA'ın bir jel yüklemeden önce buzda yerleştirin ve sonra standart olarak GTC jel 100 V 45 dk. yük DNA veya RNA moleküler ağırlık işaretçi için üzerinde RNA ayrı RNA örnek.
- Etidyum bromür ile jelleri leke ve ultraviyole ışık altında Yansıma yakalama sistemleri kullanarak bantları görselleştirin. Ökaryotlarda, en az iki keskin ve net rRNA grup (28S ve 18S) 2:1 yoğunluk oranı ile olduğu gibi toplam RNA koşulları denaturing adlı çalıştırmak gösterecektir.
- GTC jel agar 60 ° C'ye soğutma sonra bir standart 1 x TBE % 1'özel jel için 5 mM GTC ekleyerek hazırlamak
- Dnaz tedaviyle tarafından gDNA izlerinin giderilmesi (Dnaz ben RNase free). 10 µL Toplam hacim RNase free tüpte ekleyin: 0.1 - 1 µg toplam RNA, ben ve 10 x reaksiyon 1 µL tampon MgCl2ile Dnaz bir birim. 37 ° C'de 30 dk için karışım kuluçkaya 50 mm EDTA 1 µL ekleyerek ve 10 dk 65 ° C'de kuluçka tepki sonlandırın.
- RNA'ın üreticinin protokole göre Dnaz ücretsiz RNase A, kullanarak gDNA özler izleri. 5 µL RNase eklemek 10 mg/mL toplam DNA ve-80 ° C'de 1 h. mağaza RNA ve DNA özleri için 37 ° C'de kuluçkaya
2. Astar tasarım rDNA bölge gDNA tahlil için gelen
Not: Olgun rRNA molekül endonucleolytic nefrette bir dizi tarafından kaldırılır ve sonra bozulmuş (şekil 1) iki bölgeler (ITS1 ve ITS2), rDNA tam uzunlukta sıra içerir.
- NCBI (http://www.ncbi.nlm.nih.gov) faiz türler için rDNA nükleotid dizisi al. Veritabanı arama için en iyi anahtar kelime "iç kopya etmek spacer." olduğunu
- İç kopya etmek spacer bölgeleri (Itss), SSU ve LSU bulma korunmuş bölgeler için hedef nükleotid dizisi BLASTn arama içine girdi.
- Astar ya Itss dizisi sarmayı seçin veya olgun rRNA mevcut olmayan Itss dizileri genişletirsiniz.
- Astar ITS1 veya ITS2 dizileri kanat tasarımı: ilogenetik tarafından çeşitli türlerden korunmuş bölgeler hizalamak. Takson türler-özel/arası analiz AlleleID yazılımı ile sonra kanat bölgeye ilişkin astar özel tasarım. İki astar yükselterek SSU çiftleri-5.8S ve 5.8S-Louisiana Üniversitesine amplicons tasarlanmış tabanlı ITS1 ve ITS2, kanat bölgelerinde sırasıyla. Çünkü bu amplicons Its bölgesi kapsayan, amplicon uzunluğu en az 300 için artırılacak amplicons gDNA düşük kan basıncı. Bu artış hassasiyeti azaltır.
- ITS1 kanat: SSU ve 5.8S seçin rRNA sıra. Buğdaygiller için seçilen astar vardır: SSU, SF: CGTAACAAGGTTTCCGTAGGTG, R: GGTTCACGGGATTCTGCAAT. Bu astar çifti (SF: ileri ve R: geri) SSU kısmi bölge, ITS1 tam uzunlukta ve 5.8S kısmi bölgesi güçlendirir rDNA.
- ITS2 kanat: 5.8S ve LSU sırasını seçin. Buğdaygiller için seçilen astar vardır: F: ATTGCAGAATCCCGTGAACC LSU fikir birliği sıra, LR: TGCTTAAAYTCAGCGGGTAGYC. Bu astar çift 5.8S kısmi bölge, uzun ITS2 ve Louisiana Üniversitesine (şekil 1) kısmi bölgesi güçlendirir.
Not: Bölge, SSU, son derece korunmuş alanlarda kanat Itss dayalı astar tasarım durumunda 5.8S ve LSU tespit edilmiştir. İleriye ve geriye doğru astar 5.8S rRNA bağlı çiçekli bitkiler14korunmuş bir motif olarak tasarlanmıştır. İleriye ve geriye doğru astar göre tasarlanmış SSU ve LSU korunmuş bölgelerde buğdaygiller, anılan sıraya göre. SSU ve LSU astar için her tür sapma Tablo 1' de verilmiştir.
- Itss dizisi yükseltecek astar: Bu protokol için tasarım ITS1 astar Aeluropus üzerinde sıra tabanlı (NCBI taxid sayı: 110873). Astar için kullanın: İleri: GGTATGGCGTCAAGGAACACT, ters: ATAGCATCGCTGCAAGAGGT. Astar çiftleri silicotarafından oluşturulan amplicons göre 60 200 boyutu değişir kan basıncı. Bu da qPCR analiz için önerilen boyut olduğunu.
- Astar ITS1 veya ITS2 dizileri kanat tasarımı: ilogenetik tarafından çeşitli türlerden korunmuş bölgeler hizalamak. Takson türler-özel/arası analiz AlleleID yazılımı ile sonra kanat bölgeye ilişkin astar özel tasarım. İki astar yükselterek SSU çiftleri-5.8S ve 5.8S-Louisiana Üniversitesine amplicons tasarlanmış tabanlı ITS1 ve ITS2, kanat bölgelerinde sırasıyla. Çünkü bu amplicons Its bölgesi kapsayan, amplicon uzunluğu en az 300 için artırılacak amplicons gDNA düşük kan basıncı. Bu artış hassasiyeti azaltır.
- Astar bu önerileri dikkate alın: GC içeriği: % 40-60, astar uzunluğu: 18-23 temel, PCR ürün uzunluğu: 60-160 bp (özellikle için onun astar), sıcaklık (Tm) erime: 60 ° C arasında her iki astar için son Tm farklı değildir fazla 5 ° C ve prim ERS kendileri için tamamlayıcı değildir veya astar ortak.
- Astar özgüllük ve kopya numarasını kontrol edin. Astar-şok program (https://www.ncbi.nlm.nih.gov/tools/primer-blast/) tarafından seçilen astar sırası silis çözümlemesi gerçekleştirin.
- Primer-şok gönderme sayfası açın. Her iki astar dizileri form astar parametreler bölümüne girin. Parametreler bölümünde kontrol astar çifti özgüllük bir organizma adı (veya organizma grup adı) girin ve genom veritabanı seçin. Bu ayarlar hedef sıra ve astar parametreleri ürün uzunluğu, kromozom, pozisyon dahil olmak üzere hakkında özgüllük bilgi vermek ve numarasını kopyalayın.
3. qPCR adım rDNA dayalı astar DNA şablonları ile doğrulanmasını gerçekleştirmek
Not: GDNA şablon olarak kullanıp qPCR gerçekleştirerek tasarlanmış astar işlevselliğini doğrulanması. Birkaç paralel reaksiyonlar gerçekleştirmek ve pipetting hataları azaltmak için ana bir karışımı hazırlanması tavsiye edilir. İçin ana bir karışımı, bir birim tepki mix artı % ~ 10 toplam sayısı için eşdeğer hazırlayın.
- Ana bir karışımı bir PCR reaksiyon tüp DNA şablonunda hariç tüm reaksiyon bileşenleri karıştırarak hazırlayın. Master mix hazırlamak için gelen bir tepki gerektiği gibi lüks: 5 µL SYBR yeşil (SYBR) master mix (2 x), 0.3 µL astar (0.3 µM her ileriye ve geriye doğru astar) ve RNase free su ile 10 µL için son ses seviyesini. Yaklaşık ≤200 ng şablon gDNA 1 µL içinde çözümleme için kullanın.
Not: Çözülme, birleştirin ve tüm reaktifler, bileşenleri ve reaksiyon karışımları buz üzerinde tutun. - Aliquot Master mix optik bir 96-şey plaka içine. Her şey için gDNA 1 µL pipet ve sonra bu film mühürleme optik plaka ile kapsar. Spin ve cycler içinde yer.
- Aşağıdaki koşullar altında bir gerçek zamanlı termal cycler qPCR tahlil çalıştırın: 95 ° C'de 10 dakika takip 95 ° C 40 döngüsü tarafından adım 15 s ve 1 dk. gerçekleştirme veri toplama uzantısı tavlama/60 ° C, 60 ° C için.
- Amplifikasyon işlemden sonra tüm PCR tepkiler bir erime eğrisi analizi ile sürekli Floresans ölçüm için 55 ° C ile 95 ° c konu Tipik olarak, bir veri noktasını her döngüsü sıcaklığı kademeli bir artış tarafından devir başına 0.5 ° c toplamak.
Not: en az 2 şablonu olmayan denetimler (NTC) için her astar çift ana karışımını içerir. Tüm deneyleri içinde en az üç çoğaltmalar gerçekleştirin. - Astar özgüllük eritebilir eğrisi analizi ile onaylayın. Eğrileri tek eşik döngüsü ve subtracted eğrisi uygun yöntemi ile analiz.
Not: Bir Tekdüzen bireysel amplicon keskin bir bireysel tepe görünümünü gösterir. Astar dimer ürünleri daha düşük sıcaklıklarda bireysel tepeler olarak görünebilir. - Her amplicon boyutunu özel Jel Elektroforez tarafından doğrulayın.
- 3 g özel TBE tampon 100 mL ile karıştırılarak % 3 özel jel hazırlamak (TBE: 89 mM Tris, 89 mM Borik asit ve 2 mM EDTA).
- 5-10 µL PCR ürününün DNA ve 1-2 µL 6 x yükleme arabellek karıştırın. PCR ürünü % 3 özel jel bir DNA merdiven yanında yük. 1 x 100 V için 45 dk TRIS Borik EDTA arabellek elektroforetik ayrımı gerçekleştirin.
- Etidyum bromür veya herhangi bir diğer intercalating Aracısı ile jelleri leke ve ultraviyole ışık altında Yansıma yakalama sistemleri kullanarak bantları görselleştirin.
Not: DNA enterkalasyon ajanlar (örneğin, etidyum bromür) kanserojen vardır ve olmalı dikkatli ve ayrı olarak kalmaması. Amplicon özgüllük bir benzersiz keskin band (boyutu ile ilgili olarak ve astar-dimer veya yapay arka plan amplifikasyon olmadan) görünümünü doğruluyor.
4. gDNA kirlenme tahlil yordamı RNA şablonları ile
Not: Dnaz, saflaştırılmış RNA ile tedaviden sonra örnek rDNA özgü astar tarafından test edilmiştir. Bu bölgeler amplifikasyon için kullanıldığında Itss intron benzeri özelliği işleme nedeniyle amplifikasyon sinyal RNA DNA ücretsiz örnekleri tespit edilmelidir. Bu, qPCR bir güçlendirme sinyali algılandı veya özel jel bir grupta bu gDNA kirlilik nedeniyle olmalıdır (göre silico analiz tahmini), beklenen boyutu ile gözlenen temel. Bu bölümde, gerçekleştirilen adımlar olduğunu Bölüm 3, benzer cDNA tüm örneklerinin gDNA yerine şablon olarak kullanılır dışında.
- Ana bir karışım RNA şablon bir PCR reaksiyon tüp dışında tüm reaksiyon bileşenleri karıştırarak hazırlayın. Master mix birlikte bir reaksiyon için: 5 µL SYBR master mix (2 x), 0.3 µL astar (0.3 µM her ileriye ve geriye doğru astar Mix) ve RNase free su ile 10 µL için son ses seviyesini. Yaklaşık 500 ng şablon RNA 1 µL cilt analizi için kullanın.
- Aliquot ana karışımı içine görme duyusuyla ilgili bir 96-şey plaka. Her şey için 1 µL RNA pipet ve sonra bu film mühürleme optik plaka tarafından kapsar. Santrifüj ve cycler yerde.
Not: en az iki NTC ve her tahlil için iki pozitif gDNA denetimi içerir. Tüm deneyleri içinde üç teknik çoğaltma gerçekleştirmek. - Aşağıdaki koşullar altında bir gerçek zamanlı termal cycler qPCR tahlil çalıştırın: 95 ° C'de 10 dakika takip 95 ° C 40 döngüsü tarafından adım 15 s ve 1 dk. gerçekleştirme veri toplama uzantısı tavlama/60 ° C, 60 ° C için.
- Amplifikasyon işlemden sonra tüm PCR tepkiler bir erime eğrisi analizi ile sürekli Floresans ölçüm için 55 ° C ile 95 ° c konu Genellikle, bir veri noktasını her döngüsü sıcaklığı kademeli bir artış tarafından devir başına 0.5 ° c toplamak.
- %3 özel üzerinde çalıştırarak tüm PCR ürünleri Elektroforez jel kontrol edin.
Not: Herhangi bir grup veya'nin NTC tepki görünümünü muhtemelen herhangi bir grup veya RNA örnekleri'nin varlığı gDNA kirlenme sonucu ise bu erime eğri, düşük ısılarda genellikle görülen primer-dimer oluşumu ile ilgili. RDNA dayalı astar tarafından ilk tüm RNA örnekleri test etmek için tavsiye edilir ve daha sonra DNA kirlenmiş örnekleri cDNA sentezi, gen ifade analizi, vbgibi aşağı akım uygulamalar için kullanılır.
5. RT-PCR adım cDNA sentezi için ve qPCR analizi
- Dnaztezcan-RNA ve cDNA sentez Kimyasalları oda sıcaklığında tedavi. Çözdürme sonra reaktifler spin. RNA'ın 1 µg ve Oligo (dT) 18 1 µL ekleyin nükleaz ücretsiz tüp içine astar. Toplam 12 µL RNase free su seviyesini ayarlamak, karışımı yavaşça ve buz üzerinde depolamak.
- RNA şablonunun ikincil yapılar 65 ° c 5 dk. Spin için tepki aşağı kuluçka tarafından eritebilir ve şişe buz üzerinde serin.
- Reaksiyon ana mix (her reaksiyon için son hacim 20 µL) aşağıdaki gibi hazırlamak: ters transkriptaz (200 U/µL) 1 µL, 4 µL tepki arabelleği (5 x), 1 µL RNase inhibitörü (20 U/µL) ve dNTP Mix (10 mM) 2 µL. Şişe buz üzerinde serin ve karışımı yavaşça. 19 µL RNA içeren hazır tüp içine ekleyin.
- Reaksiyon 42 ° C'de 60 dk için kuluçkaya ve 70 ° c transkriptaz etkinliği sona erdirmek 5 min için kuluçkaya. RT reaksiyonlar Buza koyun ve gen ifade analizi için rutin qPCR yordam tarafından (3 ve 4 bölümünde açıklandığı gibi) devam edin.
Sonuçlar
Biz RNA örnekte gDNA kirlenme yaprak dokusu yokluğu doğrulamak için astar rDNA dayalı kullanımını öneriyoruz. QPCR analizi ve gDNA kirlenme tahlil akış çizelgesi Şekil 2' de gösterilmiştir. Sunulan protokolünde iki tamamlayıcı stratejileri rDNA astarın tasarım için kullanıldı: 1) species-specific astar Itss dizileri seçildi ve 2) evrensel astar bölgeleri kanat Itss seçildi. Kanıtı-of-concept için astar Aeluropus littoralis, için belirli ve evrensel astar buğdaygiller tür, belirli iletişim kuralı olarak göre tasarlanmış. 5.8S ileriye ve geriye doğru astar çiçekli bitkiler, bryophytes ve yosun ve mantar14birden fazla sipariş arasında benzerlik gösterir korunmuş bir 14 baz çifti (bp) motif dayalı seçildi. Tasarlanmış astar özellikleri Tablo 2' de verilmiştir. Evrensellik SSU 5.8S ve LSU astar BLASTn tarafından kontrol edildi ve astar homoloji sonuçları şekil 3 bir motif logo olarak sunulmaktadır. Homoloji analiz yanı sıra her tür için farklı astar dahil türleri listesi verilen Tablo 1. Astar özgüllük astar-BLAST tarafından kontrol edildi. Tüm genom sıra kullanılabilir olduğu türler için rDNA genler kromozom konumunu tahmin edilmiştir. Örneğin, Oryza sativa ve Arabidopsis thaliana, rDNA genler üzerinde üç farklı kromozomlar iki farklı kromozomlar ve Zea mays yer almaktadır.
qPCR doğrulama rDNA dayalı astar DNA şablon olarak kullanarak ITS1 ve ITS2-kanat amplicons eğrisi analizi erime ile gerçekleştirildi. Sunulan gibi şekil 4 ve şekil 5, astar özgüllüğü olduğunu doğruladı deneysel olarak de dahil olmak üzere farklı buğdaygiller türlerin yok astar-dimer oluşumu ile tek bir keskin tepe gözlem tarafından Triticum soğanı, Hordeum vulgare, Oryza sativave dicots Medicago sativa, Cucumis sativus, tütün, yonca alexandrinum, Vicia fabave Arabidopsis thaliana. Elektroforetik boyut ayırma tarafından amplifikasyon ürünleri daha fazla test benzersiz bir grup gösterdi. Beklendiği gibi Grup boyutu (şekil 6A ve 6B) çeşitli farklı türlerin örnekleri elde. İlginçtir, özel olarak tasarlanmış üç buğdaygiller türler için evrensel astar kullanımı sadece yararlı değildir diğer buğdaygiller türler, ama aynı zamanda A. thaliana, gibi diğer bitki türleri ve için endophytic bir mantar yani. Piriformospora indica.
Tasarlanmış belirli astar (ITS1) geçerliliğini gDNA şablon olarak kullanıp A. littoralis qPCR tarafından da doğrulandı. Hiçbir astar-dimer oluşumu ile tek bir tepe gözlendi. Doğal olarak, A. littoralis ITS1 astar (olarak belirli astar) tek bir keskin bant sadece A. littoralis, ama aynı zamanda test tütün ve yonca alexandrinum, dışında tüm diğer türler için oluşturulan olan iki grup (şekil 6C) üretilen. GDNA bulaşma tahlil veya Its Its kanat astar tüm RNA örneklerinde tarafından gerçekleştirildi. Amplifikasyon tabak içinde gDNA kirlenme tahlil şematik gösterimi ve sonuçları yorumlama Şekil 7' de sunulmaktadır.
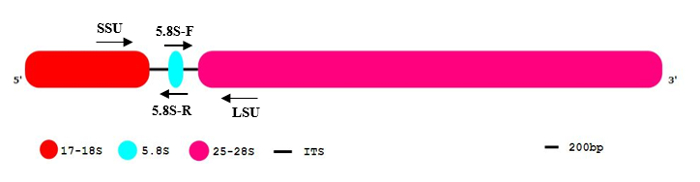
Resim 1: Ökaryotik rDNA sıra kuruluş genel deseni.
17-18 (kırmızı), ökaryotik rDNA kesimi içeren 5.8S (mavi) ve 25-28S rRNA (pembe). İç kopya etmek mesafe tutucular (ITS) siyah çizgiler olarak gösterilir. 5´and 3´ DNA molekülünün yönünü gösterir. Bu rakam daha büyük bir versiyonunu görüntülemek için buraya tıklayınız.
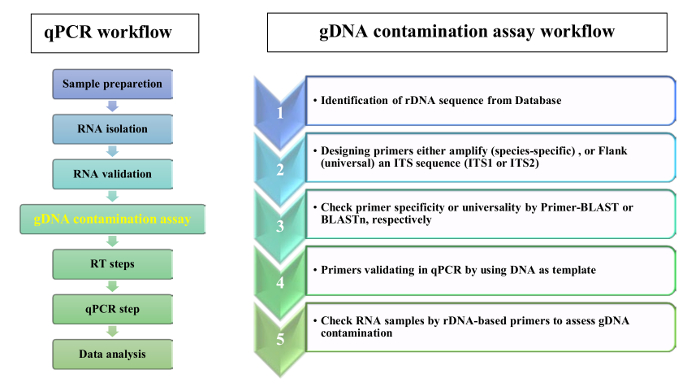
Şekil 2: iş akışı bir RT-qPCR ve gDNA kirlenme tahlil için. Bu rakam daha büyük bir versiyonunu görüntülemek için buraya tıklayınız.
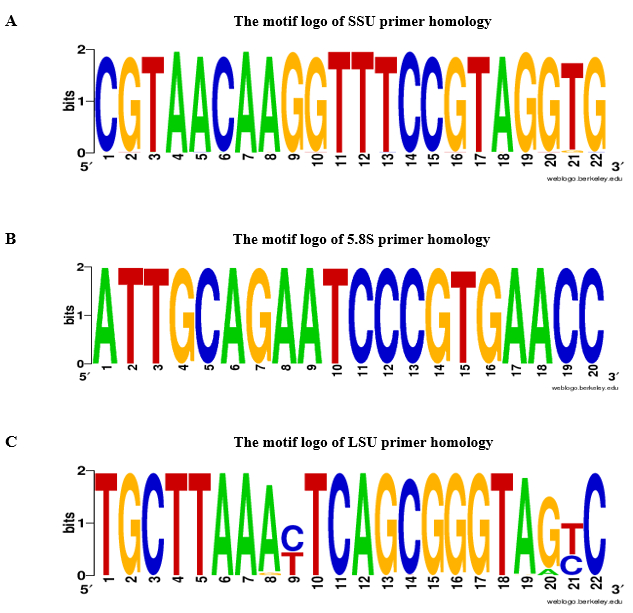
Şekil 3: A. SSU, B. 5.8S ve C. LSU astar homoloji Motif logosu. SSU, 5.8S, için LSU astar, motif logo 2.000 yeşil bitki kayıtlarda göre BLASTn tarafından inşa edilmiştir (NCBI taxid numarası: 33090) ile kesme e-değer ≤10-10. A-adenin, T-timin, G-guanin, sitozin C. Bu rakam daha büyük bir versiyonunu görüntülemek için buraya tıklayınız.
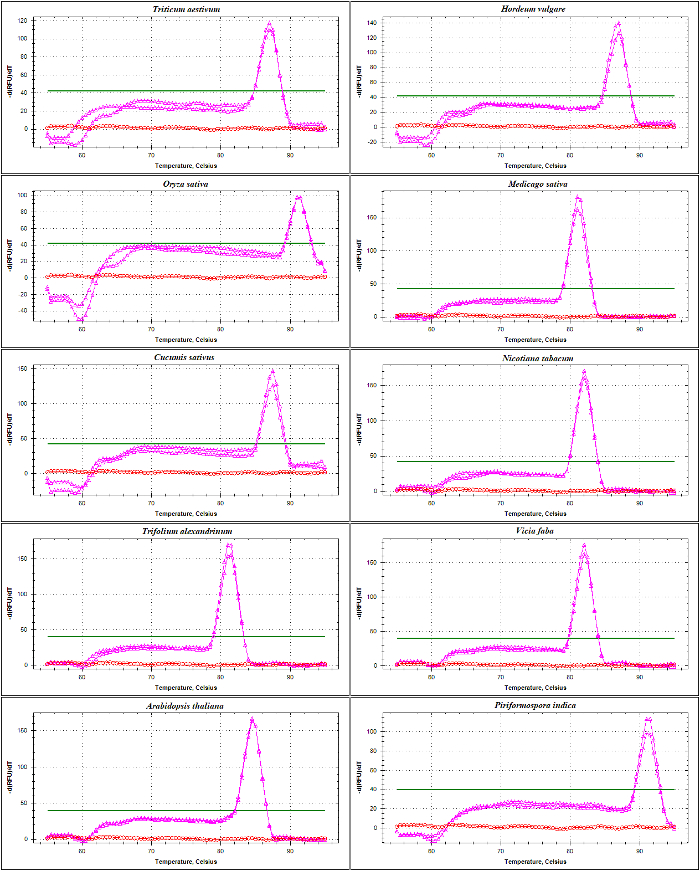
Şekil 4: Erime eğri analizinde ITS1 kanat amplicon farklı türler.
Bu amplicon güçlendirilmiş SSU ve 5.8S-R astar, 17-18'kodlama bölge serisinden, ITS1 bütün dizi ve 5.8S kısmi sıralaması bölümünü içerir. NTC Triticum soğanı, Hordeum vulgare, Oryza sativa, Medicago truncatula, Cucumis sativus, tütün, (kırmızı) ve amplicons (pembe) oluşturulan erime eğrileri gösterilmiştir Yonca alexandrinum, Vicia faba, Arabidopsis thaliana ve Piriformospora indica. Düz kalın satır taban çizgisi eşik gösterir. Bu rakam daha büyük bir versiyonunu görüntülemek için buraya tıklayınız.
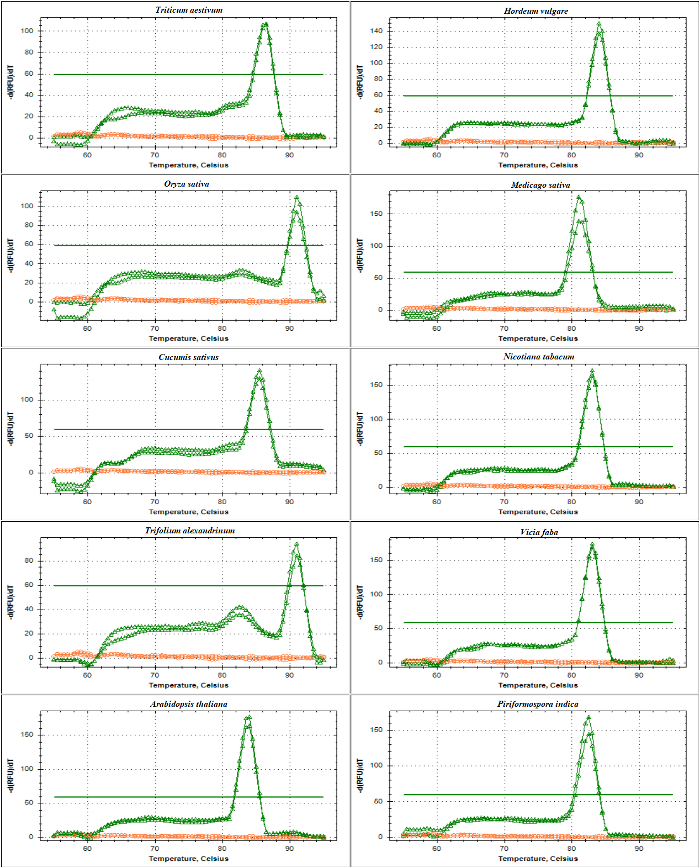
Şekil 5: Erime eğri analizinde ITS2 kanat amplicon farklı türler.
Bu amplicon 5.8S kullanımı ile oluşturulur-F ve LSU astar. Açıklanan amplicon 5,8 S parçası dizisi, ITS2 bütün dizi ve 25-28S kısmi bir dizi içerir. Amplicons (yeşil) ve NTC (kırmızı) oluşturulan Triticum soğanı, Hordeum vulgare, Oryza sativa, Medicago truncatula, Cucumis sativus, tütün, erime eğrileri gösterilmiştir Yonca alexandrinum, Vicia faba, Arabidopsis thaliana ve Piriformospora indica. Bu rakam daha büyük bir versiyonunu görüntülemek için buraya tıklayınız.
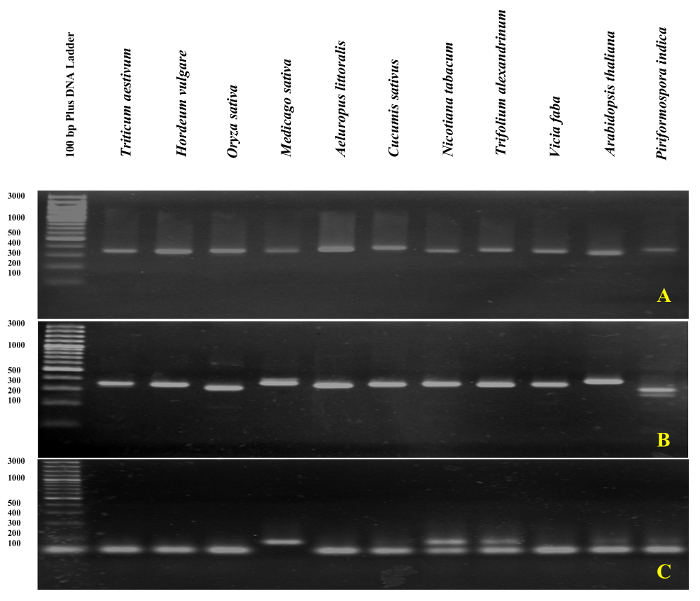
Şekil 6: Özel jel analizini PCR ürünü rDNA dayalı.
ITS1-yanları (A), ITS2-yanları amplicon (B) ve ITS1 (C) %3 özel jel üzerinde çalıştırmak. Bu rakam daha büyük bir versiyonunu görüntülemek için buraya tıklayınız.

Şekil 7: ITSs Intron benzeri özellikleri gDNA kirlenme algılayabilen astar tasarımı için kabul edilebilir.
Herhangi bir tepe veya qPCR analizde beklenen boyutu ile grup RNA örnek içinde gDNA kirlenme gösteriyor. UNK: bilinmeyen örnek, pos: pozitif kontrol, NTC: şablon olmayan denetim. Bu rakam daha büyük bir versiyonunu görüntülemek için buraya tıklayınız.
| Astar | Cins | Taxid kimliği | Türler | Iraksak astar | ||
| SSU | Arabidopsis | 3701 | kamchatica, thaliana ve lyrata | - | ||
| Vicia | 3904 | Villosa, americana, unijuga, amoenane, amurensis, craccamal, pseudo-orobus, multicaulis, japonica, ramuliflora ve faba | ||||
| Yonca | 3898 | alexandrinum, montanum, resupinatum ve repens | - | |||
| Nicotiana | 4085 | tabacum, benthamiana, otophora, picilla, bigelovii, palmeri, tomentosiformis, tomentosa, digluta, kawakamii, adaçayı, nesophila, solanifolia, cordifolia, debneyi, arentsii, thyrsiflora, wigandioides, undulata, kızılağaç, noctiflora, petunioides, obtusifolia, miersii, pauciflora, Azalt, acuminata, linearis, alata, sylvestris, rustica ve suaveolens | - | |||
| Cucumis | 3655 | anguria, melo ve sativus | CGTAACAAGGTTTCCGTAGGKG | |||
| Aeluropus | 110873 | - | Hiçbir astar bulundu | |||
| Medicago | 3877 | sativa, lupulina, pamphylica, lunata, rostrate, plicata ve truncatula | - | |||
| Oryza | 4597 | sativa, glumipatula, rufipogon barthii glaberrima punctate, longistaminata, meridionalis, nivara, meridionalis ve longistaminata | - | |||
| Triticum | 4564 | soğanı, urartu ve monococcum | - | |||
| Hordeum | 4512 | vulgare, bulbosum, marinum, brevisubulatum ve bogdanii | - | |||
| LSU | Arabidopsis | 3701 | yine, thaliana ve lyrata | TGCTTAAACTCAGCGGGTAATC | ||
| Vicia | 3904 | sylvatica, tetrasperma, sativa, kıllı, sepium, parviflora, cracca, lathyroides, orobus, orobus, bithynica ve faba | TGCTTAAATTCAGCGGGTAGCC | |||
| Yonca | 3898 | iddiası, nigrescens, resupinatum, occidentale, subterraneum, strictum, ochroleucon, glomeratum, squamosum, ornithopodioides ve repens | TGCTTAAATTCAGCGGGTAGCC | |||
| Nicotiana | 4085 | tabacum, benthamiana, otophora, picilla, bigelovii, palmeri, tomentosiformis, tomentosa, digluta, kawakamii, adaçayı, nesophila, solanifolia, cordifolia, debneyi, arentsii, thyrsiflora, wigandioides, undulata, kızılağaç, noctiflora, petunioides, obtusifolia, miersii, pauciflora, Azalt, acuminata, sylvestris linearis, alata ve suaveolens | TGCTTAAACTCAGCGGGTAGTC | |||
| Cucumis | 3655 | Melo, ritchiei ve javanica | TGCTTAAACTCAGCGGGTAGTC | |||
| Aeluropus | 110873 | lagopoide, pungens ve littoralis | TGCTTAAATTCAGCGGGTAATC | |||
| Medicago | 3877 | ruthenica, sativa, lupulina, Arabistan, polymorpha ve Minimum | TGCTTAAATTCAGCGGGTAGCC | |||
| pamphylica, lunata, rostrate ve plicata | TGCTTAAACTCAGCGGGTAGTC | |||||
| Oryza | 4597 | sativa, glumipatula, rufipogon, barthiial, glaberrima, australiensis, officinalis, australiensis, ridleyi, malampuzhaensis, alta, nivara, rufipogon, meridionalis ve longistaminata | TGCTTAAACTCAGCGGGTAGTC | |||
| Triticum | 4564 | soğanı, spelta, turgidum, dicoccoides, petropavlovskyi, urartu ve monococcum | TGCTTAAACTCAGCGGGTAGTC | |||
| Hordeum | 4512 | vulgare, bulbosum, murinum, secalinum, brevisubulatum ve bogdanii | TGCTTAAACTCAGCGGGTAGTC | |||
| Dejenere bir astar nükleotit adlandırma için IUPAC sistemi olarak tanımlanır | ||||||
Tablo 1: RDNA dayalı astar malzeme çekme için kabul türleri listesi.
Cins tutkucun SSU bağlama yer ile karşılaştırıldığında LSU bağlama site üzerinde daha yüksek sıra homoloji gösterdi.
| Amplicon uzunluğu | Amplifikasyon alan | Sıra | Astar adı | Amplicon | |
| 332 - 405 kan basıncı | Kısmi SSU, ITS1 bütün dizi ve 5.8S kısmi dizisi dizisi | CGTAACAAGGTTTCCGTAGGTG | SSU | ITS1-fıçılar | |
| GGTTCACGGGATTCTGCAAT | 5.8S-R | ||||
| 318 - 361 bp | Kısmi 5.8S, ITS2 bütün dizi ve kısmi LSU dizisi dizisi | ATTGCAGAATCCCGTGAACC | 5.8S-F | ITS2-fıçılar | |
| TGCTTAAAYTCAGCGGGTAGYC | LSU | ||||
| 100 - 200 bp | ITS1 | GGTATGGCGTCAAGGAACACT | ITS1-F | ITS1 | |
| ATAGCATCGCTGCAAGAGGT | ITS1-R | ||||
Tablo 2: Astar diziler.
Tartışmalar
Kantitatif PCR ile gen ifade analiz son yıllarda yaygın olarak uygulanmıştır. Bu hızlı, uygun maliyetli ve otomatik yöntemi ana parası onun hassas ve doğru bir sonucudur. Ancak, en iyi yarar--dan bu avantajlar kazanıyor qPCR deneme için kullanılan parametrelerinin net bir anlayış gerektirir. QPCR gen ifade analizde güvenilir bir sonuç almak için astar-dimer veya gDNA kirlenme RNA örnek3,15dakika sonra doğar nonspesifik amplifikasyon önlemek gereklidir. Bu RNA transkript düzeyleri gDNA kirlenme8altında fazla hesaplamış bekleniyor. Burada, bir rDNA geni ve benzersiz özellikleri olarak kabul RNA örnekte gDNA kirlenme tahlil için.
Bu protokol için kullanılan rDNA temel özellikleri: Ribozomal genler oluşur iki Itss, yani ITS1 ve ITS2 ve üç rRNA kodlama genler, 17-18, 5.8S ve 25-28S alt birim12. İki Its bölgeleri ribozomal alt birimleri kodlama dizisi parçası değildir. Bunlar rRNA olgun habercisi işlemek için en az üç enzimatik faaliyetleri tarafından kaldırılır: bir endonükleaz, helikaz ve eksonükleaz aktivitesi. Ribozomal RNA polycistronic transkript sentezlenir Itss içeren bir birincil ürün kesinlikle mevcut olduğu. İşleme çok hızlıdır ve çekirdekçik yer alır ve qPCR yöntemi algılama sınırın altına Its içeren tespit habercisi moleküller miktarıdır. Genişletilmiş ITS1 ya da ITS2 zaman Its tarafından astar kanat, gDNA kirlenme belirtilmedikçe bu nedenle, hiçbir amplifikasyon RNA örnekleri tespit edilebilir. Ökaryotlarda genom rDNA genler sayısını tek veya tandem dizileri kromozomlar11tarihinde düzenlenen kadar bir bin kopya eklemek için tahmin edilmiştir. Bu protokol için biz her tepki/tahlil kullanılır gDNA kirlenme tespit etmek için alternatif bir yol, NRT, yerine öneriyoruz.
Faydaları ve sınırlamaları ile ilgili mevcut yöntemler: NRT genellikle temiz veya kontamine gDNA tarafından hazırlanan RNA örnek olup olmadığını sınamak için kullanılır. Beri gDNA kirlenme farklı RNA örnekleri arasında eşit şekilde dağıtılır değil ve gDNA karşı tepki hassasiyetini önemli ölçüde analiz genler tarafından etkilenir, NRT denetimleri her örnek/tahlil çift7,15için gereklidir. Bu önemli ölçüde maliyet ekler ve birçok işlerken emek aynı anda3,9örnekleri. Literatürde belgelenen diğer alternatif yöntemler intron belirli astar gDNA tespiti için veya bir intron kanattan veya bir exon exon junction span tasarımı astar kullanımını içerir. Bu yöntemler sınırlamaları intron sırası bilgi, intron/exon yapısı tamamlanmamış ek açıklama ve intron genlerdeki yokluğu veya faiz1,4,10 psödogenler kullanılamamasıdır kök . Evrim nedeniyle, multigene ve son derece korunmuş gen aileler rDNA genler mevcut. Bunlar son derece genom bol miktarda ve farklı kromozom13üzerinde present. Diğer kodlama veya nonconding genler için karşılaştırıldığında, rDNA genler gDNA kirlilik tespiti için en uygun göster. Karşılaştırmalı transcriptomic analizleri cDNA farklılıkları gibi bazı sorunlar için qPCR veri rRNA Kalibratör tarafından normalleştirme tavsiye edilmez hazırlık (polyA astar rasgele hexamer astar vs), bereket rRNA ve mRNA arasında büyük farklılıklar , ve yanıltıcı oluşturabilir farklı Biyogenez sonuçları10,16. Ancak, biz sadece belirttiğim sorunlar gDNA kirlenme tahlil için bir avantaj var. Örneğin, daha yüksek hedefleme sitesi bereket ile ilgili genom ve farklı kromozomlar üstünde localization, rDNA dayalı astar gDNA mevcut yöntemleri ile karşılaştırıldığında algılama hassasiyeti önemli ölçüde artırır.
Versality rDNA tabanlı diğer organizma için: rDNA genler çoğu canlılar arasında tanımlanan bir iyi okudu gen aile vardır. Önerilen yöntem rDNA dayalı diğer prokaryotik ve ökaryotik organizmalar için (protokol 2 - 5) kolayca adapte olabilir gDNA kirlenme deneyleri için basit, son derece hassas ve ekonomik sistemini temsil eder. Bir vaka çalışması olarak, burada bazı Poceae türler (şekil 4 ve şekil 5) Bu yöntemde yarar göstermiştir. Kullanılan astar Aktarılabilirliği rDNA alt türler arasında son derece korunmuş yapısı nedeniyle diğer Poceae türler için yüksek bir oranı gösteriyor. Yeterli genomik sırası bilgi için astar tasarım kullanılabilir olmadığında bu sorunu daha da önemli hale gelir. Böylece, bir tür için tasarlanmış Its kanat astar akraba türler içinde kullanılabilir. Ayrıca, 5.8S-F/R astar aldı çoğu çiçekli bitkiler14' te yüksek benzerliği gösterir korunmuş bir motif dayalı. Her ne kadar yüksek işlem hacmi sıralama teknikleri kalıcı olarak bilinen genleri sayısını artırmak, exon-intron ek açıklama çoğu organizmalar tamamlanmamıştır ve çok kez astar bir exon exon sınır yayılan tasarım olanağı yoktur. Bizim yöntem açıklar nasıl rDNA dayalı astar pahalı NRT denetimleri her tahlil/astar birlikte ortadan kaldırmak amacı ile prokaryot ve Ökaryotlar qPCR analizde gDNA kirlenme tahlil için uygulanabilir.
Açıklamalar
Yazarlar hiçbir rakip mali ilgi alanlarına sahip.
Teşekkürler
Bu araştırma genetik ve tarımsal biyoteknoloji Enstitüsü of Tabarestan (GABIT), Sari Tarım Bilimleri ve doğal kaynakların Üniversitesi (SANRU) tarafından desteklenmiştir. Junior araştırma grubu abiyotik stres genomik IZN (kırpma bitki araştırmaları, Halle (Saale), Almanya için disiplinler arası merkezi. tarafından finanse edildi Biz Rhonda Meyer el yazması eleştirel okuma için teşekkür ederiz.
Malzemeler
| Name | Company | Catalog Number | Comments |
| Maxima SYBR Green / ROX qPCR Master Mix (2X) | Thermo Scientific | K0221 | |
| TissueLyser II | QIAGEN | 85300 | |
| RevertAid H Minus First Strand cDNA Synthesis Kit | Thermo Scientific | K1631 | |
| GeneRuler 100 bp Plus DNA Ladder | Thermo Scientific | SM0321 | |
| 96 well WHT/CLR | Bio-Rad | HSP9601 | |
| Microseal B film | Bio-Rad | MJ-0558 | |
| Low tube strip CLR | Bio-Rad | TLS0801 | |
| Flat cap strips | Bio-Rad | TCS0803 | |
| NanoDrop 2000 | Peqlab | ND-2000 | |
| RNaseZAP | Ambion | 9780 | |
| Centrifuge | Eppendorf | 5810 R | |
| Agilent RNA 6000 Nano Kit | Agilent Technologies | 5067-1511 | |
| 2100 Electrophoresis Bioanalyzer | Agilent Technologies | G2939AA | |
| RNase A, DNase and Protease-free | Thermo Scientific | EN0531 | |
| DNase I, RNase-free | Thermo Scientific | EN0523 | |
| TRIZOL Reagent | Ambion | 15596026 | |
| CFX96 Touch Real-Time PCR Detection System | BIO RAD | 1855195 | |
| PCR tube, 0.2 mL, RNase-free | Stratagene | Z376426 | |
| Guanidine thiocyanate for molecular biology | Sigma-Aldrich | G9277 | |
| Agarose - Nucleic Acid Electrophoresis | Sigma-Aldrich | A9414 | |
| Boric Acid for molecular biology | AppliChem | A2940 | |
| bromophenol blue | AppliChem | A2331 | |
| ethidium bromide | AppliChem | A1151 | |
| Gel documentation system | BIO RAD | Gel Doc 2000 |
Referanslar
- Bustin, S. A., Nolan, T. Pitfalls of quantitative real-time reverse-transcription polymerase chain reaction. J Biomol Tech. 15 (3), 155-166 (2004).
- Gutierrez, L., Mauriat, M., Pelloux, J., Bellini, C., Van Wuytswinkel, O. Towards a systematic validation of references in real-time RT-PCR. Plant Cell. 20 (7), 1734-1735 (2008).
- Hashemi, S. H., Nematzadeh, G., Ahmadian, G., Yamchi, A., Kuhlmann, M. Identification and validation of Aeluropus littoralis reference genes for Quantitative Real-Time PCR Normalization. J Biol Res (Thessalon). 23 (1), 18(2016).
- Bustin, S. A. Absolute quantification of mRNA using real-time reverse transcription polymerase chain reaction assays. J. Mol. Endocrinol. 25 (2), 169-193 (2000).
- Andersen, C. L., Jensen, J. L., Orntoft, T. F. Normalization of real-time quantitative reverse transcription-PCR data: a model-based variance estimation approach to identify genes suited for normalization, applied to bladder and colon cancer data sets. Cancer Res. 64 (15), 5245-5250 (2004).
- Bustin, S. A., et al. The MIQE guidelines: minimum information for publication of quantitative real-time PCR experiments. Clin Chem. 55 (4), 611-622 (2009).
- Laurell, H., et al. Correction of RT-qPCR data for genomic DNA-derived signals with ValidPrime. Nucleic Acids Res. 40 (7), e51(2012).
- Galiveti, C. R., Rozhdestvensky, T. S., Brosius, J., Lehrach, H., Konthur, Z. Application of housekeeping npcRNAs for quantitative expression analysis of human transcriptome by real-time PCR. RNA. 16 (2), 450-461 (2010).
- Laurell, H., et al. Correction of RT-qPCR data for genomic DNA-derived signals with ValidPrime. Nucleic Acids Res. 40, e51(2012).
- Caldana, C., Scheible, W. R., Mueller-Roeber, B., Ruzicic, S. A quantitative RT-PCR platform for high-throughput expression profiling of 2500 rice transcription factors. Plant Methods. 3 (1), 7(2007).
- Lawrence, R. J., Pikaard, C. S. Perspectives Chromatin Turn Ons and Turn Offs of Ribosomal RNA Genes. Cell Cycle. 3 (7), 880(2004).
- Boisvert, F. M., van Koningsbruggen, S., Navascues, J., Lamond, A. I. The multifunctional nucleolus. Nat Rev Mol Cell Biol. 8 (7), 574-585 (2007).
- Alvarez, I., Wendel, J. F. Ribosomal ITS sequences and plant phylogenetic inference. Mol Phylogenet Evol. 29 (3), 417-434 (2003).
- Jobes, D. V., Thien, L. B. A conserved motif in the 5.8 S ribosomal RNA (rRNA) gene is a useful diagnostic marker for plant internal transcribed spacer (ITS) sequences. Plant Mol Biol Report. 15 (4), 326-334 (1997).
- Padhi, B. K., Singh, M., Huang, N., Pelletier, G. A PCR-based approach to assess genomic DNA contamination in RNA: Application to rat RNA samples. Anal Biochem. 494, 49-51 (2016).
- Dheda, K., et al. Validation of housekeeping genes for normalizing RNA expression in real-time PCR. Biotechniques. 37 (1), 112-114 (2004).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır