Method Article
一种简单的分级提取方法,用于从单个样品中综合分析代谢物,脂质和蛋白质
摘要
提出了使用一个样品从生物组织中综合提取脂质,代谢物和蛋白质的方案。
摘要
了解复杂的生物系统需要测量,分析和整合活细胞的多种化合物类型,通常通过转录组学,蛋白质组学,代谢组学和脂质组学测量来确定。在本协议中,我们引入了一种简单的方法,可以使用每个样品的单一等分试样从生物组织中重现性提取代谢物,脂质和蛋白质。提取方法基于甲基叔丁基醚:甲醇:液体系统:将疏水和极性代谢物液体分配成两个不混溶相,同时沉淀蛋白质和其他大分子作为固体颗粒。因此,该方法提供了特定分子组成的三个不同部分,其与常见的高通量"omics"技术完全相容,例如与质谱联用的液相色谱(LC)或气相色谱(GC)。即使该方法是init被开发用于不同植物组织样品的分析,已被证明完全兼容于从藻类,昆虫,哺乳动物组织和细胞培养物等系统中提取和分析生物样品。
引言
系统生物学在上个世纪中期出现1 ,并通过基因组和转录组数据集2,3的大规模分析推进,已经发展成为复杂生物系统分析的新的和不可或缺的方法4,5 。系统生物学的主要目标是破译生物系统中的组分相互作用和依赖关系,并桥接基因型,其实现,分子转化和所得表型之间的联系。因此,通过各种大规模分析方法,即基因组学,转录组学,代谢组学,脂质组学和蛋白质组学及其计算分析所产生的综合数据集的整合已经成为对复杂生物系统的描述和理解的先决条件。
巴斯关于任何生活系统中生物成分的巨大化学多样性和复杂性,大量和全面的"omics"数据集的生产强烈依赖于应用提取方法的质量9 。除了提取方法的质量外,该方法的经济性也很重要;这意味着希望从尽可能少的样品输入获得尽可能多的分子信息。通常,样品量可以是限制性的,因此非常希望使用提取方法,其可以从给定样品的单次提取中获得尽可能多的分子等级。这意味着,不是使用几种专门的提取方法从相同样品的不同样品等分试样中提取不同的化合物类别,而是采用顺序提取方法,将单个等分试样的分子成分分解成不同的分子级分。
_content">这些分级提取方法采用的常用方法是基于Folch 等在1957年开发的两相脂质提取方法10 ,该方法基于氯仿:甲醇/水分配极性和疏水性代谢物,并且是随着多系统生物学的发展,Folch方法进一步逐步改进,通过利用它对蛋白质和极性代谢物和脂质的样品分配进行改进,基于气相色谱和液相色谱的代谢组学和极性和疏水性化合物的脂质组学,除了基于液相色谱的蛋白质组学11,12,13,14之外,遗憾的是,所有这些方法都依赖于基于氯仿的提取方法,导致不希望的fo蛋白质沉淀物作为极性和脂质相之间的界面,但是从绿色化学的角度来看也是不期望的溶剂15,16 。然而,溶剂甲基叔丁基醚(MTBE)克服了上述两个问题,并且是氯仿的合适替代物。根据这些要求,我们决定建立一个MTBE:甲醇:水基萃取方法,满足上述所有规范,从而成为综合多元分析的理想起点。该协议引导用户逐步通过样品制备的简单,快速和可重复的工作流程,包括常见观察问题的故障排除。此外,我们将简要介绍超高效液相色谱 - 质谱(UPLC-MS)-bas的典型分析数据来自植物组织样品的脂质组学,代谢组学和蛋白质组学分析。即使给出的实施例来源于50mg的拟南芥叶组织样品,该方案已被用于几种其他生物样品和组织,包括藻类17,18 ,昆虫19和哺乳动物细胞,器官和组织20,21 , 22 。提出的提取方案的范围是提供对提取前样品处理和提取程序本身的清楚和详细的描述。尽管我们提供了三个分析应用的简要示例,但是有关分析前和分析后数据处理的详细信息可以从我们以前的出版物16,23,24 , 25,26。
研究方案
注意:萃取过程中使用的甲醇(MeOH)和甲基叔丁基醚(MTBE)是易燃的,并且可能会长期暴露于和/或接触呼吸道,眼睛或皮肤刺激。请仔细处理,只能在通风橱中,并在提取过程中使用适当的安全程序(实验室外套,安全眼镜,手套等 )。在本方案的几个步骤中使用的液氮和干冰可能会由于长时间的皮肤接触而引起严重烧伤。请戴上防护手套和眼镜仔细处理。用户可以使用不同的化学品,试剂或内部标准进行样品分析,其中一些可能是有毒的。请检查所有材料的相关化学品安全数据表。
1.收集和收获生物样品
- 准备标签收获管。
注意:在这里,收集生物样品的标记,2 mL,圆底,安全的地方k微量离心管包含两个直径为5mm的金属球,用于组织匀浆器。 - 准备充满液氮的杜瓦瓶。
- 收获生物样品并在液氮中快速冻结组织。在几秒钟内尽快进行此步骤,以避免伤口引起的代谢变化。
注意:为了演示的目的,请在长时间的条件下使用在土壤上生长的30日龄的野生型拟南芥 (Col-0)的玫瑰花叶。 - 将收获的样品放在干冰上短暂中断,或将其储存在-80°C更长时间。
研磨和组织破坏
- 将组织匀浆器的管架预先在液氮中预冷至少10分钟。如果组织匀浆器不可用,请使用干净的预冷砂浆和杵。
- 将样品从液氮,干冰或-80°C冷冻箱中取出,并放入预冷却器中管座。
- 将管架快速放入组织匀浆器中。
- 将生物材料研磨成精细均匀的粉末。对叶子使用20 Hz 1分钟。
注意;均化时间和速度可以根据组织而变化,确保样品均匀化成细粉末,并且在均匀化的每个步骤中将该粉末保持冷冻。 - 从管座中取出生物样品,并将其保持冷冻直至进一步提取。
3.称重组织
- 对所需的样品量使用足够精度的分析天平。
- 准备标有2 mL圆底安全锁定微量离心管。
- 在液氮中预冷管管和铲子。
- 将所需量的组织粉末等分成2 mL安全锁定微量离心管。
注意:通过最小化w所需的时间,避免对植物材料进行任何除霜取样。 - 称重后将等分试样立即送回液氮。
- 记录每个样品的精确重量。对大多数植物组织使用10-50 mg±10%。
- 将等分样品储存在-80°C直至进一步萃取。
4.试剂设置
- 使用甲基叔丁基醚(MTBE)/甲醇(MeOH)的萃取混合物。
- 为了制备100mL萃取溶剂,向25mL MeOH中加入75mL MTBE以制备MTBE:MeOH(3:1,体积/体积)的混合物。
- 根据分析需求添加后期分析归一化内部标准。通常,添加50μL的1,2-二十五烷酰基-sn-甘油-3-磷酸胆碱(1mg / mL的氯仿)作为基于UPLC-MS的脂质分析的内标,同时加入50μL的13 C山梨糖醇( 1 mg / mL在水中)作为基于GC-MS的初级分析的内部标准代谢物。基于UPLC-MS的代谢物分析的内标是50μL皮质酮(甲醇中1mg / mL)和25μL氨苄青霉素(1mg / mL在甲醇中)。
- 将溶剂转移到用MTBE:MeOH混合物冲洗的干净的玻璃瓶中。
- 将提取混合物在4℃下储存长达1周。
注意:不要将萃取液长时间储存,以保持可重复的结果。
- 为了诱导相分离,使用水(H 2 O)/甲醇(MeOH)。
- 为了制备100mL的H 2 O:MeOH,加入75mL的H 2 O至25mL的MeOH中以制备H 2 O:MeOH(3:1,体积/体积)。
- 将溶剂转移到用H 2 O :MeOH混合物冲洗的干净的玻璃瓶中。该溶剂可以在室温下储存数周。
5.样品提取
- 预冷提取混合物(MTBE:MeOH,3:1,体积/体积)至-20℃,使用液体冷却系统或-20℃冷冻机。
- 取出等分样品一个接一个,并加入1 mL预冷却的提取混合物到每个样品管。注意:由于MTBE的粘度低,可以快速进行。
- 立即在涡旋混合器上混合,直至组织在萃取混合物中均匀。
注意:此步骤非常重要,因为需要沉淀蛋白质并使其酶活性失活。 - 将所有样品在轨道振荡器上以100rpm在4℃下孵育45分钟。
- 在冰冷的超声处理浴中超声处理样品15分钟。
6.分相分相
- 向每个样品管中加入650μLH 2 O :MeOH(3:1,体积/体积)。
- 通过涡旋混合1分钟。
- 在4℃下以20,000× g的速度离心样品5分钟。
注意:在此步骤之后,存在两个不混溶的液相,在管的底部具有固体颗粒。
注意:小心处理管子以避免混合两个液相,并避免破坏沉淀的颗粒。
7.分离极地和疏水部分
- 将500μL上层含脂质相的溶剂转移到标准的1.5 mL微量离心管中。
注意:等分脂质样品可以直接浓缩用于立即UPLC-MS分析(步骤8.1)或在-80℃下储存数周。 - 一旦从样品中取出500μL,使用200μL移液管清除剩余的脂质相。
- 将400μL溶剂从下相(极性和半极性代谢物)转移到标记的1.5 mL微量离心管中。等分的极性样品可以直接浓缩用于立即UPLC-MS分析(步骤8.2)或储存r几周在-80°C。
- 取另外200μL的等分试样进行额外的分析,例如基于气相色谱的代谢物分析,如16所述。
- 通过移出剩余体积来除去剩余的水相。
- 通过充分涡旋1分钟,将得到的蛋白质,淀粉,细胞壁沉淀物用500μL甲醇洗涤。
- 在4℃下以10,000xg的速度离心样品5分钟。
- 进行如前所述的蛋白质提取和消化(步骤11)或淀粉/细胞壁分析16 。
注意:如果不立即使用,这些颗粒可以在-80°C下储存几周。
8.分数的浓缩和储存
- 在不加热(1-2小时)的真空浓缩器中从脂质样品(步骤7.1)中蒸发溶剂,或优选使用硝基ogen流量蒸发器以避免脂质的氧化修饰。
注意:干燥样品应立即分析。储存时,将样品留在MTBE溶液中,理想情况下在玻璃小瓶中(步骤7.1)。 - 在无需加热的真空浓缩器中将溶剂从水样中(步骤7.3或7.4)蒸发过夜。注意:干燥的样品可以在-80℃下储存数周,然后进行分析。
9.使用UPLC-MS分析脂质24
- 将干燥的脂质部分(步骤8.1)重新悬浮在400μL乙腈:2-丙醇(7:3,体积/体积)中。
- 将足够的液体转移到玻璃小瓶中并盖住盖子。
- 将玻璃小瓶放入冷却的自动进样器(4°C)中。
- 每个样品注入2μL,并使用以400μL/ min的流速运行的UPLC系统将保持在60°C的反相(RP)C 8柱上的脂质分离。
- 使用手机表1中描述的色谱分离相。
- 使用覆盖150和1500 m / z质量范围的合适的MS仪器,在正和负电离模式下获取质谱。
使用UPLC-MS分析极性和半极性代谢物25 。
- 在200μLUPLC级甲醇:水(1:1,vol / vol)中重新悬浮极性相(步骤8.2)。
- 将足够的液体转移到玻璃小瓶中并盖住盖子。
- 将玻璃小瓶放入冷却的自动进样器(4°C)中。
- 从每个样品注入2μL,并使用以400μL/ min的流速运行的UPLC系统分离保留在40°C的RP C 18柱上的代谢物。
- 使用流动相色谱分离,参数如表2所示 。
- 在正,负电离模式下获取全扫描质谱图使用覆盖质量范围在50到1500m / z之间的合适的质谱仪。
蛋白质提取,消化和分析16
- 将洗涤的蛋白质/淀粉/细胞壁沉淀物(来自步骤7.8)重新悬浮在200μL所选择的蛋白质提取缓冲液中。注意:我们使用尿素/硫脲缓冲液(5M尿素,2mM硫脲,15mM DTT,2%CHAPS和蛋白酶和磷酸酶抑制剂) 27 。
- 在冰冷却的声波浴中超声处理样品10分钟。
- 在室温下,在轨道振荡器(100rpm)上孵育样品30分钟。
- 将溶解的蛋白质以10,000× g离心 5分钟。
- 在新管中收集蛋白质上清液。
- 从收集的上清液28中确定蛋白质浓度。
- 用选择的方案摘录50μg蛋白质溶液。通常,使用胰蛋白酶/ Lys-C混合物使用说明书。
- 消化后,在使用C 18阶段提取物进行质谱分析前进行肽的脱盐,并洗脱消化的肽29 。
- 将样品在真空浓缩器中浓缩至接近干燥,无需加热。
- 将样品重新悬浮在适当的加载缓冲液(例如5%乙腈,0.5%甲酸)中,并使用连接到纳米LC系统的高分辨率质谱仪通过LC-MS / MS分析肽混合物。
注意:在本协议中提供的示例性蛋白质组学数据集中,我们使用如表3所述的梯度。 - 使用前15个策略设置质谱仪,其中一次全扫描(FS)后跟多达15个数据相关MS / MS扫描,以下参数:FS在质量范围200 - 2000 m / z目标值为3×10 6离子的分辨率为70,000。通过更高级的获取数据相关的MS / MS扫描rgy碰撞解离(HCD)。将MS / MS的目标值设置为1e 5个离子,最大离子填充时间为50 ms,隔离窗口为4.0 m / z,标准化碰撞能量(NCE)为30%,底部填充率为1%。以分辨率17.500测量MS / MS离子,动态排除设置为60秒。
结果
综合多学科数据集对于了解复杂的生物系统是非常宝贵的。成功的生物实验的策略通常从有意义的实验设计,实验设置和性能开始,然后进行采样,提取,分析数据采集,原始数据处理,统计数据分析,相关代谢物鉴定和生物数据解释包括路径映射和可视化( 图1 )。
在这里介绍的提取协议中,我们专注于样本收集,处理和提取步骤,它们在图2的详细工作流程概述中描述。为了演示目的,选择了50毫克拟南芥叶组织。收获该物质,研磨并萃取,然后再进行三次示例性的分析型UPLC-MS平台,提供可用于靶向和非靶向脂质体,代谢组和蛋白质组学分析的数据。 图2和图6还包括在标准条件下萃取溶剂应如何的代表性图片。另外,显示了含有过量沉淀的大分子(蛋白质和淀粉)和不适当样品均质的样品的样品的实例( 图3 )。对于这两个常见问题的故障排除在图3中给出,但在以前的出版物16中也将对其进行更详细的讨论。
图4和图5概述了从脂质衍生的三种分析色谱图 ,极性/半数i极性代谢物和蛋白质分析。通过与高分辨率质谱联用的反相(RP)C 8超高效液相色谱法分析从上MTBE阶段( 图2 )取得的脂质。可以使用正和负的MS电离模式( 图4 ,上部窗格)16,24获得脂质。
通过反相(RP)C 18 UPLC-MS 25从极性(水/甲醇)相( 图2 )分析极性和半极性的初级和次级代谢物。所示的方法,使用反相色谱,与半极性代谢物(即植物次生代谢物的代谢物)的分析高度相容,可以使用MS和MS中的正离子和负离子模式进行分析( 图4 ,下窗格) 16 。可以通过其他分析方法如GC-MS 16或亲水相互作用液相色谱法30分析来自该级分(糖,极性氨基酸等)的更亲水的代谢物,其在反相材料上不显示良好的保留性。
从提取管底部的固体颗粒中回收的蛋白质( 图2 )使用喷枪LC-MS溶解消化并分析( 图5 ),而提取淀粉和细胞壁的方案材料可以从我们以前发布的协议16获得 。
总之,超过200种脂类,50种注射半极性代谢物和数千种蛋白质可以从我们示例中使用的类型的样本中常规地识别ns。此外,该方法显示了使用不同组织,器官和细胞培养材料的广泛适用性( 图6 )。

图1: 大规模未定向Omics分析的一般工作流程。 请点击此处查看此图的较大版本。

图2 :从生物样品的单等分试样分析脂质,代谢物和蛋白质的样品制备和提取工作流程。请点击此处查看此图的较大版本。
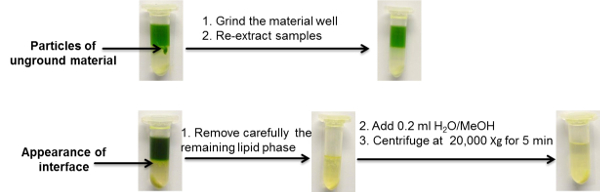
图3 :使用两相分离提取方案的常见问题的说明性实例。 请点击此处查看此图的较大版本。
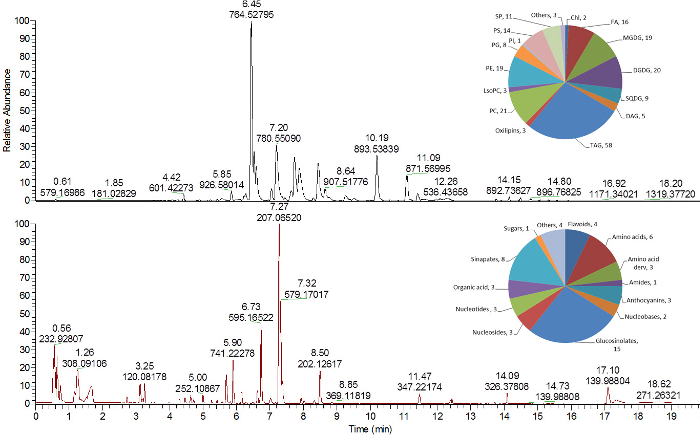
图4 :来自 拟南芥 叶提取物 的脂质和半极性代谢 物的 代表性色谱 图。基峰色谱图以正电离模式16分析脂质(上层)和半极性代谢物(下层)。每个色谱图右上角的饼图显示分配给不同化学类别的鉴定脂质和代谢物的数量。叶绿素DAG,二酰基甘油酯; DGDG,半乳糖基二酰基甘油; FA,脂肪酸;溶血磷脂酰胆碱; MGDG,单半乳糖基二酰基甘油; PC,磷脂酰胆碱; PE,磷脂酰乙醇胺; PG,磷脂酰甘油; PI,磷脂酰肌醇PS,磷脂酰丝氨酸; SP,鞘脂; SQDG,磺基奎诺糖基二酰基甘油; TAG,三酰基甘油酯。 请点击此处查看此图的较大版本。
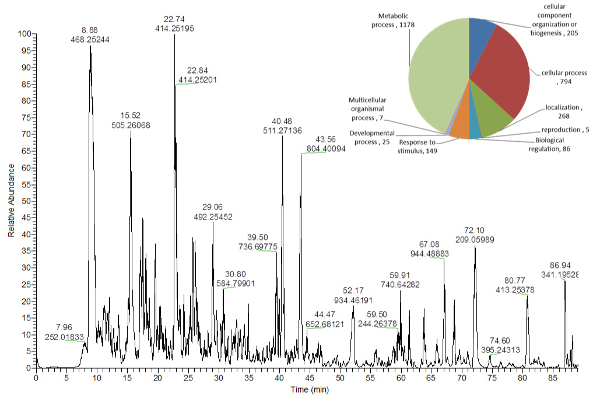
图5 : 拟南芥 叶提取物的肽的代表性基峰峰色谱。
右上角的饼图显示了分配给不同生物过程的已鉴定蛋白质数量16 。 请点击此处查看此图的较大版本。

图6 :来自野生型 拟南芥 的各种组织类型的代表性提取实施例 。
从指定的组织中取出50mg新鲜重的样品。">请点击此处查看此图的较大版本。
| 时间(分钟) | %缓冲液A至缓冲液B | |
| 0至1分钟 | 45%A | 缓冲液A:在UPLC MS级水中1%1M NH 4 - 乙酸酯,0.1%乙酸 |
| 1〜4分钟 | 线性梯度从45%A到25%A | 缓冲液B:1%1M NH 4 - 乙酸酯,0.1%乙酸的乙腈/异丙醇7:3(v:v) |
| 4至12分钟 | 线性梯度从25%A到11%A | 流速400μL/ min |
| 12至15分钟 | 线性梯度从11%A到0%A | 注射量2μL |
| 15至19.5分钟 | 用0%A洗涤柱4.5分钟 | |
| 19.50至19.51分钟 | 回到45%A | |
| 19.51至24分钟 | 平衡45%A |
表1:RP-UPLC分离脂质的梯度参数。 RP,反相。 UPLC,超高效液相色谱。
| 时间(分钟) | %缓冲液A至缓冲液B | |
| 0至1分钟 | 99%A | 缓冲液A:在UPLC级水中0.1%甲酸 |
| 1至11分钟 | 线性梯度从99%A到60%A | 缓冲液B:UPLC梯度乙腈中0.1%甲酸 |
| 11至13分钟 | 线性梯度从60%A到30%A | 流量4001; L /分钟 |
| 13至15分钟 | 从30%A到1%A的线性梯度 | 注射量2μL |
| 15至16分钟 | 用1%A洗柱1分钟 | |
| 16至17分钟 | 线性梯度从1%A到99%A | |
| 17至20分钟 | 在99%A平衡3分钟 |
表2:RP-UPLC分离极性和半极性代谢物的梯度参数。 RP,反相。 UPLC,超高效液相色谱。
| 时间(分钟) | 缓冲液B的缓冲液A | |
| 0至5分钟 | 线性梯度从0到10% | 缓冲液A:在UPLC级水中0.1%甲酸 |
| 5至80分钟 | 线性梯度从10%到40% | 缓冲液B:在60%UPLC级乙腈中的0.1%甲酸 |
| 80至85分钟 | 线性梯度从40%到60% | 流速300 nL / min |
| 85至86分钟 | 线性梯度从60%到95% | 注射体积5μL |
| 86至91分钟 | 洗涤柱5分钟,95% | |
| 91至92分钟 | 线性梯度从95%到0% | |
| 93至110分钟 | 在0%平衡色谱柱17分钟 |
表3:肽的纳米LC分离的梯度参数。 LC,液相色谱。
讨论
在本文中,我们描述和说明了一个简单且高度适用的提取方案,用于从单个50 mg叶片样品进行综合脂质体,代谢组学和蛋白质组学分析。这种方法以前已经在几项研究中使用,已经在不同的文章17,18,19,20,21,22,23,24,25,26,31,32,33,34,35,36,37并证明,除了它的直接工作流程和高适用性要坚固可重复。
这里提供的应用程序显示了复杂生物样品的初步筛选的一些常规方法。这些说明了大规模代谢组学和脂质组学数据集可以提供关于分析的生物系统的代谢的广泛或具体变化的综合信息,而从蛋白质分析获得的数据提供了对定量(丰度)和定性(修饰)酶,结构蛋白或转录因子(TF)的变化,控制细胞功能和机械。因此,通过阐明与特定代谢途径或细胞过程相关的不同分子的分子变化,整合的omics数据具有揭示关于生物系统的遗传或生物和/或非生物扰动诱发的可能变化的初始信息的潜力。
当然从长远来看,对于成功的系统生物学分析来说,最大限度地分析和注释分子实体的数量是非常重要的,从而尽可能完全监测细胞功能和活动。为此,所得到的级分可以额外应用于多种分析方法,靶向其他化合物或化合物类别( 图4 )。
说到这一点,必须提到的是,获取的数据的全球分析策略可以遵循两种不同的策略:一方面,我们一直在强调通过定量已知化合物来阐明细胞功能。另一方面,许多测量的代谢物和脂质尚未知晓或注释。这些尚未注释的复合测量还包含大量有意义的信息,可以通过统计学方法用于分类或鉴别b治疗组或治疗20,21,22 。
然而,这些未知化合物,特别是与组分类有关或用作生物标志物的化合物需要被鉴定。这种识别过程不幸很繁琐,如果没有额外的分析测量或策略,则无法实现。从图4可以看出,未注释化合物的数量相当高(实际上绝大多数)。然而,如上所述,这些色谱峰可以在数据分析中处理,因此显着影响的实体可以被阐明并进行进一步的识别策略。
总之,我们可以得出结论,这里介绍的协议为实验系统生物学和经典统计学应用提供了几个优点ations。
首先,由于从单个样品中提取所有级分,所以不同实验数据集(脂质,代谢物,蛋白质)之间的变化显着减少,因为每个数据集都是从相同的样品等分试样得到的。这显然导致获得的结果的可比性增加。
第二,该方法易于扩展,因此与小到大的样品量高度兼容。我们常规使用10-100毫克的组织样本,但是也可以在20个拟南芥种子上进行成功的脂质学研究31 。特别是与小样品量的相容性使得该方法适用于有限量的生物组织或样品。然而,即使有足够的样品材料可用,这里提出的方法提供了利用这些样品在更大数量的实验重复而不是u的优点为不同的提取程序唱歌。这允许更好和精细化的统计数据分析。
第三,由于该方法基于极性和非极性分子的液 - 液分馏,因此与简单的单相萃取方法( 例如甲醇萃取)相反,该方法在该方法中显着的去络合步骤。这种有效的样品去络合导致由于化学干扰分子彼此分离而导致单个级分的部分纯化。因此,化学分配过程不仅提供了将提取的样品系统地等分为不同化学分类的实际优点,而且改进了各自的分析测量,因为它从不同级分中除去污染化合物。显然,我们可以观察到,特别是脂质被分配到有机相,通常是负面影响的极性化合物的色谱分析将几乎完全不含极性部分。对于分解极性化合物的疏水性脂质也是如此。除了极性和非极性化合物的净化之外,我们从样品中消耗和收集蛋白质和其他大分子,这不仅提供了单独的级分,可用于蛋白质,淀粉和细胞壁分析16 ,而且导致各个部分内的清洁剂样品。这是特别相关的,因为已知大分子的存在导致分析柱的损伤或寿命至少更短。
最后但并非最不重要的一点,MTBE萃取方法依赖于较少危险性和更有利的氯仿置换溶剂15 ,已被我们的几项研究表明,被广泛应用来自植物16 ,藻类17,18 ,苍蝇19的不同生物样品的融合性,还包括几种哺乳动物组织,器官或细胞20,21,22 。
披露声明
作者没有什么可以披露的
致谢
MS获得GERLS-DAAD计划的完整博士学位奖学金。我们要感谢Andrew Wiszniewski博士对手稿的阅读和评论。我们非常感谢德国戈尔姆马克斯普朗克分子植物生理学研究所的Giavalisco实验室的所有成员的帮助。
材料
| Name | Company | Catalog Number | Comments |
| Reagents and standards | |||
| Ampicillin | Sigma Aldrich | A9393-5G | Internal standard for metabolites |
| Corticosterone | Sigma Aldrich | 27840-500MG | Internal standard for metabolites, HPLC grade |
| 13C Sorbitol | Sigma Aldrich | 605514 | Internal standard for metabolites, ISOTEC® Stable Isotopes |
| 1,2-diheptadecanoyl-sn-glycero-3-phosphocholine (17:0 PC) | Avanti Polar Lipids | 850360P | Internal standard for lipids |
| Methanol (MeOH) | Biosolve Chemicals | 13684102 | ULC-MS grade |
| Water | Biosolve Chemicals | 23214102 | ULC-MS grade |
| Methyl tert-butyl ether (MTBE) | Biosolve Chemicals | 13890602 | HPLC grade |
| Trypsin/Lys-C mix | Promega | V5072 | Enzymatic digestion of proteins |
| Equipment | |||
| Balance | Sartorius Corporation | 14 557 572 | |
| Tissue grinding mixer mill | Retsch, Mixer Mill MM 300 | 20.746.0001 | |
| Mortar and pestle | Sigma Aldrich | Z247464-1EA | |
| Vortex mixer | Vortex-Genie 2, Model G560 | SI-0236 | |
| Vacuum concentrator | Scan Speed Maxi Vac Alpha Evaporators | 7.008.500.002 | |
| 2 mL Safe-lock microcentrifuge tubes | Eppendorf | 30120094 | Used for sample extarction |
| 1.5 mL Safe-lock microcentrifuge tubes | Eppendorf | 30120086 | Used for fractions |
| Shaker | Eppendorf Thermomixer 5436 | 2050-100-05 | |
| Sonicator | USC 300 TH | 142-0084 | |
| Refrigerated microcentrifuge | Eppendorf, model 5427R | 22620701 | |
| UPLC system | Waters Acquity UPLC system (Waters, Machester, UK) | ||
| MS system | Exactive, Orbitrap-type, MS (Exactive, Thermo-Fisher, Bremen, Germany). | ||
| Reversed Phase (RP) Bridged Ethyl Hybrid (BEH) C8 column (100 mm × 2.1 mm containing 1.7 μm diameter particles) | Waters, Machester, UK | 186002878 | Analysis of lipids |
| RP High Strength Silica (HSS) T3 column (100 mm × 2.1 mm containing 1.8 μm diameter particles) | Waters, Machester, UK | 186003539 | Analysis of metabolites |
| Q ExactivePlus high resolution mass spectrometer connected to an EASY-nLC 1000 system | Thermo-Fisher, Bremen, Germany | Analysis of peptides |
参考文献
- Hodgkin, A. L., Huxley, A. F. A quantitative description of membrane current and its application to conduction and excitation in nerve. J Physiol. 117 (4), 500-544 (1952).
- Wang, Z., Gerstein, M., Snyder, M. RNA-Seq: a revolutionary tool for transcriptomics. Nat Rev Genet. 10 (1), 57-63 (2009).
- Yang, M. Q., et al. The emerging genomics and systems biology research lead to systems genomics studies. BMC Genomics. 15, 1 (2014).
- Sheth, B. P., Thaker, V. S. Plant systems biology: insights, advances and challenges. Planta. 240 (1), 33-54 (2014).
- Ideker, T., Galitski, T., Hood, L. A new approach to decoding life: Systems biology. Annu Rev Genom Hum G. 2, 343-372 (2001).
- Somvanshi, P. R., Venkatesh, K. V. A conceptual review on systems biology in health and diseases: from biological networks to modern therapeutics. Syst Synth Biol. 8 (1), 99-116 (2014).
- Oliver, S. G., Winson, M. K., Kell, D. B., Baganz, F. Systematic functional analysis of the yeast genome. Trends Biotechnol. 16 (9), 373-378 (1998).
- Tweeddale, H., Notley-McRobb, L., Ferenci, T. Effect of slow growth on metabolism of Escherichia coli, as revealed by global metabolite pool ("metabolome") analysis. J Bacteriol. 180 (19), 5109-5116 (1998).
- Kim, H. K., Verpoorte, R. Sample preparation for plant metabolomics. Phytochemical analysis : PCA. 21 (1), 4-13 (2010).
- Folch, J., Lees, M., Stanley, G. H. S. A Simple Method for the Isolation and Purification of Total Lipides from Animal Tissues. J Biol Chem. 226 (1), 497-509 (1957).
- Weckwerth, W., Wenzel, K., Fiehn, O. Process for the integrated extraction, identification and quantification of metabolites, proteins and RNA to reveal their co-regulation in biochemical networks. Proteomics. 4 (1), 78-83 (2004).
- Wienkoop, S., et al. Integration of metabolomic and proteomic phenotypes: analysis of data covariance dissects starch and RFO metabolism from low and high temperature compensation response in Arabidopsis thaliana. Mol Cell Proteomics. 7 (9), 1725-1736 (2008).
- Valledor, L., et al. A universal protocol for the combined isolation of metabolites, DNA, long RNAs, small RNAs, and proteins from plants and microorganisms. Plant J. 79 (1), 173-180 (2014).
- Nakayasu, E. S., et al. MPLEx: a Robust and Universal Protocol for Single-Sample Integrative Proteomic, Metabolomic, and Lipidomic Analyses. mSystems. 1 (3), (2016).
- Alfonsi, K., et al. Green chemistry tools to influence a medicinal chemistry and research chemistry based organisation. Green Chem. 10 (1), 31-36 (2008).
- Salem, M. A., Juppner, J., Bajdzienko, K., Giavalisco, P. Protocol: a fast, comprehensive and reproducible one-step extraction method for the rapid preparation of polar and semi-polar metabolites, lipids, proteins, starch and cell wall polymers from a single sample. Plant Methods. 12, 45 (2016).
- Hemme, D., et al. Systems-wide analysis of acclimation responses to long-term heat stress and recovery in the photosynthetic model organism Chlamydomonas reinhardtii. Plant Cell. 26 (11), 4270-4297 (2014).
- Sharma, D. K., et al. UPLC-MS analysis of Chlamydomonas reinhardtii and Scenedesmus obliquus lipid extracts and their possible metabolic roles. J Appl Phycol. 27 (3), 1149-1159 (2015).
- Delgado, R., Munoz, Y., Pena-Cortes, H., Giavalisco, P., Bacigalupo, J. Diacylglycerol activates the light-dependent channel TRP in the photosensitive microvilli of Drosophila melanogaster photoreceptors. J Neurosci. 34 (19), 6679-6686 (2014).
- Bozek, K., et al. Organization and evolution of brain lipidome revealed by large-scale analysis of human, chimpanzee, macaque, and mouse tissues. Neuron. 85 (4), 695-702 (2015).
- Khrameeva, E. E., et al. Neanderthal ancestry drives evolution of lipid catabolism in contemporary Europeans. Nat Commun. 5, 3584 (2014).
- Bozek, K., et al. Exceptional evolutionary divergence of human muscle and brain metabolomes parallels human cognitive and physical uniqueness. PLoS Biol. 12 (5), 1001871 (2014).
- Krueger, S., Steinhauser, D., Lisec, J., Giavalisco, P. Analysis of subcellular metabolite distributions within Arabidopsis thaliana leaf tissue: a primer for subcellular metabolomics. Methods Mol Biol. 1062, 575-596 (2014).
- Hummel, J., et al. Ultra performance liquid chromatography and high resolution mass spectrometry for the analysis of plant lipids. FrontPlant Sci. 2, 54 (2011).
- Giavalisco, P., et al. Elemental formula annotation of polar and lipophilic metabolites using (13) C, (15) N and (34) S isotope labelling, in combination with high-resolution mass spectrometry. Plant J. 68 (2), 364-376 (2011).
- Caldana, C., et al. Systemic analysis of inducible target of rapamycin mutants reveal a general metabolic switch controlling growth in Arabidopsis thaliana. Plant J. 73 (6), 897-909 (2013).
- Giavalisco, P., et al. Proteome analysis of Arabidopsis thaliana by two-dimensional gel electrophoresis and matrix-assisted laser desorption/ionisation-time of flight mass spectrometry. Proteomics. 5 (7), 1902-1913 (2005).
- Bradford, M. M. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding. Anal Biochem. 72, 248-254 (1976).
- Rappsilber, J., Mann, M., Ishihama, Y. Protocol for micro-purification, enrichment, pre-fractionation and storage of peptides for proteomics using StageTips. Nature protocols. 2 (8), 1896-1906 (2007).
- Spagou, K., et al. Hydrophilic interaction chromatography coupled to MS for metabonomic/metabolomic studies. J Sep Sci. 33 (6-7), 716-727 (2010).
- Hauck, O. K., et al. Uric acid accumulation in an Arabidopsis urate oxidase mutant impairs seedling establishment by blocking peroxisome maintenance. Plant Cell. 26 (7), 3090-3100 (2014).
- Avin-Wittenberg, T., et al. Global analysis of the role of autophagy in cellular metabolism and energy homeostasis in Arabidopsis seedlings under carbon starvation. Plant Cell. 27 (2), 306-322 (2015).
- Watanabe, M., et al. Comprehensive dissection of spatiotemporal metabolic shifts in primary, secondary, and lipid metabolism during developmental senescence in Arabidopsis. Plant physiol. 162 (3), 1290-1310 (2013).
- Lambers, H., et al. Proteaceae from severely phosphorus-impoverished soils extensively replace phospholipids with galactolipids and sulfolipids during leaf development to achieve a high photosynthetic phosphorus-use-efficiency. New Phytol. 196 (4), 1098-1108 (2012).
- Degenkolbe, T., et al. Differential remodeling of the lipidome during cold acclimation in natural accessions of Arabidopsis thaliana. Plant J. 70, 972-982 (2012).
- Bromke, M. A., et al. Liquid chromatography high-resolution mass spectrometry for fatty acid profiling. Plant J. 81 (3), 529-536 (2015).
- Li, N., et al. FAX1, a novel membrane protein mediating plastid fatty acid export. PLoS Biol. 13 (2), 1002053 (2015).
- Kueger, S., Steinhauser, D., Willmitzer, L., Giavalisco, P. High-resolution plant metabolomics: from mass spectral features to metabolites and from whole-cell analysis to subcellular metabolite distributions. Plant J. 70 (1), 39-50 (2012).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。