Method Article
単一サンプルからの代謝産物、脂質およびタンパク質の包括的分析のための単純分別抽出法
要約
1つのサンプルを用いて生物学的組織からの脂質、代謝産物およびタンパク質を包括的に抽出するためのプロトコルを提示する。
要約
複雑な生物学的システムの理解には、通常、トランスクリプトーム、プロテオーム、メタボロミクスおよび脂質測定によって決定される、生存細胞の複数の化合物クラスの測定、分析および統合が必要である。このプロトコールでは、試料ごとに1つのアリコートを使用して生物学的組織からの代謝産物、脂質およびタンパク質の再現性のある抽出のための簡単な方法を紹介する。抽出方法は、液体のメチルtert-ブチルエーテル:メタノール:水系に基づいており、疎水性および極性の代謝産物を2つの非混和性の相に液体分配し、タンパク質および他の巨大分子を固体ペレットとして沈殿させる。したがって、この方法は、質量分析計に結合された液体クロマトグラフィー(LC)またはガスクロマトグラフィー(GC)などの一般的なハイスループット「オミックス」技術と完全に適合する特定の分子組成の3つの異なる画分を提供する。メソッドがinitであったとしても藻類、昆虫、哺乳類の組織や細胞培養など多様なシステムの生物学的サンプルの抽出と分析に完全に適合することが証明されています。
概要
システム生物学は、 1世紀半ばに現れ、ゲノムおよび転写データセットの大規模解析によって進歩しました2、3 、複雑な生物学的システムの分析のための新たな不可欠なアプローチに発展しました4 。システム生物学の主な目的は、生物学的システムにおける構成要素の相互作用および依存性を解読し、遺伝子型、それらの実現、分子変換および結果として生じる表現型間の関係を橋渡しすることである。したがって、複雑な生物学的システムの記述および理解のためには、様々な大規模分析アプローチ、すなわちゲノミクス、トランスクリプトミックス、メタボロミクス、リピドミクスおよびプロテオミクスおよびそれらのコンピュータ分析によって生成される包括的なデータセットの統合が前提となっている。
Bas生きているシステムの生物学的成分の巨大な化学的多様性と複雑さに基づいて、大規模で包括的な「オミクス」データセットの作成は、適用された抽出方法の質に強く依存している9 。抽出方法の質に加えて、この方法の経済性が重要である。これはできるだけ少ない試料投入量から多くの分子情報を得ることが望ましいことを意味する。多くの場合、試料量は制限されることがあり、従って、所与の試料の単一抽出から多くの分子クラスを導くことができる抽出方法を使用することが非常に望ましい。これは、同じ試料の異なる試料アリコートから異なる化合物クラスを抽出するためのいくつかの特殊な抽出法を使用する代わりに、単一のアリコートの分子成分を異なる分子画分に分ける逐次抽出法が使用されることを意味する。
これらの分画抽出法に用いられる一般的な方法は、1957年に開発されたFolch らの 2相脂質抽出法に基づいている。この方法は、極性および疎水性代謝産物のクロロホルム:メタノール/水分配に基づいており、高品質脂質分析のためのサンプルのクリーンアップとデコンプレックスを目的としています。マルチオミックスシステムの生物学の進歩に伴い、フォルチック法はタンパク質や極性代謝物のサンプル分割や脂質のサンプル分割にさらに段階的に改良されました。液体クロマトグラフィーに基づくプロテオミクス11,12,13,14に加えて、極性および疎水性化合物のガスクロマトグラフィーおよび液体クロマトグラフィーに基づくメタボロミクスおよびリピドミクスがある。残念なことに、これらの方法のすべては、クロロホルムに基づく抽出方法に依存する望ましくないfo極性と脂質相との間の中間相としてタンパク質ペレットを生成するが、グリーンケミストリーの観点からも望ましくない溶媒である 15,16 。しかしながら、溶媒メチルtert-ブチルエーテル(MTBE)は、これらの上記の問題を克服し、クロロホルムの適切な代替物である。これらの要求に基づき、私たちはMTBE:メタノール:水ベースの抽出法を確立することに決めました。これは前述のすべての仕様を満たすため、包括的なマルチオミックス分析の理想的な出発点として機能します16 。このプロトコルは、一般的に観察される問題のトラブルシューティングを含む、サンプル調製の簡単で迅速で再現性のあるワークフローを段階的にユーザーにガイドします。さらに、超高速液体クロマトグラフィー - 質量分析(UPLC-MS) - バースからの例示的な分析データを簡単に紹介する植物組織サンプルからの脂質代謝物、メタボロミクスおよびプロテオミクスプロファイリングを含む。与えられた例は50mgのArabidopsis thaliana葉組織サンプルに由来するものであるが、このプロトコールは、藻類17,18 、昆虫19および哺乳動物細胞、臓器および組織20,21および24を含むいくつかの他の生物学的サンプルおよび組織に用いられている。 22 。提示された抽出プロトコルの範囲は、抽出前のサンプル処理および抽出手順自体の明確で詳細な説明を提供することである。分析アプリケーションの3つの簡単な例を提供していますが、分析前および分析後のデータ処理に関する詳細情報は、 25,26。
プロトコル
注意:抽出中に使用されるメタノール(MeOH)およびメチルtert-ブチルエーテル(MTBE)は引火性があり、長期間暴露および/または接触すると、呼吸器系、眼または皮膚の刺激を引き起こす可能性があります。煙霧フードでのみ取り扱ってください。抽出中に適切な安全手順(ラボコート、安全眼鏡、手袋など )を使用してください。このプロトコールのいくつかのステップで使用される液体窒素とドライアイスは、長期にわたる皮膚接触によって重度のやけどを引き起こす可能性があります。保護手袋と眼鏡を着用して慎重に取り扱ってください。ユーザーは、サンプル分析にさまざまな化学物質、試薬または内部標準を使用することができます。そのうちのいくつかは毒性があります。使用されるすべての物質について、関連する化学物質安全性データシートを調べてください。
1.生物学的サンプルの採取と収穫
- 標識採取管を準備する。
注:ここでは、標識された2 mL、丸底、安全なloc2つの直径5mmの組織ホモジナイザーのための金属ボールを含む2つのマイクロ遠心チューブ。 - 満たされた液体窒素デュワーを準備する。
- 生物学的サンプルを採取し、組織を液体窒素中で急速に凍結させる。創傷によって引き起こされる代謝変化を避けるために、このステップを数秒以内にできるだけ早く実行してください。
注:デモの目的で、長い日の条件で土壌に生育した30日齢の野生型シロイヌナズナ (Col-0)のロゼット葉を使用してください。 - 収穫したサンプルをドライアイス上に短期間休憩するか、-80℃で長期間保存してください。
2.粉砕および組織破壊
- 組織ホモジナイザーのチューブホルダーを液体窒素中で少なくとも10分間あらかじめ冷却する。ティッシュホモジナイザーが利用できない場合は、清潔であらかじめ冷却したモルタルと乳棒を使用してください。
- 液体窒素、ドライアイスまたは-80℃冷凍庫からサンプルを取り出し、プレ冷却したものチューブホルダー。
- チューブホルダーを組織ホモジナイザーにすばやく入れます。
- 生物学的物質を細かく均一な粉末に粉砕する。葉は20 Hzで1分間使用してください。
注意;組織に応じて均質化の時間と速度を変えることができます。サンプルがホモジナイズして細かい粉末になっていることを確認し、ホモジナイゼーションのすべてのステップでこの粉末を凍らせます。 - チューブホルダーから生物学的サンプルを取り出し、さらに抽出するまで凍らせておいてください。
3.組織の重量測定
- 必要なサンプル量に十分な精度の分析天びんを使用してください。
- ラベルが付いた2 mLの丸底安全ロックマイクロチューブを準備する。
- チューブとスパチュラを液体窒素で予め冷却してください。
- 必要な量の組織粉末を2 mLセーフロックマイクロ遠心チューブに分注する。
注意:wにかかる時間を最小限に抑えて植物材料の解凍を避けるサンプルを集める。 - 液体窒素に秤量した直後にアリコート試料を戻す。
- 各サンプルの正確な重量を記録する。ほとんどの植物組織に10〜50 mg±10%を使用してください。
- - 抽出するまで分取したサンプルを-80℃で保存する。
4.試薬のセットアップ
- メチルtert-ブチルエーテル(MTBE)/メタノール(MeOH)の抽出混合物を使用する。
- 抽出溶媒100mLの調製のために、75mLのMTBEを25mLのMeOHに加えて、MTBE:MeOH(3:1、vol / vol)の混合物を作製する。
- 分析ニーズに応じて、分析後の標準化のための内部標準を追加します。典型的にはUPLC-MSに基づく脂質分析のための内部標準として50μLの1,2-ジヘプタデカノイル-sn-グリセロ-3-ホスホコリン(クロロホルム中1mg / mL)を添加する一方、50μLの13 Cソルビトール( 1 mg / mLの水中)を、GC-MSに基づく一次代謝産物。 UPLC-MSに基づく代謝物分析のための内部標準は、コルチコステロン50μL(メタノール中1mg / mL)およびアンピシリン(メタノール中1mg / mL)25μLである。
- MTBE:MeOH混合物でリンスしたきれいなガラス瓶に溶媒を移す。
- 抽出混合液は4℃で1週間保存してください。
注:再現性のある結果を維持するために、抽出混合物を長期間保管しないでください。
- 相分離を誘発するために、水(H 2 O)/メタノール(MeOH)を使用する。
- 100mLのH 2 O:MeOHの調製のために、75mLのH 2 Oを25mLのMeOHに加えてH 2 O:MeOH(3:1、vol / vol)を製造する。
- H 2 O:MeOH混合物でリンスしたきれいなガラス瓶に溶媒を移す。この溶媒は、室温で数週間保存することができます。
サンプルの抽出
- 抽出前に冷却する液体冷却システムまたは-20℃冷凍庫を使用して-20℃に冷却する(MTBE:MeOH、3:1、vol / vol)。
- アリコートに分けられたサンプルを1つずつ取り出し、1mLの予め冷却した抽出混合物を各サンプルチューブに加える。注意:MTBEの粘度が低いため、この手順を迅速に実行してください。
- 組織が抽出混合物内で十分にホモジナイズされるまで、ボルテックスミキサーで直ちに混合する。
注:このステップは、タンパク質を沈殿させ、その酵素活性を不活性化する必要があるので、非常に重要である。 - オービタルシェーカー上のすべてのサンプルを100 rpmで45分間4℃でインキュベートする。
- 氷冷超音波浴で15分間試料を超音波処理する。
6.相分離による分別
- 650μLのH 2 O:MeOH(3:1、vol / vol)を各試料管に加える。
- 1分間ボルテックスしてよく混合する。
- サンプルを4℃で5分間20,000 x gの速度で遠心分離する。
注記:このステップの後、チューブの底に固体ペレットを含む2つの混和しない液相が存在します。
注意:2つの液相が混ざるのを避けるために注意してチューブを取り扱い、沈殿したペレットを破壊しないように注意してください。
7.極性および疎水性画分のアリコート
- 500μLの溶媒を上部の脂質含有相から1.5mLのマイクロ遠心チューブに移す。
注:一定分量の脂質サンプルは、直ちにUPLC-MS分析(ステップ8.1)のために直接濃縮するか、または-80℃で数週間保存することができます。 - 試料から500μLを一旦除去したら、200μLのピペットを用いて残りの脂質相を除去する。
- 下の相(極性および半極性代謝産物)から標識された1.5 mL微量遠心管に400μLの溶媒を移します。分取された極性サンプルは、即時UPLC-MS分析のために直接濃縮することができ(ステップ8.2)-80℃で数週間。
- 200μLの追加分取液を追加して、例えば、ガスクロマトグラフィーに基づく代謝産物分析などを行います( 16) 。
- 過剰量をピペッティングして水相の残りを除去する。
- 得られたタンパク質、デンプン、細胞壁ペレットを500μLのメタノールで1分間完全にボルテックスして洗浄する。
- 10,000xgの速度で5分間4℃でサンプルを遠心分離する。
- 先に述べたようにタンパク質の抽出と消化(ステップ11)またはデンプン/細胞壁分析を行います16 。
注:すぐに使用しない場合、これらのペレットは-80℃で数週間保存することができます。
8.画分の濃縮および保存
- 加熱しない真空濃縮器(1〜2時間)または好ましくはニトリルを使用して、脂質サンプル(ステップ7.1から)から溶媒を蒸発させる。脂質の酸化的修飾を避けるためにogen flow evaporatorを使用してください。
注:乾燥サンプルはすぐに分析する必要があります。保管のために、試料をガラスバイアル中の理想的にはMTBE溶液に残す(ステップ7.1)。 - 加熱せずに真空濃縮器で一晩(ステップ7.3または7.4の)水性サンプルから溶媒を蒸発させる。注:乾燥したサンプルは分析前に-80℃で数週間保存することができます。
UPLC-MSを用いた脂質分析24
- 400μLのアセトニトリル:2-プロパノール(7:3、vol / vol)中で乾燥した脂質画分(ステップ8.1から)を再懸濁する。
- 十分な液体をガラスバイアルに移し、しっかりと蓋をする。
- ガラスバイアルを冷却オートサンプラー(4℃)に入れます。
- 1サンプルあたり2μLを注入し、400μL/分の流速で作動するUPLCシステムを用いて60℃に保持された逆相(RP)C 8カラムで脂質を分離する。
- モバイルを使用するクロマトグラフィー分離のために表1に記載されている。
- 150〜1,500 m / zの質量範囲をカバーする適切なMS装置を使用して、陽イオン化モードおよび陰イオン化モードで質量スペクトルを取得する。
UPLC-MSを用いた極性および半極性代謝物の分析25 。
- 200μLのUPLCグレードのメタノール:水(1:1、vol / vol)中で極性相(ステップ8.2から)を再懸濁する。
- 十分な液体をガラスバイアルに移し、しっかりと蓋をする。
- ガラスバイアルを冷却オートサンプラー(4℃)に入れます。
- 各サンプルから2μLを注入し、流速400μL/分で稼動するUPLCシステムを使用して40℃に保持されたRP C 18カラムで代謝産物を分離する。
- 表2に示すパラメーターを用いてクロマトグラフィー分離に移動相を使用する。
- 陽イオン化モードと陰イオン化モードでフルスキャンマススペクトルを取得50〜1,500 m / zの質量範囲をカバーする適切な質量分析計を使用してください。
11.タンパク質抽出、消化および分析16
- 選択したタンパク質抽出バッファー200μL中で洗浄したタンパク質/デンプン/細胞壁ペレット(ステップ7.8から)を再懸濁する。注:尿素/チオ尿素緩衝液(5M尿素、2mMチオ尿素、15mM DTT、2%CHAPSおよびプロテアーゼおよびホスファターゼ阻害剤)を使用する。
- 氷冷した音波浴で10分間試料を超音波処理する。
- サンプルを室温でオービタルシェーカー(100rpm)で30分間インキュベートする。
- 溶解したタンパク質を10,000 x gで5分間遠心します。
- 新しいチューブにタンパク質上清を集める。
- 収集した上清28からタンパク質濃度を決定する。
- 選択したプロトコールで溶液中のタンパク質50μgを消化する。典型的には、Trypsin / Lys-C mix accordi取扱説明書を参照してください。
- 消化後、C 18段階チップを用いて質量分析に先立ってペプチドの脱塩を行い、消化されたペプチド29を溶出する。
- 試料を加熱せずに真空濃縮器でほぼ乾燥状態に濃縮する。
- 適切なローディングバッファー(例えば5%アセトニトリル、0.5%ギ酸)でサンプルを再懸濁し、ナノLCシステムに接続された高分解能質量分析計を使用してLC-MS / MSによりペプチド混合物を分析する。
注記:このプロトコールで提示された例示的なプロテオミクスデータセットでは、 表3に記載されるような勾配を使用した。 - 1回のフルスキャン(FS)の後に最大15のデータ依存MS / MSスキャンが続く上位15の戦略を使用して、質量分析計を次のパラメータに設定します。FSは質量範囲200〜2,000 m / z目標値3×10 6のイオンで70,000の分解能。データ依存のMS / MSスキャンを上位エンコードで取得するrgy collisional dissociation(HCD)。最大イオン充填時間50 ms、アイソレーションウィンドウ4.0 m / z、正規化衝突エネルギー(NCE)30%、アンダーフィル比1%のMS / MSの目標値を1e 5イオンに設定します。 MS / MSイオンを17.500の分解能で測定し、動的除外を60秒に設定した。
結果
包括的なマルチオミックスデータセットは、複雑な生物システムを理解する上で非常に重要です。成功した生物実験の戦略は、通常、有意義な実験計画、実験のセットアップとパフォーマンス、サンプル収集、抽出、分析データ取得、生データ処理、統計データ分析、関連する代謝産物および生物学的データ解釈経路マッピングや視覚化を含む( 図1 )。
ここで紹介する抽出プロトコルでは、 図2の詳細なワークフローの概要に示されているサンプル収集、処理および抽出手順に焦点を当てます。実証目的のために、50mgのシロイヌナズナ葉組織を選択した。この物質を収穫し、粉砕し、抽出してから3つ例示的な分析UPLC-MSプラットフォームであり、標的化および非標的化の脂質、代謝およびプロテオーム分析に利用できるデータを提供する。 図2および図6は、抽出溶媒が標準的な条件下でどのように見えるかの代表的な写真をさらに含む。さらに、析出した巨大分子(タンパク質およびデンプン)の過剰量を含むサンプルおよび不適当なサンプル均質化を有するサンプルの例が示される( 図3 )。これらの2つの一般的な問題のトラブルシューティングは、 図3に簡潔に記載されていますが、これについては、前回の刊行物16でさらに詳しく説明しています。
図4および図5は、脂質、極性/セミi-極性代謝物およびタンパク質分析が含まれる。上部MTBE相( 図2 )から採取した脂質を、高分解能質量分析に結合した逆相(RP)C8超高速液体クロマトグラフィーにより分析した。脂質は、正および負のMSイオン化モード( 図4 、上部ペイン)16,24を使用して得ることができる。
極性および半極性の一次代謝物および二次代謝物を、逆相(RP)C 18 UPLC-MS 25によって極性(水/メタノール)相( 図2 )から分析した。示された方法は、逆相クロマトグラフィーを使用して、半極性代謝物(すなわち、植物の二次代謝からの代謝産物)の分析に高度に適合し、これは、MSにおいて陽イオン化モードおよび陰イオン化モードを使用して分析することができる( 図4 、下部ペイン) 16 。 GC-MS 16または親水性相互作用液体クロマトグラフィー30のような他の分析方法によって、逆相物質上の良好な保持を示さないこの画分(糖、極性アミノ酸など)からのより親水性の代謝産物を分析することができる。
抽出チューブの底の固体ペレットから回収されたタンパク質( 図2 )を、溶液中で消化し、ショットガンLC-MS( 図5 )を用いて分析したが、デンプンおよび細胞壁抽出プロトコル材料は、これまでに公表されたプロトコール16から得ることができる。
要約すると、200種以上の脂質種、50種の注釈付き半極性代謝物および数千種のプロテイnsは、この例で使用されるタイプのサンプルから日常的に識別できます。さらに、この方法は、異なる組織、器官および細胞培養材料を用いて幅広い適用性を示した( 図6 )。

図1: 大規模な非標的オミックス解析の一般的なワークフロー この図の拡大版を見るには、ここをクリックしてください。

図2 :生物学的サンプルの単一アリコートからの脂質、代謝産物およびタンパク質の分析のための試料調製および抽出ワークフロー。この図の拡大版を見るには、ここをクリックしてください。
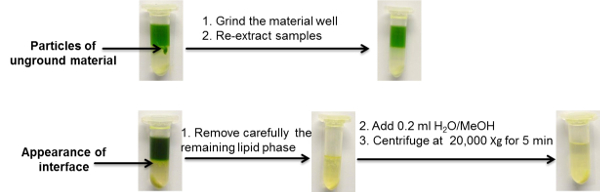
図3 :2相パーティショニング抽出プロトコルを使用して一般的に観察される問題の実例 この図の拡大版を見るには、ここをクリックしてください。
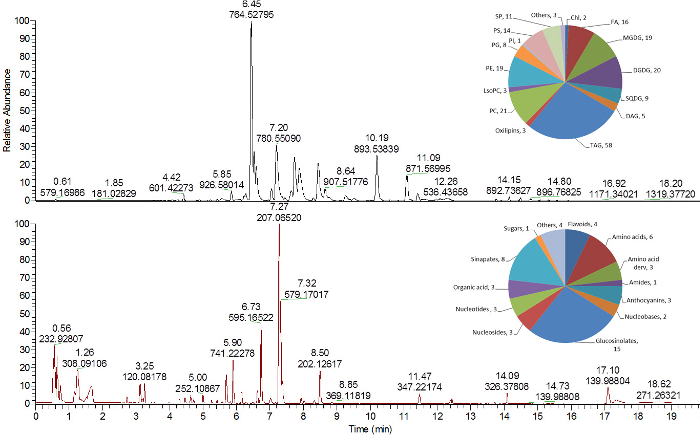
図4 :Arabidopsis thaliana 葉エキス からの脂質および半極性代謝 物の 代表的なクロマトグラム 。塩基ピーククロマトグラム(上部ペイン)および半極性代謝物(下部ペイン)を陽イオン化モードで分析した16 。各クロマトグラムの右上隅の円グラフは、異なる化学クラスに割り当てられた同定された脂質および代謝産物の数を示しています。 Chl、クロロフィル; DAG、ジアシルグリセリド; DGDG、ジガラクトシルジアシルグリセロール; FA、脂肪酸;リゾPC、リゾホスファチジルコリン; MGDG、モノガラクトシルジアシルグリセロール; PC、ホスファチジルコリン; PE、ホスファチジルエタノールアミン; PG、ホスファチジルグリセロール; PI、ホスファチジルイノシトール; PS、ホスファチジルセリン; SP、スフィンゴ脂質; SQDG、スルホキノボシルジアシルグリセロール; TAG、トリアシルグリセリド。 この図の拡大版を見るには、ここをクリックしてください。
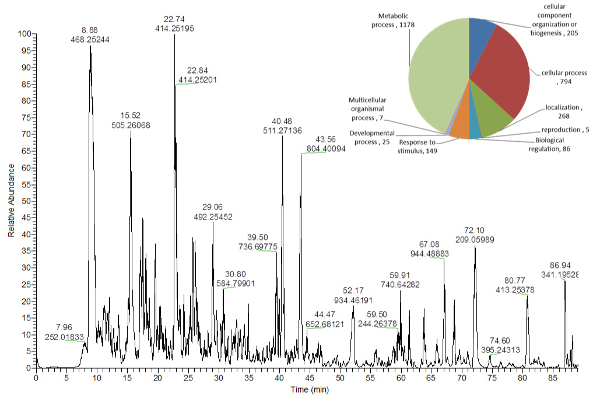
図5 trong>:Arabidopsis thaliana 葉エキスからのペプチドの代表的な塩基ピーククロマトグラム。
右上の円グラフには、異なる生物学的プロセスに割り当てられた同定されたタンパク質の数が示されています16 。 この図の拡大版を見るには、ここをクリックしてください。

図6 :野生型 シロイヌナズナ からの様々な組織型の代表的な抽出例 。
示された組織から50mgの新鮮な重量を用いて、全てのサンプルを抽出した。">この図の拡大版を見るには、ここをクリックしてください。
| 時間(分) | バッファAからバッファBへの% | |
| 0〜1分 | 45%A | 緩衝液A:UPLC MSグレードの水中の1%1M NH 4 - アセテート、0.1%酢酸 |
| 1~4分 | 45%Aから25%Aまでの直線勾配 | 緩衝液B:アセトニトリル/イソプロパノール7:3(v:v)中の1%1M NH 4 - アセテート、0.1%酢酸、 |
| 4〜12分 | 25%Aから11%Aまでの直線勾配 | 流速400μL/分 |
| 12〜15分 | 11%Aから0%Aまでの線形勾配 | 注入量2μL |
| 15〜19.5分 | 0%Aで4.5分間カラムを洗浄する。 | |
| 19.50~19.51分 | 45%に戻すA | |
| 19.51〜24分 | 45%Aで平衡を保つ |
表1:RP-UPLCの脂質分離のための勾配パラメータ。 RP、逆相。 UPLC、超高速液体クロマトグラフィー。
| 時間(分) | バッファAからバッファBへの% | |
| 0〜1分 | 99%A | 緩衝液A:UPLCグレードの水中の0.1%ギ酸 |
| 1~11分 | 99%Aから60%Aまでの直線勾配 | 緩衝液B:UPLCグラジエントアセトニトリル中の0.1%ギ酸 |
| 11〜13分 | 60%Aから30%Aまでの直線勾配 | 流量4001; L /分 |
| 13〜15分 | 30%Aから1%Aまでの線形勾配 | 注入量2μL |
| 15〜16分 | カラムを1%Aで1分間洗浄する | |
| 16〜17分 | 線形勾配1%Aから99%A | |
| 17〜20分 | 99%Aで3分間平衡化する |
表2:極性および半極性代謝物のRP-UPLC分離のための勾配パラメータ。 RP、逆相。 UPLC、超高速液体クロマトグラフィー。
| 時間(分) | バッファBからバッファAへの% | |
| 0〜5分 | 直線勾配0から10% | 緩衝液A:UPLCグレードの水中の0.1%ギ酸 |
| 5〜80分 | 直線勾配10%から40% | 緩衝液B:60%UPLCグレードアセトニトリル中の0.1%ギ酸 |
| 80〜85分 | 40%から60%までの直線勾配 | 流速300 nL /分 |
| 85〜86分 | 60%から95%までの直線勾配 | 注入量5μL |
| 86〜91分 | カラムを5分間95% | |
| 91〜92分 | 線形勾配95%から0% | |
| 93〜110分 | カラムを0%で17分間平衡化させ、 |
表3:ペプチドのナノLC分離のための勾配パラメータ。 LC、液体クロマトグラフィー。
ディスカッション
この記事では、単一の50 mgの葉試料からの総合的な脂質代謝、メタボロームおよびプロテオーム分析のための簡単で高度に適用可能な抽出プロトコールを記載し説明する。この方法は、以前に、様々な記事17,18,19,20,21,22,23,24,25,26,31,32,33,34,35,36,37に掲載されているいくつかの研究で使用されているその直進性に加えて、証明されたワークフローと高い堅牢性と再現性を実現します。
ここに提供されたアプリケーションは、複雑な生物学的サンプルの最初のスクリーニングのためのいくつかの日常的な方法を示す。これらの例示された大規模なメタボロミクスおよびリピドームデータセットは、分析された生物系の代謝における広範なまたは特異的な変化に関する包括的な情報を提供することができる一方で、タンパク質の分析から得られたデータは定量(豊富)および定性)変化、細胞機能および機構を制御する構造タンパク質または転写因子(TF)したがって、統合オミックスデータは、特定の代謝経路または細胞プロセスに関連する多様な分子の分子変化を解明することによって、生物系の遺伝的または生物学的および/または非生物的摂動によって誘導される可能性のある変化に関する初期情報を明らかにする可能性を有する。
もちろん長期的には、成功したシステム生物学分析のために、分析され、注釈された分子実体の数を最大にし、細胞機能および活性のモニターを可能な限り完全に可能にすることが極めて重要である。この目的のために、得られた画分を、さらなる化合物または化合物クラスを標的とする多様な分析方法に付加的に適用することができる( 図4 )。
これを述べた上で、得られたデータの全体的な分析戦略は、2つの異なる戦略に従うことができると述べなければならない:一方で、我々は既知の化合物の定量化による細胞機能の解明を強調している。一方、測定された代謝物および脂質の多くは、未知または注釈されていない。これらの、まだ注釈の付いていない化合物の測定値には、多くの意味のある情報が含まれています。これは、分類または差別の統計的方法によって利用できます。bグループ間または治療間20,21,22 。
それでも、これらの未知の化合物、特にグループ分類に関連するものまたはバイオマーカーとしての役割を果たすものを同定する必要がある。この識別プロセスは残念ながら非常に退屈で、追加の分析測定や戦略なしには達成できません。 図4からわかるように、非注釈化合物の数は非常に多い(実際には大多数)。それにもかかわらず、上記のように、これらのクロマトグラフのピークはデータ解析内で扱うことができ、従って影響を受けたエンティティは解明され、さらなる同定戦略に供される。
要約すると、本明細書に導入されたプロトコルは、実験的システム生物学ならびに古典的統計学的適用のためのいくつかの利点を提供すると結論付けることができるations。
第1に、すべての画分が単一のサンプルから抽出されるので、各実験データセット(脂質、代謝物、タンパク質)間の変動は、すべてのデータセットが同じサンプルアリコートから得られるので、著しく低減される。これは明らかに得られた結果の比較可能性の向上につながる。
第2に、この方法は容易にスケーラブルであり、それゆえ、少量から大量の試料量に非常に適合する。我々は、通常、10〜100mgの組織サンプルを使用するが、成功したリピドーム研究もまた、20個のシロイヌナズナ種子31で実施されている31 。特に少量の試料量との適合性は、限られた量の生物学的組織または試料が利用可能である場合に、この方法を適用可能にする。それでもなお、十分なサンプル材料が入手可能であっても、ここに提示された方法は、これらのサンプルを、より多くの実験的反復で、u異なる抽出手順でそれらを歌います。これにより、より優れた洗練された統計データ分析が可能になります。
第3に、この方法は、極性および非極性分子の液体 - 液体分画に基づいているため、単純な単相抽出法( 例えば、メタノール抽出)とは対照的に、手順における顕著な脱錯化工程を提供する。この効率的なサンプルの脱錯化は、化学的に干渉する分子の互いの分離に起因する個々の画分の部分精製をもたらす。したがって、化学的分割プロセスは、抽出された試料を異なる化学的クラスに系統的に等分するための実際的利点を提供するだけでなく、異なるフラクションから汚染化合物を除去するので、個々の分析測定を改善する。明らかに、本発明者らは、特に、有機相に分配され、通常は極性化合物のクロマトグラフィー分析は、極性画分にはほとんど完全に存在しない。極性化合物が枯渇する疎水性脂質の分析についても同様である。極性化合物と非極性化合物の精製に加えて、サンプルからタンパク質や他のマクロ分子を枯渇させて回収します。タンパク質、デンプン、細胞壁解析に利用できる分離画分を提供するだけでなく、個々の画分内のより鮮明なサンプルに導く。大きな巨大分子の存在が分析カラムの損傷または少なくともより短い寿命につながることが知られているので、これは特に重要である。
最後に重要なのは、危険性が低く、より好都合なクロロホルム置換溶媒15に頼っている、記載されたMTBE抽出方法は、我々のグループからのいくつかの研究によって既に広く示されている植物16 、藻類17,18 、ハエ19からの異なる生物学的サンプルについての妥当性を示すが、いくつかの哺乳類の組織、器官または細胞20,21,22 。
開示事項
著者は何も開示していない
謝辞
MSは、GERLS-DAADプログラムの博士論文の全面的なサポートを受けています。私たちはAndrew Wiszniewski博士に感謝の意を表する。 Max Plankの分子植物生理学研究所(Golm、Germany)のGiavaliscoラボのメンバー全員に心から感謝しています。
資料
| Name | Company | Catalog Number | Comments |
| Reagents and standards | |||
| Ampicillin | Sigma Aldrich | A9393-5G | Internal standard for metabolites |
| Corticosterone | Sigma Aldrich | 27840-500MG | Internal standard for metabolites, HPLC grade |
| 13C Sorbitol | Sigma Aldrich | 605514 | Internal standard for metabolites, ISOTEC® Stable Isotopes |
| 1,2-diheptadecanoyl-sn-glycero-3-phosphocholine (17:0 PC) | Avanti Polar Lipids | 850360P | Internal standard for lipids |
| Methanol (MeOH) | Biosolve Chemicals | 13684102 | ULC-MS grade |
| Water | Biosolve Chemicals | 23214102 | ULC-MS grade |
| Methyl tert-butyl ether (MTBE) | Biosolve Chemicals | 13890602 | HPLC grade |
| Trypsin/Lys-C mix | Promega | V5072 | Enzymatic digestion of proteins |
| Equipment | |||
| Balance | Sartorius Corporation | 14 557 572 | |
| Tissue grinding mixer mill | Retsch, Mixer Mill MM 300 | 20.746.0001 | |
| Mortar and pestle | Sigma Aldrich | Z247464-1EA | |
| Vortex mixer | Vortex-Genie 2, Model G560 | SI-0236 | |
| Vacuum concentrator | Scan Speed Maxi Vac Alpha Evaporators | 7.008.500.002 | |
| 2 mL Safe-lock microcentrifuge tubes | Eppendorf | 30120094 | Used for sample extarction |
| 1.5 mL Safe-lock microcentrifuge tubes | Eppendorf | 30120086 | Used for fractions |
| Shaker | Eppendorf Thermomixer 5436 | 2050-100-05 | |
| Sonicator | USC 300 TH | 142-0084 | |
| Refrigerated microcentrifuge | Eppendorf, model 5427R | 22620701 | |
| UPLC system | Waters Acquity UPLC system (Waters, Machester, UK) | ||
| MS system | Exactive, Orbitrap-type, MS (Exactive, Thermo-Fisher, Bremen, Germany). | ||
| Reversed Phase (RP) Bridged Ethyl Hybrid (BEH) C8 column (100 mm × 2.1 mm containing 1.7 μm diameter particles) | Waters, Machester, UK | 186002878 | Analysis of lipids |
| RP High Strength Silica (HSS) T3 column (100 mm × 2.1 mm containing 1.8 μm diameter particles) | Waters, Machester, UK | 186003539 | Analysis of metabolites |
| Q ExactivePlus high resolution mass spectrometer connected to an EASY-nLC 1000 system | Thermo-Fisher, Bremen, Germany | Analysis of peptides |
参考文献
- Hodgkin, A. L., Huxley, A. F. A quantitative description of membrane current and its application to conduction and excitation in nerve. J Physiol. 117 (4), 500-544 (1952).
- Wang, Z., Gerstein, M., Snyder, M. RNA-Seq: a revolutionary tool for transcriptomics. Nat Rev Genet. 10 (1), 57-63 (2009).
- Yang, M. Q., et al. The emerging genomics and systems biology research lead to systems genomics studies. BMC Genomics. 15, 1 (2014).
- Sheth, B. P., Thaker, V. S. Plant systems biology: insights, advances and challenges. Planta. 240 (1), 33-54 (2014).
- Ideker, T., Galitski, T., Hood, L. A new approach to decoding life: Systems biology. Annu Rev Genom Hum G. 2, 343-372 (2001).
- Somvanshi, P. R., Venkatesh, K. V. A conceptual review on systems biology in health and diseases: from biological networks to modern therapeutics. Syst Synth Biol. 8 (1), 99-116 (2014).
- Oliver, S. G., Winson, M. K., Kell, D. B., Baganz, F. Systematic functional analysis of the yeast genome. Trends Biotechnol. 16 (9), 373-378 (1998).
- Tweeddale, H., Notley-McRobb, L., Ferenci, T. Effect of slow growth on metabolism of Escherichia coli, as revealed by global metabolite pool ("metabolome") analysis. J Bacteriol. 180 (19), 5109-5116 (1998).
- Kim, H. K., Verpoorte, R. Sample preparation for plant metabolomics. Phytochemical analysis : PCA. 21 (1), 4-13 (2010).
- Folch, J., Lees, M., Stanley, G. H. S. A Simple Method for the Isolation and Purification of Total Lipides from Animal Tissues. J Biol Chem. 226 (1), 497-509 (1957).
- Weckwerth, W., Wenzel, K., Fiehn, O. Process for the integrated extraction, identification and quantification of metabolites, proteins and RNA to reveal their co-regulation in biochemical networks. Proteomics. 4 (1), 78-83 (2004).
- Wienkoop, S., et al. Integration of metabolomic and proteomic phenotypes: analysis of data covariance dissects starch and RFO metabolism from low and high temperature compensation response in Arabidopsis thaliana. Mol Cell Proteomics. 7 (9), 1725-1736 (2008).
- Valledor, L., et al. A universal protocol for the combined isolation of metabolites, DNA, long RNAs, small RNAs, and proteins from plants and microorganisms. Plant J. 79 (1), 173-180 (2014).
- Nakayasu, E. S., et al. MPLEx: a Robust and Universal Protocol for Single-Sample Integrative Proteomic, Metabolomic, and Lipidomic Analyses. mSystems. 1 (3), (2016).
- Alfonsi, K., et al. Green chemistry tools to influence a medicinal chemistry and research chemistry based organisation. Green Chem. 10 (1), 31-36 (2008).
- Salem, M. A., Juppner, J., Bajdzienko, K., Giavalisco, P. Protocol: a fast, comprehensive and reproducible one-step extraction method for the rapid preparation of polar and semi-polar metabolites, lipids, proteins, starch and cell wall polymers from a single sample. Plant Methods. 12, 45 (2016).
- Hemme, D., et al. Systems-wide analysis of acclimation responses to long-term heat stress and recovery in the photosynthetic model organism Chlamydomonas reinhardtii. Plant Cell. 26 (11), 4270-4297 (2014).
- Sharma, D. K., et al. UPLC-MS analysis of Chlamydomonas reinhardtii and Scenedesmus obliquus lipid extracts and their possible metabolic roles. J Appl Phycol. 27 (3), 1149-1159 (2015).
- Delgado, R., Munoz, Y., Pena-Cortes, H., Giavalisco, P., Bacigalupo, J. Diacylglycerol activates the light-dependent channel TRP in the photosensitive microvilli of Drosophila melanogaster photoreceptors. J Neurosci. 34 (19), 6679-6686 (2014).
- Bozek, K., et al. Organization and evolution of brain lipidome revealed by large-scale analysis of human, chimpanzee, macaque, and mouse tissues. Neuron. 85 (4), 695-702 (2015).
- Khrameeva, E. E., et al. Neanderthal ancestry drives evolution of lipid catabolism in contemporary Europeans. Nat Commun. 5, 3584 (2014).
- Bozek, K., et al. Exceptional evolutionary divergence of human muscle and brain metabolomes parallels human cognitive and physical uniqueness. PLoS Biol. 12 (5), 1001871 (2014).
- Krueger, S., Steinhauser, D., Lisec, J., Giavalisco, P. Analysis of subcellular metabolite distributions within Arabidopsis thaliana leaf tissue: a primer for subcellular metabolomics. Methods Mol Biol. 1062, 575-596 (2014).
- Hummel, J., et al. Ultra performance liquid chromatography and high resolution mass spectrometry for the analysis of plant lipids. FrontPlant Sci. 2, 54 (2011).
- Giavalisco, P., et al. Elemental formula annotation of polar and lipophilic metabolites using (13) C, (15) N and (34) S isotope labelling, in combination with high-resolution mass spectrometry. Plant J. 68 (2), 364-376 (2011).
- Caldana, C., et al. Systemic analysis of inducible target of rapamycin mutants reveal a general metabolic switch controlling growth in Arabidopsis thaliana. Plant J. 73 (6), 897-909 (2013).
- Giavalisco, P., et al. Proteome analysis of Arabidopsis thaliana by two-dimensional gel electrophoresis and matrix-assisted laser desorption/ionisation-time of flight mass spectrometry. Proteomics. 5 (7), 1902-1913 (2005).
- Bradford, M. M. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding. Anal Biochem. 72, 248-254 (1976).
- Rappsilber, J., Mann, M., Ishihama, Y. Protocol for micro-purification, enrichment, pre-fractionation and storage of peptides for proteomics using StageTips. Nature protocols. 2 (8), 1896-1906 (2007).
- Spagou, K., et al. Hydrophilic interaction chromatography coupled to MS for metabonomic/metabolomic studies. J Sep Sci. 33 (6-7), 716-727 (2010).
- Hauck, O. K., et al. Uric acid accumulation in an Arabidopsis urate oxidase mutant impairs seedling establishment by blocking peroxisome maintenance. Plant Cell. 26 (7), 3090-3100 (2014).
- Avin-Wittenberg, T., et al. Global analysis of the role of autophagy in cellular metabolism and energy homeostasis in Arabidopsis seedlings under carbon starvation. Plant Cell. 27 (2), 306-322 (2015).
- Watanabe, M., et al. Comprehensive dissection of spatiotemporal metabolic shifts in primary, secondary, and lipid metabolism during developmental senescence in Arabidopsis. Plant physiol. 162 (3), 1290-1310 (2013).
- Lambers, H., et al. Proteaceae from severely phosphorus-impoverished soils extensively replace phospholipids with galactolipids and sulfolipids during leaf development to achieve a high photosynthetic phosphorus-use-efficiency. New Phytol. 196 (4), 1098-1108 (2012).
- Degenkolbe, T., et al. Differential remodeling of the lipidome during cold acclimation in natural accessions of Arabidopsis thaliana. Plant J. 70, 972-982 (2012).
- Bromke, M. A., et al. Liquid chromatography high-resolution mass spectrometry for fatty acid profiling. Plant J. 81 (3), 529-536 (2015).
- Li, N., et al. FAX1, a novel membrane protein mediating plastid fatty acid export. PLoS Biol. 13 (2), 1002053 (2015).
- Kueger, S., Steinhauser, D., Willmitzer, L., Giavalisco, P. High-resolution plant metabolomics: from mass spectral features to metabolites and from whole-cell analysis to subcellular metabolite distributions. Plant J. 70 (1), 39-50 (2012).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved