Method Article
Une méthode simple d'extraction fractionnée pour l'analyse complète des métabolites, des lipides et des protéines à partir d'un seul échantillon
Dans cet article
Résumé
Un protocole pour l'extraction complète de lipides, de métabolites et de protéines à partir de tissus biologiques en utilisant un échantillon est présenté.
Résumé
La compréhension des systèmes biologiques complexes nécessite la mesure, l'analyse et l'intégration de multiples classes composites de la cellule vivante, généralement déterminées par des mesures transcriptomiques, protéomiques, métaboliques et lipidomiques. Dans ce protocole, nous introduisons une méthode simple pour l'extraction reproductible de métabolites, de lipides et de protéines à partir de tissus biologiques en utilisant une aliquote unique par échantillon. La méthode d'extraction est basée sur un système méthyl- tert -butyléther: méthanol: eau pour le partage liquide: liquide des métabolites hydrophobes et polaires en deux phases non miscibles avec la précipitation de protéines et d'autres macromolécules sous forme de pastilles solides. Par conséquent, cette méthode fournit trois fractions différentes de composition moléculaire spécifique, qui sont totalement compatibles avec les technologies «omics» à haut débit communes telles que la chromatographie liquide (LC) ou la chromatographie en phase gazeuse (GC) associée à des spectromètres de masse. Même si la méthode était initPour l'analyse de différents échantillons de tissus végétaux, il s'est avéré être totalement compatible pour l'extraction et l'analyse d'échantillons biologiques à partir de systèmes aussi divers que les algues, les insectes et les tissus de mammifères et les cultures cellulaires.
Introduction
La biologie des systèmes, qui a émergé au milieu du siècle dernier 1 et a été avancée par l'analyse à grande échelle des ensembles de données génomiques et transcriptomiques 2 , 3 , s'est développée en une approche nouvelle et indispensable pour l'analyse de systèmes biologiques complexes 4 , 5 . L'objectif principal de la biologie des systèmes est de déchiffrer les interactions et les dépendances des composants dans les systèmes biologiques et de relier le lien entre les génotypes, leur réalisation, les transformations moléculaires et les phénotypes résultants. En conséquence, l'intégration d'ensembles de données complets, produits par les différentes approches analytiques à grande échelle, à savoir la génomique, la transcriptomie, la métabolomique, la lipidomie et la protéomique, et leur analyse de calcul est devenue une condition préalable à la description et à la compréhension des systèmes biologiques complexes.
Bas Compte tenu de l'énorme diversité chimique et de la complexité des composants biologiques dans tout système vivant, la production d'ensembles de données «omiques» vastes et complets s'appuie fortement sur la qualité de la méthode d'extraction appliquée 9 . En plus de la qualité de la méthode d'extraction, l'économie de la méthode est importante; Cela signifie qu'il serait souhaitable d'obtenir autant d'informations moléculaires à partir du plus petit nombre d'échantillons que possible. Souvent, les quantités d'échantillon peuvent être limitantes et, par conséquent, il est hautement souhaitable d'utiliser une méthode d'extraction, qui peut dériver autant de classes moléculaires à partir d'une seule extraction d'un échantillon donné. Cela signifie qu'au lieu d'utiliser plusieurs méthodes d'extraction spécialisées pour l'extraction de différentes classes composées à partir d'aliquotes d'échantillons différentes du même échantillon, on utilise un procédé d'extraction séquentiel qui fractionne les constituants moléculaires d'une aliquote unique en différentes fractions moléculaires.
_content "> La méthode courante utilisée pour ces méthodes d'extraction fractionnée est basée sur la méthode d'extraction des lipides à deux phases de Folch et al., Développée en 1957 10. Cette méthode est basée sur un partage chloroforme: méthanol / eau de métabolites polaires et hydrophobes et a été Destiné à nettoyer et à décomplexer des échantillons pour une analyse lipidique de haute qualité. Avec l'évolution de la biologie des systèmes multi-omiques, la méthode de Folch a été améliorée par étapes, en l'utilisant pour le partage d'échantillons de protéines et de métabolites et lipides polaires pour La métabolomique à base de chromatographie liquide et gazeuse et les lipidomies de composés polaires et hydrophobes, en plus de la protéomique à base de chromatographie liquide 11 , 12 , 13 , 14. Malheureusement, toutes ces méthodes dépendent d'une méthode d'extraction à base de chloroforme qui, non seulement Conduit à l'indeseDe la pastille de protéine en tant qu'interfase entre la phase polaire et la phase lipidique, mais qui est également un solvant indésirable à partir d'une perspective de chimie verte 15 , 16 . Cependant, le solvant méthyl tert -butyl éther (MTBE) surmonte ces deux problèmes précités et est un remplacement approprié pour le chloroforme. Sur la base de ces exigences, nous avons décidé d'établir une méthode d'extraction MTBE: méthanol: à base d'eau, qui remplit toutes les spécifications susmentionnées et fonctionne donc comme un point de départ idéal pour une analyse multi-omique complète 16 .Ce protocole guide l'utilisateur étape par étape grâce au flux de travail simple, rapide et reproductible de la préparation de l'échantillon, y compris le dépannage des problèmes couramment observés. De plus, nous présenterons brièvement des données analytiques exemplaires à partir de la chromatographie liquide ultra-performance - spectrométrie de masse (UPLC-MS) -basLa lipidomie, la métabolomique et la protéomique à partir des échantillons de tissus végétaux. Même si les exemples donnés sont dérivés de 50 mg d'un échantillon de tissu de feuilles d' Arabidopsis thaliana , ce protocole a été utilisé pour plusieurs autres échantillons et tissus biologiques, y compris les algues 17 , 18 , les insectes 19 et les cellules de mammifères, les organes et les tissus 20 , 21 , 22 . La portée du protocole d'extraction présenté est de fournir une description claire et détaillée de la manipulation de l'échantillon de pré-extraction et de la procédure d'extraction elle-même. Même si nous fournissons trois exemples succincts d'application analytique, des informations détaillées sur la gestion des données pré et post-analytiques peuvent être obtenues à partir de nos publications précédentes 16 , 23 , 24 , 25 , 26 .
Protocole
Attention : le méthanol (MeOH) et l' éther de méthyl tert -butyle (MTBE), utilisés pendant l'extraction, sont inflammables et peuvent avoir une exposition et / ou un contact prolongés, des irritations respiratoires, des yeux ou de la peau. Manipulez-les soigneusement uniquement dans une hotte et utilisez les procédures de sécurité appropriées pendant l'extraction (blouse de laboratoire, lunettes de sécurité, gants, etc. ). L'azote liquide et la glace sèche, utilisés dans plusieurs étapes de ce protocole, peuvent provoquer de graves brûlures par contact prolongé avec la peau. Veuillez les manipuler soigneusement en portant des gants de protection et des lunettes. Les utilisateurs peuvent utiliser différents produits chimiques, réactifs ou normes internes pour l'analyse des échantillons, dont certains peuvent être toxiques. Veuillez examiner les fiches techniques de sécurité chimique pertinentes pour tous les matériaux utilisés.
1. Collecte et récolte d'échantillons biologiques
- Préparer les tubes de récolte étiquetés.
REMARQUE: Ici, récoltez des échantillons biologiques dans des endroits étiquetés, 2 mL, à fond rond et à sécuritéK tubes de microcentrifugeuse contenant deux boules de métal de 5 mm de diamètre pour l'homogénéisateur de tissus. - Préparez un dégazage d'azote liquide.
- Récoltez l'échantillon biologique et congéluez le tissu dans de l'azote liquide. Effectuez cette étape aussi rapidement que possible en quelques secondes pour éviter les changements métaboliques induits par les blessures.
Remarque: À des fins de démonstration, utilisez des feuilles de rosette à partir de Arabidopsis thaliana (col-0) de type sauvage de 30 jours cultivées sur un sol dans des conditions prolongées. - Gardez les échantillons récoltés sur de la glace carbonique pour des pauses à court terme ou rangez-les à -80 ° C pendant de longues périodes.
2. Broyage et rupture des tissus
- Pré-refroidir les supports de tubes de l'homogénéisateur de tissus dans de l'azote liquide pendant au moins 10 min. Si un homogénéisateur de tissu n'est pas disponible, utilisez des mortiers et des pilons propres et pré-refroidis.
- Prendre les échantillons de l'azote liquide, de la glace sèche ou du congélateur à -80 ° C et les placer dans le pré-refroidiPorte-tubes.
- Placez rapidement les supports de tubes dans l'homogénéisateur de tissu.
- Broyer la matière biologique en une poudre fine et homogène. Utilisez 20 Hz pendant 1 min pour les feuilles.
Remarque; Le temps et la vitesse d'homogénéisation peuvent varier en fonction du tissu, s'assurer que l'échantillon est homogénéisé en une poudre fine et que cette poudre est maintenue congelée à chaque étape de l'homogénéisation. - Prenez les échantillons biologiques des supports des tubes et conservez-les jusqu'à une extraction supplémentaire.
3. Pesage des tissus
- Utilisez un équilibre analytique avec une précision suffisante pour les quantités d'échantillons requises.
- Préparez un tube de microcentrifugeuse à sécurité sûre de 2 mL étiqueté.
- Pré-refroidir les tubes et les spatules dans l'azote liquide.
- Aliquoter la quantité requise de poudre de tissu dans le tube de microcentrifugeuse à sécurité sûre de 2 mL.
Attention: Évitez tout dégivrage du matériau végétal en minimisant le temps nécessaireHuit échantillons. - Retourner les échantillons aliquotes immédiatement après avoir pesé sur l'azote liquide.
- Notez pour chaque échantillon le poids exact. Utiliser 10 à 50 mg ± 10% pour la plupart des tissus végétaux.
- Stockez les échantillons aliquotes à -80 ° C jusqu'à l'extraction supplémentaire.
4. Configuration du réactif
- Utiliser un mélange d'extraction d'éther méthylique de tert -butyle (MTBE) / méthanol (MeOH).
- Pour la préparation de 100 ml de solvant d'extraction, ajouter 75 ml de MTBE à 25 ml de MeOH pour obtenir un mélange de MTBE: MeOH (3: 1, vol / vol).
- Ajouter des normes internes pour la normalisation après analyse en fonction des besoins analytiques. En règle générale, ajouter 50 μL de 1,2-diheptadecanoyl- sn -glycéro-3-phosphocholine (1 mg / mL dans du chloroforme) comme étalon interne pour l'analyse des lipides à base d'UPLC-MS, tout en ajoutant 50 μL de sorbitol 13 C ( 1 mg / mL dans l'eau) en tant que normes internes pour l'analyse par GC-MS du primaireMétabolites. Les normes internes pour l'analyse des métabolites basées sur UPLC-MS sont 50 μL de corticostérone (1 mg / mL dans le methanol) et 25 μL d'ampicilline (1 mg / mL dans le methanol).
- Transférer le solvant dans une bouteille de verre propre qui a été rincée avec du mélange MTBE: MeOH.
- Conservez le mélange d'extraction pendant 1 semaine à 4 ° C.
REMARQUE: Ne pas stocker le mélange d'extraction pour des périodes plus longues pour maintenir des résultats reproductibles.
- Pour induire la séparation des phases, utiliser de l'eau (H2O) / méthanol (MeOH).
- Pour la préparation de 100 ml de H20: MeOH, ajouter 75 ml de H20 à 25 ml de MeOH pour préparer H 2 O: MeOH (3: 1, vol / vol).
- Transférer le solvant dans une bouteille de verre propre qui a été rincée avec du mélange H 2 O: MeOH. Ce solvant peut être stocké pendant plusieurs semaines à température ambiante.
5. Extraction d'échantillons
- Pré-refroidir l'extraction mIxture (MTBE: MeOH, 3: 1, vol / vol) à -20 ° C à l'aide d'un système de refroidissement liquide ou d'un congélateur de -20 ° C.
- Retirez les échantillons aliquotes un à un et ajoutez 1 ml du mélange d'extraction pré-refroidi à chaque tube d'échantillon. Attention: effectuez cette étape rapidement en raison de la faible viscosité du MTBE.
- Mélanger immédiatement sur un mélangeur à vortex jusqu'à ce que le tissu soit bien homogénéisé dans le mélange d'extraction.
NOTE: Cette étape est très importante car il faut précipiter les protéines et inactiver leurs activités enzymatiques. - Incuber tous les échantillons sur un agitateur orbital à 100 tr / min pendant 45 min à 4 ° C.
- Sonicate les échantillons pendant 15 min dans un bain de sonication glacé.
6. Fractionnement par séparation de phase
- Ajouter 650 μL de H 2 O: MeOH (3: 1, vol / vol) à chaque tube d'échantillon.
- Bien mélanger en vortex pendant 1 min.
- Centrifuger les échantillons à une vitesse de 20 000 x g pendant 5 min à 4 ° C.
REMARQUE: après cette étape, il y a deux phases liquides non miscibles avec une pastille solide dans le fond du tube.
Attention: manipuler les tubes avec précaution pour éviter le mélange des deux phases liquides et éviter de perturber la pastille précipitée.
7. Aliquote des fractions polaires et hydrophobes
- Transférer 500 μL du solvant de la phase supérieure, contenant des lipides, dans un tube de microcentrifugeuse de 1,5 mL marqué.
NOTE: Les échantillons de lipides aliquotés peuvent être directement concentrés pour une analyse UPLC-MS immédiate (étape 8.1) ou stockés pendant plusieurs semaines à -80 ° C. - Une fois que les 500 μL sont retirés de l'échantillon, éliminer la phase lipidique restante en utilisant une pipette de 200 μl.
- Transférer 400 μL du solvant de la phase inférieure (métabolites polaires et semi-polaires) dans un tube de microcentrifugeuse de 1,5 mL marqué. Les échantillons polaires aliquotés peuvent être directement concentrés pour une analyse UPLC-MS immédiate (étape 8.2) ou stockés pourPlusieurs semaines à -80 ° C.
- Prenez une aliquote supplémentaire de 200 μL pour effectuer une analyse supplémentaire, par exemple, une analyse des métabolites à base de chromatographie en phase gazeuse, telle que décrite de manière précieuse 16 .
- Retirer le reste de la phase aqueuse en pipetant le volume excédentaire.
- Laver la protéine, l'amidon et la pastille de paroi cellulaire obtenue avec 500 μL de méthanol en faisant tourner complètement pendant 1 min.
- Centrifuger les échantillons à une vitesse de 10 000 x g pendant 5 min à 4 ° C.
- Effectuer l'extraction et la digestion des protéines (étape 11) ou l'analyse de l'amidon / paroi cellulaire comme décrit précédemment 16 .
REMARQUE: Si elles ne sont pas utilisées immédiatement, ces granulés peuvent être conservés pendant plusieurs semaines à -80 ° C.
8. Concentration et stockage des fractions
- Evaporer le solvant à partir d'échantillons de lipides (à partir de l'étape 7.1) soit dans un concentrateur de vide sans chauffage (pendant 1-2 heures), soit utiliser un nitrÉvaporateur de flux d'air pour éviter les modifications oxydatives des lipides.
NOTE: Les échantillons séchés doivent être analysés immédiatement. Pour le stockage, laisser des échantillons dans une solution de MTBE, idéalement dans des flacons en verre (étape 7.1). - Evaporer le solvant des échantillons aqueux (à partir de l'étape 7.3 ou 7.4) pendant une nuit dans un concentrateur sous vide sans chauffage. REMARQUE: les échantillons séchés peuvent être conservés pendant plusieurs semaines à -80 ° C avant analyse.
9. Analyse des lipides en utilisant UPLC-MS 24
- Remettre en suspension les fractions lipidiques séchées (de la étape 8.1) dans 400 μl d'acétonitrile: 2-propanol (7: 3, vol / vol).
- Transférer suffisamment de flacons liquides dans les flacons en verre et coiffer fermement.
- Mettez les flacons en verre dans un auto-échantillonneur refroidi (4 ° C).
- Injecter 2 μl par échantillon et séparer les lipides sur une colonne de phase inversée (RP) C 8 maintenue à 60 ° C en utilisant un système UPLC fonctionnant à un débit de 400 μL / min.
- Utilisez le mobilePhases décrites dans le tableau 1 pour la séparation chromatographique.
- Acquérir les spectres de masse en mode d'ionisation positive et négative en utilisant un instrument MS approprié couvrant la plage de masse entre 150 et 1500 m / z.
10. Analyse des métabolites polaires et semi-polaires en utilisant UPLC-MS 25 .
- Remettre en suspension la phase polaire (de l'étape 8.2) dans 200 μL de méthanol UPLC: eau (1: 1, vol / vol).
- Transférer suffisamment de flacons liquides dans les flacons en verre et coiffer fermement.
- Mettez les flacons en verre dans un auto-échantillonneur refroidi (4 ° C).
- Injecter 2 μL de chaque échantillon et séparer les métabolites sur une colonne RP C 18 maintenue à 40 ° C en utilisant un système UPLC fonctionnant à un débit de 400 μL / min.
- Utilisez les phases mobiles pour la séparation chromatographique avec les paramètres donnés dans le tableau 2 .
- Acquérir des spectres de masse de numérisation complète en mode d'ionisation positive et négative nousUn spectromètre de masse approprié couvrant une plage de masse entre 50 et 1500 m / z.
11. Extraction de protéines, digestion et analyse 16
- Remettre en suspension la protéine lavée / amidon / pellet de paroi cellulaire (à partir de l'étape 7.8) dans 200 μL du tampon d'extraction de protéines de choix. Note: Nous utilisons un tampon d'urée / thiourée (urée 5 M, 2 mM de thiourée, 15 mM de DTT, 2% de CHAPS et inhibiteurs de protéase et de phosphatase) 27 .
- Sonicate les échantillons pendant 10 min dans un bain sonore refroidi par de la glace.
- Incuber les échantillons pendant 30 minutes sur un agitateur orbital (100 tr / min) à température ambiante.
- Centrifuger les protéines dissoutes à 10 000 x g pendant 5 min.
- Recueillir le surnageant de protéines dans un nouveau tube.
- Déterminer la concentration de protéines à partir du surnageant collecté 28 .
- Digérer 50 μg de protéines en solution avec un protocole de choix. En règle générale, utilisez le mélange Trypsin / Lys-CConformément au manuel d'instructions.
- Après la digestion, effectuer le dessalage des peptides avant la spectrométrie de masse à l'aide de pointes C 18 et éluer les peptides digérés 29 .
- Concentrez les échantillons à proximité de la sécheresse dans un concentrateur de vide sans chauffage.
- Remonter les échantillons dans un tampon de chargement approprié (par exemple, 5% d'acétonitrile, 0,5% d'acide formique) et analyser les mélanges peptidiques par LC-MS / MS en utilisant un spectromètre de masse à haute résolution connecté à un système nano LC.
NOTE: Dans l'ensemble de données protéomiques exemplaire présenté dans ce protocole, nous avons utilisé un gradient tel que décrit dans le Tableau 3 . - Définissez le spectromètre de masse, en utilisant une stratégie 15 supérieure, où une analyse complète (FS) a été suivie de jusqu'à 15 analyses MS / MS dépendantes des données, aux paramètres suivants: le FS était dans la plage de masse 200-2000 m / z à Une résolution de 70 000 avec une valeur cible de 3x10 6 ions. Obtenir les analyses MS / MS dépendantes des données par le niveau supérieurDissociation collisionnelle rgy (HCD). Définissez les valeurs cibles pour les ions MS / MS à 1e 5 , avec un temps maximal de remplissage d'ions de 50 ms, une fenêtre d'isolement de 4,0 m / z, une énergie de collision normalisée (NCE) de 30% et un rapport de sous-remplissage de 1%. Mesurez les ions MS / MS à une résolution 17.500 et l'exclusion dynamique a été définie à 60 s.
Résultats
Des ensembles de données multi-omiques complets sont inestimables pour la compréhension des systèmes biologiques complexes. La stratégie pour une expérience biologique réussie provient habituellement d'une conception expérimentale, d'une mise en place et d'une exécution expérimentales suivies d'une collecte, d'une extraction, d'une acquisition de données analytiques, d'un traitement des données brutes, d'une analyse statistique des données, de l'identification des métabolites et de l'interprétation biologique pertinente. Y compris la cartographie et la visualisation des voies ( Figure 1 ).
Dans le protocole d'extraction introduit ici, nous nous concentrons sur les étapes de collecte, de prise en main et d'extraction, qui sont décrites dans l'aperçu détaillé du flux de travail de la figure 2 . À des fins de démonstration, 50 mg de tissu de feuilles d'Arabidopsis ont été sélectionnés. Ce matériel a été récolté, broyé et extrait avant de le soumettre à troisDes plates-formes analytiques UPLC-MS exemplaires, fournissant des données qui peuvent être utilisées pour des analyses lipidomiques, métabolomiques et protéomiques ciblées et non ciblées. Les figures 2 et 6 comprennent en outre des images représentatives de la façon dont, dans des conditions standard, le solvant d'extraction devrait ressembler. En outre, des exemples d'échantillons contenant des quantités excessives de macromolécules précipitées (protéines et amidon) et des échantillons avec une homogénéisation inappropriée de l'échantillon sont présentés ( Figure 3 ). Le dépannage de ces deux problèmes communs est donné brièvement dans la figure 3, mais il est également discuté plus en détail dans notre publication précédente 16 .
Les figures 4 et 5 décrivent des exemples de trois chromatogrammes analytiques dérivés du lipide, du polaire / semLes metabolites i-polaires et les analyses de protéines. Les lipides, qui ont été prélevés dans la phase MTBE supérieure ( figure 2 ), ont été analysés par chromatographie liquide ultra performante en phase inversée (RP) C 8 couplée à une spectrométrie de masse à haute résolution. Les lipides peuvent être acquis en utilisant des modes d'ionisation MS positifs et négatifs ( Figure 4 , panneau supérieur) 16 , 24 .
Les métabolites primaires et secondaires polaires et semi-polaires ont été analysés à partir de la phase polaire (eau / méthanol) ( Figure 2 ) par phase inversée (RP) C 18 UPLC-MS 25 . La méthode illustrée, utilisant la chromatographie en phase inversée, est hautement compatible avec l'analyse des métabolites semi-polaires (c'est-à-dire les métabolites du métabolisme secondaire des plantes), qui peuvent être analysés en utilisant des modes d'ionisation positive et négative dans le MS( Figure 4 , volet inférieur) 16 . Des métabolites plus hydrophiles de cette fraction (sucres, acides aminés polaires, etc.), qui ne présentent pas une bonne rétention sur le matériau en phase inversée, peuvent être analysés par d'autres méthodes analytiques telles que GC-MS 16 ou chromatographie liquide à interaction hydrophile 30 .
Les protéines, qui ont été extraites de la pastille solide dans le fond du tube d'extraction ( Figure 2 ), ont été digérées et analysées en solution à l'aide d'un pistolet de tir LC-MS ( Figure 5 ), tandis que le protocole pour l'extraction de l'amidon et de la paroi cellulaire Le matériel peut être obtenu à partir de notre protocole 16 précédemment publié.
En résumé, plus de 200 espèces lipidiques, 50 métabolites semi-polaires annotés et plusieurs milliers de protéinesNs peuvent être identifiés de façon routinière à partir d'échantillons du type utilisé dans notre exemple. En outre, la méthode a montré une large applicabilité en utilisant différents tissus, organes et matériel de culture cellulaire ( figure 6 ).

Figure 1: flux de travail général pour l'analyse Omics non ciblée à grande échelle. Cliquez ici pour voir une version plus grande de ce chiffre.

Figure 2 : Préparation des échantillons et flux de travail d'extraction pour l'analyse des lipides, des métabolites et des protéines à partir d'une unique partie aliquote d'un échantillon biologique.Cliquez ici pour voir une version plus grande de ce chiffre.
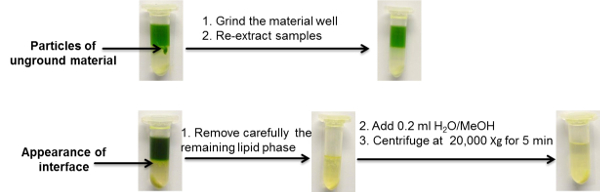
Figure 3 : Exemples illustratifs de problèmes communément observés utilisant des protocoles d'extraction par partitions en deux phases. Cliquez ici pour voir une version plus grande de ce chiffre.
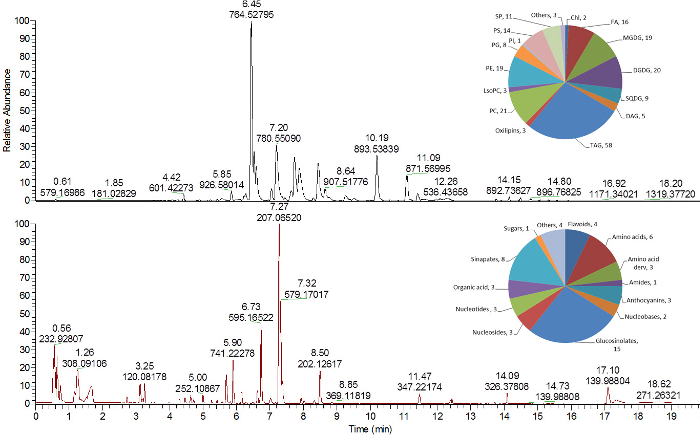
Figure 4 : Chromatogrammes représentatifs des métabolites lipidiques et semi-polaires des extraits de feuilles d' Arabidopsis thaliana . Chromatogramme de baseS des lipides (panneau supérieur) et des métabolites semi-polaires (panneau inférieur) analysés en mode d'ionisation positive 16 . Les tableaux circulaires dans le coin supérieur droit de chaque chromatogramme montrent le nombre de lipides identifiés et de métabolites affectés à différentes classes chimiques. Chl, chlorophylles; DAG, diacylglycéride; DGDG, digalactosyldiacylglycérol; FA, acide gras; LysoPC, lysophosphatidylcholine; MGDG, monogalactosyldiacylglycérol; PC, phosphatidylcholine; PE, phosphatidyléthanolamine; PG, phosphatidylglycérol; PI, phosphatidylinositol; PS, phosphatidylsérine; SP, sphingolipide; SQDG, sulfoquinovosyldiacylglycérol; TAG, triacylglycéride. Cliquez ici pour voir une version plus grande de ce chiffre.
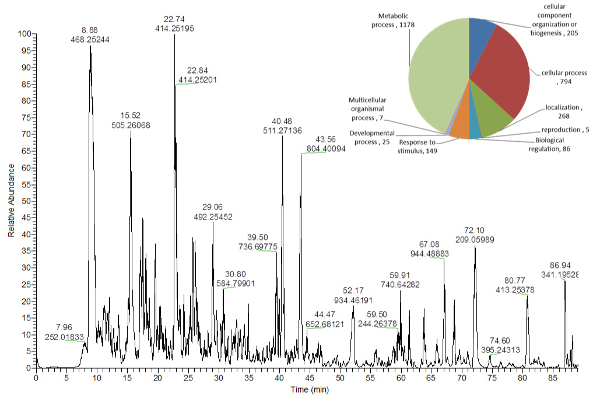
Figure 5 Trong>: Chromatogramme de Peak de Base représentatif de Peptides provenant des Extraits de Feuillets d' Arabidopsis Thaliana .
Le diagramme circulaire montre que dans le coin supérieur droit indique le nombre de protéines identifiées affectées à différents processus biologiques 16 . Cliquez ici pour voir une version plus grande de ce chiffre.

Figure 6 : Exemples d'extractions représentatives de divers types de tissus de type sauvage Arabidopsis thaliana .
Tous les échantillons ont été extraits à l'aide de 50 mg de poids frais provenant des tissus indiqués."> Cliquez ici pour voir une version plus grande de ce chiffre.
| Temps (min) | % Buffer A to Buffer B | |
| 0 à 1 min | 45% A | Tampon A: 1% d'acétate de NH4 1 M, 0,1% d'acide acétique dans l'eau de classe MSLC |
| 1 à 4 min | Gradient linéaire de 45% A à 25% A | Buffer B: 1% d'acétate de NH4 1 M, 0,1% d'acide acétique dans l'acétonitrile / isopropanol 7: 3, (v: v) |
| 4 à 12 min | Gradient linéaire de 25% A à 11% A | Débit 400 μL / min |
| 12 à 15 min | Gradient linéaire de 11% A à 0% A | Volume d'injection 2 μL |
| 15 à 19,5 min | Laver la colonne pendant 4,5 min avec 0% A | |
| 19.50 à 19.51 min | Rétablir à 45% A | |
| 19,51 à 24 min | Equilibrer avec 45% A |
Tableau 1: Paramètres de dégradé pour la séparation RP-UPLC des lipides. RP, phase inversée. UPLC, chromatographie liquide ultra-performance.
| Temps (min) | % Buffer A to Buffer B | |
| 0 à 1 min | 99% A | Buffer A: 0,1% d'acide formique dans de l'eau de qualité UPLC |
| 1 à 11 min | Gradient linéaire de 99% A à 60% A | Buffer B: 0,1% d'acide formique dans de l'acétonitrile UPLC Grad |
| 11 à 13 min | Gradient linéaire de 60% A à 30% A | Débit 4001; L / min |
| 13 à 15 min | Gradient linéaire de 30% A à 1% A | Volume d'injection 2 μL |
| 15 à 16 min | Laver la colonne pendant 1 min avec 1% A | |
| 16 à 17 min | Gradient linéaire de 1% A à 99% A | |
| 17 à 20 min | Equilibrer pendant 3 min à 99% A |
Tableau 2: Paramètres de gradient pour la séparation RP-UPLC des métabolites polaires et semi-polaires. RP, phase inversée. UPLC, chromatographie liquide ultra-performance.
| Temps (min) | % Buffer B to Buffer A | |
| 0 à 5 min | Gradient linéaire de 0 à 10% | Buffer A: 0,1% d'acide formique dans de l'eau de qualité UPLC |
| 5 à 80 min | Gradient linéaire de 10% à 40% | Buffer B: 0,1% d'acide formique dans de l'acétonitrile à 60% d'indice UPLC |
| 80 à 85 min | Gradient linéaire de 40% à 60% | Débit 300 nL / min |
| 85 à 86 min | Gradient linéaire de 60% à 95% | Volume d'injection 5 μL |
| 86 à 91 min | Colonne de lavage pendant 5 min avec 95% | |
| 91 à 92 min | Gradient linéaire de 95% à 0% | |
| 93 à 110 min | Equilibrer la colonne pendant 17 min à 0% |
Tableau 3: Paramètres de gradient pour la séparation Nano-LC des peptides. LC, chromatographie liquide.
Discussion
Dans cet article, nous décrivons et illustrons un protocole d'extraction simple et hautement applicable pour une analyse lipidomique, métabolomique et protéomique complète à partir d'un seul échantillon de feuilles de 50 mg. La méthode a été précédemment utilisée dans plusieurs études, qui ont été publiées dans divers articles 17 , 18 , 19 , 20 , 21 , 22 , 23 , 24 , 25 , 26 , 31 , 32 , 33 , 34 , 35 , 36 , 37. Et a prouvé, en plus de son droitLe flux de travail et l'applicabilité élevée pour être robustes et reproductibles.
Les applications fournies ici montrent certaines méthodes de routine pour le dépistage initial d'un échantillon biologique complexe. Ces ensembles de données métabolomiques et lipidomiques illustrés à grande échelle peuvent fournir des informations complètes sur les changements généraux ou spécifiques du métabolisme du système biologique analysé, tandis que les données obtenues à partir de l'analyse des protéines fournissent un aperçu de la quantité (abondance) et qualitative (modifications ) Changements d'enzymes, de protéines structurales ou de facteurs de transcription (TF) contrôlant les fonctions et les machines cellulaires. En conséquence, les données omiques intégratives ont le potentiel de révéler des informations initiales sur les éventuels changements induits par les perturbations génétiques ou biotiques et / ou abiotiques d'un système biologique en éluçant les changements moléculaires de diverses molécules associées à des voies métaboliques spécifiques ou à des processus cellulaires.
Bien sûr, À long terme, il est tout à fait essentiel, pour une analyse réussie de la biologie des systèmes, de maximiser le nombre d'entités moléculaires analysées et annotées, ce qui permet de surveiller les fonctions et les activités cellulaires aussi complètement que possible. A cet effet, les fractions obtenues pourraient être appliquées en plus à diverses méthodes analytiques, ciblant d'autres composés ou classes composées ( Figure 4 ).
Cela dit, il faut mentionner que la stratégie d'analyse globale des données obtenues peut être suivie par deux stratégies différentes: d'une part, nous mettons l'accent sur l'élucidation des fonctions cellulaires par quantification de composés connus. D'autre part, bon nombre des métabolites et des lipides mesurés ne sont pas encore connus ou annotés. Ceux-ci, pourtant, les mesures composées non annotées contiennent également beaucoup d'informations significatives, qui, peuvent être utilisées par des méthodes statistiques pour la classification ou la discrimination bParmi les groupes ou traitements 20 , 21 , 22 .
Néanmoins, ces composés inconnus, en particulier ceux qui sont pertinents pour la classification de groupe ou servant de biomarqueurs, doivent être identifiés. Ce processus d'identification est malheureusement assez fastidieux et ne peut être réalisé sans mesures ou stratégies analytiques supplémentaires 38 . Comme on peut le voir à partir de la figure 4 , le nombre de composés non annotés est assez élevé (en fait, la grande majorité). Néanmoins, comme mentionné ci-dessus, ces pics chromatographiques peuvent être traités dans l'analyse des données et, par conséquent, les entités affectées de manière significative peuvent être élucidées et soumises à d'autres stratégies d'identification.
En résumé, nous pouvons conclure que le protocole introduit ici offre plusieurs avantages pour la biologie des systèmes expérimentaux ainsi que pour l'application statistique classiqueTions.
Tout d'abord, étant donné que toutes les fractions sont extraites d'un seul échantillon, la variation entre les différents ensembles de données expérimentales (lipides, métabolites, protéines) est considérablement réduite puisque chaque ensemble de données provient de la même aliquote d'échantillons. Cela conduit clairement à une comparabilité accrue des résultats obtenus.
Deuxièmement, la méthode est facilement évolutive et la rend donc très compatible avec des quantités d'échantillons de petite à grande taille. Nous utilisons systématiquement 10 à 100 mg d'échantillons de tissus, mais des études lipidomiques réussies ont également été réalisées sur seulement 20 graines d'Arabidopsis 31 . En particulier, la compatibilité avec de petites quantités d'échantillons rend cette méthode applicable si des quantités limitées de tissus biologiques ou d'échantillons sont disponibles. Pourtant, même si un matériel d'échantillon suffisant est disponible, la méthode présentée ici offre l'avantage d'utiliser ces échantillons dans un plus grand nombre de répliques expérimentales au lieu de vousChantez-les pour différentes procédures d'extraction. Cela permet une meilleure et plus précise analyse statistique des données.
Troisièmement, puisque la méthode est basée sur un fractionnement liquide-liquide de molécules polaires et non polaires, elle fournit, contrairement aux méthodes simples d'extraction en phase unique ( p. Ex. Extractions au méthanol), une étape de décomplexement significative dans la procédure. Ce décomplexement efficace de l'échantillon conduit à une purification partielle des fractions individuelles en raison de la séparation des molécules interférant chimiquement l'une de l'autre. En conséquence, le processus de partitionnement chimique fournit non seulement un avantage pratique pour l'aliquote systématique des échantillons extraits en différentes classes chimiques, mais aussi améliore les mesures analytiques individuelles, puisqu'il élimine les composés contaminants des différentes fractions. De toute évidence, nous pouvons observer que, en particulier, les lipides, qui sont répartis dans la phase organique et qui affectent habituellementAnalyse chromatographique des composés polaires, sera presque complètement absente de la fraction polaire. Il en va de même pour l'analyse des lipides hydrophobes, qui seront épuisés par les composés polaires. Outre la purification de composés polaires et non polaires, nous épuisons et collectons des protéines et d'autres macro-molécules de l'échantillon, qui fournit non seulement une fraction séparée, qui peut être utilisée pour l'analyse des protéines, de l'amidon et de la paroi cellulaire 16 , mais aussi Conduit à un échantillon plus propre dans les différentes fractions. Ceci est particulièrement pertinent, car on sait que la présence de grandes macromolécules entraîne des dommages ou au moins une durée de vie plus courte des colonnes analytiques.
Enfin, la méthode d'extraction MTBE décrite, qui repose sur le solvant de remplacement de chloroforme moins dangereux et plus favorable 15 , a déjà été démontrée par plusieurs études de notre groupe, pour être largement applicableIcability pour différents échantillons biologiques des plantes 16 , des algues 17 , 18 , des mouches 19, mais aussi de plusieurs tissus, organes ou cellules de mammifères 20 , 21 , 22 .
Déclarations de divulgation
Les auteurs n'ont rien à dévoiler
Remerciements
La MS est soutenue par une bourse de doctorat complète du programme GERLS-DAAD. Nous tenons à remercier le Dr Andrew Wiszniewski pour la lecture et le commentaire du manuscrit. Nous sommes très reconnaissants à tous les membres du laboratoire Giavalisco de l'Institut Max-Planck de Molecular Plant Physiology, Golm, en Allemagne pour leur aide.
matériels
| Name | Company | Catalog Number | Comments |
| Reagents and standards | |||
| Ampicillin | Sigma Aldrich | A9393-5G | Internal standard for metabolites |
| Corticosterone | Sigma Aldrich | 27840-500MG | Internal standard for metabolites, HPLC grade |
| 13C Sorbitol | Sigma Aldrich | 605514 | Internal standard for metabolites, ISOTEC® Stable Isotopes |
| 1,2-diheptadecanoyl-sn-glycero-3-phosphocholine (17:0 PC) | Avanti Polar Lipids | 850360P | Internal standard for lipids |
| Methanol (MeOH) | Biosolve Chemicals | 13684102 | ULC-MS grade |
| Water | Biosolve Chemicals | 23214102 | ULC-MS grade |
| Methyl tert-butyl ether (MTBE) | Biosolve Chemicals | 13890602 | HPLC grade |
| Trypsin/Lys-C mix | Promega | V5072 | Enzymatic digestion of proteins |
| Equipment | |||
| Balance | Sartorius Corporation | 14 557 572 | |
| Tissue grinding mixer mill | Retsch, Mixer Mill MM 300 | 20.746.0001 | |
| Mortar and pestle | Sigma Aldrich | Z247464-1EA | |
| Vortex mixer | Vortex-Genie 2, Model G560 | SI-0236 | |
| Vacuum concentrator | Scan Speed Maxi Vac Alpha Evaporators | 7.008.500.002 | |
| 2 mL Safe-lock microcentrifuge tubes | Eppendorf | 30120094 | Used for sample extarction |
| 1.5 mL Safe-lock microcentrifuge tubes | Eppendorf | 30120086 | Used for fractions |
| Shaker | Eppendorf Thermomixer 5436 | 2050-100-05 | |
| Sonicator | USC 300 TH | 142-0084 | |
| Refrigerated microcentrifuge | Eppendorf, model 5427R | 22620701 | |
| UPLC system | Waters Acquity UPLC system (Waters, Machester, UK) | ||
| MS system | Exactive, Orbitrap-type, MS (Exactive, Thermo-Fisher, Bremen, Germany). | ||
| Reversed Phase (RP) Bridged Ethyl Hybrid (BEH) C8 column (100 mm × 2.1 mm containing 1.7 μm diameter particles) | Waters, Machester, UK | 186002878 | Analysis of lipids |
| RP High Strength Silica (HSS) T3 column (100 mm × 2.1 mm containing 1.8 μm diameter particles) | Waters, Machester, UK | 186003539 | Analysis of metabolites |
| Q ExactivePlus high resolution mass spectrometer connected to an EASY-nLC 1000 system | Thermo-Fisher, Bremen, Germany | Analysis of peptides |
Références
- Hodgkin, A. L., Huxley, A. F. A quantitative description of membrane current and its application to conduction and excitation in nerve. J Physiol. 117 (4), 500-544 (1952).
- Wang, Z., Gerstein, M., Snyder, M. RNA-Seq: a revolutionary tool for transcriptomics. Nat Rev Genet. 10 (1), 57-63 (2009).
- Yang, M. Q., et al. The emerging genomics and systems biology research lead to systems genomics studies. BMC Genomics. 15, 1 (2014).
- Sheth, B. P., Thaker, V. S. Plant systems biology: insights, advances and challenges. Planta. 240 (1), 33-54 (2014).
- Ideker, T., Galitski, T., Hood, L. A new approach to decoding life: Systems biology. Annu Rev Genom Hum G. 2, 343-372 (2001).
- Somvanshi, P. R., Venkatesh, K. V. A conceptual review on systems biology in health and diseases: from biological networks to modern therapeutics. Syst Synth Biol. 8 (1), 99-116 (2014).
- Oliver, S. G., Winson, M. K., Kell, D. B., Baganz, F. Systematic functional analysis of the yeast genome. Trends Biotechnol. 16 (9), 373-378 (1998).
- Tweeddale, H., Notley-McRobb, L., Ferenci, T. Effect of slow growth on metabolism of Escherichia coli, as revealed by global metabolite pool ("metabolome") analysis. J Bacteriol. 180 (19), 5109-5116 (1998).
- Kim, H. K., Verpoorte, R. Sample preparation for plant metabolomics. Phytochemical analysis : PCA. 21 (1), 4-13 (2010).
- Folch, J., Lees, M., Stanley, G. H. S. A Simple Method for the Isolation and Purification of Total Lipides from Animal Tissues. J Biol Chem. 226 (1), 497-509 (1957).
- Weckwerth, W., Wenzel, K., Fiehn, O. Process for the integrated extraction, identification and quantification of metabolites, proteins and RNA to reveal their co-regulation in biochemical networks. Proteomics. 4 (1), 78-83 (2004).
- Wienkoop, S., et al. Integration of metabolomic and proteomic phenotypes: analysis of data covariance dissects starch and RFO metabolism from low and high temperature compensation response in Arabidopsis thaliana. Mol Cell Proteomics. 7 (9), 1725-1736 (2008).
- Valledor, L., et al. A universal protocol for the combined isolation of metabolites, DNA, long RNAs, small RNAs, and proteins from plants and microorganisms. Plant J. 79 (1), 173-180 (2014).
- Nakayasu, E. S., et al. MPLEx: a Robust and Universal Protocol for Single-Sample Integrative Proteomic, Metabolomic, and Lipidomic Analyses. mSystems. 1 (3), (2016).
- Alfonsi, K., et al. Green chemistry tools to influence a medicinal chemistry and research chemistry based organisation. Green Chem. 10 (1), 31-36 (2008).
- Salem, M. A., Juppner, J., Bajdzienko, K., Giavalisco, P. Protocol: a fast, comprehensive and reproducible one-step extraction method for the rapid preparation of polar and semi-polar metabolites, lipids, proteins, starch and cell wall polymers from a single sample. Plant Methods. 12, 45 (2016).
- Hemme, D., et al. Systems-wide analysis of acclimation responses to long-term heat stress and recovery in the photosynthetic model organism Chlamydomonas reinhardtii. Plant Cell. 26 (11), 4270-4297 (2014).
- Sharma, D. K., et al. UPLC-MS analysis of Chlamydomonas reinhardtii and Scenedesmus obliquus lipid extracts and their possible metabolic roles. J Appl Phycol. 27 (3), 1149-1159 (2015).
- Delgado, R., Munoz, Y., Pena-Cortes, H., Giavalisco, P., Bacigalupo, J. Diacylglycerol activates the light-dependent channel TRP in the photosensitive microvilli of Drosophila melanogaster photoreceptors. J Neurosci. 34 (19), 6679-6686 (2014).
- Bozek, K., et al. Organization and evolution of brain lipidome revealed by large-scale analysis of human, chimpanzee, macaque, and mouse tissues. Neuron. 85 (4), 695-702 (2015).
- Khrameeva, E. E., et al. Neanderthal ancestry drives evolution of lipid catabolism in contemporary Europeans. Nat Commun. 5, 3584 (2014).
- Bozek, K., et al. Exceptional evolutionary divergence of human muscle and brain metabolomes parallels human cognitive and physical uniqueness. PLoS Biol. 12 (5), 1001871 (2014).
- Krueger, S., Steinhauser, D., Lisec, J., Giavalisco, P. Analysis of subcellular metabolite distributions within Arabidopsis thaliana leaf tissue: a primer for subcellular metabolomics. Methods Mol Biol. 1062, 575-596 (2014).
- Hummel, J., et al. Ultra performance liquid chromatography and high resolution mass spectrometry for the analysis of plant lipids. FrontPlant Sci. 2, 54 (2011).
- Giavalisco, P., et al. Elemental formula annotation of polar and lipophilic metabolites using (13) C, (15) N and (34) S isotope labelling, in combination with high-resolution mass spectrometry. Plant J. 68 (2), 364-376 (2011).
- Caldana, C., et al. Systemic analysis of inducible target of rapamycin mutants reveal a general metabolic switch controlling growth in Arabidopsis thaliana. Plant J. 73 (6), 897-909 (2013).
- Giavalisco, P., et al. Proteome analysis of Arabidopsis thaliana by two-dimensional gel electrophoresis and matrix-assisted laser desorption/ionisation-time of flight mass spectrometry. Proteomics. 5 (7), 1902-1913 (2005).
- Bradford, M. M. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding. Anal Biochem. 72, 248-254 (1976).
- Rappsilber, J., Mann, M., Ishihama, Y. Protocol for micro-purification, enrichment, pre-fractionation and storage of peptides for proteomics using StageTips. Nature protocols. 2 (8), 1896-1906 (2007).
- Spagou, K., et al. Hydrophilic interaction chromatography coupled to MS for metabonomic/metabolomic studies. J Sep Sci. 33 (6-7), 716-727 (2010).
- Hauck, O. K., et al. Uric acid accumulation in an Arabidopsis urate oxidase mutant impairs seedling establishment by blocking peroxisome maintenance. Plant Cell. 26 (7), 3090-3100 (2014).
- Avin-Wittenberg, T., et al. Global analysis of the role of autophagy in cellular metabolism and energy homeostasis in Arabidopsis seedlings under carbon starvation. Plant Cell. 27 (2), 306-322 (2015).
- Watanabe, M., et al. Comprehensive dissection of spatiotemporal metabolic shifts in primary, secondary, and lipid metabolism during developmental senescence in Arabidopsis. Plant physiol. 162 (3), 1290-1310 (2013).
- Lambers, H., et al. Proteaceae from severely phosphorus-impoverished soils extensively replace phospholipids with galactolipids and sulfolipids during leaf development to achieve a high photosynthetic phosphorus-use-efficiency. New Phytol. 196 (4), 1098-1108 (2012).
- Degenkolbe, T., et al. Differential remodeling of the lipidome during cold acclimation in natural accessions of Arabidopsis thaliana. Plant J. 70, 972-982 (2012).
- Bromke, M. A., et al. Liquid chromatography high-resolution mass spectrometry for fatty acid profiling. Plant J. 81 (3), 529-536 (2015).
- Li, N., et al. FAX1, a novel membrane protein mediating plastid fatty acid export. PLoS Biol. 13 (2), 1002053 (2015).
- Kueger, S., Steinhauser, D., Willmitzer, L., Giavalisco, P. High-resolution plant metabolomics: from mass spectral features to metabolites and from whole-cell analysis to subcellular metabolite distributions. Plant J. 70 (1), 39-50 (2012).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon