需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
用于丙烷脱氢的负载型Pt-Cu固溶体纳米粒子催化剂的合成与测试
摘要
这里报道了合成2nm负载的双金属纳米颗粒Pt-Cu催化剂用于丙烷脱氢的方便方法。 原位同步加速器X射线技术允许确定催化剂结构,这通常使用实验室仪器无法获得。
摘要
这里证明了合成双金属Pt-Cu催化剂的方便方法和丙烷脱氢和表征的性能测试。该催化剂形成一个取代的固溶体结构,其粒径约为2nm左右。这通过仔细控制催化剂制备过程中的浸渍,煅烧和还原步骤而实现,并通过先进的原位同步加速技术进行鉴定。催化剂丙烷脱氢性能随着Cu:Pt原子比的增加而不断提高。
引言
丙烷脱氢(PDH)是生产丙烯的关键加工步骤,利用页岩气,国内增长最快的天然气来源1 。该反应在丙烷分子中断裂两个CH键以形成一个丙烯和分子氢。贵金属催化剂,包括Pd纳米颗粒,对PDH的选择性差,破坏CC键以产生高产率的甲烷,随之产生焦炭,导致催化剂失活。最近的报告表明,选择性PDH催化剂可以通过加入像Zn或在与Pd 2,3,4的启动子来获得。促进的催化剂对PDH的选择性接近100%,而相同尺寸的单金属Pd纳米颗粒的催化剂相对于小于50%。选择性的巨大改善归因于PdZn或PdIn金属间化合物的形成(IMC)结构。 IMC中两种不同类型的原子的有序阵列用非催化的Zn或In原子几何地分离Pd活性位点,这导致由相邻Pd活性位点的整体(组)催化的副反应。
铂在丙烷脱氢贵金属中的固有选择性最高,但商业用途仍然不令人满意1 。典型地,锡,锌,在,或Ga被添加作为启动子的Pt 5,6,7,8,9,10,11,12,13。基于几何活性位置隔离有助于高选择性的想法,任何形成合金的非催化元素与Pt结合,如Cu,也应潜在地促进催化剂性能14 。一些以前的研究表明,添加铜的确实提高了Pt的PDH选择性催化剂15,16,17,18。然而,没有报道直接证据来确定Pt和Cu是否形成双金属纳米颗粒或有序结构,这对于理解Cu的促进作用至关重要。在Pt的Cu的二元相图,两个不同的结构类型是可能在很宽的组成范围内16,18:金属间化合物,其中Pt和铜各自占据特定的结晶位点,和固溶体,其中铜在随机代铂格。 IMCs在低温下形成,并在大约600-800℃下转变成固溶体,用于散装材料 14。在PDH的反应温度( 即 550℃)附近,纳米颗粒的转变温度可能较低。因此,必须在反应条件下研究Pt-Cu的原子顺序。对于具有小的颗粒尺寸的纳米颗粒的支持,这是非常具有挑战性的,以获得使用实验室仪器19有意义的结构信息。单元电池的有限重复导致非常宽的衍射峰,具有非常低的强度。由于在空气中被氧化的纳米粒子1-3nm的表面原子的高分数,必须使用通常用同步加速技术的高通量X射线原位收集衍射。
先前报道的Pt-Cu系催化剂PDH均大于5nm的尺寸15,16,17,18。然而,对于贵金属纳米颗粒催化剂,总是有强烈的愿望,通过合成催化剂具有高分散体(通常大约或尺寸小于2nm)19以最大化每单位成本的催化活性。尽管通过标准浸渍方法可以制备这种尺寸的双金属纳米颗粒,但是合理控制方法是必要的。需要控制金属前体,浸渍溶液的pH和支持体,以优化金属物质在高表面积载体上的锚定。还应仔细控制随后的煅烧和还原热处理以抑制金属纳米颗粒的生长。
本文介绍了合成支持的2 nm Pt-Cu双金属纳米粒子催化剂和丙烷脱氢性能测试的方案。通过扫描T研究催化剂的结构传输电子显微镜(STEM), 原位同步加速器X射线吸收光谱(XAS)和原位同步加速器X射线衍射(XRD),有助于阐明引入Cu时催化剂性能的改善。
研究方案
负载型2nm Pt-Cu双金属纳米粒子催化剂的合成
- 金属前体溶液的制备
- 将0.125g硝酸铜三水合物(Cu(NO 3 ) 2 ·3H 2 O)溶解在1mL水中以获得天蓝色溶液。
注意:处理化学品时请使用防护手套。 - 将氨滴加到硝酸铜溶液中,形成深蓝色的氢氧化铜沉淀。
注意:使用通风橱处理碱和挥发性化学物质。 - 继续加入氨,直到深蓝色沉淀物溶解形成深蓝色溶液,pH> 10。
- 向溶液中加入0.198g硝酸四氨基铵((NH 3 ) 4 Pt(NO 3 ) 2 )和另外的水,使溶液的总体积为3.5mL。如果需要添加额外的氨,以保持溶液的pH值大于10。
- 将溶液加热至70℃,直到所有的四氨基十六烷基硝酸盐溶解在溶液中。让溶液冷却至室温。
- 将0.125g硝酸铜三水合物(Cu(NO 3 ) 2 ·3H 2 O)溶解在1mL水中以获得天蓝色溶液。
- 共浸渍金属前体溶液
- 在催化剂制备之前,确定二氧化硅载体的浸渍孔体积。小心地将约5g干二氧化硅称重到加重盘中。混合时,滴加H 2 O直到二氧化硅完全湿润,但没有过量溶液。重刷湿二氧化硅。将加入的克的克数除以样品的克数以计算孔体积。
- 在陶瓷蒸发皿中一次将溶解的金属前体溶液几滴加入到5g高孔二氧化硅(SiO 2 )中,并轻轻搅拌以分散粘附在一起的颗粒以实现溶液的均匀分布。
注意:一旦吸收了所有3.5 mL的金属前体溶液,白色二氧化硅就会变成深蓝色ñ。- 确保二氧化硅颗粒的质地保持与干砂的质地相同。避免在浸渍过程中过量溶液的积聚。
- 将浸渍的Pt-0.7Cu / SiO 2催化剂前体放入干燥炉中,并以125°CO / N干燥。
- 煅烧和还原
- 在250℃的炉中以5℃/ min的升温速率在空气中煅烧催化剂3小时。
注意:在较高温度下煅烧通常会导致较大的Pt纳米颗粒。 - 在1"石英管反应器的中间放置2厘米的石英棉层,并通过塑料漏斗将煅烧后的Pt-0.7Cu / SiO 2催化剂装入管中,将管放置在蛤壳温度程序化的炉中。
- 在室温下用N 2吹洗管5分钟后,以与N 2 (100ccm)相同的流速开始流动H 2 (室温),以将Pt-0.7Cu /SiO 2催化剂。
- 以5℃/ min的升温速率将温度升至150℃并保持5分钟。
- 以2.5°C / min的速度缓慢升温至250°C。每25°C保持15分钟。
注意:其他金属可能需要较低或更高的还原温度。通常可以通过检查Pt-Cu的催化剂的颜色变化( 例如,从蓝色到黑色)确定确切的温度。 - 以10℃/ min的速度倾斜至550℃(或反应温度,如果较高),并停留30分钟以完成还原。用N 2吹扫并冷却至室温。
- 卸载Pt-0.7Cu / SiO2催化剂并储存在小瓶中以备将来使用。
注意:使用不同量的Cu(NO 3 ) 2 ·3H 2 O和(NH 3 ) 4 Pt(NO 3 ) 2重复类似的合成程序以制备另一种Pt-X Cu / SiO 2
- 在250℃的炉中以5℃/ min的升温速率在空气中煅烧催化剂3小时。
丙烷脱氢性能试验
- 催化剂装载
- 取3/8"石英管反应器,将1厘米的石英棉层放在中间的凹坑处。
注意:处理石英棉时请使用防护手套,因为细针可以嵌入皮肤。 - 称取40mg Pt-0.7Cu / SiO 2催化剂和960mg二氧化硅用于稀释。将颗粒(总重量为1g)混合在空的小瓶中。
- 使用塑料漏斗将所有催化剂混合物装入反应管。用无毛巾擦拭两个管端的外壁,以清除任何污垢,以便与O型圈保持良好的密封。
- 将管接头插入石英反应管的两端,并将其连接到装有蛤壳式炉的反应器系统中。
<泄漏试验和催化剂预处理 - 取3/8"石英管反应器,将1厘米的石英棉层放在中间的凹坑处。
- 打开通过管式反应器的50 cm 3 / min N 2流量。 1分钟后,关闭反应器出口上的球阀。等待系统压力增加到5 psig。关闭入口N 2线上的球阀,以停止N 2流动并密封反应堆系统。
- 等待1分钟,记录从量规读取的压力。如果压力下降,打开反应器出口上的球阀以释放压力并重新连接配件。如果没有,首先打开反应器出口上的球阀,以通过打开入口N 2管线上的球阀来重新启动N 2流,释放压力,以清洗系统1分钟。
- 在运行反应之前开始流动50cm 3 / min的5%H 2 / N 2用于催化剂还原并停止N 2流。开始将管加热至550℃的反应温度食用10°C / min。炉子达到设定点30分钟后,使系统温度稳定在目标温度。
- 丙烷脱氢反应试验
- 启动反应器系统中的气相色谱仪(GC),并选择适当的气体成分分析方法。
- 将反应堆气流切换到旁路管路。流量为100cm 3 / min的5%丙烷/ N 2和100cm 3 / min的5%H 2 / N 2 。等待1分钟,使丙烷流量稳定并将旁路流注入GC作为参考样品。
- 将气流切换回反应管管线,开始反应并记录时间。
- 反应进行4分钟后,将反应器出口气体流(GC样品)注入GC以获得出口气体成分信息。每4分钟注入样品,运行测试直到转换达到稳定状态 te或转换非常低。
- 使用相应的峰分析软件分析每个峰。
- 单击以选择峰的起点和终点。使用积分功能获得峰值区域。记下丙烷(C 3 H 8 )反应物的峰面积;丙烯(C 3 H 6 )产物;和副产物甲烷(CH 4 ),乙烷(C 2 H 4 )和乙烯(C 2 H 6 )。
注意:对于每次注射,获得具有多个峰的GC模式,其面积与不同气体种类的摩尔数相关。
- 单击以选择峰的起点和终点。使用积分功能获得峰值区域。记下丙烷(C 3 H 8 )反应物的峰面积;丙烯(C 3 H 6 )产物;和副产物甲烷(CH 4 ),乙烷(C 2 H 4 )和乙烯(C 2 H 6 )。
- 使用响应因子将峰面积转换为每个物种的摩尔数。根据下列公式确定每个样品的丙烷转化率和丙烯选择性:
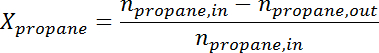
ad / 56040 / 56040eq2.jpg"/>
哪里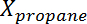 是丙烷的转化,
是丙烷的转化, 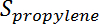 是丙烯选择性,
是丙烯选择性, 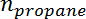 是丙烷的摩尔数,
是丙烷的摩尔数, 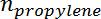 是丙烯的摩尔数。
是丙烯的摩尔数。 - 通过使用指数拟合外推推测测量的转化率和选择性对时间上的时间,获得t = 0时的初始转化率和选择性值。
- 启动反应器系统中的气相色谱仪(GC),并选择适当的气体成分分析方法。
- 后反应
- 关闭温度程序停止加热反应堆。将气体流量切换到10厘米3 /分钟N 2 。
- 将气相色谱仪切换回待机方式,以降低载气的流量。
- 冷却后从石英固定床反应器中取出所用的催化剂室内温度。在指定的废物处理区域收集催化剂重量。
3.催化剂样品的表征
- 扫描透射电子显微镜 4,20
- 将催化剂装入研钵中,并用研杵将其研磨成小于100目的粉末。
- 将约30mg催化剂粉末分散在小瓶中的约5mL异丙醇中。摇动小瓶完全混合,然后让小瓶放置5分钟以使沉积较大的颗粒。
注意:所得悬浮液应包含非常小的负载催化剂颗粒。 - 将Au TEM准备好的栅格放置在蒸发皿上。将盘子加热至80°C。将三滴催化剂悬浮液加入电网。
注意:异丙醇会迅速蒸发,并将催化剂颗粒留在其上电网。 - 将网格加载到样品架上进行电子显微镜样品成像。
- 原位 X射线吸收光谱 3,4,19,20
- 将催化剂装入砂浆中,并用研杵将其研磨成小于100目的粉末。将细粉末装入模具组并用手指按压以形成自支撑晶片。
- 将〜100毫克样品装入样品架。
- 将样品架置于石英管反应器中,并以50 cm 3 / min 3%H 2 / He进行减压,对样品进行预处理。
- 冷却至室温后,密封管并将其转移到同步加速器束线以收集XAS数据。
- 原位 X射线衍射 19,20
- 罗将催化剂加入砂浆中,并用研杵将其研磨成小于100目的粉末。
- 使用标准7 mm直径的模具压制薄片。
注意:模具包含一个女性件和顶部和底部男性件。- 将底部阳件连接到女性部件。将样品装载到底部的抛光表面上。将顶部的阳件连接并将模具转移到压机的样品台上。按适当的力量按压。
- 卸载晶片并将其转移到专用样品台的陶瓷杯中(参见材料表 )。密封舞台,并将其固定在束线上的样品台上。
- 通过流动并将温度升高到550℃来减少样品。在550℃下冷却至RT 20后,在3%H 2 / He气流下收集原位 X射线衍射数据。
结果
在初始丙烷转化率下测量的Pt和Pt-Cu催化剂的丙烯选择性对时间约为20%, 如图1A所示 。 Pt催化剂具有61%的初始选择性,随着催化剂失活1小时,随着时间的推移,其增加到约82%。 Pt-0.7Cu催化剂显示72%的较好的初始丙烯选择性。对于Pt-2.3Cu和Pt-7.3Cu催化剂,其初始选择性分别达到90%和96%,并保持反应时间。 图1B显示Pt和Pt-7.3C...
讨论
本工作中制备的Pt-Cu催化剂包含大小为2nm的均匀纳米颗粒,类似于符合工业应用的非均相催化剂。与分离的单金属颗粒相反,所有Pt和Cu前体形成双金属结构。这种双金属相互作用和小粒径通过对合成方法的仔细控制来实现。浸渍过程利用金属离子与某些氧化物载体21的表面之间的强静电吸附(SEA)。氧化物材料如二氧化硅在表面具有羟基,其可以根据pH在溶液中被质子化或去质子...
披露声明
作者没有什么可以披露的。
致谢
这项工作得到了普渡大学化学工程学院的支持。先进光子源的使用得到了美国能源部基础能源科学办公室的支持。 DE-AC02-06CH11357。 MRCAT业务,beamline 10-BM由能源部和MRCAT成员机构支持。作者还承认使用beamline 11-ID-C。我们感谢Evan Wegener对XAS的实验帮助。
材料
| Name | Company | Catalog Number | Comments |
| 1 inch quartz tube reactor | Quartz Scientific | Processed by glass blower | |
| drying oven | Fisher Scientific | ||
| calcination Furnace | Thermo Sciencfic | ||
| clam-shell temperature programmed furnace | Applied Test System | Custom made | |
| propane dehydorgenation performance evaluation system | Homemade | ||
| gas chromatography | Hewlett-Packard | Model 7890 | |
| TEM grid | TedPella | 01824G | |
| pellet press | International Crystal Lab | 0012-8211 | |
| die set | International Crystal Lab | 0012-189 | |
| Linkam Sample Stage | Linkam Scientific | Model TS1500 | |
| copper nitrate trihydrgate | Sigma Aldrich | 61197 | |
| tetraammineplatinum nitrate | Sigma Aldrich | 278726 | |
| ammonia | Sigma Aldrich | 294993 | |
| silica | Sigma Aldrich | 236802 | |
| isopropyl alcohol | Sigma Aldrich | ||
| balance | Denver Instrument Company | A-160 | |
| spatulas | VWR | ||
| ceramic and glass evaporating dishes, beakers | VWR | ||
| heating plate | |||
| kimwipe papers | |||
| mortar and pestle | |||
| quartz wool | |||
| Swagelok tube fittings |
参考文献
- Sattler, J. J., Ruiz-Martinez, J., Santillan-Jimenez, E., Weckhuysen, B. M. Catalytic dehydrogenation of light alkanes on metals and metal oxides. Chem. Rev. 114 (20), 10613-10653 (2014).
- Childers, D. J., et al. Modifying structure-sensitive reactions by addition of Zn to Pd. J Catal. 318, 75-84 (2014).
- Gallagher, J. R., et al. Structural evolution of an intermetallic Pd-Zn catalyst selective for propane dehydrogenation. Phys. Chem. Chem. Phys. 17, 28144-28153 (2015).
- Wu, Z., et al. Pd-In intermetallic alloy nanoparticles: highly selective ethane dehydrogenation catalysts. Catal Sci Technol. 6 (18), 6965-6976 (2016).
- Siddiqi, G., Sun, P., Galvita, V., Bell, A. T. Catalyst performance of novel Pt/Mg (Ga)(Al) O catalysts for alkane dehydrogenation. J Catal. 274 (2), 200-206 (2010).
- Passos, F. B., Aranda, D. A., Schmal, M. Characterization and catalytic activity of bimetallic Pt-In/Al 2 O 3 and Pt-Sn/Al 2 O 3 catalysts. J Catal. 178 (2), 478-488 (1998).
- Virnovskaia, A., Morandi, S., Rytter, E., Ghiotti, G., Olsbye, U. Characterization of Pt, Sn/Mg (Al) O catalysts for light alkane dehydrogenation by FT-IR spectroscopy and catalytic measurements. J Phys Chem C. 111 (40), 14732-14742 (2007).
- Jablonski, E., Castro, A., Scelza, O., De Miguel, S. Effect of Ga addition to Pt/Al 2 O 3 on the activity, selectivity and deactivation in the propane dehydrogenation. Appl Catal A. 183 (1), 189-198 (1999).
- Galvita, V., Siddiqi, G., Sun, P., Bell, A. T. Ethane dehydrogenation on Pt/Mg (Al) O and PtSn/Mg (Al) O catalysts. J Catal. 271 (2), 209-219 (2010).
- Shen, J., Hill, J. M., Watwe, R. M., Spiewak, B. E., Dumesic, J. A. Microcalorimetric, infrared spectroscopic, and DFT studies of ethylene adsorption on Pt/SiO2 and Pt-Sn/SiO2 catalysts. J Phys Chem B. 103 (19), 3923-3934 (1999).
- Silvestre-Albero, J., et al. Microcalorimetric, reaction kinetics and DFT studies of Pt–Zn/X-zeolite for isobutane dehydrogenation. Catal Lett. 74 (1-2), 17-25 (2001).
- Sun, P., Siddiqi, G., Vining, W. C., Chi, M., Bell, A. T. Novel Pt/Mg (In)(Al) O catalysts for ethane and propane dehydrogenation. J Catal. 282 (1), 165-174 (2011).
- Sun, P., Siddiqi, G., Chi, M., Bell, A. T. Synthesis and characterization of a new catalyst Pt/Mg (Ga)(Al) O for alkane dehydrogenation. J Catal. 274 (2), 192-199 (2010).
- Okamoto, H. . Phase diagrams for binary alloys. Desk handbook. , (2000).
- Hamid, S. B. D. -. A., Lambert, D., Derouane, E. G. Dehydroisomerisation of n-butane over (Pt, Cu)/H-TON catalysts. Catal Today. 63 (2), 237-247 (2000).
- Veldurthi, S., Shin, C. -. H., Joo, O. -. S., Jung, K. -. D. Promotional effects of Cu on Pt/Al 2 O 3 and Pd/Al 2 O 3 catalysts during n-butane dehydrogenation. Catal Today. 185 (1), 88-93 (2012).
- Han, Z., et al. Propane dehydrogenation over Pt-Cu bimetallic catalysts: the nature of coke deposition and the role of copper. Nanoscale. 6 (17), 10000-10008 (2014).
- Komatsu, T., Tamura, A. Pt 3 Co and PtCu intermetallic compounds: promising catalysts for preferential oxidation of CO in excess hydrogen. J Catal. 258 (2), 306-314 (2008).
- Gallagher, J. R., et al. In situ diffraction of highly dispersed supported platinum nanoparticles. Catal Sci Technol. 4 (9), 3053-3063 (2014).
- Ma, Z., Wu, Z., Miller, J. T. Effect of Cu content on the bimetallic Pt-Cu catalysts for propane dehydrogenation. Catal Struct React. 3 (1-2), 43-53 (2017).
- Richards, R. . Surface and nanomolecular catalysis. , (2006).
- Jiao, L., Regalbuto, J. R. The synthesis of highly dispersed noble and base metals on silica via strong electrostatic adsorption: I. Amorphous silica. J Catal. 260 (2), 329-341 (2008).
- Miller, J. T., Schreier, M., Kropf, A. J., Regalbuto, J. R. A fundamental study of platinum tetraammine impregnation of silica: 2. The effect of method of preparation, loading, and calcination temperature on (reduced) particle size. J Catal. 225 (1), 203-212 (2004).
- Wei, H., et al. Selective hydrogenation of acrolein on supported silver catalysts: A kinetics study of particle size effects. J Catal. 298, 18-26 (2013).
- Ertl, G., Knözinger, H., Schüth, F., Weitkamp, J. . Handbook of heterogeneous catalysis: 8 volumes. , (2008).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。