Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
Síntesis y Prueba de Catalizadores de Nanopartículas de Solución Sólida Pt-Cu Soportadas para la Deshidrogenación de Propano
En este artículo
Resumen
En este documento se describe un método conveniente para la síntesis de catalizadores de Pt-Cu de nanopartículas bimetálicas soportadas de 2 nm para la deshidrogenación de propano. Las técnicas de rayos X de sincrotrón in situ permiten la determinación de la estructura del catalizador, que normalmente no se puede obtener utilizando instrumentos de laboratorio.
Resumen
Un método conveniente para la síntesis de catalizadores de Pt-Cu bimetálicos y pruebas de rendimiento para la deshidrogenación y caracterización de propano se demuestra aquí. El catalizador forma una estructura de solución sólida sustitutiva, con un tamaño de partícula pequeño y uniforme alrededor de 2 nm. Esto se realiza mediante un control cuidadoso de las etapas de impregnación, calcinación y reducción durante la preparación del catalizador y se identifica mediante técnicas avanzadas de sincrotrón in situ . El desempeño del catalizador de deshidrogenación de propano mejora continuamente con el aumento de la relación atómica Cu: Pt.
Introducción
La deshidrogenación del propano (PDH) es una etapa clave de procesamiento en la producción de propileno, aprovechando el gas de esquisto, la fuente de mayor crecimiento de gas en el país 1 . Esta reacción rompe dos enlaces CH en una molécula de propano para formar un propileno y hidrógeno molecular. Los catalizadores metálicos nobles, incluidas las nanopartículas de Pd, presentan una selectividad pobre para la PDH, rompiendo el enlace CC para producir metano con un alto rendimiento, con la producción concomitante de coque, dando lugar a la desactivación del catalizador. Informes recientes mostraron que los catalizadores de PDH selectivos podrían ser obtenidos por la adición de promotores como Zn o In a Pd 2, 3, 4. Los catalizadores promovidos son casi 100% selectivos para PDH, en oposición a menos del 50% para nanopartículas de Pd monometálicas del mismo tamaño. La gran mejora en la selectividad se atribuyó a la formación de PdZn o PdIn compuesto intermetálico(IMC) sobre la superficie del catalizador. La matriz ordenada de dos tipos diferentes de átomos en los IMCs aisló geométricamente los sitios activos de Pd con átomos de Zn o In no catalíticos, que desactivaron las reacciones secundarias catalizadas por un conjunto (grupo) de sitios activos de Pd vecinos.
El platino tiene la más alta selectividad intrínseca entre los metales nobles para la deshidrogenación del propano, pero todavía no es satisfactoria para el uso comercial 1 . Típicamente, se añade Sn, Zn, In, Ga o como promotor para Pt 5, 6, 7, 8, 9, 10, 11, 12, 13. Basándose en la idea de que el aislamiento geométrico del sitio activo contribuye a una alta selectividad, cualquier elemento no catalítico que forma una aleaciónTructura con Pt, como Cu, también potencialmente promover el rendimiento del catalizador [ 14] . Varios estudios anteriores sugirieron que la adición de Cu de hecho mejoró la selectividad de PDH de los catalizadores Pt 15 , 16 , 17 , 18 . Sin embargo, no se ha reportado evidencia directa para determinar si Pt y Cu forman nanopartículas bimetálicas o estructuras ordenadas, lo cual es crucial para entender el efecto promocional de Cu. En el diagrama de fases binario de Pt-Cu, son posibles dos tipos de estructura diferentes en un amplio rango de composición 16 , 18 : compuesto intermetálico, en el que Pt y Cu ocupan cada uno sitios cristalinos específicos y solución sólida, en la que Cu se sustituye aleatoriamente en el Red de Pt. Los IMC se forman a baja temperatura y se transforman en una solución sólida a unos 600 - 800 ° C para materiales a granel 14. Esta temperatura de transformación puede ser menor para nanopartículas, cerca de la temperatura de reacción de PDH ( es decir, 550ºC). Por lo tanto, es esencial para investigar el orden atómico de Pt-Cu en condiciones de reacción. Para nanopartículas soportadas con tamaños de partícula pequeños, es muy difícil obtener información estructural significativa utilizando instrumentos de laboratorio 19 . La repetición limitada de células unitarias conduce a picos de difracción muy amplios con intensidades muy bajas. Debido a la alta fracción de átomos de superficie en nanopartículas de 1 - 3 nm de tamaño, que se oxidan en el aire, la difracción debe ser recolectada in situ utilizando rayos X de alto flujo, típicamente disponible con técnicas de sincrotrón.
Los catalizadores de Pt-Cu PDH anteriormente descritos eran todos mayores de 5 nm en tamaño 15 , 16 , 17 , 18. Sin embargo, para los catalizadores de nanopartículas de metales nobles, existe siempre un fuerte deseo de maximizar la actividad catalítica por coste unitario al sintetizar catalizadores con dispersiones altas (típicamente alrededor de o de menos de 2 nm de tamaño) 19 . Aunque la preparación de nanopartículas bimetálicas de este tamaño es posible por métodos de impregnación estándar, es necesario un control racional de los procedimientos. Es necesario controlar los precursores metálicos, el pH de la solución de impregnación y el tipo de soporte para optimizar el anclaje de las especies metálicas sobre soportes de gran superficie. Los tratamientos térmicos de calcinación y reducción posteriores también deben ser cuidadosamente controlados para suprimir el crecimiento de las nanopartículas metálicas.
Este artículo cubre el protocolo para la síntesis de catalizadores de nanopartículas bimetálicas de Pt-Cu de 2 nm soportados y para la prueba de su rendimiento de deshidrogenación de propano. La estructura de los catalizadores es investigada por Scanning T(STEM), la Espectroscopia de Absorción de Rayos X de sincrotrón in situ (XAS) y la difracción de rayos X de sincrotrón in situ (XRD), que ayudan a dilucidar el rendimiento mejorado del catalizador con la introducción de Cu.
Protocolo
1. Síntesis de Catalizadores de Nanopartículas Bimetálicas de Pt-Cu Soportados de 2 nm
- Preparación de una solución de precursor de metal
- Disolver 0,125 g de trihidrato de nitrato de cobre (Cu (NO3) 2 · 3H 2 O) en 1 ml de agua para lograr una solución de color azul cielo.
Precaución: Utilice guantes de protección cuando manipule productos químicos. - Añadir amoníaco gota a gota a la solución de nitrato de cobre, formando precipitados azul oscuro de hidróxido de cobre.
Precaución: Utilice una campana para manipular bases y productos químicos volátiles. - Seguir añadiendo amoníaco hasta que los precipitados azul oscuro se disuelvan para formar una solución de color azul oscuro y el pH> 10.
- Añadir 0,198 g de nitrato de tetraammineplatinum ((NH 3) 4 Pt (NO3) 2) a la solución y el agua adicional de manera que el volumen total de la solución es 3,5 mL. Agregue amoníaco adicional si es necesario para mantener el pH de la solución mayor que 10.
- Calentar la solución a 70 ° C hasta que todas las sales de nitrato de tetraaminaplatino se disuelvan en la solución. Dejar enfriar la solución a RT.
- Disolver 0,125 g de trihidrato de nitrato de cobre (Cu (NO3) 2 · 3H 2 O) en 1 ml de agua para lograr una solución de color azul cielo.
- Co-impregnación de una solución de precursor de metal
- Antes de la preparación del catalizador, determine el volumen de poro de impregnación del soporte de sílice. Pesar cuidadosamente aproximadamente 5 g de sílice seca en un plato de pesaje. Mientras se mezcla, añadir H 2 O gota a gota hasta que la sílice está completamente mojado, pero sin exceso de solución. Volver a pesar la sílice húmeda. Dividir los gramos de agua añadida por los gramos de muestra para calcular el volumen de poro.
- Añadir la solución de precursor de metal disuelto unas gotas a la vez para 5 g de sílice de alta poroso (SiO 2) en una cápsula de evaporación de cerámica y se agita suavemente para romper las partículas que se pegan juntos para lograr una distribución homogénea de la solución.
NOTA: La sílice blanca se volverá azul oscuro una vez que se adsorben todos los 3,5 mL de solución de precursor de metalnorte.- Asegúrese de que la textura de las partículas de sílice permanece como la de arena seca. Evitar la acumulación de exceso de solución durante la impregnación.
- Coloque el Pt-0.7Cu / SiO precursor 2 catalizador impregnado en un horno de secado y se seca a 125 ° CO / N.
- Calcinación y reducción
- Calcinar el catalizador en un horno a 250 ° C con una velocidad de rampa de 5 ° C / min en aire durante 3 h.
NOTA: La calcinación a temperaturas más altas generalmente conduce a nanopartículas de Pt más grandes. - Colocar una capa de 2 cm de lana de cuarzo en el medio de un reactor de tubo de 1" de cuarzo y cargar el catalizador calcinado Pt-0.7Cu / SiO 2 en el tubo a través de un embudo de plástico. Colocar el tubo en un horno a temperatura programada clamshell.
- Después de purgar el tubo con N2 durante 5 min a TA, comenzará a fluir H 2 (a temperatura ambiente) a la misma velocidad de flujo como N 2 (100 ccm) para reducir el Pt-0.7Cu /SiO $ ₂ $.
- Aumentar la temperatura a 150 ° C con una velocidad de rampa de 5 ° C / min y mantener durante 5 min.
- Comience la rampa lenta de la temperatura a una velocidad de 2,5 ° C / min a 250 ° C. Mantenga la temperatura durante 15 minutos cada 25 ° C.
NOTA: Otros metales pueden requerir temperaturas de reducción más bajas o más altas. La temperatura exacta se puede determinar generalmente examinando los cambios de color del catalizador ( por ejemplo, de azul a negro) para Pt-Cu. - La rampa a 550 ° C (o la temperatura de reacción, si es superior) a 10 ° C / min y se mantiene durante 30 min para completar la reducción. Purgar con N $ ₂ $ y enfriar a temperatura ambiente.
- Descargue los catalizadores Pt-0.7Cu / SiO2 y guárdelos en un vial para uso futuro.
NOTA: Repita procedimientos de síntesis similares utilizando diferentes cantidades de Cu (NO 3 ) 2 · 3H 2 O y (NH 3 ) 4 Pt (NO 3 ) 2 para preparar el otro Pt-X Cu / SiO 2 (X = 0,7, 2,3 y 7,3 y representa las relaciones atómicas Cu: Pt) y catalizadores Pt / SiO2.
- Calcinar el catalizador en un horno a 250 ° C con una velocidad de rampa de 5 ° C / min en aire durante 3 h.
2. Prueba de Desempeño de Propano-Deshidrogenación
- Carga del catalizador
- Tome un reactor de tubo de cuarzo de 3/8 "y coloque una capa de 1 cm de lana de cuarzo contra el hoyuelo en el medio.
Precaución: Use guantes protectores cuando maneje lana de cuarzo, ya que las agujas finas pueden quedar incrustadas en la piel. - Pesar 40 mg de Pt-0.7Cu / 2 catalizador SiO y 960 mg de la sílice para la dilución. Mezclar las partículas (1 g de peso total) en un vial vacío.
- Utilice un embudo de plástico para cargar toda la mezcla de catalizadores en el tubo de reacción. Limpie la pared exterior de ambos extremos del tubo con toallitas sin pelusa para quitar cualquier suciedad para obtener un buen sellado con la junta tórica.
- Coloque los accesorios de tubo en ambos extremos del tubo de reactor de cuarzo y conectarlos al sistema de reactor equipado con un horno de concha.
- Tome un reactor de tubo de cuarzo de 3/8 "y coloque una capa de 1 cm de lana de cuarzo contra el hoyuelo en el medio.
- Prueba de fugas y pretratamiento del catalizador
- A su vez en 50 cm 3 / min N 2 de flujo a través del reactor tubular. Después de 1 minuto, cierre la válvula de bola en la salida del reactor. Espere a que la presión del sistema aumente a 5 psig. Cierre la válvula de bola en la línea N 2 de entrada para detener el flujo de N 2 y sellar el sistema del reactor.
- Espere 1 minuto y registre la presión leída desde el medidor. Si la presión cae, abra la válvula de bola en la salida del reactor para liberar la presión y volver a fijar los accesorios. Si no, primero abrir la válvula de bola en la salida del reactor para liberar la presión antes de reiniciar el flujo de N 2 mediante la activación de la válvula de bola en la línea de entrada de N 2 para purgar el sistema durante 1 min.
- Comienzan a fluir 50 cm 3 / min de 5% H 2 / N 2 para la reducción de catalizador antes de ejecutar una reacción y detener el flujo de N 2. Iniciar el calentamiento del tubo a la temperatura de reacción de 550 ° C, con arDe 10 ° C / min. Espere 30 minutos después de que el horno alcance el punto de ajuste y permita que la temperatura del sistema se estabilice a la temperatura deseada.
- Prueba de reacción de deshidrogenación de propano
- Iniciar el cromatógrafo de gases (GC) en el sistema del reactor y seleccionar el método adecuado para el análisis de componentes de gas.
- Cambie el flujo de gas del reactor a una línea de bypass. El flujo 100 cm 3 / min de 5% de propano / N 2 y 100 cm 3 / min de 5% H 2 / N 2. Espere 1 minuto para que el flujo de propano se estabilice e inyecte el flujo de bypass en GC como una muestra de referencia.
- Cambiar el flujo de gas de vuelta a la línea del tubo del reactor para iniciar la reacción y registrar el tiempo.
- Después de que la reacción transcurra durante 4 minutos, inyecte el flujo de gas de salida del reactor (una muestra de GC) en el GC para obtener la información del componente de gas de salida. Inyectar las muestras cada 4 min y ejecutar la prueba hasta que la conversión alcance sta sta Te o la conversión es muy baja.
- Utilice el software de análisis de pico correspondiente para analizar cada pico.
- Haga clic para seleccionar los puntos inicial y final del pico. Utilice la función de integración para obtener el área del pico. Anote el área de pico para el propano (C 3 H 8) reactivo; el propileno (C 3 H 6) de producto; y los productos secundarios, el metano (CH 4), etano (C 2 H 4), y etileno (C 2 H 6).
NOTA: Para cada inyección se obtiene un patrón de GC con múltiples picos cuya área se relaciona con el número de moles de diferentes especies de gas.
- Haga clic para seleccionar los puntos inicial y final del pico. Utilice la función de integración para obtener el área del pico. Anote el área de pico para el propano (C 3 H 8) reactivo; el propileno (C 3 H 6) de producto; y los productos secundarios, el metano (CH 4), etano (C 2 H 4), y etileno (C 2 H 6).
- Convertir el área del pico en el número de moles para cada especie utilizando el factor de respuesta. Determine la conversión de propano y la selectividad de propileno en el momento para cada muestra de acuerdo con las siguientes fórmulas:
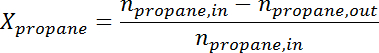
Ad / 56040 / 56040eq2.jpg "/>
dónde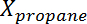 Es la conversión de propano,
Es la conversión de propano, 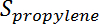 Es la selectividad del propileno,
Es la selectividad del propileno, 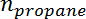 Es el número de moles de propano, y
Es el número de moles de propano, y 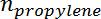 Es el número de moles de propileno.
Es el número de moles de propileno. - Obtenga el valor de conversión y selectividad inicial en t = 0 extrapolando la conversión medida y la selectividad frente al tiempo en la corriente usando un ajuste exponencial.
- Iniciar el cromatógrafo de gases (GC) en el sistema del reactor y seleccionar el método adecuado para el análisis de componentes de gas.
- Post-reacción
- Pare de calentar el reactor apagando el programa de temperatura. Cambiar el flujo de gas a 10 cm 3 / min N 2 .
- Cambiar el cromatógrafo de gases de nuevo al modo de espera para reducir el caudal del gas portador.
- Descargue el catalizador usado del reactor de lecho fijo de cuarzo después de enfriar hastatemperatura ambiente. Recoja el peso del catalizador en un área de eliminación de desechos designada.
3. Caracterización de las muestras de catalizador
- Microscopía electrónica de transmisión de barrido 4 , 20
- Cargar el catalizador en un mortero y moler en menos de 100 malla de polvo con un mazo.
- Dispersar aproximadamente 30 mg de polvo de catalizador en aproximadamente 5 ml de alcohol isopropílico en un vial pequeño. Agitar el vial para su mezcla completa y dejar que el vial se asiente durante 5 min para permitir la deposición de las partículas relativamente grandes.
NOTA: La suspensión obtenida debe contener partículas muy pequeñas de catalizadores soportados. - Coloque una rejilla de Au TEM en un plato de evaporación. Calentar el plato a 80 ° C en una placa caliente. Añadir tres gotas de la suspensión de catalizador a la red.
NOTA: El alcohol isopropílico se evaporará rápidamente y dejará las partículas deE cuadrícula. - Cargar la rejilla en el soporte de la muestra para la obtención de imágenes por microscopía electrónica.
- Espectroscopia in situ de absorción de rayos X 3 , 4 , 19 , 20
- Cargar el catalizador en un mortero y moler en menos de 100 malla de polvo con un mazo. Cargue los polvos finos en un juego de troqueles y presione con los dedos para formar una oblea autoportante.
- Cargue una muestra de ~ 100 mg en el porta muestras.
- Colocar el porta muestras en un reactor de tubo de cuarzo y pretratar la muestra reduciéndola en 50 cm 3 / min 3% H 2 / He.
- Después de enfriar a RT, sellar el tubo y transferirlo a la línea de luz del sincrotrón para recoger los datos XAS.
- Difracción de rayos X in situ 19 , 20
- LoAd el catalizador en un mortero y moler en menos de 100 malla de polvo con un mazo.
- Presione una oblea delgada utilizando un conjunto de troqueles estándar de 7 mm de diámetro.
NOTA: El juego de troqueles contiene una pieza hembra y piezas masculinas superior e inferior.- Sujete la pieza masculina inferior a la parte hembra. Cargue la muestra sobre la superficie pulida de la parte inferior. Fije la pieza macho superior y transfiera el conjunto de matrices a la etapa de muestreo de la prensa. Presione con la fuerza adecuada.
- Descargue la oblea y transfiérala a la copa de cerámica de la etapa de muestra especializada (véase la tabla de materiales ). Sellar el escenario y fijarlo en la mesa de muestras de la línea de luz.
- Reduzca la muestra fluyendo y aumentando la temperatura a 550 ° C. Recoger los datos de difracción de rayos X in situ bajo un flujo de gas H 2 / He al 3% a 550 ° C y después de enfriar a RT 20 .
Resultados
La selectividad de propileno frente al tiempo para los catalizadores de Pt y Pt-Cu medidos a una conversión inicial de propano de aproximadamente el 20% se presenta en la Figura 1A . El catalizador de Pt tiene una selectividad inicial de 61%, que aumenta hasta aproximadamente 82% con el tiempo en la corriente a medida que el catalizador se desactiva durante 1 h. El catalizador de Pt-0,7Cu muestra una mejor selectividad de propileno inicial del 72%. Para los...
Discusión
Los catalizadores de Pt-Cu preparados en este trabajo contienen nanopartículas uniformes de aproximadamente 2 nm de tamaño, similares a los catalizadores heterogéneos calificados para aplicaciones industriales. Todos los precursores de Pt y Cu forman estructuras bimetálicas, en oposición a partículas monometálicas separadas. Esta interacción bimetálica y el pequeño tamaño de partícula se realizan mediante un control cuidadoso sobre los procedimientos de síntesis. El proceso de impregnación hace uso de la a...
Divulgaciones
Los autores no tienen nada que revelar.
Agradecimientos
Este trabajo fue apoyado por la Escuela de Ingeniería Química, Universidad de Purdue. El uso de la Fuente de Fotones Avanzada fue apoyado por el Departamento de Energía de EE.UU., Oficina de Ciencias de la Energía Básica, bajo el contrato no. DE-AC02-06CH11357. Las operaciones del MRCAT, la línea de luz 10-BM son apoyadas por el Departamento de Energía y las instituciones miembros de MRCAT. Los autores también reconocen el uso de la línea de haz 11-ID-C. Damos las gracias a Evan Wegener por la asistencia experimental con el XAS.
Materiales
| Name | Company | Catalog Number | Comments |
| 1" quartz tube reactor | Quartz Scientific | Processed by glass blower | |
| drying oven | Fisher Scientific | ||
| calcination Furnace | Thermo Sciencfic | ||
| clam-shell temperature programmed furnace | Applied Test System | Custom made | |
| propane dehydorgenation performance evaluation system | Homemade | ||
| gas chromatography | Hewlett-Packard | Model 7890 | |
| TEM grid | TedPella | 01824G | |
| pellet press | International Crystal Lab | 0012-8211 | |
| die set | International Crystal Lab | 0012-189 | |
| Linkam Sample Stage | Linkam Scientific | Model TS1500 | |
| copper nitrate trihydrgate | Sigma Aldrich | 61197 | |
| tetraammineplatinum nitrate | Sigma Aldrich | 278726 | |
| ammonia | Sigma Aldrich | 294993 | |
| silica | Sigma Aldrich | 236802 | |
| isopropyl alcohol | Sigma Aldrich | ||
| balance | Denver Instrument Company | A-160 | |
| spatulas | VWR | ||
| ceramic and glass evaporating dishes, beakers | VWR | ||
| heating plate | |||
| kimwipe papers | |||
| mortar and pestle | |||
| quartz wool | |||
| Swagelok tube fittings |
Referencias
- Sattler, J. J., Ruiz-Martinez, J., Santillan-Jimenez, E., Weckhuysen, B. M. Catalytic dehydrogenation of light alkanes on metals and metal oxides. Chem. Rev. 114 (20), 10613-10653 (2014).
- Childers, D. J., et al. Modifying structure-sensitive reactions by addition of Zn to Pd. J Catal. 318, 75-84 (2014).
- Gallagher, J. R., et al. Structural evolution of an intermetallic Pd-Zn catalyst selective for propane dehydrogenation. Phys. Chem. Chem. Phys. 17, 28144-28153 (2015).
- Wu, Z., et al. Pd-In intermetallic alloy nanoparticles: highly selective ethane dehydrogenation catalysts. Catal Sci Technol. 6 (18), 6965-6976 (2016).
- Siddiqi, G., Sun, P., Galvita, V., Bell, A. T. Catalyst performance of novel Pt/Mg (Ga)(Al) O catalysts for alkane dehydrogenation. J Catal. 274 (2), 200-206 (2010).
- Passos, F. B., Aranda, D. A., Schmal, M. Characterization and catalytic activity of bimetallic Pt-In/Al 2 O 3 and Pt-Sn/Al 2 O 3 catalysts. J Catal. 178 (2), 478-488 (1998).
- Virnovskaia, A., Morandi, S., Rytter, E., Ghiotti, G., Olsbye, U. Characterization of Pt, Sn/Mg (Al) O catalysts for light alkane dehydrogenation by FT-IR spectroscopy and catalytic measurements. J Phys Chem C. 111 (40), 14732-14742 (2007).
- Jablonski, E., Castro, A., Scelza, O., De Miguel, S. Effect of Ga addition to Pt/Al 2 O 3 on the activity, selectivity and deactivation in the propane dehydrogenation. Appl Catal A. 183 (1), 189-198 (1999).
- Galvita, V., Siddiqi, G., Sun, P., Bell, A. T. Ethane dehydrogenation on Pt/Mg (Al) O and PtSn/Mg (Al) O catalysts. J Catal. 271 (2), 209-219 (2010).
- Shen, J., Hill, J. M., Watwe, R. M., Spiewak, B. E., Dumesic, J. A. Microcalorimetric, infrared spectroscopic, and DFT studies of ethylene adsorption on Pt/SiO2 and Pt-Sn/SiO2 catalysts. J Phys Chem B. 103 (19), 3923-3934 (1999).
- Silvestre-Albero, J., et al. Microcalorimetric, reaction kinetics and DFT studies of Pt–Zn/X-zeolite for isobutane dehydrogenation. Catal Lett. 74 (1-2), 17-25 (2001).
- Sun, P., Siddiqi, G., Vining, W. C., Chi, M., Bell, A. T. Novel Pt/Mg (In)(Al) O catalysts for ethane and propane dehydrogenation. J Catal. 282 (1), 165-174 (2011).
- Sun, P., Siddiqi, G., Chi, M., Bell, A. T. Synthesis and characterization of a new catalyst Pt/Mg (Ga)(Al) O for alkane dehydrogenation. J Catal. 274 (2), 192-199 (2010).
- Okamoto, H. . Phase diagrams for binary alloys. Desk handbook. , (2000).
- Hamid, S. B. D. -. A., Lambert, D., Derouane, E. G. Dehydroisomerisation of n-butane over (Pt, Cu)/H-TON catalysts. Catal Today. 63 (2), 237-247 (2000).
- Veldurthi, S., Shin, C. -. H., Joo, O. -. S., Jung, K. -. D. Promotional effects of Cu on Pt/Al 2 O 3 and Pd/Al 2 O 3 catalysts during n-butane dehydrogenation. Catal Today. 185 (1), 88-93 (2012).
- Han, Z., et al. Propane dehydrogenation over Pt-Cu bimetallic catalysts: the nature of coke deposition and the role of copper. Nanoscale. 6 (17), 10000-10008 (2014).
- Komatsu, T., Tamura, A. Pt 3 Co and PtCu intermetallic compounds: promising catalysts for preferential oxidation of CO in excess hydrogen. J Catal. 258 (2), 306-314 (2008).
- Gallagher, J. R., et al. In situ diffraction of highly dispersed supported platinum nanoparticles. Catal Sci Technol. 4 (9), 3053-3063 (2014).
- Ma, Z., Wu, Z., Miller, J. T. Effect of Cu content on the bimetallic Pt-Cu catalysts for propane dehydrogenation. Catal Struct React. 3 (1-2), 43-53 (2017).
- Richards, R. . Surface and nanomolecular catalysis. , (2006).
- Jiao, L., Regalbuto, J. R. The synthesis of highly dispersed noble and base metals on silica via strong electrostatic adsorption: I. Amorphous silica. J Catal. 260 (2), 329-341 (2008).
- Miller, J. T., Schreier, M., Kropf, A. J., Regalbuto, J. R. A fundamental study of platinum tetraammine impregnation of silica: 2. The effect of method of preparation, loading, and calcination temperature on (reduced) particle size. J Catal. 225 (1), 203-212 (2004).
- Wei, H., et al. Selective hydrogenation of acrolein on supported silver catalysts: A kinetics study of particle size effects. J Catal. 298, 18-26 (2013).
- Ertl, G., Knözinger, H., Schüth, F., Weitkamp, J. . Handbook of heterogeneous catalysis: 8 volumes. , (2008).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados