需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
光刺激后小龙虾光受体的脱敏和回收
摘要
提出了一种研究小龙虾光感受器作为昼夜时间函数的脱敏和灵敏度恢复的方案。
摘要
提出了一种研究小龙虾光感受器脱敏和回收的方法。我们使用不连续的单电极开关电压夹配置对隔离眼眼中的光受体细胞进行了细胞内电记录。首先,用剃刀刀片,我们在背角膜打开,以获得视网膜。之后,我们插入一个玻璃电极通过开口,并穿透一个细胞,如记录负电位报告。膜电位被夹在光受体的静息电位上,并应用光脉冲来激活电流。最后,采用两种光闪协议测量电流脱敏和恢复。第一个光闪光触发,在滞后期后,转导离子电流,达到峰值振幅后衰减为脱敏状态;以不同时间间隔应用的第二次闪光可评估光激活电导的状态。为了描述光激发电流的特征,测量了三个参数:1) 延迟(从光闪光传递到电流达到其最大值的 10% 之间的时间);2) 峰值电流;3) 脱敏时间常数(电流衰减相的指数时间常数)。所有参数都受到第一个脉冲的影响。
为了量化脱敏回收,采用了 p2/p1 的比率与脉冲之间的时间。p1 是第一个光脉冲引起的峰值电流,p2 是第二个脉冲引起的峰值电流。这些数据被拟合到指数函数的总和上。最后,这些测量是作为昼夜时间的功能进行的。
引言
为了被视为视觉刺激,到达眼睛的光必须转换成电信号。因此,在所有视觉生物体中,光触发转导电电流,进而产生光受体细胞膜电位的变化,即所谓的受体电位。因此,眼睛的光灵敏度主要取决于光激活电导的状态,该电导可以激活或脱敏。
在小龙虾光感受器中,光触发一个缓慢的,瞬态的,离子电流1。照明后,转导电流在延迟或延迟后产生,然后达到最大值;之后,它衰减,因为转导通道进入脱敏状态,其中它们对进一步的光刺激2没有反应。也就是说,光除了激活对视觉负责的转导电流外,还会引起光受体细胞的灵敏度的瞬时递减。脱敏可能是防止过度暴露于适当刺激的一般保护机制。当转导电导从脱敏中恢复时,眼睛对光的敏感性会恢复。
细胞内记录是测量兴奋细胞3、4、5、6、7、8的电活性的有用技术。虽然随着贴片夹技术9的出现,细胞内记录已经变得不那么频繁,但当细胞难以分离,或者呈现几何形状,使得贴片夹紧的千兆密封的形成变得困难(即,贴片电极和抗电阻为109欧姆的膜之间的密封或紧密接触),它仍然是一种方便的方法。后者的例子是精子细胞10和本文研究的光受体细胞。根据我们的经验,Procambarus克拉克光感受器很难在初级文化中分离和保存;此外,它们是薄棒,使千兆海豹形成难以实现。在细胞内记录中,一个尖锐的电极被推进到细胞中,由周围的组织固定到位。电极被放大器的高速开关电路切碎,因此在电压脉冲之间采样电流。此模式称为不连续单电极电压夹(dSEVC 模式)11。电极的高电阻(小开口)阻碍细胞和移液器溶液之间的扩散交换,对细胞内环境产生最小的干扰。这种技术的一个潜在缺点是电极插入可能产生非选择性的泄漏电流;因此,必须小心避免从电池记录泄漏电流的大小可能会干扰预定的测量4,12。
在此,我们使用孤立的小龙虾眼眼,通过在电压夹条件下对光受体细胞进行细胞内电记录,评估光激活电导的脱敏和恢复。
研究方案
注:实验符合墨西哥动物保护法。
1. 实验设置
- 常规连接
- 通过模拟到数字转换器将放大器连接到合适的计算机,并使用示波器监控实验(图1)。
- 将照片模拟器连接到转换的 A/D。
- 录音室
- 将记录室放在防振台的顶部,并将其放置在法拉第保持架内。
注:这可以防止可能影响记录的机械振动和电气噪音。我们的法拉第笼子是由黑暗的铁丝网组成的。使用自制的 2 mL 丙烯酸记录室 (图 2)。 - 准备沐浴溶液,以保持准备活着13: 205 mM NaCl;5 mM KCl;2 mM MgSO4;13 mM CaCl2;5 mM Hepes-NaOH,pH 7.3。
注: 溶液不包括去电玫瑰或任何冒泡95%O 2,5%CO2混合物,因为实验过程足够短,足以检测电气记录造成的损坏(有关完整性,请参阅步骤4.2.3)。
- 将记录室放在防振台的顶部,并将其放置在法拉第保持架内。
- 电极
- 使用氯化涂层银线电极作为参考电极
注: 氯化银涂层是允许电极反应所必需的: AgCl(s) = e=↔ Ag(s) = Cl-. - 砂银线(厚度 = 1 毫米,长度 = 10 厘米),用细级砂纸清洁其表面。
- 用蒸馏水冲洗银丝。
- 将干净的银线浸入 4-6% 次氯酸钠溶液 (NaClO) 中,直到出现暗(约 20 分钟)。
- 使用装有电解质溶液(2.7 M KCl)的薄玻璃移液器作为细胞内电极。
- 用微移液器拉拔器拉一个玻璃毛细管(内径 = 1 mm),以获得一个开口小(0.01-0.1 μm)的薄尖端14。
- 用 2.7 M KCl 溶液填充拉拔毛细管玻璃。首先用毛细管填充它(将移液器尖端浸入 2.7 M KCl 溶液中),然后用细注射针填充移液器的一半。如有必要,点按电极移液器以消除气泡。
- 将电极连接到支架。使用放大器将支架连接到放大器头级。使用稳定的三维微操作器定位电极支架头台。降低电极,直到沐浴溶液盖住其尖端。
注:电极必须具有垂直方向
- 使用氯化涂层银线电极作为参考电极
- 选择放大器的桥接模式(在放大器的"模式"部分,按下"桥接"按钮)并测量电极电阻。确保电阻约为 50 MΩ11。
注:此电极尺寸允许高质量的电气记录,对电池的损坏有限。 - 使用放大器部分电压夹中的"保持位置"按钮和放大器微电极 1 部分中的电容中和按钮,空空偏移电流并补偿电容瞬变。
- 超级融合系统
- 将沐浴溶液(步骤 1.2.2)倒入合适的容器(250 mL 血清瓶),并将其连接到灌溉管组(内径 3.2 mm),从而连接记录室。使用重力驱动的超融合系统。将流速调节到 ± 0.5 mL/s。
- 将造型室连接到吸力装置。调节溶液吸入系统,使记录室的总体积不发生变化。使用真空泵进行吸力。
注: 记录室中的恒定体积对于在整个实验中保持杂散电容恒定非常重要。
2. 生物材料
注意:在模糊性中穿插的阶段使用成年小龙虾P.克拉克(7-10厘米长)。
- 循环时间
- 在实验前一个月,在12小时光/12-h暗周期15(白光,2.4 kW/m2)下保持100只小龙虾。
注:一个月是足够的时间来同步小龙虾种群。 - 通过评估5只随机选择的动物的电热表的振幅15,确定小龙虾种群的昼夜时间。
注:0 h 昼夜时间(CT 0)表示主观日的开始,即生物体通常活跃16、17、18、19的时间(图3)。小龙虾是夜间动物,因此在12小时光/12-h暗循环下,它在黑暗阶段是活跃的。
- 在实验前一个月,在12小时光/12-h暗周期15(白光,2.4 kW/m2)下保持100只小龙虾。
- 眼语隔离程序
- 在所需的昼夜时间,在0-4°C下浸入自来水中,对选定的小龙虾进行15分钟的麻醉。
- 通过精细剪刀,将眼睛从底座上分离出来。
- 使用剃刀刀片进入视网膜,在背角膜中开口(± 1-mm2)。
- 将眼睛在记录室的中心(硅胶覆盖的孔)处,并打开进入室顶部的视网膜。
- 保持眼睛在持续的黑暗下交谈20分钟。
注:20分钟是光感受器细胞完全暗适应的足够时间。
3. 光感受器刺穿
- 将微电极和眼茎的纵轴平行放置,使微电极居中进入视网膜。使用立体显微镜 (10X) 将设备置于正确的配置中。
- 通过选择放大器的桥接模式11来监控参考电极和记录电极之间的电压差。
- 将电极放入浴缸中,然后放在视网膜上。
- 移开显微镜,将照相灯与眼道的纵轴平行放置。
注:灯室和超级聚液室之间的距离约为15厘米。 - 缓慢降低微电极,直到检测到突然的电压降。
注:约+50 mV的电压降表示健康光受体细胞的压浸。 - 提供测试闪光灯(白光,7.2 kW/m2,10μs持续时间),以记录光受体的受体电位。
注:光受体的受体电位是10-15 mV振幅和300 ms持续时间的去极化电位(图4)。
4. 电气记录
- 确保光受体细胞完全适应黑暗条件(参见步骤 2.3)。
- 每 2 分钟提供一次测试灯闪光灯。通过在数据采集软件中选择足够值(120 秒)的"单集间时间"来自动执行闪烁之间的时间。
注:2分钟是光感受器电响应所基础电流完全恢复的必要时间。 - 监测静止膜电位,以及受体电位的振幅和持续时间。假设一旦受体电位、振幅和持续时间保持不变,光受体就完全适应。眼睛以前在恒定的黑暗下保持20分钟(步骤2.3)完成他们的适应约5分钟。
- 在记录光激发电流之前,停止刺激细胞 2 分钟。
- 每 2 分钟提供一次测试灯闪光灯。通过在数据采集软件中选择足够值(120 秒)的"单集间时间"来自动执行闪烁之间的时间。
- 当前录制
- 通过在数据采集软件中选择"保持振幅"(在模拟输出通道部分的波形中),在测量的静止膜电位值处夹紧电压。
- 选择放大器的dSEVC模式。在放大器的"模式"部分,选择 SEVC 按钮,然后将操纵杆切换到"无模子 SEVC"位置。
- 根据电极11的速度,将开关速率设置为500-1,000赫兹(通过使用放大器的速率调整按钮)。
- 发出一个闪光,并观察引起电的流入。
注:这是光导或转导电流(图5)。 - 返回放大器上的网桥模式,并通过发送光闪烁记录受体电位(参见第 3 节)。确保光感受器细胞完全适应黑暗条件。测量受体电位特征(振幅和持续时间),并与第一次测量进行比较。假设被刺穿的光受体细胞是一个健康的细胞,如果他们具有相同的特征。
注:眼角消融后,生物制剂在以下2小时内是可行的。
- 两种脉冲协议:使用两个光闪光协议测量脱敏的恢复。
注:两个光闪协议类似于用于测量电压门控通道20失活恢复的标准双脉冲电压协议。第一个光闪光会导致光感受器细胞的灵敏度暂时变化,第二个闪光评估光激活电导的状态。- 传递一对光脉冲。在所需的时间间隔(从 300 ms 到 2 分钟)后应用第二次闪光。
- 使用数据采集软件在10 KHz采样时对电流进行数字化,并保存数据进行线下分析11。
注: 包含软件配置值的表作为补充材料。
5. 数据分析
- 光光电流动力学
- 测量三个电流参数:激活延迟 L,从光闪光传输到电流达到其最大振幅的 10% 所经过的时间(图 5);峰值或最大电流振幅 Ip;脱敏时间常数 T. 通过将电流衰减相拟合到:
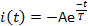
其中,A = -I(t=0)是正常数 (图 5)。
- 测量三个电流参数:激活延迟 L,从光闪光传输到电流达到其最大振幅的 10% 所经过的时间(图 5);峰值或最大电流振幅 Ip;脱敏时间常数 T. 通过将电流衰减相拟合到:
- 脱敏和恢复
注意:从脱敏状态恢复被评估为比率 p2/p1,其中 p1是控制电流的相关参数(L、Ip或 T),p2是第二个测试电流的相应参数。- 绘制 p2/p 1(L、Ip或 T)作为脉冲之间的时间函数。
- 根据参数,将每个绘图的点拟合到:
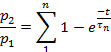
或: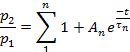
- 使用适当的统计测试来确定适合实验数据所需的指数项数。
结果
首先,获得小龙虾光受体细胞的代表性受体电位(图4)。之后,应用了测试光闪光来触发光转导电流(图5)。阳离子转导电流1在滞后后激活,达到最大值,然后慢慢下降到吸收脱敏状态,从中缓慢恢复。
可以合理地假设,光激发电流的长延迟L(几十毫秒)取决?...
讨论
小龙虾由于能够在非自然条件下生存,已被证明是一个优秀的模型。易于进行体内和体外电生理分析。此外,甲壳类动物是比较时间生物学领域神经生物学研究的有利群体。
本文采用细胞内记录技术,对小龙虾光活化转导电流的脱敏和恢复进行了研究。然而,我们相信,只要有可能获得光受体细胞,同样的技术就可以适应其他无脊椎动物视觉?...
披露声明
我们没有什么可透露的。
致谢
这项工作得到了DGAPA-UNAMIN224616-RN224616赠款的支持。作者要感谢联合国妇女署医学学院科学论文翻译部主任何塞菲娜·博拉多夫人编辑本手稿的英文版本。
材料
| Name | Company | Catalog Number | Comments |
| Axoclamp2A | Axon Instruments Inc | Amplifier | |
| Digidata 1200 Interface | Axon Instruments Inc | Digitizer | |
| Oscilloscope TDS430A | Tektronix | Analogic Oscilloscope | |
| Photostimulator PS33 Plus | Grass | Lamp | |
| Puller PC-100 | Narishige | Micropipette Puller | |
| Puller P-97 | Sutter Instruments | Micropipette Puller | |
| Glass Capillary Tube Kimax-51 | Kimble Products | 34502 | 0.8, 1.10, 100 mm |
| HS-2 Headstage | Axon Instruments Inc | Headstage | |
| Micromanipulator MX-4 | Narishige | Mechanical Micromanipulator | |
| Stereoscopic Microscope | Zeiss | Microscope | |
| pClamp | Axon Instruments Inc | Data acquisition software for digidata 1200 interface | |
| Clampfit | Axon Instruments, Inc | Analysis software linked to pClamp | |
| Origin | OriginLab Corp. | Data analysis and graphing software | |
| Sodium Chloride | Sigma | S7653 | >99.5% |
| Potassium Chloride | Sigma | P-9333 | Minimum 99% |
| Magnesium Sulfate | Sigma | M7506 | Minimum 99.5% |
| Calcium Chloride | Sigma | C5080 | Minimum 99.0% |
| Hepes | Sigma | H7523 | >99.5% |
| Sodium Hydroxide | Sigma | S8045 | 98.00% |
| Sodium hypochlorite solution | Sigma | 425044 | Available chlorine, 10-15% |
参考文献
- Barriga-Montoya, C., Gómez-Lagunas, F., Fuentes-Pardo, B. Effect of pigment dispersing hormone on the electrical activity of crayfish visual photoreceptors during the 24-h cycle. Comp. Biochem. Physiol. A Comp. Physiol. 157 (4), 338-345 (2010).
- Barriga-Montoya, C., de la O-Martínez, A., Fuentes-Pardo, B., Gómez-Lagunas, F. Desensitization and recovery of crayfish photoreceptors. Dependency on circadian time, and pigment-dispersing hormone. Comp. Biochem. Physiol. A Comp. Physiol. 203, 297-303 (2017).
- Wickenden, A. D. Overview of electrophysiological techniques. Curr. protoc. pharmacol. 11, 1-17 (2014).
- Brette, R., Destexhe, A. Intracellular recording. Handbook of Neural Activity Measurement. , 44-91 (2012).
- Cummins, D., Goldsmith, T. H. Cellular identification of the violet receptor in the crayfish eye. J. Comp. Physiol. 142 (2), 199-202 (1981).
- Eguchi, E. Rhabdom structure and receptor potentials in single crayfish retinular cells. J. Cell and Comp. Physiol. 66, 411-430 (1965).
- Nosaki, H. Electrophysiological study of color encoding in the compound eye of crayfish, Procambarus clarkii. Z. vergl. Physiologie. 64 (3), 318-323 (1969).
- Miller, C. S., Glantz, R. M. Visual adaptation modulates a potassium conductance in retinular cells of the crayfish. Vis Neurosci. 17 (3), 353-368 (2000).
- Hamill, O. P., Marty, A., Neher, E., Sakmann, B., Sigworth, F. J. Improved patch-clamp techniques for high-resolution current recording from cells and cell-free membrane patches. Pflugers Arch. 391 (2), 85-100 (1981).
- Lishko, P., Clapham, D. E., Navarro, B., Kirichok, Y. Sperm patch-clamp. Methods Enzymol. 525, 59-79 (2013).
- Finkel, A. Axoclamp-2A microelectrode clamp theory and operation. Axon Instruments, Inc. , (1990).
- Sakmann, B. . Single-channel recording. , (2013).
- Van Harreveld, A. A physiological solution for freshwater crustacea. Proc. Soc. Exp. Biol. Med. 34 (4), 428-432 (1936).
- Oesterle, A. . pipette cookbook. , 97 (2008).
- Fuentes-Pardo, B., Ramos-Carvajal, J. The phase response curve of electroretinographic circadian rhythm of crayfish. Comp. Biochem. Physiol. A Comp. Physiol. 74 (3), 711-714 (1983).
- Pace-Schott, E. F., Hobson, J. A. The neurobiology of sleep: genetics, cellular physiology and subcortical networks. Nat. Rev. Neurosci. 3 (8), 591-605 (2002).
- Pittendrigh, C. S., Aschoff, J. On the mechanism of the entrainment of a circadian rhythm by light cycles. Circadian Clocks. , 277-297 (1965).
- Pittendrigh, C. S., Aschoff, J. Circadian systems: entrainment. Handbook Behavioral Neurobiology Biological Rhythms. , 94-124 (1981).
- Vitaterna, M. H., Takahashi, J. S., Turek, F. W. Overview of circadian rhythms. Alcohol Res. Health. 25 (2), 85-93 (2001).
- Hille, B. . Ion channels of excitable membranes. 507, (2001).
- Dircksen, H., Strauss, J. Circadian clocks in crustaceans: identified neuronal and cellular systems. Front Biosci. 15, 1040-1074 (2010).
- Terakita, A., Hariyama, T., Tsukahara, Y., Katsukura, Y., Tashiro, H. Interaction of GTP-binding protein Gq with photoactivated rhodopsin in the photoreceptor membranes of crayfish. FEBS Lett. 330, 197-200 (1993).
- Terakita, A., Takahama, H., Hariyama, T., Suzuki, T., Tsukahara, Y. Light regulated localization of the beta-subunit of Gq-type G-protein in the crayfish photoreceptors. J Comp Physiol A. 183 (4), 411-417 (1998).
- Terakita, A., Takahama, H., Tamotsu, S., Suzuki, T., Hariyama, T., Tsukahara, Y. Light-modulated subcellular localization of the alpha-subunit of GTP-binding protein Gq in crayfish photoreceptors. Vis Neurosci. 13 (3), 539-547 (1996).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。