Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
Desensibilización y recuperación de fotorreceptores de cangrejo de río tras la entrega de un estímulo ligero
En este artículo
Resumen
Se presenta un protocolo para el estudio de la desensibilización y la recuperación de la sensibilidad de los fotorreceptores de cangrejo sin efecto en función del tiempo circadiano.
Resumen
Se presenta un método para estudiar la desensibilización y recuperación de fotorreceptores de cangrejos. Realizamos grabaciones eléctricas intracelulares de células fotorreceptoras en miradas aisladas utilizando la configuración discontinua de abrazadera de voltaje conmutada por electrodo único. Primero, con una cuchilla de afeitar hicimos una abertura en la córnea dorsal para tener acceso a la retina. A partir de entonces, insertamos un electrodo de vidrio a través de la abertura, y penetramos en una célula según lo reportado por la grabación de un potencial negativo. El potencial de membrana se afianzó al potencial de reposo del fotorreceptor y se aplicó un pulso de luz para activar las corrientes. Por último, se empleó el protocolo de dos flashes de luz para medir la desensibilización y recuperación actuales. El primer destello de luz desencadena, después de un período de retraso, la corriente iónica de transducción, que después de alcanzar una amplitud máxima se descompone hacia un estado desensifiado; el segundo flash, aplicado en intervalos de tiempo variables, evalúa el estado de la conductividad activada por luz. Para caracterizar la corriente iluminada, se midieron tres parámetros: 1) latencia (el tiempo transcurrido entre la entrega del flash de luz y el momento en el que la corriente alcanza el 10% de su valor máximo); 2) corriente pico; y 3) constante de tiempo de desensibilización (constante de tiempo exponencial de la fase de decaimiento actual). Todos los parámetros se ven afectados por el primer pulso.
Para cuantificar la recuperación de la desensibilización, se empleó la relación p2/p1 frente al tiempo entre pulsos. p1 es la corriente pico evocada por el primer pulso de luz, y p2 es la corriente pico evocada por el segundo pulso. Estos datos se instalaron en una suma de funciones exponenciales. Finalmente, estas mediciones se llevaron a cabo en función del tiempo circadiano.
Introducción
Para ser percibido como un estímulo visual, la luz que llega a los ojos debe ser transducida en una señal eléctrica. Por lo tanto, en todos los organismos visuales, la luz desencadena una corriente iónnica de transducción, que a su vez produce un cambio en el potencial de membrana de las células fotorreceptoras, el llamado potencial receptor. Debido a esto, la sensibilidad a la luz del ojo depende principalmente del estado de la conductancia activada por la luz, que puede estar disponible para ser activada o insinotada.
En los fotorreceptores de cangrejo de río, la luz desencadena una corriente iónica lenta, transitoria1. Tras la iluminación, la corriente de transducción surge después de un retraso o latencia antes de alcanzar su máximo; a partir de entonces se descompone, ya que los canales de transducción caen en un estado desensensible en el que no responden a un estímulo de luz adicional2. Es decir, la luz, además de activar la corriente de transducción responsable de la visión, también induce un decremento transitorio de la sensibilidad de las células fotorreceptoras. La desensibilización puede representar un mecanismo de protección general contra la sobreexposición a un estímulo adecuado. La sensibilidad del ojo a la luz se recupera a medida que la conductancia de transducción se recupera de la desensibilización.
El registro intracelular es una técnica útil para medir la actividad eléctrica de las células excitables3,4,5,6,7,8. Aunque la grabación intracelular se ha vuelto menos frecuente con la llegada de la técnica de abrazadera de parche9, sigue siendo un enfoque conveniente cuando las células son difíciles de aislar, o presentar una geometría que hace difícil la formación de los sellos giga de sujeción de parches(es decir,sellos o contactos estrechos entre el electrodo de parche y las membranas con resistencia eléctrica del orden de 109ohmios). Ejemplos de estos últimos son las células espermáticas10 y las células fotorreceptoras aquí estudiadas. En nuestra experiencia, los fotorreceptores Procambarus clarkii son difíciles de aislar y mantener en la cultura primaria; además, son varillas delgadas que dificultan la formación de giga-sello. En las grabaciones intracelulares, un electrodo afilado se introduce en una célula que se mantiene en su lugar por el tejido circundante. El electrodo es cortado por el circuito de conmutación de alta velocidad del amplificador, por lo que la corriente se muestrea entre pulsos de voltaje. Este modo se conoce como abrazadera de voltaje de un solo electrodo discontinuo (modo dSEVC)11. La alta resistencia (pequeña apertura) del electrodo dificulta el intercambio de difusión entre la célula y las soluciones de pipetas, produciendo una mínima perturbación del entorno intracelular3. Un inconveniente potencial de esta técnica es que la inserción de electrodos puede producir una corriente de fuga no selectiva; por lo tanto, se debe tener cuidado de evitar el registro de las células donde el tamaño de la corriente de fuga puede interferir con las mediciones previstas4,12.
En este documento, utilizamos acechadores aislados de cangrejos para evaluar la desensibilización y recuperación de la conductancia iónica activada por la luz mediante la realización de registros eléctricos intracelulares de células fotorreceptoras en condiciones de abrazadera de tensión.
Protocolo
NOTA: Los experimentos cumplen con las Leyes de Protección Animal de México.
1. Configuración experimental
- Conexiones generales
- Conecte el amplificador a un ordenador adecuado a través de un convertidor analógico a digital y utilice un osciloscopio para supervisar el experimento(Figura 1).
- Conecte el fotoestimulador al A/D convertido.
- Cámara de grabación
- Coloque la cámara de grabación encima de una mesa antivibración y localícela dentro de una jaula de Faraday.
NOTA: Esto evita las vibraciones mecánicas y el ruido eléctrico que pueden afectar a la grabación. Nuestra jaula Faraday estaba hecha de malla de alambre oscurecida. Se utiliza una cámara de grabación de acrílico casera de 2 ml (Figura 2). - Preparar la solución de baño para mantener viva la preparación13: 205 mM NaCl; 5 mM KCl; 2 mM MgSO4; 13 mM CaCl2; 5 mM Hepes-NaOH, pH 7.3.
NOTA: La solución no incluye dextrosa ni cualquier burbujeo en un 95% O2, una mezcla deCO2 al 5% porque el procedimiento experimental es lo suficientemente corto como para detectar daños por el registro eléctrico (ver paso 4.2.3 para ver la integridad).
- Coloque la cámara de grabación encima de una mesa antivibración y localícela dentro de una jaula de Faraday.
- Electrodos
- Utilice un electrodo de alambre de plata recubierto de cloruro como electrodo de referencia
NOTA: El recubrimiento de cloruro de plata es necesario para permitir la reacción del electrodo: AgCl(s) + e-↔ Ag(s) + Cl-. - Lijar un alambre de plata (espesor de 1 mm, longitud de 10 cm) con un papel de esmeruja de grado fino para limpiar su superficie.
- Enjuague el alambre de plata con agua destilada.
- Sumerja el alambre de plata limpio en una solución de hipoclorito de sodio (NaClO) de 4-6% hasta que parezca oscuro (aproximadamente 20 min).
- Utilice pipetas de vidrio fino llenas de una solución de electrolitos (2,7 M KCl) como electrodo intracelular.
- Tire de un tubo capilar de vidrio (diámetro interno de 1 mm) con un tirador de micropipeta para obtener una punta delgada con una pequeña abertura (0,01-0,1 m)14.
- Llene el vidrio capilar tirado con una solución de 2.7 M KCl. Primero llénalo por capilaridad (sumerja la punta de la pipeta en la solución kCl de 2,7 M) y luego llene la mitad de la pipeta con una aguja de inyección fina. Si es necesario, toque la pipeta del electrodo para eliminar las burbujas de aire.
- Conecte el electrodo a su soporte. Conecte el soporte al cabezal del amplificador con el amplificador. Coloque el cabezal del soporte del electrodo con un micromanipulador 3D estable. Baje el electrodo hasta que la solución de baño cubra su punta.
NOTA: El electrodo debe tener una orientación vertical
- Utilice un electrodo de alambre de plata recubierto de cloruro como electrodo de referencia
- Seleccione el modo puente del amplificador (en la sección Modo del amplificador, pulse el botón Puente) y mida la resistencia del electrodo. Asegúrese de que la resistencia es de aproximadamente 50 Ma 11.
NOTA: Este tamaño del electrodo permite una grabación eléctrica de buena calidad con daños limitados a la célula. - Anule la corriente de desplazamiento y compense los transitorios capacitivos utilizando el botón Posición de sujeción en la sección Abrazadera de voltaje del amplificador y el botón neutralización de la capacitancia en la sección Microelectrodo 1 del amplificador.
- Sistema de superfusión
- Vierta la solución de baño (paso 1.2.2) en un recipiente adecuado (una botella de suero de 250 ml) y conéctela a un juego de tubos de riego (3,2 mm de diámetro interno), conectando así la cámara de grabación. Utilice un sistema de superfusión impulsado por gravedad. Regula el caudal a 0,5 ml/s.
- Conecte la cámara a un dispositivo de aspiración. Regular el sistema de aspiración de la solución de tal manera que el volumen total de la cámara de grabación no varíe. Utilice una bomba de vacío para la succión.
NOTA: Un volumen constante en la cámara de grabación es importante para mantener constantes las capacitancias perdidas durante todo el experimento.
2. Material biológico
Nota: Utilice cangrejos adultos P. clarkii (7-10 cm de largo) en la etapa intermot del sexo indistinto.
- Tiempo circadiano
- Un mes antes de los experimentos, mantener 100 cangrejos bajo un ciclo oscuro de 12 h de luz/12-h15 (luz blanca, 2,4 kW/m2).
NOTA: Un mes es tiempo suficiente para sincronizar la población de cangrejos de río. - Determinar la hora circadiana de la población de cangrejos de río mediante la evaluación de la amplitud de los electroretinogramas de cinco animales elegidos al azar15.
NOTA: 0 h hora circadiana (CT 0) indica el comienzo de un día subjetivo, es decir,el tiempo durante el cual un organismo está normalmente activo16,17,18,19 (Figura 3). El cangrejo de río es un animal nocturno, por lo que bajo un ciclo oscuro de 12 h de luz/12 h, está activo durante la fase oscura.
- Un mes antes de los experimentos, mantener 100 cangrejos bajo un ciclo oscuro de 12 h de luz/12-h15 (luz blanca, 2,4 kW/m2).
- Procedimiento de aislamiento de Eyestalk
- A la hora circadiana deseada, anestesia un cangrejo de río seleccionado por inmersión en agua del grifo a 0-4 oC, durante 15 min.
- Por medio de una tijera fina, separe el tallo de los ojos de la base.
- Acceda a la retina con una cuchilla de afeitar para hacer una abertura (1 mmy 2) en la córnea dorsal.
- Coloque el tallo en el centro de la cámara de registro (el orificio cubierto de silicona) con la abertura de acceso a la retina en la parte superior de la cámara.
- Mantenga los ojos en constante oscuridad durante 20 minutos.
NOTA: 20 min es tiempo suficiente para que la célula del fotorreceptor esté completamente oscura adaptada.
3. Empalandamiento del fotorreceptor
- Ponga el microelectrodo y el eje longitudinal del talla ocular paralelos de tal manera que el microelectrodo esté centrado para el acceso a la retina. Utilice un microscopio estereoscópico (10X) para colocar los dispositivos en la configuración correcta.
- Supervise la diferencia de voltaje entre los electrodos de referencia y de grabación seleccionando el modo puente11 del amplificador.
- Baje el electrodo en el baño y colóquelo sobre la retina.
- Aleje el microscopio y coloque la lámpara fotoestimuladora paralela al eje longitudinal del tallo ocular.
NOTA: La distancia entre la lámpara y la cámara de superfusión es de aproximadamente 15 cm. - Reduzca lentamente el microelectrodo hasta que se detecte una caída repentina de tensión.
NOTA: Una caída de tensión de alrededor de 50 mV indica el empalamiento de una célula fotorreceptora sana. - Proporcione un flash de luz de prueba (luz blanca, 7,2 kW/m2,duración de 10 os) para registrar el potencial del receptor del fotorreceptor.
NOTA: El potencial del receptor del fotorreceptor es un potencial de despolarizante de 10-15 mV de amplitud y 300 ms de duración(Figura 4).
4. Grabación eléctrica
- Asegúrese de que las células del fotorreceptor estén totalmente adaptadas a condiciones oscuras (ver paso 2.3).
- Proporcione un flash de luz de prueba cada 2 minutos. Automatice el tiempo entre flashes eligiendo un valor adecuado (120 s) de "tiempo entre episodios" en el software de adquisición de datos.
NOTA: 2 min es el tiempo necesario para permitir la recuperación total de las corrientes subyacentes a la respuesta eléctrica del fotorreceptor. - Monitorear el potencial de la membrana en reposo, así como la amplitud y duración del potencial del receptor. Supongamos que el fotorreceptor se adapta completamente una vez que el potencial de membrana, amplitud, y la duración del potencial del receptor permanecen sin cambios. Los ojos previamente mantenidos bajo oscuridad constante durante 20 min (paso 2.3) completan su adaptación en aproximadamente 5 min.
- Deje de estimular la celda 2 minutos antes de grabar la corriente iluminada.
- Proporcione un flash de luz de prueba cada 2 minutos. Automatice el tiempo entre flashes eligiendo un valor adecuado (120 s) de "tiempo entre episodios" en el software de adquisición de datos.
- Grabación actual
- Sujete el voltaje en el valor potencial de membrana de reposo medido de la celda seleccionando "Amplitud de sujeción" en el software de adquisición de datos (en Forma de onda en la sección Canal de salida analógica).
- Seleccione el modo dSEVC del amplificador. En la sección Modo del amplificador, seleccione el botón SEVC y cambie la palanca a la posición Discont SEVC.
- Ajuste la velocidad de conmutación a 500-1.000 Hz (mediante el botón Ajuste de velocidad del amplificador), según lo determinado por la velocidad del electrodo11.
- Proporcione un destello de luz y observe la afluencia iónda.
NOTA: Esta es la corriente de transducción o de la luz provocada(Figura 5). - Vuelva al modo Puente en el amplificador y registre un potencial de receptor enviando un flash de luz (ver sección 3). Asegúrese de que la célula del fotorreceptor esté totalmente adaptada a condiciones oscuras. Mida las características potenciales del receptor (amplitud y duración) y compárela con las primeras mediciones. Supongamos que la célula fotorreceptora empalada es una célula sana si tienen las mismas características.
NOTA: Después de la ablación de los ojos, la preparación biológica es viable durante las siguientes 2 h.
- Protocolo de dos pulsos: Mida la recuperación de la desensibilización con un protocolo de dos flashes de luz.
NOTA: El protocolo de dos flash de luz es similar al protocolo de voltaje estándar de dos pulsos utilizado para medir la recuperación de la inactivación de los canales cerrados por voltaje20. El primer flash de luz causa un cambio temporal en la sensibilidad de la célula del fotorreceptor y el segundo flash evalúa el estado de la conductividad activada por la luz.- Proporcione un par de pulsos de luz. Aplique el segundo flash después de un intervalo de tiempo deseado (de 300 ms a 2 min).
- Digitalice las corrientes a muestreo de 10 KHz con el software de adquisición de datos y guarde los datos para el análisis fuera de línea11.
NOTA: Una tabla con los valores de configuración del software se incluye como material complementario.
5. Análisis de datos
- Cinética de la corriente iluminada
- Mida tres parámetros de corriente: latencia de activación L, el tiempo transcurrido desde la entrega de flash de luz hasta que la corriente alcanza el 10% de su amplitud máxima(Figura 5); amplitud de corriente máxima o pico Ip; y la constante de tiempo de desensibilización T. Mida la constante de tiempo de desensibilización (o) ajustando la fase de decaimiento actual a:
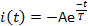
donde, A -I(t-0) es una constante positiva(Figura 5).
- Mida tres parámetros de corriente: latencia de activación L, el tiempo transcurrido desde la entrega de flash de luz hasta que la corriente alcanza el 10% de su amplitud máxima(Figura 5); amplitud de corriente máxima o pico Ip; y la constante de tiempo de desensibilización T. Mida la constante de tiempo de desensibilización (o) ajustando la fase de decaimiento actual a:
- Desensibilización y recuperación
Nota: La recuperación de la desensibilización se evaluó como la relación p2/p1, donde p1 es el parámetro relevante (L, Ipo T) de la corriente de control, y p2 es el parámetro correspondiente de la segunda corriente de prueba.- Trazar p2/p1 (ya sea L, Ip,o T) en función del tiempo entre pulsos.
- Dependiendo del parámetro, ajuste los puntos de cada trazado a:
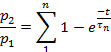
o para: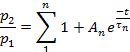
- Utilice una prueba estadística adecuada para determinar el número de términos exponenciales necesarios para ajustarse a los datos experimentales.
Resultados
En primer lugar, se obtiene un potencial receptor representativo de células fotorreceptoras de cangrejo de río(Figura 4). Posteriormente, se aplicó un flash de luz de prueba para activar la corriente de transducción de luz(Figura 5). La corriente de transducción catiónica1 se activa después de un desenlace, alcanzando un máximo y posteriormente cae lentamente en un estado absorbente desensifiado de...
Discusión
El cangrejo de río ha demostrado ser un excelente modelo debido a su capacidad para sobrevivir en condiciones no naturales. Hay fácil acceso a análisis electrofisiológicos in vivo e in vitro. Además, los crustáceos son un grupo favorable para la investigación neurobiológica en el campo de la cronobiología comparativa21.
En este artículo, el estudio de la desensibilización y recuperación de la corriente de transducción activada por la luz d...
Divulgaciones
No tenemos nada que revelar.
Agradecimientos
Este trabajo fue apoyado por la subvención DGAPA-UNAM IN224616-RN224616. Los autores quieren agradecer a la Sra. Josefina Bolado, Jefa del Departamento de Traducción de Documentos Científicos, de la División de Investigación de la Facultad de Medicina de la UNAM, unaM, por editar la versión en inglés de este manuscrito.
Materiales
| Name | Company | Catalog Number | Comments |
| Axoclamp2A | Axon Instruments Inc | Amplifier | |
| Digidata 1200 Interface | Axon Instruments Inc | Digitizer | |
| Oscilloscope TDS430A | Tektronix | Analogic Oscilloscope | |
| Photostimulator PS33 Plus | Grass | Lamp | |
| Puller PC-100 | Narishige | Micropipette Puller | |
| Puller P-97 | Sutter Instruments | Micropipette Puller | |
| Glass Capillary Tube Kimax-51 | Kimble Products | 34502 | 0.8, 1.10, 100 mm |
| HS-2 Headstage | Axon Instruments Inc | Headstage | |
| Micromanipulator MX-4 | Narishige | Mechanical Micromanipulator | |
| Stereoscopic Microscope | Zeiss | Microscope | |
| pClamp | Axon Instruments Inc | Data acquisition software for digidata 1200 interface | |
| Clampfit | Axon Instruments, Inc | Analysis software linked to pClamp | |
| Origin | OriginLab Corp. | Data analysis and graphing software | |
| Sodium Chloride | Sigma | S7653 | >99.5% |
| Potassium Chloride | Sigma | P-9333 | Minimum 99% |
| Magnesium Sulfate | Sigma | M7506 | Minimum 99.5% |
| Calcium Chloride | Sigma | C5080 | Minimum 99.0% |
| Hepes | Sigma | H7523 | >99.5% |
| Sodium Hydroxide | Sigma | S8045 | 98.00% |
| Sodium hypochlorite solution | Sigma | 425044 | Available chlorine, 10-15% |
Referencias
- Barriga-Montoya, C., Gómez-Lagunas, F., Fuentes-Pardo, B. Effect of pigment dispersing hormone on the electrical activity of crayfish visual photoreceptors during the 24-h cycle. Comp. Biochem. Physiol. A Comp. Physiol. 157 (4), 338-345 (2010).
- Barriga-Montoya, C., de la O-Martínez, A., Fuentes-Pardo, B., Gómez-Lagunas, F. Desensitization and recovery of crayfish photoreceptors. Dependency on circadian time, and pigment-dispersing hormone. Comp. Biochem. Physiol. A Comp. Physiol. 203, 297-303 (2017).
- Wickenden, A. D. Overview of electrophysiological techniques. Curr. protoc. pharmacol. 11, 1-17 (2014).
- Brette, R., Destexhe, A. Intracellular recording. Handbook of Neural Activity Measurement. , 44-91 (2012).
- Cummins, D., Goldsmith, T. H. Cellular identification of the violet receptor in the crayfish eye. J. Comp. Physiol. 142 (2), 199-202 (1981).
- Eguchi, E. Rhabdom structure and receptor potentials in single crayfish retinular cells. J. Cell and Comp. Physiol. 66, 411-430 (1965).
- Nosaki, H. Electrophysiological study of color encoding in the compound eye of crayfish, Procambarus clarkii. Z. vergl. Physiologie. 64 (3), 318-323 (1969).
- Miller, C. S., Glantz, R. M. Visual adaptation modulates a potassium conductance in retinular cells of the crayfish. Vis Neurosci. 17 (3), 353-368 (2000).
- Hamill, O. P., Marty, A., Neher, E., Sakmann, B., Sigworth, F. J. Improved patch-clamp techniques for high-resolution current recording from cells and cell-free membrane patches. Pflugers Arch. 391 (2), 85-100 (1981).
- Lishko, P., Clapham, D. E., Navarro, B., Kirichok, Y. Sperm patch-clamp. Methods Enzymol. 525, 59-79 (2013).
- Finkel, A. Axoclamp-2A microelectrode clamp theory and operation. Axon Instruments, Inc. , (1990).
- Sakmann, B. . Single-channel recording. , (2013).
- Van Harreveld, A. A physiological solution for freshwater crustacea. Proc. Soc. Exp. Biol. Med. 34 (4), 428-432 (1936).
- Oesterle, A. . pipette cookbook. , 97 (2008).
- Fuentes-Pardo, B., Ramos-Carvajal, J. The phase response curve of electroretinographic circadian rhythm of crayfish. Comp. Biochem. Physiol. A Comp. Physiol. 74 (3), 711-714 (1983).
- Pace-Schott, E. F., Hobson, J. A. The neurobiology of sleep: genetics, cellular physiology and subcortical networks. Nat. Rev. Neurosci. 3 (8), 591-605 (2002).
- Pittendrigh, C. S., Aschoff, J. On the mechanism of the entrainment of a circadian rhythm by light cycles. Circadian Clocks. , 277-297 (1965).
- Pittendrigh, C. S., Aschoff, J. Circadian systems: entrainment. Handbook Behavioral Neurobiology Biological Rhythms. , 94-124 (1981).
- Vitaterna, M. H., Takahashi, J. S., Turek, F. W. Overview of circadian rhythms. Alcohol Res. Health. 25 (2), 85-93 (2001).
- Hille, B. . Ion channels of excitable membranes. 507, (2001).
- Dircksen, H., Strauss, J. Circadian clocks in crustaceans: identified neuronal and cellular systems. Front Biosci. 15, 1040-1074 (2010).
- Terakita, A., Hariyama, T., Tsukahara, Y., Katsukura, Y., Tashiro, H. Interaction of GTP-binding protein Gq with photoactivated rhodopsin in the photoreceptor membranes of crayfish. FEBS Lett. 330, 197-200 (1993).
- Terakita, A., Takahama, H., Hariyama, T., Suzuki, T., Tsukahara, Y. Light regulated localization of the beta-subunit of Gq-type G-protein in the crayfish photoreceptors. J Comp Physiol A. 183 (4), 411-417 (1998).
- Terakita, A., Takahama, H., Tamotsu, S., Suzuki, T., Hariyama, T., Tsukahara, Y. Light-modulated subcellular localization of the alpha-subunit of GTP-binding protein Gq in crayfish photoreceptors. Vis Neurosci. 13 (3), 539-547 (1996).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados