Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Десенсибилизация и восстановление фоторецепторов раков после доставки легкого стимула
В этой статье
Резюме
Представлен протокол для изучения десенсибилизации и восстановления чувствительности фоторецепторов раков в качестве функции циркадного времени.
Аннотация
Представлен метод изучения десенсибилизации и восстановления фоторецепторов раков. Мы провели внутриклеточные электрические записи фоторецепторных клеток в изолированных глазах с использованием прерывистой конфигурации с одноэлектрическим переключенным напряжением-зажимом. Во-первых, с лезвием бритвы мы сделали отверстие в донской роговицы, чтобы получить доступ к сетчатке. После этого мы вставили стеклянный электрод через отверстие, и проникли в клетку, как сообщается в записи отрицательного потенциала. Мембранный потенциал был зажат на потенциале отдыха фоторецептора и свет-пульс был применен для активации токов. Наконец, для измерения текущей десенсибилизации и восстановления использовался два протокола о вспышках света. Первая световая вспышка запускает после периода задержки трансдукционный ионный ток, который после достижения пика амплитуды распадается к десенсибилизированному состоянию; вторая вспышка, применяемая с разной временной интервалами, оценивает состояние свето-активированной проводимости. Для характеристики светосвязанного тока были измерены три параметра: 1) задержка (время, прошедшее между доставкой вспышки света и моментом, когда ток достигает 10% от его максимального значения); 2) пикового тока; и 3) константа времени десенсибилизации (экспоненциальная константа времени текущей фазы распада). На все параметры влияет первый импульс.
Для количественной оценки восстановления после десенсибилизации использовалось соотношение p2/p1 по сравнению со временем между импульсами. p1 — это пиковое ток, вызываемый первым световым импульсом, а p2 — пиковым током, вызванным вторым импульсом. Эти данные были приспособлены к сумме экспоненциальных функций. Наконец, эти измерения были проведены в качестве функции циркадного времени.
Введение
Для того, чтобы восприниматься как визуальный стимул, свет, достигающий глаз, должен быть преобразован в электрический сигнал. Следовательно, во всех зрительных организмах свет вызывает трансдукционный ионный ток, который, в свою очередь, производит изменение мембранного потенциала фоторецепторных клеток, так называемого рецепторного потенциала. Из-за этого светочувствительность глаза в первую очередь зависит от состояния светоактивированной проводимости, которая может быть либо доступна для активации, либо десенсибилизирована.
В фоторецепторах раков свет вызывает медленный, переходный, ионный ток1. При освещении трансдукционный ток возникает после задержки или задержки до достижения своего максимума; после этого он распадается, так как каналы трансдукции попадают в десенсибилизированное состояние, в котором они не реагируют на дальнейший свет стимул2. То есть, свет, в дополнение к активации трансдукционного тока, отвечающего за зрение, также вызывает переходное декременцию чувствительности фоторецепторных клеток. Десенсибилизация может представлять собой общий защитный механизм против чрезмерного воздействия адекватного стимула. Чувствительность глаза к свету восстанавливается по мере восстановления трансдукции после десенсибилизации.
Внутриклеточная запись является полезным методом измерения электрической активности возбудимых клеток3,4,5,6,7. Хотя внутриклеточная запись стала менее частой с появлением патч-зажима техники9,это все еще удобный подход, когда клетки либо трудно изолировать, или представить геометрию, что делает формирование патч-зажимных гига-уплотнений трудно(т.е.,уплотнения или плотные контакты между патч электрод и мембраны с электрическим сопротивлением порядка 10ohms). Примерами последних являются сперматозоиды10 и изученные фоторецепторные клетки. По нашему опыту, фоторецепторы Procambarus clarkii трудно изолировать и сохранить в первичной культуре; кроме того, они являются тонкими стержнями, которые делают гига-печать формирования трудно достичь. Во внутриклеточных записях острый электрод превращается в клетку, которая удерживается на месте окружающими тканями. Электрод рубится высокоскоростной схемой переключения усилителя, поэтому ток пробирается между импульсами напряжения. Этот режим известен как прерывистый зажим одноэлектронного напряжения (режим dSEVC)11. Высокое сопротивление (небольшое отверстие) электрода препятствует диффузионному обмену между клеткой и растворами пипетки, что дает минимальное нарушение внутриклеточной среды3. Потенциальным недостатком этого метода является то, что вставка электрода может привести к неселективному току утечки; поэтому необходимо проявлять осторожность, чтобы избежать записи из клеток, где размер тока утечки может помешать предполагаемым измерениям4,12.
В этом случае мы используем изолированные глаза раков для оценки десенсибилизации и восстановления светоактивной ионной проводимости путем выполнения внутриклеточных электрических записей фоторецепторных клеток в условиях зажима напряжения.
протокол
ПРИМЕЧАНИЕ: Эксперименты соответствуют законам защиты животных Мексики.
1. Экспериментальная настройка
- Общие соединения
- Подключите усилитель к подходящему компьютеру с помощью аналогового цифрового конвертера и используйте осциллоскоп для мониторинга эксперимента(рисунок 1).
- Подключите фототимилиатор к преобразованию A/D.
- Камера звукозаписи
- Поместите камеру звукозаписи на столе против вибрации и найдите его в клетке Фарадея.
ПРИМЕЧАНИЕ: Это предотвращает механическую вибрацию и электрический шум, который может повлиять на запись. Наша клетка Фарадея была сделана из затемненной проволочного сетки. Используется самодельная, 2 мл, акриловая камера записи(рисунок 2). - Подготовьте решение ванны для того чтобы держать подготовкуживой 13: 205 mM NaCl; 5 мМ KCl; 2 мМ MgSO4; 13 mM CaCl2; 5 мМ Хепес-НаОХ, рН 7,3.
ПРИМЕЧАНИЕ: Решение не включает декстрозу или любой пузырьков на 95% O2, 5% CO2 смеси, потому что экспериментальная процедура достаточно коротка, чтобы обнаружить повреждения электрической записи (см. шаг 4.2.3 для полноты).
- Поместите камеру звукозаписи на столе против вибрации и найдите его в клетке Фарадея.
- Электроды
- Используйте электрод из серебристого провода с хлоридом в качестве эталонного электрода
ПРИМЕЧАНИЕ: Серебряное хлоридовое покрытие необходимо для того, чтобы электродная реакция: AgCl (ы) и e↔Ag (ы) и Cl-. - Песок серебряной проволоки (толстость 1 мм, длина 10 см) с тонкой бумагой эмери для очистки его поверхности.
- Промыть серебряную проволоку дистиллированной водой.
- Погрузите чистую серебряную проволоку в раствор гипохлорит натрия 4-6% (NaClO) до тех пор, пока он не окажется темным (примерно 20 мин).
- Используйте тонкие стеклянные пипетки, наполненные раствором электролита (2,7 М КЛ) в качестве внутриклеточного электрода.
- Потяните стеклянную капиллярную трубку (внутренний диаметр 1 мм) с помощью выдвиженца микропипетты, чтобы получить тонкий наконечник с небольшим отверстием (0,01-0,1 мкм)14.
- Заполните вытянутое капиллярное стекло раствором 2,7 м KCl. Сначала заполните его капиллярностью (погрузите кончик пипетки в раствор 2,7 М KCl), а затем заполните половину пипетки тонкой иглой для инъекций. При необходимости коснитесь электродной пипетки, чтобы устранить пузырьки воздуха.
- Подключите электрод к его держателю. Подключите держатель к головной укладу усилителя с усилителем. Расположите электрод-держатель-головной убор со стабильным 3-D микроманипулятором. Опустите электрод до тех пор, пока раствор ванны не покроет свой кончик.
ПРИМЕЧАНИЕ: Электрод должен иметь вертикальную ориентацию
- Используйте электрод из серебристого провода с хлоридом в качестве эталонного электрода
- Выберите режим усилителя моста (в разделе режима усилителя, нажмите кнопку Моста) и измерьте сопротивление электрода. Убедитесь, что сопротивление составляет около 50 МЗ11.
ПРИМЕЧАНИЕ: Этот размер электрода позволяет хорошее качество электрической записи с ограниченным повреждением ячейки. - Снизовать офсетный ток и компенсировать емкостные переходные с помощью кнопки Удержания позиции в разделе Зажим напряжения усилителя и кнопки нейтрализации емкостя в микроэлектроде 1 секции усилителя.
- Система суперфузии
- Налейте раствор ванны (шаг 1.2.2) в подходящий сосуд (бутылка сыворотки 250 мл) и соедините его с набором оросительных труб (3,2 мм внутреннего диаметра), тем самым соединяя камеру звукозаписи. Используйте гравитационную систему сверхфузива. Регулируйте скорость потока до 0,5 мл/с.
- Подключите камеру к всасывающему устройству. Регулируйте систему всасывания раствора таким образом, чтобы общий объем камеры звукозаписи не меняться. Используйте вакуумный насос для всасывания.
ПРИМЕЧАНИЕ: Постоянный объем в камере записи имеет важное значение для поддержания конденсаций на протяжении всего эксперимента.
2. Биологический материал
Примечание: Используйте взрослых раков P. clarkii (7-10 см в длину) в стадии интермольты невнятного секса.
- Circadian время
- За месяц до экспериментов, поддерживать 100 раков под 12-h свет / 12-h темный цикл15 (белый свет, 2,4 кВт /м2).
ПРИМЕЧАНИЕ: Один месяц достаточно времени, чтобы синхронизировать популяцию раков. - Определить циркадное время популяции раков путем оценки амплитуды электроретинограмм пяти случайно выбранных животных15.
ПРИМЕЧАНИЕ: 0 ч циркадного времени (CT 0) указывает на начало субъективного дня, т.е.время, в течение которого организм обычно активен16,17,18,19 (Рисунок 3). Раки ночных животных, так что под 12-h свет / 12-h темный цикл, он активен во время темной фазы.
- За месяц до экспериментов, поддерживать 100 раков под 12-h свет / 12-h темный цикл15 (белый свет, 2,4 кВт /м2).
- Процедура изоляции глаз
- В нужное циркадное время, анестезируйте выбранных раков путем погружения в водопроводную воду при 0-4 градусах по Цельсию, в течение 15 мин.
- С помощью тонкого ножница, отсоедините глазной стебель от основания.
- Доступ к сетчатке с помощью лезвия бритвы, чтобы сделать отверстие (1 мм2) в области роговицы.
- Поместите глазной стебель в центре камеры записи (отверстие, покрытое силиконом) с отверстием доступа к сетчатке в верхней части камеры.
- Держите глазной talk в постоянной темноте в течение 20 минут.
ПРИМЕЧАНИЕ: 20 мин достаточно времени для фоторецептора клетки, чтобы быть полностью темной адаптированы.
3. Фоторецептор Impaling
- Поставьте микроэлектрод и продольную ось глаз нойся параллель таким образом, чтобы микроэлектрод был сосредоточен для доступа к сетчатке. Используйте стереоскопический микроскоп (10X) для размещения устройств в правильной конфигурации.
- Отслеживайте разницу напряжения между эталонными и записывающими электродами, выбрав режим моста11 усилителя.
- Опустите электрод в ванну, а затем поместите его прямо над сетчаткой.
- Отойдите от микроскопа и расположите лампу фототимулятора параллельно продольной оси глаза.
ПРИМЕЧАНИЕ: Расстояние между лампой и камерой излжания составляет около 15 см. - Медленно опустите микроэлектрод до тех пор, пока не будет обнаружено внезапное падение напряжения.
ПРИМЕЧАНИЕ: Падение напряжения около 50 мВ указывает на прокол здоровой фоторецепторной клетки. - Для записи потенциала рецептора фоторецептора (белый свет, 7,2 кВт/м 2,00) выполнит тест-вспышку света.
ПРИМЕЧАНИЕ: Потенциал рецептора фоторецептора является деполяризующим потенциалом амплитуды 10-15 мВ и продолжительности 300 мс(рисунок 4).
4. Электрическая запись
- Убедитесь, что фоторецепторные клетки полностью адаптированы к темным условиям (см. шаг 2.3).
- Доставьте вспышку тестового света каждые 2 минуты. Автоматите время между вспышками, выбрав адекватное значение (120 с) "времени между эпизодами" в программном обеспечении для сбора данных.
ПРИМЕЧАНИЕ: 2 мин является необходимым временем, чтобы обеспечить полное восстановление токов, лежащих в основе электрического ответа фоторецептора. - Мониторинг потенциала покоя мембраны, а также амплитуды и продолжительности потенциала рецептора. Предположим, что фоторецептор полностью адаптируется после того, как мембранный потенциал, амплитуда, и продолжительность потенциала рецептора остаются неизменными. Eyestalks ранее держали в постоянной темноте в течение 20 минут (шаг 2.3) завершить их адаптации примерно в 5 минут.
- Прекратите стимулировать клетку 2 мин перед записью свето-илированного тока.
- Доставьте вспышку тестового света каждые 2 минуты. Автоматите время между вспышками, выбрав адекватное значение (120 с) "времени между эпизодами" в программном обеспечении для сбора данных.
- Текущая запись
- Зажим напряжения на измеренной мембраны отдыха потенциальной стоимости клетки, выбрав "Холдинг амплитуда" в программном обеспечении для сбора данных (в Waveform на разделе Analog Выходного канала).
- Выберите режим усилителя dSEVC. В разделе Режим усилителя выберите кнопку SEVC и переключите рычаг на позицию Discont SEVC.
- Установите скорость переключения до 500-1000 Гц (с помощью кнопки настройки скорости усилителя), определяемой скоростью электрода11.
- Доставьте световую вспышку и наблюдайте за вызванным притоком ионов.
ПРИМЕЧАНИЕ: Это светосвязанный или трансдукционный ток(рисунок 5). - Вернуться в режим моста на усилителе и записать потенциал рецептора, отправив световую вспышку (см. раздел 3). Убедитесь, что фоторецепторная клетка полностью адаптирована к темным условиям. Измерьте потенциальные характеристики рецепторов (амплитуду и продолжительность) и сравните с первыми измерениями. Предположим, что проколотная фоторецепторная клетка является здоровой клеткой, если они имеют те же характеристики.
ПРИМЕЧАНИЕ: После абляции глазной лакли, биологическая подготовка жизнеспособна в течение следующих 2 ч.
- Два импульсных протокола: Измерьте восстановление после десенсибилизации с помощью протокола с двумя световыми вспышками.
ПРИМЕЧАНИЕ: Протокол двух световых флэш-накопителей похож на стандартный двухимпульсный протокол напряжения, используемый для измерения восстановления после инактивации каналов напряжения20. Первая световая вспышка вызывает временное изменение чувствительности фоторецепторной клетки, а вторая вспышка оценивает состояние свето-активированной проводимости.- Доставьте пару световых импульсов. Нанесите вторую вспышку после желаемого интервала времени (от 300 мс до 2 мин).
- Оцифровка токов при выборке 10 КГц с помощью программного обеспечения для сбора данных и сохранение данных для автономного анализа11.
ПРИМЕЧАНИЕ: Таблица со значениями конфигурации программного обеспечения включена в качестве дополнительного материала.
5. Анализ данных
- Кинетика свето-вызываемого тока
- Измерьте три текущих параметра: задержка активации L, время, прошедшее от доставки световой вспышки, до достижения током 10% от его максимальной амплитуды(рисунок 5); пик овперная или максимальная амплитуда тока Ip; и десенсибилизации время постоянной T. Измерьте время десенсибилизации постоянной (я) путем установки текущей фазы распада на:
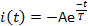
где, А -I (t'0) является положительнойпостоянной (рисунок 5).
- Измерьте три текущих параметра: задержка активации L, время, прошедшее от доставки световой вспышки, до достижения током 10% от его максимальной амплитуды(рисунок 5); пик овперная или максимальная амплитуда тока Ip; и десенсибилизации время постоянной T. Измерьте время десенсибилизации постоянной (я) путем установки текущей фазы распада на:
- Десенсибилизация и восстановление
Примечание: Восстановление от десенсибилизации оценивалось как соотношение p2/p1, где p1 является соответствующим параметром (или L, Ip,или T) элемента управления тока, а p2 является соответствующим параметром второго тест-тока.- Участок p2/p1 (или L, ip,или T) как функция времени между импульсами.
- В зависимости от параметра, подходят точки каждого участка:
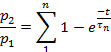
или: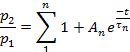
- Используйте соответствующий статистический тест для определения количества экспоненциальных терминов, необходимых для соответствия экспериментальным данным.
Результаты
Во-первых, получается представительный рецепторный потенциал фоторецепторных клеток раков(рисунок 4). После этого, испытание световой вспышки был применен для запуска светтрансатов тока(рисунок 5). Катионный трансдукционный ток
Обсуждение
Раки оказались отличной моделью из-за своей способности выживать в неестественных условиях. Существует легкий доступ к in vivo и in vitro электрофизиологических анализов. Кроме того, ракообразные являются благоприятной группой для нейробиологических исследований в области сравни...
Раскрытие информации
Нам нечего раскрывать.
Благодарности
Эта работа была поддержана грантом DGAPA-UNAM IN224616-RN2224616. Авторы хотят поблагодарить г-жу Хосефина Боладо, руководителя Отдела научного перевода документов, от Диверсион де Инвестигацион в Факультете Медицины, НАУ, за редактирование англоязычной версии этой рукописи.
Материалы
| Name | Company | Catalog Number | Comments |
| Axoclamp2A | Axon Instruments Inc | Amplifier | |
| Digidata 1200 Interface | Axon Instruments Inc | Digitizer | |
| Oscilloscope TDS430A | Tektronix | Analogic Oscilloscope | |
| Photostimulator PS33 Plus | Grass | Lamp | |
| Puller PC-100 | Narishige | Micropipette Puller | |
| Puller P-97 | Sutter Instruments | Micropipette Puller | |
| Glass Capillary Tube Kimax-51 | Kimble Products | 34502 | 0.8, 1.10, 100 mm |
| HS-2 Headstage | Axon Instruments Inc | Headstage | |
| Micromanipulator MX-4 | Narishige | Mechanical Micromanipulator | |
| Stereoscopic Microscope | Zeiss | Microscope | |
| pClamp | Axon Instruments Inc | Data acquisition software for digidata 1200 interface | |
| Clampfit | Axon Instruments, Inc | Analysis software linked to pClamp | |
| Origin | OriginLab Corp. | Data analysis and graphing software | |
| Sodium Chloride | Sigma | S7653 | >99.5% |
| Potassium Chloride | Sigma | P-9333 | Minimum 99% |
| Magnesium Sulfate | Sigma | M7506 | Minimum 99.5% |
| Calcium Chloride | Sigma | C5080 | Minimum 99.0% |
| Hepes | Sigma | H7523 | >99.5% |
| Sodium Hydroxide | Sigma | S8045 | 98.00% |
| Sodium hypochlorite solution | Sigma | 425044 | Available chlorine, 10-15% |
Ссылки
- Barriga-Montoya, C., Gómez-Lagunas, F., Fuentes-Pardo, B. Effect of pigment dispersing hormone on the electrical activity of crayfish visual photoreceptors during the 24-h cycle. Comp. Biochem. Physiol. A Comp. Physiol. 157 (4), 338-345 (2010).
- Barriga-Montoya, C., de la O-Martínez, A., Fuentes-Pardo, B., Gómez-Lagunas, F. Desensitization and recovery of crayfish photoreceptors. Dependency on circadian time, and pigment-dispersing hormone. Comp. Biochem. Physiol. A Comp. Physiol. 203, 297-303 (2017).
- Wickenden, A. D. Overview of electrophysiological techniques. Curr. protoc. pharmacol. 11, 1-17 (2014).
- Brette, R., Destexhe, A. Intracellular recording. Handbook of Neural Activity Measurement. , 44-91 (2012).
- Cummins, D., Goldsmith, T. H. Cellular identification of the violet receptor in the crayfish eye. J. Comp. Physiol. 142 (2), 199-202 (1981).
- Eguchi, E. Rhabdom structure and receptor potentials in single crayfish retinular cells. J. Cell and Comp. Physiol. 66, 411-430 (1965).
- Nosaki, H. Electrophysiological study of color encoding in the compound eye of crayfish, Procambarus clarkii. Z. vergl. Physiologie. 64 (3), 318-323 (1969).
- Miller, C. S., Glantz, R. M. Visual adaptation modulates a potassium conductance in retinular cells of the crayfish. Vis Neurosci. 17 (3), 353-368 (2000).
- Hamill, O. P., Marty, A., Neher, E., Sakmann, B., Sigworth, F. J. Improved patch-clamp techniques for high-resolution current recording from cells and cell-free membrane patches. Pflugers Arch. 391 (2), 85-100 (1981).
- Lishko, P., Clapham, D. E., Navarro, B., Kirichok, Y. Sperm patch-clamp. Methods Enzymol. 525, 59-79 (2013).
- Finkel, A. Axoclamp-2A microelectrode clamp theory and operation. Axon Instruments, Inc. , (1990).
- Sakmann, B. . Single-channel recording. , (2013).
- Van Harreveld, A. A physiological solution for freshwater crustacea. Proc. Soc. Exp. Biol. Med. 34 (4), 428-432 (1936).
- Oesterle, A. . pipette cookbook. , 97 (2008).
- Fuentes-Pardo, B., Ramos-Carvajal, J. The phase response curve of electroretinographic circadian rhythm of crayfish. Comp. Biochem. Physiol. A Comp. Physiol. 74 (3), 711-714 (1983).
- Pace-Schott, E. F., Hobson, J. A. The neurobiology of sleep: genetics, cellular physiology and subcortical networks. Nat. Rev. Neurosci. 3 (8), 591-605 (2002).
- Pittendrigh, C. S., Aschoff, J. On the mechanism of the entrainment of a circadian rhythm by light cycles. Circadian Clocks. , 277-297 (1965).
- Pittendrigh, C. S., Aschoff, J. Circadian systems: entrainment. Handbook Behavioral Neurobiology Biological Rhythms. , 94-124 (1981).
- Vitaterna, M. H., Takahashi, J. S., Turek, F. W. Overview of circadian rhythms. Alcohol Res. Health. 25 (2), 85-93 (2001).
- Hille, B. . Ion channels of excitable membranes. 507, (2001).
- Dircksen, H., Strauss, J. Circadian clocks in crustaceans: identified neuronal and cellular systems. Front Biosci. 15, 1040-1074 (2010).
- Terakita, A., Hariyama, T., Tsukahara, Y., Katsukura, Y., Tashiro, H. Interaction of GTP-binding protein Gq with photoactivated rhodopsin in the photoreceptor membranes of crayfish. FEBS Lett. 330, 197-200 (1993).
- Terakita, A., Takahama, H., Hariyama, T., Suzuki, T., Tsukahara, Y. Light regulated localization of the beta-subunit of Gq-type G-protein in the crayfish photoreceptors. J Comp Physiol A. 183 (4), 411-417 (1998).
- Terakita, A., Takahama, H., Tamotsu, S., Suzuki, T., Hariyama, T., Tsukahara, Y. Light-modulated subcellular localization of the alpha-subunit of GTP-binding protein Gq in crayfish photoreceptors. Vis Neurosci. 13 (3), 539-547 (1996).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены