Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Désensibilisation et récupération des photorécepteurs d'écrevisses à la livraison d'un stimulus léger
Dans cet article
Résumé
Un protocole pour l'étude de la désensibilisation et de la récupération de sensibilité des photorécepteurs d'écrevisses en fonction du temps circadien est présenté.
Résumé
Une méthode pour étudier la désensibilisation et la récupération des photorécepteurs d'écrevisses est présentée. Nous avons exécuté des enregistrements électriques intracellulaires des cellules de photorécepteur dans les yeux isolés utilisant la configuration de tension-clamp simple discontinuous d'électrode-switched. Tout d'abord, avec une lame de rasoir, nous avons fait une ouverture dans la cornée dorsale pour avoir accès à la rétine. Par la suite, nous avons inséré une électrode de verre à travers l'ouverture, et pénétré une cellule comme indiqué par l'enregistrement d'un potentiel négatif. Le potentiel de membrane a été serré au potentiel de repos du photorécepteur et une impulsion lumineuse a été appliquée pour activer des courants. Enfin, le protocole de deux flash s'est vu utilisé pour mesurer la désensibilisation et la récupération actuelles. Le premier flash lumineux déclenche, après une période de décalage, le courant ionique de transduction qui, après avoir atteint un pic d'amplitude, se désintègre vers un état désensibilisé; le deuxième flash, appliqué à intervalles de temps variables, évalue l'état de la conductance activée par la lumière. Pour caractériser le courant lumineux, trois paramètres ont été mesurés : 1) la latence (le temps écoulé entre la livraison du flash lumineux et le moment où le courant atteint 10 % de sa valeur maximale); 2) le courant de pointe; et 3) temps de désensibilisation constant (constante de temps exponentielle de la phase actuelle de décomposition). Tous les paramètres sont affectés par la première impulsion.
Pour quantifier le rétablissement de la désensibilisation, le rapport p2/p1 a été employé par rapport au temps entre les impulsions. p1 est le courant de pointe évoqué par la première impulsion lumineuse, et p2 est le courant de pointe évoqué par la deuxième impulsion. Ces données ont été adaptées à une somme de fonctions exponentielles. Enfin, ces mesures ont été effectuées en fonction du temps circadien.
Introduction
Pour être perçu comme un stimulus visuel, la lumière atteignant les yeux doit être transduie dans un signal électrique. Ainsi, dans tous les organismes visuels, la lumière déclenche un ion-courant de transduction, qui à son tour produit un changement dans le potentiel membranaire des cellules photoréceptrices, le potentiel dit de récepteur. Pour cette raison, la sensibilité de la lumière de l'œil dépend principalement de l'état de la conductance activée par la lumière, qui peut être disponible pour être activé ou désensibilisé.
Dans les photorécepteurs d'écrevisses, la lumière déclenche un courant lent, transitoire et ionique1. Lors de l'illumination, le courant de transduction surgit après un décalage ou une latence avant d'atteindre son maximum; par la suite, il se désintègre, comme les canaux de transduction tombent dans un état désensibilisé dans lequel ils ne répondent pas à d'autres stimulus léger2. C'est-à-dire que la lumière, en plus d'activer le courant de transduction responsable de la vision, induit également une décrement transitoire de la sensibilité des cellules photoréceptrices. La désensibilisation peut représenter un mécanisme de protection général contre la surexposition à un stimulus adéquat. La sensibilité de l'œil à la lumière est récupérée lorsque la conductance de la transduction se remet d'une désensibilisation.
L'enregistrement intracellulaire est une technique utile pour mesurer l'activité électrique des cellules excitables3,4,5,6,7,8. Bien que l'enregistrement intracellulaire soit devenu moins fréquent avec l'avènement de la technique de patch-clamp9, il est toujours une approche commode quand les cellules sont soit difficiles à isoler, ou présentent une géométrie qui rend la formation des giga-scellements patch-clamping difficile(c.-à-d., joints ou étroits-contacts entre l'électrode de correction et les membranes avec la résistance électrique de l'ordre de 109ohms). Des exemples de ces derniers sont les spermatozoïdes10 et les cellules photoréceptrices étudiées. D'après notre expérience, les photorécepteurs Procambarus clarkii sont difficiles à isoler et à conserver dans la culture primaire; en outre, ce sont des tiges minces qui rendent la formation giga-sceau difficile à atteindre. Dans les enregistrements intracellulaires, une électrode pointue est avancée dans une cellule qui est maintenue en place par le tissu environnant. L'électrode est coupée par les circuits de commutation à grande vitesse de l'amplificateur, de sorte que le courant est échantillonné entre les impulsions de tension. Ce mode est connu sous le nom de pince discontinu de tension à une électrode (mode dSEVC)11. La résistance élevée (petite ouverture) de l'électrode entrave l'échange de diffusion entre la cellule et les solutions de pipette, ce qui donne une perturbation minimale du milieu intracellulaire3. Un inconvénient potentiel de cette technique est que l'insertion d'électrode peut produire un courant de fuite non sélectif ; par conséquent, il faut prendre soin d'éviter l'enregistrement à partir de cellules où la taille du courant de fuite peut interférer avec les mesures prévues4,12.
Ici, nous utilisons des tiges isolées d'écrevisses pour évaluer la désensibilisation et la récupération de la conductance d'ion activée par la lumière en effectuant des enregistrements électriques intracellulaires des cellules photorécepteurs dans des conditions de pince de tension.
Protocole
REMARQUE : Les expériences sont conformes aux Lois de protection des animaux du Mexique.
1. Configuration expérimentale
- Connexions générales
- Connectez l'amplificateur à un ordinateur approprié au moyen d'un convertisseur analogique au numérique et utilisez un oscilloscope pour surveiller l'expérience (Figure 1).
- Connectez le phototimulator au convertis A/D.
- Chambre d'enregistrement
- Placez la chambre d'enregistrement sur une table anti-vibration et placez-la à l'intérieur d'une cage de Faraday.
REMARQUE : Cela empêche les vibrations mécaniques et les bruits électriques qui peuvent affecter l'enregistrement. Notre cage de Faraday était faite de grillage noirci. Une chambre d'enregistrement en acrylique faite maison, 2 mL, est utilisée (Figure 2). - Préparer la solution de bain pour maintenir la préparation en vie13: 205 mM NaCl; 5 mM KCl; 2 mM MgSO4; 13 mM CaCl2; 5 mM Hepes-NaOH, pH 7,3.
REMARQUE: La solution n'inclut pas le dextrose ou tout bouillonnement de 95% O2, 5% CO2 mélange parce que la procédure expérimentale est assez courte pour détecter les dommages par l'enregistrement électrique (voir l'étape 4.2.3 pour l'exhaustivité).
- Placez la chambre d'enregistrement sur une table anti-vibration et placez-la à l'intérieur d'une cage de Faraday.
- Électrodes
- Utilisez une électrode enduite de fil d'argent recouverte de chlorure comme électrode de référence
REMARQUE : Le revêtement de chlorure d'argent est nécessaire pour permettre la réaction d'électrode : AgCl (s) ete ↔Ag(s) et Cl-. - Sablez un fil d'argent (épaisseur de 1 mm, longueur de 10 cm) avec un papier émeri de qualité fine afin de nettoyer sa surface.
- Rincer le fil d'argent avec de l'eau distillée.
- Immerger le fil d'argent propre dans une solution d'hypochlorite de sodium de 4 à 6 % (NaClO) jusqu'à ce qu'il semble foncé (environ 20 min).
- Utilisez de fines pipettes en verre remplies d'une solution d'électrolyte (2,7 M KCl) comme électrode intracellulaire.
- Tirez un tube capillaire en verre (diamètre interne de 1 mm) à l'aide d'une tireuse micropipette pour obtenir une fine pointe avec une petite ouverture (0,01-0,1 m)14.
- Remplissez le verre capillaire tiré d'une solution de 2,7 M KCl. Remplissez d'abord par capillarité (plongez la pointe de pipette dans la solution de 2,7 M KCl) puis remplissez la moitié de la pipette avec une aiguille d'injection fine. Si nécessaire, appuyez sur la pipette d'électrode pour éliminer les bulles d'air.
- Connectez l'électrode à son support. Connectez le support à la tête de l'amplificateur avec l'amplificateur. Placez le poste de tête porte-électrodes avec un micromanipulateur 3D stable. Abaissez l'électrode jusqu'à ce que la solution de bain couvre sa pointe.
REMARQUE : L'électrode doit avoir une orientation verticale
- Utilisez une électrode enduite de fil d'argent recouverte de chlorure comme électrode de référence
- Sélectionnez le mode Pont de l'amplificateur (dans la section Mode de l'amplificateur, appuyez sur le bouton Bridge) et mesurez la résistance à l'électrode. Assurez-vous que la résistance est d'environ 50 M11.
REMARQUE : Cette taille d'électrode permet un enregistrement électrique de bonne qualité avec des dommages limités à la cellule. - Annuler le courant de compensation et compenser les transitoires capacitifs à l'aide du bouton Position de fixation dans la section Tension Clamp de l'amplificateur, et le bouton de neutralisation de la capacité dans la section Microélectrode 1 de l'amplificateur.
- Système de superfusion
- Verser la solution de bain (étape 1.2.2) dans un réceptacle approprié (une bouteille de sérum de 250 ml) et la connecter à un ensemble de tubes d'irrigation (3,2 mm de diamètre interne), reliant ainsi la chambre d'enregistrement. Utilisez un système de superfusion gravitationnel. Réglementer le débit à 0,5 ml/s.
- Connectez la chambre à un dispositif d'aspiration. Réglementer le système d'aspiration de solution de telle sorte que le volume total de la chambre d'enregistrement ne varie pas. Utilisez une pompe à vide pour l'aspiration.
REMARQUE : Un volume constant dans la chambre d'enregistrement est important pour maintenir les capacitances errantes constantes tout au long de l'expérience.
2. Matériel biologique
Remarque : Utilisez des écrevisses adultes P. clarkii (7-10 cm de long) au stade intermolt du sexe indistincte.
- Heure circadienne
- Un mois avant les expériences, maintenir 100 écrevisses sous un cycle sombre de 12 h/12 h15 (lumière blanche, 2,4 kW/m2).
REMARQUE : Un mois est suffisant pour synchroniser la population d'écrevisses. - Déterminer le temps circadien de la population d'écrevisses en évaluant l'amplitude des électrorétinogrammes de cinq animaux choisis au hasard15.
REMARQUE: 0 h temps circadien (CT 0) indique le début d'une journée subjective, c'est-à-à-d., le temps au cours duquel un organisme est normalement actif16,17,18,19 ( Figure3). L'écrevisse est un animal nocturne, donc sous un cycle sombre de 12 h/ 12 h, il est actif pendant la phase sombre.
- Un mois avant les expériences, maintenir 100 écrevisses sous un cycle sombre de 12 h/12 h15 (lumière blanche, 2,4 kW/m2).
- Procédure d'isolement Eyestalk
- Au moment circadien désiré, anesthésiez une écrevisse sélectionnée par immersion dans l'eau du robinet à 0-4 oC, pendant 15 min.
- Au moyen d'un ciseaux fins, détachez le regard de la base.
- Accédez à la rétine à l'aide d'une lame de rasoir pour faire une ouverture (1 mm2) dans la cornée dorsale.
- Placez le couvre-yeux au centre de la chambre d'enregistrement (le trou recouvert de silicone) avec l'ouverture d'accès à la rétine sur le dessus de la chambre.
- Gardez le regard dans l'obscurité constante pendant 20 min.
REMARQUE : 20 min est suffisamment de temps pour que la cellule photoréceptrice soit entièrement adaptée à l'obscurité.
3. Impaling photorécepteur
- Mettez le microélectrode et l'axe longitudinal de la tige des yeux parallèles de telle sorte que le microélectrode est centré pour l'accès à la rétine. Utilisez un microscope stéréoscopique (10X) pour placer les appareils dans la configuration correcte.
- Surveillez la différence de tension entre les électrodes de référence et d'enregistrement en sélectionnant le modepont 11 de l'amplificateur.
- Baissez l'électrode dans le bain et placez-la par la suite juste au-dessus de la rétine.
- Éloignez le microscope et placez la lampe phototimulator parallèle à l'axe longitudinal de la bande oculaire.
REMARQUE : La distance entre la lampe et la chambre de superfusion est d'environ 15 cm. - Abaissez lentement le microélectrode jusqu'à ce qu'une chute soudaine de tension soit détectée.
REMARQUE : Une chute de tension d'environ 50 mV indique l'empalement d'une cellule photoréceptrice saine. - Fournir un flash lumineux d'essai (lumière blanche, 7,2 kW/m2, durée de 10 euros) pour enregistrer le potentiel récepteur du photorécepteur.
REMARQUE : Le potentiel de récepteur du photorécepteur est un potentiel de dépolarisation de 10 à 15 mV d'amplitude et de 300 ms de durée(figure 4).
4. Enregistrement électrique
- Assurez-vous que les cellules photoréceptrices sont totalement adaptées aux conditions sombres (voir l'étape 2.3).
- Fournir un flash de lumière de test toutes les 2 minutes. Automatisez le temps entre les flashs en choisissant une valeur adéquate (120 s) de « temps entre les épisodes » dans le logiciel d'acquisition de données.
REMARQUE : 2 min est le temps nécessaire pour permettre la récupération totale des courants sous-jacents à la réponse électrique du photorécepteur. - Surveillez le potentiel de la membrane de repos, ainsi que l'amplitude et la durée du potentiel récepteur. Supposons que le photorécepteur est complètement adapté une fois que le potentiel de la membrane, l'amplitude et la durée du potentiel du récepteur demeurent inchangés. Les yeux précédemment maintenus dans l'obscurité constante pendant 20 min (étape 2.3) complètent leur adaptation en environ 5 min.
- Arrêtez de stimuler la cellule 2 min avant d'enregistrer le courant lumineux.
- Fournir un flash de lumière de test toutes les 2 minutes. Automatisez le temps entre les flashs en choisissant une valeur adéquate (120 s) de « temps entre les épisodes » dans le logiciel d'acquisition de données.
- Enregistrement actuel
- Clamp la tension à la valeur potentielle mesurée de la membrane de repos de la cellule en sélectionnant "Holding amplitude" dans le logiciel d'acquisition de données (dans Waveform sur la section Analog Output Channel).
- Sélectionnez le mode dSEVC de l'amplificateur. Dans la section Mode de l'amplificateur, sélectionnez le bouton SEVC et basculez le levier vers la position Discont SEVC.
- Réglez le taux de commutation à 500-1000 Hz (en utilisant le bouton D'ajustement de taux de l'amplificateur), tel que déterminé par la vitesse de l'électrode11.
- Délivrez un flash lumineux, et observez l'afflux d'ions évoqué.
REMARQUE : Il s'agit du courant de transduction ou de transduction allumé par la lumière (figure 5). - Retour au mode Bridge sur l'amplificateur et enregistrer un potentiel récepteur en envoyant un flash lumineux (voir la section 3). Assurez-vous que la cellule photoréceptrice est totalement adaptée aux conditions sombres. Mesurer les caractéristiques potentielles des récepteurs (amplitude et durée) et comparer avec les premières mesures. Supposons que la cellule photoréceptrice empalée est une cellule saine si elles ont les mêmes caractéristiques.
REMARQUE : Après l'ablation de la tige des yeux, la préparation biologique est viable pendant les 2 heures suivantes.
- Protocole de deux impulsions : Mesurez la récupération de la désensibilisation à l'égard d'un protocole à deux éclairs.
REMARQUE : Le protocole de deux flash-lumière est semblable au protocole standard de tension à deux impulsions utilisé pour mesurer la récupération de l'inactivation des canaux à rayons de tension20. Le premier flash lumineux provoque un changement temporaire de la sensibilité de la cellule photoréceptrice et le second flash évalue l'état de la conductance activée par la lumière.- Apportez une paire d'impulsions lumineuses. Appliquer le deuxième flash après un intervalle de temps souhaité (de 300 ms à 2 min).
- Numérisez les courants à l'échantillonnage de 10 KHz avec le logiciel d'acquisition de données et enregistrez les données pour l'analyse hors ligne11.
REMARQUE : Une table avec les valeurs de configuration du logiciel est incluse comme matériel supplémentaire.
5. Analyse des données
- Cinétique du courant lumineux
- Mesurer trois paramètres actuels : la latence d'activation L, le temps écoulé entre la livraison du flash lumineux jusqu'à ce que le courant atteigne 10 % de son amplitude maximale (figure 5); amplitude maximale de courant ou maximum Ip; et temps de désensibilisation constant T. Mesurer le temps de désensibilisation constant () en adaptant la phase de décomposition actuelle à :
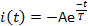
où, A -I (t-0) est une constante positive (Figure 5).
- Mesurer trois paramètres actuels : la latence d'activation L, le temps écoulé entre la livraison du flash lumineux jusqu'à ce que le courant atteigne 10 % de son amplitude maximale (figure 5); amplitude maximale de courant ou maximum Ip; et temps de désensibilisation constant T. Mesurer le temps de désensibilisation constant () en adaptant la phase de décomposition actuelle à :
- Désensibilisation et récupération
Remarque : Le recouvrement de la désensibilisation a été évalué comme le rapport p2/p1, où p1 est le paramètre pertinent (L, Ip, ou T) du courant de contrôle, et p2 est le paramètre correspondant du deuxième courant de test.- Terrain p2/p1 (l'un ou l'autre L, ip, ou T) en fonction du temps entre les impulsions.
- Selon le paramètre, adaptons les points de chaque parcelle à :
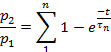
ou à :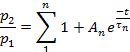
- Utilisez un test statistique approprié pour déterminer le nombre de termes exponentiels requis pour s'adapter aux données expérimentales.
Résultats
Tout d'abord, un potentiel récepteur représentatif des cellules photoréceptrices d'écrevisses est obtenu (figure 4). Par la suite, un flash lumineux d'essai a été appliqué pour déclencher le courant de transduction de lumière (figure 5). Le courant de transduction cationique1 s'active après un décalage, atteignant un maximum et tombe par la suite lentement dans un état désensibilisé absorbant...
Discussion
L'écrevisse s'est avérée être un excellent modèle en raison de sa capacité à survivre dans des conditions non naturelles. Il est facile d'accéder aux analyses électrophysiologiques in vivo et in vitro. En outre, les crustacés sont un groupe favorable pour la recherche neurobiologique dans le domaine de la chronobiologie comparative21.
Dans cet article, l'étude de la désensibilisation et de la récupération du courant de transduction-activ?...
Déclarations de divulgation
Nous n'avons rien à divulguer.
Remerciements
Ces travaux ont été soutenus par la subvention DGAPA-UNAM IN224616-RN224616. Les auteurs remercient Mme Josefina Bolado, chef du département de traduction scientifique de papier, de Division de Investigacion à Facultad de Medicina, UNAM, pour avoir édité la version anglaise de ce manuscrit.
matériels
| Name | Company | Catalog Number | Comments |
| Axoclamp2A | Axon Instruments Inc | Amplifier | |
| Digidata 1200 Interface | Axon Instruments Inc | Digitizer | |
| Oscilloscope TDS430A | Tektronix | Analogic Oscilloscope | |
| Photostimulator PS33 Plus | Grass | Lamp | |
| Puller PC-100 | Narishige | Micropipette Puller | |
| Puller P-97 | Sutter Instruments | Micropipette Puller | |
| Glass Capillary Tube Kimax-51 | Kimble Products | 34502 | 0.8, 1.10, 100 mm |
| HS-2 Headstage | Axon Instruments Inc | Headstage | |
| Micromanipulator MX-4 | Narishige | Mechanical Micromanipulator | |
| Stereoscopic Microscope | Zeiss | Microscope | |
| pClamp | Axon Instruments Inc | Data acquisition software for digidata 1200 interface | |
| Clampfit | Axon Instruments, Inc | Analysis software linked to pClamp | |
| Origin | OriginLab Corp. | Data analysis and graphing software | |
| Sodium Chloride | Sigma | S7653 | >99.5% |
| Potassium Chloride | Sigma | P-9333 | Minimum 99% |
| Magnesium Sulfate | Sigma | M7506 | Minimum 99.5% |
| Calcium Chloride | Sigma | C5080 | Minimum 99.0% |
| Hepes | Sigma | H7523 | >99.5% |
| Sodium Hydroxide | Sigma | S8045 | 98.00% |
| Sodium hypochlorite solution | Sigma | 425044 | Available chlorine, 10-15% |
Références
- Barriga-Montoya, C., Gómez-Lagunas, F., Fuentes-Pardo, B. Effect of pigment dispersing hormone on the electrical activity of crayfish visual photoreceptors during the 24-h cycle. Comp. Biochem. Physiol. A Comp. Physiol. 157 (4), 338-345 (2010).
- Barriga-Montoya, C., de la O-Martínez, A., Fuentes-Pardo, B., Gómez-Lagunas, F. Desensitization and recovery of crayfish photoreceptors. Dependency on circadian time, and pigment-dispersing hormone. Comp. Biochem. Physiol. A Comp. Physiol. 203, 297-303 (2017).
- Wickenden, A. D. Overview of electrophysiological techniques. Curr. protoc. pharmacol. 11, 1-17 (2014).
- Brette, R., Destexhe, A. Intracellular recording. Handbook of Neural Activity Measurement. , 44-91 (2012).
- Cummins, D., Goldsmith, T. H. Cellular identification of the violet receptor in the crayfish eye. J. Comp. Physiol. 142 (2), 199-202 (1981).
- Eguchi, E. Rhabdom structure and receptor potentials in single crayfish retinular cells. J. Cell and Comp. Physiol. 66, 411-430 (1965).
- Nosaki, H. Electrophysiological study of color encoding in the compound eye of crayfish, Procambarus clarkii. Z. vergl. Physiologie. 64 (3), 318-323 (1969).
- Miller, C. S., Glantz, R. M. Visual adaptation modulates a potassium conductance in retinular cells of the crayfish. Vis Neurosci. 17 (3), 353-368 (2000).
- Hamill, O. P., Marty, A., Neher, E., Sakmann, B., Sigworth, F. J. Improved patch-clamp techniques for high-resolution current recording from cells and cell-free membrane patches. Pflugers Arch. 391 (2), 85-100 (1981).
- Lishko, P., Clapham, D. E., Navarro, B., Kirichok, Y. Sperm patch-clamp. Methods Enzymol. 525, 59-79 (2013).
- Finkel, A. Axoclamp-2A microelectrode clamp theory and operation. Axon Instruments, Inc. , (1990).
- Sakmann, B. . Single-channel recording. , (2013).
- Van Harreveld, A. A physiological solution for freshwater crustacea. Proc. Soc. Exp. Biol. Med. 34 (4), 428-432 (1936).
- Oesterle, A. . pipette cookbook. , 97 (2008).
- Fuentes-Pardo, B., Ramos-Carvajal, J. The phase response curve of electroretinographic circadian rhythm of crayfish. Comp. Biochem. Physiol. A Comp. Physiol. 74 (3), 711-714 (1983).
- Pace-Schott, E. F., Hobson, J. A. The neurobiology of sleep: genetics, cellular physiology and subcortical networks. Nat. Rev. Neurosci. 3 (8), 591-605 (2002).
- Pittendrigh, C. S., Aschoff, J. On the mechanism of the entrainment of a circadian rhythm by light cycles. Circadian Clocks. , 277-297 (1965).
- Pittendrigh, C. S., Aschoff, J. Circadian systems: entrainment. Handbook Behavioral Neurobiology Biological Rhythms. , 94-124 (1981).
- Vitaterna, M. H., Takahashi, J. S., Turek, F. W. Overview of circadian rhythms. Alcohol Res. Health. 25 (2), 85-93 (2001).
- Hille, B. . Ion channels of excitable membranes. 507, (2001).
- Dircksen, H., Strauss, J. Circadian clocks in crustaceans: identified neuronal and cellular systems. Front Biosci. 15, 1040-1074 (2010).
- Terakita, A., Hariyama, T., Tsukahara, Y., Katsukura, Y., Tashiro, H. Interaction of GTP-binding protein Gq with photoactivated rhodopsin in the photoreceptor membranes of crayfish. FEBS Lett. 330, 197-200 (1993).
- Terakita, A., Takahama, H., Hariyama, T., Suzuki, T., Tsukahara, Y. Light regulated localization of the beta-subunit of Gq-type G-protein in the crayfish photoreceptors. J Comp Physiol A. 183 (4), 411-417 (1998).
- Terakita, A., Takahama, H., Tamotsu, S., Suzuki, T., Hariyama, T., Tsukahara, Y. Light-modulated subcellular localization of the alpha-subunit of GTP-binding protein Gq in crayfish photoreceptors. Vis Neurosci. 13 (3), 539-547 (1996).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon