JoVE 비디오를 활용하시려면 도서관을 통한 기관 구독이 필요합니다. 전체 비디오를 보시려면 로그인하거나 무료 트라이얼을 시작하세요.
Method Article
빛 자극전달 시 가재 광수용체 의 둔감화 및 회수
요약
circadian 시간의 함수로 가재 광수용체의 둔감 및 감도 회복에 대한 연구를 위한 프로토콜이 제시된다.
초록
가재 광수용체의 탈감작 및 회복을 연구하는 방법이 제시된다. 우리는 불연속 단일 전극 전환 전압 클램프 구성을 사용하여 격리 된 눈 줄기에서 광수용체 세포의 세포 내 전기 적 기록을 수행했습니다. 첫째, 면도날을 사용하여 망막에 접근하기 위해 등각막에 구멍을 내서 만들었습니다. 그 후, 우리는 개구부를 통해 유리 전극을 삽입하고, 음의 전위 기록에 의해 보고된 바와 같이 세포를 침투시켰다. 멤브레인 전위는 광수용체의 휴식 잠재력에 고정되었고 전류를 활성화하기 위해 광 펄스를 적용했습니다. 마지막으로, 두 개의 라이트 플래시 프로토콜은 현재 둔감 및 복구를 측정하기 위해 사용되었습니다. 첫 번째 라이트 플래시 트리거, 지연 기간 후, 감전 이온 전류, 이는 피크 진폭에 도달 한 후 둔감 한 상태로 붕괴; 다양한 시간 간격으로 적용되는 두 번째 플래시는 광 활성화 전도도의 상태를 평가합니다. 빛 유도 전류를 특성화하기 위해, 세 가지 매개 변수를 측정했다: 1) 대기 시간 (광 플래시 전달과 전류가 최대 값의 10 %를 달성하는 순간 사이의 경과 시간); 2) 피크 전류; 및 3) 둔감화 시간 상수(현재 감쇠 단계의 지수 시간 상수). 모든 파라미터는 첫 번째 펄스의 영향을 받습니다.
탈감작으로부터의 회복을 정량화하기 위해, p2/p1의 비율을 펄스 사이의 시간 대 사용하였다. p1은 제1 광 펄스에 의해 유발되는 피크 전류이고, p2는 제2 펄스에 의해 유발되는 피크 전류이다. 이러한 데이터는 지수 함수의 합계에 맞습니다. 마지막으로, 이러한 측정은 일주기 시간의 함수로서 수행되었다.
서문
시각적 자극으로 인식되려면 눈에 도달하는 빛을 전기 신호로 변환해야 합니다. 따라서 모든 시각적 유기체에서 빛은 형질 전환 이온 전류를 유발하여 광수용체 세포의 막 전위, 소위 수용체 전위변화를 일으킵니다. 이 로 인해, 눈의 빛 감도는 주로 활성화 되거나 탈감 될 수 있는 빛 활성화 전도도의 상태에 따라 달라 집니다.
가재 광수용체에서 빛은 느리고 일시적인 이온 전류1을유발합니다. 조명시, 감전 전류는 최대에 도달하기 전에 지연 또는 대기 시간 후에 발생합니다. 그 후, 감쇠 채널은 더 빛자극에응답하지 않는 둔감 한 상태로 떨어질 때 붕괴 2 . 즉, 빛은 시력을 담당하는 형질전환 전류를 활성화하는 것 외에도, 광수용체 세포의 감도의 일시적인 감소도 유도한다. 둔감은 적절한 자극에 과다 노출에 대한 일반적인 보호 메커니즘을 나타낼 수 있습니다. 감전 전도가 둔감에서 회복됨에 따라 빛에 대한 눈의 민감도가 회복됩니다.
세포내 기록은 흥분성 세포의 전기 적 활성을 측정하는 데 유용한기술이다3,4,5,6,7,8. 세포내 기록은 패치 클램프 기술9의출현으로 덜 빈번해졌지만, 세포가 분리하기 어렵거나 패치 클램핑 기가 씰의 형성을 어렵게 만드는 기하학을 제시할 때 여전히 편리한 접근법입니다(즉, 패치 전극과 10의 전기 저항을가진 패치 전극과 멤브레인 사이의 단단한 접촉). 후자의 예는 정자세포(10)와 광수용체 세포가 본원에 연구되어 있다. 우리의 경험에서, Procambarus clarkii 광수용기는 1 차적인 문화에서 격리하고 지키기 어렵습니다; 또한 기가 씰 형성을 달성하기 어렵게 만드는 얇은 막대입니다. 세포 내 기록에서 날카로운 전극은 주변 조직에 의해 제자리에 보관되는 세포로 진행됩니다. 전극은 증폭기의 고속 스위칭 회로에 의해 절단되므로 전류는 전압 펄스 사이에서 샘플링됩니다. 이 모드는 불연속 단일 전극 전압 클램프(dSEVC 모드)11로알려져 있다. 전극의 높은 저항 (작은 개구부)은 세포와 파이펫 용액 사이의 확산 교환을 방해하여 세포 내밀리외3의 최소한의 교란을 생성합니다. 이 기술의 잠재적인 단점은 전극 삽입이 비선택적 누수 전류를 생성할 수 있다는 것입니다. 따라서 누수 전류의 크기가 의도 된측정을방해 할 수있는 셀에서 기록을 피하기 위해주의를 기울여야합니다4,12.
본 명세서에서, 우리는 전압 클램프 조건하에서 광수용체 세포의 세포내 전기적 기록을 수행함으로써 광 활성화 이온 전도도의 둔감화 및 회수를 평가하기 위해 고립된 가재 눈줄기를 사용한다.
프로토콜
참고: 실험은 멕시코 동물 보호법을 준수합니다.
1. 실험 적 설정
- 일반 연결
- 아날로그-디지털 컨버터를 통해 앰프를 적합한 컴퓨터에 연결하고 오실로스코프를 사용하여 실험을 모니터링합니다(그림1).
- 포토티뮬레이터를 변환된 A/D에 연결합니다.
- 레코딩 챔버
- 녹음실을 진동 방지 테이블 위에 놓고 패럽데이 케이지 내부에 놓습니다.
참고: 이렇게 하면 기록에 영향을 줄 수 있는 기계적 진동 및 전기 적 소음을 방지할 수 있습니다. 우리의 패러데이 케이지는 어두운 와이어 메쉬로 만들어졌습니다. 수제, 2 mL, 아크릴 녹음 챔버가 사용된다(그림 2). - 205mM NaCl : 살아있는 준비를 유지하기 위해 목욕 용액을 준비; 5 mM KCl; 2 mM MgSO4; 13 mM CaCl2; 5 mM 헤페스-NaOH, pH 7.3.
참고: 실험 절차가 전기 기록에 의한 손상을 검출하기에 충분히 짧기 때문에 용액은 덱스트로오스 또는 95%O2,5%CO2 혼합물을 포함하지 않는다(완전성을 위해 4.2.3 단계 참조).
- 녹음실을 진동 방지 테이블 위에 놓고 패럽데이 케이지 내부에 놓습니다.
- 전극
- 염화물 코팅 실버 와이어 전극을 기준 전극으로 사용
참고 : 은 염화물 코팅은 전극 반응을 허용하는 데 필요한 : AgCl (들) + e-↔ Ag (들)- Cl-. - 표면을 청소하기 위해 실버 와이어 (두께 ~ 1mm, 길이 ~ 10cm)를 미세 한 등급의 에머리 페이퍼로 모래.
- 증류수로 실버 와이어를 헹구어 보시고 있습니다.
- 깨끗한 은와이어를 4-6% 하이포아염소산염 용액(NaClO)에 담그면 어두워질 때까지(약 20분)
- 전해질 용액(2.7M KCl)으로 채워진 얇은 유리 파이펫을 세포내 전극으로 사용하십시오.
- 마이크로 파이펫 풀러로 유리 모세관(내부 직경 □ 1mm)을 당겨 작은 개구부(0.01-0.1 μm)로 얇은 팁을구한다(14) 14.
- 당겨진 모세관 유리를 2.7M KCl 용액으로 채웁니다. 먼저 모세관으로 채우고 (파이펫 팁을 2.7 M KCl 용액에 담그고) 파이펫의 절반을 미세 한 주입 바늘로 채웁니다. 필요한 경우 전극 파이펫을 탭하여 기포를 제거합니다.
- 전극을 홀더에 연결합니다. 앰프와 함께 홀더를 앰프 헤드스테이지에 연결합니다. 안정적인 3D 마이크로 조작기로 전극 홀더 헤드스테이지를 배치합니다. 목욕 용액이 끝을 덮을 때까지 전극을 낮춥춥습니다.
참고: 전극의 방향은 수직 방향이어야 합니다.
- 염화물 코팅 실버 와이어 전극을 기준 전극으로 사용
- 증폭기의 브리지 모드(증폭기의 모드 섹션에서 브리지 버튼을 누르기)를 선택하고 전극 저항을 측정합니다. 저항이 약 50 MΩ11인지확인합니다.
참고 : 이 전극 크기는 셀에 제한된 손상과 좋은 품질의 전기 기록을 할 수 있습니다. - 증폭기의 전압 클램프 섹션의 고정 위치 버튼과 증폭기의 Microelectroi 1 섹션의 정전 용량 중화 버튼을 사용하여 오프셋 전류를 무효화하고 정전 용량 과도 를 보정합니다.
- 수퍼퓨전 시스템
- 목욕 용액 (단계 1.2.2)을 적절한 리셉터클 (250 mL 세럼 병)에 붓고 관개 튜브 세트 (내부 직경 3.2 mm)에 연결하여 녹음 챔버를 연결합니다. 중력 구동 과수 시스템을 사용합니다. 유량을 ~ 0.5 mL/s로 조절합니다.
- 챔버를 흡입 장치에 연결합니다. 기록 챔버의 총 부피가 변하지 않는 방식으로 용액 흡입 시스템을 조절한다. 진공 펌프를 사용하여 흡입하십시오.
참고: 실험 기간 내내 길잃은 정전 용량을 일정하게 유지하기 위해 기록 챔버의 일정한 부피는 중요합니다.
2. 생물학적 물질
참고 : 불명료한 섹스의 intermolt 단계에서 성인 가재 P. clarkii (7-10cm 길이)를 사용합니다.
- 일주기 시간
- 실험 한 달 전에 12-h 빛/12-h 다크 사이클 15(백색광, 2.4 kW/m2)에서100마리의 가재를 유지합니다.
참고 : 한 달은 가재 인구를 동기화하기에 충분한 시간입니다. - 가재 집단의 일주기 시간을 임의로 선택된 5마리의 동물의 전기레티노그램의 진폭을 평가하여결정한다(15).
참고 : 0 h circadian 시간 (CT 0)은 주관적인 날의 시작을 나타냅니다, 즉,유기체가 일반적으로 활성 인 시간16,17,18,19 (그림 3). 가재는 야행성 동물이기 때문에 12-h 빛 / 12-h 암흑 주기에서 어두운 단계 동안 활성화됩니다.
- 실험 한 달 전에 12-h 빛/12-h 다크 사이클 15(백색광, 2.4 kW/m2)에서100마리의 가재를 유지합니다.
- 아이즈토크 격리 절차
- 원하는 일주기 시간에, 0-4 °C에서 수돗물에 침지하여 선택한 가재를 15 분 동안 마취시.
- 좋은 가위를 통해 눈줄기를 베이스에서 분리합니다.
- 면도날을 사용하여 망막에 접근하여 등쪽 각막에서 개구부(~ 1mm2)를만듭니다.
- 아이스토크를 녹음실(실리콘으로 덮인 구멍)의 중앙에 놓고 챔버 상단에 있는 망막에 접근할 수 있습니다.
- 20 분 동안 일정한 어둠 속에서 눈을 유지합니다.
참고: 20분은 광수용체 세포가 완전히 어두워질 수 있는 충분한 시간입니다.
3. 광수용체 임팔링
- 마이크로 전극과 아이스토크의 세로 축을 평행하게 놓아 마이크로 전극이 망막에 접근하기 위해 중앙에 있는 방식으로 합니다. 입체 현미경(10X)을 사용하여 장치를 올바른 구성으로 배치합니다.
- 앰프의 브리지모드(11)를 선택하여 기준전극과 레코딩 전극 간의 전압 차이를 모니터링합니다.
- 욕조에 전극을 낮추고 그 후 망막 바로 위에 놓습니다.
- 현미경을 멀리 이동하고 눈줄기의 세로 축에 평행한 광자극기 램프를 배치합니다.
참고 : 램프와 수퍼퓨전 챔버 사이의 거리는 약 15cm입니다. - 갑작스런 전압 강하가 감지될 때까지 마이크로 전극을 천천히 낮춥습니다.
참고: 약 -50 mV의 전압 강하는 건강한 광수용체 세포의 침투를 나타냅니다. - 광수용체의 수용체 잠재력을 기록하기 위해 테스트 라이트플래시(백색광, 7.2kW/m2, 10μs 지속시간)를 제공합니다.
참고 : 광수용체의 수용체 전위는 10-15 mV 진폭 및 300 ms 지속 시간의 탈분극 전위이다(그림 4).
4. 전기 기록
- 광수용체 세포가 어두운 조건에 완전히 적응되었는지 확인합니다(2.3단계 참조).
- 2분마다 테스트 라이트 플래시를 제공합니다. 데이터 수집 소프트웨어에서 "에피소드 간 시간"의 적절한 값(120초)을 선택하여 깜박임 사이의 시간을 자동화합니다.
참고 : 2 분은 광수용체의 전기 반응의 기초전류의 총 회복을 허용하는 데 필요한 시간입니다. - 수용체 전위진및 지속 시간뿐만 아니라 휴식 막 전위를 모니터링한다. 수용체 전위, 진폭 및 수용체 전위 기간이 변하지 않고 일단 광수용체가 완전히 적응된다고 가정합니다. 눈떼개는 20분(2.3단계)에 대한 일정한 어둠 속에서 약 5분 만에 적응을 완료했습니다.
- 빛을 유도한 전류를 기록하기 전에 셀을 자극하는 것을 2분 간 멈춥시다.
- 2분마다 테스트 라이트 플래시를 제공합니다. 데이터 수집 소프트웨어에서 "에피소드 간 시간"의 적절한 값(120초)을 선택하여 깜박임 사이의 시간을 자동화합니다.
- 현재 기록
- 데이터 수집 소프트웨어에서 "진폭 유지"(아날로그 출력 채널 섹션의 파형)를 선택하여 셀의 측정된 휴식 멤브레인 전위 값에서 전압을 고정합니다.
- 앰프의 dSEVC 모드를 선택합니다. 앰프의 모드 섹션에서 SEVC 버튼을 선택하고 레버를 Discont SEVC 위치로 전환합니다.
- 전극(11)의속도에 의해 결정된 바와 같이 스위칭 속도를 500-1,000 Hz(증폭기의 속도 조정 버튼을 사용하여)로 설정합니다.
- 라이트 플래시를 제공하고, 연상 이온 유입을 관찰.
참고: 라이트 유도 또는 트랜스덕트 전류입니다(그림5). - 앰프의 브리지 모드로 돌아가라이트 플래시를 전송하여 수용체 전위를 기록합니다(섹션 3 참조). 광수용체 세포가 어두운 조건에 완전히 적응되어 있는지 확인하십시오. 수용체 전위 특성(진폭 및 지속 시간)을 측정하고 첫 번째 측정값과 비교합니다. 찔린 광수용체 세포가 동일한 특성을 가지고 있다면 건강한 세포라고 가정합니다.
참고 : 눈 토크 절제 후, 생물학적 제제는 다음 2 시간 동안 실행 가능합니다.
- 두 개의 펄스 프로토콜: 두 개의 라이트 플래시 프로토콜로 탈감작으로부터의 복구를 측정합니다.
참고 : 두 개의 라이트 플래시 프로토콜은 전압 게이트 채널(20)의불활성화로부터의 복구를 측정하는 데 사용되는 표준 2 펄스 전압 프로토콜과 유사합니다. 제1 광플래시는 광수용체 세포의 감도에 일시적인 변화를 일으키고 제2 플래시는 광 활성화 전도도의 상태를 평가한다.- 한 쌍의 광 펄스를 전달합니다. 원하는 시간 간격(300ms ~ 2분)에 두 번째 플래시를 적용합니다.
- 데이터 수집 소프트웨어로 10KHz 샘플링에서 전류를 디지털화하고 오프라인 분석을 위해 데이터를저장합니다 11.
참고: 소프트웨어의 구성 값이 있는 표가 보충 자료로 포함되어 있습니다.
5. 데이터 분석
- 빛 유도 전류의 역학
- 세 가지 전류 매개 변수를 측정: 활성화 대기 시간 L, 전류가 최대 진폭의 10 %에 도달 할 때까지 광 플래시 전달에서 경과 시간(그림 5); 피크 또는 최대 전류 진폭 Ip; 및 탈감작 시간 상수 T. 현재 감쇠 단계를 다음과 같은 상태로 피팅하여 탈감작 시간 상수(Θ)를 측정합니다.
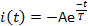
여기서 A = -I(t=0)는 양수 상수입니다(그림5).
- 세 가지 전류 매개 변수를 측정: 활성화 대기 시간 L, 전류가 최대 진폭의 10 %에 도달 할 때까지 광 플래시 전달에서 경과 시간(그림 5); 피크 또는 최대 전류 진폭 Ip; 및 탈감작 시간 상수 T. 현재 감쇠 단계를 다음과 같은 상태로 피팅하여 탈감작 시간 상수(Θ)를 측정합니다.
- 둔감및회복
주: 탈감작으로부터의 회수는p2/p1의비율로 평가되었고, 여기서p1은 대조군 전류의 관련 파라미터(L, Ip, 또는 T)이고,p2는 제2 시험 전류의 해당 파라미터이다.- 펄스 사이의 시간 함수로서p2/p1(L, Ip또는 T)을 플로팅합니다.
- 매개변수에 따라 각 플롯의 점을 다음에 맞춥춥습니다.
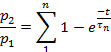
또는 다음을 수행합니다.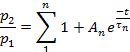
- 적절한 통계 검정을 사용하여 실험 데이터에 맞게 필요한 지수 용어 수를 결정합니다.
결과
먼저, 가재 광수용체 세포의 대표적인 수용체 전위가 얻어진다(도4). 그 후, 광 환전 전류를 트리거하기 위해 테스트 라이트 플래시를 적용하였다(그림5). 양이온 형질 전환 전류1은 지연 후 활성화되어 최대값에 도달한 다음 천천히 흡수되는 둔감 상태로 떨어집니다.
토론
가재는 비자연적 조건에서 살아남을 수있는 능력으로 인해 우수한 모델로 입증되었습니다. 생체 내 및 체외 전기 생리학적 분석에 쉽게 접근할 수 있습니다. 또한 갑각류는 비교 연대기21의 분야에서 신경 생물학적 연구에 유리한 그룹입니다.
이 논문에서는 가재 광수용체 세포의 광 활성화 형질전환 전류의 탈감작 및 회복에 대한 연구가 세포?...
공개
우리는 공개 할 것이 없습니다.
감사의 말
이 작품은 DGAPA-UNAM IN224616-RN224616 교부금에 의해 지원되었습니다. 저자는 이 원고의 영어 버전을 편집한 UNAM의 디비시온 드 인베티가시온(División de Investigación)의 과학 논문 번역 부서장인 요세피나 볼라도(Josefina Bolado) 여사에게 감사를 표하고 자합니다.
자료
| Name | Company | Catalog Number | Comments |
| Axoclamp2A | Axon Instruments Inc | Amplifier | |
| Digidata 1200 Interface | Axon Instruments Inc | Digitizer | |
| Oscilloscope TDS430A | Tektronix | Analogic Oscilloscope | |
| Photostimulator PS33 Plus | Grass | Lamp | |
| Puller PC-100 | Narishige | Micropipette Puller | |
| Puller P-97 | Sutter Instruments | Micropipette Puller | |
| Glass Capillary Tube Kimax-51 | Kimble Products | 34502 | 0.8, 1.10, 100 mm |
| HS-2 Headstage | Axon Instruments Inc | Headstage | |
| Micromanipulator MX-4 | Narishige | Mechanical Micromanipulator | |
| Stereoscopic Microscope | Zeiss | Microscope | |
| pClamp | Axon Instruments Inc | Data acquisition software for digidata 1200 interface | |
| Clampfit | Axon Instruments, Inc | Analysis software linked to pClamp | |
| Origin | OriginLab Corp. | Data analysis and graphing software | |
| Sodium Chloride | Sigma | S7653 | >99.5% |
| Potassium Chloride | Sigma | P-9333 | Minimum 99% |
| Magnesium Sulfate | Sigma | M7506 | Minimum 99.5% |
| Calcium Chloride | Sigma | C5080 | Minimum 99.0% |
| Hepes | Sigma | H7523 | >99.5% |
| Sodium Hydroxide | Sigma | S8045 | 98.00% |
| Sodium hypochlorite solution | Sigma | 425044 | Available chlorine, 10-15% |
참고문헌
- Barriga-Montoya, C., Gómez-Lagunas, F., Fuentes-Pardo, B. Effect of pigment dispersing hormone on the electrical activity of crayfish visual photoreceptors during the 24-h cycle. Comp. Biochem. Physiol. A Comp. Physiol. 157 (4), 338-345 (2010).
- Barriga-Montoya, C., de la O-Martínez, A., Fuentes-Pardo, B., Gómez-Lagunas, F. Desensitization and recovery of crayfish photoreceptors. Dependency on circadian time, and pigment-dispersing hormone. Comp. Biochem. Physiol. A Comp. Physiol. 203, 297-303 (2017).
- Wickenden, A. D. Overview of electrophysiological techniques. Curr. protoc. pharmacol. 11, 1-17 (2014).
- Brette, R., Destexhe, A. Intracellular recording. Handbook of Neural Activity Measurement. , 44-91 (2012).
- Cummins, D., Goldsmith, T. H. Cellular identification of the violet receptor in the crayfish eye. J. Comp. Physiol. 142 (2), 199-202 (1981).
- Eguchi, E. Rhabdom structure and receptor potentials in single crayfish retinular cells. J. Cell and Comp. Physiol. 66, 411-430 (1965).
- Nosaki, H. Electrophysiological study of color encoding in the compound eye of crayfish, Procambarus clarkii. Z. vergl. Physiologie. 64 (3), 318-323 (1969).
- Miller, C. S., Glantz, R. M. Visual adaptation modulates a potassium conductance in retinular cells of the crayfish. Vis Neurosci. 17 (3), 353-368 (2000).
- Hamill, O. P., Marty, A., Neher, E., Sakmann, B., Sigworth, F. J. Improved patch-clamp techniques for high-resolution current recording from cells and cell-free membrane patches. Pflugers Arch. 391 (2), 85-100 (1981).
- Lishko, P., Clapham, D. E., Navarro, B., Kirichok, Y. Sperm patch-clamp. Methods Enzymol. 525, 59-79 (2013).
- Finkel, A. Axoclamp-2A microelectrode clamp theory and operation. Axon Instruments, Inc. , (1990).
- Sakmann, B. . Single-channel recording. , (2013).
- Van Harreveld, A. A physiological solution for freshwater crustacea. Proc. Soc. Exp. Biol. Med. 34 (4), 428-432 (1936).
- Oesterle, A. . pipette cookbook. , 97 (2008).
- Fuentes-Pardo, B., Ramos-Carvajal, J. The phase response curve of electroretinographic circadian rhythm of crayfish. Comp. Biochem. Physiol. A Comp. Physiol. 74 (3), 711-714 (1983).
- Pace-Schott, E. F., Hobson, J. A. The neurobiology of sleep: genetics, cellular physiology and subcortical networks. Nat. Rev. Neurosci. 3 (8), 591-605 (2002).
- Pittendrigh, C. S., Aschoff, J. On the mechanism of the entrainment of a circadian rhythm by light cycles. Circadian Clocks. , 277-297 (1965).
- Pittendrigh, C. S., Aschoff, J. Circadian systems: entrainment. Handbook Behavioral Neurobiology Biological Rhythms. , 94-124 (1981).
- Vitaterna, M. H., Takahashi, J. S., Turek, F. W. Overview of circadian rhythms. Alcohol Res. Health. 25 (2), 85-93 (2001).
- Hille, B. . Ion channels of excitable membranes. 507, (2001).
- Dircksen, H., Strauss, J. Circadian clocks in crustaceans: identified neuronal and cellular systems. Front Biosci. 15, 1040-1074 (2010).
- Terakita, A., Hariyama, T., Tsukahara, Y., Katsukura, Y., Tashiro, H. Interaction of GTP-binding protein Gq with photoactivated rhodopsin in the photoreceptor membranes of crayfish. FEBS Lett. 330, 197-200 (1993).
- Terakita, A., Takahama, H., Hariyama, T., Suzuki, T., Tsukahara, Y. Light regulated localization of the beta-subunit of Gq-type G-protein in the crayfish photoreceptors. J Comp Physiol A. 183 (4), 411-417 (1998).
- Terakita, A., Takahama, H., Tamotsu, S., Suzuki, T., Hariyama, T., Tsukahara, Y. Light-modulated subcellular localization of the alpha-subunit of GTP-binding protein Gq in crayfish photoreceptors. Vis Neurosci. 13 (3), 539-547 (1996).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유