需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
大动物淋巴结的采集与处理 RNA 分析: 大动物 Transcriptomic 淋巴结的制备研究
摘要
本议定书概述了从大型动物的淋巴结组织 transcriptomic 分析中分离 RNA 的程序, 包括从家畜和野生动物中鉴别和切除淋巴结的步骤, 取样方法为了在多个动物之间提供一致性, 并考虑到收集后保存和处理 RNA 分析的代表性结果。
摘要
大型动物 (牲畜和野生动物) 是人畜共患病病原体的重要储集物, 包括布鲁氏杆菌、牛分枝菌、沙门氏菌和大肠杆菌, 并有助于研究发病机制和/或细菌在天然寄主中的传播。随着淋巴结在宿主免疫应答中的关键作用, 淋巴结组织作为潜在的 RNA 来源, 为下游 transcriptomic 分析, 以评估在细胞感染过程中基因表达的时间变化。本文概述了在家畜的淋巴结收集, 组织取样和下游 RNA 处理的过程, 使用牛 (金牛座) 作为模型, 并提供了更多的例子, 美国野牛 (野牛野牛).该协议包括有关人体内多个关键部位淋巴结的位置、识别和清除的信息。此外, 还提出了一种活检抽样方法, 允许在多个动物之间进行抽样的一致性。讨论了样品保存的几个考虑因素, 包括 rna 序列和 rt-pcr 等下游方法的生成。由于大型动物vs小鼠时间课程研究中固有的长时间延迟, 提出了野牛和牛淋巴结组织的代表性结果来描述这种组织类型中退化的时间过程, 在审查其他组织中 RNA 降解的以前的方法学研究。总的来说, 这项议定书将是有益的两个兽医研究员开始转录项目的大型动物样本和对学习技术的分子生物学家感兴趣的体内组织取样和体外处理。
引言
RNA 序列分析的淋巴结转录提供了机会, 以描述动物的免疫反应的各种病原体。虽然这种方法已广泛应用于小鼠, 但最近的分析已经扩展到较大的哺乳动物1,2。牲畜/大型动物淋巴结可用于鉴定宿主对感染的反应, 不仅用于疫苗或遗传易感性研究以及确定药物发展目标, 而且还作为人类研究的模范系统。关于人畜共患病。例如, 在布鲁氏菌病 (每年影响全世界100万人的人畜共患病细菌疾病) 的情况下, 尽管费用大大增加, 但绵羊或山羊的研究与人类感染和人类疫苗的相关性更大。发展比实验动物模型。老鼠感染模型重述了内皮系统感染, 但没有特点的临床标志3.
在大型动物实验中, 与实验动物研究相比, 组织收获的过程必然涉及安乐死与组织收集之间的较长延迟, 这给保存高质量的 RNA。完整的 RNA 是产生生物相关 transcriptomic 数据的必要条件。从组织样本中生成高质量的 RNA 对于在密闭设施中进行的大型动物病原体研究尤其重要。这种研究在本质上更难执行, 因为它们不仅需要核定的设施和训练有素的人员, 而且还要承担重大的财政费用, 这取决于工作, 可以从数以万计的美元不等。这些类型的研究还涉及跨学科协作和跨学科的知识, 以完成他们的工作, 增加他们的复杂性。因此, 对样本收集和保存的简化系统进行培训、开发和遵守, 为受感染动物组织的下游分子研究提供了重要的好处。
与小鼠淋巴结相似抽样相比, 大淋巴结的收集对组织收集带来了额外的挑战。标本切除的准备需要对淋巴结的解剖, 包括相关的内部结构有基本的理解。淋巴结的结构由淋巴小叶包围, 由鼻窦充满淋巴。这些结构被封闭在一个坚硬的纤维胶囊中。4淋巴小叶是 "淋巴结基本解剖和功能单元", 由卵泡、深皮质单元、髓质线和鼻窦4 (图 1A) 组成。B 和 T 淋巴细胞分别是卵泡和深皮质单位的家。这些结构提供一个3D 支架和促进淋巴细胞和抗原或抗原呈现细胞之间的相互作用。
严重的, 卵泡和深皮质单位可以确定在切割表面, 因为他们包含一个密集的网状网, 并显示较深的鼻窦, 这是由一个更微妙的网状网和显得更轻 (图 1B)。根据惯例, 病理学家指淋巴结的区域为浅皮层 (卵泡)、paracortex (深皮质单位) 和髓质 (髓质线和鼻窦)。对所有三个区域进行的适当检查已被认为是淋巴结常规病理检查指南的最佳实践5。请注意, 淋巴结的一致性、大小和颜色有相当大的变化, 即使在单个动物中也是如此。随着动物年龄的增长, 他们的淋巴结将趋于减少, 并变得比年轻动物更牢固, 通常由于其结缔组织的增加和正常淋巴结构的减少6,7。

图 1.淋巴结解剖。(A) 此卡通图像显示了淋巴结的解剖, 描述了关键结构。(B) 此静止图像显示一个牛淋巴结切开横断面。对肉眼可见的相关结构/层进行了突出显示。请单击此处查看此图的较大版本.
根据实验性的问题, 不同淋巴结的收集和分析有一定的兴趣。外周淋巴结位于皮下组织深处。在牛, 周围或浅淋巴结经常用于临床和实验的做法包括腮腺, 颌下腺, 咽后, prescapular, prefemoral (precrural) 和浅腹股沟 (supramammary 在女性, 阴囊在男性) (图 2)。在表 1中, 概述了牛系统8中描述的主要浅淋巴结的属性。下面, 提出了一些潜在的牛传染性细菌性疾病淋巴结采集计划, 作为调查的出发点。
布鲁氏菌流产/布鲁氏菌 melitensis: 标准验尸为b. 流产受感染的牛和b. melitensis感染的山羊在国家动物疾病中心恢复 supramammary, prescapular 和腮腺淋巴结组织, 无论是为细菌计数的研磨和为 rna 的准备为宿主 rna 表达分析。在实验感染的牛9中, 每个淋巴结都可以定期恢复B. 流产.在B. melitensis-感染的山羊中, 在感染后至少九月内, 使用我们研究中的基于 RNA 的方法 (Boggiatto et., 未发表), 可以在这些淋巴结类型中检测到细菌的存在。沙门氏菌sp: prescapular、subiliac (prefemoral) 和肠系膜淋巴结在对沙门氏菌患病率10、11、12和对 transcriptomic 研究有潜在的兴趣。大肠杆菌 O157:H7: 肠系膜淋巴结 (在中间小肠和远端小肠位置) 可以是偶尔恢复的细菌在受感染的小牛 (但不是在受感染的成年牛)13。钩端螺旋体病 (钩端螺旋体 sp.): 在引流乳腺14的淋巴结中观察到细菌的长期持续存在。牛分枝杆菌: 在牛中, 这些细菌已经从小牛的纵隔和气管支气管淋巴结的实验性感染中恢复了15。此外, 淋巴结 RNA 被用来检查大型动物宿主对病毒的反应, 如猪繁殖和呼吸道综合征病毒2。图 2描述了牛体内这些主要淋巴结的子集位置。
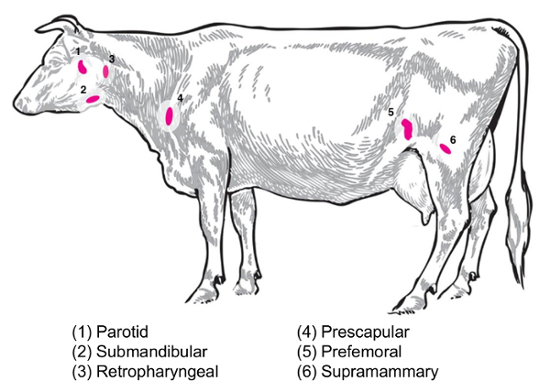
图 2:动画描述选定的淋巴结位置金牛座. 编号的淋巴结被标注。请单击此处查看此图的较大版本.
在本文和相关视频中, 我们提出了一种用于 RNA 研究的大型动物淋巴结分离的协议, 旨在为参与大型动物感染 transcriptomic 研究的分子生物学家提供信息。首先, 我们以牛和野牛组织的抽样为例, 概述了淋巴结的分离过程。与这个演示, 如显示在视频中, 是一个工作流为一个可重现的组织取样, RNA 隔离。接下来, 我们描述了处理感染性淋巴结的重要因素, 重点是安全性、一致性和 RNA 质量。
用酸化苯酚-胍基异硫氰酸酯试剂制备组织中的 RNA, 是基于 Chomczynski 和萨基16、17的原始方法, 在存在的情况下, 对基于二氧化硅的自旋柱进行纯化。基于 Vogelstein 和 chaotropic18的原始工作的代理。我们还研究了从替代方法保存的牛淋巴结中恢复转录组学 RNA 的可能性。最后, 我们探讨了时间变量对大动物验尸 rna 质量的影响, 包括一个代表性的实验, 描述了在安乐死与从野牛中恢复的 rna 剖面上的采样时间的增加的影响, 并牛淋巴结。这篇文章将不仅对分子生物学家, 而且对兽医研究人员开始 transcriptomic 研究是有用的。
研究方案
这里描述的动物尸检程序是在国家动物疾病中心, 艾姆斯, IACUC 批准的协议范围内。所有实验都是按照批准的动物护理和福利准则进行的。
1. 尸检前的预规划
- 在尸检之前, 准备以下材料运输到尸检套件:
- 1.5 或2毫升离心管填充1.0 毫升的 RNA 保存溶液, 在机架或运输容器中。确保按照制造商的指导方针, 保存液体积与组织体积的比值。
- 一次性手术刀和清洁, 蒸压钳: 一组用于解剖皮肤和另一套收集淋巴结 (一个为每个淋巴结, 每种动物), 从而防止皮肤和环境菌群的交叉污染与淋巴结组织。
- 3毫米冲压活检工具, 尸检刀, 用于手术刀和活检工具的锋利容器, 以及用于淋巴结清扫的切割板或一次性托盘。
- 使用个人防护设备, 包括为系统适当的 BSL 级别工作所需的 PPE。
- 可重复使用的金属工具, 包括镊子, 在尸检前的金属锅中, 采用器皿/干品设置。
2. 牛和野牛淋巴结的鉴定和取样
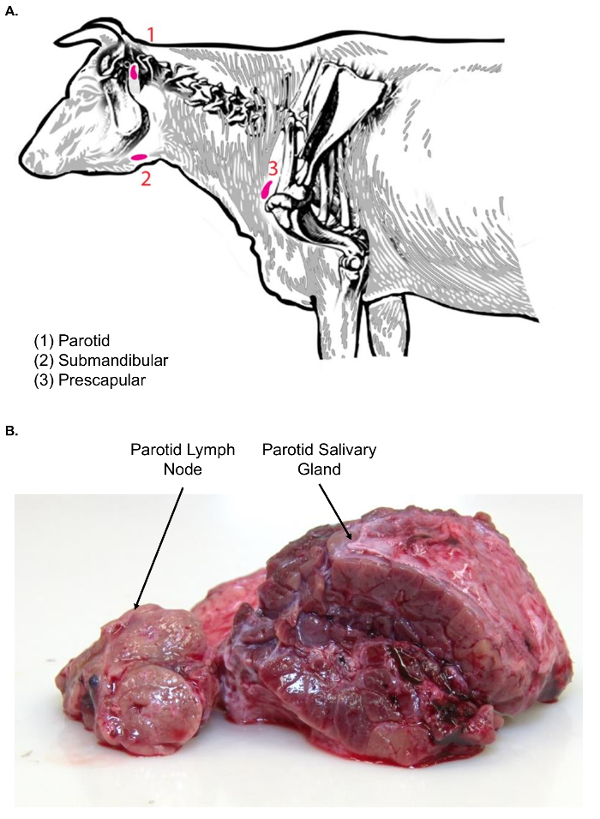
图 3.牛头颈部淋巴结.(A) 此卡通图像显示金牛座的头部和颈部的选定淋巴结。(B) 此图像显示腮腺淋巴结的横断面 (左) 与腮腺涎腺的横断面 (右)。注意两种组织类型之间的纹理差异。请单击此处查看此图的较大版本.
-
牛和野牛 prescapular 淋巴结的分离
- 根据当地 IACUC 协议, 弄死动物 (任何年龄的牛或野牛)。通过机构 IACUC 协议中具体描述的方法确认死亡, 包括缺乏心跳, 缺乏呼吸, 以及缺乏角膜反射。把动物移到尸检的地板上。
注意: 在大型动物的实验室实践中, 有多种人道安乐死方法。然而, 静脉注射戊巴比妥钠和苯妥英钠溶液是最普遍认可和使用的形式。请参考 AVMA 关于动物安乐死的指南。19
注意事项: 在东道机构尸检所有相关的生物安全协议, 包括防穿刺容器中锋利的安全处理指南, 以及可重复使用的金属刀和镊子的净化。该协议从使用一次性手术刀产生锋利废料。根据机构指南, 包括靴子、工作服、手套和眼部防护, 佩戴个人防护用品。 - 确定3名参与者从事动物组织工作。
注: 在这里, 刀1将负责大规模切片的期望动物组织, 刀2将恢复淋巴结从不同的动物切片, 刀3将工作在一个单独的表, 以隔离部分从每个淋巴结和用防腐剂溶液把它们转移到管子里。 - 首先将动物置于侧卧床。
- 将前肢向后移动到膝部 (腕骨), 伸展肩部;这项议案将使肩部背部, 并允许更容易触诊淋巴结。感觉到淋巴结的存在 "肿块"。
注意: 在疾病情况下, 淋巴结肿大可能存在, 这使得淋巴结的鉴别更加容易, 但这一过程也会影响淋巴结的一致性、组成和结构。 - 一旦定位, 并与肩膀仍然延长, 使用手术刀或尸检刀, 使皮肤切口沿轮廓的肩膀。
注意: 不要限制切口的大小, 即使淋巴结已经找到通过触诊。较大的切口提供更容易进入更深的组织, 使淋巴结切除更容易刀。 - 用一双镊子, 收回皮肤, 露出肩部和颈部肌组织的点。
注: prescapular 淋巴结常见于皮下脂肪, 尤其是 overconditioned 动物。 - 再次, 触及淋巴结的位置 (图 3A)。
注意: 与皮下脂肪不同, 淋巴结在触及时会保持其形状。此外, 淋巴结与任何周围组织都不相邻, 因为它们被一层薄薄的纤维胶囊所包围。 - 在定位 prescapular 淋巴结后, 仔细解剖出皮下脂肪, 使用手术刀和钳, 并隔离淋巴结。
- 寻找如图 1B所示的薄纤维胶囊的存在, 以区分淋巴结和脂肪组织;淋巴结与周围组织不相邻。
- 将淋巴结转移到淋巴结解剖表, 用塑料托盘进行组织移植, 进一步切片。
注意: 野牛的这些淋巴结的出现是相似的。相关视频描述了 prescapular 淋巴结的外观, 解剖出美国野牛的右肩。
- 根据当地 IACUC 协议, 弄死动物 (任何年龄的牛或野牛)。通过机构 IACUC 协议中具体描述的方法确认死亡, 包括缺乏心跳, 缺乏呼吸, 以及缺乏角膜反射。把动物移到尸检的地板上。
-
牛和野牛腮腺淋巴结的分离
- 首先把动物放在尸检地板的侧卧床上。定位颞下颌关节。
- 如果难以定位, 则缓慢移动下颌骨, 确定下颌骨附着在颅骨上的位置;这是颞下颌关节
- 用手术刀或尸检刀, 小心地在皮肤上做切口。开始切口背部到关节和延伸它腹部/垂直沿下巴。
- 解剖皮肤去揭示皮下组织。腮腺涎腺首先是可见的, 因为它的大小, 肿块的表面形貌, 和红色的着色。
- 使用镊子和手术刀, 将腮腺涎腺移到一旁, 发现腮腺淋巴结仅坐在颅内和内侧至唾液腺 (图 3A)。在进一步处理前检查腮腺淋巴结组织的质地。
注: 面部淋巴结 (腮腺和颌下腺) 与涎腺有关, 可混淆淋巴结隔离。与淋巴结相比, 涎腺更大, 肿块表面出现。此外, 在切口表面上, 涎腺的性质是同源的, 不表现出典型的淋巴结皮质和髓质结构模式 (图 3B)。 - 用手术刀把腺体切除。将其转移到淋巴结解剖表, 使用塑料托盘进行组织转移, 进一步切片。
- 首先把动物放在尸检地板的侧卧床上。定位颞下颌关节。
-
雌性牛和野牛 supramammary 淋巴结的分离
- 将动物置于侧卧床。
- 抬高后腿, 露出腹股沟区域, 找到乳房。
注意: 在一个健康的, 非哺乳的动物, 这些淋巴结的触诊可能是不可能的。在泌乳动物中, 这些淋巴结可以在乳房底部的尾部边缘明显可见。 - 使用手术刀, 做一个切口只是背部的乳房, 运行沿上腿, 以暴露 supramammary 腺体。
- 解剖皮下组织, 发现 supramammary 淋巴结嵌入薄层皮下脂肪。如果没有视觉上的区别, 触及暴露的组织为存在一个牢固的结构在皮下脂肪。
- 使用镊子和手术刀, 仔细解剖从脂肪的淋巴结。将其转移到淋巴结解剖表, 使用塑料托盘进行组织转移, 进一步切片。
3. 淋巴结的切片和贮存
- 将分离的淋巴结从刀2转移到刀 3, 并在靠近主尸检空间的解剖表中传递。将每个淋巴结放在切割板的新切片上。用淋巴结对切片进行预贴标, 便于连续接收多个淋巴结。对于传染性样品, 使用一次性托盘。
- 使用镊子和一次性手术刀或尸检刀, 删除淋巴结的一部分。用锋利的刀子, 做一个矢状切口打开淋巴结。
- 检查淋巴结的内部, 特别是在受感染动物标本中, 寻找不对称、病变、颜色差异、等等记录观察结果。
-
(备选案文 1)小组织部分
- 使用一次性手术刀的每一个淋巴结, 其厚度小于5毫米的部分, 并将每片转移到一个管与 RNA 保存解决方案与清洁钳。
-
(备选案文 2)淋巴结活检或切片方法学
注: 活检或切片方法, 当应用到平行淋巴结科跨不同的节点和动物, 提供了样本组织的一致性, 以大量 RNA 分析。-
楔切片法
- 检查后矢状切片捕获细胞横跨淋巴结剖面, 从淋巴结, 从中心到外囊的一个馅饼形楔。对于一个2厘米宽的节点 (标准尺寸; 请参见表 1), 将楔形切割到中心, 其外弧长度为4毫米, 厚度为5毫米, 其湿重为 ~ 100 毫克。
- 使用手术刀, 切成小块, 不超过5毫米, 大约 50-100 毫克每个在湿组织重量。
注意: 为了一致性, 处理所有楔件从一个单一的淋巴结, 无论是在一个批次或单独的管后, RNA 汇集, 以提供一个具有代表性的 RNA 剖面从淋巴结的兴趣。 - 与组织的体积相比, 将组织块与镊子放入含有至少10卷 RNA 保存液的管子中。
-
冲压活检方法
- 如果目标是收集特定的部分, 例如从节点中抽取特定的滤泡, 请选择穿孔活检工具。选择与收集所需的样本大小一致的工具。冲压活检工具可从直径1到8毫米不等的尺寸。
- 在淋巴结中直观地定位样本感兴趣的区域。
- 使用冲床活检工具, 以消耗部分的兴趣, 按下和转动的工具, 以创建核心。将组织片与镊子转移到包含至少10卷 RNA 保存溶液的管中。如果厚度大于5毫米, 使用镊子和手术刀进一步将组织分成小块。
-
楔切片法
- 一旦样品被转移到保存解决方案 (e. g, RNALater), 把它们运回实验室在室温下。
- 将样品存放在4摄氏度, 以允许组织穿透。
- 第二天, 倒入多余的 RNA 防腐剂溶液, 并将组织样本储存在-80 摄氏度。在冷冻样品之前, 尽可能多地去除防腐剂。使用 P1000 和/或 P200 微提示有效地去除 RNA 防腐剂溶液。
注意: 根据所使用的病原体的感染特性以及安全数据表中规定的防腐剂溶液的化学和环境危害, 适当地丢弃排水保存解决方案。
注: 此处提供的指南是为材料表中描述的 RNA 保存解决方案提供的。如果使用其他保存解决方案, 请查阅制造商指南。
4. RNA 淋巴结的处理
注意: 穿上实验室的大衣、手套和适当的眼部防护以处理步骤。
注: 此处使用的基于苯酚的试剂在材料表(并且协议基于制造商的指南) 中描述20。根据制造商对所购买的特定产品的建议, 使用替代酚基试剂可能需要修改该程序。
- 在进入样品之前, 用吸管将冷冻 (4 °c) 苯酚基试剂整除均匀管 (1.5 毫升/管)。
注意: 苯酚具有毒性、腐蚀性和健康危害。氯仿有毒, 危害健康。完成处理步骤 4.1-4.9 在一个化学油烟机, 并佩戴手套, 以防止任何接触化学品。在美国, 氯仿是一种危险废物;根据当地和机构的指导方针, 处理含有危险废物的管子。在相应的 BSL-2、BSL-3 或 BSL-4 指导下处理感染病原体的动物组织样本。 - 一旦样品可以松开从离心管与清洁钳, 立即转移约 50-100 毫克的保存组织到均匀管含有苯酚基试剂。
- 在添加苯酚试剂之前限制解冻。当从冷冻柜中取出多个样品进行加工时, 使用干冰储存。
- 紧盖管, 将其放在均质机上, 并在苯酚基试剂上用转子-定子组织均质体融汇样品。在室温下完成加工。完成后, 检查多云外观, 确保样品顺利匀质;组织应分散到多云悬浮。
注: 使用2分钟 RNA 提取设置 (在材料表中描述的均质机的预设置 RNA_02_1 设置); 为冷冻组织设计)。本协议中指定的转子定子 (见材料表) 是大齿形的, 适合于各种组织类型 (包括纤维材料) 的均匀化。RNA_02_01 的设置是专门为冷冻 (而不是新鲜) 组织设计的。由于淋巴结有纤维结缔组织成分, 建议采用类似的优化转子-定子均质体, 以实现有效的离解。有关均匀化建议的其他信息, 请参见国家环境健康科学研究所21 。- 如果在均匀化后仍有大块的组织存在, 重复匀质过程。为了有效地恢复 RNA, 组织必须很好地离解。
- 对于更多的纤维状淋巴结, 使用镊子和剪刀在转移到均匀化管之前将淋巴结片预切到几个小块。如导言所述, 较年长动物的淋巴结组织可能更具纤维。
注: 如果需要对寄主和病原体 rna 进行双重分析, 则对细菌 rna 的恢复可能需要额外的治疗 (如珠均匀化), 特别是在组织中存在革兰阳性病原体的情况下。
- 立即去除管子中的匀质样品, 并将其转移到 RNase 离心管 (2.0 毫升大小) 与 P1000 微。
- 离心样品为5分钟在 1.2万 x g 在4°c 去除任何样品碎片。使用 P1000 微尖, 转移上清到一个新鲜的离心管, 留下球团后面。
- 室温下在5分钟内孵化上清液。在两个1.5 离心管之间拆分每个样本。
- 添加0.2 毫升氯仿每1毫升的苯酚基试剂 (即, 0.3 毫升为1.5 毫升样品);用手将它反转 1-2 分钟以混合相, 但不要将样品涡流。在室温下孵化2分钟。
- 离心机它为15分钟在 1.2万 x g 在4°c。
- 小心地移除上部, 清澈的水相与微尖端 (P1000 或 P200), 这将形成上层, 不破坏相间或红色酚-氯仿层。把它转移到一个新的离心管。
- 将其与同等体积的100% 乙醇混合;通过反转管 4-5 倍, 彻底混合。管子通常会出现多云。
- 使用微提示, 将液体转移到基于二氧化硅的商业旋转柱, 以进一步纯化和洗脱 RNA, 按照制造商的说明 22.洗脱从50毫克的组织生成的 RNA 到 50-100 µl 的 RNase 无水。
注: 虽然酚基试剂提取去除有机相中的 DNA, 为下游使用 rna 在 qRT PCR 和/或 rna 排序应用, 建议额外处理 rna 样品与 DNase。 - 整除将洗脱 rna 分离为用于定量和质量评估的试管, 以减少主 RNA 样品的冻融。把管子转到-80 摄氏度存放。
- 如果从感染了人畜共患病病原体的动物那里获得的淋巴结样本, 特别是在 BSL-3 遏制水平, 则验证所产生的 RNA 样本是否缺乏病原体, 如果样品将被移到一个较低的生物安全水平控制区用于质量分析、rt-pcr 和/或 RNA 序列库准备。
注意: 重要的是要考虑当地的法规, 并在 CDC (疾病控制和预防中心) 的情况下, 与选择剂工作的灭活指南, 有必要验证所有的灭活程序在研究员的本地网站。- 从步骤 4.12 ( 即, 5 µl 从总 RNA 的50µl) 中移除每个洗脱 RNA 样本的 1/10 th 卷。使用无菌技术, 将样品与100µl 的细菌生长液混合在一个无菌1.5 毫升离心管中。使用无菌塑料摊铺机, 将 RNA 汤混合物分散在琼脂盘子的表面。
注: 选择一种肉汤类型和琼脂板, 与动物受到挑战的病原体生长相一致。 - 在特定于动物受到挑战的病原体生长的条件下孵化琼脂板块。在从 BSL-3 容器中取出样品之前, 请检查是否没有恢复的细菌。
注: 结果洗脱 rna, 经过量化和完整性测试后, 适用于下游应用, 包括 rna 测序和 rt-pcr 分析。
- 从步骤 4.12 ( 即, 5 µl 从总 RNA 的50µl) 中移除每个洗脱 RNA 样本的 1/10 th 卷。使用无菌技术, 将样品与100µl 的细菌生长液混合在一个无菌1.5 毫升离心管中。使用无菌塑料摊铺机, 将 RNA 汤混合物分散在琼脂盘子的表面。
- 使用分光光度计评估 RNA 的恢复和纯度。为了评估 rna 质量, 将洗脱 RNA 样品的 1-2 µl 载入分光光度计进行分析。在紫外线 (UV) 范围内记录样品的光谱。
- 从 UV 光谱中, 记录260/280比率、260/230比率以及示例的260值 (A = 吸光度)。
- 由于单链 RNA 在浓度为40µg/毫升有1.0 在 260 nm 的吸光度, 计算 RNA 浓度 (µg/毫升) 乘以一个260 x 40 的纯化样品。
- 作为一种快速评估 RNA 完整性的方法, 要排除任何退化的样品从进一步分析, 混合2µl 每个 RNA 样品与4µl 1.5x 甲酰胺装载染料 [95% 去离子甲酰胺, 0.025% (瓦特/v) 溴酚蓝色, 0.025% (瓦特/v) 二甲苯蓝, 5 毫米 EDTA (pH 值8.0), 0.025% (瓦特/v) SDS] 在1.5 毫升离心管23,24。
- 将管子加热70摄氏度1分钟, 然后将管子转到冰上1分钟。
- 将样品装入1% 的琼脂糖凝胶 (用于 RNA 的本机琼脂糖凝胶电泳的完整描述), 请参阅里约热内卢、小阿瑞斯、汉龙和尼尔森24。用标准凝胶电泳方法分离样品, 确认28S 和18S 核糖体 RNA 带的存在。
- 跟踪凝胶电泳与定量分析的方法为 RNA 完整性确定 [例如, Bioanalyzer 和玲 (RNA 完整性数字) 分析] 如代表结果和米勒, O.等。 25和施罗德, A.等。26。
5. 从福尔马林固定石蜡嵌入 (FFPE) 组织中提取的替代方法
注意: 虽然 FFPE 组织保存不代表最强健的核酸保存方法, 下面提出的协议可以是一个方法来研究一些转录变化时, 其他保存组织是不可用的。
- 通过将福尔马林配药到塑料容器中制备组织保存用福尔马林试剂。组织应保存在福尔马林中, 其比例为20:1 福尔马林: 组织体积/重量分别。
注意: 福尔马林是已知的人类致癌物质, 虽然不是剧毒, 但慢性暴露 (通常通过吸入烟雾) 可以代表严重的健康危害。需要适当的通风和 PPE (即, 使用丁腈橡胶手套, 在初次接触后15分钟内改变), 以尽量减少健康风险。有关暴露监测和风险评估的其他信息, 请参阅 OSHA 甲醛标准 (29 CFR 1910.1048)。
注意: 使用太少的福尔马林会影响组织的能力, 使其在浸泡在防腐剂时完全保存。 - 分离后的组织的兴趣, 仔细修剪组织到小于5毫米的厚度。
- 使用镊子, 小心地将修剪过的组织浸入福尔马林中, 以减少飞溅。
注: 组织应完全浸没在福尔马林中, 以便完全固定。至关重要的是, 所有的组织表面完全覆盖福尔马林。
- 使用镊子, 小心地将修剪过的组织浸入福尔马林中, 以减少飞溅。
- 一旦组织被浸泡在福尔马林, 允许组织固定在室温下至少发生24小时。
注: 福尔马林从所有表面27,28, 缓慢地穿透组织, 速度为每小时1毫米。因此, 将组织切片的厚度保持在小于5毫米的情况下, 可以快速固定整个组织。 - 固定后, 将组织转移到适当的石蜡嵌入试剂。
注: 例如, 本手稿中检查的组织在嵌入之前被转移到70% 乙醇。 - 将组织嵌入石蜡中。29
- 将组织切片的厚度 10-80 µm (如果需要提取 miRNA, 请使用10-20 µm)29。
- 使用手术刀和镊子, 从每个样品中取出40毫克的组织片进行加工, 并将其放入无菌、无核酸酶的离心管中。
- 利用设计用于 deparaffinization 和核酸回收的 FFPE 组织样品的商业套件, 从保存的样品中提取 RNA。
注: 在材料表中引用的套件利用二甲苯和乙醇洗涤除去石蜡、蛋白酶处理步骤和玻璃纤维过滤器以纯化 RNA。
结果
使用本文中提出的考虑因素 (《议定书》 1-4 步) 将有助于从大型动物标本中恢复 RNA, 这些样本适合于宿主基因表达研究的下游分析。下游应用的 RNA 质量由多种标准措施评估。对于分光光度,260/280比值提供了对蛋白质污染的度量, 而260/230比值提供了另一种纯度评估方法, 可检测苯酚等化学污染物。在每种情况下, 2.0 的比率是高质量 RNA 的证据, 而降低比率则是污染的?...
讨论
大多数的 transcriptomic 研究和相关的协议集中在老鼠, 老鼠, 或验尸后的人类样本。然而, 对牲畜和野生动物的调查为对疾病的免疫反应的定性提供了广泛的机会, 无论是适用于兽医医学, 还是关于人畜共患病, 人类公共卫生。该协议提供了一个概要的关键考虑的高完整性 RNA 提取从组织从大型动物, 如牛, 野牛, 山羊和绵羊。动物的大小, 以及样本收集的条件, 使恢复更广泛的过程, 更长的验尸后处理时?...
披露声明
作者没有披露的利益冲突。所有的研究都是由美国农业部、农业研究服务处的校内资金提供的。所有对特定产品的引用都是为实验重现性而提供的, 并不代表联邦政府对这些产品的任何认可。
致谢
作者感谢詹姆斯福斯在所有录像和视频处理方面的出色工作;迈克尔. 马蒂为他的优秀作品在一代数字化牛形象;莉莉娅瓦尔特为她的帮助与 RNA 提取和 Bioanalyzer 奔跑;米奇. 帕默和卡莉 Kanipe 对淋巴结图像进行了有益的回顾和反馈;和动物护理和兽医人员在国家动物疾病中心为他们的辛勤工作和协助畜牧业和验尸的准备。
材料
| Name | Company | Catalog Number | Comments |
| RNA preservation solution (we used RNALater for all experiments) | ThermoFisher | AM7020 | |
| 1.5 ml or 2 ml polypropylene microcentrifuge tubes | Fisher Scientific | 05-408-129 | |
| Disposable scalpels | Daigger Scientific | EF7281 | |
| Tissue forceps, rat tooth | Fisher Scientific | 12-460-117 | Other tissue forceps available including curved tip, tapered edge, etc. , depends on user preference |
| 3 mm punch biopsy needles | Fisher Scientific | NC9949469 | |
| Sharps container (small and transportable for necropsy) | Stericycle | 8900SA | 1 qt. size shown here |
| Cutting boards or disposable trays | Fisher Scientific | 09-002-24A | Available in a variety of sizes, depends on user preference |
| Personal protective equipment | Varies with pathogen (gloves, respirator masks, goggles, etc.) | ||
| Phenol-based RNA extraction reagent (we used TRIzol Reagent for all experiments) | ThermoFisher | 15596026 | |
| Silica column-based RNA extraction kit (we used the PureLink RNA Mini kit for all experiments) | ThermoFisher | 12183018A | Designed for up to 100 mg tissue |
| 100% Ethanol (200 proof for molecular biology) | Sigma-Aldrich | E7023 | |
| Tissue homogenizer with enclosed homogenization tubes (we used the gentleMACS dissociator for all experiments) | Miltenyi Biotec | 130-093-235 | |
| Agarose (General, for gel electrophoresis) | Sigma-Aldrich | A9539 | |
| 1X TBE | Fisher Scientific | BP24301 | Can also make from scratch in the laboratory |
| Deionized formamide | EMD Millipore | S4117 | |
| Sodium dodecyl sulfate | Sigma-Aldrich | L3771 | |
| Bromophenol blue | Sigma-Aldrich | 114391 | |
| Xylene cyanol | Sigma-Aldrich | X4126 | |
| EDTA (Ethylenediaminetetraacetic acid) | Sigma-Aldrich | EDS | |
| UV-Vis Spectrophotometer (we used the NanoDrop Spectrophotometer) | ThermoFisher | ND-2000 | |
| Device for quantitative RNA assessment (we used the Bioanalyzer, with associated components and protocols) | Agilent | G2939BA | |
| FFPE RNA extraction kit (we used the RecoverAll Total Nucleic Acid Isolation Kit for Formalin Fixed, Paraffin Embedded Tissue) | ThermoFisher | AM1975 | |
| Plastic spreader (L-shaped spreader) | Fisher Scientific | 14-665-231 | Only needed for sterility testing for samples from infected animals |
| Necropsy knives | Livestock Concepts | WI-0009209 |
参考文献
- Tizioto, P. C., et al. Immunological response to single pathogen challenge with agents of the bovine respiratory disease complex: an RNA-sequence analysis of the bronchial lymph node transcriptome. PLoS One. 10 (6), e0131459 (2015).
- Miller, L. C., et al. Analysis of the swine tracheobronchial lymph node transcriptomic response to infection with a Chinese highly pathogenic strain of porcine reproductive and respiratory syndrome virus. BMC Veterinary Research. 8, 208 (2012).
- Silva, T. M. A., Costa, E. A., Paixao, T. A., Tsolis, R. M., Santos, R. L. Laboratory animal models for brucellosis research. Journal of Biomedicine and Biotechnology. 2011, 518323 (2011).
- Willard-Mack, C. L. Normal structure, function, and histology of the lymph nodes. Toxicologic Pathology. 34, 409-424 (2006).
- Elmore, S. A. Histopathology of the lymph nodes. Toxicologic Pathology. 34 (5), 425-454 (2006).
- Luscieti, P., Hubschmid, T. h., Cottier, H., Hess, M. W., Sobin, L. H. Human lymph node morphology as a function of age and site. Journal of Clinical Pathology. 33 (5), 454-461 (1980).
- Hadamitsky, C., et al. Age-dependent histoarchitectural changes in human lymph nodes: an underestimated process with clinical relevance?. Journal of Anatomy. 216 (5), 556-562 (2010).
- Sisson, S., Grossman, J. D., Getty, R. . Sisson and Grossman’s The Anatomy of Domestic Animals, Volume 1. , (1975).
- Olsen, S. C., Johnson, C. Comparison of abortion and infection after experimental challenge of pregnant bison and cattle with Brucella abortus strain 2308. Clinical and Vaccine Immunology. 18 (12), 2075-2078 (2011).
- Brichta-Harhay, D. M., et al. Microbiological analysis of bovine lymph nodes for the detection of Salmonella enterica. Journal of Food Protection. 75 (5), 854-858 (2012).
- Samuel, J. L., O’Boyle, D. A., Mathers, W. J., Frost, A. J. Isolation of Salmonella from mesenteric lymph nodes of healthy cattle at slaughter. Research in Veterinary Science. 28 (2), 238-241 (1980).
- Arthur, T. M., et al. Prevalence and characterization of Salmonella in bovine lymph nodes potentially destined for use in ground beef. Journal of Food Protection. 71 (8), 1685-1688 (2008).
- Cray, W. C., Moon, H. W. Experimental infection of calves and adult cattle with Escherichia coli O157:H7. Applied and Environmental Microbiology. 61 (4), 1586-1590 (1995).
- Thiermann, A. B. Experimental leptospiral infections in pregnant cattle with organisms of the Hebdomadis serogroup. American Journal of Veterinary Research. 43 (5), 780-784 (1982).
- Palmer, M. V., Waters, W. R., Whipple, D. L. Investigation of the transmission of Mycobacterium bovis from deer to cattle through indirect contact. American Journal of Veterinary Research. 65 (11), 1483-1489 (2004).
- Chomczynski, P. A reagent for the single-step simultaneous isolation of RNA, DNA, and proteins from cell and tissue samples. BioTechniques. 15 (3), 532-537 (1993).
- Chomczynski, P., Sacchi, N. Single step method of RNA isolation by acid guanidinium thiocyanate-phenol-chloroform extraction. Analytical Biochemistry. 162 (1), 156-159 (1987).
- Vogelstein, B., Gillespie, D. Preparative and analytical purification of DNA from agarose. Proceedings of the National Academy of Sciences of the United States of America. 76 (2), 615-619 (1979).
- . . AVMA Guidelines for the Euthanasia of Animals. , (2013).
- . . TRIzol Reagent Manual. , (2016).
- . . Disruption and Homogenization of Tissue for the Extraction of RNA. , (2014).
- . . PureLink RNA Mini Kit Protocol . , (2012).
- . . RNA Gel-loading Buffer. , (2006).
- Rio, D. C., Ares, M., Hannon, G. J., Nilsen, T. W. Nondenaturing Agarose Gel Electrophoresis of RNA. Cold Spring Harbor Protocols. , (2010).
- Mueller, O., et al. A microfluidic system for high-speed reproducible DNA sizing and quantitation. Electrophoresis. 21 (1), 128-134 (2000).
- Schroeder, A., et al. The RIN: an RNA integrity number for assigning integrity values to RNA measurements. BMC Molecular Biology. 7 (3), (2006).
- Suvarna, K. S., Layton, C., Bancroft, J. D. . Bancroft’s Theory and Practice of Histological Techniques. , (2012).
- Medawar, P. B. The rate of penetration of fixatives. Journal of Microscopy. 61 (1-2), 46-57 (1941).
- Canene-Adams, K. Preparation of formalin-fixed paraffin-embedded tissue for immunohistochemistry. Methods in Enzymology. 533, 225-233 (2013).
- Fleige, S., Pfaffl, M. W. RNA integrity and the effect on the real-time qRT-PCR performance. Molecular Aspects of Medicine. 27, 126-139 (2006).
- Fajardy, I., et al. Time course analysis of RNA stability in human placenta. BMC Molecular Biology. 10 (21), (2009).
- Bahar, B., et al. Long-term stability of RNA in post-mortem bovine skeletal muscle, liver and subcutaneous adipose tissues. BMC Molecular Biology. 8, 108 (2007).
- Yamagishi, A., et al. Gene profiling and bioinformatics analyses reveal time course differential gene expression in surgically resected colorectal tissues. Oncology Reports. 31 (4), 1532-1538 (2014).
- Choi, S., Ray, H. E., Lai, S. H., Alwood, J. S., Globus, R. K. Preservation of multiple mammalian tissues to maximize science return from ground based and spaceflight experiments. PLoS One. 11 (12), e0167391 (2016).
- Almeida, A., Thiery, J. P., Magdelenat, H., Radvanyi, F. Gene expression analysis by real-time reverse transcription polymerase chain reaction: influence of tissue handling. Analytical Biochemistry. 328 (2), 101-108 (2004).
- Lee, S. M. L., Schelcher, C., Thasler, R., Schiergens, T. S., Thasler, W. E. Pre-analytical determination of the effect of extended warm or cold ischaemia on RNA stability in the human ileum mucosa. PLoS One. 10 (9), e0138214 (2015).
- Kap, M., et al. The influence of tissue procurement procedures on RNA integrity, gene expression, and morphology in porcine and human liver tissue. Biopreservation and Biobanking. 13 (3), 200-206 (2015).
- Hong, S. H., et al. Effects of delay in the snap freezing of colorectal cancer tissues on the quality of DNA and RNA. Journal of the Korean Society of Coloproctology. 26 (5), 316-325 (2010).
- Lee, S. M., et al. RNA stability in human liver: comparison of different processing times, temperatures and methods. Molecular Biotechnology. 53 (1), 1-8 (2013).
- Morrison, P. K., et al. Post-mortem stability of RNA in skeletal muscle and adipose tissue and the tissue-specific expression of myostatin, perilipin and associated factors in the horse. PLoS One. 9 (6), e100810 (2014).
- Seear, P. J., Sweeney, G. E. Stability of RNA isolated from post-mortem tissues of Atlantic salmon (Salmo salar L.). Fish Physiology and Biochemistry. 34 (1), 19-24 (2008).
- Marchuk, L., Sciore, P., Reno, C., Frank, C. B., Hart, D. A. Postmortem stability of total RNA isolated from rabbit ligament, tendon, and cartilage. Biochimica et Biophysica Acta. 1379 (2), 171-177 (1998).
- Inoue, H., Kimura, A., Tuji, T. Degradation profile of mRNA in a dead rat body: basic semi-quantification study. Forensic Science International. 130 (2-3), 127-132 (2002).
- Micke, P., et al. Biobanking of fresh frozen tissue: RNA is stable in nonfixed surgical specimens. Laboratory Investigation. 86 (2), 202-211 (2006).
- Srinivasan, M., Sedmak, D., Jewell, S. Effect of fixatives and tissue processing on the content and integrity of nucleic acids. The American Journal of Pathology. 161 (6), 1961-1971 (2002).
- Ahmed, A. M., et al. Variation in the ovine abomasal lymph node transcriptome between breeds known to differ in resistance to the gastrointestinal nematode. PLoS One. 10 (5), e0124823 (2015).
- Russell, G. C., et al. Host gene expression changes in cattle infected with Alcelaphine herpesvirus 1. Virus Research. 169 (1), 246-254 (2012).
- Avraham, R., et al. A highly multiplexed and sensitive RNA-seq protocol for simultaneous analysis of host and pathogen transcriptomes. Nature Protocols. 11, 1477-1491 (2016).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。