Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Collecte et traitement des ganglions lymphatiques des animaux de grande taille pour l’analyse de l’ARN : préparation pour l’étude de transcriptomique ganglion des grandes espèces animales
Dans cet article
Résumé
Ce protocole donne un aperçu des procédures d’isolement d’ARN pour le profilage de transcriptomique des tissus ganglionnaires de grands animaux, y compris les étapes dans l’identification et l’excision des ganglions lymphatiques du bétail et la faune, échantillonnage des approches pour assurer la cohérence entre plusieurs animaux et des considérations plus des résultats représentatifs pour la préservation de l’après la collecte et le traitement aux fins d’analyse de RNA.
Résumé
Les grands animaux (bétail et la faune) servent d’importants réservoirs d’agents pathogènes zoonotiques, y compris les Brucella, Mycobacterium bovis, Salmonellaet e. coliet sont utiles pour l’étude de la pathogenèse et/ou propagation de la bactérie dans ses hôtes naturels. Avec la touche de fonction des ganglions lymphatiques dans la réponse immunitaire de l’hôte, ganglion lymphatique tissus servent comme une source potentielle de l’ARN pour les analyses transcriptomiques en aval, afin d’évaluer les changements temporels dans l’expression des gènes dans les cellules au cours d’une infection. Cet article présente une vue d’ensemble du processus de ganglion lymphatique collection et prélèvement d’ARN en aval traitement du bétail, utilisant des bovins (Bos taurus) comme un modèle, avec des exemples supplémentaires fournis par le bison d’Amérique (Bison bison ). Le protocole contient des informations sur la localisation, l’identification et enlèvement des ganglions lymphatiques de plusieurs sites clés dans le corps. Par ailleurs, une méthode d’échantillonnage de biopsie est présentée qui permet une cohérence de l’échantillonnage à travers plusieurs animaux. Plusieurs considérations pour la conservation de l’échantillon sont examinées, y compris la production d’ARN adapté aux méthodologies en aval comme RNA-sequencing et RT-PCR. Par les longs délais inhérents aux gros animaux vs des études souris temps, des résultats représentatifs de bison et de tissus bovins ganglion sont présentés pour décrire l’évolution temporelle de la dégradation dans ce type de tissu, dans le cadre d’un examen de travaux méthodologique antérieurs sur la dégradation de l’ARN dans d’autres tissus. Dans l’ensemble, ce protocole sera utile pour les deux chercheurs vétérinaires en début du transcriptome projets sur grands échantillons d’animaux et de biologistes moléculaires intéressés par l’apprentissage de techniques pour échantillons in vivo et in vitro de traitement.
Introduction
RNA-sequencing analyse du transcriptome de ganglions lymphatiques offre la possibilité de caractériser la réponse immunitaire des animaux à une variété de pathogènes. Tandis que cette méthodologie a été utilisée intensivement chez les souris, les analyses ont récemment étendu dans les plus grands mammifères1,2. Bétail/gros ganglions animales peut être utilisées pour caractériser les réactions de l’hôte à une infection, non seulement pour leur utilisation dans les vaccins ou les études de susceptibilité génétique et l’identification de cibles pour le développement de médicaments, mais aussi comme systèmes modèles pour les études chez l’homme sur les maladies zoonotiques. Par exemple, dans le cas de brucellose (une maladie zoonotique bactérienne qu’effets un demi-million de personnes dans le monde entier chaque année), malgré a considérablement augmenté des coûts, des études chez les moutons ou les chèvres sont plus pertinents pour l’infection humaine et le vaccin pour les humains développement de modèles animaux de laboratoire. Modèles de souris infection récapitulent l’infection du système réticulo-endothélial mais pas les signes cliniques caractéristiques3.
Lors des expérimentations animales importantes par rapport aux études animales de laboratoire, le processus de récolte nécessairement le tissu implique un délai plus long entre l’euthanasie et la collection de tissus, qui constitue un défi potentiel pour la conservation des RNA de haute qualité. L’ARN intact est essentiel pour la génération de données transcriptomiques biologiquement pertinente. Est de la génération de l’ARN de qualité des échantillons de tissus particulièrement critique pour les études de pathogène animal grand menée dans des installations de confinement. Ces études sont par nature plus difficiles à effectuer car non seulement ils exigent agréées et un personnel hautement qualifié mais aussi portent des frais importants, qui, selon les travaux, peuvent varier de quelques dizaines à des centaines de milliers de dollars. Ces types d’études impliquent aussi une collaboration interdisciplinaire et connaissances interdisciplinaires pour leur achèvement, ajoutant à leur complexité. Par conséquent, formation, développement d’et l’adhésion à un système simplifié de prélèvement et de conservation procure des avantages importants pour les études moléculaires en aval des tissus provenant d’animaux infectés.
La collection des plus gros ganglions lymphatiques présente des difficultés supplémentaires pour la collection de tissus par rapport à l’échantillonnage semblable des ganglions murines. La préparation pour l’excision de l’échantillon nécessite une compréhension de base de l’anatomie du ganglion, y compris les structures internes pertinentes. La structure d’un ganglion lymphatique est constituée de lobules lymphoïdes entourées de sinus remplis de ganglions. Ces structures sont enfermés dans une capsule dure, fibreuse. 4 un lobule lymphoïde est le « unité anatomique et fonctionnelle fondamentale du ganglion » et se compose de follicules, une unité profonde corticale et cordons médullaires et sinus4 (Figure 1 a). Les lymphocytes B et T sont abrite les follicules et profondément corticales unités, respectivement. Ces structures offrent un échafaudage 3D et facilitent l’interaction entre le lymphocytes ou cellules présentatrices d’antigène.
Grossièrement, follicules et unités profond corticales peuvent être identifiées sur la surface coupée car ils contiennent un maillage plus dense réticulaire et apparaissent plus sombres que les sinus, qui sont constituées d’un maillage réticulaire plus délicat et apparaissent plus léger (Figure 1 b). Par convention, les pathologistes se référer aux régions des ganglions lymphatiques comme le cortex superficiel (follicules), le paracortex (unités corticales profonde) et le bulbe rachidien (cordons médullaires et des sinus). Un examen sérieux de ces trois régions a été jugé comme le meilleur pratique dans les lignes directrices de routine d’examen pathologique des ganglions lymphatiques,5. Notez qu’il existe une variation considérable de la cohérence, la taille et couleur des ganglions lymphatiques, même au sein d’un seul animal. Comme l’âge des animaux, leurs ganglions lymphatiques aura tendance à diminuer en taille et devenir plus ferme que celles des animaux plus jeunes, généralement due à une augmentation dans leur tissu conjonctif et une réduction de la normale lymphoïde structure6,7.

Figure 1. Anatomie du ganglion. (A) cette image de dessin animé montre l’anatomie du ganglion, représentant les principales structures. (B) toujours cette image montre un ganglion bovin couper en coupe transversale. Les structures/couches pertinentes qui sont visibles à le œil nu sont mises en évidence. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
Selon la question expérimentale, ganglions différentes seront d’intérêt pour la collecte et l’analyse. Ganglions lymphatiques périphériques sont celles situées profondément dans le tissu sous-cutané. Chez les bovins, les ganglions lymphatiques périphériques ou superficielles souvent utilisés en pratique clinique et expérimentale incluent parotides, sous-maxillaires, rétropharyngiens, préscapulaires préfémoraux (PRECRURAUX) et inguinal superficiel (supramammaires chez les femelles, du scrotum chez les mâles) () La figure 2). Dans le tableau 1, les propriétés des principaux ganglions superficielles, comme décrit dans le système de bovins8, sont mentionnées. Ci-dessous, quelques plans de collection ganglion potentiels pour les maladies infectieuses bactériennes des bovins sont présentés comme point de départ pour l’enquête.
Brucella abortus/Brucella melitensis: norme necropsies pour b. abortus-infectés par les bovins et br. melitensis-chèvres infectés au Centre National des maladies animales récupérer supramammaires, prescapular et le tissu ganglionnaire parotide , tous deux pour la moudre pour l’énumération bactérienne et pour la préparation d’ARN pour le profilage de l’expression hôte RNA. B. abortus peuvent être régulièrement récupérés dans chacun de ces ganglions lymphatiques chez les bovins infectés expérimentalement9. La présence de bactéries dans chacun de ces types de ganglion lymphatique peut être détectée dans br. melitensis-infecté chèvres jusqu’après l’infection au moins neuf mois selon les méthodes de base d’ARN de nos études (Boggiatto et al., inédit). Salmonella SP: le prescapular, subiliaque (préfémoral), et les ganglions mésentériques ont été utiles lors de la détermination des caractéristiques des carcasses de gros bovins pour une prévalence de Salmonella 10,11,12 et serait d’intérêt potentiel pour les études de transcriptomique. E. coli O157 : H7: les ganglions mésentériques (à l’intestin grêle moyen et les emplacements de l’intestin grêle distal) peut être les sites d’une reprise occasionnelle des bactéries chez les veaux infectés (mais pas chez les bovins adultes infectés)13. La leptospirose (Leptospira SP.): une persistance chronique des bactéries a été observée dans les ganglions lymphatiques de drainage de la glande mammaire14. Mycobacterium bovis : Chez les bovins, les bactéries ont été récupérée infection post expérimentale par les ganglions lymphatiques médiastinaux et trachéo-bronchique de veaux15. En outre, ganglion RNA a été utilisée pour examiner les réactions de l’hôte animal grand à des virus, tels que le syndrome dysgénésique et respiratoire porcin virus2. La figure 2 montre l’emplacement d’un sous-ensemble de ces principaux ganglions lymphatiques dans le corps de bovins.
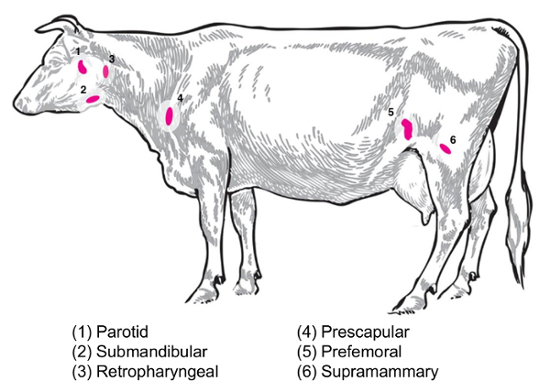
Figure 2 : Caricature illustrant certains ganglions lymphatiques emplacements dans Bos taurus . Les ganglions lymphatiques numérotées sont annotées. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
Dans cet article et la vidéo associée, nous présentons un protocole pour l’isolement des gros animaux ganglions lymphatiques pour des études de RNA, conçues pour être instructif pour les biologistes moléculaires participant aux études de transcriptomique des grandes infections animales. Tout d’abord, nous donnent un aperçu de la procédure d’isolement pour les ganglions lymphatiques, utilisant l’échantillonnage de tissus bovins et bisons comme exemples. Associé à cette manifestation, comme indiqué dans la vidéo, est un "workflow" pour un échantillon de tissu reproductible pour ARN. Ensuite, nous décrivons des considérations importantes pour le traitement d’un ganglion infecté, en mettant l’accent sur la sécurité, la cohérence et la qualité de la RNA.
La préparation de l’ARN du tissu avec un réactif d’isothiocyanate de phénol-guanidine acidifié est basée sur la méthode originale de Chomczynski et Sacchi16,17, avec une purification sur colonnes à centrifuger à base de silice en présence de agents chaotropiques basés sur le œuvre originale de Vogelstein et Gillespie18. Nous examinons également le potentiel pour la reprise de l’ARN pour transcriptomique de bovins ganglions lymphatiques conservés par des méthodes alternatives. Enfin, nous examinons l’impact de la variable de temps sur la qualité de RNA dans grands autopsies animales, y compris une expérience représentative montrant l’effet de l’augmentation dans le temps entre l’euthanasie et l’échantillonnage sur le profil de RNA récupéré de bison et bovines ganglions lymphatiques. Cet article sera utile non seulement pour les biologistes moléculaires, mais aussi de vétérinaires chercheurs commençant des études de transcriptomique.
Protocole
Les procédures de nécropsie animale représentées ici relèvent de protocoles IACUC approuvés au Centre National de la maladie animale, Ames, IA. Toutes les expériences ont été menées conformément aux principes directeurs adoptés pour la santé animale et le bien-être.
1. planification préalable avant l’autopsie
- Avant l’autopsie, préparer les documents suivants pour le transport à la suite de l’autopsie :
- rempli de 1,5 ou 2 tubes de microcentrifuge mL ~ 1,0 mL de solution de préservation de RNA, dans un conteneur de grille ou de transport. N’oubliez pas de suivre les directives du fabricant pour le rapport entre le volume de la solution de préservation pour le volume du tissu.
- Bistouris jetables et pinces propres, stérilisés à l’autoclave : un ensemble pour la dissection de la peau et un autre jeu pour collecter les ganglions lymphatiques (un pour chaque ganglion, par animal), empêchant ainsi une contamination croisée de la peau et de la flore environnementale avec le ganglion lymphatique tissus.
- 3 poinçon mm outils de biopsie, couteaux de l’autopsie, un conteneur pour objets tranchants pour le bistouris utilisés, les outils de la biopsie et les planches à découper ou plateaux jetables devant servir à la dissection des ganglions lymphatiques.
- Utiliser les équipements de protection individuelle, y compris les EPI nécessaire pour travailler au niveau approprié, BSL pour le système.
- Autoclave réutilisables outils en métal, y compris la pince, dans des plats en métal avant l’autopsie, en utilisant les ustensiles/Mercerie définissant.
2. identification et prélèvement des ganglions lymphatiques chez les bovins et bisons
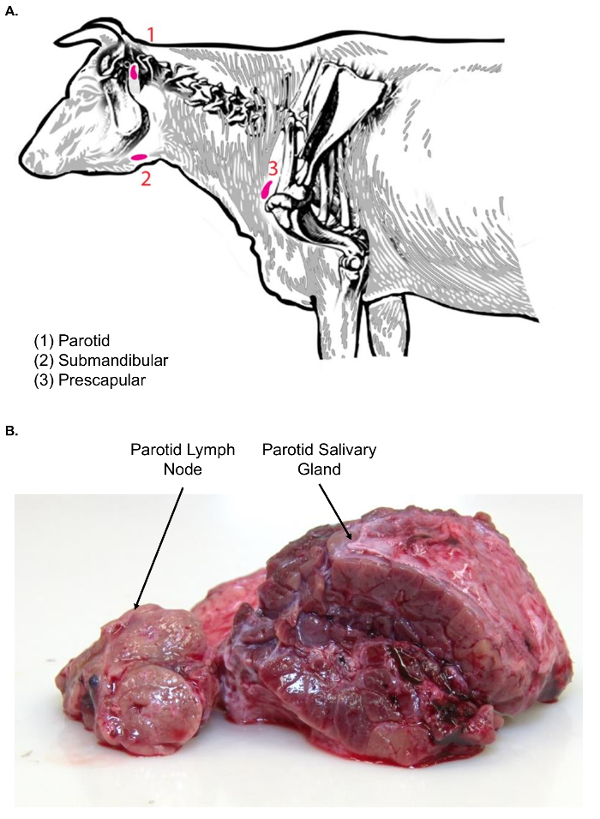
Figure 3 . Ganglions lymphatiques du cou et tête bovine. (A) cette image de dessin animé montre certains ganglions lymphatiques de la tête et le cou de Bos taurus. (B) cette image montre le ganglion lymphatique parotidien en coupe transversale (à gauche) par rapport à la glande salivaire parotide coupe transversale (à droite). Notez la différence de textures entre les types de deux tissus. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
-
Isolement des ganglions préscapulaires chez les bovins et bisons
- Euthanasier l’animal (bovins ou des bisons de n’importe quel âge, en fonction de l’expérience) basé sur le protocole IACUC local. Confirmer la mort de méthodes spécifiquement décrites dans le protocole IACUC institutionnel, y compris l’absence d’un battement de coeur, l’absence de la respiration et l’absence d’un réflexe cornéen. Déplacer l’animal à l’étage de l’autopsie.
Remarque : Il existe différentes méthodes d’euthanasie humaine utilisés dans la pratique de laboratoire de grands animaux. Toutefois, l’administration intraveineuse d’une solution de sodium pentobarbital sodique et la phénytoïne est le plus couramment approuvé et utilisé le formulaire. Consulter les directives de l’AVMA pour l’euthanasie des animaux. 19
ATTENTION : Suivre tous les protocoles de biosécurité pertinentes pour une autopsie à l’institution hôte, y compris les directives relatives à l’élimination sécuritaire des objets pointus ou tranchants dans un récipient résistant à la perforation et la décontamination des couteaux métalliques réutilisables et des pinces. Ce protocole génère des déchets coupants de l’utilisation de Bistouris jetables. Porter des équipements de protection individuelle comme dicté par les orientations institutionnelles, y compris les bottes, combinaisons, gants et lunettes de protection. - Identifier les 3 participants de travailler sur les tissus d’origine animales.
Remarque : Ici, dissecteur 1 va être chargé à grande échelle découpe des tissus animaux désirés, dissecteur 2 va récupérer les ganglions lymphatiques des animale différentes sections et dissecteur 3 fonctionnera à une table séparée pour isoler des sections de chaque ganglion lymphatique et Transférez-les sur tubes avec une solution d’agent de conservation. - Commencez en plaçant l’animal en décubitus latéral.
- Étendre l’épaule en replaçant la branche avant au niveau du genou (carpe) ; cette motion ramèneront l’épaule et permettre une palpation plus facile du ganglion. Sentir la présence du ganglion « forfaitaire ».
Remarque : Au cours de pathologies, lymphadénopathie peut-être être présente, qui facilite l’identification des ganglions lymphatiques, mais ce processus peut aussi affecter la cohérence, la composition et architecture du ganglion. - Une fois localisé et avec l’épaule encore étendu, utilisez un couteau scalpel ou nécropsie pour pratiquer une incision de la peau le long du contour de l’épaule.
Remarque : Ne restreignent pas la taille de l’incision, même si le ganglion lymphatique a été situé par palpation. Une incision plus large permet d’accéder plus facilement aux tissus plus profonds et facilite l’excision du ganglion pour le dissecteur. - À l’aide d’une paire de pinces, retirer la peau pour révéler la pointe de l’épaule et l’encolure de la musculature.
Remarque : Le ganglion préscapulaires se trouve souvent dans la graisse sous-cutanée, surtout chez les animaux overconditioned. - Une fois de plus, palper l’emplacement du ganglion (Figure 3 a).
Remarque : Contrairement à la graisse sous-cutanée, le ganglion lymphatique tiendra sa forme lorsqu’il est palpée. En outre, ganglions lymphatiques ne sont pas contiguës avec n’importe quel tissu environnant, car ils sont entourés d’une capsule fibreuse mince. - Après avoir localisé le ganglion préscapulaires, soigneusement disséquer sur la graisse sous-cutanée, à l’aide d’un scalpel et forceps et isoler le ganglion lymphatique.
- Recherchez la présence d’une capsule fibreuse mince, comme l’illustre l' Figure 1 b, pour distinguer entre les ganglions lymphatiques et le tissu adipeux ; ganglions lymphatiques ne sont pas contiguës avec n’importe quel tissu environnant.
- Transfert du ganglion lymphatique à la table de dissection ganglionnaire, à l’aide d’un plateau en plastique pour le transfert de tissus, pour la coupe de plus.
Remarque : L’apparition de ces ganglions lymphatiques chez les bisons est similaire. La vidéo associée représente l’aspect du ganglion préscapulaires comme découpées hors de l’épaule droite d’un bison d’Amérique.
- Euthanasier l’animal (bovins ou des bisons de n’importe quel âge, en fonction de l’expérience) basé sur le protocole IACUC local. Confirmer la mort de méthodes spécifiquement décrites dans le protocole IACUC institutionnel, y compris l’absence d’un battement de coeur, l’absence de la respiration et l’absence d’un réflexe cornéen. Déplacer l’animal à l’étage de l’autopsie.
-
Isolement des ganglions parotides chez les bovins et bisons
- Commencez en plaçant l’animal en décubitus latéral sur le plancher de l’autopsie. Localiser l’articulation temporo-mandibulaire (ATM).
- Si c’est difficile à localiser, placent la mandibule lentement et déterminer l’emplacement auquel la mandibule se fixe sur le crâne ; Il s’agit de l’ATM.
- À l’aide d’un bistouri ou autopsie d’un couteau, faites une incision dans la peau. Commencer l’incision dorsale de l’articulation et l’étendre sur le ventre/verticalement le long de la mâchoire.
- Disséquer la peau pour révéler le tissu sous-cutané. La glande salivaire parotide sera visible en premier lieu, en raison de sa grande taille, aspect de surface lobulée et coloration rouge.
- À l’aide de pinces et un scalpel, déplacer la glande salivaire parotide côté pour trouver le ganglion lymphatique parotidien assis juste crânienne et médiale de la glande salivaire (Figure 3 a). Examiner le tissu ganglionnaire parotide pour texture avant traitement ultérieur.
Remarque : ganglions lymphatiques de la face (sous-maxillaires et parotide) sont associés aux glandes salivaires, ce qui peut confondre l’isolement du ganglion lymphatique. Par rapport aux ganglions lymphatiques, glandes salivaires sont beaucoup plus grands et ont un aspect de surface lobulée. En outre, sur la surface de la coupe, les glandes salivaires sont homogènes dans la nature et ne présentent pas le modèle architectural classique cortical et médullaire des ganglions lymphatiques (Figure 3 b). - La glande au scalpel de l’accise. Transférer vers la table de dissection ganglionnaire, à l’aide d’un plateau en plastique pour le transfert de tissus, pour la coupe de plus.
- Commencez en plaçant l’animal en décubitus latéral sur le plancher de l’autopsie. Localiser l’articulation temporo-mandibulaire (ATM).
-
Isolement des ganglions lymphatiques supramammaires chez les bovins femelles et bison
- Placez l’animal en décubitus latéral.
- Élever la patte arrière pour exposer la région inguinale et localiser la mamelle.
Remarque : Chez des animaux sain, non en lactation, palpation de ces ganglions n'est pas possible. Chez un animal qui n’allaitaient pas, ces ganglions lymphatiques peut être palpables à la frontière caudale de la base de la mamelle. - À l’aide d’un scalpel, faites une incision juste dorsale à la mamelle, le long de la cuisse, pour exposer les glandes supramammaires.
- Disséquer les tissus sous-cutanés et trouver le nœud de ganglions lymphatiques supramammaires incorporé dans une fine couche de graisse sous-cutanée. Si non distinguables visuellement, palper les tissus exposés pour la présence d’une structure ferme au sein de la graisse sous-cutanée.
- À l’aide de pinces et un scalpel, disséquer attentivement sur le ganglion de la graisse. Transférer vers la table de dissection ganglionnaire, à l’aide d’un plateau en plastique pour le transfert de tissus, pour la coupe de plus.
3. découpe et l’entreposage des ganglions lymphatiques
- Passez les ganglions isolées de dissecteur 2 à dissecteur 3 autour d’une table de dissection adjacente à l’espace principal de l’autopsie. Placez chaque ganglion sur une section fraîche d’une planche à découper. Avant numéroter les planches à découper en sections en ganglion, afin de faciliter la réception de plusieurs ganglions lymphatiques dans la succession. Pour les échantillons infectieux, utiliser des plateaux jetables.
- À l’aide de pince et un couteau jetable de bistouri ou d’une nécropsie, enlever une partie du ganglion. À l’aide d’un couteau bien aiguisé, faites une coupe sagittale d’ouvrir le ganglion lymphatique.
- Examiner l’intérieur du ganglion, surtout dans des échantillons provenant d’animaux infectés, à la recherche d’asymétrie, lésions, différences de couleur, etc. enregistrer les observations.
-
(Option 1) Sections de tissu petit
- Bistouris jetables permet d’exciser les morceaux de chaque ganglion lymphatique qui est moins de 5 mm d’épaisseur et de transférer chaque morceau dans un tube avec une solution de conservation RNA avec une pince propre.
-
(Option 2) Méthodes de biopsie ou de sectionnement ganglion lymphatique
Remarque : Des Biopsies ou méthodologies sectionnement, lorsqu’il est appliqué aux sections parallèles ganglion lymphatique à travers différents nœuds et animaux, assurer la cohérence des tissus prélevés pour une analyse de RNA en vrac.-
Calez la methode de sectionnement
- Après avoir examiné la coupe sagittale pour capturer des cellules dans l’ensemble du profil du ganglion, une cale en forme de camembert de ganglion, du centre de la capsule externe de l’accise. Pour un nœud de 2 cm de largeur (taille standard ; Voir tableau 1), un coin coupé au centre qui est la longueur de l’arc extérieur de 4 mm et 5 mm d’épaisseur auront un poids net de ~ 100 mg.
- Avec le scalpel, couper l’écarteur en petits morceaux, pas plus épaisse que 5 mm et environ 50-100 mg chaque poids de tissu humide.
Remarque : Par souci de cohérence, processus de toutes les pièces de coin d’un seul ganglion lymphatique soit en un seul lot ou dans des tubes distincts suivie par l’ARN mise en commun afin de fournir un profil représentatif de RNA de ganglion d’intérêt. - Placer les morceaux de tissus avec une pince dans des éprouvettes contenant au moins 10 volumes de la solution de préservation de RNA, par rapport au volume du tissu.
-
Punch biopsie méthode
- Sélectionnez un outil de punch biopsie si le but est de collecter des sections spécifiques, tels que les follicules spécifiques à partir du nœud. Sélectionnez un outil compatible avec la taille de l’échantillon souhaité pour la collection. Punch biopsie outils sont disponibles dans une gamme de tailles, de 1 à 8 mm de diamètre.
- Localiser visuellement les régions d’intérêt pour l’échantillon dans le ganglion lymphatique.
- Utilisez l’outil de biopsie de punch pour les sections d’intérêt, en pressant et en tournant l’outil dans le tissu pour créer le noyau de l’accise. Transférer le morceau de tissu avec une pince dans un tube contenant au moins 10 volumes de la solution de préservation de RNA. Si supérieure à 5 mm, utiliser forceps et un scalpel pour diviser encore plus le tissu en petits morceaux.
-
Calez la methode de sectionnement
- Une fois que les échantillons ont été transférés à la solution de préservation (e.g., RNALater), leur transport vers le laboratoire à température ambiante.
- Stocker les échantillons à 4 ° C durant la nuit pour permettre la pénétration tissulaire.
- Le lendemain, décanter la solution de préservation RNA excès et stocker les échantillons de tissus à-80 ° C. Eliminez autant conservateur que possible avant de congeler les échantillons. Utiliser un embout de micropipette P1000 et/ou P200 pour une élimination efficace de préservation solution RNA.
ATTENTION : Jeter la solution décantée préservation appropriée, basée sur les propriétés infectieuses de l’agent pathogène utilisés ainsi que les dangers chimiques et environnementales de la solution de conservation tel qu’indiqué sur la fiche de données de sécurité.
Remarque : Les directives fournies ici sont fournis pour la solution de préservation de RNA décrite dans la Table des matières. Consulter les directives du fabricant si vous utilisez des solutions de rechange de préservation.
4. le traitement des ganglions lymphatiques de l’ARN
ATTENTION : Porter une blouse, des gants et une protection oculaire appropriée pour les étapes de traitement.
Note : Le réactif à base de phénol utilisé ici est décrite dans la Table des matières (et le protocole est basé sur les directives du fabricant)20. L’utilisation de réactifs alternatifs à base de phénol peut nécessiter une modification de la procédure, basée sur les recommandations du fabricant pour le produit acheté.
- Avant d’accéder à des échantillons, pré aliquote du réactif à base de phénol frais (4 ° C) aux tubes d’homogénéisation (1,5 mL/tube), l’aide d’une pipette.
ATTENTION : Le phénol est toxique, corrosif et dangereux pour la santé. Le chloroforme est toxique et dangereux pour la santé. Toutes les étapes de traitement 4.1 à 4.9 sous une hotte chimique et porter des gants pour éviter tout contact avec des produits chimiques. Aux États-Unis, le chloroforme est un déchet dangereux ; Débarrassez-vous des tubes contenant des déchets dangereux selon les directives locales et institutionnelles. Processus des échantillons de tissus provenant d’animaux infectés par des agents pathogènes relevant de la BSL-2 correspondant, BSL-3 ou lignes directrices BSL-4. - Une fois qu’un échantillon peut être desserré provenant des tubes de microcentrifuge avec une pince propre, immédiatement transférer environ 50-100 mg du tissu préservé dans le tube de l’homogénéisation contenant le réactif à base de phénol.
- Limiter la décongélation avant l’addition pour le réactif à base de phénol. Utiliser le stockage sur glace sèche lors de plusieurs échantillons sont retirés du congélateur à la transformation.
- Étroitement bouchon du tube, placez-le sur l’homogénéisateur et homogénéiser l’échantillon avec un homogénéisateur rotor-stator de tissu dans le réactif à base de phénol. Compléter le traitement à température ambiante. Lorsque terminé, vérifier pour un aspect nuageux pour s’assurer que l’échantillon a été homogénéisé avec succès ; les tissus doivent être dispersées dans une suspension trouble.
Remarque : Un réglage de 2 min RNA extraction est utilisé (le paramètre prédéfini de RNA_02_1 pour l’homogénéisateur décrit dans la Table des matières; conçu pour denrées congelées). Rotor-stator précisé dans le présent protocole (voir la Table des matières) est grand-denté et adaptés pour l’homogénéisation d’un éventail de types de tissus, y compris les matériaux fibreux. Le paramètre RNA_02_01 est spécialement conçu pour les congelés (par opposition à des frais) les tissus. Comme les ganglions lymphatiques ont des composants du tissu conjonctif fibreux, un homogénéisateur rotor-stator de même optimisé est recommandé de réaliser une dissociation efficace. Voir le National Institute of Environmental Health Sciences21 pour plus d’informations sur les recommandations de l’homogénéisation.- Si les grands morceaux de tissu restent après l’homogénéisation, répéter l’homogénéisation. Afin de récupérer efficacement les l’ARN, le tissu doit être bien dissocié.
- Pour des pièces de ganglion lymphatique plus fibreux, utilisez pinces et ciseaux pour hacher avant la pièce de ganglion lymphatique en plusieurs petits morceaux avant le transfert vers le tube d’homogénéisation. Comme décrit dans l’introduction, ganglion lymphatique tissus provenant d’animaux plus âgés peuvent être plus fibreux.
Remarque : Si vous souhaitez une double analyse de l’hôte et l’agent pathogène RNA, traitement supplémentaire (par exemple, homogénéisation de la perle) peut être nécessaire pour la récupération de l’ARN bactérien, en particulier si les pathogènes Gram-positifs sont présents dans les tissus.
- Immédiatement retirer l’échantillon homogénéisé des tubes et transférez-le vers exempte de RNase microtubes à (2,0 mL en taille) avec une micropipette P1000.
- Centrifuger l’échantillon pendant 5 min à 12 000 x g à 4 ° C pour éliminer les débris de l’échantillon. En utilisant un embout de micropipette P1000, transférer le surnageant dans un tube de microcentrifuge fraîches, abandonnant le culot.
- Incuber le surnageant pendant 5 min à température ambiante. Diviser chaque échantillon entre deux 1,5 microtubes à centrifuger.
- Ajouter 0,2 mL de chloroforme par 1 mL du réactif base phénol (c.-à-d., 0,3 mL d’un échantillon de 1,5 mL) ; retourner à la main pendant 1 à 2 min à mélanger les phases, mais ne pas vortexer l’échantillon. Il incuber pendant 2 min à température ambiante.
- Il Centrifuger pendant 15 min à 12 000 x g à 4 ° C.
- Retirer délicatement la phase aqueuse limpide supérieure avec une extrémité d’une micropipette (P1000 ou P200) qui forme la couche supérieure, sans perturber l’interphase ou la couche rouge de phénol-chloroforme. Transférer dans un nouveau tube de microcentrifuge.
- Mélangez-le avec un volume égal d’éthanol à 100 % ; mélanger en retournant le tube 4 - 5 fois. Le tube apparaîtra souvent nuageux.
- Avec une pointe de micropipette, transférer le liquide dans une colonne de base de silice commercial spin, pour purifier et éluer l’ARN, suite d’instructions du fabricant22. Éluer la généré à partir de l’ARN ~ 50 mg de tissu dans 50-100 µl d’eau exempte de RNase.
Remarque : Pendant que l’extraction du réactif à base de phénol supprime l’ADN dans la phase organique, pour l’utilisation en aval de l’ARN en qRT-PCR et/ou les demandes de RNA-sequencing, un traitement supplémentaire des échantillons d’ARN à la DNase est recommandé. - Aliquoter le RNA éluée pour séparer les tubes devant servir à une évaluation de quantification et de la qualité, afin de réduire tout gel-dégel de l’échantillon principal des RNA. Transférer les tubes à-80 ° C pour le stockage.
- Dans le cas de ganglion lymphatique échantillons provenant d’animaux infectés par des agents pathogènes zoonotiques, en particulier sur le niveau de confinement de niveau de biosécurité 3, valider l’échantillon de RNA qui en résulte pour l’absence des agents pathogènes, si l’échantillon sera déplacé vers une zone de confinement de niveau biosafety inférieure pour l’analyse de la qualité, RT-PCR ou préparation de bibliothèque de RNA-sequencing.
Remarque : Il est essentiel de tenir compte des réglementations locales, et si les directives de l’inactivation de CDC (Centers for Disease Control and Prevention) pour travail avec agents sélectionnés, il est nécessaire de valider toutes les procédures d’inactivation au site local du chercheur.- Retirer 1/10ème volume de chaque échantillon de RNA éluée étape 4.12 (c.-à-d., 5 µl de 50 µl de l’ARN total). En utilisant une technique stérile, mélanger l’échantillon avec 100 µl de bouillon la croissance bactérienne dans un tube de microtubes stériles de 1,5 mL. À l’aide d’un écarteur en plastique stérile, étendre le mélange de RNA-bouillon sur toute la surface d’une gélose.
Remarque : Sélectionnez un bouillon type et agar plaque conforme à la croissance de l’agent pathogène avec laquelle les animaux ont été contestés. - Incuber la gélose dans des conditions spécifiques à la croissance de l’agent pathogène avec laquelle les animaux ont été contestés. Vérifier l’absence de bactéries récupérés avant d’enlever les échantillons de l’enceinte de confinement de niveau de biosécurité 3.
Remarque : L’ARN éluée qui en résulte, après des tests d’intégrité et de quantification est adapté aux applications en aval, y compris un RNA-séquençage et l’analyse par RT-PCR.
- Retirer 1/10ème volume de chaque échantillon de RNA éluée étape 4.12 (c.-à-d., 5 µl de 50 µl de l’ARN total). En utilisant une technique stérile, mélanger l’échantillon avec 100 µl de bouillon la croissance bactérienne dans un tube de microtubes stériles de 1,5 mL. À l’aide d’un écarteur en plastique stérile, étendre le mélange de RNA-bouillon sur toute la surface d’une gélose.
- Évaluer la récupération de RNA et de la pureté à l’aide d’un spectrophotomètre. Pour évaluer la qualité de RNA, charger 1-2 µl de l’échantillon de RNA éluée au spectrophotomètre pour une analyse. Enregistrer un spectre de l’échantillon dans l’ultra-violet (UV).
- Le spectre UV, enregistrer le A/a260280 ratio, le A/a260230 ratio et la valeur de260 A pour l’exemple (A = Absorbance).
- Comme ARN simple brin à une concentration de 40 µg/mL a une absorbance de 1.0 à 260 nm, calculer la concentration en ARN (µg/mL) en multipliant l’A260 x 40 pour les échantillons purifiés.
- Comme une méthode rapide d’évaluation de l’intégrité du RNA, afin d’exclure tout échantillon de dégradé de l’analyse, mélanger 2 µl de chaque échantillon de RNA avec 4 µl de colorant de 1,5 x formamide chargement [IC95 désionisée formamide, 0.025 % (p/v) de bleu de bromophénol, 0.025 % (p/v) de xylène cyanol, 5 mM EDTA (pH 8.0), 0.025 % (p/v) SDS] dans 1,5 mL tubes de microcentrifuge23,24.
- Chauffer les tubes à 70 ° C pendant 1 min et puis transférez les tubes à la glace pendant 1 min.
- Charger les échantillons à un gel d’agarose de 1 % préparée en 1 x TBE (pour une description complète d’un gel d’agarose native pour l’ARN, voir Rio, Ares Jr., Hannon et Nilsen)24. Séparez les échantillons par des méthodes d’électrophorèse sur gel standard et confirmer la présence de bandes d’ARNr 28 s et 18 s.
- Suivi de l’électrophorèse de gel avec des méthodes d’analyse quantitative pour la détermination de l’intégrité de RNA [par exemple, une analyse (RNA intégrité nombre) Bioanalyzer et RIN] tel que décrit dans les Résultats de représentant et Mueller, O. et al. 25 et Schroeder, a. et al. 26.
5. méthode d’Extraction alternative de fixés au formol, tissus inclus en paraffine (FFIP)
Remarque : Bien que la préservation des tissus FFPE ne représente pas la méthode plus robuste de la préservation de l’acide nucléique, le protocole présenté ci-dessous peut être un moyen d’étudier certains changements transcriptionnelles lorsque les autres tissus conservés ne sont pas disponibles.
- Préparer des réactifs de formol pour la préservation des tissus en débitant du formol dans des contenants en plastique. Les tissus doivent être conservés dans du formol avec un ratio de formol : tissu de 20:1 volume/poids, respectivement.
ATTENTION : Le formol est un carcinogène humain connu et bien que pas une toxicité aiguë, une exposition chronique (généralement au moyen de vapeurs inhalées) peut représenter un danger important pour la santé. Une ventilation adéquate et EPI (p. ex., l’utilisation de gants en nitrile, être effectué moins de 15 min après l’exposition initiale) sont tenus de réduire au minimum les risques pour la santé. Se référer à la norme de formaldéhyde OSHA (29 CFR 1910.1048) pour plus d’informations sur l’évaluation des risques et de surveillance de l’exposition.
Remarque : À l’aide de formol trop peu peut influer sur la capacité du tissu à devenir entièrement conservée lorsqu’il est submergé dans le préservatif. - Après l’isolement du tissu d’intérêt, couper avec précaution le tissu à moins de 5 mm d’épaisseur.
- Avec une pincette, soigneusement submerger le tissu coupé dans le formol pour minimiser toute projection.
Remarque : Les tissus doivent être complètement immergées dans du formol pour permettre une fixation complète. Il est essentiel que toutes les surfaces du tissu sont complètement recouvertes de formol.
- Avec une pincette, soigneusement submerger le tissu coupé dans le formol pour minimiser toute projection.
- Une fois que les tissus ont été submergés dans du formol, permettent la fixation du tissu se produise pendant au moins 24 h à température ambiante.
Remarque : Formol tissus pénètre lentement, à raison de 1 mm à l’heure de toutes les surfaces27,28. Par conséquent, gardant l’épaisseur des sections de tissu à moins de 5 mm implique dans une fixation rapide du tissu entier. - Après fixation, transférer les tissus à un réactif approprié pour l’enrobage de paraffine.
Remarque : par exemple, les tissus examinés dans ce manuscrit ont été transférés à l’éthanol à 70 % avant l’incorporation. - Incorporez les tissus dans la paraffine. 29
- Section du tissu à 10-80 µm d’épaisseur (utilisation de 10 à 20 µm si miRNA désire extraire)29.
- Bistouri et forceps, prélever un morceau de tissu de 40 mg de chaque échantillon afin d’être traitées et le placer dans un tube à centrifuger stérile, exempte de nucléase.
- Utiliser un kit commercial conçu pour le déparaffinage et récupération de l’acide nucléique des échantillons de tissu FFPE extraire les échantillons conservés de RNA.
Remarque : Le kit référencé dans la Table des matières utilise xylène et éthanol lave pour enlever la paraffine, une étape de traitement de protéase et un filtre en fibre de verre pour purifier les RNA.
Résultats
L’utilisation des considérations présentées dans cet article (étapes 1 à 4 du protocole) aidera à la récupération de l’ARN de grands échantillons d’animaux qui convient à une analyse en aval dans les études d’expression génique hôte. La qualité de RNA pour applications en aval est évaluée par plusieurs mesures standards. Pour spectrophotométrie, la A/a260280 ratio donne une mesure de la contamination de la protéine, et l’A260/a230 ratio fournit un au...
Discussion
La majorité des études transcriptomique et les protocoles associés se consacrée sur la souris, le rat ou post-mortem des échantillons humains. Cependant, enquêtes du bétail et la faune offrent un large éventail de possibilités pour la caractérisation de la réponse immunitaire à la maladie, tant qu’il y a lieu, à la médecine vétérinaire et, en ce qui concerne les maladies zoonotiques, pour la santé publique humaine. Ce protocole a donné un aperçu des considérations clés pour l’extraction de l’AR...
Déclarations de divulgation
Les auteurs n’ont aucun conflit d’intérêt à divulguer. Toute la recherche est financée avec des fonds intra-muros de la U.S. Department of Agriculture, Agricultural Research Service. Toutes les références à des produits spécifiques sont fournis dans le but de reproductibilité expérimentale et ne constituent pas un endossement de ces produits par le gouvernement fédéral.
Remerciements
Les auteurs tiennent à remercier James Fosse pour son excellent travail sur tous les vidéographie et traitement vidéo ; Michael Marti pour son excellent travail dans la génération des images numérisées de bétail ; Lilia Walther pour son aide avec l’extraction de l’ARN et Bioanalyzer s’exécute ; Mitch Palmer et Carly Kanipe pour leur examen utile et commentaires sur les images de ganglion lymphatique ; et le soin des animaux et du personnel vétérinaire à l’Animal National Disease Center pour l’ensemble de leur travail acharné et l’aide à l’élevage et la préparation des autopsies.
matériels
| Name | Company | Catalog Number | Comments |
| RNA preservation solution (we used RNALater for all experiments) | ThermoFisher | AM7020 | |
| 1.5 ml or 2 ml polypropylene microcentrifuge tubes | Fisher Scientific | 05-408-129 | |
| Disposable scalpels | Daigger Scientific | EF7281 | |
| Tissue forceps, rat tooth | Fisher Scientific | 12-460-117 | Other tissue forceps available including curved tip, tapered edge, etc. , depends on user preference |
| 3 mm punch biopsy needles | Fisher Scientific | NC9949469 | |
| Sharps container (small and transportable for necropsy) | Stericycle | 8900SA | 1 qt. size shown here |
| Cutting boards or disposable trays | Fisher Scientific | 09-002-24A | Available in a variety of sizes, depends on user preference |
| Personal protective equipment | Varies with pathogen (gloves, respirator masks, goggles, etc.) | ||
| Phenol-based RNA extraction reagent (we used TRIzol Reagent for all experiments) | ThermoFisher | 15596026 | |
| Silica column-based RNA extraction kit (we used the PureLink RNA Mini kit for all experiments) | ThermoFisher | 12183018A | Designed for up to 100 mg tissue |
| 100% Ethanol (200 proof for molecular biology) | Sigma-Aldrich | E7023 | |
| Tissue homogenizer with enclosed homogenization tubes (we used the gentleMACS dissociator for all experiments) | Miltenyi Biotec | 130-093-235 | |
| Agarose (General, for gel electrophoresis) | Sigma-Aldrich | A9539 | |
| 1X TBE | Fisher Scientific | BP24301 | Can also make from scratch in the laboratory |
| Deionized formamide | EMD Millipore | S4117 | |
| Sodium dodecyl sulfate | Sigma-Aldrich | L3771 | |
| Bromophenol blue | Sigma-Aldrich | 114391 | |
| Xylene cyanol | Sigma-Aldrich | X4126 | |
| EDTA (Ethylenediaminetetraacetic acid) | Sigma-Aldrich | EDS | |
| UV-Vis Spectrophotometer (we used the NanoDrop Spectrophotometer) | ThermoFisher | ND-2000 | |
| Device for quantitative RNA assessment (we used the Bioanalyzer, with associated components and protocols) | Agilent | G2939BA | |
| FFPE RNA extraction kit (we used the RecoverAll Total Nucleic Acid Isolation Kit for Formalin Fixed, Paraffin Embedded Tissue) | ThermoFisher | AM1975 | |
| Plastic spreader (L-shaped spreader) | Fisher Scientific | 14-665-231 | Only needed for sterility testing for samples from infected animals |
| Necropsy knives | Livestock Concepts | WI-0009209 |
Références
- Tizioto, P. C., et al. Immunological response to single pathogen challenge with agents of the bovine respiratory disease complex: an RNA-sequence analysis of the bronchial lymph node transcriptome. PLoS One. 10 (6), e0131459 (2015).
- Miller, L. C., et al. Analysis of the swine tracheobronchial lymph node transcriptomic response to infection with a Chinese highly pathogenic strain of porcine reproductive and respiratory syndrome virus. BMC Veterinary Research. 8, 208 (2012).
- Silva, T. M. A., Costa, E. A., Paixao, T. A., Tsolis, R. M., Santos, R. L. Laboratory animal models for brucellosis research. Journal of Biomedicine and Biotechnology. 2011, 518323 (2011).
- Willard-Mack, C. L. Normal structure, function, and histology of the lymph nodes. Toxicologic Pathology. 34, 409-424 (2006).
- Elmore, S. A. Histopathology of the lymph nodes. Toxicologic Pathology. 34 (5), 425-454 (2006).
- Luscieti, P., Hubschmid, T. h., Cottier, H., Hess, M. W., Sobin, L. H. Human lymph node morphology as a function of age and site. Journal of Clinical Pathology. 33 (5), 454-461 (1980).
- Hadamitsky, C., et al. Age-dependent histoarchitectural changes in human lymph nodes: an underestimated process with clinical relevance?. Journal of Anatomy. 216 (5), 556-562 (2010).
- Sisson, S., Grossman, J. D., Getty, R. . Sisson and Grossman’s The Anatomy of Domestic Animals, Volume 1. , (1975).
- Olsen, S. C., Johnson, C. Comparison of abortion and infection after experimental challenge of pregnant bison and cattle with Brucella abortus strain 2308. Clinical and Vaccine Immunology. 18 (12), 2075-2078 (2011).
- Brichta-Harhay, D. M., et al. Microbiological analysis of bovine lymph nodes for the detection of Salmonella enterica. Journal of Food Protection. 75 (5), 854-858 (2012).
- Samuel, J. L., O’Boyle, D. A., Mathers, W. J., Frost, A. J. Isolation of Salmonella from mesenteric lymph nodes of healthy cattle at slaughter. Research in Veterinary Science. 28 (2), 238-241 (1980).
- Arthur, T. M., et al. Prevalence and characterization of Salmonella in bovine lymph nodes potentially destined for use in ground beef. Journal of Food Protection. 71 (8), 1685-1688 (2008).
- Cray, W. C., Moon, H. W. Experimental infection of calves and adult cattle with Escherichia coli O157:H7. Applied and Environmental Microbiology. 61 (4), 1586-1590 (1995).
- Thiermann, A. B. Experimental leptospiral infections in pregnant cattle with organisms of the Hebdomadis serogroup. American Journal of Veterinary Research. 43 (5), 780-784 (1982).
- Palmer, M. V., Waters, W. R., Whipple, D. L. Investigation of the transmission of Mycobacterium bovis from deer to cattle through indirect contact. American Journal of Veterinary Research. 65 (11), 1483-1489 (2004).
- Chomczynski, P. A reagent for the single-step simultaneous isolation of RNA, DNA, and proteins from cell and tissue samples. BioTechniques. 15 (3), 532-537 (1993).
- Chomczynski, P., Sacchi, N. Single step method of RNA isolation by acid guanidinium thiocyanate-phenol-chloroform extraction. Analytical Biochemistry. 162 (1), 156-159 (1987).
- Vogelstein, B., Gillespie, D. Preparative and analytical purification of DNA from agarose. Proceedings of the National Academy of Sciences of the United States of America. 76 (2), 615-619 (1979).
- . . AVMA Guidelines for the Euthanasia of Animals. , (2013).
- . . TRIzol Reagent Manual. , (2016).
- . . Disruption and Homogenization of Tissue for the Extraction of RNA. , (2014).
- . . PureLink RNA Mini Kit Protocol . , (2012).
- . . RNA Gel-loading Buffer. , (2006).
- Rio, D. C., Ares, M., Hannon, G. J., Nilsen, T. W. Nondenaturing Agarose Gel Electrophoresis of RNA. Cold Spring Harbor Protocols. , (2010).
- Mueller, O., et al. A microfluidic system for high-speed reproducible DNA sizing and quantitation. Electrophoresis. 21 (1), 128-134 (2000).
- Schroeder, A., et al. The RIN: an RNA integrity number for assigning integrity values to RNA measurements. BMC Molecular Biology. 7 (3), (2006).
- Suvarna, K. S., Layton, C., Bancroft, J. D. . Bancroft’s Theory and Practice of Histological Techniques. , (2012).
- Medawar, P. B. The rate of penetration of fixatives. Journal of Microscopy. 61 (1-2), 46-57 (1941).
- Canene-Adams, K. Preparation of formalin-fixed paraffin-embedded tissue for immunohistochemistry. Methods in Enzymology. 533, 225-233 (2013).
- Fleige, S., Pfaffl, M. W. RNA integrity and the effect on the real-time qRT-PCR performance. Molecular Aspects of Medicine. 27, 126-139 (2006).
- Fajardy, I., et al. Time course analysis of RNA stability in human placenta. BMC Molecular Biology. 10 (21), (2009).
- Bahar, B., et al. Long-term stability of RNA in post-mortem bovine skeletal muscle, liver and subcutaneous adipose tissues. BMC Molecular Biology. 8, 108 (2007).
- Yamagishi, A., et al. Gene profiling and bioinformatics analyses reveal time course differential gene expression in surgically resected colorectal tissues. Oncology Reports. 31 (4), 1532-1538 (2014).
- Choi, S., Ray, H. E., Lai, S. H., Alwood, J. S., Globus, R. K. Preservation of multiple mammalian tissues to maximize science return from ground based and spaceflight experiments. PLoS One. 11 (12), e0167391 (2016).
- Almeida, A., Thiery, J. P., Magdelenat, H., Radvanyi, F. Gene expression analysis by real-time reverse transcription polymerase chain reaction: influence of tissue handling. Analytical Biochemistry. 328 (2), 101-108 (2004).
- Lee, S. M. L., Schelcher, C., Thasler, R., Schiergens, T. S., Thasler, W. E. Pre-analytical determination of the effect of extended warm or cold ischaemia on RNA stability in the human ileum mucosa. PLoS One. 10 (9), e0138214 (2015).
- Kap, M., et al. The influence of tissue procurement procedures on RNA integrity, gene expression, and morphology in porcine and human liver tissue. Biopreservation and Biobanking. 13 (3), 200-206 (2015).
- Hong, S. H., et al. Effects of delay in the snap freezing of colorectal cancer tissues on the quality of DNA and RNA. Journal of the Korean Society of Coloproctology. 26 (5), 316-325 (2010).
- Lee, S. M., et al. RNA stability in human liver: comparison of different processing times, temperatures and methods. Molecular Biotechnology. 53 (1), 1-8 (2013).
- Morrison, P. K., et al. Post-mortem stability of RNA in skeletal muscle and adipose tissue and the tissue-specific expression of myostatin, perilipin and associated factors in the horse. PLoS One. 9 (6), e100810 (2014).
- Seear, P. J., Sweeney, G. E. Stability of RNA isolated from post-mortem tissues of Atlantic salmon (Salmo salar L.). Fish Physiology and Biochemistry. 34 (1), 19-24 (2008).
- Marchuk, L., Sciore, P., Reno, C., Frank, C. B., Hart, D. A. Postmortem stability of total RNA isolated from rabbit ligament, tendon, and cartilage. Biochimica et Biophysica Acta. 1379 (2), 171-177 (1998).
- Inoue, H., Kimura, A., Tuji, T. Degradation profile of mRNA in a dead rat body: basic semi-quantification study. Forensic Science International. 130 (2-3), 127-132 (2002).
- Micke, P., et al. Biobanking of fresh frozen tissue: RNA is stable in nonfixed surgical specimens. Laboratory Investigation. 86 (2), 202-211 (2006).
- Srinivasan, M., Sedmak, D., Jewell, S. Effect of fixatives and tissue processing on the content and integrity of nucleic acids. The American Journal of Pathology. 161 (6), 1961-1971 (2002).
- Ahmed, A. M., et al. Variation in the ovine abomasal lymph node transcriptome between breeds known to differ in resistance to the gastrointestinal nematode. PLoS One. 10 (5), e0124823 (2015).
- Russell, G. C., et al. Host gene expression changes in cattle infected with Alcelaphine herpesvirus 1. Virus Research. 169 (1), 246-254 (2012).
- Avraham, R., et al. A highly multiplexed and sensitive RNA-seq protocol for simultaneous analysis of host and pathogen transcriptomes. Nature Protocols. 11, 1477-1491 (2016).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon