Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Сбор и обработка лимфатических узлов от крупных животных для анализа РНК: подготовка исследований транскриптомики Лимфоузел крупных видов животных
В этой статье
Резюме
Этот протокол обеспечивает обзор процедур для изоляции РНК для профилирования транскриптомики Лимфоузел тканей от крупных животных, включая шаги в процессе идентификации и иссечение лимфоузлов от скота и диких животных, выборки подходы чтобы обеспечить согласованность несколько животных и соображения плюс представитель результаты для сохранения после сбора и обработки для анализа РНК.
Аннотация
Крупные животные (скота и диких животных) служат в качестве важных водохранилищ зоонозными патогенами, включая бруцеллы, Mycobacterium bovis, сальмонеллаи кишечная палочкаи являются полезными для изучения патогенеза и/или распространение бактерий в естественных хостов. С помощью ключевых функции лимфатических узлов в иммунного ответа тканей лимфатических узлов служат потенциальным источником РНК для вниз по течению транскриптомики анализа, для того чтобы оценить временные изменения в экспрессии генов в клетках в течение инфекции. Эта статья содержит обзор процесса лимфатических узлов коллекции, ткани проб и ниже по течению РНК переработки скота, используя крупного рогатого скота (Bos taurus) в качестве модели, с дополнительные примеры из американских бизонов (Бизон, Бизон ). Протокол включает в себя сведения о местонахождении, идентификации и удаления лимфатических узлов из нескольких ключевых узлов в организме. Кроме того методология отбора проб биопсии представлена который позволяет для соответствия выборки через несколько животных. Обсуждаются несколько соображений охраны образцов, включая поколения РНК подходит для вниз по течению методологии как РНК последовательности и RT-PCR. Вследствие длительных задержек, присущих крупных животных против мыши время курса исследований представитель от зубров и говядину Лимфоузел тканей результаты для описания время курс деградации в этом типе ткани, в контексте обзора предыдущие методологической работы по деградации РНК в других тканях. В целом этот протокол будет полезным для обоих ветеринарных исследователей, начиная с транскриптом проекты на больших животных образцы и молекулярные биологи заинтересованы в изучении методов для обработки в пробирке и в естественных условиях выборки ткани.
Введение
РНК последовательности анализа транскриптом лимфатических узлов обеспечивает возможность характеризовать иммунная реакция животных на целый ряд патогенов. Хотя эта методология широко использовались в мышей, анализ недавно расширяется в больших млекопитающих1,2. Скот и крупных животных лимфатические узлы могут использоваться для характеризуют разместить ответы на инфекции, не только для их использования в вакцины или генетической предрасположенности исследований, так и для определения целевых показателей для разработки лекарственных средств, но и как модель системы для человека исследования на зоонозных заболеваний. Например в случае бруцеллеза (зоонозных бактериальных заболеваний, что воздействие полмиллиона людей во всем мире каждый год), несмотря на значительно увеличить расходы, исследования в овец или коз более актуальны для инфицирования человека и человеческой вакцины развития, чем лабораторные животные модели. Модели мыши инфекции пилки ретикулоэндотелиальной системы инфекции, но не характерных клинических признаков3.
В крупных животных эксперименты по сравнению с лабораторных исследований на животных процесс ткани, уборки обязательно включает в себя более длительную задержку между эвтаназии и ткани коллекции, которая представляет собой потенциальный вызов для сохранения высокое качество РНК. Нетронутыми РНК имеет важное значение для поколения биологически соответствующих транскриптомики данных. Поколения высокого качества РНК из образцов ткани особенно важно для крупных животных патогенов исследований проводится в изолирующего оснащения. Такие исследования являются по своей сути сложнее выполнять, поскольку они не только требуют утверждения зал и высоко квалифицированного персонала, но также осуществляем значительные финансовые расходы, которые, в зависимости от работы, может варьироваться от нескольких десятков до сотен тысяч долларов. Эти типы исследований также включать кросс дисциплинарного сотрудничества и кросс дисциплинарного знания для их завершения, добавляя к их сложности. Таким образом, обучение, развитие и приверженность рациональной системы для сбора и сохранения обеспечивает значительные преимущества течению молекулярных исследований тканей от зараженных животных.
В коллекции более крупных лимфатических узлов представлены дополнительные проблемы для коллекции тканей, по сравнению с аналогичными выборки мышиных лимфатических узлов. Подготовка образца иссечение требует базового понимания анатомии лимфатических узлов, включая соответствующих внутренних структур. Структуры лимфатического узла состоит из лимфоидных долек, окруженный пазухи заполнены с лимфы. Эти структуры заключаются в жесткой, фиброзной капсулы. 4 лимфоидных долька является «основной анатомической и функциональной единицей лимфатических узлов» и состоит из фолликулов, глубоко корковых подразделение и Медуллярного шнуры и пазухах4 (рис. 1A). Лимфоцитов T и B являются домом для фолликулов и глубоко корковых единиц, соответственно. Эти структуры обеспечивают 3D леску и облегчить взаимодействие между лимфоцитов и антиген или антиген представляющих клеток.
Грубо, фолликулы и глубоко корковые блоки могут быть определены на поверхности среза как они содержат более плотной сети ретикулярные и темнее чем придаточных пазух носа, которые состоят из более тонкие ретикулярных сеть и светлее (рис. 1B). Конвенцией патологов относятся к области лимфатических узлов как поверхностные коры (фолликулов), paracortex (глубоко корковых единиц) и продолговатого мозга (Медуллярного шнуры и придаточных пазух носа). Надлежащее рассмотрение всех трех регионов был признан как лучший практика в обычной патологических экспертизе лимфатические узлы5. Обратите внимание, что существуют значительные различия в последовательности, размер и цвет лимфатических узлов, даже в пределах одного животного. Как возраст животных их лимфатических узлов, как правило, будет уменьшаться в размерах и становятся тверже, чем у молодых животных, обычно за счет увеличения их соединительной ткани и сокращение нормальных лимфоидных структуры6,7.

Рис. 1. Анатомия лимфатического узла. (A) это изображение мультфильм показывает анатомию лимфоузлов, изображающие ключевых структур. (B) это еще изображение показывает бычий лимфоузлов, сократить в поперечном сечении. Будут выделены соответствующие структуры/слои, которые видны невооруженным глазом. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
В зависимости от экспериментальных вопрос различные лимфатические узлы будут представлять интерес для сбора и анализа. Периферические лимфатические узлы являются те расположен глубоко в подкожной клетчатке. Крупного рогатого скота, периферийных устройств или поверхностные лимфатические узлы часто используются в клинической и экспериментальной практике включают околоушной, подчелюстные, заглоточный, предлопаточные, предбедренные (precrural) и поверхностные паховые (supramammary у самок, мошонки у самцов) () Рисунок 2). В таблице 1изложены свойства ключевых поверхностных лимфатических узлов, как описано в8системы крупного рогатого скота. Ниже представлены некоторые потенциальные лимфатических узлов коллекции планы инфекционных бактериальных болезней крупного рогатого скота как отправной точки для проведения расследования.
Бруцеллы абортуса/бруцеллы melitensis: стандарт necropsies для B. абортуса-инфицированных скот и B. melitensis-инфицированных коз в национальном центре болезни животных восстановить supramammary, prescapular и околоушной лимфатический узел ткани , как для измельчения для бактериальных перечисления, а также для подготовки РНК для профилирования выражение принимающей РНК. B. абортуса может восстанавливаться регулярно в каждом из этих лимфатических узлов в экспериментально зараженных скота9. Присутствие бактерий в каждом из этих типов лимфатических узлов может быть обнаружен в B. melitensis-инфицированных коз до по меньшей мере девять месяцев послеоперационные инфекции с использованием методологии на базе РНК из нашего исследования (Boggiatto et al., неопубликованные). Сальмонелла SP.: prescapular, лимфатического (предбедренные), и брыжеечных лимфатические узлы были полезны во время профилирования туш крупного рогатого скота для сальмонеллы распространенности10,и11,12 и бы потенциальный интерес для транскриптомики исследования. Кишечной палочки O157: H7: брыжеечных лимфатические узлы (в среднем тонкой кишки и дистальной части тонкой кишки местах) могут быть сайты время от времени восстановления бактерий в зараженных телят (но не в инфицированного взрослого скота)13. Лептоспироз (Лептоспире sp.): хронический сохранение бактерий наблюдается в лимфатических узлах, осушение молочной железы14. Mycobacterium bovis : Крупного рогатого скота бактерии были восстановленные после экспериментальной инфекции от средостения и Трахеобронхиальные лимфоузлы телят15. Кроме того лимфоузлов РНК была использована для изучения крупных животных принимающих ответы вирусов, таких как вирус свиного репродуктивного и респираторных синдром2. Рисунок 2 изображает расположение подмножество этих крупных лимфатических узлов в организме скота.
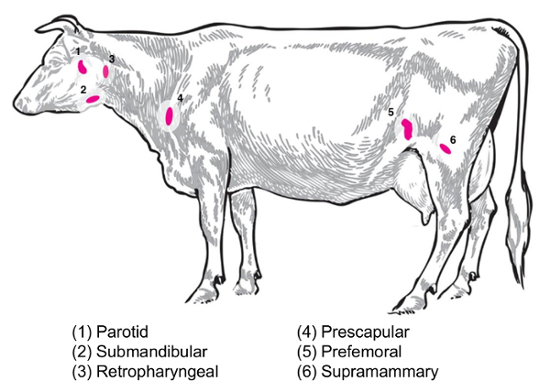
Рисунок 2: Мультфильм с изображением выбранной Лимфоузел мест в Bos taurus . Аннотированная пронумерованных лимфатические узлы. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
В этом документе и связанные видео мы представляем собой протокол для изоляции крупных лимфатических узлов животных РНК исследований, разработан, чтобы быть информативным для молекулярные биологи, участвующих в исследованиях транскриптомики крупных животных инфекций. Во-первых мы предоставляем обзор процедуры изоляции лимфатических узлов, используя выборки из тканей говядину и зубров в качестве примеров. В паре с этой демонстрации, как показано в видео, — это рабочий процесс для воспроизводимых ткани выборки для изоляции РНК. Далее мы описывают важные соображения для обработки зараженных лимфатических узлов, с уделением особого внимания безопасности, согласованности и качества РНК.
Подготовка РНК из ткани с Изотиоцианаты реактивом подкисленных фенол Гуанидин основывается на оригинальный метод Chomczynski и Сакки16,17, с очисткой столбцов на основе силики спина в присутствии chaotropic агенты, основанный на оригинальной работой Фогельштейна и Гиллеспи18. Мы также изучить возможности для восстановления РНК для transcriptomics от скота лимфатических узлов, консервированные в альтернативных методов. Наконец, мы исследуем влияние переменной среды на качество РНК в крупных животных necropsies, включая представителя эксперимент с изображением эффект увеличения времени между эвтаназии и выборки на восстановленные профиль РНК из зубров и говядину лимфатические узлы. Эта статья будет полезна не только молекулярные биологи, но также для ветеринарных исследователей, начиная с исследования транскриптомики.
протокол
Животных патанатомия процедур, изображен здесь охватываются утвержденных IACUC протоколов в национальном центре болезни животных, Эймс, НМА. Все эксперименты проводились в соответствии с утвержденными руководящими принципами для ухода за животными и благополучия.
1. Предварительное планирование перед патанатомия
- Перед вскрытие Подготовьте следующие материалы для транспортировки патанатомия люкс:
- 1.5 или 2 мл microcentrifuge трубы заполнены с ~ 1,0 мл раствора сохранение РНК, в стойку или транспортного контейнера. Обязательно следуйте рекомендациям производителя соотношение объема раствора сохранения объема ткани.
- Одноразовые скальпели и чистый, газобетона пинцет: один набор для рассечения кожи и другой набор для сбора лимфатических узлов (один для каждого лимфоузлов, одно животное), таким образом предотвращая перекрестного загрязнения кожи и окружающей флоры с лимфатических узлов тканей.
- 3 мм пробивать биопсии инструменты, патанатомия ножи, Шарпс контейнер для используемых скальпели и биопсия инструменты и разделочные доски или одноразовые поддоны для использования в лимфодиссекции.
- Используйте средства индивидуальной защиты, включая средства индивидуальной защиты, необходимой для работы на соответствующем уровне BSL для системы.
- Автоклав Многоразовые металлические инструменты, щипцы, в том числе в металлические лотки до вскрытие, использование посуды/галантерея параметр.
2. выявление и отбор проб из лимфатических узлов в крупного рогатого скота и зубров
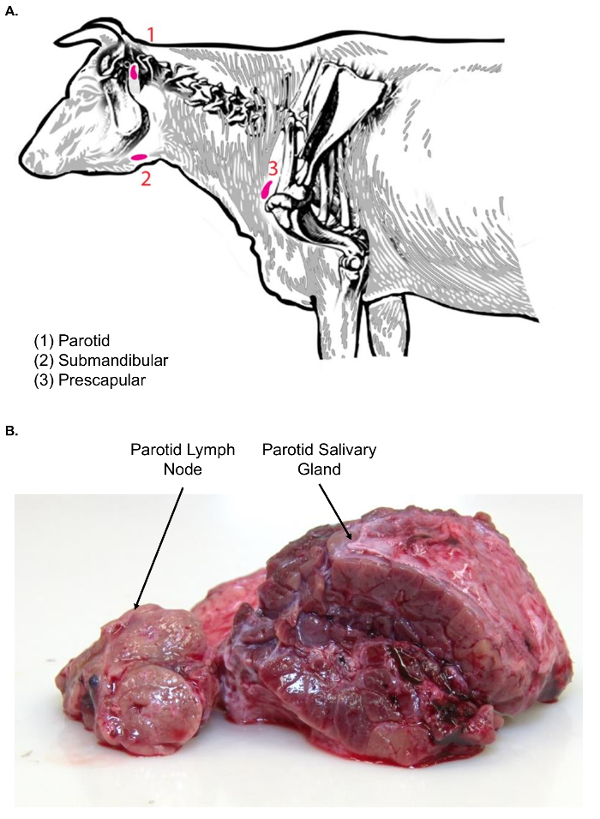
Рисунок 3 . Лимфатические узлы говядину головы и шеи. (A) это изображение мультфильм показывает выбранный лимфатические узлы головы и шеи Bos taurus. (B) это изображение показывает околоушной лимфоузлов в поперечном сечении (слева) по сравнению с околоушной слюнной железы в поперечном сечении (справа). Обратите внимание на разницу в текстуры между типами двух тканей. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
-
Изоляция предлопаточные лимфатических узлов в крупного рогатого скота и Бизон
- Усыпить животных (крупного рогатого скота или зубров любого возраста, в случае необходимости для эксперимента) на основе местных протокола IACUC. Подтвердите смерть, описанных в институциональных протокол IACUC, включая отсутствие сердцебиения, отсутствие дыхания и отсутствие роговицы рефлекс. Перемещение животных на вскрытие этаж.
Примечание: Существуют различные методы гуманного эвтаназии, используется в лабораторной практике крупных животных. Однако внутривенного введения раствора Натрий Пентобарбитал натрия и фенитоин является наиболее часто одобрил и использовать форму. Консультироваться AVMA руководящие принципы для эвтаназии животных. 19
Предупреждение: Выполните все протоколы соответствующих биобезопасности для патанатомия на принимающее учреждение, включая руководящие принципы для безопасного удаления Шарпс контейнер прокола доказательство и обеззараживания Многоразовые металлические ножи и пинцет. Этот протокол создает колющих от использования одноразовые скальпели. Носите личного защитного снаряжения, как продиктовано институциональных руководящих принципов, включая сапоги, Спецодежда, перчатки и средства защиты глаз. - Определите 3 участников для работы на в животных тканях.
Примечание: Здесь, диссектор 1 будет отвечает за крупномасштабных секционирование желаемого тканей животных, диссектор 2 будет восстановить лимфатических узлов из разных животных секций и диссектор 3 будет работать в отдельную таблицу для изоляции секций от каждого лимфоузлов и передача их в пробирки с раствором консервант. - Начните с размещения животных в боковых recumbency.
- Расширить плеча, перемещая передних конечностей обратно на уровне колена (запястье); Это движение будет вернуть плеча и позволяют легче пальпация лимфатических узлов. Чувствовать себя на наличие лимфатического узла «комок».
Примечание: Во время болезни условия, лимфаденопатия могут присутствовать, что облегчает выявление лимфатических узлов, но этот процесс также может повлиять на согласованность, состав и архитектуры лимфатических узлов. - После того, как расположены и с плечу продлен до сих пор, используйте скальпелем или вскрытие нож, чтобы сделать разрез кожи по контуру плеча.
Примечание: Не ограничивать размер разреза, даже если расположен через пальпация лимфатических узлов. Большой разрез обеспечивает легкий доступ к более глубокие ткани и облегчает диссектор иссечение лимфоузлов. - Используя пару щипцов, втягивать кожу, чтобы выявить точки плеча и шеи мускулатура.
Примечание: Предлопаточные Лимфоузел часто встречается в подкожно-жировой клетчатки, особенно в overconditioned животных. - Еще раз ощупывайте расположения лимфоузлов (рис. 3A).
Примечание: В отличие от подкожной жировой клетчатки, лимфатических узлов проведет свою форму, когда пальпируется. Кроме того лимфатические узлы не являются смежными с любой окружающие ткани, как они заключены в тонкой фиброзной капсулы. - После обнаружения предлопаточные лимфоузел, тщательно анализировать подкожный жир, с помощью скальпеля и щипцы и изолировать лимфатических узлов.
- Посмотрите на наличие тонкой фиброзной капсулы, как показано на рисунке 1B, различать лимфоузлов и жировой ткани; лимфатические узлы не являются смежными с любой окружающие ткани.
- Трансфер лимфатических узлов в таблице диссекции лимфатических узлов, используя пластиковый лоток для передачи ткани, для дальнейшего секционирование.
Примечание: Внешний вид этих лимфатических узлов в зубров похож. Связанные видео изображает вид предлопаточные Лимфоузел как расчлененное из правого плеча Американский бизон.
- Усыпить животных (крупного рогатого скота или зубров любого возраста, в случае необходимости для эксперимента) на основе местных протокола IACUC. Подтвердите смерть, описанных в институциональных протокол IACUC, включая отсутствие сердцебиения, отсутствие дыхания и отсутствие роговицы рефлекс. Перемещение животных на вскрытие этаж.
-
Изоляция околоушные лимфатические узлы в крупного рогатого скота и Бизон
- Начните с размещения животных в боковых recumbency на дне вскрытие. Найдите височно-нижнечелюстного сустава (ВНЧС).
- Если это трудно найти, медленно двигайте нижней челюсти и определить расположение, в котором челюсти придает черепа; Это височно-нижнечелюстного сустава.
- С помощью скальпеля или вскрытие нож, тщательно сделайте надрез в коже. Запустите разрез спинной к суставу и продлить его вентрально/вертикально вдоль линии подбородка.
- Рассечения кожи от показывают, подкожной клетчатки. Околоушной слюнной железы будет виден во-первых, из-за ее большого размера, lobulated внешний вид поверхности и красную окраску.
- Использование щипцы и скальпеля, переместить околоушной слюнной железы сторону, чтобы найти околоушной лимфатический узел сидит просто черепной и медиальнее слюнной железы (рис. 3A). Изучите околоушной лимфатический узел ткани для текстуры перед дальнейшей обработкой.
Примечание: лимфатические узлы лица (околоушной и подчелюстные) связаны с слюнных желез, которые можно смешивать изоляции лимфатических узлов. По сравнению с лимфатических узлов слюнные железы гораздо крупнее и имеют lobulated внешний вид поверхности. Кроме того на поверхности среза, слюнные железы однородный характер и не проявляют классический коркового и мозгового архитектурный шаблон лимфатических узлов (рис. 3B). - Акцизный железы с помощью скальпеля. Передача его в таблице диссекции лимфатических узлов, используя пластиковый лоток для передачи ткани, для дальнейшего секционирование.
- Начните с размещения животных в боковых recumbency на дне вскрытие. Найдите височно-нижнечелюстного сустава (ВНЧС).
-
Изоляция supramammary лимфатических узлов в женские скотин и Бизон
- Место животного в боковых recumbency.
- Поднимите заднюю ногу подвергать паховой области и найдите вымени.
Примечание: В здоровой, не кормящих животных, пальпация лимфатических узлов может оказаться невозможным. В кормящих животных эти лимфатические узлы могут быть ощутима на хвостовой границе базы вымени. - С помощью скальпеля, надрезают просто спинной к вымени, идущую вдоль верхней части ноги, чтобы разоблачить supramammary желез.
- Вскрыть подкожной клетчатки и найти supramammary лимфоузел, встроенных в тонкий слой подкожного жира. Если не визуально различимы, ощупывайте подвергаются ткани на наличие твердой структуры в подкожной клетчатке.
- С помощью щипцов и скальпеля, тщательно анализировать из лимфоузлов от жира. Передача его в таблице диссекции лимфатических узлов, используя пластиковый лоток для передачи ткани, для дальнейшего секционирование.
3. Вырезание и хранения лимфатических узлов
- Передайте изолированных лимфатические узлы от диссектор 2 для dissector 3 столом рассечение, прилегающих к основным патанатомия пространства. Поместите каждый Лимфоузел на свежем срезе разделочную доску. Предварительно ярлык разделочные доски в разделах, лимфатических узлов, чтобы облегчить получение нескольких лимфатических узлов в порядке правопреемства. Для инфекционных образцов используйте Одноразовые лотки.
- С помощью щипцов и одноразовые скальпелем или вскрытие нож, удалите раздел лимфатического узла. Используя острый нож, сделайте Сагиттальный разрез открыть лимфатических узлов.
- Изучение внутренних лимфатических узлов, особенно в образцах, взятых из зараженных животных, ищет асимметрия, поражения, цветовые различия, и т.д. запись замечания.
-
(Вариант 1) Малые ткани разделы
- Используйте одноразовые скальпели для акцизных штук каждого лимфоузлов, которые находятся менее чем в 5 мм в толщину и передавать каждый кусок трубки с решением сохранение РНК чистым пинцетом.
-
(Вариант 2) Лимфатических узлов биопсии или секционирование методологии
Примечание: Биопсии или секущей методологий, при применении к параллельной Лимфоузел секции через различные узлы и животных, обеспечивают согласованность пробы ткани для массового анализа РНК.-
Клин, секционирование метод
- После изучения сагиттальное сечение захвата клетки через профиль лимфатических узлов, акцизный пирог форменный клин от лимфатического узла, от центра к внешней капсулы. Для узла 2 см в ширину (стандартный размер; см. таблицу 1), вырезать клин к центру, что внешней дуги длиной 4 мм и толщиной 5 мм будет иметь живого веса ~ 100 мг.
- С помощью скальпеля, вырезать клин на мелкие кусочки, не толще 5 мм и примерно 50-100 мг каждый весом влажных тканей.
Примечание: Для обеспечения согласованности процесса все клин куски от одного лимфатического узла, либо в одном пакете или в отдельных труб следуют РНК, объединения для обеспечения представительного профиль РНК из лимфатических узлов, представляющих интерес. - Поместите куски ткани с щипцами в пробирки, содержащие по крайней мере 10 томов РНК сохранения решения, по сравнению с объемом ткани.
-
Пробивать биопсии метод
- Выберите инструмент биопсии удара, если цель состоит в сборе конкретных разделов, например конкретных фолликулов от узла. Выберите инструмент в соответствии с размером выборки, желательных для коллекции. Punch биопсии инструменты доступны в диапазоне размеров от 1 до 8 мм в диаметре.
- Визуально найти области, представляющие интерес для образца в лимфатических узлов.
- Используйте инструмент биопсии удара для акцизных секции интересов, нажатие и превращения ткани для создания основной инструмент. Передать кусок ткани с щипцами трубка, содержащая по меньшей мере 10 томов РНК сохранения решения. Если толще, чем 5 мм, используйте щипцы и скальпеля для дальнейшего разделения тканей на более мелкие куски.
-
Клин, секционирование метод
- После того как образцы были переданы сохранения решения (например., RNALater), транспортировать их обратно в лабораторию при комнатной температуре.
- Храните образцы на 4 ° C на ночь для проникновения в ткани.
- На следующий день, слить избыток консервант раствор РНК и хранить образцы тканей при температуре-80 ° C. Удалите столько консервант максимально до замораживания образцы. Используйте кончик микропипеткой P1000 и/или Р200 для эффективного удаления консервант раствор РНК.
Предупреждение: Слейте отстой сохранения решения надлежащим образом, основываясь на свойствах инфекционный возбудитель, использованы, а также химических и экологических опасностей консервант решения, указанного в паспорте безопасности.
Примечание: Рекомендации, представленные здесь предоставляются для сохранения решения РНК, описанные в Таблица материалов. Проконсультируйтесь с изготовителя, если с помощью сохранения альтернативных решений.
4. обработка от РНК лимфатических узлов
Предупреждение: Носите пальто лаборатории, перчатки и защиты надлежащего глаз для шаги обработки.
Примечание: На основе фенола реагент, используемый здесь описан в Таблице материалов (и протокол основан на руководящих принципах изготовителя)20. Использование альтернативных реагентов на основе фенол может потребовать изменения процедуры, на основе рекомендаций изготовителя конкретного продукта приобретен.
- До доступа к образцов, предварительно Алиготе охлажденные (4 ° C) на основе фенола реагент для гомогенизации трубы (1,5/мл), с помощью пипетки.
ОСТОРОЖНОСТЬ: Фенол, токсичные, коррозионные и опасность для здоровья. Хлороформ-токсичных и опасность для здоровья. Выполните обработку 4.1-4.9 Химический вытяжной шкаф и носить перчатки, чтобы предотвратить любой контакт с химикатами. В Соединенных Штатах хлороформ является опасных отходов; распоряжаться трубок, содержащих опасные отходы согласно местным и институциональных руководящих принципов. Процесс образцы ткани из животных, зараженных патогенов под соответствующий BSL-2, BSL-3 или BSL-4 руководящих принципов. - После того, как образец можно ослабил от трубы microcentrifuge чистым пинцетом, немедленно передать примерно 50-100 мг сохранившиеся ткани гомогенизации трубка, содержащая реагент на основе фенола.
- Ограничьте оттаивания перед добавлением к реагент на основе фенола. Используйте хранилище на сухой лед, когда несколько образцов удаляются из морозильной камеры для обработки.
- Плотно крышка трубки, поместите его на гомогенизатор и гомогенизации образца с ткани гомогенизатор Ротор Статор в реагент на основе фенола. Полная обработка при комнатной температуре. По завершении, проверьте на Пасмурное возникновение чтобы убедиться, что образец успешно гомогенизации; ткани следует быть рассеяны в пасмурный подвеска.
Примечание: Используется параметр извлечения 2 мин РНК (предустановленные настройки RNA_02_1 для гомогенизатор описанные в Таблица материалов; для замороженных тканей). Ротор Статор, указанных в настоящем Протоколе (см. Таблицу материалов) большой зубчатый и адаптирован для гомогенизации широкий спектр типов тканей, включая волокнистого материала. Параметр RNA_02_01 разработан специально для замороженных (в отличие от свежих) тканей. У компонентов волокнистой соединительной ткани, лимфатических узлов аналогично оптимизированный Ротор Статор гомогенизатор рекомендуется для достижения эффективной диссоциации. Смотрите Национального института медицинских наук окружающей среды21 за дополнительной информацией о гомогенизации рекомендаций.- Если после гомогенизации остаются большие куски ткани, повторите процедуру гомогенизации. Для того, чтобы эффективно восстановить РНК, должны также отделить ткани.
- Для более волокнистых частей лимфоузлов используйте щипцами и ножницы для предварительно нарезать кусок Лимфоузел на несколько меньших частей до передачи на трубу гомогенизации. Как описано во введении, тканей лимфатических узлов из старых животных может быть более волокнистая.
Примечание: Если двойной анализ хозяина и возбудителя РНК, дополнительная обработка (например, шарик гомогенизации) может быть необходимы для восстановления бактериальных РНК, особенно если в тканях присутствуют грамположительных возбудителей.
- Немедленно удалите гомогенизированных образцов из трубы и передать бесплатно РНКазы microcentrifuge трубы (2,0 мл в размер) с P1000 микропипеткой.
- Центрифуга для образца для 5 мин при 12000 x g при 4 ° C для удаления любой образец мусора. С помощью кончика микропипеткой P1000, супернатанта передать свежие microcentrifuge трубки, оставив гранулы.
- Инкубируйте супернатант 5 мин при комнатной температуре. Разделите каждый образец между двумя 1.5 microcentrifuge трубы.
- Добавить 0,2 мл хлороформа на 1 мл реагента на основе фенола (т.е., 0,3 мл 1,5 мл образца); Инвертируйте его вручную за 1-2 мин смешать этапы, но не вихревой образца. Проинкубируйте 2 мин при комнатной температуре.
- Центрифуга для 15 мин на 12000 x g при 4 ° C.
- Осторожно удалите верхний, ясно водные фазы с наконечником микропипеткой (P1000 или Р200), который будет образуют верхний слой, не нарушая интерфаза или слой красного фенол хлороформ. Перевести его на новые пробки microcentrifuge.
- Смешать с равным объемом 100% этанола; тщательно смешайте его переворачивать трубка 4 - 5 раз. Трубка будет часто появляются облачность.
- С наконечником микропипеткой передача жидкости в столбец на основе силики коммерческих спина, для дальнейшей очистки и элюировать РНК, следуя инструкциям производителя22. Элюировать РНК, образующиеся ~ 50 мг ткани в 50-100 мкл РНКазы свободной воды.
Примечание: в то время как добыча реагент на основе фенола удаляет ДНК в органической фазе, ниже по течению использования РНК в qRT-PCR и/или РНК виртуализации приложений, рекомендуется дополнительная обработка образцов РНК с DNase. - Алиготе eluted РНК отделить трубы для использования в количественной оценки и оценку качества, уменьшить любые замораживания отогрева основной выборки РНК. Передача трубы до-80 ° C для хранения.
- В случае образцов лимфоузлов, получены от животных, зараженных с зоонозными патогенами, особенно на уровне сдерживания BSL-3 Проверьте полученный образец РНК для отсутствие патогенов, если образца будут перемещены в нижней области уровня сдерживания биобезопасности для качественного анализа, RT-PCR, и/или РНК последовательности библиотеки подготовка.
Примечание: Очень важно учитывать местные правила, и в случае руководящие принципы инактивации CDC (центры по контролю и профилактике заболеваний) для работы с агентов, надо проверить все инактивации процедуры на локальном сайте исследователя.- Удаление 1/10й объем каждого eluted РНК выборки из шага 4.12 (т.е., 5 мкл от 50 мкл всего РНК). С помощью стерильных, смешайте образца с 100 мкл концентрированного бульона рост бактерий в стерильных 1,5 мл microcentrifuge. С помощью стерильных пластиковых разбрасыватель, распространение РНК отвара смеси по всей поверхности плиты агара.
Примечание: Выберите бульон тип и агар плиты в соответствии с ростом патоген, с которым были оспорены животных. - Инкубируйте плита агара в условиях, характерных для роста патоген, с которым были оспорены животных. Проверьте отсутствие восстановленные бактерий перед удалением образцы из сдерживания BSL-3.
Примечание: Результате eluted РНК, после количественной оценки и проверки целостности, подходит для нисходящие приложения, включая РНК последовательности и ПЦР-анализа.
- Удаление 1/10й объем каждого eluted РНК выборки из шага 4.12 (т.е., 5 мкл от 50 мкл всего РНК). С помощью стерильных, смешайте образца с 100 мкл концентрированного бульона рост бактерий в стерильных 1,5 мл microcentrifuge. С помощью стерильных пластиковых разбрасыватель, распространение РНК отвара смеси по всей поверхности плиты агара.
- Оценки, восстановления РНК и чистоты, используя спектрофотометр. Для оценки качества РНК, загрузите 1-2 мкл eluted РНК образца к спектрофотометру для анализа. Запись спектр образца в ультрафиолетовой (УФ) диапазоне.
- С УФ-спектре, записать соотношение 280/a A260, коэффициент230 260/a A и значение260 A для образца (A = поглощения).
- Как одноцепочечной РНК в концентрации 40 мкг/мл поглощения 1.0 на 260 Нм, рассчитать концентрации РНК (мкг/мл) путем умножения A260 x 40 для очищенного образцов.
- Как быстрый метод оценки целостности РНК чтобы исключить любые деградированных образцы из дальнейшего анализа, смешайте 2 мкл каждого образца РНК с 4 мкл 1,5 x formamide загрузки красителя [95% деионизированная формамид, 0,025% (w/v) бромфеноловый синий, 0,025% (w/v) ксилол cyanol, 5 мм ЭДТА (рН 8.0), 0,025% (w/v) SDS] в 1,5 мл microcentrifuge трубы23,24.
- Тепловые трубы при 70 ° C за 1 мин, а затем перенесите трубы для льда за 1 мин.
- Загрузить образцы к гель агарозы 1%, подготовленный в 1 x TBE (полное описание родной геля агарозы для РНК, см. в Рио, Ares младший, Ханнон и Нильсен)24. Отдельные образцы стандартных гель электрофорез методами и подтвердить наличие 28S и 18S рибосомной РНК полос.
- Следить гель-электрофорез с количественные методы анализа для определения целостности РНК [например, Bioanalyzer и Рин (РНК целостности номер) анализ] как описано в Представитель результаты и Мюллер, о.в. и др. 25 и Шредер, а. и др. 26.
5. альтернативные извлечения метода от формалин исправлена, парафин врезанных (FFPE) тканей
Примечание: Хотя FFPE ткани сохранение не представляют собой наиболее надежный метод сохранения нуклеиновых кислот, протокол, представленные ниже может быть способ для изучения некоторых transcriptional изменений, когда недоступны другие сохранившиеся ткани.
- Подготовьте формалин реагентов для сохранения ткани, дозирования формалина в пластиковые контейнеры. Ткани должны быть сохранены в формалине с в соотношении 20:1 формалин: ткани объем/вес, соответственно.
Предупреждение: Формалин является известный канцероген человека и хотя не высокотоксичные, хронического воздействия (обычно путем вдыхания паров) может представлять значительную здоровью. Чтобы свести к минимуму риски для здоровья требуются надлежащей вентиляции и СИЗ (то есть, использовать нитриловые перчатки, чтобы быть изменены в течение 15 минут после первоначального воздействия). Обратитесь к стандарту OSHA формальдегида (29 CFR 1910.1048) для получения дополнительной информации об экспозиции мониторинга и оценки рисков.
Примечание: Использование слишком мало формалин может повлиять на способность ткани при погруженной в консервант, стать полностью сохраняется. - После изоляции ткани интерес тщательно Обрежьте ткань до менее чем 5 мм в толщину.
- С помощью щипцов, тщательно погружаться обрезанной ткани в формалин, чтобы свести к минимуму любые брызги.
Примечание: Ткани необходимо полностью погружать в формалином для полной фиксации. Важно, что все поверхности ткани полностью покрыты с формалином.
- С помощью щипцов, тщательно погружаться обрезанной ткани в формалин, чтобы свести к минимуму любые брызги.
- Как только ткани были затоплены в формалине, позволяют для фиксации ткани для по крайней мере за 24 ч при комнатной температуре.
Примечание: Формалин проникает ткани медленно, со скоростью 1 мм в час от всех поверхностей27,28. Таким образом сохраняя толщину разделов ткани до менее чем 5 мм результаты в быстрой фиксации всей ткани. - После фиксации передавать соответствующий реагент для встраивания парафин ткани.
Примечание: например, тканей, рассмотренных в этой рукописи были переведены в 70% этанол до внедрения. - Встройте тканей в парафин. 29
- В разделе ткани до 10-80 мкм толщина (использование 10-20 мкм Мирна по желанию быть извлечены)29.
- С помощью скальпеля и щипцы, удалите 40 мг кусок ткани из каждого образца обрабатываться и поместить его в трубку стерильные, свободной от нуклеиназы отцентрифугировать.
- Использование коммерческих комплект, предназначенный для депарафинизации и восстановления нуклеиновых кислот FFPE образцов ткани для извлечения РНК из сохранившихся образцов.
Примечание: Комплект, ссылка в Таблице материалов использует ксилол и этанола смывки для удаления парафина, шаг лечения протеазы и стекло волокна фильтра для очистки РНК.
Результаты
Использование соображений, представленных в этой статье (шаги 1-4 протокола) поможет в восстановлении РНК от крупных животных образцы, подходит для вниз по течению анализа в исследованиях выражение гена хоста. Несколько стандартных мер оценивается качество РНК в нисходящие приложения. ...
Обсуждение
Большинство транскриптомики исследований и связанных с ними протоколов сосредоточиться на мыши, крысы или post-mortem образцах. Однако исследования на домашний скот и диких животных предоставляют широкий спектр возможностей для характеризации иммунной реакции на болезни, как применимые ?...
Раскрытие информации
Авторы не имеют никаких конфликтов интересов раскрыть. Все исследования финансируется с очной средств от Департамента сельского хозяйства США, Служба сельскохозяйственных исследований. Все ссылки на конкретные продукты предоставляются для целей экспериментальной воспроизводимость и не представляют собой какого-либо одобрения этих продуктов федеральным правительством.
Благодарности
Авторы хотели бы поблагодарить Джеймса Fosse за его отличную работу на всех видеосъемка и видео обработка; Майкл Marti за его прекрасную работу в генерации изображения оцифрованных скота; Lilia Walther за ее помощь с РНК добыча и Bioanalyzer бежит; Митч Палмер и Карли Канип за их полезный обзор и обратной связи на изображениях лимфатических узлов; и уход за животными и ветеринарных сотрудников национального центра болезни животных для всех их напряженную работу и помощь с животноводством и подготовки necropsies.
Материалы
| Name | Company | Catalog Number | Comments |
| RNA preservation solution (we used RNALater for all experiments) | ThermoFisher | AM7020 | |
| 1.5 ml or 2 ml polypropylene microcentrifuge tubes | Fisher Scientific | 05-408-129 | |
| Disposable scalpels | Daigger Scientific | EF7281 | |
| Tissue forceps, rat tooth | Fisher Scientific | 12-460-117 | Other tissue forceps available including curved tip, tapered edge, etc. , depends on user preference |
| 3 mm punch biopsy needles | Fisher Scientific | NC9949469 | |
| Sharps container (small and transportable for necropsy) | Stericycle | 8900SA | 1 qt. size shown here |
| Cutting boards or disposable trays | Fisher Scientific | 09-002-24A | Available in a variety of sizes, depends on user preference |
| Personal protective equipment | Varies with pathogen (gloves, respirator masks, goggles, etc.) | ||
| Phenol-based RNA extraction reagent (we used TRIzol Reagent for all experiments) | ThermoFisher | 15596026 | |
| Silica column-based RNA extraction kit (we used the PureLink RNA Mini kit for all experiments) | ThermoFisher | 12183018A | Designed for up to 100 mg tissue |
| 100% Ethanol (200 proof for molecular biology) | Sigma-Aldrich | E7023 | |
| Tissue homogenizer with enclosed homogenization tubes (we used the gentleMACS dissociator for all experiments) | Miltenyi Biotec | 130-093-235 | |
| Agarose (General, for gel electrophoresis) | Sigma-Aldrich | A9539 | |
| 1X TBE | Fisher Scientific | BP24301 | Can also make from scratch in the laboratory |
| Deionized formamide | EMD Millipore | S4117 | |
| Sodium dodecyl sulfate | Sigma-Aldrich | L3771 | |
| Bromophenol blue | Sigma-Aldrich | 114391 | |
| Xylene cyanol | Sigma-Aldrich | X4126 | |
| EDTA (Ethylenediaminetetraacetic acid) | Sigma-Aldrich | EDS | |
| UV-Vis Spectrophotometer (we used the NanoDrop Spectrophotometer) | ThermoFisher | ND-2000 | |
| Device for quantitative RNA assessment (we used the Bioanalyzer, with associated components and protocols) | Agilent | G2939BA | |
| FFPE RNA extraction kit (we used the RecoverAll Total Nucleic Acid Isolation Kit for Formalin Fixed, Paraffin Embedded Tissue) | ThermoFisher | AM1975 | |
| Plastic spreader (L-shaped spreader) | Fisher Scientific | 14-665-231 | Only needed for sterility testing for samples from infected animals |
| Necropsy knives | Livestock Concepts | WI-0009209 |
Ссылки
- Tizioto, P. C., et al. Immunological response to single pathogen challenge with agents of the bovine respiratory disease complex: an RNA-sequence analysis of the bronchial lymph node transcriptome. PLoS One. 10 (6), e0131459 (2015).
- Miller, L. C., et al. Analysis of the swine tracheobronchial lymph node transcriptomic response to infection with a Chinese highly pathogenic strain of porcine reproductive and respiratory syndrome virus. BMC Veterinary Research. 8, 208 (2012).
- Silva, T. M. A., Costa, E. A., Paixao, T. A., Tsolis, R. M., Santos, R. L. Laboratory animal models for brucellosis research. Journal of Biomedicine and Biotechnology. 2011, 518323 (2011).
- Willard-Mack, C. L. Normal structure, function, and histology of the lymph nodes. Toxicologic Pathology. 34, 409-424 (2006).
- Elmore, S. A. Histopathology of the lymph nodes. Toxicologic Pathology. 34 (5), 425-454 (2006).
- Luscieti, P., Hubschmid, T. h., Cottier, H., Hess, M. W., Sobin, L. H. Human lymph node morphology as a function of age and site. Journal of Clinical Pathology. 33 (5), 454-461 (1980).
- Hadamitsky, C., et al. Age-dependent histoarchitectural changes in human lymph nodes: an underestimated process with clinical relevance?. Journal of Anatomy. 216 (5), 556-562 (2010).
- Sisson, S., Grossman, J. D., Getty, R. . Sisson and Grossman’s The Anatomy of Domestic Animals, Volume 1. , (1975).
- Olsen, S. C., Johnson, C. Comparison of abortion and infection after experimental challenge of pregnant bison and cattle with Brucella abortus strain 2308. Clinical and Vaccine Immunology. 18 (12), 2075-2078 (2011).
- Brichta-Harhay, D. M., et al. Microbiological analysis of bovine lymph nodes for the detection of Salmonella enterica. Journal of Food Protection. 75 (5), 854-858 (2012).
- Samuel, J. L., O’Boyle, D. A., Mathers, W. J., Frost, A. J. Isolation of Salmonella from mesenteric lymph nodes of healthy cattle at slaughter. Research in Veterinary Science. 28 (2), 238-241 (1980).
- Arthur, T. M., et al. Prevalence and characterization of Salmonella in bovine lymph nodes potentially destined for use in ground beef. Journal of Food Protection. 71 (8), 1685-1688 (2008).
- Cray, W. C., Moon, H. W. Experimental infection of calves and adult cattle with Escherichia coli O157:H7. Applied and Environmental Microbiology. 61 (4), 1586-1590 (1995).
- Thiermann, A. B. Experimental leptospiral infections in pregnant cattle with organisms of the Hebdomadis serogroup. American Journal of Veterinary Research. 43 (5), 780-784 (1982).
- Palmer, M. V., Waters, W. R., Whipple, D. L. Investigation of the transmission of Mycobacterium bovis from deer to cattle through indirect contact. American Journal of Veterinary Research. 65 (11), 1483-1489 (2004).
- Chomczynski, P. A reagent for the single-step simultaneous isolation of RNA, DNA, and proteins from cell and tissue samples. BioTechniques. 15 (3), 532-537 (1993).
- Chomczynski, P., Sacchi, N. Single step method of RNA isolation by acid guanidinium thiocyanate-phenol-chloroform extraction. Analytical Biochemistry. 162 (1), 156-159 (1987).
- Vogelstein, B., Gillespie, D. Preparative and analytical purification of DNA from agarose. Proceedings of the National Academy of Sciences of the United States of America. 76 (2), 615-619 (1979).
- . . AVMA Guidelines for the Euthanasia of Animals. , (2013).
- . . TRIzol Reagent Manual. , (2016).
- . . Disruption and Homogenization of Tissue for the Extraction of RNA. , (2014).
- . . PureLink RNA Mini Kit Protocol . , (2012).
- . . RNA Gel-loading Buffer. , (2006).
- Rio, D. C., Ares, M., Hannon, G. J., Nilsen, T. W. Nondenaturing Agarose Gel Electrophoresis of RNA. Cold Spring Harbor Protocols. , (2010).
- Mueller, O., et al. A microfluidic system for high-speed reproducible DNA sizing and quantitation. Electrophoresis. 21 (1), 128-134 (2000).
- Schroeder, A., et al. The RIN: an RNA integrity number for assigning integrity values to RNA measurements. BMC Molecular Biology. 7 (3), (2006).
- Suvarna, K. S., Layton, C., Bancroft, J. D. . Bancroft’s Theory and Practice of Histological Techniques. , (2012).
- Medawar, P. B. The rate of penetration of fixatives. Journal of Microscopy. 61 (1-2), 46-57 (1941).
- Canene-Adams, K. Preparation of formalin-fixed paraffin-embedded tissue for immunohistochemistry. Methods in Enzymology. 533, 225-233 (2013).
- Fleige, S., Pfaffl, M. W. RNA integrity and the effect on the real-time qRT-PCR performance. Molecular Aspects of Medicine. 27, 126-139 (2006).
- Fajardy, I., et al. Time course analysis of RNA stability in human placenta. BMC Molecular Biology. 10 (21), (2009).
- Bahar, B., et al. Long-term stability of RNA in post-mortem bovine skeletal muscle, liver and subcutaneous adipose tissues. BMC Molecular Biology. 8, 108 (2007).
- Yamagishi, A., et al. Gene profiling and bioinformatics analyses reveal time course differential gene expression in surgically resected colorectal tissues. Oncology Reports. 31 (4), 1532-1538 (2014).
- Choi, S., Ray, H. E., Lai, S. H., Alwood, J. S., Globus, R. K. Preservation of multiple mammalian tissues to maximize science return from ground based and spaceflight experiments. PLoS One. 11 (12), e0167391 (2016).
- Almeida, A., Thiery, J. P., Magdelenat, H., Radvanyi, F. Gene expression analysis by real-time reverse transcription polymerase chain reaction: influence of tissue handling. Analytical Biochemistry. 328 (2), 101-108 (2004).
- Lee, S. M. L., Schelcher, C., Thasler, R., Schiergens, T. S., Thasler, W. E. Pre-analytical determination of the effect of extended warm or cold ischaemia on RNA stability in the human ileum mucosa. PLoS One. 10 (9), e0138214 (2015).
- Kap, M., et al. The influence of tissue procurement procedures on RNA integrity, gene expression, and morphology in porcine and human liver tissue. Biopreservation and Biobanking. 13 (3), 200-206 (2015).
- Hong, S. H., et al. Effects of delay in the snap freezing of colorectal cancer tissues on the quality of DNA and RNA. Journal of the Korean Society of Coloproctology. 26 (5), 316-325 (2010).
- Lee, S. M., et al. RNA stability in human liver: comparison of different processing times, temperatures and methods. Molecular Biotechnology. 53 (1), 1-8 (2013).
- Morrison, P. K., et al. Post-mortem stability of RNA in skeletal muscle and adipose tissue and the tissue-specific expression of myostatin, perilipin and associated factors in the horse. PLoS One. 9 (6), e100810 (2014).
- Seear, P. J., Sweeney, G. E. Stability of RNA isolated from post-mortem tissues of Atlantic salmon (Salmo salar L.). Fish Physiology and Biochemistry. 34 (1), 19-24 (2008).
- Marchuk, L., Sciore, P., Reno, C., Frank, C. B., Hart, D. A. Postmortem stability of total RNA isolated from rabbit ligament, tendon, and cartilage. Biochimica et Biophysica Acta. 1379 (2), 171-177 (1998).
- Inoue, H., Kimura, A., Tuji, T. Degradation profile of mRNA in a dead rat body: basic semi-quantification study. Forensic Science International. 130 (2-3), 127-132 (2002).
- Micke, P., et al. Biobanking of fresh frozen tissue: RNA is stable in nonfixed surgical specimens. Laboratory Investigation. 86 (2), 202-211 (2006).
- Srinivasan, M., Sedmak, D., Jewell, S. Effect of fixatives and tissue processing on the content and integrity of nucleic acids. The American Journal of Pathology. 161 (6), 1961-1971 (2002).
- Ahmed, A. M., et al. Variation in the ovine abomasal lymph node transcriptome between breeds known to differ in resistance to the gastrointestinal nematode. PLoS One. 10 (5), e0124823 (2015).
- Russell, G. C., et al. Host gene expression changes in cattle infected with Alcelaphine herpesvirus 1. Virus Research. 169 (1), 246-254 (2012).
- Avraham, R., et al. A highly multiplexed and sensitive RNA-seq protocol for simultaneous analysis of host and pathogen transcriptomes. Nature Protocols. 11, 1477-1491 (2016).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены