需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
用体外激酶法鉴定细胞周期蛋白依赖性激酶1特异磷酸化部位
摘要
细胞周期蛋白依赖性激酶 1 (Cdk1) 在 G2 阶段被激活并且调控许多细胞通路。在这里, 我们提出了一个协议的体外激酶检测与 Cdk1, 这使得识别 Cdk1-specific 磷酸化的网站, 以建立细胞目标的这个重要的激酶。
摘要
周期蛋白依赖性激酶 1 (Cdk1) 是一个主控制器为细胞周期在所有真核生物和 phosphorylates 估计 8-13% 的蛋白质组;然而, 已确定的 Cdk1 目标的数目, 特别是在人类细胞中的数量仍然很低。Cdk1-specific 磷酸化部位的鉴定是重要的, 因为它们提供了机械的洞察力如何 Cdk1 控制细胞周期。细胞周期调节对忠实的染色体分离至关重要, 而在这个复杂过程中的缺陷导致染色体畸变和癌症。
在这里, 我们描述了一个体外激酶检测, 用于识别 Cdk1-specific 磷酸化部位。在本试验中, 纯化蛋白是通过商业上可获得的人类 Cdk1/cyclin 磷酸化而成的体外b. 成功的磷酸酶是由 SDS 页确认的, 并且随后用质谱法鉴定磷酸的部位。我们还描述了纯化的协议, 产生高纯度和均匀的蛋白质制剂, 适合于激酶的检测, 和结合试验的功能验证鉴定的磷酸化部位, 探讨之间的相互作用经典核定位信号 (cNLS) 及其核传输受体 karyopherin α。为了辅助实验设计, 我们回顾了从蛋白质序列预测 Cdk1-specific 磷酸化部位的方法。这些协议一起提供了一个非常强大的方法, 产生 Cdk1-specific 磷酸化网站, 并使机械研究如何 Cdk1 控制细胞周期。由于这种方法依赖于纯化的蛋白质, 它可以应用于任何模型有机体和产生可靠的结果, 特别是当结合细胞功能研究。
引言
激酶是将磷酸酯从 ATP 转移到基质并调节许多细胞过程的酶。这种磷酸化是可逆的, 快速的, 增加两个负电荷, 并储存自由的能量, 是最常见的翻译后修改之一, 细胞使用。Cdk1, 也称为细胞分裂周期蛋白2同源 (cdc2) 是所有真核生物的细胞周期的主控制器1,2,3,4,5, 和 phosphorylates 一个估计8-13% 的蛋白质组6,7。
虽然最近的蛋白质组研究已经确定了许多蛋白质磷酸化部位, 在大多数情况下, 负责这些修改的激酶是未知的。已知的 Cdk1 目标 (特别是在人类细胞中) 的数量低7。Cdk1-specific 磷酸化部位的鉴定是很重要的, 因为它能使机械学研究确定 Cdk1 如何控制细胞周期。细胞周期调节对于忠实的染色体分离和细胞分裂是很重要的, 需要大量的细胞过程来支持这个重要的生理功能。这包括在有丝分裂开始前停止转录和翻译, 以及细胞结构和组织的戏剧性重组, 如核包膜的拆卸、染色体凝结和有丝分裂纺锤体的组装。这些过程中的放松管制和错误导致癌症、出生缺陷或有丝分裂细胞死亡。Cdk1 的特定抑制剂如 RO-3306 被开发了8, 为功能性研究提供强有力的工具, 并且其中一些抑制剂当前在临床试验为癌症治疗 (参见9为审查)。
在这里, 我们描述了一个体外激酶检测, 允许鉴定 Cdk1-specific 磷酸化部位。在这项试验中, 商业上可用的人类 Cdk1/cyclin B 用于 phosphorylate 纯化的目标蛋白体外。基板的磷酸化增加了其质量, 增加了两个负电荷;因此, 蛋白凝胶带在 SDS 页上的向上转移证实了成功的磷酸化。Cdk1-specific 磷酸化部位随后通过质谱分析对体外磷酸化蛋白进行鉴定。为了辅助实验设计, 我们还回顾了从蛋白质序列预测 Cdk1-specific 磷酸化部位的计算工具和参考文献。此外, 我们还描述了纯化的协议, 产生高纯度和同类蛋白制剂适合的激酶检测。最后, 确定的磷酸化部位必须经功能研究证实, 并在此描述一个简单的结合试验。结合, 这是一个非常强大的方法, 产生 Cdk1-specific 磷酸化网站, 并使机械研究如何 Cdk1 控制细胞周期7,10,11。由于这种方法依赖于纯化的蛋白质, 它可以应用于任何模型有机体, 并产生可靠的结果。但是, 建议对获得的磷酸化站点体外进行功能验证, 因为细胞有额外的调控机制, 如翻译后修改、交互伙伴或细胞定位,可能使磷酸化的网站容易被 Cdk1 承认或无法获得。
Cdk1 认识到一个协商一致的磷酸化站点, 它由 (x-赖氨酸/精氨酸) 组成, 其中 x-是任何残留物, 而丝氨酸或苏化是磷酸化的场所。特别重要的是要识别的是存在的脯氨酸在 +1 的位置。此外, 在 +2 或 +3 位中, 基本残留物是首选的, 大多数 Cdk1-specific 磷酸化站点含有赖氨酸或 Arg, 在 +3 位置6,12。
激活 Cdk1 被严密地调控并且导致有丝分裂的开始1,2,3,4,5。细胞周期蛋白依赖性激酶的活动一般取决于它们与不同的细胞周期蛋白 (周期蛋白 A、B、C、D 和 E 在人类中) 的关联, 这些都是以振荡的水平表达的, 在整个单元循环中13。Cdk1 的表达是恒定的在细胞周期和它的活动的章程依靠它与调控亚基周期蛋白 A 和细胞周期蛋白 B5,13,14,15的关联, 作为以及翻译后的修改。Cdk1/cyclin B 复合体的形成需要为激酶激活5,14,15,16,17,18。在 G2 阶段, 细胞周期蛋白 B 在细胞质中被翻译并导入到细胞核中, 它绑定到 Cdk15,14,15,16,17,18;然而, Cdk1/cyclin B 是由人类 Cdk1-inhibitory 激酶 Myt1 (与膜相关的酪氨酸-和苏氨酸特定 cdc2-inhibitory 激酶) 和 Wee1 分别在残留 Thr14 和 Tyr15 上的磷酸化而被灭活而成的19, 20,21。在晚期 G2 阶段, 细胞分裂周期25磷酸酶 (cdc25) 除磷 Thr14 和 Tyr15 激活 Cdk1/cyclin B 复合体的激酶活性并触发有丝分裂 12, 14,18,20,22,23. Thr161 的磷酸化也需要 Cdk1/cyclin B 活化, 并由 Cdk7、Cdk 活化激酶 (CAK)18介导。细胞周期蛋白 B 在后期钝化 Cdk1 中的降解, 允许从有丝分裂中退出24,25。因此, 活化 Cdk1/cyclin B 是一个复杂的过程。此处介绍的协议是用商用 Cdk1/cyclin B 进行的。在这种复杂的昆虫细胞的重组表达, 它是激活在体内由内源性激酶14,20 , 并保持活跃的纯化状态。所产生的活性, 重组人 Cdk1/cyclin B 适用于体外激酶测定。
在这里, 我们描述了在人类着丝粒蛋白 F (CENP)10 中鉴定 Cdk1-specific 磷酸化点的协议。CENP 是一种动粒蛋白, 驻留在细胞核中的大部分界面 (G1 和 s-阶段), 并导出到细胞质 G2 阶段 26, 27, 28 在 Cdk1-dependent 方式 10, 11. 核本地化由二分 cNLS26授予。cNLSs 由核运输因素 karyopherin α认可, 促进, 与 karyopherin β和 RanGDP 一起, 进口 cNLS-货物入核29。G2 阶段的核出口是通过未知的出口途径10来促进的。一旦 CENP 驻留在细胞质, 它被招募到核信封, 并反过来招募马达蛋白复合蛋白30,31。这一途径是重要的, 以蛋白的方式在有丝分裂纺锤体的初始阶段定位细胞核各自的中心体, 这对于正确的有丝分裂时机和大脑的基本过程是重要的。开发30,31,32。从 G2 阶段开始, CENP 也被组装到动粒中, 它对忠实的染色体隔离有重要的作用 27, 28, 33, 34, 35.这些路径的一个关键管理步骤是在 G2 阶段 CENP 的核输出, 它依赖于 Cdk110、11。这里我们描述了一个在 CENP cNLS 的 Cdk1-specific 磷酸化部位鉴定的协议。这些站点的 Phosphomimetic 突变减慢了 CENP 的核进口, 这表明 Cdk1/cyclin B 通过其 cNLS10的磷酸化直接调节 CENP F 的细胞定位。
总体而言, 此体外激酶检测允许识别激酶 Cdk1 的特定基底. 纯化靶蛋白是磷酸化体外由商业可利用的 Cdk1/cyclin B 复合体和磷酸化点随后用质谱法鉴定。Cdk1-specific 磷酸化部位的鉴定支持机械研究, 揭示了 Cdk1 如何控制细胞周期。
研究方案
1. 从蛋白质序列预测 Cdk1-specific 磷酸化部位
- 在开始激酶测定之前, 分析预测的 Cdk1-specific 磷酸化部位的蛋白质序列, 并在实验性地建立具有未知激酶特异性的磷酸化部位的文献。使用汇总的下列工具、数据库和引用。
- 使用 iGPS 3.0 软件36、37 (http://gps.biocuckoo.org/online_full.php) 预测目标蛋白质序列中的 Cdk1-specific 磷酸化站点。使用此处的链接进行全面的预测, 包括二次结构和表面可访问性的注释。
- 在软件中, 输入 FASTA 格式的蛋白质序列。对于激酶特异性, 请检查丝氨酸/苏氨酸激酶, CMGC, CDK, CDC2, CDK1, 并取消选中所有其他的特殊性。选择 "介质" 作为阈值, 然后单击提交按钮。
- 将结果预测的站点与 Cdk1 协商一致的磷酸化站点 (x-赖氨酸/Arg) 进行比较。
- 重要的是, 检查在磷酸化残留物旁边的脯氨酸的预测站点 (一些 Cdk1 基板是磷酸化在一个极小的站点 (系列/在 Pro)6,12)。此外, 检查在 +2 或 +3 位置首选的基本残留物, 其中大多数 Cdk1-specific 磷酸化站点含有赖氨酸或 Arg, 在 +3 位置6,12。
- 还要检查站点是否可以被识别, 因为完全一致的站点的存在不足以 Cdk1 磷酸化。
- 检查 iGPS 输出中的表面可访问性和二次结构预测注释, 说明是否预测该站点是否可访问;蛋白质的 N 和 C 终点在许多情况下是灵活和容易接近的为磷酸化。
- 如果目标蛋白的 X 射线结构可用, 检查其在结构中的位置, 查看所假定的磷酸化部位的可访问性。
- 使用 UniProtKB/瑞士-波特数据库38 (http://www.uniprot.org), 搜索用于实验性地建立具有未知激酶特异性的磷酸化部位的文献。
- 在搜索框中输入蛋白质的名称, 然后单击搜索按钮。选择正确的序列条目。磷酸化站点在氨基酸修改部分注明和引用。
- 人类细胞系有丝分裂提取物的蛋白质组学研究7,39,40, 这是特别有用的, 因为 Cdk1 在细胞周期的 G2 阶段变得活跃。
- 用 NLSmapper 识别二 cNLS (可选)。
注: 对于在细胞质和细胞核之间穿梭的蛋白质, 一种调节细胞定位的共同机制是 Cdk1 主要母题的-1 位置上的二 cNLS 的磷酸化。磷酸化取消了 G2 阶段的核本地化10,41,42,43。- 对于这种穿梭蛋白, 通过 NLSmapper43 (http://nls-mapper.iab.keio.ac.jp/cgi-bin/NLS_Mapper_form.cgi) 识别蛋白质序列中的 cNLS。将蛋白质序列作为文本粘贴到序列框中, 选择一个截止分数为 5.0, 然后在整个区域中选中搜索 NLS。单击预测 NLS按钮。
- 将由此产生的预测 cNLS 与二分 cNLS 的一致序列进行比较, 其中包括小的主题 (赖氨酸-Arg), 至少10残留物的链接器, 和主要的主题 (赖氨酸-赖氨酸/arg-X-赖氨酸/arg), 其中 x 是任何残留, 没有负电荷.
- 检查所预测的 Cdk1 磷酸化站点 (*) 是否位于链接器-1 位置的主要主题附近: 系列/x-x-赖氨酸-赖氨酸/arg-x-赖氨酸/arg。
注: Cdk1 的-1 位 cNLS 的磷酸化建立为几种穿梭蛋白的细胞定位调节机制10,41,42,43。
2. 重组蛋白在大肠杆菌中的表达
- 使用步骤 2.1. 1-2. 1.2 中的表达质粒在大肠杆菌中表达重组蛋白。
- 要创建人 CENP (残滓 2987-3065) 表达式构造, 可通过聚合酶链反应 (PCR) 从全长 CENP 结构 (基因库加入: U19769.1) 中放大 DNA 片段来生成插入。使用以下引物: AGTCGGGGATCCCAGCAATCTAAACAAGATTCCCG 和 AGTCGGCTCGAGTCATTATTCTGCAGGGTGAATACCACTCATG。
注: 全长人类 CENP 质粒是由中国科学院生物科学研究院的 x 博士慷慨提供的, 中国上海。- 使用 BamHI 和 XhoI 限制站点克隆插入到 pGEX6p1 向量中。用此质粒表达 n-端谷胱甘肽 s-转移酶 (GST) 融合蛋白 CENP F (残留物 2,987-3, 065)。
注: GST 标签可由 PreScission 蛋白酶 (从今以后称为 PS 蛋白酶) 来切割。
- 使用 BamHI 和 XhoI 限制站点克隆插入到 pGEX6p1 向量中。用此质粒表达 n-端谷胱甘肽 s-转移酶 (GST) 融合蛋白 CENP F (残留物 2,987-3, 065)。
- 对于人类的karyopherin α表达式构造, 通过从全长 karyopherin α2 cDNA 模板 (序列加入 NM_002264.3) 中扩增 DNA 片段来生成插入; 底漆: GCACTACATATGTCCACCAACGAGAATGCTAATA 和TCACGCCTCGAGTTATCAAAAGTTAAAGGTCCCAGGAGCC)。
注意: 由于亚型的相似性, 此 karyopherin α2构造在后面的文本中称为 karyopherin α。- 使用 NdeI 和 XhoI 限制站点克隆插入到 pET28a-pres 向量中。
注意: 这是一个修改后的 pET28a 向量, 其中凝血酶解切部位的序列编码被一个编码为 PS 蛋白酶裂解部位的序列所取代。使用此质粒表达 karyopherin α的融合蛋白与 N 终端他的6标记, 在那里他的6标记可以被 PS 蛋白酶切割。
- 使用 NdeI 和 XhoI 限制站点克隆插入到 pET28a-pres 向量中。
- 要创建人 CENP (残滓 2987-3065) 表达式构造, 可通过聚合酶链反应 (PCR) 从全长 CENP 结构 (基因库加入: U19769.1) 中放大 DNA 片段来生成插入。使用以下引物: AGTCGGGGATCCCAGCAATCTAAACAAGATTCCCG 和 AGTCGGCTCGAGTCATTATTCTGCAGGGTGAATACCACTCATG。
- 若要创建目标蛋白质的点突变, 请使用工具箱执行站点定向的诱变。
- 在大肠杆菌中表达重组蛋白以进行后续纯化。
- 制作以下股票:50 毫克/毫升卡那霉素 (1:1, 000 库存溶液), 35 毫克/毫升氯霉素在70% 乙醇 (1:1, 000), 100 毫克/毫升氨苄西林 (1:1, 000), 1 米异丙基β D-1-thiogalactopyranoside (IPTG; 1:5, 000)。
- 无菌过滤器库存和贮存在-20 摄氏度。避免重复冻融循环 IPTG。
- 根据制造商的指示, 将1µL 的表达质粒转化成50µL 的大肠杆菌罗塞塔 2 (DE3) pLysS 菌株的合格细胞。
- 以氯霉素 (35 µg/毫升磅) 和氨苄西林 (100 µg/毫升磅) 为 CENP-F 结构, 或氯霉素和卡那霉素 (50 µg/毫升培养) 的 karyopherin α结构, 在 Luria-Bertani (磅) 琼脂上印上培养基。在37摄氏度孵化12-20 小时的板材。
- 选择一个单一的殖民地和接种50毫升的 LB 补充抗生素 (见步骤 2.3.4)。孵化的 preculture, 而颤抖在 160-180 rpm 12-20 小时在37摄氏度。
- 在2800毫升的折流 Fernbach 瓶中准备1升的 LB 培养基。为每个 preculture 做两个烧瓶并蒸压它们。要允许曝气, 不要将烧瓶填满两个以上的烧瓶容积。锥形烧瓶也可以使用。
- 添加抗生素 (步骤 2.3.4) 和10毫升的无菌过滤 40% (瓦特/v) 葡萄糖溶液每1升的冷却 lb. 添加20毫升的 preculture 每1升的 lb 培养基。
注: 600 毫微米的吸光度在1:10 稀释的 preculture 应介于 0.15-0. 2 之间。 - 孵化的烧瓶, 而颤抖在 160-180 rpm 在37摄氏度。定期测量细菌培养 600 nm 的吸光度。如果吸光度达到 0.5-0.6, 通过增加0.2 毫米 IPTG (每1升的磅培养基的200µL 1 米) 诱导蛋白质表达。
注意: 重要的是细胞被诱导在正确的吸光度。通常需要3-4 小时才能到达这个阶段。 - 在37摄氏度晃动3小时的烧瓶。通过离心 (15 分钟, 4100 x g, 4 °c, 摆动转子) 收割细胞。放弃上清。并用重悬在20毫升的 GST-绑定缓冲区 (CENP) 或他的6 绑定缓冲区 (karyopherin α) 中的细胞颗粒, 每1升的文化。将单元格存储在摄氏-80 摄氏度。
- 准备 GST 捆绑缓冲 (10 毫米三 pH 值8.0 在25°c, 150 毫米氯化钠, 1 毫米 dithiothreitol (德勤), 0.5 毫米 EDTA) 和他的6结合缓冲器 (10 毫米三 ph 8.0 在25°c, 250 毫米氯化钠, 5 毫米咪唑 pH 值 8.0, 5 毫米β-巯基乙醇 (BME)) 预先。
3. 谷胱甘肽亲和层析和凝胶过滤纯化重组蛋白
- 制作以下股票: 1 M (1:1, 000 库存, 无菌过滤与0.2 µM 孔大小, 和脱气);250毫米 phenylmethylsulfonyl 氟 (PMSF; 1:1, 000 股 dimethylsulfoxide)。存储在-20 摄氏度。避免反复冻融循环。
- 使以下缓冲区和冷却到4摄氏度。
- 准备GST 绑定缓冲区, 使用10毫米三 pH 值8.0 在25°c, 150 毫米氯化钠, 1 毫米的, 0.5 毫米 EDTA。
- 使用 10 mm 减少的谷胱甘肽 (0.15 g/50 毫升), 在25摄氏度、150毫米氯化钠、1毫米的50毫米的缓冲液中溶解, 准备GST 洗脱缓冲。确认最终缓冲器的 pH 值为 8.0, 并在当天使用。
- 准备凝胶过滤缓冲, 使用20毫米三 pH 值7.5 在25°c, 60 毫米氯化钠, 2 毫米的德勤。无菌过滤器的缓冲与瓶顶过滤器 (0.2 µM 孔大小)。在真空 (-6 psi) 下搅动缓冲, 15 分钟。
- 在使用当天, 在上面的所有缓冲器上加上数码。
- 解冻包含 CENP 构造的2节中的单元格。使用 GST 绑定缓冲区将音量调整到40毫升。加1毫米, 0.25 毫米 PMSF, 0.5 毫米 EDTA (0.5 米库存溶液, pH 8.0), 7 毫克脒盐酸盐 (1 毫米), 和40毫克/升蛋氨酸。
注: 为了减少蛋白水解降解, 执行所有步骤在4摄氏度, 最好在寒冷的房间, 除非另有说明。在任何时候保持细胞, 裂解物和纯化的蛋白质组分在冰上, 并添加蛋白酶抑制剂。为了防止半胱氨酸和蛋氨酸残留物的氧化, 在实验当天添加还原剂, 如德勤和蛋氨酸。为了减少蛋白水解降解, 快速完成步骤。 - 溶解sonicator 中的单元格, 如下所示。用裂解液填充玻璃烧杯, 并将其浸入冰水浴中。油脂实验文化 (1 分钟四十年代, 在 100 W (50%) 输出或振幅, 以十年代脉冲和十年代休息周期)。在超声波后添加250µM PMSF。检查细胞裂解, 这应该看起来更透明, 不再是粘性。
- 清除通过离心在 1200万 x g, 25 分钟, 4 °c 的裂解。使用圆底离心管和固定角度转子。
- 通过将2毫升谷胱甘肽琼脂糖1:1 浆添加到一次性色谱柱上进行平衡。生成的列将有1毫升的体积。用25毫升的超纯水和25毫升的 GST 结合缓冲液洗涤柱。
- 按如下方式执行绑定。在寒冷的房间或寒冷的盒子里工作, 醒酒从颗粒中裂解出来。过滤裂解液 (0.2 µm 孔径) 并倒入插入柱上。将柱子盖上, 在4摄氏度时轻轻 nutating 30 分钟。
- 若要清洗该列, 请将其放在机架上, 让树脂沉淀, 并收集流过的流量。用25毫升的 GST 绑定缓冲液将列清洗两次。
-
洗脱水解。
- 插入列。添加400µL 的 GST 结合缓冲器和250µL 的 PS 蛋白酶 (2 毫克/毫升股票的活动 1000 U/毫克, 无论是在实验室纯化或购买; 请参见材料表)。
- 盖上柱子, 轻轻地旋转, 并用重悬在缓冲器中的树脂。在4摄氏度孵育16-20 小时的柱子。然后添加4毫升的 GST 绑定缓冲区, 以洗脱从该列 proteolytically 拆下的 CENP 片段。
-
谷胱甘肽洗脱
- 插入列, 添加4毫升的 GST-洗脱缓冲 (4 列卷), 孵化10分钟, 以洗脱绑定的 gst 标签。收集洗脱液。重新生成列, 然后再按制造商描述的那样使用。
- 用16% 丙烯酰胺凝胶的SDS 页分析 PS 蛋白酶洗脱分数和谷胱甘肽洗脱分数。在25伏/厘米处进行电泳, 45 分钟, 用考马斯蓝染色凝胶。PS 蛋白酶分数将包含纯化的 CENP 片段, 而谷胱甘肽分数将包含已裂的 GST 标签。检查凝胶, 以评估蛋白水解裂解效率。
- 浓缩PS 蛋白酶洗脱液0.5 毫升, 使用 3 kDa 分子量截止的离心过滤器 (见材料表)。在过滤器的上部隔间添加洗脱液, 并在 4100 x g、4°c (摆动式转子) 中以10-15 分钟的增量离心它以浓缩样品。每次增加后吹打混合。
- 将合适的凝胶过滤柱(参见材料表用于采购信息) 应用于快速蛋白质液相色谱 (FPLC) 系统, 并平衡1柱凝胶过滤缓冲器。
- 离心浓缩 CENP 离心 (20 分钟, 21700 x 克, 4 °c)。在该列上插入示例, 并将其与1列的凝胶过滤缓冲区洗脱。收集0.6 毫升的分数。
注: 凝胶过滤缓冲器的优化与后续激酶检测的兼容性。测试目标蛋白在这个缓冲区中是否稳定。如果不稳定, 试着加入更多的氯化钠。 - 通过 SDS 页面分析峰值分数 (步骤 3.11)。池中包含纯 CENP 片段的峰值分数。将纯化的 CENP 碎片浓缩为3.3 毫克/毫升 (步骤 3.12)。用 SDS 页分析纯化的 CENP 碎片 (步骤 3.11)。
-
蛋白质浓度测定
- 稀释样品1:100 在超纯水和放置它在石英微试管。在分光光度计的波长范围内记录光谱 220-300 nm。
注: 蛋白质浓度 c (毫克/毫升) 来源于以下方程式: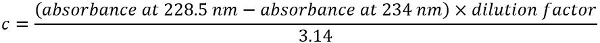
- 稀释样品1:100 在超纯水和放置它在石英微试管。在分光光度计的波长范围内记录光谱 220-300 nm。
- 使50µL 整除数的纯化蛋白在0.5 毫升管内和闪光冷冻他们在液氮。把整除数-80 摄氏度。
4. 镍-NTA 亲和层析法纯化重组蛋白
- 使以下缓冲区和冷却到4摄氏度。
- 准备他的6绑定缓冲区, 使用10毫米三 pH 8.0 在25°c, 250 毫米氯化钠, 5 毫米咪唑 pH 8.0, 5 毫米 BME。在使用当天将 BME 添加到所有缓冲区。
- 以与6绑定缓冲区相同的方式准备他的6洗涤缓冲区, 但使用20毫米咪唑。
- 以与绑定缓冲区相同的方式准备他的6洗脱缓冲, 但使用150毫米咪唑。
-
从包含 karyopherin α构造的部分2中解冻单元格, 并使用其6绑定缓冲区将卷调整为 40 mL。添加5毫米 BME, 0.250 毫米 PMSF, 7 毫克脒盐酸盐 (1 毫米), 和40毫克 d-/升蛋氨酸。
- 按照步骤 3.4-3.8 中的说明进行操作, 其中有以下变体: 使用他的6绑定缓冲区而不是所有步骤的 GST 绑定缓冲区。而不是谷胱甘肽琼脂糖, 使用4毫升的镍亲和凝胶 (见材料表), 使列, 这将有一个列体积为2毫升。
注: 镍亲和柱与德勤和 EDTA 不相容。如果在洗脱缓冲液中咪唑浓度增加到250毫米 (见材料表), 则可以使用 Ni2 +-nitrilotriacetic 酸 (NTA) 琼脂糖代替镍亲和凝胶。
- 按照步骤 3.4-3.8 中的说明进行操作, 其中有以下变体: 使用他的6绑定缓冲区而不是所有步骤的 GST 绑定缓冲区。而不是谷胱甘肽琼脂糖, 使用4毫升的镍亲和凝胶 (见材料表), 使列, 这将有一个列体积为2毫升。
- 使用6洗涤缓冲区的8毫升来清洗列。
- 洗脱 karyopherin α, 其6洗脱缓冲器有12毫升, 并通过 SDS 页 (步骤 3.11) 分析洗脱液.
- 添加250µL 的 PS 蛋白酶(步骤 3.9) 对洗脱液和孵育为16-20 小时在4°c。同时, 透析对其6绑定缓冲区的 1 L 进行了两次洗脱液, 其2-20 小时, 使用了 6-8 kDa 分子量截止的透析膜。
- 根据制造商的描述再生镍亲和凝胶柱。平衡6绑定缓冲区的25毫升的列。将透析蛋白添加到列中, 并按照步骤3.7 中的说明执行绑定步骤。
- 收集流经, 其中包含纯化的 karyopherin α (与他的6标记分离), 并洗脱其6绑定缓冲区的额外4毫升的剩余蛋白质.把这些分数集合起来。然后洗脱其6洗脱缓冲区的12毫升的列.这个分数含有杂质。
- 通过SDS 页(步骤 3.11), 从步骤 4.4-4.5 和两个洗脱分数中分析 uncleaved 和 karyopherin α, 以评估其6标记的解理和纯度的效率。
- 将karyopherin α浓缩为8毫克/毫升和在液氮中的闪光冷冻(步骤 3.15-3. 17)。
5.体外激酶测定与 Cdk1/Cyclin B
-
体外激酶检测
注意: 当激酶到达时, 做小整除数, 将它们冷冻在液氮中, 储存在-80 摄氏度。在6月内使用。虽然分子量是 34 kDa Cdk1 和 48 kDa 的细胞周期蛋白 b, 表观分子量的细胞周期蛋白 b 在 SDS 页约 60 kDa。- 用0.5 米三盐酸, 0.1 米氯化镁2, 1 毫米 EDTA, 20 毫米, 0.1% Brij 35, pH 7.5 在25°c 准备 10x PK 缓冲器 (用激酶提供)。
- 准备 10x atp 库存: 在 1x PK 缓冲器中制作4毫米 atp 溶液, 并检查库存的最终 pH 值。贮存在小整除数-20 摄氏度, 避免冻融循环。
- 混合40µL 的 CENP 片段 (浓度为3.3 毫克/毫升, 或400µM), 6 µL 10x PK 缓冲器, 3 µL 超纯水, 6 µL ATP 10x 股票, 5 µL 人类 Cdk1/cyclin B (1 µg, 100 U) 在0.5 毫升微细。
注: CENP 片段的摩尔质量为 8.6 kDa 和四 Cdk1-specific 磷酸化部位。对于新的基质, 根据蛋白质的摩尔浓度和磷酸化部位的数量, 调整检测中的激酶浓度。人类重组 Cdk1/cyclin B 种群的活性为 2万 u/毫升, 具体活性为 100万 u/毫克. 1 u 定义为催化将 1 pmol 磷酸酯转化为 Cdk1 肽基片 PKTPKKAKKL-NH2 (50 µM) 所需的 Cdk1/cyclin B 的量。在1分钟30摄氏度 (请参阅材料表)。 - 准备一个没有 Cdk1/cyclin 的控制反应 b. 在30摄氏度的水浴中孵育反应1-16 小时。
- 通过使用16% 丙烯酰胺的凝胶, 分析2.5 µL 的激酶测定反应和2.5 µL 的控制 (步骤 3.11). 若要增加分辨率, 请延长运行时间。
- 在剩余的激酶测定反应 (和控制) 中加入等量的盐酸胍6米溶液。最后盐酸胍浓度将为 3 m. 通过质谱 (6 节) 分析这些样品, 确定磷酸化部位或将样品送到质谱仪进行分析, 然后进行功能验证 (7节)。
注: 对于随后的质谱分析, 重要的是, 个别场址的磷酸化效率尽可能高, 最好是 100%, 否则磷酸化的地点无法映射。为了大大提高磷酸化效率, 增加 Cdk1/cyclin B 的数量, 并将孵化时间提高到16小时。ATP 的浓度也可以加倍。 - 对于疑难解答, 请执行体外激酶检测 CENP (残滓 2,987-3, 065) 作为阳性对照。使用新鲜批次的 Cdk1/cyclin B 与高活动。
6. 质谱法鉴定 Cdk1-specific 磷酸化部位
- 变性和淡化蛋白质样品, 执行 microbore反相液相色谱与 PLRP300 柱。
- 为了获得 CENP 片段中磷酸化点的数量, 通过电喷雾电离离子阱质谱(ESI-ITMS)44,45, 分析完整的体外磷酸化 CENP-f 84。
- 要评估 CENP 的 phosphoamino 酸站点位置, 请准备体外磷酸化 CENP 蛋白样品的胰蛋白酶文摘。淡化吸管小贴士的胰蛋白酶文摘。
- 用电喷雾电离傅里叶变换离子回旋共振质谱 (ESI-以及 MS)分析 CENP 的胰蛋白酶摘要。对具有169µs 积累时间的ESI-以及质谱仪进行分析。
注: 由以及 MS 确定的肿块的准确度在0.005。为了量化每个磷酸化物种与总蛋白质量的比值, 确定质谱的峰值高度。
7. 功能验证: 用解析尺寸排除色谱法检测 Phosphomimetic 突变对蛋白质-蛋白质相互作用的影响
注: 对于已识别的 Cdk1-specific 磷酸化站点的功能验证, 通过将已识别的磷酸化站点替换为 aspartates,创建了 CENP 片段 phosphomimetic 突变体。天门冬氨酸的负电荷模拟磷酸化的影响。创建了 CENP 片段的 S3048D 突变体 (残滓 2,987-3, 065)。
- 对于功能验证, 比较野生型和 phosphomimetic CENP 片段与 karyopherin α的结合. 使用分析凝胶过滤作为结合试验。对于分析凝胶过滤, 通过谷胱甘肽亲和层析 (步骤 3.1-3.12) 纯化CENP 片段, 并跳过凝胶过滤步骤。
- 把蛋白质浓缩到5-6 毫克/毫升。液态氮中的闪光冷冻蛋白整除数 (步骤 3.15-3. 17)。
- 混合纯化的 CENP 片段 (0.1 毫克, 无论是野生型还是 S3048D 变种) 和纯化的 karyopherin α (0.7 毫克) 在1:1 摩尔比。用凝胶过滤缓冲器将试样体积调整为200µL。在冰上孵化样品30分钟, 过滤器样品 (0.2 µm 孔径), 并清除样品离心 (25 分钟, 21700 x g, 4 °c)
- 将示例按大小排除色谱分隔 (步骤 3.13-3. 14)。使用凝胶过滤缓冲器, 包括20毫米 HEPES, pH 值 7.5, 150 毫米氯化钠和2毫米的德勤。对所有样品在相同条件下进行分析凝胶过滤实验。
- 按照制造商描述的已知摩尔质量的分子量标准对分析凝胶过滤柱进行标定。
- 分析洗脱分数 16% SDS 页 (步骤 3.11)。
结果
我们最近使用了体外激酶检测 (图 1) 来确定包含 cNLS10的 CENP 片段中的 Cdk1-specific 磷酸化站点。这一信号赋予 CENP 在界面的核定位。在 G2 阶段, CENP 以 Cdk1-dependent 的方式从原子核向细胞质出口。为了获得关于 Cdk1 如何调节 CENP 细胞定位的机械见解, 我们通过 iGPS 服务器36,37, 分析了 CEN...
讨论
我们的体外激酶检测是一种非常有效的方法来识别激酶 Cdk1 的分子靶点, 它是细胞周期的主控制器, 调节许多重要的细胞过程。该方法确定纯化蛋白是否为 Cdk1 的基质, 并允许识别特定的磷酸化部位。这促进机械研究通过磷酸化通过 Cdk1 调控细胞过程。
质谱法成功识别磷酸化部位的最关键因素是激酶测定的磷酸化效率。个别场址的磷酸化效率应尽可能高, 最好是100%。这?...
披露声明
作者没有什么可透露的。
致谢
我们感谢加州大学伯克利分校霍华德休斯医学院的大卫. 金博士进行质谱分析和有益的评论。我们感谢雪莲博士, 上海, 中国科学院生物科学研究所, 上海, 中国提供了一个全长的 CENP 建设。最后, 我们感谢苏珊. 贝恩博士和 Christof Grewer 博士在宾汉大学获得设备。这项研究由纽约州立大学和纽约州立大学化学系研究基金会资助。
材料
| Name | Company | Catalog Number | Comments |
| 2800 ml baffled Fernbach flask | Corning | 44232XL | |
| ampicillin | Gold Biotechnology | A-301-25 | |
| ATP | Fisher Scientfiic | BP413-25 | |
| benzamidine hydrochloride | Millipore Sigma | B6506-25 | |
| bottletop filter | Corning | 431161 | |
| Cdk1/cyclin B recombinant, human 20,000 U/mL | New England Biolabs | P6020 | |
| Cdk1/cyclin B (alternate source) | EMD Millipore | 14-450 | |
| Cdk1/cyclin B (alternate source) | Invitrogen | PV3292 | |
| Cdk1/cyclin B + 10x PK buffer | New England Biolabs | P6020 | |
| CENP-F (residues 2987 – 3065) pGEX6P1 plasmid | Available upon request. | ||
| centrifuge: Heraeus Multifuge X3R, cooled, with TX-1000 swing-out rotor | Thermo Scientific | 10033-778 | |
| centrifugal filter units: Amicon Ultra-15 centrifugal filter units, 3 kDa cutoff, Ultracel-PL membranes | EMD Millipore | UFC900324 | |
| chlorampenicol | Gold Biotechnology | C-105-100 | |
| D/L methionine | Agros Organics / Fisher | 125650010 | |
| desalting pipet tips: Zip tips | Millipore Sigma | ZTC18S008 | |
| disposable chromatography columns, Econo-Pac 1.5 x 12 cm | Biorad | 7321010 | |
| dithiothreitol | Gold Biotechnology | DTT50 | |
| E. coli Rosetta 2(DE3)pLysS strain | EMD Millipore | 71403 | |
| electrospray ionization Fourier transform ion | Bruker Amazon | Apex III | |
| cyclotron resonance mass spectrometer | |||
| electrospray ionization ion trap mass spectrometer | Bruker Amazon | custom | |
| fixed angle rotor: Fiberlite F15-8x-50cy | Thermo Scientific | 97040-276 | |
| FPLC system: Äkta Pure FPLC | GE Healthcare | 29032697 | |
| Gel filtration column: Superdex 200 Increase 10/300 GL | GE Healthcare | 28990944 | |
| glutathione agarose | Pierce | 16101 | |
| glutathione, reduced | Millipore Sigma | G4251-50g | |
| incubation shaker: multitron shaker | Infors | I10102 | |
| isopropyl β-D-1-thiogalactopyranoside | Gold Biotechnology | I2481C50 | |
| kanamycin | Gold Biotechnology | K-120-25 | |
| karyopherin α pet-28a pres plasmid | Available upon request. | ||
| Luria Bertani medium | Fisher Scientfiic | BP1426-2 | |
| microcentrifuge 5418R, refrigerated | Eppendorf | 5401000013 | |
| microtubes (0.5 ml) | Eppendorf | 30121023 | |
| microtubes (1.5 ml) | Eppendorf | 30120086 | |
| Nickel affinity gel: His-Select Nickel affinity gel | Millipore Sigma | P6611-100ml | |
| pGEX-6P-1 plasmid | Millipore Sigma | GE28-9546-48 | |
| phenylmethylsulfonyl fluoride | Gold Biotechnology | P470-10 | |
| PS protease: PreScission protease | GE Healthcare | 27084301 | |
| Phos-tag acrylamide | Wako Pure Chem. Ind. | 304-93521 | |
| reduced gluthathione | Millipore Sigma | G4251-50g | |
| roundbottom centrifuge tubes (Oakridge tubes) | Fisher Scientfiic | 055291D | |
| site-directed mutagenesis kit: QuikChange Lightning | Agilent | 210518 | |
| Site-Directed Mutagenesis Kit | |||
| sonifier: Branson S-250D sonifier | Branson | 15 338 125 | |
| Spectra/Por 1RC dialysis membrane (6-8 kDa cutoff) | Spectrum Labs | 08 670B | |
| swing out rotor TX-1000 | Thermo Scientific | 10033-778 |
参考文献
- Nurse, P. Cyclin dependent kinases and cell cycle control (Nobel Lecture). ChemBioChem. 3 (7), 596-603 (2002).
- Lee, M. G., Nurse, P. Complementation used to clone a human homologue of the fission yeast cell cycle control gene cdc2. Nature. 327, 31 (1987).
- Lohka, M. J., Hayes, M. K., Maller, J. L. Purification of maturation-promoting factor, an intracellular regulator of early mitotic events. Proc Natl Acad of Sci U S A. 85 (9), 3009-3013 (1988).
- Gautier, J., Norbury, C., Lohka, M., Nurse, P., Maller, J. Purified maturation-promoting factor contains the product of a Xenopus homolog of the fission yeast cell cycle control gene. Cell. 54 (3), 433-439 (1988).
- Gautier, J., Minshull, J., Lohka, M., Glotzer, M., Hunt, T., Maller, J. L. Cyclin is a component of maturation-promoting factor from Xenopus. Cell. 60 (3), 487-494 (1990).
- Ubersax, J. A., Woodbury, E. L., Quang, P. N., Paraz, M., Blethrow, J. D., Shah, K., Shokat, K. M., Morgan, D. O. Targets of the cyclin-dependent kinase Cdk1. Nature. 425 (6960), 859-864 (2003).
- Petrone, A., Adamo, M. E., Cheng, C., Kettenbach, A. N. Identification of Candidate Cyclin-dependent kinase 1 (Cdk1) Substrates in Mitosis by Quantitative Phosphoproteomics. Mol Cell Proteomics. 15 (7), 2448-2461 (2016).
- Vassilev, L. T., Tovar, C., Chen, S., Knezevic, D., Zhao, X., Sun, H., Heimbrook, D. C., Chen, L. Selective small-molecule inhibitor reveals critical mitotic functions of human CDK1. Proc Natl Acad of Sci U S A. 103 (28), 10660-10665 (2006).
- Balakrishnan, A., Vyas, A., Deshpande, K., Vyas, D. Pharmacological cyclin dependent kinase inhibitors: Implications for colorectal cancer. World J Gastroenterol. 22 (7), 2159-2164 (2016).
- Loftus, K. M., Coutavas, E., Cui, H., King, D., Ceravolo, A., Pereiras, D., Solmaz, S. Mechanism for G2 phase-specific nuclear export of the kinetochore protein CENP-F. Cell Cycle. 16 (15), 1414-1429 (2017).
- Baffet, A. D., Hu, D. J., Vallee, R. B. Cdk1 activates pre-mitotic nuclear envelope dynein recruitment and apical nuclear migration in neural stem cells. Dev Cell. 33 (6), 703-716 (2015).
- Songyang, Z., Blechner, S., Hoagland, N., Hoekstra, M. F., Piwnica-Worms, H., Cantley, L. C. Use of an oriented peptide library to determine the optimal substrates of protein kinases. Curr Biol. 4 (11), 973-982 (1994).
- Malumbres, M. Cyclin-dependent kinases. Genome Biol. 15 (6), 122 (2014).
- Peeper, D. S., Parker, L. L., Ewen, M. E., Toebes, M., Hall, F. L., Xu, M., Zantema, A., van der Eb, A. J., Piwnica-Worms, H. A- and B-type cyclins differentially modulate substrate specificity of cyclin-cdk complexes. EMBO J. 12 (5), 1947-1954 (1993).
- Trembley, J., Ebbert, J., Kren, B., Steer, C. Differential regulation of cyclin B1 RNA and protein expression during hepatocyte growth in vivo. Cell Growth Differ. 7 (7), 903-916 (1996).
- Pines, J., Hunter, T. The differential localization of human cyclins A and B is due to a cytoplasmic retention signal in cyclin B. EMBO J. 13 (16), 3772-3781 (1994).
- Morgan, D. O. Principles of CDK regulation. Nature. 374, 131 (1995).
- Larochelle, S., Merrick, K. A., Terret, M. -. E., Wohlbold, L., Barboza, N. M., Zhang, C., Shokat, K. M., Jallepalli, P. V., Fisher, R. P. Requirements for Cdk7 in the assembly of Cdk1/cyclin B and activation of Cdk2 revealed by chemical genetics in human cells. Mol cell. 25 (6), 839-850 (2007).
- Parker, L. L., Sylvestre, P. J., Byrnes, M. J., Liu, F., Piwnica-Worms, H. Identification of a 95-kDa WEE1-like tyrosine kinase in HeLa cells. Proc Natl Acad of Sci U S A. 92 (21), 9638-9642 (1995).
- Atherton-Fessler, S., Parker, L. L., Geahlen, R. L., Piwnica-Worms, H. Mechanisms of p34cdc2 regulation. Mol Cell Biol. 13 (3), 1675-1685 (1993).
- Liu, F., Stanton, J. J., Wu, Z., Piwnica-Worms, H. The human Myt1 kinase preferentially phosphorylates Cdc2 on threonine 14 and localizes to the endoplasmic reticulum and Golgi complex. Mol Cell Biol. 17 (2), 571-583 (1997).
- McGowan, C. H., Russell, P. Human Wee1 kinase inhibits cell division by phosphorylating p34cdc2 exclusively on Tyr15. EMBO J. 12 (1), 75-85 (1993).
- Strausfeld, U., Labbé, J. C., Fesquet, D., Cavadore, J. C., Picard, A., Sadhu, K., Russell, P., Dorée, M. Dephosphorylation and activation of a p34cdc2/cyclin B complex in vitro by human CDC25 protein. Nature. 351, 242 (1991).
- Leuken, R., Clijsters, L., Wolthuis, R. To cell cycle, swing the APC/C. Biochim Biophys Acta. 1786 (1), 49-59 (2008).
- Acquaviva, C., Pines, J. The anaphase-promoting complex/cyclosome: APC/C. J Cell Sci. 119 (12), 2401-2404 (2006).
- Zhu, X., Chang, K. -. H., He, D., Mancini, M. A., Brinkley, W. R., Lee, W. -. H. The C-terminus of mitosin is essential for its nuclear localization, centromere/kinetochore targeting, and dimerization. J Biol Chem. 270 (33), 19545-19550 (1995).
- Liao, H., Winkfein, R. J., Mack, G., Rattner, J. B., Yen, T. J. CENP-F is a protein of the nuclear matrix that assembles onto kinetochores at late G2 and is rapidly degraded after mitosis. J Cell Biol. 130 (3), 507-518 (1995).
- Rattner, J. B., Rao, A., Fritzler, M. J., Valencia, D. W., Yen, T. J. CENP-F is a ca 400 kDa kinetochore protein that exhibits a cell-cycle dependent localization. Cell Motil Cytoskeleton. 26 (3), 214-226 (1993).
- Christie, M., Chang, C. -. W., Rona, G., Smith, K. M., Stewart, A. G., Takeda, A. A. S., Fontes, M. R. M., Stewart, M., Vertessy, B. G., Forwood, J. K., Kobe, B. Structural biology and regulation of protein import into the nucleus. J Mol Biol. 428 (10A), 2060-2090 (2016).
- Zuccolo, M., Alves, A., Galy, V., Bolhy, S., Formstecher, E., Racine, V., Sibarita, J. B., Fukagawa, T., Shiekhattar, R., Yen, T., Doye, V. The human Nup107/160 nuclear pore subcomplex contributes to proper kinetochore functions. EMBO J. 26, 1853-1864 (2007).
- Bolhy, S., Bouhlel, I., Dultz, E., Nayak, T., Zuccolo, M., Gatti, X., Vallee, R., Ellenberg, J., Doye, V. A Nup133-dependent NPC-anchored network tethers centrosomes to the nuclear envelope in prophase. J Cell Biol. 192 (5), 855-871 (2011).
- Hu, D. J., Baffet, A. D., Nayak, T., Akhmanova, A., Doye, V., Vallee, R. B. Dynein recruitment to nuclear pores activates apical nuclear migration and mitotic entry in brain progenitor cells. Cell. 154 (6), 1300-1313 (2013).
- Vergnolle, M. S., Taylor, S. S. Cenp-F links kinetochores to Ndel1/Nde1/Lis1/Dynein microtubule motor complexes. Curr Biol. 17 (13), 1173-1179 (2007).
- Yang, Z. Y., Guo, J., Li, N., Qian, M., Wang, S. N., Zhu, X. L. Mitosin/CENP-F is a conserved kinetochore protein subjected to cytoplasmic dynein-mediated poleward transport. Cell Res. 13 (4), 275-283 (2003).
- Yang, Z., Guo, J., Chen, Q., Ding, C., Du, J., Zhu, X. Silencing mitosin induces misaligned chromosomes, premature chromosome decondensation before anaphase onset, and mitotic cell death. Mol Cell Biol. 25 (10), 4062-4074 (2005).
- Xue, Y., Ren, J., Gao, X., Jin, C., Wen, L., Yao, X. GPS 2.0, a tool to predict kinase-specific phosphorylation sites in hierarchy. Mol Cell Proteomics. 7 (9), 1598-1608 (2008).
- Song, C., Ye, M., Liu, Z., Cheng, H., Jiang, X., Han, G., Songyang, Z., Tan, Y., Wang, H., Ren, J., Xue, Y., Zou, H. Systematic analysis of protein phosphorylation networks from phosphoproteomic data. Mol Cell Proteomics. 11 (10), 1070-1083 (2012).
- UniProt-Consortium. UniProt: the universal protein knowledgebase. Nucleic Acids Res. 45 (D1), D158-D169 (2017).
- Olsen, J. V., Vermeulen, M., Santamaria, A., Kumar, C., Miller, M. L., Jensen, L. J., Gnad, F., Cox, J., Jensen, T. S., Nigg, E. A., Brunak, S., Mann, M. Quantitative phosphoproteomics reveals widespread full phosphorylation site occupancy during mitosis. Science Signal. 3 (104), ra3 (2010).
- Dephoure, N., Zhou, C., Villén, J., Beausoleil, S. A., Bakalarski, C. E., Elledge, S. J., Gygi, S. P. A quantitative atlas of mitotic phosphorylation. Proc Natl Acad of Sci U S A. 105 (31), 10762-10767 (2008).
- Rona, G., Marfori, M., Borsos, M., Scheer, I., Takacs, E., Toth, J., Babos, F., Magyar, A., Erdei, A., Bozoky, Z., Buday, L., Kobe, B., Vertessy, B. G. Phosphorylation adjacent to the nuclear localization signal of human dUTPase abolishes nuclear import: structural and mechanistic insights. Acta Cryst D. 69 (12), 2495-2505 (2013).
- Harreman, M. T., Kline, T. M., Milford, H. G., Harben, M. B., Hodel, A. E., Corbett, A. H. Regulation of nuclear import by phosphorylation adjacent to nuclear localization signals. J Biol Chem. 279 (20), 20613-20621 (2004).
- Kosugi, S., Hasebe, M., Tomita, M., Yanagawa, H. Systematic identification of cell cycle-dependent yeast nucleocytoplasmic shuttling proteins by prediction of composite motifs. Proc Natl Acad Sci U S A. 106 (25), 10171-10176 (2009).
- McLachlin, D. T., Chait, B. T. Analysis of phosphorylated proteins and peptides by mass spectrometry. Curr Opin Chem Biol. 5 (5), 591-602 (2001).
- Van Berkel, G. J., Glish, G. L., McLuckey, S. A. Electrospray ionization combined with ion trap mass spectrometry. Anal Chem. 62 (13), 1284-1295 (1990).
- Hodel, A. E., Harreman, M. T., Pulliam, K. F., Harben, M. E., Holmes, J. S., Hodel, M. R., Berland, K. M., Corbett, A. H. Nuclear localization signal receptor affinity correlates with in vivo localization in Saccharomyces cerevisiae. J Biol Chem. 281 (33), 23545-23556 (2006).
- Hong, K. U., Kim, H. -. J., Kim, H. -. S., Seong, Y. -. S., Hong, K. -. M., Bae, C. -. D., Park, J. Cdk1-Cyclin B1-mediated Phosphorylation of Tumor-associated Microtubule-associated Protein/Cytoskeleton-associated Protein 2 in Mitosis. J Biol Chem. 284 (24), 16501-16512 (2009).
- Meraldi, P., Lukas, J., Fry, A. M., Bartek, J., Nigg, E. A. Centrosome duplication in mammalian somatic cells requires E2F and Cdk2–Cyclin A. Nature Cell Biol. 1, 88 (1999).
- Heuvel, S., Harlow, E. Distinct roles for cyclin-dependent kinases in cell cycle control. Science. 262 (5142), 2050-2054 (1993).
- Kinoshita, E., Kinoshita-Kikuta, E., Takiyama, K., Koike, T. Phosphate-binding Tag, a New Tool to Visualize Phosphorylated Proteins. Mol Cell Proteomics. 5 (4), 749-757 (2006).
- Takeda, H., Kawasaki, A., Takahashi, M., Yamada, A., Koike, T. Matrix-assisted laser desorption/ionization time-of-flight mass spectrometry of phosphorylated compounds using a novel phosphate capture molecule. Rapid Commun Mass Spectrom. 17 (18), 2075-2081 (2003).
- Linder, M. I., Köhler, M., Boersema, P., Weberruss, M., Wandke, C., Marino, J., Ashiono, C., Picotti, P., Antonin, W., Kutay, U. Mitotic Disassembly of Nuclear Pore Complexes Involves CDK1- and PLK1-Mediated Phosphorylation of Key Interconnecting Nucleoporins. Dev Cell. 43 (2), (2017).
- Arai, T., Haze, K., Iimura-Morita, Y., Machida, T., Iida, M., Tanaka, K., Komatani, H. Identification of β-catenin as a novel substrate of polo-like kinase 1. Cell Cycle. 7 (22), 3556-3563 (2008).
- Hansen, D. V., Tung, J. J., Jackson, P. K. CaMKII and Polo-like kinase 1 sequentially phosphorylate the cytostatic factor Emi2/XErp1 to trigger its destruction and meiotic exit. Proc Natl Acad of Sci U S A. 103 (3), 608-613 (2006).
- Zhang, Y., Dong, Z., Nomura, M., Zhong, S., Chen, N., Bode, A. M., Dong, Z. Signal Transduction Pathways Involved in Phosphorylation and Activation of p70S6K Following Exposure to UVA Irradiation. J Biol Chem. 276 (24), 20913-20923 (2001).
- Richard, D. E., Berra, E., Gothié, E., Roux, D., Pouysségur, J. p42/p44 Mitogen-activated Protein Kinases Phosphorylate Hypoxia-inducible Factor 1α (HIF-1α) and Enhance the Transcriptional Activity of HIF-1. J Biol Chem. 274 (46), 32631-32637 (1999).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。