Method Article
检测幼虫行为反应剖面的实验协议: 在神经刺激咖啡因中的应用
摘要
在这里, 我们提出了一个协议, 以检查斑马鱼和傻瓜鱼的运动活动和 photomotor 反应 (PMR) 使用自动跟踪软件。在共同的毒理学生物鉴定中, 对这些行为的分析提供了一种检查化学活性的诊断工具。这个协议是用咖啡因, 一个模型 neurostimulant 描述的。
摘要
鱼类模型和行为越来越多地应用于生物医学科学;然而, 鱼类长期以来一直是生态、生理和毒理学研究的主题。使用自动数字跟踪平台, 最近在神经药理学的努力利用幼虫鱼的运动行为, 以确定潜在的治疗目标的新的小分子。与这些努力类似, 环境科学和比较药理学和毒理学的研究正在审查鱼类模型的各种行为, 作为对污染物进行分层评估的诊断工具和对地表水的实时监测, 以污染威胁。斑马鱼是生物医学科学中流行的幼体鱼类模型, 而傻瓜鱼是生态中常见的幼虫鱼类模型。不幸的是, 傻瓜小鱼幼虫在行为学研究中受到的关注较少。在这里, 我们开发并演示了一种使用咖啡因作为模型 neurostimulant 的行为配置文件协议。虽然傻瓜鱼的 photomotor 反应偶尔受到咖啡因的影响, 但斑马鱼对 photomotor 和运动终点的敏感度明显更高, 在环境相关的水平上反应。今后的研究需要了解鱼类与日龄和时间的比较行为敏感性差异, 并确定类似的行为效应是否会发生在自然界中, 并表明在个人或生物组织的人口水平。
引言
虽然鱼类模型越来越多地用于生物医学研究, 但鱼类经常被用于生态学和生理学研究, 检查地表水的污染, 并了解化学品的毒理学门槛。这种努力很重要, 因为化学污染会损害水生生态系统, 危害水源水供应的质量1,2。然而, 商业中的大多数化学品甚至缺乏基本的毒物学信息3。
传统上用于管制毒性试验的动物模型化验是资源密集型的, 不能提供4第二十一世纪毒性试验所需的高通量、早期筛查。随后, 采用和利用体外模型的动力越来越大, 可以更迅速、更有效地筛选生物活动的化合物3、5。虽然基于细胞的模型提供了许多机会, 但它们往往缺乏生物复杂性, 因此不能解释许多重要的整个有机体过程, 包括新陈代谢6。
斑马鱼是一种常见的生物医学动物模型, 作为一种替代模式在水生毒物学和生态7,8获得普及。由于鱼类模型体积小、发育迅速、繁殖力高, 可用于快速高效地筛查化学物质在整个生物体9级的生物活性和毒性。在自动跟踪软件的帮助下, 斑马鱼的幼虫行为提供了增强的诊断效用, 用于筛选毒性10,11的污染物。药物学研究表明, 运动端点是化学作用机制的信息, 可用于表型行为, 然后可以初步确定新分子12的亚细胞靶点, 13。斑马鱼是生物医学科学中流行的幼虫鱼模型, 而傻瓜鱼是一种常见的生态重要鱼类模型, 用于生态研究和前瞻性 (例如, 新的化学评价) 和回顾 (例如,环境地表水或废水排放监测) 环境评估。不幸的是, 幼虫傻瓜小鱼的行为反应受到的关注明显少于斑马鱼。我们正在进行的研究与两种常见的幼虫鱼模型, 斑马鱼和傻瓜鲤鱼, 表明幼虫鱼类游泳模式似乎独特的预期模式或行动机制的各种化学品。因此, 行为端点提供了迅速和敏感地检查化学品毒性的潜力, 并确定工业化学品和其他污染物的亚细胞目标, 特别是在早期评估期间。
在这里, 我们报告了一个检查幼虫鱼行为反应剖面的协议。我们用咖啡因、模型 neurostimulant 和一种常见的水生污染物来演示这些方法, 通过污水处理厂排出的食物、饮料和用咖啡因配制的药物14。我们检查对斑马鱼和傻瓜鱼的咖啡因的行为反应, 包括在光照条件的突然变化, 这通常被称为 photomotor 反应 (PMR) 在药物研究与胚胎和幼虫斑马鱼13,15。我们进一步确定咖啡因对几个运动端点的影响, 为每个鱼类模型开发化学反应剖面。本研究中使用的咖啡因治疗水平代表了基于咖啡因16测量环境值的暴露分布上 centiles。我们还包括基准的治疗幼虫的鱼 LC50值, 和治疗危险值 (THV), 在水中的药物浓度预期会导致在鱼血浆水平与人类治疗血浆剂量一致。
研究方案
本议定书的研究一般遵循标准化的实验设计, 并建议美国环境保护局 (EPA 2000.0 号) 对傻瓜鱼和经济合作组织的统计分析指导方针。发展 (经合组织236号) 为斑马鱼。这些实验设计 (例如, 增加复制) 可以在当前的协议中进行修改以供将来研究之用。鱼类养殖条件遵循以前发表的文献17。所有实验程序和鱼类养殖协议都遵循了在贝勒大学批准的机构动物保育和使用委员会的协议。
1. 将鱼暴露在化学处理中
- 通过在重组的硬水中溶解咖啡因来制备咖啡因暴露溶液。通过稀释更高的咖啡因治疗和硬水来进行适当的串行稀释, 以产生较低的咖啡因治疗水平。
注:表 1总结了本实验中使用的每种治疗水平。
| 斑马 鱼 | 傻瓜鲤鱼 | ||||
| 治疗 | 标称咖啡因浓度 (毫克/升) | 咖啡因浓度测定 (毫克/升) | 治疗 | 标称咖啡因浓度 (毫克/升) | 咖啡因浓度测定 (毫克/升) |
| 控制 | 0 | < LOD | 控制 | 0 | < LOD |
| 第七十五 Centile * | 0.001 | 0.001 | 第七十五 Centile * | 0.001 | 0.001 |
| 第九十五 Centile * | 0.039 | 0.013 | 第九十五 Centile * | 0.039 | 0.009 |
| 第九十九 Centile * | 0.412 | 0.361 | 第九十九 Centile * | 0.412 | 0.310 |
| THV | 4.07 | 3.81 | THV | 4.07 | 4.12 |
| 10% LC50 | 48.46 | 46.66 | 10% LC50 | 14。1 | 14。7 |
| 40% LC50 | 193.82 | 186.67 | 40% LC50 | 56.38 | 53.91 |
表 1: 对斑马鱼和傻瓜鲤鱼实验的实验性咖啡因治疗.给出了每种治疗中的咖啡因的标称值和测量量。* 本研究中使用的咖啡因疗法代表了基于咖啡因16的测量环境值的暴露分布上 centiles。THV: 治疗危险值。LOD: 检测的限制
- 将准备好的解决方案倒入单独的暴露香槟。使用100毫升玻璃烧杯填充20毫升的暴露溶液的斑马鱼接触室和500毫升烧杯与200毫升的暴露解决方案傻瓜鲤鱼接触室。
- 使用转移吸管, 放置10斑马鱼胚胎年龄第4-6 h 后受精 (hpf) 每四复制暴露室每治疗。
- 放置10傻瓜幼鱼幼虫在24小时内孵化, 每三复制暴露室每治疗。为了适应较大的傻瓜小鱼幼虫, 在转移前切掉转移吸管的尖端。
- 保持斑马鱼的实验在16:8 小时的光: 黑暗周期和恒定的温度 28 1 °c。使用相同的光周期机制傻瓜鲤鱼研究, 但在25的温度1摄氏度。
-
经过96小时的化学照射, 将单独的鱼装入 48 (用于斑马鱼) 和 24 (用于傻瓜鲤鱼) 的井板。
- 为了确保每个井都包含等量的溶液, 将斑马鱼幼虫转移到48井板上, 使用5000µL autopipette, 每井1000µL 容积。使用 autopipette 同时提取和转移斑马鱼幼虫和暴露溶液。
- 由于其较大的大小, 转移傻瓜小鱼幼虫使用转移吸管与尖端切断。在将傻瓜幼鱼幼虫转移到个体井之前, 用 autopipette 将其填好至2000µL。将单个傻瓜幼虫转移到井中时, 将转移吸管的尖端放在井溶液中, 让鱼从吸管尖端游入井中。
2. 视频跟踪参数的标定
-
在行为措施之前, 在视频跟踪软件中设置观察和校准参数 (见材料表)。
- 在记录室中放置一个井板, 在一个个体井中至少有1条幼体鱼。使用板材和伴生的鱼作为表示法设置定标参数。
- 在视频跟踪软件中, 单击 "文件 |生成协议 ", 它将打开一个" 协议创建向导 "对话框。在 "位置计数" 字段中, 输入井板的个人井数, 然后单击 "确定"。
- 在屏幕顶部, 单击 "查看 |全屏 ", 这将提示系统显示的一个高架摄像头视图的井板。
- 单击 "绘图区域" 图标, 它显示为三个多彩多姿的形状。在井板查看区域的右侧, 选择标记为 "区域" 的字段中的圆圈图标。
- 使用光标在井板左上井中描绘圆形视频跟踪区域。选择 "右上标记", 然后勾勒出右上方的查看区域。然后, 选择 "底部标记" 以勾勒出右下角。
注: 绘制圆形轮廓后, 其位置可能需要调整。 要调整轮廓的位置, 请单击 "选择", 然后使用光标移动轮廓区域。此外, 可以通过单击 "复制" 然后 "粘贴" 来复制轮廓。 - 在左上角、右上角和右下井跟踪区域已定义后, 单击 "生成" 以提示软件自动划定剩余井的查看区域。
- 在标记为 "校准" 的区域中, 单击 "绘制比例"。使用光标在板上画一条水平线。一旦绘制线, 将出现一个标记为 "校准测量" 的对话框。输入井板长度, 然后单击 "确定"。
- 通过单击 "绘制区域" 图标退出绘图管理器。
- 单击 "平铺" 图标。 使用光标, 突出显示在查看屏幕上的所有框, 使每个框都是绿色的。
注: 瓷砖图标显示为一组六个单独的小方块 - "单击" 查看 "|"全屏 "。 在面板查看区域的右侧, 单击标记为 "检测阈值" 的框中的 "Bkg"。使用阈值调整栏设置像素检测阈值。一旦选择了适当的像素检测阈值, 请单击 "应用于组"。
注意: 此协议将检测阈值设为 13, 以黑色模式为斑马鱼观察, 并以透明模式为傻瓜的鲤鱼观测设置110。 - 在标记为 "移动阈值" 的框中, 输入所需的移动速度跟踪参数。设置了速度参数后, 单击 "应用于组"。
注: 此协议设置小/大移动在20毫米/秒和不活跃/小移动在5毫米/秒。这些选择程序的软件跟踪幼虫鱼运动在三不同的速度水平: 非活动 (冻结) = < 5 毫米/秒, 小 (巡航) = 5–20毫米/秒, 大 (爆裂) = > 20 毫米/秒。 - 单击 "参数 |协议参数 "从下拉菜单中。在对话框中, 选择 "时间" 选项卡. 输入观察时间和积分时间。输入参数后, 单击 "确定"。
- 要设置每个光周期的光照/暗光照时间和光强度, 可通过从 "参数" 下拉菜单中选择 "光驱动" 来打开 "轻型驱动程序设置" 对话框。
注意: 请参阅协议视频, 以设置多个浅暗光周期。 - 设置视频跟踪参数后, 保存观察协议。
注: 本议定书观察50分钟内的鱼类行为, 包括10分钟的驯化阶段, 4 个改变光/暗相, 由两个10分钟的光期和两个10分钟的黑暗期组成。集成时间被设置为测量50分钟行为试验每分钟的行为。
3. 鱼类幼虫运动和 Photomotor 行为的观察
- 将含有实验性鱼的井板放置在行为记录室中。
- 在视频跟踪软件中, 打开步骤3中开发的跟踪协议。
- 在视频跟踪查看器中, 检查以确保所有幼虫都在计算机屏幕上可见, 在每个井中只有一个单独的幼虫存在, 并且在步骤2.1.5 和2.1.6 中定义的观察区域内对单个井进行排列。
- 点击 "实验 |执行 "。
注: 系统将提示用户提供一个名称和位置, 以保存观察数据。 - 一旦指定了观察数据的名称和保存位置, 请单击 "多个实时图像" 图标以突出显示所有预定义的查看区域。
注意: 此图标位于计算机屏幕的顶部, 并显示为一个框, 分为四个较小的正方形。单击此图标将突出显示所有预定义的查看区域。 - 关闭录音室的面板, 然后点击 "背景 |启动 "在计算机监视器上。
4. 分析行为数据
- 要检索幼虫鱼活动数据, 请打开电子表格, 它由跟踪软件自动编译, 并位于用户指定的文件夹中, 然后启动行为试验 (步骤 3.4)。
- 请参阅图 1A和1B , 以代表对未公开的斑马鱼和傻瓜幼鱼幼虫天真运动活动的代表性测量。请参阅图 1C和1D中的 PMR 计算, 它有效地检查了光到暗或暗到光转换之间的运动差的大小。
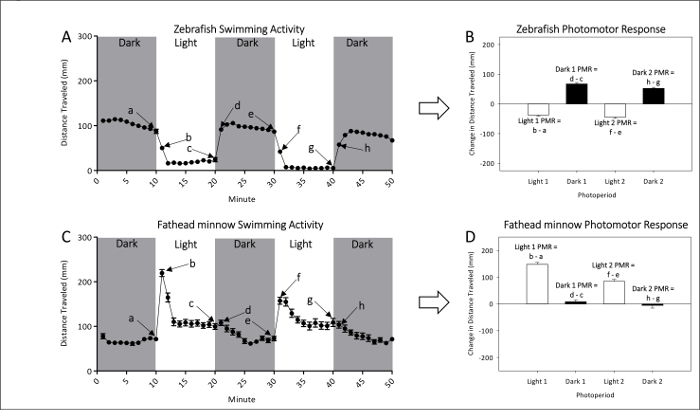
图 1:未公开的斑马鱼 (A和B) 和傻瓜鱼 (C和D) 基线活动的例子。对斑马鱼 (A) 和傻瓜小鱼 (C) 的平均距离游泳是由每一分钟的活动间隔点给出。测量两个暗和两个光周期的 photomotor 反应。最后 (a、c、e、g) 和第一 (b、d、f 和 h) 每一个光周期的分钟都用于计算 PMRs. 斑马鱼 (b) 和傻瓜小鱼 (d) 的 Photomotor 反应是以平均 (±SEM) 距离在最后一分钟之间的变化来衡量的。初始光周期和下一时期的第一分钟。请单击此处查看此图的较大版本.
结果
在96小时的实验中, 与斑马鱼和傻瓜鱼的咖啡因治疗水平没有明显的变化。例如,表 1显示了每种治疗水平的分析验证的浓度。该协议通过同位素稀释液相色谱串联质谱 (LC-ms) 验证了咖啡因治疗水平的水样, 通常遵循以前报告的方法28。咖啡因的主要代谢产物 paraxanthine 的形成也被量化。在补充分析资料中提供了这些分析程序的说明。由于治疗的名义和分析验证的相似性, 在本手稿的其余部分, 名义治疗水平呈现。咖啡因显著改变了斑马鱼和傻瓜鱼的行为。然而, 斑马鱼的运动反应对咖啡因的敏感性一直比傻瓜鱼更敏感。0.039 毫克/升浓度的咖啡因对斑马鱼和傻瓜鱼幼虫最敏感的行为终点有影响.表 2总结了最低观察到的效果浓度 (LOECs) 和没有观察到的效果浓度 (NOECs)对于两个鱼模型中的每个行为端点。
| 斑马 鱼 | 傻瓜鲤鱼 | ||||
| 端点 | LOEC (毫克/升) | NOEC (毫克/升) | 端点 | LOEC (毫克/升) | NOEC (毫克/升) |
| 总距离黑暗 | 0.412 | 0.039 | 总距离黑暗 | − | 56.38 |
| 总距离灯 | 48.46 | 4.07 | 总距离灯 | − | 56.38 |
| 总计数暗 | 0.412 | 0.039 | 总计数暗 | − | 56.38 |
| 总计数光 | 48.46 | 4.07 | 总计数光 | − | 56.38 |
| 爆裂距离黑暗 | − | 193.82 | 爆裂距离黑暗 | − | 56.38 |
| 爆裂距离灯 | 193.82 | 48.46 | 爆裂距离灯 | − | 56.38 |
| 爆破计数黑暗 | 193.82 | 48.46 | 爆破计数黑暗 | − | 56.38 |
| 爆破计数光 | 193.82 | 48.46 | 爆破计数光 | − | 56.38 |
| 爆破持续时间黑暗 | 193.82 | 48.46 | 爆破持续时间黑暗 | − | 56.38 |
| 爆破持续时间灯 | − | 193.82 | 爆破持续时间灯 | − | 56.38 |
| 巡航距离黑暗 | 0.412 | 0.039 | 巡航距离黑暗 | − | 56.38 |
| 巡航距离灯 | 48.46 | 4.07 | 巡航距离灯 | − | 56.38 |
| 巡航计数黑暗 | 0.412 | 0.039 | 巡航计数黑暗 | − | 56.38 |
| 巡航计数光 | 48.46 | 4.07 | 巡航计数光 | − | 56.38 |
| 巡航持续时间暗 | 0.412 | 0.039 | 巡航持续时间暗 | − | 56.38 |
| 巡航持续时间灯 | 48.46 | 4.07 | 巡航持续时间灯 | − | 56.38 |
| 冻结距离黑暗 | 0.412 | 0.039 | 冻结距离黑暗 | 0.039 | 0.001 |
| 冻结距离灯 | 0.039 | 0.001 | 冻结距离灯 | − | 56.38 |
| 冻结计数黑暗 | 0.412 | 0.039 | 冻结计数黑暗 | − | 56.38 |
| 冻结计数灯 | 48.46 | 4.07 | 冻结计数灯 | − | 56.38 |
| 冻结持续时间暗 | − | 193.82 | 冻结持续时间暗 | 56.38 | 14.10 |
| 冻结持续时间灯 | 48.46 | 4.07 | 冻结持续时间灯 | − | 56.38 |
| 深色 1 PMR | 48.46 | 4.07 | 深色 1 PMR | 0.039 | 0.001 |
| 轻型 1 PMR | 48.46 | 4.07 | 轻型 1 PMR | − | 56.38 |
| 深色 2 PMR | 48.46 | 4.07 | 深色 2 PMR | − | 56.38 |
| 轻型 2 PMR | 48.46 | 4.07 | 轻型 2 PMR | − | 56.38 |
| 爆裂黑暗 1 PMR | − | 193.82 | 爆裂黑暗 1 PMR | − | 56.38 |
| 爆裂灯 1 PMR | − | 193.82 | 爆裂灯 1 PMR | − | 56.38 |
| 爆裂黑暗 2 PMR | 193.82 | 48.46 | 爆裂黑暗 2 PMR | − | 56.38 |
| 爆裂灯 2 PMR | − | 193.82 | 爆裂灯 2 PMR | − | 56.38 |
| 巡航深色 1 PMR | 48.46 | 4.07 | 巡航深色 1 PMR | − | 56.38 |
| 巡航灯 1 PMR | 48.46 | 4.07 | 巡航灯 1 PMR | − | 56.38 |
| 巡航深色 2 PMR | 48.46 | 4.07 | 巡航深色 2 PMR | − | 56.38 |
| 巡航灯 2 PMR | 193.82 | 48.46 | 巡航灯 2 PMR | 56.38 | 14.10 |
| 冰冻深色 1 PMR | 48.46 | 4.07 | 冰冻深色 1 PMR | − | 56.38 |
| 冷冻灯 1 PMR | 193.82 | 48.46 | 冷冻灯 1 PMR | − | 56.38 |
| 冰冻深色 2 PMR | 48.46 | 4.07 | 冰冻深色 2 PMR | − | 56.38 |
| 冷冻灯 2 PMR | 193.82 | 48.46 | 冷冻灯 2 PMR | − | 56.38 |
表 2: 斑马鱼和傻瓜鱼的行为 NOECs 和 LOECs 的咖啡因.没有观察到的效果浓度 (NOEC) 和最低观察效果浓度 (LOEC) (毫克/升) 值的每一个光/暗游泳活动端点和 photomotor 反应, 斑马鱼和傻瓜的鱼接触咖啡因。破折号表明在所有治疗水平的特定终点没有观察到任何效果。
图 2展示了斑马鱼和傻瓜鱼的总运动活动和 PMRs, 在咖啡因暴露96小时之后。傻瓜小鱼幼虫 PMRs 是由咖啡因在较低的治疗水平 (0.038 毫克/升) 比斑马鱼, 但明显更大数量的 photomotor 终点受影响的斑马鱼。咖啡因的最高治疗水平 (193.82 毫克/升) 改变了斑马鱼的 PMR, 其中这些反应与对照完全相反。然而, 在这种高度的治疗水平, PMRs 在黑暗中减少, 并在光照条件下增加。

图 2:96小时接触咖啡因后, 斑马鱼 (A和B) 和傻瓜鱼 (C和D) 的游泳活动和 photomotor 反应。斑马鱼 (A) 和傻瓜鱼 (C) 的平均距离游泳是由每一个代表1分钟活动间隔的点给出。斑马鱼 (B) 和傻瓜小鱼 (D) 的 Photomotor 反应是指在初始光周期的最后几分钟和下一分钟的第一分之间的平均 (SE) 总距离的变化。测量了两个暗和两个光周期 photomotor 反应。共 24 (4 复制6幼虫) 斑马鱼和 12 (3 复制每4幼虫) 傻瓜鱼被用于行为观察。*p < 0.10;** < 0.05;p < 0.01。请单击此处查看此图的较大版本.
除了测量幼虫 PMRs 外, 还分析了在距离移动、运动次数和运动持续时间三速阈值范围内的光和暗运动活动。此数据用于开发咖啡因的行为响应配置文件 (图 3,补充图 1)。在这两种鱼类模型中, 咖啡因对运动终点都有显著的抑制作用。两种鱼类模型都表明, 在暴露于咖啡因之后, 爆炸速度阈值的活动增加, 但并不显著。与 PMR 观察结果相似, 咖啡因影响了更多的斑马鱼运动终点。事实上, 咖啡因在 THV 以下的环境现实水平上明显改变了一些在黑暗条件下的运动反应。然而, 在光照条件下, 傻瓜鱼的运动活动没有受到任何治疗水平的显著影响。

图 3: 在咖啡因照射96小时后, 斑马鱼和傻瓜鱼的反应剖面.指斑马鱼暗 (A) 和轻 (B) 游泳活动相比, 平均傻瓜鲤鱼暗 (C) 和光 (D) 活动后, 96 小时接触咖啡因。绘制的数据代表了两个10分钟暗光周期的活动, 每个鱼模型有两个10分钟的光光周期。数据被规范化为控制, 在每个数字的0个轴上表示。行为参数包括距离游, 运动次数 (计数) 和每一个运动的持续时间在3速度水平, 爆裂 (> 20 毫米/秒), 巡航 (5–20毫米/秒) 和冻结 (< 5 毫米/秒)。除了每一个速度阈值的运动模式, 总距离游, 和总的运动数量代表。↑代表活动的一个显著的增量在比较控制和↓表明活动的显著的减退与控制比较。共 24 (4 复制每6幼虫) 斑马鱼和 12 (3 复制每4幼虫) 傻瓜鲤鱼在每组行为观察使用。*p < 0.10;** < 0.05;p < 0.01。请单击此处查看此图的较大版本.
补充图 1:Photomotor 斑马鱼 (A和B) 和傻瓜鱼 (C和D) 在三速度阈值的反应。斑马鱼 (A、B 和 C) 和傻瓜鱼幼虫 (D、E 和 F) 在96hr 暴露于咖啡因之后, photomotor 响应三速阈值 (冰冻:20 毫米/秒)。斑马鱼和傻瓜小鱼的 Photomotor 反应被测量为平均 (±SE) 总距离在最初的光周期的最后分钟和以下期间的第一分钟之间的变化。测量了两个暗和两个光周期 photomotor 反应。共 24 (4 复制6幼虫) 斑马鱼和 12 (3 种复制4幼虫) 傻瓜鱼被用于行为观察。* p < 0.01请点击这里下载此文件.
讨论
在为行为毒理学研究选择化学治疗水平时, 必须考虑几个因素。本研究中的咖啡因治疗水平是根据16污水排放预测环境暴露情况的上 centile 值选择的。在可能的情况下, 我们通常会使用环境观测19、20、21的概率暴露评估来选择水生毒物学研究的治疗水平。一种可计算为药物的 THV 也被作为治疗水平纳入本研究。THV 值 (Eq 1)22,23被定义为预测的水浓度导致人类治疗剂量 (Cmax) 的药物在鱼23, 是灵感来自最初的等离子建模努力24, 并根据血液计算: 水化学分配系数 (Eq 2)25。
THV = C最大/对数 P (Eq 1)
日志 P = 日志 [(100.73. 日志九· 0.16) + 0.84] (Eq 2)
在这里, 我们也选择致死治疗水平相对于斑马鱼和傻瓜鲤鱼 LC50 价值。我们认为这一方法是一个有用的基准程序的行为反应, 特别是当比较特定行为的阈值与鱼类模型跨多个化学品。它进一步促进了对急性和慢性比值的计算, 这对于机械研究和评估的水生毒物学诊断有用。LC50 值是根据步骤2.1 中给出的标准准则从初步毒性生物鉴定中获得的。
在本议定书中, 我们采用了美国 EPA 和经合组织为鱼类模型进行毒理学研究的标准化方法所推荐的通用实验设计和统计技术。虽然我们报告p值 (e., < 0.01, < 0.05, < 0.10), 在活动水平上的显著差异 (α = 0.10) 在使用方差分析的方法中, 如果方差假设的常态和等价性被确定得到满足。Dunnett 或 Tukey 的 HSD 后进行专项测试, 以确定治疗水平的差异。我们选择这个 alpha (α = 0.10) 值, 以减少第二类错误, 特别是早期的层次分析, 当了解生物重要的影响大小是有限的理解行为终结点和模型有机体26, 而不是在生物医学科学中使用的程序比较常见, 用于多种比较 (例如, RNA 序列数据的 Bonferroni 校正)27。 未来的研究需要了解这些行为反应的变异性, 并有可能修改实验设计 (例如, 增加复制)。
除了化学暴露外, 还有许多因素会影响幼体的行为。例如, 在每个井中, 每天的时间、年龄、大小、温度、光照条件和曝光解决方案的体积都代表重要的考虑因素11、30。因此, 应采取预防措施, 尽量减少影响幼虫在试验过程中的运动行为的外在因素的影响。行为观察应在狭窄的时间窗口 (3 到4小时) 和跨越时间段, 当一天的影响预计对幼虫运动行为的影响最小11。此外, 幼虫鱼应保持在一个一致的温度 (28, 1 °c 为斑马鱼和 24, 1 °c 为男人) 和在一个定义的光/暗循环的温度控制孵化器在整个暴露期间。此外, 记录行为的实验室温度应保持在接近实验条件的条件下, 以避免温度对行为的影响。此外, 在行为观测期间使用的水井应保持在每条鱼的一致体积。
幼虫和胚胎斑马鱼 PMRs 以前曾用于生物医学科学, 以确定潜在的治疗目标的新化合物12,13。该协议扩大了以前的行为研究与斑马鱼通过利用38端点来调查环境污染物的化学生物活性。虽然咖啡因是一种常见的水生污染物, 有一种理解的作用机制, 但许多商业中的化合物缺乏重要的机械数据。因此, 本议定书可用于获得起效模式的化合物缺乏毒性数据, 包括商业化学品39。此外, 该议定书还为两种最常用的鱼类模型提供了方法。如前所述, 斑马鱼是一种常见的生物医学鱼类模型, 在生态越来越受欢迎, 傻瓜鱼通常被用作环境评估应用的生态模型, 但已收到相对于斑马鱼来说, 与自动化系统相比, 对行为研究的关注较少。虽然对鱼类行为毒理学研究尚无规范化的管理方法, 但该议定书提供了一种支持今后努力的方法。
咖啡因引起的行为反应在每一个鱼模型在水平上已经发现在水生环境16。罗德里格斯-吉尔等2018 根据咖啡因测定值16, 在水生系统中开发了全球环境暴露分布。具体地说, 在本研究中, 95% 的预测废水排放浓度将低于 LOECs 斑马鱼和傻瓜鱼最敏感的行为终点 (表 2)。尽管在环境相关的水平上, 斑马鱼 (特别是在黑暗条件下) 观察到咖啡因的几种行为效应, 但目前还不清楚这些行为是否会发生在天然鱼类种群中, 或导致生态上重要的不利结果。虽然对敏感的、诊断性的筛查有用, 但幼虫的行为阈值可能不代表其他生命史阶段或自然种群中的鱼类。还有必要进行进一步的研究, 以确定类似的行为反应阈值是否会发生在自然界中, 并表明生物组织的个体或人口水平的不利结果。
披露声明
作者没有什么可透露的。
致谢
这项研究的支持是由美国国家科学基金会 (项目 #: CHE-1339637) 提供的, 并得到美国环境保护局的额外支持。我们感谢琼斯博士 Corrales, 劳伦 Kristofco 博士, 加文 Saari, 塞缪尔哈达德, Bekah 伯克特和 Bridgett 希尔的一般实验室支持。
材料
| Name | Company | Catalog Number | Comments |
| ViewPoint Zebrabox | ViewPoint | ZebraLab and ZebraLab platform for automated behavioral observations | |
| Caffeine | Sigma-Aldrich | C0750-100G | Study chemical |
| Incubator | VWR | 9110589 | Maintains light/dark cycle and temperature for fathead minnow experiments |
| Incubator | Thermo Fisher Scientific | 35824-636 | Maintains light/dark cycle and temperature for zebrafish experiments |
| 100 mL glass beakers | VWR | 89000-200 | Zebrafish exposure chambers |
| 500 mL glass beakers | Pyrex | EW-34502-03 | Fathead minnow exposure chambers |
| 5,000 µL auto-pipette | Eppendorf | Research 5000 | Used to fill individual wells in well plates |
| Transfer Pippettes | VWR | 414-004-004 | Used to transfer study organisms |
| 48-well plates | Fisher Scientific | 08-772-52 | Larval zebrafish behavioral recording chambers |
| 24-well plates | VWR | 10062-896 | Larval fathead minnow behavioral recording chambers |
| Calcium sulfate dihydrate | Sigma-Aldrich | C3771 | For reconstituted hard water |
| Magnesium Sulfate | Sigma-Aldrich | M7506 | For reconstituted hard water |
| Sodium Bicarbonate | Sigma-Aldrich | S5761 | For reconstituted hard water |
| Potassium Chloride | Sigma-Aldrich | P9333 | For reconstituted hard water |
| z-mod recirculating system | Marine Biotech Systems | Recirculating system to maintian zebrafish cultures | |
| Statistical analysis software | Sigma Plot | Version 13.0 | Used to analyze beahvioral data and produce figures |
| Statistical analysis software | Graphpad Prism | Prism 5 | Used to produce figures |
| Autosampler/quaternary pumping system | Agilent Technologies | Infinity 1260 model | Analytical verification of caffeine treatment levels |
| Jet stream thermal gradient electrospray ionization source | Agilent Technologies | Analytical verification of caffeine treatment levels | |
| Triple quadrupole mass analyzer | Agilent Technologies | Model 6420 | Analytical verification of caffeine treatment levels |
| 10 cm × 2.1 mm Poroshell 120 SB-AQ column (120Å, 2.7) | Agilent Technologies | 685775-914T | Caffiene chromatography |
| MassHunter Optimizer Software | Agilent Technologies | Determine the ionization mode, monitored transitions, and instrumental parameters for caffeine/caffeine-d9 and paraxanthine/paraxanthine-d6 |
参考文献
- Malaj, E., et al. Organic chemicals jeopardize the health of freshwater ecosystems on the continental scale. Proceedings of the National Academy of Sciences. 111 (26), 9549-9554 (2014).
- Schäfer, R. B., Kühn, B., Malaj, E., König, A., Gergs, R. Contribution of organic toxicants to multiple stress in river ecosystems. Freshwater Biology. 61 (12), 2116-2128 (2016).
- Andersen, M. E., Krewski, D. Toxicity testing in the 21st century: bringing the vision to life. Toxicological Sciences. 107 (2), 324-330 (2008).
- Rovida, C., Hartung, T. Re-evaluation of animal numbers and costs for in vivo tests to accomplish REACH legislation requirements for chemicals-a report by the transatlantic think tank for toxicology (t (4)). Altex. 26 (3), 187-208 (2009).
- Council, N. R. . Toxicity testing in the 21st century: a vision and a strategy. , (2007).
- Mehta, G., Hsiao, A. Y., Ingram, M., Luker, G. D., Takayama, S. Opportunities and challenges for use of tumor spheroids as models to test drug delivery and efficacy. Journal of Controlled Release. 164 (2), 192-204 (2012).
- Scholz, S., Fischer, S., Gündel, U., Küster, E., Luckenbach, T., Voelker, D. The zebrafish embryo model in environmental risk assessment-applications beyond acute toxicity testing. Environmental Science and Pollution Research. 15 (5), 394-404 (2008).
- Fraysse, B., Mons, R., Garric, J. Development of a zebrafish 4-day embryo-larval bioassay to assess toxicity of chemicals. Ecotoxicology and Environmental Safety. 63 (2), 253-267 (2006).
- Noyes, P. D., Haggard, D. E., Gonnerman, G. D., Tanguay, R. L. Advanced morphological-behavioral test platform reveals neurodevelopmental defects in embryonic zebrafish exposed to comprehensive suite of halogenated and organophosphate flame retardants. Toxicological Sciences. 145 (1), 177-195 (2015).
- Colón-Cruz, L., et al. Alterations of larval photo-dependent swimming responses (PDR): New endpoints for rapid and diagnostic screening of aquatic contamination. Ecotoxicology and Environmental Safety. 147, 670-680 (2018).
- Kristofco, L. A., et al. Age matters: developmental stage of Danio rerio larvae influences photomotor response thresholds to diazinion or diphenhydramine. Aquatic Toxicology. 170, 344-354 (2016).
- Rihel, J., et al. Zebrafish behavioral profiling links drugs to biological targets and rest/wake regulation. Science. 327 (5963), 348-351 (2010).
- Kokel, D., et al. Rapid behavior-based identification of neuroactive small molecules in the zebrafish. Nature Chemical Biology. 6 (3), 231-237 (2010).
- Bruton, T., Alboloushi, A., DeL a Garza, B., Kim, B. -. O., Halden, R. U. . Contaminants of Emerging Concern in the Environment: Ecological and Human Health Considerations. , 257-273 (2010).
- Woudenberg, A. B., et al. Zebrafish embryotoxicity test for developmental (neuro) toxicity: Demo case of an integrated screening approach system using anti-epileptic drugs. Reproductive Toxicology. 49, 101-116 (2014).
- Rodríguez-Gil, J., Cáceres, N., Dafouz, R., Valcárcel, Y. Caffeine and paraxanthine in aquatic systems: Global exposure distributions and probabilistic risk assessment. Science of the Total Environment. 612, 1058-1071 (2018).
- Corrales, J., et al. Toward the Design of Less Hazardous Chemicals: Exploring Comparative Oxidative Stress in Two Common Animal Models. Chemical Research in Toxicology. 30 (4), 893-904 (2017).
- Kimmel, C. B., Ballard, W. W., Kimmel, S. R., Ullmann, B., Schilling, T. F. Stages of embryonic development of the zebrafish. Developmental Dynamics. 203 (3), 253-310 (1995).
- Kristofco, L. A., Brooks, B. W. Global scanning of antihistamines in the environment: Analysis of occurrence and hazards in aquatic systems. Science of the Total Environment. 592, 477-487 (2017).
- Saari, G. N., Scott, W. C., Brooks, B. W. Global assessment of calcium channel blockers in the environment: Review and analysis of occurrence, ecotoxicology and hazards in aquatic systems. Chemosphere. , (2017).
- Corrales, J., et al. Toward the Design of Less Hazardous Chemicals: Exploring Comparative Oxidative Stress in Two Common Animal Models. Chemical Research in Toxicology. 30 (4), 893-904 (2017).
- Berninger, J. P., et al. Effects of the antihistamine diphenhydramine on selected aquatic organisms. Environmental Toxicology and Chemistry. 30 (9), 2065-2072 (2011).
- Brooks, B. W. Fish on Prozac (and Zoloft): ten years later. Aquatic Toxicology. 151, 61-67 (2014).
- Huggett, D., Cook, J., Ericson, J., Williams, R. A theoretical model for utilizing mammalian pharmacology and safety data to prioritize potential impacts of human pharmaceuticals to fish. Human and Ecological Risk Assessment. 9 (7), 1789-1799 (2003).
- Fitzsimmons, P. N., Fernandez, J. D., Hoffman, A. D., Butterworth, B. C., Nichols, J. W. Branchial elimination of superhydrophobic organic compounds by rainbow trout (Oncorhynchus mykiss). Aquatic Toxicology. 55 (1-2), 23-34 (2001).
- Scheiner, S. M., Gurevitch, J. . Design and Analysis of Ecological Experiments. , (2001).
- Nakagawa, S. A farewell to Bonferroni: the problems of low statistical power and publication bias. Behavioral Ecology. 15 (6), 1044-1045 (2004).
- Bean, T. G., et al. Pharmaceuticals in water, fish and osprey nestlings in Delaware River and Bay. Environmental Pollution. 232, 533-545 (2018).
- Richendrfer, H., Pelkowski, S., Colwill, R., Creton, R. On the edge: pharmacological evidence for anxiety-related behavior in zebrafish larvae. Behavioural Brain Research. 228 (1), 99-106 (2012).
- Padilla, S., Hunter, D., Padnos, B., Frady, S., MacPhail, R. Assessing locomotor activity in larval zebrafish: Influence of extrinsic and intrinsic variables. Neurotoxicology and Teratology. 33 (6), 624-630 (2011).
- Sukardi, H., Chng, H. T., Chan, E. C. Y., Gong, Z., Lam, S. H. Zebrafish for drug toxicity screening: bridging the in vitro cell-based models and in vivo mammalian models. Expert Opinion on Drug Metabolism & Toxicology. 7 (5), 579-589 (2011).
- Ankley, G. T., Villeneuve, D. L. The fathead minnow in aquatic toxicology: past, present and future. Aquatic Toxicology. 78 (1), 91-102 (2006).
- Hutson, L. D., Liang, J. O. Making an impact: zebrafish in education. Zebrafish. 6, 119 (2009).
- Hutson, L. D., Liang, J. O., Pickart, M. A., Pierret, C., Tomasciewicz, H. G. Making a difference: education at the 10th international conference on zebrafish development and genetics. Zebrafish. 9 (4), 151-154 (2012).
- Kane, A., Salierno, J., Brewer, S. Fish models in behavioral toxicology: automated techniques, updates and perspectives. Methods in Aquatic Toxicology. 2, 559-590 (2005).
- Rodriguez, A., et al. ToxTrac: a fast and robust software for tracking organisms. Methods in Ecology and Evolution. 9 (3), 460-464 (2018).
- Hamm, J., Wilson, B., Hinton, D. Increasing uptake and bioactivation with development positively modulate diazinon toxicity in early life stage medaka (Oryzias latipes). Toxicological Sciences. 61 (2), 304-313 (2001).
- Kristofco, L. A., Haddad, S. P., Chambliss, C. K., Brooks, B. W. Differential uptake of and sensitivity to diphenhydramine in embryonic and larval zebrafish. Environmental Toxicology and Chemistry. 37, 1175-1181 (2018).
- Steele, W. B., Kristofco, L. A., Corrales, J., Saari, G. N., Haddad, S. P., Gallagher, E. P., Kavanagh, T. J., Kostal, J., Zimmerman, J. B., Voutchkova-Kostal, A., Anastas, P. T., Brooks, B. W. Comparative behavioral toxicology of two common larval fish models: exploring relationships between modes of action and locomotor responses. Science of the Total Environment. 460-461, 1587-1600 (2018).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。