Method Article
Experimentelles Protokoll für die Prüfung Verhaltensreaktion Profile in Larval Fish: Anwendung auf die Neuro-Stimulans Koffein
In diesem Artikel
Zusammenfassung
Hier präsentieren wir ein Protokoll, um Larven Zebrafisch und Fathead Elritze motorischen Aktivitäten und Photomotor Antworten (PMR) mithilfe einer automatischen Tracking-Software prüfen. Wenn gemeinsam Toxikologie Bioassays enthalten, liefern Analysen dieser Verhaltensweisen ein Diagnose-Tool um chemische Bioaktivität zu untersuchen. Dieses Protokoll wird beschrieben mit Koffein, ein Modell Neurostimulant.
Zusammenfassung
Fisch-Modelle und Verhaltensweisen werden zunehmend in den biomedizinischen Wissenschaften verwendet; Allerdings sind Fische längst das Thema ökologische, physiologische und toxikologische Studien. Mit automatisierten digitalen Tracking Plattformen, die jüngsten Anstrengungen in Neuropharmacology nutzen larval Fish Bewegungsorgane Verhaltensweisen um mögliche therapeutische Ziele für neuartige kleine Moleküle zu identifizieren. Ähnlich wie bei diesen Bemühungen Forschung in den Umweltwissenschaften und vergleichende Pharmakologie und Toxikologie prüft verschiedene Verhaltensweisen der Fische-Modelle als diagnostische Hilfsmittel in mehrstufigen Bewertung von Schadstoffen und Echtzeit-Überwachung von Oberflächengewässern für Schadstoff-Bedrohungen. Während der Zebrabärbling ein beliebtes larval Fish-Modell in den biomedizinischen Wissenschaften ist, ist Fathead Elritze ein gemeinsames larval Fish-Modell in der Ökotoxikologie. Leider erhielten Fathead Elritze Larven in Verhaltensstudien deutlich weniger Aufmerksamkeit. Hier entwickeln wir und zeigen ein Verhaltens-Profil-Protokoll mit Koffein als ein Modell Neurostimulant. Obwohl Photomotor Antworten von Fathead Elritzen gelegentlich von Koffein betroffen waren, Zebrafisch waren für Photomotor und Bewegungsorgane Endpunkte, die umweltrelevanten Ebene reagiert deutlich empfindlicher. Zukünftige Studien werden benötigt, um vergleichende Verhaltens Empfindlichkeit Unterschiede unter den Fischen mit Alter und Tageszeit zu verstehen, und um festzustellen, ob ähnliche Auswirkungen auf das Verhalten in der Natur vorkommen und würde bezeichnend für negative Ergebnisse in den einzelnen oder Bevölkerung Ebenen der biologischen Organisation.
Einleitung
Obwohl Fisch-Modelle zunehmend für biomedizinischen Studien verwendet werden, sind Fische routinemäßig für Ökologie und Physiologie Studien, Verschmutzung der Oberflächengewässer zu prüfen und zu verstehen, toxikologischen Schwellenwerte von Chemikalien eingesetzt worden. Diese Bemühungen sind wichtig, weil chemischer Verunreinigung kann aquatische Ökosysteme beeinträchtigen und die Qualität der Quelle Wasserversorgung1,2 gefährden. Die meisten der Chemikalien im Handel, jedoch fehlen sogar grundlegende toxikologische Informationen3.
Tiermodell Assays traditionell in regulatorischen Toxizitätstests verwendet ressourcenintensiv sind und nicht den hohen Durchsatz bieten Tier Früherkennung für Toxizitätstests in das 21. Jahrhundert-4benötigt. Anschließend gibt es ein wachsender Impuls zu verabschieden und in-vitro- Modelle, die schneller und effizienter Verbindungen für biologische Aktivitäten3,5Bildschirm können zu nutzen. Obwohl zellbasierten Modelle viele Gelegenheiten bieten, sie oft nicht über biologische Komplexität und somit nicht entfallen viele wichtige Gesamtorganismus Prozesse, einschließlich Stoffwechsel6.
Der Zebrabärbling ist ein gemeinsames biomedizinische Tiermodell, das gewinnt Popularität als ein alternatives Modell in aquatische Toxikologie und Ökotoxikologie7,8. Angesichts ihrer geringen Größe, schnelle Entwicklung und hohe Fruchtbarkeit, Fisch-Modelle lässt sich schnell und effizient Chemikalien für Bioaktivität und Toxizität auf dem gesamten Organismus Skala9Bildschirm. Mit Hilfe von automatisierten Tracking-Software bieten Larven Zebrafisch Verhaltensweisen erweiterten Diagnosedienstprogramm Screening-Kontaminanten für Toxizität10,11. Studien in der pharmazeutischen Wissenschaften haben gezeigt, dass Bewegungsorgane Endpunkte informativ von chemischen Wirkmechanismen sind, Phänotyp Verhaltensweisen genutzt werden und dann versuchsweise subzelluläre Ziele für neuartige Moleküle12identifizieren können, 13. Der Zebrabärbling ist ein beliebtes larval Fish-Modell in den biomedizinischen Wissenschaften, Fathead Elritze ist eine gemeinsame, ökologisch wertvollen Fisch-Modell, das für Ökotoxikologie Studien und prospektive verwendet wird (z. B. neue chemische Bewertungen) und Retrospektive (z. B. ambient Oberflächenwasser oder Abwasser Abwässer Überwachung) Umweltprüfungen. Verhaltensreaktionen von Larven Fathead Elritzen haben leider deutlich weniger Aufmerksamkeit als Zebrafisch erhalten. Unsere kontinuierliche Forschung mit zwei gemeinsamen larval Fish-Modellen, dem Zebrafisch und Fathead Elritze, legt nahe, dass Larven Fische schwimmen Muster zu erwartenden Modi oder Wirkmechanismen für diverse Chemikalien einzigartig erscheinen. Verhaltens Endpunkte geben damit das Potenzial, schnell und sensibel prüfen Chemikalien für Toxizität und subzelluläre Ziele für industrielle chemische und andere Verunreinigungen, besonders während der frühen Stufe Bewertungen zu identifizieren.
Hier berichten wir über ein Protokoll zur Untersuchung Verhaltensreaktion Profile in larval Fish. Wir zeigen diese Methoden mit Koffein, eine Modell-Neurostimulant und eine gemeinsame aquatische Verunreinigung, die in aquatischen Systemen durch Entlastung von Abwasseranlagen Behandlungen nach Verzehr von Lebensmitteln, eingeführt ist Getränke, und Arzneimittel mit Koffein14formuliert. Wir untersuchen Verhaltensreaktionen auf Koffein in beiden Larven Zebrafisch und Fathead Elritze, unter anderem zu einer plötzlichen Änderung der Lichtverhältnisse, die oft als Photomotor Reaktion (PMR) während pharmazeutische Studien mit embryonale und Larvale bezeichnet wird Zebrafisch13,15. Wir identifizieren weitere Effekte des Koffeins über mehrere Bewegungsorgane Endpunkte, chemische Reaktion Profile für jedes Fisch-Modell zu entwickeln. Koffein Behandlung Ebenen in dieser Studie verwendeten repräsentieren die oberen Perzentile der Exposition Distributionen basierend auf ökologischen Messwerte von Koffein16. Wir gehören auch Behandlungen Benchmarking larval Fish LC50 Werte und der therapeutischen Gefahr Wert (THV), eine pharmazeutische Konzentration im Wasser, das voraussichtlich Plasmaspiegel in Einklang mit einer therapeutischen Humanplasma Dosis Fisch führen.
Protokoll
Studien in diesem Protokoll in der Regel folgen standardisierte Versuchsplanung und statistische Analyse Leitlinien empfohlen, von der US Environmental Protection Agency (EPA Nr. 2000.0) für Fathead Elritzen und der Organisation für wirtschaftliche Zusammenarbeit und Entwicklung (OECD Nr. 236) für Zebrafisch. Diese experimentellen Designs (z.B.Erhöhung der Replikation) können im Rahmen des aktuellen Protokolls für zukünftige Studien geändert werden. Fisch-Kultur, die Bedingungen zuvor folgen veröffentlicht Literatur17. Alle experimentellen Verfahren und Fisch-Kultur-Protokolle gefolgt institutionelle Animal Care und Use Committee Protokolle an der Baylor Universität zugelassen.
(1) Fische, chemische Behandlung aussetzen
- Bereiten Sie Koffein Belichtung Lösungen durch Koffein in rekonstituierte hartes Wasser auflösen. Führen Sie entsprechende serielle Verdünnungen durch Verdünnung höheren Koffein Behandlungen mit hartem Wasser, geringeren Koffein Behandlung zu produzieren.
Hinweis: Tabelle 1 fasst die Behandlung Ebenen in diesem Experiment verwendet.
| Zebrafisch | Fathead Elritze | ||||
| Behandlung | Nominale Koffein-Konzentration (mg/L) | Gemessenen Koffein-Konzentration (mg/L) | Behandlung | Nominale Koffein-Konzentration (mg/L) | Gemessenen Koffein-Konzentration (mg/L) |
| Kontrolle | 0 | < LOD | Kontrolle | 0 | < LOD |
| 75. Herz * | 0,001 | 0,001 | 75. Herz * | 0,001 | 0,001 |
| 95. Herz * | 0,039 | 0,013 | 95. Herz * | 0,039 | 0,009 |
| 99. Herz * | 0,412 | 0.361 | 99. Herz * | 0,412 | 0,310 |
| THV | 4.07 | 3.81 | THV | 4.07 | 4.12 |
| 10 % LC50 | 48.46 | 46,66 | 10 % LC50 | 14.1 | 14.7 |
| 40 % LC50 | 193.82 | 186.67 | 40 % LC50 | 56.38 | 53.91 |
Tabelle 1: experimentelle Koffein Behandlungen für Zebrafisch und Fathead Elritze Experimente. Nominal- und gemessenen Werte von Koffein für jede Behandlung erhalten. * Die Koffein-Behandlungen, die in dieser Studie verwendeten repräsentieren die oberen Perzentile der Exposition Distributionen basierend auf ökologischen Messwerte von Koffein16. THV: Therapeutische Risiko Wert. DG: Limit of Detection
- Gießen Sie die fertige Lösung in einzelnen Exposition Sekt. Verwenden Sie 100 mL Glas Becher gefüllt mit 20 mL Exposition Lösung für Zebrafisch Exposition Kammern und 500 mL Becher mit 200 mL Exposition Lösung für Fathead Elritze Exposition Kammern.
- Legen Sie mit einer transferpipette, 10 Zebrafish Embryos im Alter von 4 – 6 h Post Düngung (hpf) in jede der vier wiederholte Exposition Kammern pro Behandlung.
- Platz 10 Fathead Elritze Larven im Alter innerhalb von 24 h von Schraffuren in jedem der drei wiederholte Exposition Kammern pro Behandlung. Um die größere Größe von Fathead Elritze Larven unterzubringen, geschnitten Sie die Transfer-PIPETTENSPITZE vor Übertragung ab.
- Pflegen Zebrafisch Experimente auf eine 16:8 h hell: dunkel Photoperiode und eine Konstante Temperatur von 28 ± 1 ° C. Verwenden Sie das gleiche Photoperiode Regime für Fathead Elritze Studien, aber bei einer Temperatur von 25 ± 1 ° C.
-
Nach 96 h Exposition gegenüber chemischen Stoffen Platten Ladung Fisch einzeln in separaten Brunnen von 48 (für Zebrafisch) und 24 (für Fathead Elritze) gut.
- Um sicherzustellen, dass jeder auch ein gleiches Volumen der Lösung enthält, übertragen Sie zebrafischlarven auf 48 well-Platten mit einer 5.000 µL Autopipette ein Volumen von 1.000 µL pro Bohrloch. Verwenden der Autopipette zum zurückziehen und übertragen der zebrafischlarven und der Exposition Lösung gleichzeitig.
- Aufgrund ihrer größeren Größe übertragen Sie Fathead Elritze Larven mit einer transferpipette mit der Spitze abgeschnitten. Vor der Übertragung von Fathead Elritze Larven auf einzelnen Wells, füllen jeweils gut auf 2.000 µL mit einer Autopipette. Beim Übertragen von einzelnen Fathead Larven in Brunnen, die Transfer-PIPETTENSPITZE in die gut Lösung und ermöglichen Sie die Fische zu schwimmen von der Pipettenspitze in den Brunnen.
2. Kalibrierung des Video-Tracking-Parameter
-
Vor Verhaltensmaßnahmen, Beobachtung und Kalibrierung Parameter in der Videospur Software einstellen (siehe Tabelle der Materialien).
- Legen Sie eine well-Platte in der Aufnahme-Kammer mit mindestens 1 larval Fish in einem einzelnen Brunnen. Verwenden Sie die Platte und die damit verbundenen Fisch als Darstellungen, um Kalibrierung Parameter festzulegen.
- In der Videospur Software, klicken Sie auf "Datei | Protokoll zu generieren", dem öffnet sich einer Dialogbox"Protokoll-Assistent". Geben Sie im Feld "Standort Count" die Anzahl der einzelnen Vertiefungen der well-Platte, und klicken Sie dann auf "OK".
- Am oberen Rand des Bildschirms, klicken Sie auf "Ansicht | Full Screen", die das System eine obenliegende Kameraansicht der well-Platte anzeigen veranlassen wird.
- Klicken Sie auf "Zeichnen Areas", die als drei bunten Formen erscheint. Wählen Sie auf der rechten Seite der gut Sichtbereich Platte das Kreissymbol im Feld mit der Bezeichnung "Areas".
- Verwenden Sie den Cursor, um das kreisförmige Video tracking-Bereich in der oberen linken gut von der well-Platte zu umreißen. Wählen Sie "Oben rechts markieren" und dann skizzieren Sie den Anzeigebereich oben rechts gut zu. Wählen Sie dann "Unten Mark" unten rechts gut zu skizzieren.
Hinweis: Nachdem Sie den kreisförmigen Umriss gezeichnet, seine Position müssen wahrscheinlich angepasst werden. Um die Position der Kontur ändern möchten, klicken Sie auf "auswählen" und verwenden Sie dann den Cursor zu den umrissenen Bereich bewegen. Außerdem können Konturen repliziert werden, indem Sie auf "Kopieren" und dann "Einfügen". - Nach oben, rechts, oben links und unten recht gut tracking Bereiche definiert wurden, klicken Sie auf "Build", um die Software automatisch die Viewings der verbleibenden Brunnen abzugrenzen.
- Klicken Sie in den Bereich mit der Bezeichnung "Kalibrierung" "Scale zeichnen". Verwenden Sie den Cursor auf um eine horizontale Linie über die Platte zu ziehen. Sobald die Linie gezeichnet wird, erscheint ein Dialogfeld mit der Bezeichnung "Kalibriermessung". Geben Sie die Länge der well-Platte, und klicken Sie auf "OK".
- Beenden Sie die Zeichnung Manager durch Anklicken des Symbols "Bereiche zeichnen".
- Klicken Sie auf das Symbol "Kacheln". Mit dem Cursor markieren Sie alle Felder, die auf dem Bildschirm angezeigt werden, so dass jede Box grün ist.
Hinweis: Die Fliesen-Symbol erscheint als eine Gruppe von sechs einzelne kleine Quadrate - "Klicken Sie auf Ansicht | "Full Screen". Klicken Sie auf der rechten Seite der Platte die Bildfläche "Bkg" in das Feld mit der Bezeichnung "Nachweisgrenze". Verwenden Sie den Schwellenwert-Schieberegler, um die Pixel-Nachweisgrenze festzulegen. Einmal die entsprechenden Pixel Nachweisgrenze ausgewählt ist, klicken Sie auf "Anwenden, Gruppe".
Hinweis: Dieses Protokoll wird die Nachweisgrenze um 13 Uhr im schwarzen Modus für Zebrafisch-Beobachtungen und bei 110 im transparenten Modus für Fathead Elritze Beobachtungen. - Geben Sie im Feld mit der Bezeichnung "Bewegungsgrenze" die gewünschten Bewegungsgeschwindigkeit tracking-Parameter. Sobald Geschwindigkeitsparameter festgelegt sind, klicken Sie auf "Anwenden zu Gruppe".
Hinweis: Dieses Protokoll setzt kleine/große Bewegungen auf 20 mm/s und inaktiv/kleine Bewegungen bei 5 mm/s. Diese Auswahl Programmieren die Software larval Fish Bewegung auf drei verschiedenen Geschwindigkeitsstufen: inaktiv (Einfrieren) = < 5 mm/s, kleine (cruising) = 5-20 mm/s und großen (platzen) = > 20 mm/s. - Klicken Sie auf "Parameter | Das Protokoll Parameter"aus dem Dropdown-Menü. Wählen Sie in der Dialogbox die Registerkarte "Time" "geben Sie die Beobachtungszeit und Integrationszeit. Klicken Sie auf "Ok", nachdem Parameter eingegeben werden.
- Legen Sie Dropdown die hell/dunkel Photoperiode Zeiten und Lichtintensität für jede Photoperiode offen die leichte Treibereinstellungen Box Dialog durch Auswahl von "Licht fahren" von den "Parametern"-Menü.
Hinweis: Siehe Protokoll für die Einstellung mehrere hell-dunkel-photoperioden video. - Nachdem Sie die video-Tracking-Parameter eingestellt haben, retten Sie die Beobachtung-Protokoll.
Hinweis: Dieses Protokoll beobachtet Fisch Verhalten über einen Zeitraum von 50 min, der enthält eine 10 min Akklimatisierung Phase gefolgt von 4 hell/dunkel-Phasen, bestehend aus zwei 10 min leichte Perioden und zwei 10 min dunkle Perioden zu verändern. Die Integrationszeit soll Verhalten für jede Minute der 50 min Verhaltens Prüfung zu messen.
3. Beobachtung der Bewegungsorgane Larval Fish und Photomotor Verhalten
- Legen Sie die well-Platte mit experimentellen Fischen in der Verhaltenstherapie Aufnahme Kammer.
- Öffnen Sie in dem Video tracking-Software die Tracking-Protokoll, das in Schritt 3 entwickelt.
- Überprüfen Sie im video-Tracking-Viewer, um sicherzustellen, dass alle Larven auf dem Bildschirm sichtbar sind, dass nur eine einzelne Larve in jede Vertiefung vorhanden ist, und dass einzelne Brunnen innerhalb der Beobachtung Bereiche ausgerichtet sind, die in den Schritten 2.1.5 und 2.1.6 definiert wurden.
- Klicken Sie auf "Experiment | Execute".
Hinweis: Das System fordert den Benutzer, einen Namen und einen Speicherort für die Beobachtungsdaten anzugeben. - Einmal den Namen und Speicherort der Beobachtung Daten angegeben wurden, klicken Sie auf das Symbol "Mehrere Live-Bilder" markieren Sie alle vordefinierten Viewings
Hinweis: Dieses Symbol befindet sich oben auf dem Computerbildschirm angezeigt und erscheint als eine Box in vier kleinere Quadrate unterteilt. Klicken Sie auf dieses Symbol, markieren Sie alle vordefinierten Viewings. - Schließen Sie das Fenster der Kammer Aufnahme und klicken Sie auf "Hintergrund | Start"auf dem Computer-Monitor.
4. Analyse von Verhaltensdaten
- Larval Fish Aktivitätsdaten abzurufen, öffnen Sie die Tabelle, die wird automatisch von der Tracking-Software zusammengestellt und in den Ordner vom Benutzer vor Einleitung eines Verhaltens Studien (Schritt 3.4) angegeben ist.
- Siehe Abbildungen 1A und 1 b für repräsentative Messungen der naiv lokomotorischen Tätigkeit der unbelichteten Zebrafisch und Fathead Elritze Larven, beziehungsweise. Finden Sie unter Zahlen 1 und 1D PMR Berechnungen, die das Ausmaß der Bewegung Unterschied zwischen hell, dunkel oder hell zu dunkel Übergänge effektiv zu untersuchen.
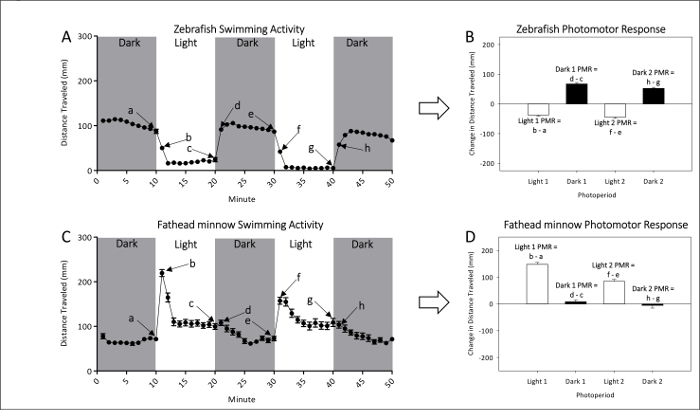
Abbildung 1: Beispiel der Grundlinie unbelichteten Zebrafisch (A und B) und Fathead Elritze (C und D). Der Mittelwert (± SEM) Abstand Schwamm für Zebrafisch (A) und Fathead Elritze (C) ist gegeben durch Punkte jede Vertretung einminütigen Abständen Aktivität. Zwei dunkle und zwei leichte Perioden der Photomotor Antworten werden gemessen. Die letzte (a, c, e und g) und erste (b, d, f und h) Minute jede Photoperiode dienen zum PMRs. Photomotor Reaktionen der Zebrafisch (B) berechnen und Fathead Elritze (D) werden gemessen, als die Veränderung der Mittelwert (±SEM) zurückgelegte Strecke zwischen der Last-Minute eine anfängliche Photoperiode und der ersten Minute der folgenden Periode. Bitte klicken Sie hier für eine größere Version dieser Figur.
Ergebnisse
Koffein Behandlung nicht merklich während der 96 h-Experimente mit Zebrafisch und Fathead Elritzen unterschiedlich. Tabelle 1 stellt analytisch geprüfte Konzentrationen des Levels Behandlung. Dieses Protokoll Wasserproben für Koffein Behandlung Ebenen von Isotop-Verdünnung Flüssigkeitschromatographie Tandem-Massenspektrometrie (LC-MS/MS) in der Regel nach zuvor gemeldeten Methoden28überprüft. Die Bildung von Paraxanthine, der primäre Metabolit von Koffein, wurde ebenfalls quantifiziert. Eine Beschreibung dieser analytischen Verfahren in der analytischen Zusatzinformationen. Aufgrund der Ähnlichkeiten zwischen nominal- und analytische Überprüfung der Behandlungen sind nominale Behandlung für den Rest des Manuskripts vorgestellt. Koffein verändert deutlich Zebrafisch und Fathead Elritze Verhaltensweisen. Zebrafisch Bewegungsapparates Antworten waren durchweg mehr empfindlich auf Koffein als Fathead Elritzen. Die empfindlichsten Verhaltens Endpunkte für Zebrafisch und Fathead Elritze Larven waren betroffen von Koffein in einer Konzentration von 0,039 mg/L. Tabelle 2 fasst niedrigste beobachtete Effekt Konzentrationen (LOECs) und keine beobachtete Effekt-Konzentrationen (NOECs) für jeden Verhaltens Endpunkt in beide Fisch-Modelle.
| Zebrafisch | Fathead Elritze | ||||
| Endpunkt | LOEC (mg/L) | NOEC (mg/L) | Endpunkt | LOEC (mg/L) | NOEC (mg/L) |
| Gesamtstrecke dunkel | 0,412 | 0,039 | Gesamtstrecke dunkel | − | 56.38 |
| Gesamtstrecke Licht | 48.46 | 4.07 | Gesamtstrecke Licht | − | 56.38 |
| Insgesamt zählt Dark | 0,412 | 0,039 | Insgesamt zählt Dark | − | 56.38 |
| Insgesamt zählt Licht | 48.46 | 4.07 | Insgesamt zählt Licht | − | 56.38 |
| Platzende Abstand dunkel | − | 193.82 | Platzende Abstand dunkel | − | 56.38 |
| Platzende Ferne Licht | 193.82 | 48.46 | Platzende Ferne Licht | − | 56.38 |
| Platzen zählt dunkel | 193.82 | 48.46 | Platzen zählt dunkel | − | 56.38 |
| Platzende zählt Licht | 193.82 | 48.46 | Platzende zählt Licht | − | 56.38 |
| Platzende Dauer dunkel | 193.82 | 48.46 | Platzende Dauer dunkel | − | 56.38 |
| Dauer Licht platzen | − | 193.82 | Dauer Licht platzen | − | 56.38 |
| Cruising Abstand dunkel | 0,412 | 0,039 | Cruising Abstand dunkel | − | 56.38 |
| Cruising Abstand Licht | 48.46 | 4.07 | Cruising Abstand Licht | − | 56.38 |
| Kreuzfahrt zählt dunkel | 0,412 | 0,039 | Kreuzfahrt zählt dunkel | − | 56.38 |
| Kreuzfahrt zählt Licht | 48.46 | 4.07 | Kreuzfahrt zählt Licht | − | 56.38 |
| Kreuzfahrt Dauer dunkel | 0,412 | 0,039 | Kreuzfahrt Dauer dunkel | − | 56.38 |
| Kreuzfahrt Dauer Licht | 48.46 | 4.07 | Kreuzfahrt Dauer Licht | − | 56.38 |
| Entfernung dunkle Einfrieren | 0,412 | 0,039 | Entfernung dunkle Einfrieren | 0,039 | 0,001 |
| Entfernung leicht Einfrieren | 0,039 | 0,001 | Entfernung leicht Einfrieren | − | 56.38 |
| Gefrierpunkt zählt dunkel | 0,412 | 0,039 | Gefrierpunkt zählt dunkel | − | 56.38 |
| Einfrierende zählt Licht | 48.46 | 4.07 | Einfrierende zählt Licht | − | 56.38 |
| Einfrieren von Dauer dunkel | − | 193.82 | Einfrieren von Dauer dunkel | 56.38 | 14.10. |
| Dauer Licht Einfrieren | 48.46 | 4.07 | Dauer Licht Einfrieren | − | 56.38 |
| Dunkel 1 PMR | 48.46 | 4.07 | Dunkel 1 PMR | 0,039 | 0,001 |
| Licht 1 PMR | 48.46 | 4.07 | Licht 1 PMR | − | 56.38 |
| Dunkel 2 PMR | 48.46 | 4.07 | Dunkel 2 PMR | − | 56.38 |
| Licht 2 PMR | 48.46 | 4.07 | Licht 2 PMR | − | 56.38 |
| Platzende dunkel 1 PMR | − | 193.82 | Platzende dunkel 1 PMR | − | 56.38 |
| Platzen Licht 1 PMR | − | 193.82 | Platzen Licht 1 PMR | − | 56.38 |
| Dunkel 2 PMR platzen | 193.82 | 48.46 | Dunkel 2 PMR platzen | − | 56.38 |
| Platzen Licht 2 PMR | − | 193.82 | Platzen Licht 2 PMR | − | 56.38 |
| Cruising dunkel 1 PMR | 48.46 | 4.07 | Cruising dunkel 1 PMR | − | 56.38 |
| Kreuzfahrt Licht 1 PMR | 48.46 | 4.07 | Kreuzfahrt Licht 1 PMR | − | 56.38 |
| Cruising dunkel 2 PMR | 48.46 | 4.07 | Cruising dunkel 2 PMR | − | 56.38 |
| Cruising Light 2 PMR | 193.82 | 48.46 | Cruising Light 2 PMR | 56.38 | 14.10. |
| Einfrieren von dunklen 1 PMR | 48.46 | 4.07 | Einfrieren von dunklen 1 PMR | − | 56.38 |
| Einfrieren von Licht 1 PMR | 193.82 | 48.46 | Einfrieren von Licht 1 PMR | − | 56.38 |
| Einfrieren von dunklen 2 PMR | 48.46 | 4.07 | Einfrieren von dunklen 2 PMR | − | 56.38 |
| Einfrieren von Licht 2 PMR | 193.82 | 48.46 | Einfrieren von Licht 2 PMR | − | 56.38 |
Tabelle 2: Zebrafisch und Fathead Elritze behavioral NOECs und LOECs für Koffein. Keine beobachtete Effekt-Konzentration (NOEC) und niedrigste beobachtete Effekt Konzentration (LOEC) (mg/L) Werte für jede der hell/dunkel Schwimmen Aktivität Endpunkte und Photomotor Antworten für Zebrafisch und Fathead Elritzen Koffein ausgesetzt. Striche zeigen an, dass keine Auswirkungen auf einen bestimmten Endpunkt auf allen Ebenen der Behandlung beobachtet wurden.
Abbildung 2 zeigt Bewegungsorgane Gesamtaktivität und PMRs Zebrafisch und Fathead Elritze nach 96 h Exposition gegenüber Koffein. Fathead Elritze Larven, die durch Koffein auf den unteren Ebenen der Behandlung (0,038 mg/L) als Zebrafisch, aber eine deutlich größere Anzahl von Photomotor Endpunkte PMRs verändert wurden waren im Zebrafisch betroffen. Höchstmaß an Koffein (193,82 mg/L) Behandlung verändert PMR im Zebrafisch, in denen diese Reaktionen genau gegenüber waren von Steuerelementen. Auf dieser Ebene erhöhte Behandlung jedoch PMRs verringerte sich im Dunkeln und bei Licht erhöht.

Abbildung 2: Schwimmen-Aktivität und Photomotor Reaktionen der Zebrafisch (A und B) und Fathead Elritze (C und D) nach 96 h Exposition gegenüber Koffein. Der Mittelwert (± SEM) Abstand Schwamm für Zebrafisch (A) und Fathead Elritze (C) ist gegeben durch Punkte jede Vertretung 1-min Abständen von Aktivität. Photomotor Reaktionen der Zebrafisch (B) und Fathead Elritze (D) werden als die Veränderung der Mittelwert (± SE) insgesamt zurückgelegte Strecke zwischen der Last minutes von einer anfänglichen Photoperiode und der ersten Minute der folgenden Periode gemessen. Zwei dunkle und zwei leichte Periode Photomotor Antworten wurden gemessen. Insgesamt 24 Zebrafisch (4 Wiederholungen jeder 6 Larven) und 12 (3 Wiederholungen jeweils 4 Larven) Fathead Elritzen dienten für die Verhaltensbeobachtung. p < 0,10; p < 0,05; p < 0,01. Bitte klicken Sie hier für eine größere Version dieser Figur.
Neben der Messung Larven PMRs, war hell und dunkel lokomotorische Aktivität über drei Geschwindigkeit Schwellenwerte für Abstand verschoben, Anzahl der Bewegungen und die Dauer der Bewegungen analysiert. Diese Daten werden verwendet, um Verhaltensreaktion Profile für Koffein (Abbildung 3, Supplemental Abbildung 1) zu entwickeln. In beiden die Fisch-Modelle betroffen Koffein gehemmt Aktivität überhaupt deutlich Bewegungsorgane Endpunkte. Beide Fische Modelle nachgewiesenen erhöhten Aktivität bei der Bersten Geschwindigkeit Schwellen nach Exposition gegenüber Koffein, aber nicht signifikant. Ähnlich wie die Ergebnisse der Beobachtungen PMR, Koffein bewirkt eine größere Anzahl von Zebrafisch Bewegungsorgane Endpunkte. In der Tat verändert Koffein deutlich mehrere Bewegungsapparates Antworten unter dunklen Bedingungen bei ökologisch realistischen Werten unterhalb der THV. Fathead Elritze lokomotorischen Tätigkeit wurde unter Lichtverhältnissen von jeder Behandlung-Ebene jedoch nicht wesentlich beeinträchtigt.

Abbildung 3: Antwort Profile der Larven Zebrafisch und Fathead Elritzen nach 96 h Exposition gegenüber Koffein. Meine Zebrafisch dunkel (A) und Licht (B) schwimmen Aktivität im Vergleich zu Fathead Elritze dunkel (C) und Licht (D) Tätigkeit nach 96 h Exposition gegenüber Koffein bedeuten. Daten stellt Aktivität über zwei 10 min dunkle photoperioden und zwei 10 min leichte photoperioden für jedes Fisch-Modell dargestellt. Daten ist zu kontrollieren, normalisiert, die an der 0-Achse in jeder Figur vertreten sind. Verhaltensbezogene Parameter umfassen Distanz Schwamm, Anzahl der Bewegungen (Grafen) und Dauer eines jeden Satzes über 3 Geschwindigkeitsstufen, platzen (> 20 mm/s), Kreuzfahrt (5 – 20 mm/s), und Einfrieren (< 5 mm/s). Neben Bewegungsmuster bei jeder Geschwindigkeit Schwellen Gesamtstrecke geschwommen und Gesamtzahl der Bewegungen vertreten. ↑ stellt eine deutliche Steigerung in Aktivität im Vergleich zur Kontrolle und ↓ zeigt eine signifikante Abnahme der Aktivität im Vergleich zur Kontrolle. Insgesamt 24 Zebrafisch (4 Wiederholungen jeder 6 Larven) und 12 (3 Wiederholungen jeweils 4 Larven) Fathead Elritze Verwendungsnachweis in Verhaltensbeobachtungen für jede Gruppe. p < 0,10; p < 0,05; p < 0,01. Bitte klicken Sie hier für eine größere Version dieser Figur.
Ergänzende Abbildung 1: Photomotor Reaktionen der Zebrafisch (A und B) und Fathead Elritze (C und D) über drei Geschwindigkeit Schwellen. Zebrafisch (A, B und C) und Fathead Elritze Larven (D, E und F) Photomotor Antworten über drei Geschwindigkeit Schwellen (Einfrieren: 20 mm/s) nach 96 Stunden Exposition gegenüber Koffein. Photomotor Reaktionen der Zebrafisch und Fathead Elritze werden als die Abstandsänderung bedeuten (±SE) total reiste zwischen den Last minutes von einer anfänglichen Photoperiode und der ersten Minute der folgenden Periode gemessen. Zwei dunkle und zwei leichte Periode Photomotor Antworten wurden gemessen. Insgesamt 24 Zebrafisch (4 Wiederholungen jeder 6 Larven) und 12 (3 Wiederholungen von 4 Larven) Fathead Elritzen dienten für die Verhaltensbeobachtung. * p < 0,01 Bitte klicken Sie hier, um diese Datei herunterladen.
Diskussion
Bei der Auswahl der chemischen Behandlung Ebenen für Verhaltensstörungen toxikologischen Untersuchungen müssen mehrere Faktoren berücksichtigt werden. Coffein-Behandlung-Ebenen in der vorliegenden Studie wurden anhand der oberen Herz Werte für vorausgesagten ökologischen Expositionsszenarien aus Abwasser Abwasser16ausgewählt. Wenn möglich, wählen wir routinemäßig Behandlung Ebenen für aquatische Toxikologie Studien mit probabilistischen Expositionsabschätzungen ökologische Beobachtungen19,20,21. Ein THV, die berechenbar für Arzneimittel ist, wurde auch als eine Behandlung-Ebene in der vorliegenden Studie aufgenommen. THV Werte (GL. 1)22,23 als vorhergesagten Wasser-Konzentrationen führt zu menschlichen therapeutischen Dosen (Cmax) von Arzneimitteln in Fisch23gelten, sind inspiriert vom ersten Plasma Modellierung Bemühungen24und sind Blut: Wasser chemisch Partitionierung Koeffizienten (GL. 2)25berechnet.
THV = Cmax / log PBW (GL. 1)
Log PBW = Log [(100,73. log Kow · 0,16) + 0,84] (GL. 2)
Hier wählen wir zudem subletalen Behandlung Ebenen relativ Zebrafisch und Fathead Elritze LC50-Werte. Berücksichtigen wir diesen Ansatz ein nützliches benchmarking-Verfahren für Verhaltensreaktionen, insbesondere Schwellenwerte für spezifische Verhaltensweisen mit einem Fisch-Modell über mehrere Chemikalien zu vergleichen. Es ermöglicht weitere Berechnungen von akuten zu chronischen Verhältnisse, die in aquatische Toxikologie für mechanistische Studien und Evaluierungen diagnostisch hilfreich sein kann. LC50-Werte wurden von vorläufigen Toxizität Bioassays nach standardisierten Richtlinien gegeben in Schritt 2.1 erhalten.
In diesem Protokoll beschäftigen wir gemeinsamen experimentellen Designs und statistische Techniken von der US-EPA und OECD standardisierte Methoden zur toxikologischen Untersuchungen mit Fisch-Modelle empfohlen. Wenn wir p Werte melden (zB., < 0,01, < 0,05, < 0.10), signifikante Unterschiede (α = 0,10) Aktivität Ebenen werden identifiziert, unter Behandlungen mit Varianzanalyse (ANOVA), wenn Normalität und Gleichwertigkeit der Varianz Annahmen erfüllt sind. Die Dunnett oder Tukey HSD post-hoc-Tests werden durchgeführt, um die Behandlung Höhenunterschiede zu identifizieren. Wir wählen diese Alpha (α = 0,10) Wert zu reduzieren Typ II Fehler, insbesondere bei frühen Stufe Assays und wann ein Verständnis der biologisch wichtigen Effektgröße für erforschten Verhaltens Endpunkte und Modell Organismen26, anstelle von begrenzt ist Verfahren immer häufiger in den biomedizinischen Wissenschaften für Mehrfachvergleiche beschäftigt (zB., Bonferroni-Korrektur für RNA-Seq Daten)27. Zukünftige Studien sind erforderlich, Variabilität der diese Verhaltensreaktionen zu verstehen und möglicherweise experimentellen Designs (z.B. Erhöhung der Replikation) entsprechend ändern.
Eine Reihe von Faktoren beeinflussen Verhalten von Larven Fischen neben Exposition gegenüber chemischen Stoffen. Beispiel: Zeit des Tages, Alter, gut Größe, Temperatur, unter welchen Lichtbedingungen und Volumen der Exposition Lösung in jedem gut repräsentieren wichtige Überlegungen11,30. Aus diesen Gründen sollten Vorkehrungen getroffen werden, die Auswirkungen von externen Faktoren zu minimieren, die lokomotorische Verhalten der Larven Fische während der Experimente beeinflussen könnten. Verhaltensbeobachtungen sollte durchgeführt werden, in engen Zeitfenstern (3 bis 4 h) und über Zeiträume als Zeit des Tages Effekte werden voraussichtlich nur geringen Einfluss auf Larven lokomotorische Verhalten11haben. Darüber hinaus sollten larval Fish bei einer konstanten Temperatur (28 ± 1 ° C für Zebrafisch) und 24 ± 1 ° C für FHM und auf einen definierten Hell/Dunkel-Zyklus in temperaturgesteuerten Inkubatoren während der Expositionszeit beibehalten werden. Darüber hinaus sollte die Temperatur des Labors wo Verhaltensweisen erfasst werden, Bedingungen, die Annäherung der Versuchsbedingungen, Temperatureinflüsse auf Verhaltensweisen zu vermeiden beibehalten werden. Darüber hinaus sollten Brunnen während Verhaltensbeobachtungen eingesetzt auf eine einheitliche Lautstärke für jeden einzelnen Fisch gehalten werden.
Larven und embryonalen Zebrafisch, die PMRs zuvor in den biomedizinischen Wissenschaften verwendet wurden, um mögliche therapeutische Ziele zu identifizieren, für Roman12,13Verbindungen. Dieses Protokoll baut auf früheren Verhaltensforschung mit Zebrafisch durch die Verwendung von 38 Endpunkte untersuchen chemische Bioaktivität von Umweltschadstoffen. Obwohl Koffein eine gemeinsame aquatische Verunreinigung mit einem verständlichen Wirkmechanismus (MoA) ist, fehlt vielen Verbindungen im Handel wichtige mechanistische Daten. Daher kann dieses Protokoll Einblick von MoAs für Verbindungen fehlen Toxizitätsdaten, einschließlich kommerzielle Chemikalien39eingesetzt werden. Darüber hinaus sieht das Protokoll Methoden für zwei der am häufigsten verwendeten Fisch-Modelle. Wie zuvor erwähnt, während der Zebrabärbling ist ein gemeinsames biomedizinische Fisch-Modell, das immer in Ökotoxikologie beliebter wird, Fathead Elritze dient häufig als ein ökologisches Modell für Umweltbewertung Anwendungen aber erhielt vergleichsweise weniger Aufmerksamkeit in Verhaltensstudien mit automatischen Systemen, im Vergleich zu der Zebrabärbling. Obwohl es keine standardisierten regulatorischen Methoden für Fisch Verhaltens toxikologischen Untersuchungen bleibt, bietet dieses Protokoll einen Ansatz zur zukünftigen Bemühungen zu unterstützen.
Koffein entlockte Verhaltensreaktionen aller Fisch-Modelle auf Ebenen, die in der aquatischen Umwelt16entdeckt wurden. Rodriguez-Gil Et Al. 2018 entwickelt globale Umweltexposition Verteilungen in aquatischen Systemen basierend auf Messwerten von Koffein16. Insbesondere würden 95 % der vorhergesagten Abwasser Abwasser-Konzentrationen der LOECs für die empfindlichsten Verhaltens Endpunkte der Zebrafisch und Fathead Elritze in der vorliegenden Studie (Tabelle 2) unterschritten werden. Obwohl mehrere Auswirkungen auf das Verhalten des Koffeins im Zebrafisch (besonders im Dunkeln) auf umweltrelevante Ebenen beobachtet wurden, ist unklar, ob diese Verhalten-Änderungen können in natürlichen Populationen auftreten oder führen ökologisch wichtige negative Ergebnisse. Obwohl für empfindliche diagnostische Screening Zwecke nützlich, möglicherweise larval Fish Verhaltens Schwellenwerte nicht Vertreter der anderen Lebensgeschichte Stufen oder Fische in natürlichen Populationen. Weiterer Forschung ist erforderlich um festzustellen, ob ähnliche Verhaltensreaktion Schwellen wäre in der Natur vorkommen und bezeichnend für negative Ergebnisse auf den Einzel- oder Bevölkerung Ebenen der biologischen Organisation.
Offenlegungen
Die Autoren haben nichts preisgeben.
Danksagungen
Die Unterstützung für diese Studie durch die US National Science Foundation zur Verfügung gestellt wurde (Projekt-Nr.: CHE-1339637) mit zusätzlicher Unterstützung durch die US Environmental Protection Agency. Wir danken Dr. Jone Corrales, Dr. Lauren Kristofco, Gavin Saari, Samuel Haddad, Bekah Burket und Bridgett Hill für allgemeine Labor Unterstützung.
Materialien
| Name | Company | Catalog Number | Comments |
| ViewPoint Zebrabox | ViewPoint | ZebraLab and ZebraLab platform for automated behavioral observations | |
| Caffeine | Sigma-Aldrich | C0750-100G | Study chemical |
| Incubator | VWR | 9110589 | Maintains light/dark cycle and temperature for fathead minnow experiments |
| Incubator | Thermo Fisher Scientific | 35824-636 | Maintains light/dark cycle and temperature for zebrafish experiments |
| 100 mL glass beakers | VWR | 89000-200 | Zebrafish exposure chambers |
| 500 mL glass beakers | Pyrex | EW-34502-03 | Fathead minnow exposure chambers |
| 5,000 µL auto-pipette | Eppendorf | Research 5000 | Used to fill individual wells in well plates |
| Transfer Pippettes | VWR | 414-004-004 | Used to transfer study organisms |
| 48-well plates | Fisher Scientific | 08-772-52 | Larval zebrafish behavioral recording chambers |
| 24-well plates | VWR | 10062-896 | Larval fathead minnow behavioral recording chambers |
| Calcium sulfate dihydrate | Sigma-Aldrich | C3771 | For reconstituted hard water |
| Magnesium Sulfate | Sigma-Aldrich | M7506 | For reconstituted hard water |
| Sodium Bicarbonate | Sigma-Aldrich | S5761 | For reconstituted hard water |
| Potassium Chloride | Sigma-Aldrich | P9333 | For reconstituted hard water |
| z-mod recirculating system | Marine Biotech Systems | Recirculating system to maintian zebrafish cultures | |
| Statistical analysis software | Sigma Plot | Version 13.0 | Used to analyze beahvioral data and produce figures |
| Statistical analysis software | Graphpad Prism | Prism 5 | Used to produce figures |
| Autosampler/quaternary pumping system | Agilent Technologies | Infinity 1260 model | Analytical verification of caffeine treatment levels |
| Jet stream thermal gradient electrospray ionization source | Agilent Technologies | Analytical verification of caffeine treatment levels | |
| Triple quadrupole mass analyzer | Agilent Technologies | Model 6420 | Analytical verification of caffeine treatment levels |
| 10 cm × 2.1 mm Poroshell 120 SB-AQ column (120Å, 2.7) | Agilent Technologies | 685775-914T | Caffiene chromatography |
| MassHunter Optimizer Software | Agilent Technologies | Determine the ionization mode, monitored transitions, and instrumental parameters for caffeine/caffeine-d9 and paraxanthine/paraxanthine-d6 |
Referenzen
- Malaj, E., et al. Organic chemicals jeopardize the health of freshwater ecosystems on the continental scale. Proceedings of the National Academy of Sciences. 111 (26), 9549-9554 (2014).
- Schäfer, R. B., Kühn, B., Malaj, E., König, A., Gergs, R. Contribution of organic toxicants to multiple stress in river ecosystems. Freshwater Biology. 61 (12), 2116-2128 (2016).
- Andersen, M. E., Krewski, D. Toxicity testing in the 21st century: bringing the vision to life. Toxicological Sciences. 107 (2), 324-330 (2008).
- Rovida, C., Hartung, T. Re-evaluation of animal numbers and costs for in vivo tests to accomplish REACH legislation requirements for chemicals-a report by the transatlantic think tank for toxicology (t (4)). Altex. 26 (3), 187-208 (2009).
- Council, N. R. . Toxicity testing in the 21st century: a vision and a strategy. , (2007).
- Mehta, G., Hsiao, A. Y., Ingram, M., Luker, G. D., Takayama, S. Opportunities and challenges for use of tumor spheroids as models to test drug delivery and efficacy. Journal of Controlled Release. 164 (2), 192-204 (2012).
- Scholz, S., Fischer, S., Gündel, U., Küster, E., Luckenbach, T., Voelker, D. The zebrafish embryo model in environmental risk assessment-applications beyond acute toxicity testing. Environmental Science and Pollution Research. 15 (5), 394-404 (2008).
- Fraysse, B., Mons, R., Garric, J. Development of a zebrafish 4-day embryo-larval bioassay to assess toxicity of chemicals. Ecotoxicology and Environmental Safety. 63 (2), 253-267 (2006).
- Noyes, P. D., Haggard, D. E., Gonnerman, G. D., Tanguay, R. L. Advanced morphological-behavioral test platform reveals neurodevelopmental defects in embryonic zebrafish exposed to comprehensive suite of halogenated and organophosphate flame retardants. Toxicological Sciences. 145 (1), 177-195 (2015).
- Colón-Cruz, L., et al. Alterations of larval photo-dependent swimming responses (PDR): New endpoints for rapid and diagnostic screening of aquatic contamination. Ecotoxicology and Environmental Safety. 147, 670-680 (2018).
- Kristofco, L. A., et al. Age matters: developmental stage of Danio rerio larvae influences photomotor response thresholds to diazinion or diphenhydramine. Aquatic Toxicology. 170, 344-354 (2016).
- Rihel, J., et al. Zebrafish behavioral profiling links drugs to biological targets and rest/wake regulation. Science. 327 (5963), 348-351 (2010).
- Kokel, D., et al. Rapid behavior-based identification of neuroactive small molecules in the zebrafish. Nature Chemical Biology. 6 (3), 231-237 (2010).
- Bruton, T., Alboloushi, A., DeL a Garza, B., Kim, B. -. O., Halden, R. U. . Contaminants of Emerging Concern in the Environment: Ecological and Human Health Considerations. , 257-273 (2010).
- Woudenberg, A. B., et al. Zebrafish embryotoxicity test for developmental (neuro) toxicity: Demo case of an integrated screening approach system using anti-epileptic drugs. Reproductive Toxicology. 49, 101-116 (2014).
- Rodríguez-Gil, J., Cáceres, N., Dafouz, R., Valcárcel, Y. Caffeine and paraxanthine in aquatic systems: Global exposure distributions and probabilistic risk assessment. Science of the Total Environment. 612, 1058-1071 (2018).
- Corrales, J., et al. Toward the Design of Less Hazardous Chemicals: Exploring Comparative Oxidative Stress in Two Common Animal Models. Chemical Research in Toxicology. 30 (4), 893-904 (2017).
- Kimmel, C. B., Ballard, W. W., Kimmel, S. R., Ullmann, B., Schilling, T. F. Stages of embryonic development of the zebrafish. Developmental Dynamics. 203 (3), 253-310 (1995).
- Kristofco, L. A., Brooks, B. W. Global scanning of antihistamines in the environment: Analysis of occurrence and hazards in aquatic systems. Science of the Total Environment. 592, 477-487 (2017).
- Saari, G. N., Scott, W. C., Brooks, B. W. Global assessment of calcium channel blockers in the environment: Review and analysis of occurrence, ecotoxicology and hazards in aquatic systems. Chemosphere. , (2017).
- Corrales, J., et al. Toward the Design of Less Hazardous Chemicals: Exploring Comparative Oxidative Stress in Two Common Animal Models. Chemical Research in Toxicology. 30 (4), 893-904 (2017).
- Berninger, J. P., et al. Effects of the antihistamine diphenhydramine on selected aquatic organisms. Environmental Toxicology and Chemistry. 30 (9), 2065-2072 (2011).
- Brooks, B. W. Fish on Prozac (and Zoloft): ten years later. Aquatic Toxicology. 151, 61-67 (2014).
- Huggett, D., Cook, J., Ericson, J., Williams, R. A theoretical model for utilizing mammalian pharmacology and safety data to prioritize potential impacts of human pharmaceuticals to fish. Human and Ecological Risk Assessment. 9 (7), 1789-1799 (2003).
- Fitzsimmons, P. N., Fernandez, J. D., Hoffman, A. D., Butterworth, B. C., Nichols, J. W. Branchial elimination of superhydrophobic organic compounds by rainbow trout (Oncorhynchus mykiss). Aquatic Toxicology. 55 (1-2), 23-34 (2001).
- Scheiner, S. M., Gurevitch, J. . Design and Analysis of Ecological Experiments. , (2001).
- Nakagawa, S. A farewell to Bonferroni: the problems of low statistical power and publication bias. Behavioral Ecology. 15 (6), 1044-1045 (2004).
- Bean, T. G., et al. Pharmaceuticals in water, fish and osprey nestlings in Delaware River and Bay. Environmental Pollution. 232, 533-545 (2018).
- Richendrfer, H., Pelkowski, S., Colwill, R., Creton, R. On the edge: pharmacological evidence for anxiety-related behavior in zebrafish larvae. Behavioural Brain Research. 228 (1), 99-106 (2012).
- Padilla, S., Hunter, D., Padnos, B., Frady, S., MacPhail, R. Assessing locomotor activity in larval zebrafish: Influence of extrinsic and intrinsic variables. Neurotoxicology and Teratology. 33 (6), 624-630 (2011).
- Sukardi, H., Chng, H. T., Chan, E. C. Y., Gong, Z., Lam, S. H. Zebrafish for drug toxicity screening: bridging the in vitro cell-based models and in vivo mammalian models. Expert Opinion on Drug Metabolism & Toxicology. 7 (5), 579-589 (2011).
- Ankley, G. T., Villeneuve, D. L. The fathead minnow in aquatic toxicology: past, present and future. Aquatic Toxicology. 78 (1), 91-102 (2006).
- Hutson, L. D., Liang, J. O. Making an impact: zebrafish in education. Zebrafish. 6, 119 (2009).
- Hutson, L. D., Liang, J. O., Pickart, M. A., Pierret, C., Tomasciewicz, H. G. Making a difference: education at the 10th international conference on zebrafish development and genetics. Zebrafish. 9 (4), 151-154 (2012).
- Kane, A., Salierno, J., Brewer, S. Fish models in behavioral toxicology: automated techniques, updates and perspectives. Methods in Aquatic Toxicology. 2, 559-590 (2005).
- Rodriguez, A., et al. ToxTrac: a fast and robust software for tracking organisms. Methods in Ecology and Evolution. 9 (3), 460-464 (2018).
- Hamm, J., Wilson, B., Hinton, D. Increasing uptake and bioactivation with development positively modulate diazinon toxicity in early life stage medaka (Oryzias latipes). Toxicological Sciences. 61 (2), 304-313 (2001).
- Kristofco, L. A., Haddad, S. P., Chambliss, C. K., Brooks, B. W. Differential uptake of and sensitivity to diphenhydramine in embryonic and larval zebrafish. Environmental Toxicology and Chemistry. 37, 1175-1181 (2018).
- Steele, W. B., Kristofco, L. A., Corrales, J., Saari, G. N., Haddad, S. P., Gallagher, E. P., Kavanagh, T. J., Kostal, J., Zimmerman, J. B., Voutchkova-Kostal, A., Anastas, P. T., Brooks, B. W. Comparative behavioral toxicology of two common larval fish models: exploring relationships between modes of action and locomotor responses. Science of the Total Environment. 460-461, 1587-1600 (2018).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten