Method Article
Protocole expérimental pour l’examen des profils de réponse comportementale dans les larves de poissons : Application à la caféine Neuro-stimulant
Dans cet article
Résumé
Nous présentons ici un protocole afin d’examiner les larves activités locomotrices zebrafish et fathead minnow et photomotor réponses (PMR) à l’aide d’un logiciel de suivi automatisé. Lorsque incorporé en commun bioessais de toxicologie, analyses de ces comportements fournissent un outil de diagnostic afin d’examiner la bioactivité chimique. Ce protocole est décrit à l’aide de la caféine, un neurostimulant modèle.
Résumé
Les modèles de poissons et les comportements sont de plus en plus utilisés en sciences biomédicales ; Cependant, poissons ont longtemps fait l’objet d’études écologiques, physiologiques et toxicologiques. À l’aide d’automatisé de plates-formes de suivi numérique, des efforts récents en neuropharmacologie mettent des comportements locomoteurs de larves de poissons afin d’identifier des cibles thérapeutiques potentielles pour nouvelles petites molécules. Semblable à ces efforts, la recherche dans les sciences de l’environnement et de la pharmacologie comparative et la toxicologie étudie divers comportements des modèles de poisson comme outils de diagnostic dans l’évaluation à plusieurs niveaux de contaminants et de surveillance en temps réel des eaux de surface pour menaces de contaminant. Considérant que le poisson-zèbre est un modèle de larves de poissons populaires en sciences biomédicales, la boule est un modèle commun de larves de poissons en écotoxicologie. Malheureusement, les larves de fathead minnow ont reçu beaucoup moins d’attention dans les études comportementales. Ici, nous développer et démontrer un protocole profil comportemental à l’aide de caféine comme un neurostimulant modèle. Bien que les réponses de photomotor de boule étaient parfois influencées par caféine, zebrafish étaient nettement plus sensible pour les photomotor et les points de terminaison locomotrices, qui a répondu aux niveaux environnemental. Les études à venir sont nécessaires pour comprendre les différences de sensibilité comportementale comparative chez les poissons avec l’âge et le moment de la journée et pour déterminer si des effets comportements similaires seraient présentes dans la nature et indiquer des résultats négatifs au niveau individuel ou niveaux d’organisation biologique de population.
Introduction
Bien que les modèles de poissons sont plus utilisés pour les études biomédicales, poisson régulièrement travaillent pour des études d’écologie et de physiologie, pour étudier la contamination des eaux de surface et de comprendre des seuils toxicologiques des substances chimiques. Ces efforts sont importants, car la contamination chimique peut altérer les écosystèmes aquatiques et compromettre la qualité de l’approvisionnement en eau de source1,2. La plupart des produits chimiques dans le commerce, cependant, l’absence même de toxicologie fondamentale d’information3.
Tests de modèle animal traditionnellement utilisés dans les essais de toxicité réglementaire sont nécessitent beaucoup de ressources et ne peut pas fournir le débit élevé, un dépistage précoce de niveau permettant de toxicité au XXIe siècle4. Par la suite, il y a un élan croissant d’adopter et d’utiliser des modèles in vitro qui peuvent plus rapidement et efficacement l’écran composés d’activités biologiques3,5. Bien que les modèles de cellule en fonction présentent beaucoup d’occasions, ils n’ont souvent pas la complexité biologique et donc ne tiennent pas compte des nombreux processus important ensemble de l’organisme, y compris le métabolisme6.
Le poisson-zèbre est un modèle animal biomédicaux commun qui gagne en popularité comme un modèle alternatif en toxicologie aquatique et écotoxicologie7,8. Compte tenu de leur petite taille, le développement rapid et forte fécondité, poissons modèles peuvent être utilisés pour les produits chimiques pour la bioactivité et la toxicité à l' échelle de l’organisme entier9de l’écran rapidement et efficacement. Avec l’aide du logiciel de suivi automatisé, des comportements de larves de poisson zèbre fournissent utilitaire de diagnostic amélioré dans le dépistage des contaminants pour toxicité10,11. Études en sciences pharmaceutiques ont démontré que les points de terminaison locomotrices ont un caractère informatifs des mécanismes chimiques d’action, peuvent être utilisé pour des comportements de phénotype et peuvent identifier puis provisoirement de subcellulaires cibles nouvelles molécules12, 13. Considérant que le poisson-zèbre est un modèle de larves de poissons populaires en sciences biomédicales, la boule est un modèle de poisson commun, écologique important qui est utilisé pour les études d’écotoxicologie et au cours de prospective (p. ex., les nouvelles évaluations chimiques) et évaluations environnementales rétrospective (p. ex., les eaux de surface ambiantes ou surveillance des rejets d’effluents des eaux usées). Malheureusement, les réponses comportementales des larves de boule ont reçu nettement moins d’attention que le poisson-zèbre. Nos recherches en cours avec deux modèles courants de larves de poisson, le poisson-zèbre et fathead minnow, suggère que les larves de poissons nager modèles apparaissent uniques modes prévus ou les mécanismes d’action des divers produits chimiques. Ainsi, des points de terminaison comportementales fournissent la possibilité de rapidement et avec sensibilité examiner des produits chimiques pour la toxicité et d’identifier des cibles subcellulaires des contaminants chimiques et d’autres industriels, en particulier durant les premières évaluations de niveau.
Nous rapportons ici un protocole pour l’examen des profils de réponse comportementale de larves de poissons. Nous démontrons ces méthodes à l’aide de la caféine, un neurostimulant modèle et un polluant aquatique commun qui est introduit dans les systèmes aquatiques par l’intermédiaire de décharge des usines de traitements des eaux usées suite à la consommation humaine des denrées alimentaires, boissons, et produits pharmaceutiques formulés avec caféine14. Nous examinons les réponses comportementales à la caféine dans les deux larves minnow poisson-zèbre et boule, y compris à un changement soudain des conditions d’éclairage, qui sont souvent considéré comme une réponse de photomotor (PMR) pendant les études pharmaceutiques avec embryonnaire et larvaire poisson zèbre13,15. Nous d’identifier plus précisément les effets de la caféine à travers plusieurs points de terminaison locomotrices à élaborer des profils de réaction chimique pour chaque modèle de poisson. Niveaux de traitement de caféine utilisées dans cette étude représentent les centiles supérieurs des distributions d’exposition fondées sur les valeurs environnementales mesurées de caféine16. Nous incluons également les traitements comparés aux larves de poissons LC50 valeurs et la valeur de risque thérapeutique (THV), une concentration pharmaceutique dans l’eau qui devrait pour entraîner des concentrations plasmatiques chez les poissons compatibles avec une dose de plasma thérapeutique humain.
Protocole
Études dans le présent protocole généralement suivre normalisé de conception expérimentale et analyse statistique lignes directrices recommandées à la US Environmental Protection Agency (EPA no 2000.0) pour boule et l’Organisation pour la coopération économique et Développement (OCDE n° 236) pour le poisson-zèbre. Ces conceptions expérimentales (par exemple, augmentation de la réplication) peuvent être modifiées dans le protocole actuel pour de futures études. Pisciculture des conditions suivent précédemment publié17de la littérature. Tous les protocoles expérimentaux de culture de procédures et poissons suivi des protocoles institutionnels animalier et Comité d’urbanisme approuvés à l’Université Baylor.
1. exposer le poisson à un traitement chimique
- Préparer des solutions d’exposition de caféine en dissolvant la caféine dans l’eau dure reconstitué. Effectuer des dilutions appropriées en diluant des traitements de caféine plus élevés avec une eau dure pour produire des bas niveaux de traitement de caféine.
Remarque : Le tableau 1 résume chacun des niveaux de traitement utilisés dans cette expérience.
| Poisson zèbre | Vairon | ||||
| Traitement | Concentration nominale caféine (mg/L) | Concentration de caféine mesurée (mg/L) | Traitement | Concentration nominale caféine (mg/L) | Concentration de caféine mesurée (mg/L) |
| Contrôle | 0 | < LOD | Contrôle | 0 | < LOD |
| 75e Centile * | 0,001 | 0,001 | 75e Centile * | 0,001 | 0,001 |
| 95e Centile * | 0,039 | 0,013 | 95e Centile * | 0,039 | 0,009 |
| 99ème Centile * | 0,412 | 0,361 | 99ème Centile * | 0,412 | 0,310 |
| THV | 4.07 | 3.81 | THV | 4.07 | 4.12 |
| 10 % CL50 | 48,46 | 46,66 | 10 % CL50 | 14.1 | 14,7 |
| 40 % CL50 | 193.82 | 186.67 | 40 % CL50 | 56,38 | 53,91 |
Tableau 1 : traitements expérimentaux de caféine pour des expériences de vairon poisson-zèbre et fathead. Valeurs nominales et mesurées de caféine pour chaque traitement sont donnés. * Les traitements de caféine utilisés dans cette étude représentent les centiles supérieurs des distributions d’exposition fondées sur les valeurs environnementales mesurées de caféine16. THV : Valeur de risque thérapeutique. LOD : Limite de détection
- Versez la solution préparée champers exposition individuelle. Béchers en verre 100 mL utilisation remplie de 20 mL de solution d’exposition pour le poisson-zèbre chambres d’exposition et de 500 mL béchers avec 200 mL de solution d’exposition pour les chambres d’exposition fathead minnow.
- À l’aide d’une pipette de transfert, placez 10 poisson zèbre embryons âgés de 4 à 6 h après la fécondation (hpf) dans chacune des quatre chambres d’exposition répétées par traitement.
- Placer 10 larves de fathead minnow âgés de moins de 24 h de l’éclosion dans chacune des trois chambres d’exposition répétées par traitement. Pour tenir compte de la taille des larves de fathead minnow, couper l’extrémité de la pipette de transfert avant le transfert.
- Maintenir le poisson-zèbre expériences à une photopériode de 16:8 h lumière : obscurité et une température constante de 28 ± 1 ° C. Utilisez le même régime de photopériode pour études de fathead minnow, mais à une température de 25 ± 1 ° C.
-
Après 96 h d’exposition aux produits chimique, charge chaque poisson dans des puits séparés de 48 (pour le poisson-zèbre) et 24 (pour boule) plaques bien.
- Pour s’assurer que chacun contient bien un volume égal de solution, transfert des larves de poisson zèbre à 48 plats à l’aide d’un autopipette µL 5 000 pour un volume de 1 000 µL / puits. Utilisez l’autopipette de retirer et de transférer les larves de poisson zèbre et l’exposition solution simultanément.
- En raison de leur plus grande taille, transférer des larves-de-boule à l’aide d’une pipette de transfert avec le bout coupé. Avant de transférer les larves de fathead minnow de puits individuels, remplir chaque bien à 2 000 µL à l’aide d’un autopipette. Lors du transfert de larves de fathead individuels à Herbert George wells, placer l’embout de la pipette de transfert dans la solution bien et laisser le poisson à la nage de l’embout de la pipette dans le puits.
2. étalonnage des paramètres de suivi vidéo
-
Avant que les mesures comportementales, définir les paramètres d’observation et d’étalonnage dans le logiciel de la piste vidéo (voir Table des matières).
- Posez une plaque bien dans la chambre d’enregistrement au moins 1 larves de poissons dans un puits individuel. Utilisez la plaque et les poissons associés comme des représentations pour définir les paramètres d’étalonnage.
- Dans le logiciel de la piste vidéo, cliquez sur « fichier | Générer le protocole », qui ouvrira une boîte de dialogue « Assistant de création de protocole ». Dans le champ « nombre de lieu », entrez le nombre de personnes des puits de la plaque bien et puis cliquez sur « OK ».
- En haut de l’écran, cliquez sur « View | Plein écran », qui invitera le système pour afficher une vue de caméra aérienne de la plaque bien.
- Cliquez sur l’icône de « Dessiner les zones », qui apparaît sous trois formes multicolores. À droite de la plaque bien la zone d’affichage, sélectionnez l’icône de cercle dans le champ intitulé « Zones ».
- Utilisez le curseur pour délimiter la vidéo circulaire suivi de zone en haut à gauche des puits de la plaque bien. Sélectionnez « Marque » du haut à droite et ensuite définir la zone d’affichage de la partie supérieure droite bien. Ensuite, sélectionnez « Bas marque » pour décrire la partie inférieure droite bien.
Remarque : Après avoir dessiné le contour circulaire, sa position devra probablement être ajustés. Pour ajuster la position du contour, cliquez sur « Sélectionner » et puis utilisez le curseur pour déplacer la zone décrite. Aussi, les contours peuvent être répliqués en cliquant sur «copier», puis «coller». - Une fois le coin supérieur gauche, droite, haut et bas droite bien suivi les zones ont été définies, cliquez sur « Build » pour inviter le logiciel pour délimiter automatiquement les aires d’observation des puits restants.
- Dans la zone étiquetée « Étalonnage », cliquez sur « Dessiner échelle ». Utilisez le curseur pour tracer une ligne horizontale sur la plaque. Une fois que la ligne est tracée, une boîte de dialogue intitulée « Mesure de Calibration » apparaîtra. Entrez la longueur de la plaque bien, puis cliquez sur « OK ».
- Quittez le gestionnaire de dessin en cliquant sur l’icône de « Zones de dessiner ».
- Cliquez sur l’icône « Tiles ». L’aide du curseur, mettez en surbrillance toutes les cases qui s’affichent sur l’écran de visualisation, afin que chaque boîte est verte.
Remarque : L’icône de carreaux apparaît comme un groupe de six petits carrés individuels - « Cliquez sur affichage | Plein écran ». À droite de la plaque de la zone d’affichage, cliquez sur « Bkg » dans la zone intitulée « Seuil de détection ». Utilisez la barre de réglage du seuil pour définir le seuil de détection de pixels. Une fois, le seuil de détection de pixels approprié est sélectionné, cliquez sur « Appliquer au groupe ».
Remarque : Ce protocole définit le seuil de détection à 13 en mode noir pour les observations de poisson-zèbre et à 110 en mode transparent pour les observations de fathead minnow. - Dans la zone intitulée « Seuil de déplacement », entrez la vitesse de déplacement souhaitée paramètres de suivi. Une fois que les paramètres de vitesse sont définis, cliquez sur « Appliquer au groupe ».
Remarque : Ce protocole fixe des petits/grands mouvements à 20 mm/s et inactif/petits mouvements à 5 mm/s. Ces sélections de programmer le logiciel pour suivre les déplacements des larves de poissons à trois niveaux de vitesse différents : inactive (congélation) = < 5 mm/s, petit (croisière) = 5 à 20 mm/s et grand (éclatement) = > 20 mm/s. - Cliquez sur « paramètres | Protocole de paramètres » dans le menu déroulant. Dans la boîte de dialogue, sélectionnez l’onglet « Temps » entrez l’heure de l’observation et le temps d’intégration. Quand paramètres sont entrés, cliquez sur « Ok ».
- Pour définir la fois lumière/obscurité photopériode et l’intensité lumineuse pour chaque photopériode ouvert, que les paramètres du pilote léger boîte de dialogue en sélectionnant « Conduite lumière » dans les « paramètres » du menu déroulant.
Remarque : Voir la vidéo de protocole pour définir plusieurs photopériodes lumière-obscurité. - Après ont défini les paramètres de suivi vidéo, enregistrez le protocole d’observation.
Remarque : Ce protocole observe comportement du poisson pendant une période de 50 min qui comprend une phase d’acclimatation 10 min suivie de 4 modifier lumière/obscurité phases consistant en deux périodes de lumière de 10 min et deux périodes sombres de 10 min. Le temps d’intégration est défini sur mesure de comportement pour chaque minute du procès comportementale 50 min.
3. observation des larves de poissons locomotrices et comportement Photomotor
- Placer la plaque bien poissonneuses expérimentale dans la chambre d’enregistrement comportemental.
- Dans la vidéo dépistant le logiciel, ouvrez le protocole de suivi élaboré à l’étape 3.
- Dans la visionneuse de suivi vidéo, vérifiez pour vous assurer que toutes les larves sont visibles sur l’écran de l’ordinateur, cette seule larve individuelle est présente dans chaque puits et que les puits individuels sont alignées dans les zones d’observation qui ont été définis aux étapes 2.1.5 et 2.1.6.
- Cliquez sur « expérience | Exécuter ».
Remarque : Le système invitera l’utilisateur à fournir un nom et un emplacement pour enregistrer les données d’observation. - Une fois le nom et emplacement de l’observation d’enregistrement des données ont été spécifiées, cliquez sur l’icône « Plusieurs Images Live » pour mettre en évidence toutes les zones prédéfinies Regarde un
Remarque : Cette icône est située en haut de l’écran de l’ordinateur et apparaît comme une boîte divisée en quatre carrés plus petits. En cliquant sur cette icône mettra en valeur tous les aires d’observation prédéfinis. - Fermez le panneau de la chambre d’enregistrement, puis cliquez sur « fond | Démarrer » sur l’écran d’ordinateur.
4. analyser les données comportementales
- Pour récupérer des données d’activité de larves de poisson, ouvrez la feuille de calcul, qui est compilé automatiquement par le logiciel de suivi et se trouve dans le dossier spécifié par l’utilisateur avant de commencer les essais comportements (étape 3.4).
- Se référer aux Figures 1bis et 1 b pour des mesures représentatives de l’activité locomotrice naïve du poisson-zèbre non exposé et larves de fathead minnow, respectivement. Voir Figures 1 et 1D pour les calculs PMR, examiner efficacement l’ampleur de la différence de circulation entre les transitions de pâle à foncé ou noir à la lumière.
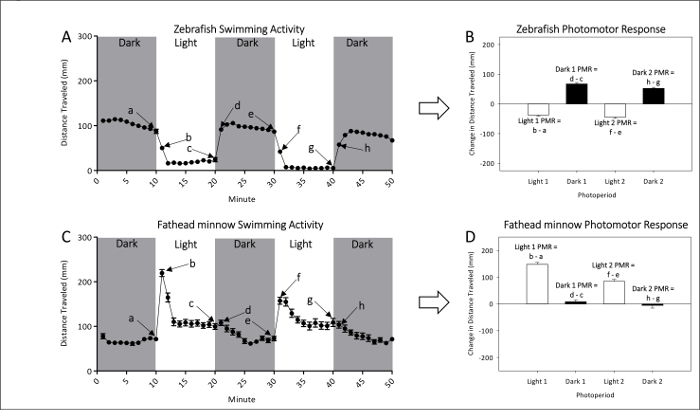
Figure 1 : Exemple d’activité de base du poisson-zèbre non exposé (A et B) et boule (C et D). La distance moyenne (± SEM) à la nage de poisson-zèbre (A) et boule (C) est donné par des points, chaque représentant une minute d’intervalle de l’activité. Deux sombres et deux périodes de lumière de photomotor réponses sont mesurés. Le dernier (a, c, e et g) et première (b, d, f et h) minute de chaque photopériode servent à calculer les réponses PMRs. Photomotor du poisson-zèbre (B) et boule (D) est mesurés comme le changement de moyenne (±ÉT) distance parcourue entre la dernière minute une photopériode initiale et la première minute de la période suivante. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
Résultats
Niveaux de traitement de caféine n’a pas sensiblement varié au cours des expériences de 96 h avec poisson-zèbre et fathead minnows. Par exemple, le tableau 1 présente des concentrations analytiquement vérifiées de chaque niveau de traitement. Ce protocole a vérifié des échantillons d’eau pour les niveaux de traitement de caféine par dilution isotopique par chromatographie liquide spectrométrie de masse (LC-MS/MS) généralement suivant des méthodes rapportées antérieurement,28. La formation de paraxanthine, le principal métabolite de la caféine, a été aussi quantifiée. Une description de ces méthodes d’analyse est fournie dans les informations analytiques supplémentaires. En raison des similitudes entre la vérification nominale et analytique des traitements, les niveaux de traitement nominal sont présentés durant le reste de ce manuscrit. Caféine a considérablement altérés comportements minnow poisson-zèbre et -de-boule. Cependant, zebrafish locomotrice réponses étaient toujours plus sensibles à la caféine que boule. Les points de terminaison comportementales plus sensibles pour le poisson-zèbre et fathead larves ont été touchées par la caféine à une concentration de 0,039 mg/L. le tableau 2 résume les concentrations de l’effet observé (CMEO) et les concentrations sans effet observé (CSEO) pour chaque point de terminaison comportementale dans les deux modèles de poissons.
| Poisson zèbre | Vairon | ||||
| Point de terminaison | CMEO (mg/L) | CSEO (mg/L) | Point de terminaison | CMEO (mg/L) | CSEO (mg/L) |
| Distance totale obscurité | 0,412 | 0,039 | Distance totale obscurité | − | 56,38 |
| Distance totale lumière | 48,46 | 4.07 | Distance totale lumière | − | 56,38 |
| Total compte foncé | 0,412 | 0,039 | Total compte foncé | − | 56,38 |
| Lumière de comptages totaux | 48,46 | 4.07 | Lumière de comptages totaux | − | 56,38 |
| Dark de la Distance d’éclatement | − | 193.82 | Dark de la Distance d’éclatement | − | 56,38 |
| Éclatant de lumière de Distance | 193.82 | 48,46 | Éclatant de lumière de Distance | − | 56,38 |
| Éclatement compte foncé | 193.82 | 48,46 | Éclatement compte foncé | − | 56,38 |
| Éclatement des comtes Light | 193.82 | 48,46 | Éclatement des comtes Light | − | 56,38 |
| Éclatement d’obscurité de durée | 193.82 | 48,46 | Éclatement d’obscurité de durée | − | 56,38 |
| Durée lumière d’éclatement | − | 193.82 | Durée lumière d’éclatement | − | 56,38 |
| Croisière Distance Dark | 0,412 | 0,039 | Croisière Distance Dark | − | 56,38 |
| Croisière Distance lumière | 48,46 | 4.07 | Croisière Distance lumière | − | 56,38 |
| Croisière compte foncé | 0,412 | 0,039 | Croisière compte foncé | − | 56,38 |
| Croisière comtes Light | 48,46 | 4.07 | Croisière comtes Light | − | 56,38 |
| Croisière durée Dark | 0,412 | 0,039 | Croisière durée Dark | − | 56,38 |
| Croisière durée lumière | 48,46 | 4.07 | Croisière durée lumière | − | 56,38 |
| Distance de congélation foncé | 0,412 | 0,039 | Distance de congélation foncé | 0,039 | 0,001 |
| Distance de congélation léger | 0,039 | 0,001 | Distance de congélation léger | − | 56,38 |
| Gel compte foncé | 0,412 | 0,039 | Gel compte foncé | − | 56,38 |
| Gel compte léger | 48,46 | 4.07 | Gel compte léger | − | 56,38 |
| Durée de congélation foncé | − | 193.82 | Durée de congélation foncé | 56,38 | 14.10 |
| Durée de congélation léger | 48,46 | 4.07 | Durée de congélation léger | − | 56,38 |
| Foncé 1 PMR | 48,46 | 4.07 | Foncé 1 PMR | 0,039 | 0,001 |
| Allumer 1 PMR | 48,46 | 4.07 | Allumer 1 PMR | − | 56,38 |
| PMR 2 noir | 48,46 | 4.07 | PMR 2 noir | − | 56,38 |
| Lumière 2 PMR | 48,46 | 4.07 | Lumière 2 PMR | − | 56,38 |
| Éclatement foncé 1 PMR | − | 193.82 | Éclatement foncé 1 PMR | − | 56,38 |
| Éclatant de lumière 1 PMR | − | 193.82 | Éclatant de lumière 1 PMR | − | 56,38 |
| Éclatement des PMR 2 noir | 193.82 | 48,46 | Éclatement des PMR 2 noir | − | 56,38 |
| Éclatant de lumière 2 PMR | − | 193.82 | Éclatant de lumière 2 PMR | − | 56,38 |
| Croisière noire 1 PMR | 48,46 | 4.07 | Croisière noire 1 PMR | − | 56,38 |
| Croisière léger 1 PMR | 48,46 | 4.07 | Croisière léger 1 PMR | − | 56,38 |
| Croisière noire 2 PMR | 48,46 | 4.07 | Croisière noire 2 PMR | − | 56,38 |
| Croisière Light 2 PMR | 193.82 | 48,46 | Croisière Light 2 PMR | 56,38 | 14.10 |
| Gel foncé 1 PMR | 48,46 | 4.07 | Gel foncé 1 PMR | − | 56,38 |
| Gel clair 1 PMR | 193.82 | 48,46 | Gel clair 1 PMR | − | 56,38 |
| Gel noir 2 PMR | 48,46 | 4.07 | Gel noir 2 PMR | − | 56,38 |
| Gel lumineux 2 PMR | 193.82 | 48,46 | Gel lumineux 2 PMR | − | 56,38 |
Tableau 2 : poisson-zèbre et fathead minnow CSEO comportementale et LOEC pour la caféine. Aucune Concentration d’effet observé (CSEO) et les valeurs observées effet Concentration (CMEO) (mg/L) pour chacun de la lumière/obscurité natation photomotor réponses pour le poisson-zèbre et les têtes-de-boule exposés à la caféine et points de terminaison de l’activité. Tirets indiquent qu’aucun effet observé à un point de terminaison particulier à tous les niveaux de traitement.
La figure 2 présente l’activité locomotrice totale et PMRs de poisson-zèbre et fathead minnow après exposition de 96 heures à la caféine. Larves Fathead que PMRS furent modifiées par la caféine à des niveaux inférieurs de traitement (0,038 mg/L) que le poisson-zèbre, mais un nombre nettement supérieur de photomotor points de terminaison ont été touchés chez le poisson zèbre. Le plus haut niveau de traitement de la caféine (193,82 mg/L) modifié PMR chez le poisson zèbre, dans lequel ces réponses ont été exactement inverse de contrôles. Toutefois, à ce niveau de traitement élevé, PMRs a diminué dans l’obscurité et a augmenté dans des conditions de lumière.

Figure 2 : Activité de natation et les réponses de photomotor du poisson-zèbre (A et B) et boule (C et D) après exposition de 96 heures à la caféine. La distance moyenne (± SEM) à la nage de poisson-zèbre (A) et boule (C) est donnée par des points, chaque représentant intervalles de 1 min d’activité. Photomotor réponses de poisson-zèbre (B) et boule (D) sont mesurés comme le changement de distance totale moyenne (± et) se déplace entre les last minutes d’une photopériode initiale et la première minute de la période suivante. Deux sombres et deux photomotor période lumineuse réponses ont été mesurées. Un total de 24 poisson-zèbre (4 répétitions chaque 6 larves) et 12 (3 répétitions chaque 4 larves) boule ont été utilisés pour l’observation comportementale. p < 0,10 ; p < 0,05 ; p < 0,01. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
En plus de mesurer PMRs larvaires, lumière et l’obscurité l’activité locomotrice a été analysée à travers trois seuils de vitesse pour la distance parcourue, nombre de mouvements et la durée des mouvements. Ces données sont utilisées pour établir les profils de réponse comportementale pour la caféine (Figure 3, Supplement , Figure 1). Dans les deux modèles de poissons, caféine inhibée tout nettement effet sur l’activité locomotrices points de terminaison. Les deux poissons modèles a démontré une activité accrue à l’éclatement seuils de vitesse après une exposition à la caféine, mais pas de façon significative. Tout comme les résultats des observations PMR, caféine effectue un plus grand nombre de points de terminaison locomotrice de poisson-zèbre. En fait, caféine significativement modifiées plusieurs réponses locomotrices dans la pénombre aux niveaux environnementalement réalistes dessous le THV. Toutefois, l’activité locomotrice fathead minnow n’est pas significativement affectée en conditions de luminosité par n’importe quel niveau de traitement.

Figure 3 : profils de réponse de ménés larvaires de poisson-zèbre et boule après exposition de 96 heures à la caféine. Veut dire poisson zèbre noir (A) et la lumière (B) activité comparée pour signifier la boule noire (C) et l’activité de la lumière (D) après exposition de 96 heures à la caféine de natation. Tracés de données représente l’activité sur deux photopériodes foncé de 10 min et deux photopériodes lumière de 10 min pour chaque modèle de poisson. Données sont normalisées au contrôle qui est représenté sur l’axe 0 dans chaque figure. Paramètres du comportement incluent distance traversé à la nage, nombre de mouvements (comtes) et la durée de chaque mouvement 3 niveaux de vitesse, éclatement (> 20 mm/s), croisière (5 à 20 mm/s) et à la congélation (< 5 mm/s). En plus des mouvements migratoires à chacun des seuils de vitesse, distance totale a nagé et nombre total de mouvements est représenté. ↑ représente une augmentation significative de l’activité par rapport à la commande et ↓ indique une diminution significative de l’activité par rapport à la commande. Un total de 24 poisson-zèbre (4 répétitions chaque 6 larves) et 12 (3 répétitions chaque 4 larves) boule lorsque utilisé dans des observations comportementales pour chaque groupe. p < 0,10 ; p < 0,05 ; p < 0,01. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
Supplémentaire Figure 1 : Photomotor réponses de poisson-zèbre (A et B) et boule (C et D) à travers trois seuils de vitesse. Poisson-zèbre (A, B et C) et fathead minnow larves (D, E et F) photomotor réponses à travers trois seuils de vitesse (congélation : 20 mm/s) après exposition de 96 h à la caféine. Photomotor réponses de poisson-zèbre et fathead minnow sont mesurés comme le changement de distance totale moyenne (±SE) se déplace entre les last minutes d’une photopériode initiale et la première minute de la période suivante. Deux sombres et deux photomotor période lumineuse réponses ont été mesurées. Un total de 24 poisson-zèbre (4 répétitions chaque 6 larves) et 12 (3 séries de 4 larves) boule ont été utilisés pour l’observation comportementale. * p < 0,01 s’il vous plaît cliquez ici pour télécharger ce fichier.
Discussion
Lors de la sélection des niveaux de traitement chimique pour les études de toxicologie comportementale, plusieurs facteurs doivent être considérés. Niveaux de traitement de caféine dans la présente étude ont été choisis sur des valeurs de centile supérieur pour les scénarios d’exposition environnementale prévue des effluents des eaux usées16. Lorsque cela est possible, nous sélectionnons systématiquement des niveaux de traitement pour les études de toxicologie aquatique à l’aide d’évaluations de l’exposition probabiliste des observations sur l’environnement19,20,21. Un THV, ce qui est calculable pour des médicaments, a également été inclus comme un niveau de traitement dans la présente étude. THV valeurs (EQ. 1)22,23 sont définis comme des concentrations dans l’eau prédites conduisant à des doses thérapeutiques humaines (Cmax) de produits pharmaceutiques en poissons23, sont inspirés du premier plasma modélisation des efforts24et sont calculée sur produits chimiques : l’eau du sang coefficients (EQ. 2)25.
THV = Cmax / log PBW (EQ. 1)
log PBW = log [(100,73. log Koe · 0,16) + 0,84] (EQ. 2)
Ici, nous sélectionnons également des concentrations sublétales par rapport au poisson-zèbre et fathead minnow CL50. Nous considérons cette approche une procédure analyse comparative utile pour des réactions comportementales, en particulier lors de la comparaison des seuils de comportements spécifiques à un modèle de poisson à travers de multiples produits chimiques. Elle facilite davantage calculs de courte durée aux ratios chroniques, qui peuvent être diagnostique utiles en toxicologie aquatique pour les évaluations et les études mécanistes. Valeurs de la CL50 proviennent de bio-essais préliminaires toxicité suivant les directives normalisées, donnés à l’étape 2.1.
Dans ce protocole, nous employons des conceptions expérimentales communes et techniques statistiques recommandés par l’EPA des États-Unis et de l’OCDE des méthodes normalisées pour les études toxicologiques chez les modèles de poissons. Si nous rapportons les valeurs de p (e.g., < 0,01, < 0,05, < 0,10), des différences significatives (α = 0,10) en activité les niveaux sont identifiés entre les traitements à l’aide de l’analyse de variance (ANOVA) si la normalité et l’équivalence des hypothèses de la variance sont remplies. De Dunnett ou de Tukey HSD post-hoc tests sont effectués afin d’identifier les différences de niveau de traitement. Nous choisissons cette alpha (α = 0,10) valeur pour réduire les erreurs de type II, en particulier pour le début des tests de niveau et quelle taille d’effet biologiquement importants des est limitée pour paramètres comportements sous-étudié et modèle organismes26, au lieu de employant des procédures plus fréquentes dans les sciences biomédicales pour les comparaisons multiples (p. ex.., correction de Bonferroni pour données RNA-Seq)27. Les études à venir sont nécessaires pour comprendre la variabilité de ces réactions comportementales et potentiellement modifier les conceptions expérimentales (par exemple, augmentation de la réplication) en conséquence.
Un certain nombre de facteurs peut influencer le comportement des larves de poissons en plus de l’exposition aux produits chimique. Par exemple, heure, âge, taille bien, température, l’éclairage et volume de solution d’exposition dans chaque puits représentent des considérations importantes11,30. Pour ces raisons, précautions doivent être prises pour minimiser les effets des facteurs externes pouvant influencer le comportement locomoteur des larves de poissons au cours de l’expérimentation. Des observations comportementales doivent être effectuées dans les fenêtres de temps étroit (3 à 4 h) et dans l’ensemble des périodes de temps quand temps des effets de jour devraient avoir une influence minimale sur larves comportement locomoteur11. En outre, larves de poisson doivent être maintenus à une température constante (28 ± 1 ° C pour le poisson-zèbre) et 24 ± 1 ° C pour FHM et sur un cycle de lumière/obscurité défini en couveuse sous température contrôlée tout au long de la période d’exposition. En outre, la température du laboratoire où sont enregistrés les comportements doit être maintenue à des conditions se rapprochant des conditions expérimentales afin d’éviter les influences de la température sur les comportements. En outre, puits utilisé lors des observations comportementales devraient être maintenus à un volume cohérent pour chaque poisson individuel.
Larvaire ou embryonnaire zebrafish que PMRS ont été précédemment utilisés en sciences biomédicales à identifier des cibles thérapeutiques potentielles pour roman composés de12,13. Ce protocole développe des recherches comportementales antérieures avec poisson zèbre grâce à 38 points de terminaison afin d’étudier la bioactivité chimique des contaminants environnementaux. Bien que la caféine est un contaminant commun aquatique avec un mécanisme compris d’action (MoA), beaucoup de composés dans le commerce n’ont pas données mécaniques importantes. Par conséquent, ce protocole peut être utilisé pour mieux comprendre des protocoles d’accord pour les composés manque de données sur la toxicité, y compris des produits chimiques commerciaux39. En outre, le protocole fournit des méthodes pour deux des modèles plus couramment utilisé des poissons. Tel que noté précédemment, tandis que le poisson-zèbre est un modèle biomédical poisson commun qui devient de plus en plus populaire en écotoxicologie, la fathead minnow est couramment utilisé comme un modèle écologique pour les applications de l’évaluation environnementale mais n’a reçu comparativement moins d’attention dans les études comportementales avec des systèmes automatisés par rapport au poisson-zèbre. Bien qu’il ne reste aucune méthodes réglementaires standardisées pour les études de toxicologie comportementale de poissons, ce protocole prévoit une approche visant à soutenir les efforts futurs.
Caféine a suscité des réactions comportementales dans chacun des modèles de poissons à des niveaux qui ont été détectées dans le milieu aquatique16. Rodriguez-Gil et al 2018 développé des distributions de l’exposition mondiale de l’environnement dans les systèmes aquatiques, fondés sur des valeurs mesurées de caféine16. Plus précisément, 95 % des concentrations dans les effluents prédit des eaux usées serait inférieure de la CMEO pour les paramètres comportements plus sensibles du poisson-zèbre et fathead minnow dans cette étude (tableau 2). Bien que plusieurs effets sur le comportement de la caféine ont été observés chez le poisson zèbre (particulièrement dans l’obscurité) aux niveaux environnemental, on ne sait pas si ces modifications comportementales pourraient se produire dans les populations naturelles de poissons ou donner lieu à effets indésirables importants sur le plan écologique. Bien qu’utile à des fins de dépistage sensibles, diagnostic, seuils comportementaux de larves de poissons ne sont pas forcément représentatifs des autres stades du cycle de vie ou de poissons dans les populations naturelles. D’autres recherches s’impose pour déterminer si semblables seuils de réponse comportementale seraient présentes dans la nature et indiquer des résultats négatifs à l’individu ou la population des niveaux d’organisation biologique.
Déclarations de divulgation
Les auteurs n’ont rien à divulguer.
Remerciements
Prise en charge de cette étude a été fournie par l’US National Science Foundation (No de projet : CHE-1339637) avec le soutien de la U.S. Environmental Protection Agency. Nous remercions le Dr Jone Corrales, Dr Lauren Kristofco, Gavin Saari, Samuel Haddad, Bekah Burket et Bridgett Hill pour support lab générales.
matériels
| Name | Company | Catalog Number | Comments |
| ViewPoint Zebrabox | ViewPoint | ZebraLab and ZebraLab platform for automated behavioral observations | |
| Caffeine | Sigma-Aldrich | C0750-100G | Study chemical |
| Incubator | VWR | 9110589 | Maintains light/dark cycle and temperature for fathead minnow experiments |
| Incubator | Thermo Fisher Scientific | 35824-636 | Maintains light/dark cycle and temperature for zebrafish experiments |
| 100 mL glass beakers | VWR | 89000-200 | Zebrafish exposure chambers |
| 500 mL glass beakers | Pyrex | EW-34502-03 | Fathead minnow exposure chambers |
| 5,000 µL auto-pipette | Eppendorf | Research 5000 | Used to fill individual wells in well plates |
| Transfer Pippettes | VWR | 414-004-004 | Used to transfer study organisms |
| 48-well plates | Fisher Scientific | 08-772-52 | Larval zebrafish behavioral recording chambers |
| 24-well plates | VWR | 10062-896 | Larval fathead minnow behavioral recording chambers |
| Calcium sulfate dihydrate | Sigma-Aldrich | C3771 | For reconstituted hard water |
| Magnesium Sulfate | Sigma-Aldrich | M7506 | For reconstituted hard water |
| Sodium Bicarbonate | Sigma-Aldrich | S5761 | For reconstituted hard water |
| Potassium Chloride | Sigma-Aldrich | P9333 | For reconstituted hard water |
| z-mod recirculating system | Marine Biotech Systems | Recirculating system to maintian zebrafish cultures | |
| Statistical analysis software | Sigma Plot | Version 13.0 | Used to analyze beahvioral data and produce figures |
| Statistical analysis software | Graphpad Prism | Prism 5 | Used to produce figures |
| Autosampler/quaternary pumping system | Agilent Technologies | Infinity 1260 model | Analytical verification of caffeine treatment levels |
| Jet stream thermal gradient electrospray ionization source | Agilent Technologies | Analytical verification of caffeine treatment levels | |
| Triple quadrupole mass analyzer | Agilent Technologies | Model 6420 | Analytical verification of caffeine treatment levels |
| 10 cm × 2.1 mm Poroshell 120 SB-AQ column (120Å, 2.7) | Agilent Technologies | 685775-914T | Caffiene chromatography |
| MassHunter Optimizer Software | Agilent Technologies | Determine the ionization mode, monitored transitions, and instrumental parameters for caffeine/caffeine-d9 and paraxanthine/paraxanthine-d6 |
Références
- Malaj, E., et al. Organic chemicals jeopardize the health of freshwater ecosystems on the continental scale. Proceedings of the National Academy of Sciences. 111 (26), 9549-9554 (2014).
- Schäfer, R. B., Kühn, B., Malaj, E., König, A., Gergs, R. Contribution of organic toxicants to multiple stress in river ecosystems. Freshwater Biology. 61 (12), 2116-2128 (2016).
- Andersen, M. E., Krewski, D. Toxicity testing in the 21st century: bringing the vision to life. Toxicological Sciences. 107 (2), 324-330 (2008).
- Rovida, C., Hartung, T. Re-evaluation of animal numbers and costs for in vivo tests to accomplish REACH legislation requirements for chemicals-a report by the transatlantic think tank for toxicology (t (4)). Altex. 26 (3), 187-208 (2009).
- Council, N. R. . Toxicity testing in the 21st century: a vision and a strategy. , (2007).
- Mehta, G., Hsiao, A. Y., Ingram, M., Luker, G. D., Takayama, S. Opportunities and challenges for use of tumor spheroids as models to test drug delivery and efficacy. Journal of Controlled Release. 164 (2), 192-204 (2012).
- Scholz, S., Fischer, S., Gündel, U., Küster, E., Luckenbach, T., Voelker, D. The zebrafish embryo model in environmental risk assessment-applications beyond acute toxicity testing. Environmental Science and Pollution Research. 15 (5), 394-404 (2008).
- Fraysse, B., Mons, R., Garric, J. Development of a zebrafish 4-day embryo-larval bioassay to assess toxicity of chemicals. Ecotoxicology and Environmental Safety. 63 (2), 253-267 (2006).
- Noyes, P. D., Haggard, D. E., Gonnerman, G. D., Tanguay, R. L. Advanced morphological-behavioral test platform reveals neurodevelopmental defects in embryonic zebrafish exposed to comprehensive suite of halogenated and organophosphate flame retardants. Toxicological Sciences. 145 (1), 177-195 (2015).
- Colón-Cruz, L., et al. Alterations of larval photo-dependent swimming responses (PDR): New endpoints for rapid and diagnostic screening of aquatic contamination. Ecotoxicology and Environmental Safety. 147, 670-680 (2018).
- Kristofco, L. A., et al. Age matters: developmental stage of Danio rerio larvae influences photomotor response thresholds to diazinion or diphenhydramine. Aquatic Toxicology. 170, 344-354 (2016).
- Rihel, J., et al. Zebrafish behavioral profiling links drugs to biological targets and rest/wake regulation. Science. 327 (5963), 348-351 (2010).
- Kokel, D., et al. Rapid behavior-based identification of neuroactive small molecules in the zebrafish. Nature Chemical Biology. 6 (3), 231-237 (2010).
- Bruton, T., Alboloushi, A., DeL a Garza, B., Kim, B. -. O., Halden, R. U. . Contaminants of Emerging Concern in the Environment: Ecological and Human Health Considerations. , 257-273 (2010).
- Woudenberg, A. B., et al. Zebrafish embryotoxicity test for developmental (neuro) toxicity: Demo case of an integrated screening approach system using anti-epileptic drugs. Reproductive Toxicology. 49, 101-116 (2014).
- Rodríguez-Gil, J., Cáceres, N., Dafouz, R., Valcárcel, Y. Caffeine and paraxanthine in aquatic systems: Global exposure distributions and probabilistic risk assessment. Science of the Total Environment. 612, 1058-1071 (2018).
- Corrales, J., et al. Toward the Design of Less Hazardous Chemicals: Exploring Comparative Oxidative Stress in Two Common Animal Models. Chemical Research in Toxicology. 30 (4), 893-904 (2017).
- Kimmel, C. B., Ballard, W. W., Kimmel, S. R., Ullmann, B., Schilling, T. F. Stages of embryonic development of the zebrafish. Developmental Dynamics. 203 (3), 253-310 (1995).
- Kristofco, L. A., Brooks, B. W. Global scanning of antihistamines in the environment: Analysis of occurrence and hazards in aquatic systems. Science of the Total Environment. 592, 477-487 (2017).
- Saari, G. N., Scott, W. C., Brooks, B. W. Global assessment of calcium channel blockers in the environment: Review and analysis of occurrence, ecotoxicology and hazards in aquatic systems. Chemosphere. , (2017).
- Corrales, J., et al. Toward the Design of Less Hazardous Chemicals: Exploring Comparative Oxidative Stress in Two Common Animal Models. Chemical Research in Toxicology. 30 (4), 893-904 (2017).
- Berninger, J. P., et al. Effects of the antihistamine diphenhydramine on selected aquatic organisms. Environmental Toxicology and Chemistry. 30 (9), 2065-2072 (2011).
- Brooks, B. W. Fish on Prozac (and Zoloft): ten years later. Aquatic Toxicology. 151, 61-67 (2014).
- Huggett, D., Cook, J., Ericson, J., Williams, R. A theoretical model for utilizing mammalian pharmacology and safety data to prioritize potential impacts of human pharmaceuticals to fish. Human and Ecological Risk Assessment. 9 (7), 1789-1799 (2003).
- Fitzsimmons, P. N., Fernandez, J. D., Hoffman, A. D., Butterworth, B. C., Nichols, J. W. Branchial elimination of superhydrophobic organic compounds by rainbow trout (Oncorhynchus mykiss). Aquatic Toxicology. 55 (1-2), 23-34 (2001).
- Scheiner, S. M., Gurevitch, J. . Design and Analysis of Ecological Experiments. , (2001).
- Nakagawa, S. A farewell to Bonferroni: the problems of low statistical power and publication bias. Behavioral Ecology. 15 (6), 1044-1045 (2004).
- Bean, T. G., et al. Pharmaceuticals in water, fish and osprey nestlings in Delaware River and Bay. Environmental Pollution. 232, 533-545 (2018).
- Richendrfer, H., Pelkowski, S., Colwill, R., Creton, R. On the edge: pharmacological evidence for anxiety-related behavior in zebrafish larvae. Behavioural Brain Research. 228 (1), 99-106 (2012).
- Padilla, S., Hunter, D., Padnos, B., Frady, S., MacPhail, R. Assessing locomotor activity in larval zebrafish: Influence of extrinsic and intrinsic variables. Neurotoxicology and Teratology. 33 (6), 624-630 (2011).
- Sukardi, H., Chng, H. T., Chan, E. C. Y., Gong, Z., Lam, S. H. Zebrafish for drug toxicity screening: bridging the in vitro cell-based models and in vivo mammalian models. Expert Opinion on Drug Metabolism & Toxicology. 7 (5), 579-589 (2011).
- Ankley, G. T., Villeneuve, D. L. The fathead minnow in aquatic toxicology: past, present and future. Aquatic Toxicology. 78 (1), 91-102 (2006).
- Hutson, L. D., Liang, J. O. Making an impact: zebrafish in education. Zebrafish. 6, 119 (2009).
- Hutson, L. D., Liang, J. O., Pickart, M. A., Pierret, C., Tomasciewicz, H. G. Making a difference: education at the 10th international conference on zebrafish development and genetics. Zebrafish. 9 (4), 151-154 (2012).
- Kane, A., Salierno, J., Brewer, S. Fish models in behavioral toxicology: automated techniques, updates and perspectives. Methods in Aquatic Toxicology. 2, 559-590 (2005).
- Rodriguez, A., et al. ToxTrac: a fast and robust software for tracking organisms. Methods in Ecology and Evolution. 9 (3), 460-464 (2018).
- Hamm, J., Wilson, B., Hinton, D. Increasing uptake and bioactivation with development positively modulate diazinon toxicity in early life stage medaka (Oryzias latipes). Toxicological Sciences. 61 (2), 304-313 (2001).
- Kristofco, L. A., Haddad, S. P., Chambliss, C. K., Brooks, B. W. Differential uptake of and sensitivity to diphenhydramine in embryonic and larval zebrafish. Environmental Toxicology and Chemistry. 37, 1175-1181 (2018).
- Steele, W. B., Kristofco, L. A., Corrales, J., Saari, G. N., Haddad, S. P., Gallagher, E. P., Kavanagh, T. J., Kostal, J., Zimmerman, J. B., Voutchkova-Kostal, A., Anastas, P. T., Brooks, B. W. Comparative behavioral toxicology of two common larval fish models: exploring relationships between modes of action and locomotor responses. Science of the Total Environment. 460-461, 1587-1600 (2018).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon