需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
测量细胞核与骨架间机械一体化的直接力探针
摘要
在本协议中, 我们描述了一种微方法, 直接将受控力应用于活细胞中的细胞核。这项化验允许审讯活体, 黏附细胞的核机械性质。
摘要
原子核的力学性质决定了它对细胞中产生的机械力的反应。由于细胞核是细胞骨架的连续分子, 因此需要方法来探讨其在黏附细胞中的力学行为。在这里, 我们讨论直接力探针 (DFP) 作为一个工具, 以力量直接向细胞核在一个活生生的黏附细胞。我们用吸力将一个狭窄的微附着在核表面。微从原子核中被翻译出来, 使原子核变形和转化。当恢复力等于吸力时, 原子核分离, 弹性松弛。因为吸入压力是已知的, 核表面上的力是已知的。该方法表明, 纳米尺度力足以使粘附细胞中的细胞核变形和转化, 并确定骨架元素, 使得原子核能够抵抗力。DFP 可用于解剖细胞和核成分对活细胞核力学性能的贡献。
引言
如癌症等病症涉及对核形态和结构1,2的改变, 通常伴随着 "软化" 的核心3,4。对机械变形的核阻力一般是将力应用于孤立原子核5。
细胞核在细胞是分子连接到细胞骨架由 Nucleoskeleton 和细胞骨架 (林肯) 复杂6,7,8,9的链接器。因此, 细胞核是机械地与细胞骨架结合, 并通过细胞基质粘连, 细胞外基质。机械地探测黏附细胞内的细胞核可以提供对这种机械整合的洞察力。在活细胞中操纵细胞核的方法包括微吸入10、11和原子力显微镜12、13、14。我们最近描述了一个直接的力量探针 (DFP), 直接地应用机械力量在原子核在活黏附力细胞15。
在这里, 我们概述了使用显微注射系统的程序, 通常是在显微镜的设施, 以应用已知的, 纳米级的机械力直接到核在黏附细胞。femtotip (0.5 µm 直径微尖端) 安装并连接到微注射系统由一个管。尖端, 定位在45°角度相对于养殖皿的表面, 被降低, 直到相邻的核表面。管子然后被断开并且被打开对大气, 在核表面创造一个负吸力压力并且封印微尖端反对核表面。通过微尖端的翻译, 原子核变形, 最终 (取决于施加的力的大小), 脱离微。当由原子核和细胞施加的恢复力 (抵抗) 力等于微所施加的吸力时, 这种分离就会发生。分析可以通过测量原子核的位移、长度应变 (方程 1) 或区域应变 (图 1A) 来进行。
研究方案
1. 准备用于成像的细胞
注: 直接力探头 (DFP) 可用于任何粘附单元类型。在这里, NIH 3T3 小鼠成纤维细胞被用作该协议的模型细胞线。
- 培养 NIH 3T3 成纤维细胞在 Dulbecco 的改良鹰的培养基 (DMEM) 补充10% 捐赠牛血清和1% 青霉素-链霉素在35毫米玻璃底部菜, 直到理想的融合。保持细胞在37°c 和 5% CO2。
- 一定要涂上所有35毫米玻璃底菜与5µg/毫升纤维连接蛋白 (或类似的 ECM 蛋白质), 然后播种 NIH 3T3 细胞进行成像。
注: 这些细胞必须在盘子上充分传播和附着, 以进行实验。对于 DFP 方法的工作融合, 没有任何限制。
- 一定要涂上所有35毫米玻璃底菜与5µg/毫升纤维连接蛋白 (或类似的 ECM 蛋白质), 然后播种 NIH 3T3 细胞进行成像。
- 在实验之前, 先用 PBS 冲洗细胞两次, 然后用完全生长培养基进行一次冲洗。
- 添加3毫升完全生长培养基的玻璃底部菜。
2. 显微和图像采集
注: 根据制造商的建议, 用机器人安装在侧臂上的倒置荧光显微镜 (或等效)。该显微镜还应配备一个环境室, 以保持37摄氏度的温度, 并2水平在5%。还需要机器人和 microinjector 显微镜。试验中建议采用油浸泡 40 x/1.3 na 或 60 x/1.49 na (或等效目标)。该显微镜应安装在隔振台上。
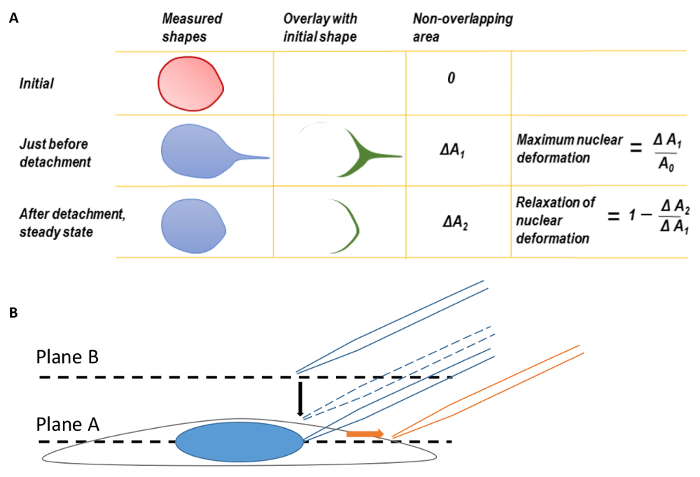
图 1.核形变与显微镜聚焦
a. 最大的核形变和放松核形变。在计算最大核形变之前, 核形状的后缘首先与变形核的平移相吻合。在微尖端脱离时, 细胞核的形状被叠加在最初的核形状上, 然后拉起。两个形状之间的面积的差异被测量为Δ1。最大核形变被定义为Δ1 除以原核区。同样, 第二个参数, Δ2, 可以定义的叠加最终稳态核形状后, 微支队的原始核形状。b. 将单元格集中在平面 A 上, 然后将焦点平面移至 B 平面, 以找到微尖。在成像过程中, 微被翻译成右侧 (橙色箭头方向)。这个数字已经从处处长 neelam. 15.请点击这里查看这个数字的更大版本.
- 根据制造商的协议打开 microinjector。
- 使用浸入式油吸管, 在物镜的顶端涂一滴浸入油。
- 把盘子紧紧夹在盘子里, 把盘子放在台上。
注: 在整个实验中, 细胞必须保持在37摄氏度和 5% CO2 。 - 调整目标的高度以使单元格成为焦点 (平面 A,图 1B)。
- 移动显微镜阶段找到感兴趣的细胞。
- 旋转机器人上的操纵杆, 将吸管保持架移动到顶部位置。将0.5 µm 直径尖端微加载到吸管支架上。
- 为避免细胞黏附于微, 在室温下用0.3 毫克/毫升锁相环-g PEG 溶液对微尖端进行预处理。通过接触微到原子核而没有任何吸入压力来测试附着力, 然后将微从原子核中平移。缺乏附着力可以从完全缺乏核形变和翻译中看出。
注: 请按照生产建议打开包装。
- 为避免细胞黏附于微, 在室温下用0.3 毫克/毫升锁相环-g PEG 溶液对微尖端进行预处理。通过接触微到原子核而没有任何吸入压力来测试附着力, 然后将微从原子核中平移。缺乏附着力可以从完全缺乏核形变和翻译中看出。
- 调整精细控制 (图 1B, 见步骤 2.4), 将平面 A 和单元格顶部的目标焦平面提升为平面 B。
- 将机器人设置为粗控。通过观察微的剪影, 慢慢地把微下到飞机 B, 直到微完全进入焦点。
- 一旦微提示集中, 将机器人设置为 "精细控制"。
- 将目标降低到单元格的赤道平面 (平面 a、图 1B) 并将微降低到平面 a (图 1B、虚线微) 的大约15µm。
- 将 microinjector 的补偿压力 (Pc) 设置为所需的压力;等待几秒钟的压力, 以稳定。
注: 最佳压力设定点取决于细胞类型和实验的具体目标。在大多数情况下, 300 的 hPa 将是一个很好的起点。 - 确保微不堵塞, 使用机器人面板上的清洁设置, 并检查以确保气泡出现从微尖端。
- 通过逐渐降低微直到尖端轻轻接触核表面, 将尖端插入到细胞中。
注意: 当降低微时, 微尖的轮廓将变得清晰, 因为它进入焦点。在微接触核之前, 提高目标焦点, 并将微尖端与核 (相同的 x y 坐标, 更高的 z 平面) 对齐。将焦点返回到原子核的赤道平面 (平面 A,图 1B), 并逐渐降低微尖端。 - 通过从微注射系统中拔下压力供应管, 在微尖端和核膜之间建立一个密封, 从而打开微管的末端到大气层。这一步产生的负压等于在核表面上的Pc 。
- 利用显微镜图像采集软件获取图像。在图像收集软件中设置 avi 捕获 (视频) 或 nd 捕获 (图像)。
注: 对于任何图像获取软件, 设置实时视频成像或时间推移图像采集短时间间隔。 - 切换到相应的荧光成像通道 (如GFP、RFP等) 并开始成像。
- 将微尖从细胞体 (右图 1B) 平移, 直到原子核与微分离。
注: 沿正向 x 方向 (在视野中的右侧) 拉出笔尖。拉速可通过计算机编程控制, 或者操纵杆可以手动移动。我们还没有发现拉速和核形变15之间的任何关联, 这暗示着对力的主要弹性反应。
3. 数据分析
- 使用任何基本的图像处理软件进行图像分析。核形变的程度可以通过长度应变 (Ɛ) 或区域应变来量化 (图 1A)。用方程1来量化长度应变, 其中 l 和 l0分别表示最大变形和初始位置的原子核长度。
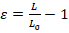 (等式 1)
(等式 1)
结果
图 2A显示了 NIH 3T3 小鼠成纤维细胞核的强迫。当微尖端被翻译成右侧时, 原子核会变形, 最终与微尖端分离。随着抽吸力的增加, 原子核的长度应变增加 (图 2B)。原子核的前缘 (微拉边) 形成核突起, 尾部边缘从原位置偏移。突起的长度远远大于尾部边缘位移 (图 2C), 表明细胞核与周围细胞质紧密结合。时间?...
讨论
测量细胞核与细胞骨架的机械结合是目前大多数方法的挑战, 如微吸入16, 因为它们需要两个孤立的原子核 (在细胞核与骨架分离的地方) 或悬浮细胞中的细胞核 (如牵引力, 无细胞外力)。通过将双轴应变应用于附着在膜17、18的细胞中, 将力应用于细胞核;然而, 这种技术是有限的事实, 在原子核的力量是未知的。原子力显微镜 (AFM) 探针被?...
披露声明
作者没有什么可透露的。
致谢
这项工作得到了 NIH R01 EB014869 的支持。
材料
| Name | Company | Catalog Number | Comments |
| FluoroDish | WPI | FD35 | |
| SYTO 59 | ThermoFisher Scientific | S11341 | |
| Femtotips | Eppendorf | 930000043 | |
| InjectMan NI2 | Eppendorf | NA | discontinued, current equivalent model: InjectMan 4 |
| FemtoJet | Eppendorf | NA | Current model FemtoJet 4i |
| Plan Fluor oil immersion 40x | Nikon | NA | |
| Apo TIRF oil immersion 60x | Nikon | NA | |
| Donor Bovine Serum (DBS) | ThermoFisher Scientific | 16030074 | NIH 3T3 serum |
| Dulbecco's Modification of Eagle's (DMEM) | Mediatech cellgro | MT10013CVRF | NIH 3T3 medium |
| Penicillin-Streptomycin | Mediatech | MT30004CIRF | NIH 3T3 medium supplement |
| Immersion Oil Type LDF Non-Fluorescing | Nikon | 77007 | Immersion oil for objective lens |
参考文献
- Chow, K. H., Factor, R. E., Ullman, K. S. The nuclear envelope environment and its cancer connections. Nature Reviews Cancer. 12 (3), 196-209 (2012).
- Zink, D., Fischer, A. H., Nickerson, J. A. Nuclear structure in cancer cells. Nature Reviews Cancer. 4 (9), 677-687 (2004).
- Bank, E. M., Gruenbaum, Y. The nuclear lamina and heterochromatin: a complex relationship. Biochemical Society Transactions. 39 (6), 1705-1709 (2011).
- Lammerding, J., et al. Lamins A and C but not lamin B1 regulate nuclear mechanics. Journal of Biological Chemistry. 281 (35), 25768-25780 (2006).
- Dahl, K. N., Engler, A. J., Pajerowski, J. D., Discher, D. E. Power-law rheology of isolated nuclei with deformation mapping of nuclear substructures. Biophysical Journal. 89 (4), 2855-2864 (2005).
- Crisp, M., et al. Coupling of the nucleus and cytoplasm: role of the LINC complex. Journal of Cell Biology. 172 (1), 41-53 (2006).
- Sosa, B. A., Rothballer, A., Kutay, U., Schwartz, T. U. LINC complexes form by binding of three KASH peptides to domain interfaces of trimeric SUN proteins. Cell. 149 (5), 1035-1047 (2012).
- Tapley, E. C., Starr, D. A. Connecting the nucleus to the cytoskeleton by SUN-KASH bridges across the nuclear envelope. Current Opinion in Cell Biology. 25 (1), 57-62 (2013).
- Arsenovic, P. T., et al. Nesprin-2G, a Component of the Nuclear LINC Complex, Is Subject to Myosin-Dependent Tension. Biophysical Journal. 110 (1), 34-43 (2016).
- Rowat, A. C., Lammerding, J., Ipsen, J. H. Mechanical properties of the cell nucleus and the effect of emerin deficiency. Biophysical Journal. 91 (12), 4649-4664 (2006).
- Rowat, A. C., Foster, L. J., Nielsen, M. M., Weiss, M., Ipsen, J. H. Characterization of the elastic properties of the nuclear envelope. Journal of the Royal Society Interface. 2 (2), 63-69 (2005).
- Pagliara, S., et al. Auxetic nuclei in embryonic stem cells exiting pluripotency. Nature Materials. 13 (6), 638-644 (2014).
- Liu, H., et al. In situ mechanical characterization of the cell nucleus by atomic force microscopy. ACS Nanotechnology. 8 (4), 3821-3828 (2014).
- Krause, M., Te Riet, J., Wolf, K. Probing the compressibility of tumor cell nuclei by combined atomic force-confocal microscopy. Physical Biology. 10 (6), 065002 (2013).
- Neelam, S., et al. Direct force probe reveals the mechanics of nuclear homeostasis in the mammalian cell. Proceedings of the National Academy of Sciences of the United States of America. 112 (18), 5720-5725 (2015).
- Pajerowski, J. D., Dahl, K. N., Zhong, F. L., Sammak, P. J., Discher, D. E. Physical plasticity of the nucleus in stem cell differentiation. Proceedings of the National Academy of Sciences of the United States of America. 104 (40), 15619-15624 (2007).
- Lammerding, J., et al. Lamin A/C deficiency causes defective nuclear mechanics and mechanotransduction. Journal of Clinical Investigation. 113 (3), 370-378 (2004).
- Chancellor, T. J., Lee, J., Thodeti, C. K., Lele, T. Actomyosin tension exerted on the nucleus through nesprin-1 connections influences endothelial cell adhesion, migration, and cyclic strain-induced reorientation. Biophysical Journal. 99 (1), 115-123 (2010).
- Neelam, S., Dickinson, R. B., Lele, T. P. New approaches for understanding the nuclear force balance in living, adherent cells. Methods. 94, 27-32 (2016).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。