JoVE 비디오를 활용하시려면 도서관을 통한 기관 구독이 필요합니다. 전체 비디오를 보시려면 로그인하거나 무료 트라이얼을 시작하세요.
Method Article
핵과 골격 사이 기계적인 통합을 측정 하기 위한 직접적인 힘 프로브
요약
이 프로토콜에서 우리가 직접 살아있는 세포에서 핵을 제어 힘을 적용 하는 micropipette 방법을 설명 합니다. 이 분석 결과 생활, 부착 세포에서 핵 기계적 특성의 심문 수 있습니다.
초록
핵의 기계적 속성 응답 세포에서 생성 된 기계적인 힘을 결정 합니다. 핵 분자로 골격과 연속 이므로 메서드 부착 세포의 기계적 동작을 필요 합니다. 여기, 우리가 살아있는 부착 세포에서 핵에 직접 힘을 적용 하는 도구로 직접 힘 프로브 (DFP) 토론. 우리는 흡입과 핵 표면에 좁은 micropipette를 연결합니다. micropipette는 변형 하 여 번역 핵 핵 거리 변환 됩니다. 복원 힘은 흡입 힘, 핵 분리 되 고 탄력적 이완. 흡입 압력을 정확 하 게 알려져 있다, 때문에 핵 표면에 강제로 알려져 있다. 이 메서드는 나노 스케일 세력 변형 및 부착 세포에서 핵을 번역 하기에 충분 되며 저항 세력에 핵을 사용할 수 있는 cytoskeletal 요소를 식별 밝혔다. DFP는 살아있는 세포에서 핵 기계적 속성의 구성 요소 세포질과 핵의 기여를 해 부를 사용할 수 있습니다.
서문
암과 같은 병 리 핵 모양 및 구조1,2, 일반적으로 동반 된다 핵3,4의 '연'을 변경 포함 됩니다. 기계적 변형에 저항을 핵은 고립 된 핵5에 힘을 적용 하 여 일반적으로 특징 되었습니다.
셀에 핵 분자로 링커의 Nucleoskeleton와 골격 (링컨) 복잡 한6,7,,89골격에 연결 됩니다. 그 결과, 골격과, 세포 층 유착, 세포 외 매트릭스를 통해 핵 기계적으로 통합 되었습니다. 기계적으로 부착 세포 안에 핵을 프로 빙이 기계적 통합에 대 한 통찰력을 제공할 수 있습니다. 살아있는 세포에서 핵을 조작 하는 메서드는 micropipette 포부10,11및 원자 힘 현미경 검사 법12,,1314있습니다. 우리는 최근 생활 부착 셀15에 핵에 직접 기계적인 힘을 적용 하는 직접 힘 프로브 (DFP)를 설명 합니다.
여기, 우리가 일반적으로 알려진된, 나노 기계적 힘을 부착 셀에서 핵 직접 적용할 현미경 시설에서 사용할 수 있는 microinjection 시스템을 사용 하기 위한 절차를 설명 합니다. Femtotip (0.5 µ m 직경 micropipette 팁) 탑재 하 고 튜브에 의해 microinjection 시스템에 연결 된. 때까지 핵 표면에 인접 한 문화 접시의 표면에 상대적으로 45 ° 각도로 위치 팁은 낮 췄 다. 튜브 분리 그리고 핵 표면에 부정적인 흡입 압력을 만들고 물개 micropipette 팁 핵 표면에 대 한 분위기에 열입니다. Micropipette 팁의 번역을 통해 핵 변형 이며 결국 (적용 되는 힘의 크기), 따라는 micropipette에서 분리. 이 분리는 micropipette에 의해 적용 되는 흡입 힘 동등 하 게 복원 (저항) 세력, 핵 및 셀에 의해 발휘 될 때 발생 합니다. 핵의 변위를 측정 하 여 분석을 수행할 수 있습니다 길이 변형 (공식 1), 또는 지역 스트레인 (그림 1A).
프로토콜
1. 영상에 대 한 셀을 준비합니다.
참고: 직접 힘 프로브 (DFP) 모든 부착 셀 형식에 사용할 수 있습니다. 여기, NIH 3T3 마우스 fibroblasts 모델 셀 라인으로이 프로토콜에 대 한 사용 됩니다.
- 문화 NIH 3T3 fibroblast 세포 Dulbecco의 수정이 글의 중간 (DMEM)에 하 1%와 10% 기증자 소 혈 청 보충 페니실린-스 35 m m 유리 하단에 원하는 confluency까지 요리. 37 ° C, 5% CO2세포를 유지 합니다.
- NIH 3T3 세포 이미징 뿌리기 전에 모든 35 mm 유리 하단 요리 fibronectin (또는 유사한 ECM 단백질), 5 µ g/mL와 코트를 해야 합니다.
참고: 셀 해야 합니다 수 완전히 확산 및 실험에 대 한 접시에 부착. DFP 메서드가 작동 하려면 confluency 측면에서 제약 되지 않습니다.
- NIH 3T3 세포 이미징 뿌리기 전에 모든 35 mm 유리 하단 요리 fibronectin (또는 유사한 ECM 단백질), 5 µ g/mL와 코트를 해야 합니다.
- 실험 직전 셀 완전 한 성장 매체를 가진 단일 세척 뒤 PBS로 두번 세척.
- 유리 하단 접시에 완전 한 성장 매체의 3 mL를 추가 합니다.
2. 현미경 및 이미지 수집
참고:는 거꾸로 형광 현미경 (또는 동등한) micromanipulator 쪽 팔의 제조 업체의 권장 사항에 따라 설치 된와 함께. 현미경은 37 ° C에서 온도 CO2 수준 5%에서 유지 하기 위해 환경 챔버를도 복 한다. Micromanipulator 및 현미경에 부착 된 microinjector는 또한 필요 합니다. 기름 침수 40 x 1.3 / NA 또는 60 x 1.49 / NA (또는 해당 목표)는 실험에 대 한 것이 좋습니다. 현미경 진동 절연 테이블에 거치 되어야 한다.
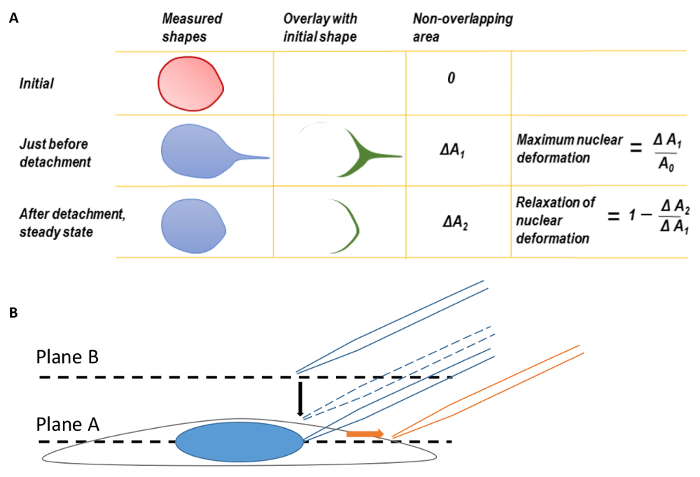
그림 1 . 핵 변형 및 현미경 초점
A. 최대 핵 변형 그리고 핵 변형의 휴식. 최대 핵 변형 계산 하기 전에 핵 모양의 뒤 가장자리 했다 처음 변형된 핵의 번역에 대 한 해결을 동시에. Micropipette 팁 초연의 순간에 핵의 모양 당기는 전에 초기 핵 모양에 중첩 되었다. 두 셰이프 사이의 지역 차이 Δ로 측정 되었다1. 최대 핵 변형 ΔA1 원래 핵 영역으로 나눈 값으로 정의 되었다. 마찬가지로, 두 번째 매개 변수, ΔA2, 원래 핵 모양에 micropipette 분리 후 최종 상태 핵 모양 오버레이하여 정의할 수 있습니다. 2. 초점 평면 A에 셀 이동한 다음 micropipette 팁을 찾을 수 평면 B까지 초점 비행기. 이미징, 동안는 micropipette 오른쪽 (주황색 화살표의 방향)으로 번역 되었다. 이 그림은 Neelam 외에서 수정 되었습니다. 15. 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.
- 제조 업체의 프로토콜 당 microinjector를 켭니다.
- 침수 기름 스포이드를 사용 하 여 대물 렌즈 위에 침수 기름 한 방울을 적용 합니다.
- 접시 홀더에 접시를 단단히 클램프 하 고 무대에 접시 홀더를 로드 합니다.
참고: 셀 실험 동안 37 ° C, 5% CO2 에서 유지 되어야 합니다. - 초점 (비행기, 그림 1B)에 셀을가지고 목표의 높이 조정 합니다.
- 관심의 셀 데 현미경 단계를 이동 합니다.
- 최상위 순위에 피펫으로 홀더 이동 micromanipulator에 조이스틱을 회전 합니다. 0.5 µ m 직경 팁 micropipette 피펫으로 보유자에 로드 합니다.
- micropipette에 세포 접착을 방지 하려면 미리 실 온에서 0.3 mg/mL 1 시간을 위한 PLL-g-말뚝 솔루션으로 micropipette 팁 취급. 모든 흡입 압력 없이 핵을 micropipette 감동 하 고 다음 핵에서 micropipette 번역 여 접착 테스트 합니다. 접착의 부재는 핵 변형 및 번역의 완전 한 부족에서 분별 수 있습니다.
참고: 패키지 여 제조 제안을 따르십시오.
- micropipette에 세포 접착을 방지 하려면 미리 실 온에서 0.3 mg/mL 1 시간을 위한 PLL-g-말뚝 솔루션으로 micropipette 팁 취급. 모든 흡입 압력 없이 핵을 micropipette 감동 하 고 다음 핵에서 micropipette 번역 여 접착 테스트 합니다. 접착의 부재는 핵 변형 및 번역의 완전 한 부족에서 분별 수 있습니다.
- 미세 제어를 조정 하 여 비행기 A와 비행기 B 셀의 맨 위에 객관적인 초점 비행기를 올립니다 (그림 1B단계 2.4 참조).
- 거친 제어는 micromanipulator를 설정 합니다. 천천히 micropipette의 실루엣에 대 한 보고는 micropipette 초점으로 완전히 때까지 비행기 B 아래로 micropipette 가져.
- 일단 micropipette 팁 초점에, 세밀 하 게 제어 하는 micromanipulator를 설정 합니다.
- 목표 셀 (비행기 A, 그림 1B)의 적도 면에 낮은 및 15 µ m 비행기 A 위의 (그림 1B, 파선된 micropipette) micropipette.
- 원하는 압력; microinjector에 보상 압력 (Pc)를 설정 안정 압력에 대 한 몇 초 동안 기다립니다.
참고: 최적의 압력 세트 포인트 셀 종류와 실험의 특정 목표에 따라 달라 집니다. 대부분의 경우, 300 hPa 좋은 출발점이 있을 것 이다. - micropipette micromanipulator 패널에 클린 설정을 사용 하 고 기포 micropipette 팁에서 나타날 ㄴ 다는 것을 확인 하 여 막힌 되지 확인 하십시오.
- 팁을 팁 핵 표면에 닿아 가볍게 때까지 micropipette을 서서히 낮추어 셀에 넣습니다.
참고:는 micropipette, 낮추는 때 micropipette 팁의 실루엣 될 것 이다 분명 그것은 초점으로 온다. 전에 micropipette 건드리면 핵, 객관적인 초점을 핵 (동일한 x y 좌표, 더 높은 z-비행기)와 micropipette 끝. 다시 핵 (비행기, 그림 1B)의 적도 면에 초점을 반환 및 점차 micropipette 팁. - 되므로 대기 micropipette 튜브의 끝을 열어 microinjection 시스템에서 압력 공급 튜브를 분리 하 여 micropipette 팁과 핵 막 인감을 만듭니다. 이 단계는 부정적인 압력 Pc 와 같은 핵 표면에 만듭니다.
- 현미경 이미지 컬렉션 소프트웨어와 함께 이미지를 취득 합니다. Avi-인수 (비디오) 또는 nd-수집 (이미지) 이미지 컬렉션 소프트웨어에서를 설정 합니다.
참고: 어떤 이미징 소프트웨어를 인수, 실시간 비디오 이미징 또는 짧은 시간 간격으로 시간 경과 이미지 인수를 설정 합니다. - 해당 형광 이미징 채널을 토글 (즉, GFP, RFP, 등)와 이미징 시작.
- (오른쪽, 그림 1B)에 셀의 본문에서 micropipette 팁 번역 핵은 micropipette에서 분리 될 때까지.
참고: (오른쪽에 있는 보기의 필드에) 긍정적인 x 방향에 따라 팁을 당겨. 풀링 레이트 프로그램을 컴퓨터에 의해 제어 또는 조이스틱을 수동으로 이동할 수 있습니다. 우리 밀 지 사이 어떤 상관 관계를 발견 하지 않은 속도 핵 변형15 를 주로 탄성 응답을 제안.
3. 데이터 분석
- 사용할 수 있는 기본적인 이미지 처리 소프트웨어 이미지 분석을 수행 합니다. 길이 변형 (Ɛ) 또는 지역 스트레인 (그림 1A)에 의해 핵 변형 정도 측정할 수 수 있습니다. 길이 변형 방정식 1를 사용 하 여 계량 어디 L과 L0 는 각각 최대 변형 및 초기 위치에서 핵의 길이 나타냅니다.
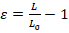 (식 1)
(식 1)
결과
그림 2A 는 NIH 3T3 마우스 구와 핵의 강제로 보여줍니다. Micropipette 팁은 오른쪽에 번역, 핵 변형 하 고 결국 micropipette 팁에서 분리. 핵의 길이 변형 흡입 힘 (그림 2B) 증가 함께 증가를 볼 수 있다. 핵 (micropipette 당기는 가장자리)의 앞쪽 가장자리 핵 돌출을 형성 하 고 후행 가장자리 그것의 원래 위치에서 난민. 돌출의 길이 후행 ?...
토론
어느 고립 된 핵 (핵은 골격에서 분리)를 필요로 하기 때문에 micropipette 포부16, 등 최신 방법에 대 한 도전 이다 골격 가진 핵의 기계적 통합 측정 또는 일시 중단 된 셀 (견인 힘, 같은 세포 외 세력 있는 결 석)에 핵. 강제로 막17,18; 세포 점착에 biaxial 긴장을 적용 하 여 핵에 적용 된 그러나,이 기술은 핵에 힘 불명 하다는 사실에 의해 제...
공개
저자는 공개 없다.
감사의 말
이 작품은 NIH R01 EB014869에 의해 지원 되었다.
자료
| Name | Company | Catalog Number | Comments |
| FluoroDish | WPI | FD35 | |
| SYTO 59 | ThermoFisher Scientific | S11341 | |
| Femtotips | Eppendorf | 930000043 | |
| InjectMan NI2 | Eppendorf | NA | discontinued, current equivalent model: InjectMan 4 |
| FemtoJet | Eppendorf | NA | Current model FemtoJet 4i |
| Plan Fluor oil immersion 40x | Nikon | NA | |
| Apo TIRF oil immersion 60x | Nikon | NA | |
| Donor Bovine Serum (DBS) | ThermoFisher Scientific | 16030074 | NIH 3T3 serum |
| Dulbecco's Modification of Eagle's (DMEM) | Mediatech cellgro | MT10013CVRF | NIH 3T3 medium |
| Penicillin-Streptomycin | Mediatech | MT30004CIRF | NIH 3T3 medium supplement |
| Immersion Oil Type LDF Non-Fluorescing | Nikon | 77007 | Immersion oil for objective lens |
참고문헌
- Chow, K. H., Factor, R. E., Ullman, K. S. The nuclear envelope environment and its cancer connections. Nature Reviews Cancer. 12 (3), 196-209 (2012).
- Zink, D., Fischer, A. H., Nickerson, J. A. Nuclear structure in cancer cells. Nature Reviews Cancer. 4 (9), 677-687 (2004).
- Bank, E. M., Gruenbaum, Y. The nuclear lamina and heterochromatin: a complex relationship. Biochemical Society Transactions. 39 (6), 1705-1709 (2011).
- Lammerding, J., et al. Lamins A and C but not lamin B1 regulate nuclear mechanics. Journal of Biological Chemistry. 281 (35), 25768-25780 (2006).
- Dahl, K. N., Engler, A. J., Pajerowski, J. D., Discher, D. E. Power-law rheology of isolated nuclei with deformation mapping of nuclear substructures. Biophysical Journal. 89 (4), 2855-2864 (2005).
- Crisp, M., et al. Coupling of the nucleus and cytoplasm: role of the LINC complex. Journal of Cell Biology. 172 (1), 41-53 (2006).
- Sosa, B. A., Rothballer, A., Kutay, U., Schwartz, T. U. LINC complexes form by binding of three KASH peptides to domain interfaces of trimeric SUN proteins. Cell. 149 (5), 1035-1047 (2012).
- Tapley, E. C., Starr, D. A. Connecting the nucleus to the cytoskeleton by SUN-KASH bridges across the nuclear envelope. Current Opinion in Cell Biology. 25 (1), 57-62 (2013).
- Arsenovic, P. T., et al. Nesprin-2G, a Component of the Nuclear LINC Complex, Is Subject to Myosin-Dependent Tension. Biophysical Journal. 110 (1), 34-43 (2016).
- Rowat, A. C., Lammerding, J., Ipsen, J. H. Mechanical properties of the cell nucleus and the effect of emerin deficiency. Biophysical Journal. 91 (12), 4649-4664 (2006).
- Rowat, A. C., Foster, L. J., Nielsen, M. M., Weiss, M., Ipsen, J. H. Characterization of the elastic properties of the nuclear envelope. Journal of the Royal Society Interface. 2 (2), 63-69 (2005).
- Pagliara, S., et al. Auxetic nuclei in embryonic stem cells exiting pluripotency. Nature Materials. 13 (6), 638-644 (2014).
- Liu, H., et al. In situ mechanical characterization of the cell nucleus by atomic force microscopy. ACS Nanotechnology. 8 (4), 3821-3828 (2014).
- Krause, M., Te Riet, J., Wolf, K. Probing the compressibility of tumor cell nuclei by combined atomic force-confocal microscopy. Physical Biology. 10 (6), 065002 (2013).
- Neelam, S., et al. Direct force probe reveals the mechanics of nuclear homeostasis in the mammalian cell. Proceedings of the National Academy of Sciences of the United States of America. 112 (18), 5720-5725 (2015).
- Pajerowski, J. D., Dahl, K. N., Zhong, F. L., Sammak, P. J., Discher, D. E. Physical plasticity of the nucleus in stem cell differentiation. Proceedings of the National Academy of Sciences of the United States of America. 104 (40), 15619-15624 (2007).
- Lammerding, J., et al. Lamin A/C deficiency causes defective nuclear mechanics and mechanotransduction. Journal of Clinical Investigation. 113 (3), 370-378 (2004).
- Chancellor, T. J., Lee, J., Thodeti, C. K., Lele, T. Actomyosin tension exerted on the nucleus through nesprin-1 connections influences endothelial cell adhesion, migration, and cyclic strain-induced reorientation. Biophysical Journal. 99 (1), 115-123 (2010).
- Neelam, S., Dickinson, R. B., Lele, T. P. New approaches for understanding the nuclear force balance in living, adherent cells. Methods. 94, 27-32 (2016).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유