Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Une sonde de Force directe permettant de mesurer l’intégration mécanique entre le noyau et le cytosquelette
Dans cet article
Résumé
Dans ce protocole, nous décrivons une méthode d’une micropipette pour appliquer directement une force contrôlée dans le noyau dans une cellule vivante. Ce dosage permet aux interrogatoires des propriétés mécaniques nucléaires dans la cellule vivante, adhérente.
Résumé
Les propriétés mécaniques du noyau déterminent sa réponse aux forces mécaniques générées dans les cellules. Parce que le noyau est moléculairement continu avec le cytosquelette, les méthodes sont nécessaires pour sonder son comportement mécanique dans les cellules adhérentes. Ici, nous discutons la sonde force directe (DFP) comme outil d’employer la force directement vers le noyau dans une cellule adhérente vivante. Nous attachons une micropipette étroite à la surface nucléaire avec aspiration. Une micropipette est traduite loin du noyau, ce qui provoque le noyau à déformer et à traduire. Lorsque la force de rappel est égale à la force d’aspiration, le noyau se détache et élastique se détend. Parce que la pression d’aspiration est connue avec précision, la force sur la surface nucléaire est connue. Cette méthode a révélé que les forces de la nano-échelle suffisent à déformer et à traduire le noyau dans les cellules adhérentes et identifié des éléments du cytosquelette qui permettent le noyau à résister aux forces. Le DFP peut servir à disséquer les contributions des composantes cellulaires et nucléaires nucléaire propriétés mécaniques dans les cellules vivantes.
Introduction
Pathologies telles que le cancer impliquent des modifications de forme nucléaire et composition1,2, qui sont généralement accompagnés par un ramollissement du noyau3,4. La résistance à la déformation mécanique nucléaire a été généralement caractérisée en appliquant une force de noyaux isolés5.
Le noyau dans les cellules est moléculairement relié au cytosquelette par l’éditeur de liens de Nucleoskeleton et cytosquelette (LINC) complexe6,7,8,9. Ainsi, le noyau est mécaniquement intégré avec le cytosquelette et, à travers les adhérences cellule-substrat, la matrice extracellulaire. Mécaniquement sonder le noyau à l’intérieur de cellules adhérentes peut donner un aperçu de cette intégration mécanique. Méthodes pour manipuler des noyaux dans les cellules vivantes incluent une micropipette aspiration10,11et la microscopie de force atomique12,13,14. Nous avons récemment décrit une sonde de force directe (DFP) qui s’applique à des forces mécaniques directement sur le noyau en une vie cellulaire adhérente15.
Ici, nous décrivons la procédure d’utilisation d’un système de micro-injection qui est couramment disponible dans les installations de microscopie d’appliquer une force mécanique de nano-échelle connue, directement vers le noyau dans une cellule adhérente. Un femtotip (0,5 µm de diamètre micropipette Astuce) est monté et raccordé au système de micro-injection par un tube. La pointe, placée à un angle de 45° par rapport à la surface de la boîte de Petri, est abaissée jusqu'à adjacente à la surface nucléaire. Le tube est ensuite déconnecté et ouvert à l’atmosphère, ce qui crée une dépression d’aspiration sur la surface nucléaire et scelle l’embout de micropipette contre la surface nucléaire. D’une traduction de la pointe d’une micropipette, le noyau est déformé et éventuellement (en fonction de l’ampleur de la force appliquée), détaché de la micropipette. Ce détachement se produit lorsque les forces de restauration (résister), exercées par le noyau et la cellule, égale à la force d’aspiration de la micropipette. Analyse peut être réalisée en mesurant le déplacement du noyau, la souche de longueur (équation 1), ou la souche de la région (Figure 1 a).
Protocole
1. préparation des cellules pour l’imagerie
Remarque : La sonde de force directe (DFP) peut être utilisée pour n’importe quel type de cellules adhérentes. Ici, les fibroblastes de souris NIH 3 t 3 sont utilisées comme la lignée cellulaire de modèle pour ce protocole.
- Cellules de fibroblastes culture NIH 3 t 3 dans de l’aigle de la modification de Dulbecco Medium (DMEM) additionné de 10 % de sérum de bovin donneur et 1 % la pénicilline-streptomycine sur un fond de verre 35 mm plat jusqu'à confluence désirée. Maintenir les cellules à 37 ° C et 5 % de CO2.
- N’oubliez pas de recouvrir tous les plats de fond verre 35 mm avec 5 µg/mL de la fibronectine (ou protéine ECM similaire), avant d’ensemencer les cellules 3 t 3 NIH pour l’imagerie.
Remarque : Les cellules doivent être entièrement étalés et adhérente sur le plat pour l’expérience. Il n’y a pas toutes les contraintes en termes de confluence pour la méthode DFP fonctionne.
- N’oubliez pas de recouvrir tous les plats de fond verre 35 mm avec 5 µg/mL de la fibronectine (ou protéine ECM similaire), avant d’ensemencer les cellules 3 t 3 NIH pour l’imagerie.
- Immédiatement avant l’expérience, laver les cellules deux fois avec du PBS suivie d’un lavage simple avec milieu de culture complet.
- Ajouter 3 mL de milieu de culture complet au verre fond plat.
2. microscopie et Acquisition d’images
Remarque : Un inversé fluorescence microscope (ou équivalent) avec micromanipulateur installée sur le bras de côté, selon les recommandations du fabricant. Le microscope devrait également être équipé d’une chambre environnementale pour maintenir la température à 37 ° C et la teneur en CO2 à 5 %. Il faut aussi un micromanipulateur et microinjector attaché au microscope. Une huile d’immersion 40 x / 1.3 NA ou x 60 / 1,49 NA (ou objectifs équivalents) sont recommandés pour les expériences. Le microscope doit être posé sur une table d’isolement de vibration.
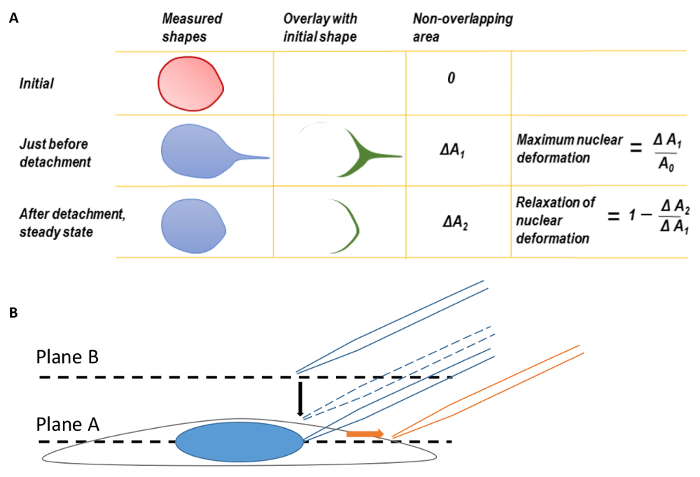
Figure 1 . Déformation nucléaire et mise au point du Microscope
A. le maximum déformation nucléaire et relaxation de déformation nucléaire. Avant de calculer la déformation maximale de nucléaire, des rebords arrières des formes nucléaires ont été tout d’abord a coïncidé pour corriger la traduction de noyau déformé. La forme du noyau au moment du détachement de pointe une micropipette été ajoutée à la forme initiale du nucléaire avant de tirer. La différence dans la zone entre les deux formes a été mesurée comme ΔA1. La déformation maximale du nucléaire a été définie comme ΔA1 divisé par la zone d’origine nucléaire. De même, un deuxième paramètre, ΔA2, peut être définie en superposant la forme nucléaire de l’état d’équilibre final après détachement micropipette forme d’origine nucléaire. B. concentrer la cellule au plan A, puis déplacez le plan focal, plan B pour trouver l’extrémité de la micropipette. Au cours de l’imagerie, la micropipette a été traduite vers la droite (sens de la flèche orange). Ce chiffre a été modifié par Neelam et al. 15. s’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
- Allumez le microinjector selon le protocole du fabricant.
- Avec un compte-gouttes d’huile d’immersion, appliquez une goutte d’huile à immersion sur le dessus de l’objectif.
- Brider le plat hermétiquement dans le porte-savon et charger le porte-savon sur scène.
Remarque : Les cellules doivent être maintenues à 37 ° C et 5 % de CO2 dans l’ensemble de l’expérience. - Régler la hauteur de l’objectif d’apporter les cellules dans le foyer (plan A, Figure 1 b).
- Déplacer la platine du microscope pour rechercher une cellule d’intérêt.
- Tournez la manette sur le micromanipulateur pour déplacer le titulaire de la pipette vers la première position. Charger une micropipette de pointe 0,5 µm de diamètre au support de la pipette.
- Pour éviter l’adhérence cellulaire à la micropipette, Prétraitez la pointe d’une micropipette et 0,3 mg/mL solution de PLL-g-PEG pendant 1 h à température ambiante. Test d’adhérence en touchant la micropipette vers le noyau sans aucune pression d’aspiration et ensuite traduire la micropipette loin du noyau. On peut discerner l’absence d’adhérence d’un manque complet de déformation nucléaire et de la traduction.
Remarque : Veuillez suivre les suggestions de fabrication à l’ouverture du paquet.
- Pour éviter l’adhérence cellulaire à la micropipette, Prétraitez la pointe d’une micropipette et 0,3 mg/mL solution de PLL-g-PEG pendant 1 h à température ambiante. Test d’adhérence en touchant la micropipette vers le noyau sans aucune pression d’aspiration et ensuite traduire la micropipette loin du noyau. On peut discerner l’absence d’adhérence d’un manque complet de déformation nucléaire et de la traduction.
- Soulever l’objectif plan focal au-dessus A de l’avion et la partie supérieure de la cellule d’avion B en réglant la commande fine (Figure 1 b, voir étape 2,4).
- Affectez le micromanipulateur contrôle grossier . Amenez lentement la micropipette jusqu'à plan B en regardant pour la silhouette de la micropipette, jusqu'à ce que la micropipette soit parfaitement net.
- Une fois la pointe d’une micropipette mise au point, régler le micromanipulateur pour un contrôle précis .
- Abaisser l’objectif du plan équatorial de la cellule (plan A, Figure 1 b) et abaissez la micropipette à environ 15 µm au-dessus plan A (Figure 1 b, micropipette en pointillés).
- Réglez la pression de compensation (Pc) sur la microinjector à la pression désirée ; attendre quelques secondes pour que la pression se stabilise.
Remarque : La consigne de pression optimale dépend de type de cellule et les objectifs spécifiques de l’expérience. Pour la plupart des cas, 300 hPa serait un bon point de départ. - Veiller à ce que la micropipette n’est pas bouchée en utilisant le paramètre Clean sur le panneau de micromanipulateur et vérification pour vous assurer que les bulles d’air sortent de la pointe de la micropipette.
- Introduire l’embout dans la cellule en abaissant progressivement la micropipette jusqu'à ce que la pointe touche légèrement la surface nucléaire.
Remarque : Lorsque vous abaissez la micropipette, la silhouette de la pointe d’une micropipette deviendra claire qu’il s’agit dans le foyer. Avant que la micropipette touche le noyau, soulever la discussion objective et alignez la pointe d’une micropipette avec noyau (même coordonnée de x-y, z-plan plus élevé). Retourner le focus vers le plan équatorial du noyau (plan A, Figure 1 b) et de diminuer progressivement la pointe d’une micropipette. - Assurer l’étanchéité entre la pointe d’une micropipette et la membrane nucléaire en déconnectant le tube de pression-alimentation du système de micro-injection, ouvrant ainsi l’extrémité du tube une micropipette dans l’atmosphère. Cette étape crée une pression négative égale à Pc sur la surface nucléaire.
- Acquisition d’images avec le logiciel de collecte d’image de microscopes. Mettre en place un avi-acquisition (vidéo) ou nd-acquisition (images) dans le logiciel de collecte d’image.
Remarque : Pour toute acquisition de logiciels de l’imagerie, mis en place une imagerie vidéo en temps réel ou d’acquisitions en Time-lapse image avec un intervalle de temps court. - Activer/désactiver à l’imagerie canal de fluorescente correspondant (c'est-à-dire, GFP, DP, etc.) et commencez à l’imagerie.
- Définition de la pointe d’une micropipette loin du corps de la cellule (à droite, Figure 1 b) jusqu'à ce que le noyau se détache de la micropipette.
Remarque : Tirer la pointe le long de l’axe x positif (vers la droite dans le champ de vision). Le taux de traction peut être programmé et contrôlé par ordinateur ou le joystick peut être déplacé manuellement. Nous n’avons trouvé aucune corrélation entre la traction taux et déformation nucléaire15 suggérant une réponse essentiellement élastique pour forcer.
3. analyse des données
- Effectuer l’analyse d’images avec n’importe quel logiciel de traitement d’image base disponible. La mesure de la déformation nucléaire peut être quantifiée par la souche de longueur (Ɛ) ou la souche de la région (Figure 1 a). Quantifier la souche de longueur à l’aide de l’équation 1, où L et L0 représentent les longueurs du noyau à la déformation maximale et la position initiale, respectivement.
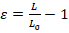 (Équation 1)
(Équation 1)
Résultats
Figure 2 a montre le forçage d’un noyau de fibroblastes de souris de 3 t 3 NIH. Comme la pointe d’une micropipette est traduite vers la droite, le noyau se déforme et finit par se détache de l’extrémité de la micropipette. La souche de la longueur du noyau semble augmenter avec l’augmentation de la force d’aspiration (Figure 2 b). Le bord avant du noyau (en tirant avantage de micropipette) forme une protubérance n...
Discussion
Mesurer l’intégration mécanique du noyau avec le cytosquelette est un défi pour les méthodes plus récentes, par exemple une micropipette aspiration16, car ils nécessitent deux noyaux isolés (où le noyau est découplé du cytosquelette) ou noyaux dans les cellules suspendues (où les forces extracellulaires, telles que les forces de traction, sont absents). Force a été appliquée au noyau en appliquant biaxiale souche aux adhérentes de cellules à une membrane17...
Déclarations de divulgation
Les auteurs n’ont rien à divulguer.
Remerciements
Ce travail a été soutenu par les NIH R01 EB014869.
matériels
| Name | Company | Catalog Number | Comments |
| FluoroDish | WPI | FD35 | |
| SYTO 59 | ThermoFisher Scientific | S11341 | |
| Femtotips | Eppendorf | 930000043 | |
| InjectMan NI2 | Eppendorf | NA | discontinued, current equivalent model: InjectMan 4 |
| FemtoJet | Eppendorf | NA | Current model FemtoJet 4i |
| Plan Fluor oil immersion 40x | Nikon | NA | |
| Apo TIRF oil immersion 60x | Nikon | NA | |
| Donor Bovine Serum (DBS) | ThermoFisher Scientific | 16030074 | NIH 3T3 serum |
| Dulbecco's Modification of Eagle's (DMEM) | Mediatech cellgro | MT10013CVRF | NIH 3T3 medium |
| Penicillin-Streptomycin | Mediatech | MT30004CIRF | NIH 3T3 medium supplement |
| Immersion Oil Type LDF Non-Fluorescing | Nikon | 77007 | Immersion oil for objective lens |
Références
- Chow, K. H., Factor, R. E., Ullman, K. S. The nuclear envelope environment and its cancer connections. Nature Reviews Cancer. 12 (3), 196-209 (2012).
- Zink, D., Fischer, A. H., Nickerson, J. A. Nuclear structure in cancer cells. Nature Reviews Cancer. 4 (9), 677-687 (2004).
- Bank, E. M., Gruenbaum, Y. The nuclear lamina and heterochromatin: a complex relationship. Biochemical Society Transactions. 39 (6), 1705-1709 (2011).
- Lammerding, J., et al. Lamins A and C but not lamin B1 regulate nuclear mechanics. Journal of Biological Chemistry. 281 (35), 25768-25780 (2006).
- Dahl, K. N., Engler, A. J., Pajerowski, J. D., Discher, D. E. Power-law rheology of isolated nuclei with deformation mapping of nuclear substructures. Biophysical Journal. 89 (4), 2855-2864 (2005).
- Crisp, M., et al. Coupling of the nucleus and cytoplasm: role of the LINC complex. Journal of Cell Biology. 172 (1), 41-53 (2006).
- Sosa, B. A., Rothballer, A., Kutay, U., Schwartz, T. U. LINC complexes form by binding of three KASH peptides to domain interfaces of trimeric SUN proteins. Cell. 149 (5), 1035-1047 (2012).
- Tapley, E. C., Starr, D. A. Connecting the nucleus to the cytoskeleton by SUN-KASH bridges across the nuclear envelope. Current Opinion in Cell Biology. 25 (1), 57-62 (2013).
- Arsenovic, P. T., et al. Nesprin-2G, a Component of the Nuclear LINC Complex, Is Subject to Myosin-Dependent Tension. Biophysical Journal. 110 (1), 34-43 (2016).
- Rowat, A. C., Lammerding, J., Ipsen, J. H. Mechanical properties of the cell nucleus and the effect of emerin deficiency. Biophysical Journal. 91 (12), 4649-4664 (2006).
- Rowat, A. C., Foster, L. J., Nielsen, M. M., Weiss, M., Ipsen, J. H. Characterization of the elastic properties of the nuclear envelope. Journal of the Royal Society Interface. 2 (2), 63-69 (2005).
- Pagliara, S., et al. Auxetic nuclei in embryonic stem cells exiting pluripotency. Nature Materials. 13 (6), 638-644 (2014).
- Liu, H., et al. In situ mechanical characterization of the cell nucleus by atomic force microscopy. ACS Nanotechnology. 8 (4), 3821-3828 (2014).
- Krause, M., Te Riet, J., Wolf, K. Probing the compressibility of tumor cell nuclei by combined atomic force-confocal microscopy. Physical Biology. 10 (6), 065002 (2013).
- Neelam, S., et al. Direct force probe reveals the mechanics of nuclear homeostasis in the mammalian cell. Proceedings of the National Academy of Sciences of the United States of America. 112 (18), 5720-5725 (2015).
- Pajerowski, J. D., Dahl, K. N., Zhong, F. L., Sammak, P. J., Discher, D. E. Physical plasticity of the nucleus in stem cell differentiation. Proceedings of the National Academy of Sciences of the United States of America. 104 (40), 15619-15624 (2007).
- Lammerding, J., et al. Lamin A/C deficiency causes defective nuclear mechanics and mechanotransduction. Journal of Clinical Investigation. 113 (3), 370-378 (2004).
- Chancellor, T. J., Lee, J., Thodeti, C. K., Lele, T. Actomyosin tension exerted on the nucleus through nesprin-1 connections influences endothelial cell adhesion, migration, and cyclic strain-induced reorientation. Biophysical Journal. 99 (1), 115-123 (2010).
- Neelam, S., Dickinson, R. B., Lele, T. P. New approaches for understanding the nuclear force balance in living, adherent cells. Methods. 94, 27-32 (2016).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon