需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
使用 NETQUANT 对中性粒细胞外陷阱的自动基于图像的定量
摘要
在这里,我们提出了一个协议,用于生成中性粒细胞外陷阱(NETs)和操作NETQUANT,这是一种用于定量免疫荧光图像中的NET的全自动软件选项。
摘要
嗜中性粒细胞外陷阱(NETs)是由DNA和颗粒衍生抗菌蛋白组成的类似网络的抗菌结构。免疫荧光显微镜和基于图像的定量方法仍然是定量中性粒细胞细胞外陷阱形成的重要工具。然而,目前可用于量化NET的基于荧光的方法存在关键局限性。基于图像的 NET 量化的手动方法通常是主观的,对于用户(尤其是没有经验的用户)来说,容易出错和繁琐。此外,目前可用的量化软件选项要么是半自动的,要么需要在操作前进行培训。在这里,我们演示了基于免疫荧光的自动图像定量方法的实现,以评估NET形成称为NETQUANT。该软件易于使用,具有用户友好的图形用户界面(GUI)。它考虑了与生物学相关的参数,如表面积和DNA:NET标记蛋白比的增加,以及核变形,以定义NET的形成。此外,此工具是作为一个免费的应用程序构建的,并允许单细胞分辨率量化和分析。
引言
嗜中性粒细胞是对抗各种微生物病原体的先天宿主防御反应的关键中介。它们通过释放含有多种抗菌蛋白2的颗粒、产生活性氧(ROS)和次氯酸盐1以及通过方噬菌体3来执行其抗菌功能。此外,布林克曼等人。4将嗜中性粒细胞外陷阱 (NETs) 描述为一种新型机制,通过这种机制,嗜中性粒细胞可以捕获和消除入侵的病原体。自从十多年前发现4,NETS就与各种传染性的5、6和非传染性7病症有关。NET形成是一个活跃的过程,导致染色质DNA的挤出涂有颗粒衍生抗菌蛋白8。与NET形成相关的细胞和核形态的一些关键变化包括核形态的丧失、染色质变性、将颗粒蛋白从细胞质调动到细胞核以及增加核和细胞直径8、9。
网络状的NET,可能显示为比细胞稍大的漫射结构或比单个嗜中性粒细胞大好几倍的结构,被认为是NETosis5,10的指标。使用荧光显微镜,通过检测DNA,如4',6-二酰胺-2-phenylindole(DAPI),并通过免疫荧光染色对NET结合的蛋白质,如中性粒细胞介酶,可以检测NET。在图11中,DNA和NET结合蛋白的重叠染色区域的量化决定了NET下的总面积。
有许多图像分析选项可用于执行基于荧光图像的NETs11、12的定量。但是,这些软件选项在用户不友好和/或完全自动化方面存在限制。在本文中,我们演示了NETQUANT13的操作,这是一个免费的应用程序,可以执行无偏的全自动免疫荧光显微镜基于NET定量。该应用程序具有用户友好的图形界面 (GUI),可以执行单单元分析。该软件通过检测DNA-NET结合标记区域的形态变化、染色质分离相关细胞核变形和DNA:NET结合蛋白比的增加来量化图像中的NETosis。综合起来,多个 NET 定义标准允许以无偏的方式跨多个数据集进行严格的 NET 量化。
研究方案
隆德大学道德委员会根据《赫尔辛基宣言》(2013/728)批准从健康志愿者中采集静脉血。所有志愿者都提供了书面知情同意。
1. 使用密度-梯度离心分离外周血中性粒细胞的分离
- 在含有肝素的管中收集人类静脉血,使管达到室温。
注意:至少需要健康献血者16 mL的血液才能产生足够大的细胞颗粒。 - 将血液与盐水中的 2% dextran(0.9% NaCl)混合,在室温下在无菌 50 mL 锥形离心管中沉淀 30 分钟。
- 将上清液吸入无菌的50 mL锥形离心管中,并在200 x g下以200 x g在4°C下10分钟。
- 从此步骤开始,在 4°C 或冰上继续隔离。
- 在5 mL的冰冷盐水中重新悬浮颗粒,在5 mL的白细胞隔离梯度(9.1% 二聚氰酸钠与5.7%dextran,w/v)的无菌15 mL锥形离心管的层。
- 在4°C下400 x g下离心30分钟。
- 吸出上清液并丢弃它。
- 将3mL的冰冷水中颗粒重新悬浮30s,立即加入1mL3.6%NaCl,然后补充10mL的冰冷盐水。
- 在 350 x g 下将细胞悬浮液离心 10 分钟。
- 去除上清液,收集细胞颗粒,并将其重新悬浮在1 mL的盐水中。在微离心管中留出10μL,用Bürker腔室中的锥蓝色评估细胞数量和活力。
- 将10μL的细胞悬浮液加入90μL的0.4%锥蓝色溶液中。在Bürker室中取取10μL的细胞悬浮液。计算在 4 个正方形中的单元格,这些单元格由造型室每个角落的 3 条线绑定。在染料的摄入中出现深蓝色的细胞是不可行的,从细胞总数中排除它们。
- 根据下面的方程定义,将单元格数表示为单元格/mL。
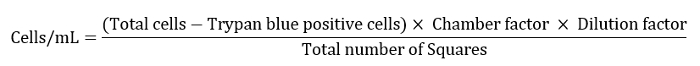
注:此处室因子为 10,000,稀释系数为 10,平方总数为 4。 - 将剩余的细胞悬浮液稀释至10 mL,进行最后的洗涤步骤。
- 在 200 x g 下离心 5 分钟。
- 用2mg/mL热灭活的人类血清白蛋白(HSA)在RPMI-1640中重新悬浮中性粒细胞,浓度为5 x 105细胞/mL。
2. 中性粒细胞的盖玻片的制备和刺激
- 将一个盖玻片(10 mm,#1)放在12孔板的每个孔中,通过加入200μL的0.01%多L-莱辛溶液来涂覆盖玻片,并将其留在37°C过夜。
- 用 300 μL 磷酸盐缓冲液盐水 (PBS) 清洗一次盖玻片,然后晾干。
- 在每个井中加入400 μL的5 x 105型嗜中性粒细胞/mL,并在室温下孵育15分钟。
- 将含有嗜中性粒的板在37°C下与5%CO2一起移至培养箱15分钟。
- 拆下上清液。在对照中加入400 μL的预预热RPMI-1640介质,带2毫克/mL HSA。加入300 μL预加热RPMI,加入20 nM phorbol 12-myristate 13醋酸酯(PMA)以刺激。
- 在37°C下用5%的CO2刺激中性粒细胞150分钟。
3. NET的可视化
- 取下上清液,用200μL的PBS清洗样品2倍。
- 在37°C下,在PBS中加入200μL的4%甲醛(PFA),20分钟,修复样品。
注意:PFA 是有毒的,必须小心处理。 - 用200 μL的PBS清洗样品3次。
- 通过添加 50 μL 的 0.5% Triton X-100 30 s 来渗透样品。
- 用200 μL的PBS清洗样品3倍。
- 在37°C下用PBS中的5%山羊血清块1小时。
- 在37°C下,在1:500稀释下,在阻断溶液中加入300μL原生兔抗人类中性粒细胞酶。
- 用300 μL的PBS清洗样品3倍。
- 在37°C下,在稀释1:1000时加入300μL的二级山羊抗兔荧光抗体90分钟。
- 用 300 μL 的 PBS 清洗盖玻片 3x。
- 从井中取出盖玻片,用包含 DAPI 的 10 μL 安装介质安装盖玻片。在黑暗中在室温下储存过夜,干燥样品。
注意:用DAPI染色DNA无疑是该方法的关键步骤。用户还可以通过在最终浓度范围 0.1\u20120.5 μg/mL 下添加外源性 DAPI 溶液进行故障排除,以 2μu20123 分钟,然后加入 3 个 300 μL PBS 的洗涤步骤。 - 使用 20X 物镜使用宽场荧光显微镜获取图像。
4. 使用 NETQUANT 分析与量化的 NET
注意:NETQUANT 可以通过单击 Zenodo Github 存档或诺登费尔特实验室网站(https://nordlab.med.lu.se/?page_id=34) 上的安装文件下载。
- 导入数据集进行分析、命名通道和转换图像
- 在 NETQUANT 中打开"设置"选项卡。
- 通过单击源菜单中的"获取路径"选项选择要分析的源文件夹,然后选择包含要分析的图像序列的文件夹。
- 单击目标菜单中的"获取路径"选项,然后选择用于在图像分析后保存数据的文件夹。
- 命名通道,使"DNA通道"与DNA染色(例如DNA或DAPI)相对应,"NET通道"在图像中描绘了NET绑定蛋白染色(例如NET、中性粒细胞乳酸酶)。为了软件的平稳运行,(建议)将包含控件图像文件的文件夹命名为"控件"。
注意:NET 通道仅指 NET 绑定颗粒蛋白标记染色。 - 单击"图像信息"子菜单上的"加载图像信息"按钮,将图像元数据馈入软件。
- 选择通道顺序子菜单中图像中包含的正确通道顺序。此选项已包含在故障保护中,以防止意外不匹配。
- 从原始数据获取主图像属性,并通过单击"准备数据"按钮转换图像。转换后的图像将显示在"示例类型"子菜单中。单击"示例类型"菜单以显示和选择获取用于分析的所有数据集。
- 从"示例类型"子菜单中选择图像,然后单击"显示图像数据"按钮,分别显示拆分为 DNA 和 NET 通道的图像。
- DNA通道和NET通道中细胞的分割
- 通过单击 DNA 通道和 NET 通道中的"方法"子菜单来选择分段方法。
注意: 默认的分段方法设置为自适应,是推荐的设置。其他选项也可用,包括全球,边缘和陈维塞。还包括一个分水岭选项,以帮助区分紧密放置的单元格或 NET。 - 输入"分段"选项卡,通过单击"分段"控制样本选项,首先在两个通道中分割控制单元格。
- 从示例类型子菜单中选择 PMA,然后单击"批处理"选项(建议)以开始分割数据集中包含的所有图像。选择示例类型菜单中的图像,然后单击"显示图像数据"按钮,以可视化和验证分段后生成的二进制图像掩码(DNA 掩码和 NET 掩膜)。
- 通过单击 DNA 通道和 NET 通道中的"方法"子菜单来选择分段方法。
- 可识别属性的单细胞分析
- 输入分析选项卡,通过单击"确定阈值"按钮分析控制样本。
- 将样本类型更改为 PMA,然后单击"获取单元格属性"按钮以完成对刺激样本的分析。
- 从"示例类型"子菜单中选择图像,然后单击"显示图像数据"按钮以显示图像中的叠加和单元格数和 NET 成形单元格数。
- 单元格属性的比较以识别 NET 成形细胞
- 从示例类型子菜单中选择示例,然后单击"分析 NET"按钮以完成分析。可以从示例类型子菜单中选择单个图像进行分析,或者通过选择批处理选项(推荐)来分析整个图像批次。
- 手动调整 NET 标准,为给定样本生成最佳结果。将已识别的 NET 与原始图像进行比较,以评估识别质量。
注意: 然后,NET 条件可用于数据集中的所有映像。NET 标准中的任何更改将同时应用于所有控制样本。这限制了由于 NET 参数的过度拟合而可能产生的任何潜在差异的可能性。NET 条件中的设置可根据用户要求进行调整。假发现率与NETQUANT之间的关系已经探索了13。面积增加的典型范围为 2\u20124,循环度为 0.7\u20120.9,DNA/NET 比率为 0.6*2.0。 - 检查Cell 数据子菜单中的数据摘要,其中显示图像数、每个图像的单元格计数和每个图像的 NET 百分比。
注意:整个数据集中的 NET 总百分比由"NET-gauge"显示。总图像计数、单元格计数、样本中 NET 的百分比 (NET%)和控制样本中的 NET% 显示在 NET 量表下方的汇总统计表中。我们建议在从刺激样本中获取的数据的同时报告控制数据。
- 结果输出
- 输入"输出"选项卡以选择和查看结果输出。
- 通过选择输出形式并单击"输出结果"按钮,探索和比较从控制分析和 PMA 分析生成的各种数据输出。
注意:控件和刺激分析后生成的所有数据都保存在目标子菜单中选择的分析文件夹中。数据以 .csv 或 .pdf 格式保存。 - 启动方法文件以获取用于分析的软件版本和 NET 标准(包含在用于发布目的的方法部分中)。
- 单击"结果"数据表可可视化给定示例中的单个数据点。
- 可视化样本中的 NET 面积分布和 DNA:NET 比率。红线表示图形中的阈值。
- 单击双变量分布文件确定 DNA 的 NET 区域与形状。
- 加载以前的分析和批处理所有步骤
- 使用"加载以前的分析"按钮将以前成功的分析设置加载到 NETQUANT 中。
- 使用"设置"菜单中包含的"批处理所有步骤"按钮直接运行步骤 5\u201212(图 1,图 2,图 3,图 4,图 5)直接获取最终输出。
结果
5 x 105嗜中性粒细胞/mL 被播种在放置在 12 孔板上的盖玻片上,用 20 nM PMA 刺激或离开未刺激 150 分钟。然后,使用原发兔抗人类中性粒细胞乳酸酶抗体、二级山羊抗兔氟荧光抗体和DAPI(一种带有荧光标签的染色DNA的染料)对样本进行染色(详情见材料表)。然后,使用荧光显微镜和20X(NA = 0.75)目标获取至少5个图像。通过按照
讨论
NET的形成是一个相对较新的除了不同的中性粒细胞武器4,并已出现了明显激增的兴趣,研究NET在广泛的研究领域5,7,14,15。使用免疫荧光显微镜和随后基于图像的定量采集图像是一种广泛使用的量化 NET 的方法。这种方法的优点是能够检测在单细胞水平上形成NET的细胞,因此可以?...
披露声明
TM 和 PN 拥有与 NETQUANT 中使用的算法相关的正在申请专利。
致谢
这项工作由克拉福德基金会(TM和PN)、瑞典政府研究基金(PN、TM)、瑞典研究理事会(PN)和格罗辛斯基基金会(TM,PN)资助。
材料
| Name | Company | Catalog Number | Comments |
| BD Vacutainer Heparinised plastic tubes | BD Biosciences | 367885 | |
| Lymphoprep | Axis-Shield | 114547 | |
| RPMI-1640 with L-Glutamine | Gibco | 11835-030 | |
| 50mL conical flasks | Sarstedt | 62.547.004 | |
| 15mL conical flasks | Sarstedt | 62.554.002 | |
| 12-well Tissue culture plates | Falcon | 10626491 | |
| #1 Coverslips 10mm | Menzel Glaser | CS10100 | |
| Glass slides | Menzel Glaser | 631-0098 | |
| Primary anti-human elastase | DAKO | DAKO rabbit 1373, contract immunization | |
| Secondary fluorophore conjugated goat anti-rabbit | Life technologies | A-11072, A-11070 | |
| PROLONG-Gold Antifade reagent with DAPI | Life technologies | P36930 | Mounting medium |
| Goat serum | Sigma-Aldrich | G9023 | |
| Phorbol 12-myristate 13-acetate (PMA) | Sigma-Aldrich | 79346 | |
| Paraformaldehyde | Sigma-Aldrich | 158127 | |
| Triton X-100 | Sigma-Aldrich | T8787 | |
| Nikon Ti-E Epifluorescence microscope | Nikon | ||
| CCD camera | Andor Zyla | ||
| Plan Apochromat 20x, 40x objectives | Nikon | ||
| Windows 10 | Microsoft | Operating system | |
| macOS Sierra 10.12 | Apple | Operating system | |
| MATLAB | Mathworks |
参考文献
- Nauseef, W. M., Borregaard, N. Neutrophils at work. Nature Immunology. 15 (7), 602-611 (2014).
- Borregaard, N., Cowland, J. B. Granules of the human neutrophilic polymorphonuclear leukocyte. Blood. 89 (10), 3503-3521 (1997).
- Nordenfelt, P., Tapper, H. Phagosome dynamics during phagocytosis by neutrophils. Journal of Leukocyte Biology. 90 (2), 271-284 (2011).
- Brinkmann, V., et al. Neutrophil extracellular traps kill bacteria. Science. 303 (5663), 1532-1535 (2004).
- Sorensen, O. E., Borregaard, N. Neutrophil extracellular traps - the dark side of neutrophils. Journal of Clinical Investigation. 126 (5), 1612-1620 (2016).
- Yipp, B. G., Kubes, P. NETosis: how vital is it?. Blood. 122 (16), 2784-2794 (2013).
- Jorch, S. K., Kubes, P. An emerging role for neutrophil extracellular traps in noninfectious disease. Nature Medicine. 23 (3), 279-287 (2017).
- Fuchs, T. A., et al. Novel cell death program leads to neutrophil extracellular traps. J Cell Biol. 176 (2), 231-241 (2007).
- Mohanty, T., et al. A novel mechanism for NETosis provides antimicrobial defense at the oral mucosa. Blood. 126 (18), 2128-2137 (2015).
- Hakkim, A., et al. Activation of the Raf-MEK-ERK pathway is required for neutrophil extracellular trap formation. Nature Chemical Biology. 7 (2), 75-77 (2011).
- Brinkmann, V., Goosmann, C., Kuhn, L. I., Zychlinsky, A. Automatic quantification of in vitro NET formation. Frontiers in Immunology. 3, 413 (2012).
- Coelho, L. P., et al. Automatic determination of NET (neutrophil extracellular traps) coverage in fluorescent microscopy images. Bioinformatics. 31 (14), 2364-2370 (2015).
- Mohanty, T., Sorensen, O. E., Nordenfelt, P. NETQUANT: Automated Quantification of Neutrophil Extracellular Traps. Frontiers in Immunology. 8, 1999 (2017).
- Kaplan, M. J., Radic, M. Neutrophil extracellular traps: double-edged swords of innate immunity. Journal of Immunology. 189 (6), 2689-2695 (2012).
- Cedervall, J., Olsson, A. K. Immunity Gone Astray - NETs in Cancer. Trends in Cancer. 2 (11), 633-634 (2016).
- Ginley, B. G., et al. Computational detection and quantification of human and mouse neutrophil extracellular traps in flow cytometry and confocal microscopy. Scientific Reports. 7 (1), 17755 (2017).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。