É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Quantificação automatizada baseada em imagem de armadilhas extracelulares de neutrófilos usando NETQUANT
Neste Artigo
Resumo
Aqui, apresentamos um protocolo para a geração de armadilhas extracelulares de neutrófilos (NETs) e a operação NETQUANT, uma opção de software totalmente automática para quantificação de NETs em imagens de imunofluorescência.
Resumo
As armadilhas extracelulares neutrófilas (NETs) são estruturas antimicrobianas semelhantes à teia, consistindo de proteínas antimicrobianas derivadas de DNA e grânulo. A microscopia de imunofluorescência e os métodos de quantificação à base de imagem continuam a ser ferramentas importantes para quantitar a formação de armadilhas extracelulares de neutrófilos. No entanto, existem limitações fundamentais para os métodos baseados em imunofluorescência que estão atualmente disponíveis para quantificar NETs. Métodos manuais de quantificação NET baseada em imagem são muitas vezes subjetivos, propensos a erros e tediosos para os usuários, especialmente usuários não experientes. Além disso, as opções de software atualmente disponíveis para quantificação são semi-automáticas ou exigem treinamento antes da operação. Aqui, demonstramos a implementação de um método automatizado de quantificação de imagem baseado em imunofluorescência para avaliar a formação NET chamada NETQUANT. O software é fácil de usar e tem uma interface gráfica de usuário (GUI) amigável ao usuário. Considera parâmetros biologicamente relevantes, como um aumento na área de superfície e dna:net marcador proteína razão, e deformação nuclear para definir a formação NET. Além disso, esta ferramenta é construída como um aplicativo disponível gratuitamente e permite a quantificação e análise de resolução de células únicas.
Introdução
Neutrófilos são mediadores cruciais de respostas inatas de defesa do hospedeiro contra uma grande variedade de patógenos microbianos1. Eles executam suas funções antimicrobianas liberando seus grânulos contendo uma grande variedade de proteínas antimicrobianas2,produzindo espécies reativas de oxigênio (ROS) e hipoclorite1,e através da fagocitose3. Além disso, Brinkmann et al. 4 descreveram armadilhas extracelulares neutantes (NETs) como um novo mecanismo pelo qual os neutrófilos prendem e eliminam patógenos invasores. Desde a sua descoberta há pouco mais de umadécada,os NETs têm sido implicados numa grande variedade de5,6 e7 morbidadesnãoinfecciosas. A formação líquida é um processo ativo e resulta na extrusão do DNA de cromatina revestido com proteínas antimicrobianas derivadas de grânulo8. Algumas das principais mudanças na morfologia celular e nuclear associadas à formação net incluem a perda de morfologia nuclear, decondensation cromatina, mobilização de proteínas de granule do citoplasma para o núcleo e um aumento no diâmetro nuclear e celular8,9.
Os NETs semelhantes à web, que podem aparecer como estruturas difusas ligeiramente maiores do que a célula ou como estruturas várias vezes maiores do que um único neutrófilo são considerados como indicadores de NETosis5,10. Usando microscopia de fluorescência, nets podem ser detectados por sondagem de DNA com uma sonda fluorescente, como 4',6-diamidino-2-fenilatoladole (DAPI) e por imunofluorescência manchando contra net-bound proteínas como neutrophil elastase. Quantificação de áreas sobrepostas de coloração para DNA e proteínas net-bound determina a área total NETs em uma imagem11.
Uma série de opções de análise de imagem estão disponíveis para realizar quantificação baseada em imagem de fluorescência de NETs11,12. Mas essas opções de software apresentam limitações em não ser amigável e/ou totalmente automatizada. Neste artigo, demonstramos o funcionamento do NETQUANT13, um aplicativo disponível gratuitamente que pode executar quantificação líquida de microfluorescência totalmente automatizada imparcial. O aplicativo tem uma interface gráfica amigável (GUI) e pode realizar análisede célula única. O software quantifica a NETose em uma imagem detectando as mudanças morfológicas na área do marcador ligado ao DNA-NET, a descondensação da cromatina associou a deformação do núcleo e o aumento da relação de proteína dna:NET-bound. Em conjunto, os múltiplos critérios de definição NET permitem uma quantificação líquida rigorosa em vários conjuntos de dados de forma imparcial.
Protocolo
O comitê de ética da Universidade de Lund aprovou a coleta de sangue venoso de voluntários saudáveis de acordo com a Declaração de Helsínquia (2013/728). Todos os voluntários forneceram seu consentimento informado por escrito.
1. Isolamento de neutrófilos de sangue periféricos usando centrífugação de densidade-gradiente
- Coletar sangue venoso humano em tubos contendo heparina e permitir que os tubos para atingir a temperatura ambiente.
Nota: Um mínimo de 16 mL de sangue de um doador saudável é necessário para produzir uma pelota de célulasuficientemente grande. - Misture o sangue com um volume de 2% dextran em saline (0,9% NaCl) e deixe sedimentar à temperatura ambiente por 30 min em um tubo de centrífuga cônica estéril de 50 mL.
- Ascute o supernatant em um tubo cical e no centrífuga estéril da centrífuga de 50 mL cical em 200 x g para 10 min em 4 °C.
- A partir deste passo em diante, continue o isolamento a 4 °C ou no gelo.
- Resuspenda a pelota em 5 mL de soro frio e camada em cima de 5 mL de gradiente de isolamento de leukócito (9,1% diatrizoato de sódio com 5,7% dextran, w/v) em um tubo de centrífuga cônico estéril de 15 mL.
- Centrífuga por 30 min a 400 x g a 4 °C.
- Aspirar o supernatant e descartá-lo.
- Lyse glóbulos vermelhos, resuspendendo a pelota em 3 mL de água gelada para 30 s. Imediatamente adicionar 1 mL de 3,6% NaCl e, em seguida, encher-se com 10 mL de saline gelado.
- Centrífuga a suspensão celular por 10 min a 350 x g.
- Retire o supernatant, recolher a pelota celular e resuspendê-lo em 1 mL de saline. Reserve 10 μL em um tubo de microcentrífuga para avaliação do número celular e viabilidade usando o trypan azul em uma câmara de Bürker.
- Adicione 10 μL de suspensão celular a 90 μL de 0,4% de solução azul trypan. Tome 10 μL da suspensão da pilha em uma câmara de Bürker. Conte as células nos 4 quadrados ligados por 3 linhas em cada canto da câmara. As células que parecem azul escuro para a captação de corante são inviáveis, excluí-los do número total de células.
- Expresse o número celular como células/mL, conforme definido pela equação abaixo.
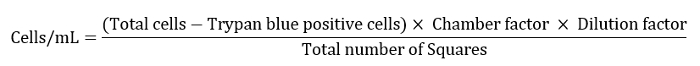
Nota: Aqui o fator de câmara era 10.000, o fator da diluição era 10 e o número total de quadrados era 4. - Diluir a suspensão celular restante para 10 mL para uma etapa de lavagem final.
- Centrífuga por 5 min a 200 x g.
- Resuspenda os neutrófilos em RPMI-1640 com 2 mg/mL de soro humano inativado de calor (HSA) a uma concentração de 5 x 105 células/mL.
2. Preparação de coverslips e estimulação de neutrófilos
- Coloque um coverslip (10 mm, #1) em cada poço de uma placa de 12 poços e cubra o coverslip adicionando 200 μL de 0,01% solução de poli-l-lisina e deixá-lo em 37 °C durante a noite.
- Lave os lábios com 300 μL fosfato tampão soline (PBS) uma vez e deixe secar.
- Adicione 400 μL de 5 x 105 neutrophils/mL a cada poço e incubar-se na temperatura ambiente para 15 min.
- Mova a placa contendo neutrófilos para uma incubadora a 37 °C com 5% de CO2 para 15 min.
- Retire o supernatant. Adicione 400 μL de RPMI-1640 pré-aquecido com 2 mg/mL HSA aos controles. Adicione 300 μL RPMI pré-aquecido com 20 nM phorbol 12-myristate 13 acetato (PMA) para estimulação.
- Estimule os neutrófilos por 150 min a 37 °C com 5% de CO2.
3. Visualização de NETs
- Retire o supernatant e lave as amostras 2x com 200 μL de PBS.
- Corrigir amostras adicionando 200 μL de paraformaldeído de 4% (PFA) na PBS por 20 min a 37 °C.
Nota: PFA é tóxico e deve ser tratado com cuidado. - Lave amostras 3x com 200 μL de PBS.
- Permeabilize as amostras adicionando 50 μL de 0,5% Triton X-100 para 30 s.
- Lave as amostras 3x com 200 μL de PBS.
- Bloqueie as amostras com 5% de soro de cabra na PBS por 1 h a 37 °C.
- Adicione 300 μL de elastase anti-humano de neutrófilos de coelho primário em solução de bloqueio em uma diluição de 1:500 para 90 min a 37 °C.
- Lave as amostras 3x com 300 μL de PBS.
- Adicione 300 μL de anticorpo fluorescente anti-coelho de cabra secundário em uma diluição de 1:1000 para 90 min a 37 °C.
- Lave os coverslips 3x com 300 μL de PBS.
- Retire os lábios dos poços e monte o coverslip com 10 μL montagem média contendo DAPI. Armazenar durante a noite à temperatura ambiente no escuro para secar as amostras.
Nota: A coloração do DNA com DAPI é certamente um passo crítico no método. Os usuários também podem solucionar problemas adicionando solução DAPI exógena em uma faixa de concentração final de 0.1\u20120.5 μg/mL para 2\u20123 min, seguido por 3 passos de lavagem com 300 μL PBS. - Adquirir imagens com um microscópio de fluorescência de campo largo usando um objetivo 20X.
4. Análise e Quantificação de NETs usando NETQUANT
Nota: NETQUANT pode ser baixado clicando no arquivo de instalação encontrado no arquivo Zenodo Github ou no site do Nordenfelt Lab (https://nordlab.med.lu.se/?page_id=34).
- Importação de conjuntos de dados para análise, nomeação de canais e conversão de imagens
- Abra a guia de configuração na NETQUANT.
- Escolha a pasta de origem para análise clicando na opção Get path no menu de origem e selecione a pasta contendo as sequências de imagem a serem analisadas.
- Clique na opção Get Path no menu alvo e selecione a pasta para salvar os dados após a análise de imagem.
- Cite os canais para que o "canal de DNA" corresponda com a coloração de DNA(por exemplo,DNA ou DAPI) e "NET-channel" retrata a mancha de proteína NET-bound(por exemplo,NET, elastase neutrófilo) nas imagens. Para o bom funcionamento do software, (recomendado) nome da pasta contendo os arquivos de imagem de controle como "controle".
Nota: O canal NET refere-se apenas à mancha de proteína de grânulo net-bound. - Alimente os metadados de imagem no software clicando no botão de informações de imagem Load no submenu de informações de imagem.
- Selecione a ordem correta do canal contida nas imagens no submenu de pedidos do Canal. Esta opção foi incluída como uma falha à prova de falhas para evitar incompatibilidades acidentais.
- Adquirir propriedades de imagem primária a partir dos dados brutos e converter as imagens clicando no botão de dados Prepare. As imagens convertidas aparecem no submenu tipo Sample. Clique no menu tipo Amostra para exibir e selecionar todos os conjuntos de dados adquiridos para análise.
- Selecione uma imagem do menu sub do tipo Sample e clique no botão de dados de imagem display para exibir as imagens divididas no DNA e no canal NET, respectivamente.
- Segmentação de células no canal de DNA e no canal NET
- Selecione o método de segmentação clicando no sub menu Método no canal de DNA e no canal NET.
Nota: O método padrão de segmentação é definido como adaptativo e é a configuração recomendada. Outras opções também estão disponíveis, incluindo global, borda e Chan-Vese. Uma opção de bacia hidrográfica também está incluída para ajudar a distinguir entre células colocadas de perto ou NETs. - Digite a guia de segmentação para células de controle do segmento em primeiro lugar em ambos os canais, clicando na opção de amostras de controle do segmento.
- Selecione pma a partir do tipo de amostra sub-menu e clique na opção lote (recomendado) para iniciar a segmentação de todas as imagens incluídas no conjunto de dados. Selecione as imagens no menu tipo amostra e clique no botão de dados de imagem display para visualizar e validar as máscaras de imagem binárias (máscara de DNA e máscara NET) geradas após segmentação.
- Selecione o método de segmentação clicando no sub menu Método no canal de DNA e no canal NET.
- Análise unicelular de propriedades identificáveis
- Digite a guia de análise e analisar as amostras de controle clicando no botão determinar limite.
- Alterar o tipo de amostra para PMA e clique no botão obter propriedades celulares para completar a análise de amostras estimuladas.
- Selecione uma imagem do submenu tipo sample e clique no botão de dados de imagem display para exibir a sobreposição e o número de células e células formadoras net na imagem.
- Comparação de propriedades celulares para identificar células formadoras de NET
- Selecione a amostra do submenu do tipo amostra e clique no botão Analyze NETs para concluir a análise. Imagens individuais podem ser selecionadas a partir do submenu tipo amostra para análise ou todo o lote de imagens pode ser analisado selecionando a opção de lote (recomendado).
- Ajuste os critérios da NET manualmente para produzir resultados ideais para uma determinada amostra. Compare NETs identificados com as imagens originais para avaliar a qualidade da identificação.
Nota: Os critérios net podem ser usados em todas as imagens no conjunto de dados. Quaisquer alterações nos critérios net são aplicadas simultaneamente em todas as amostras de controle. Isso limita a possibilidade de eventuais diferenças que possam surgir devido ao excesso de montagem dos parâmetros NET. As configurações nos critérios NET podem ser ajustadas de acordo com os requisitos do usuário. A relação entre as taxas de descoberta falsa e NETQUANT foi explorada anteriormente13. As escalas típicas para o aumento da área são 2\u20124, circularity a ser 0.7\u20120.9 e a relação do ADN/NET a ser 0.6-2.0. - Inspecione o resumo dos dados no submenu de dados cell, onde o número de imagens, a contagem de células por imagem e a porcentagem de NETs por imagem são exibidos.
Nota: A porcentagem total de NETs em todo o conjunto de dados é exibida pelo "indicador NET". A contagem total de imagens, a contagem celular, a porcentagem de NETs na amostra (NETs%) e os NETs% na amostra de controle são exibidos na tabela de estatísticas sumárias abaixo do indicador NET. Recomendamos que os dados de controle sejam relatados juntamente com os dados obtidos a partir de amostras estimuladas.
- Resultados
- Insira a guia De saída para selecionar e visualizar as saídas de resultados.
- Explore e compare as várias saídas de dados geradas a partir da análise do controle e do PMA selecionando a forma da saída e clicando no botão de resultados de saída.
Nota: Todos os dados gerados após a análise para controles e estimulação são salvos na pasta de análise escolhida no submenu alvo. Os dados são salvos em formatos .csv ou .pdf. - Ineve o arquivo Método para obter a versão do software e os critérios NET utilizados para a análise (a serem incluídos na seção de métodos para fins de publicação).
- Clique na tabela de dados de resultados para visualizar os pontos de dados individuais em uma determinada amostra.
- Visualize a distribuição da área NET e a relação DNA:NET nas amostras. A linha vermelha indica o valor limite nos gráficos.
- Determine a área NET versus a forma do DNA clicando no arquivo de distribuição bivariada.
- Carregamento de análise anterior e lote de todas as etapas
- Carregue configurações de análise previamente bem-sucedidas no NETQUANT usando o botão de análise anterior da Load.
- Use o botão Batch todas as etapas incluídas no menu de configuração para executar etapas 5\u201212 (Figura 1,Figura 2, Figura 3, Figura 4, Figura 5) diretamente para obter a saída final.
Resultados
5 x 105 neutrophils/mL foram semeados em coverslips colocados em uma placa de 12 poços e estimulados com 20 nM PMA ou deixados sem estímulo por 150 min. As amostras foram então manchadas usando anticorpos primários de nêutrons anti-humanos de coelho, anticorpos conjugados de fluorofiforas anticoelho de cabra secundário e DAPI - um corante fluorescente rotulado que mancha DNA (Veja a Tabela de Materiais para obter detalhes). Um mínimo de 5 imagens foram e...
Discussão
A formação NET é uma adição relativamente recente ao diverso armamentarium neutrófilo4 e tem havido uma onda notável de interesse para estudar a implicação de NETs em uma ampla gama de áreas de pesquisa5,7,14,15. A aquisição de imagens usando microscopia de imunofluorescência e quantificação subsequente baseada em imagem é um método amplamente utilizado ...
Divulgações
TM e PN têm uma patente pendente relacionada aos algoritmos utilizados na NETQUANT.
Agradecimentos
O trabalho foi financiado pela Fundação Crafoord (TM e PN), concessão de Pesquisa do Governo Sueco (PN, TM), conselho de pesquisa sueco (PN) e Groschinsky Foundation (TM, PN).
Materiais
| Name | Company | Catalog Number | Comments |
| BD Vacutainer Heparinised plastic tubes | BD Biosciences | 367885 | |
| Lymphoprep | Axis-Shield | 114547 | |
| RPMI-1640 with L-Glutamine | Gibco | 11835-030 | |
| 50mL conical flasks | Sarstedt | 62.547.004 | |
| 15mL conical flasks | Sarstedt | 62.554.002 | |
| 12-well Tissue culture plates | Falcon | 10626491 | |
| #1 Coverslips 10mm | Menzel Glaser | CS10100 | |
| Glass slides | Menzel Glaser | 631-0098 | |
| Primary anti-human elastase | DAKO | DAKO rabbit 1373, contract immunization | |
| Secondary fluorophore conjugated goat anti-rabbit | Life technologies | A-11072, A-11070 | |
| PROLONG-Gold Antifade reagent with DAPI | Life technologies | P36930 | Mounting medium |
| Goat serum | Sigma-Aldrich | G9023 | |
| Phorbol 12-myristate 13-acetate (PMA) | Sigma-Aldrich | 79346 | |
| Paraformaldehyde | Sigma-Aldrich | 158127 | |
| Triton X-100 | Sigma-Aldrich | T8787 | |
| Nikon Ti-E Epifluorescence microscope | Nikon | ||
| CCD camera | Andor Zyla | ||
| Plan Apochromat 20x, 40x objectives | Nikon | ||
| Windows 10 | Microsoft | Operating system | |
| macOS Sierra 10.12 | Apple | Operating system | |
| MATLAB | Mathworks |
Referências
- Nauseef, W. M., Borregaard, N. Neutrophils at work. Nature Immunology. 15 (7), 602-611 (2014).
- Borregaard, N., Cowland, J. B. Granules of the human neutrophilic polymorphonuclear leukocyte. Blood. 89 (10), 3503-3521 (1997).
- Nordenfelt, P., Tapper, H. Phagosome dynamics during phagocytosis by neutrophils. Journal of Leukocyte Biology. 90 (2), 271-284 (2011).
- Brinkmann, V., et al. Neutrophil extracellular traps kill bacteria. Science. 303 (5663), 1532-1535 (2004).
- Sorensen, O. E., Borregaard, N. Neutrophil extracellular traps - the dark side of neutrophils. Journal of Clinical Investigation. 126 (5), 1612-1620 (2016).
- Yipp, B. G., Kubes, P. NETosis: how vital is it?. Blood. 122 (16), 2784-2794 (2013).
- Jorch, S. K., Kubes, P. An emerging role for neutrophil extracellular traps in noninfectious disease. Nature Medicine. 23 (3), 279-287 (2017).
- Fuchs, T. A., et al. Novel cell death program leads to neutrophil extracellular traps. J Cell Biol. 176 (2), 231-241 (2007).
- Mohanty, T., et al. A novel mechanism for NETosis provides antimicrobial defense at the oral mucosa. Blood. 126 (18), 2128-2137 (2015).
- Hakkim, A., et al. Activation of the Raf-MEK-ERK pathway is required for neutrophil extracellular trap formation. Nature Chemical Biology. 7 (2), 75-77 (2011).
- Brinkmann, V., Goosmann, C., Kuhn, L. I., Zychlinsky, A. Automatic quantification of in vitro NET formation. Frontiers in Immunology. 3, 413 (2012).
- Coelho, L. P., et al. Automatic determination of NET (neutrophil extracellular traps) coverage in fluorescent microscopy images. Bioinformatics. 31 (14), 2364-2370 (2015).
- Mohanty, T., Sorensen, O. E., Nordenfelt, P. NETQUANT: Automated Quantification of Neutrophil Extracellular Traps. Frontiers in Immunology. 8, 1999 (2017).
- Kaplan, M. J., Radic, M. Neutrophil extracellular traps: double-edged swords of innate immunity. Journal of Immunology. 189 (6), 2689-2695 (2012).
- Cedervall, J., Olsson, A. K. Immunity Gone Astray - NETs in Cancer. Trends in Cancer. 2 (11), 633-634 (2016).
- Ginley, B. G., et al. Computational detection and quantification of human and mouse neutrophil extracellular traps in flow cytometry and confocal microscopy. Scientific Reports. 7 (1), 17755 (2017).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados