Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
NETQUANT Kullanarak Nötrofil Ekstrasellüler Tuzakların Otomatik Görüntü Tabanlı Niceliği
Bu Makalede
Özet
Burada, nötrofil ekstrasellüler tuzakları (NETTs) ve işletim NETQUANT, immünororesans görüntüleri NTs quantification için tam otomatik bir yazılım seçeneği oluşturmak için bir protokol salıyoruz.
Özet
Nötrofil ekstrasellüler tuzakları (NETs) DNA ve granül türemiş antimikrobiyal proteinlerden oluşan web benzeri antimikrobiyal yapılardır. İmmünofloresan mikroskobu ve görüntü tabanlı nicelikselleştirme yöntemleri nötrofil ekstrasellüler tuzak oluşumunu hesaplamak için önemli araçlar olmaya devam etmektedir. Ancak, şu anda NETs ölçmek için kullanılabilir immünoresans tabanlı yöntemler için önemli sınırlamalar vardır. Görüntü tabanlı NET sayısallaştırmanın manuel yöntemleri genellikle özneldir, hataya yatkındır ve kullanıcılar, özellikle de deneyimsiz kullanıcılar için sıkıcıdır. Ayrıca, sayısallaştırma için mevcut yazılım seçenekleri ya yarı otomatik ya da çalışmadan önce eğitim gerektirir. Burada NETQUANT adı verilen NET oluşumunu değerlendirmek için otomatik immünoresaneses esaslı görüntü ölçme yönteminin uygulanmasını gösteriyoruz. Yazılımın kullanımı kolaydır ve kullanıcı dostu bir grafik kullanıcı arabirimine (GUI) sahiptir. Net oluşumunu tanımlamak için yüzey alanı ve DNA:NET marker protein oranı ve nükleer deformasyon gibi biyolojik olarak ilgili parametreleri dikkate alır. Ayrıca, bu araç serbestçe kullanılabilir bir uygulama olarak inşa edilmiştir ve tek hücreli çözünürlükte niceleme ve analiz sağlar.
Giriş
Nötrofiller mikrobiyal patojenler1geniş bir yelpazede karşı doğuştan gelen konak savunma yanıtları önemli aracılar vardır. Onlar antimikrobiyal proteinler in geniş bir yelpazede içeren granülleri serbest bırakarak antimikrobiyal fonksiyonlarını yürütmek2, reaktif oksijen türleri üreten (ROS) ve hipoklorit1, ve fagositoz yoluyla3. Buna ek olarak, Brinkmann ve ark. 4 nötrofil ekstrasellüler tuzakları (NETs) tarafından nötrofiller tuzak ve işgalci patojenleri ortadan kaldırmak yeni bir mekanizma olarak tanımlanır. Onların keşfi biraz üzerinde bir on yıl önce4,NETs bulaşıcı5geniş bir yelpazede karıştığı edilmiştir,6 ve bulaşıcı olmayan7 morbiditeler. NET oluşumu aktif bir süreçtir ve granül türetilmiş antimikrobiyal proteinler ile kaplanmış kromatin DNA ekstrüzyon sonuçları8. NET oluşumu ile ilişkili hücresel ve nükleer morfolojiönemli değişikliklerden bazıları nükleer morfoloji kaybı, kromatin dekonsökonsilasyon, çekirdeğin sitoplazma granül proteinlerinin seferberliği ve nükleer ve hücresel çapı bir artış8,9.
Hücreden biraz daha büyük veya tek bir nötrofilden birkaç kat daha büyük yapılar olarak ortaya çıkabilecek web benzeri NET'ler, NETosis5,10'un göstergeleri olarak kabul edilir. Floresan mikroskobu kullanılarak, NET'ler DNA'yı 4',6-diamidino-2-fenilindole (DAPI) gibi floresan sonda ile probenerek ve nötrofil elastaz gibi NET'e bağlı proteinlere karşı immünfloresans boyama ile tespit edilebilir. DNA ve NET'e bağlı proteinler için örtüşen boyama alanlarının ölçülmesi, bir görüntüdeki NET'lerin altındaki toplam alanı belirler11.
NETs11,12floresan görüntü tabanlı nicelik gerçekleştirmek için görüntü analizi seçenekleri bir dizi kullanılabilir. Ancak bu yazılım seçenekleri, kullanıcı dostu ve/veya tam otomatik olmamak gibi sınırlamalar sunar. Bu makalede, tarafsız tam otomatik immünoreskence mikroskopi görüntü tabanlı NET nicelik gerçekleştirebilen serbestçe kullanılabilen bir uygulama olan NETQUANT13'ünişleyişini gösteriyoruz. Uygulama kullanıcı dostu bir grafik arabirimine (GUI) sahiptir ve tek hücreli analiz gerçekleştirebilir. Yazılım, DNA-NET'e bağlı belirteç, çekirdeğin kromatin dekonsiyomu ile ilişkili deformasyon ve DNA:NET'e bağlı protein oranındaki artışı alandaki morfolojik değişiklikleri algılayarak görüntüdeki NETozu ölçer. Birlikte ele alındığında, birden çok NET tanımı ölçütleri tarafsız bir şekilde çeşitli veri kümeleri arasında sıkı NET nicellik sağlar.
Protokol
Lund Üniversitesi etik komitesi Helsinki Bildirgesi (2013/728) uyarınca sağlıklı gönüllülerden venöz kan toplanmasını onayladı. Tüm gönüllüler yazılı bilgilendirilmiş onaylarını sundular.
1. Yoğunluk-Gradyan Santrifüj Kullanarak Periferik Kan Nötrofillerin İzolasyon
- Heparin içeren tüplerde insan venöz kan toplamak ve tüpler oda sıcaklığına ulaşmak için izin.
Not: Yeterince büyük hücreli bir pelet elde etmek için sağlıklı bir donörden en az 16 mL kan alınması gerekir. - Kanı salinde %2 dekstran (%0.9 NaCl) hacmiyle karıştırın ve steril 50 mL konik santrifüj tüpte 30 dk oda sıcaklığında tortu tortulmaya izin verin.
- Supernatant'ı steril 50 mL konik santrifüj tüpe ve santrifüje 200 x g'de 4 °C'de 10 dakika yada aspire edin.
- Bu adımdan itibaren 4 °C'de veya buz üzerinde izolasyon devam eder.
- Steril 15 mL konik santrifüj tüpünde 5 mL lökosit izolasyon gradyanının (%9,1 sodyum diatrizoat ile %5,7 dekstran, w/v) üzerine 5 mL buz gibi tuzlu ve tabaka da peleti yeniden askıya alın.
- 4 °C'de 400 x g'de 30 dk santrifüj.
- Supernatant aspire ve atın.
- Lyse kırmızı kan hücreleri 30 s. Için 3 mL buz gibi su 3 mL pelet resuspend tarafından kırmızı kan hücreleri hemen% 3.6 NaCl 1 mL ekleyin ve sonra buz soğuk tuzlu 10 mL ile doldurun.
- 350 x g 10 dakika hücre süspansiyon santrifüj.
- Supernatant çıkarın, hücre pelet toplamak ve tuzlu 1 mL içinde yeniden askıya. Bir Bürker odasında trypan mavisi kullanarak hücre numarası nın ve canlılığının değerlendirilmesi için mikrosentrifuge tüpünde 10 μL ayırın.
- %0,4 trypan mavi çözeltisi için 10 μL hücre süspansiyonu ekleyin. Hücre süspansiyonunun 10 μL'sini Bürker haznesinde alın. Odanın her köşesinde 3 satırile bağlanmış 4 karedeki hücreleri sayın. Boya alımına koyu mavi görünen hücreler, toplam hücre numarasından dışlanırlar.
- Hücre numarasını aşağıdaki denklemde tanımlandığı şekilde hücre/mL olarak ifade edin.
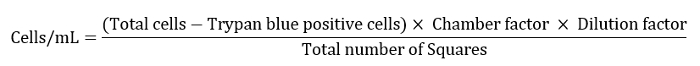
Not: Burada oda faktörü 10.000, seyreltme faktörü 10 ve toplam kare sayısı 4 idi. - Son yıkama adımı için kalan hücre süspansiyonuna 10 mL seyreltin.
- 200 x g 5 dakika santrifüj.
- RPMI-1640'taki nötrofilleri 2 mg/mL ısı yalıtımlı insan serum albumini (HSA) 5 x 105 hücre/mL konsantrasyonda yeniden askıya alın.
2. Kapakların Hazırlanması ve Nötrofillerin Uyarılması
- 12 kuyulu bir plakanın her kuyuya bir kapak kayması (10 mm, #1) yerleştirin ve %0,01 poli-L-lizin çözeltisi ekleyerek coverslip'i kaplayın ve bir gecede 37 °C'de bırakın.
- 300 μL fosfat tampon salini (PBS) ile kapakları bir kez yıkayın ve kurumaya bırakın.
- Her kuyuya 400 μL 5 x 105 nötrofil/mL ekleyin ve 15 dakika oda sıcaklığında kuluçkaya yatırın.
- Nötrofil içeren plakayı 37 °C'de %5 CO2 ile 15 dakika boyunca bir kuvöze taşıyın.
- Supernatant çıkarın. Kontrollere 2 mg/mL HSA ile 400 μL önceden ısıtılmış RPMI-1640 ortamı ekleyin. Stimülasyon için 20 nM phorbol 12-myristate 13-asetat (PMA) ile 300 μL önceden ısıtılmış RPMI ekleyin.
- Nötrofilleri 37 °C'de %5 CO2ile 150 dk için uyarın.
3. NET'lerin Görselleştirilmesi
- Supernatant çıkarın ve 200 μL PBS ile örnekleri 2x yıkayın.
- PBS'ye 37 °C'de 20 dakika boyunca %4 paraformaldehit (PFA) ekleyerek numuneleri düzeltin.
Not: PFA toksiktir ve dikkatli kullanılmalıdır. - 200 μL PBS ile 3x yıkama numunelerini yıkayın.
- 30 s için %0,5 Triton X-100 50 μL ekleyerek numuneleri permeabilize edin.
- Numuneleri 200 μL PBS ile 3x yıkayın.
- PBS'de %5 keçi serumu ile 37 °C'de 1 saat boyunca numuneleri bloke edin.
- 37 °C'de 90 dk için 1:500 seyreltme çözeltisi engelleme de birincil tavşan anti-insan nötrofil elastaz 300 μL ekleyin.
- Numuneleri 300 μL PBS ile 3x yıkayın.
- 37 °C'de 90 dakika boyunca 1:1000 seyreltme de ikincil keçi anti-tavşan floresan antikor 300 μL ekleyin.
- 300 μL PBS ile kapakları 3x yıkayın.
- Kapakları kuyulardan çıkarın ve COVER SLIP'i DAPI içeren 10 μL montaj ortamıile türün. Numuneleri kurutmak için bir gece boyunca oda sıcaklığında karanlıkta saklayın.
Not: DNA'nın DAPI ile boyanarak boyandır. Kullanıcılar ayrıca 2\u20123 dk için 0.1\u20120.5 μg/mL nihai konsantrasyon aralığında eksojen DAPI çözeltisi ekleyerek sorun giderebilir, ardından 300 μL PBS ile 3 yıkama adımı. - 20X hedefi kullanarak geniş alan floresan mikroskobuyla görüntüler edinin.
4. NETQUANT kullanılarak NET'lerin Analizi ve Niceliği
Not: NETQUANT Zenodo Github arşivinde veya Nordenfelt Lab web sitesinde(https://nordlab.med.lu.se/?page_id=34)bulunan yükleme dosyasına tıklayarak indirilebilir.
- Analiz için veri kümelerinin içe aktarılması, kanalların adlandırılması ve görüntülerin dönüştürülmesi
- NETQUANT'ta Kurulum sekmesini açın.
- Kaynak menüsündeki Yolu Al seçeneğini tıklatarak analiz için kaynak klasörü seçin ve analiz edilecek görüntü dizilerini içeren klasörü seçin.
- Hedef menüdeki Yolu Al seçeneğini tıklayın ve görüntü çözümlemesi sonrasında verileri kaydetmek için klasörü seçin.
- "DNA kanalı" DNA boyama(örneğin,DNA veya DAPI) ve "NET-kanal" net bağlı protein boyama(örneğin, NET, nötrofil elastaz) görüntüleri tasvir karşılık gelir, böylece kanalları adlandırın. Yazılımın düzgün çalışması için, (önerilen) denetim görüntü dosyalarını içeren klasörü "denetim" olarak adlandırın.
Not: NET kanalı sadece NET'e bağlı granül protein belirteci boyama anlamına gelir. - Resim bilgileri alt menüsündeki Resim Bilgilerini Yükle düğmesini tıklatarak görüntü meta verilerini yazılıma aktarın.
- Kanal siparişalt menüsündeki resimlerde yer alan doğru kanal sırasını seçin. Bu seçenek, yanlışlıkla eşleşmeleri önlemek için bir hata güvenli olarak eklenmiştir.
- Ham verilerden birincil görüntü özelliklerini edinin ve veri hazırla düğmesinitıklatarak görüntüleri dönüştürün. Dönüştürülen görüntüler Örnek türü alt menüsünde görünür. Analiz için edinilen tüm veri kümelerini görüntülemek ve seçmek için Örnek türü menüsüne tıklayın.
- Örnek türü alt menüsünden bir resim seçin ve sırasıyla DNA ve NET kanalına bölünmüş görüntüleri görüntülemek için Görüntü görüntü veri düğmesine tıklayın.
- DNA kanalında ve NET kanalında Hücrelerin Segmentasyonu
- Hem DNA kanalında hem de NET kanalında Yöntem alt menüsüne tıklayarak segmentasyon yöntemini seçin.
Not: Varsayılan segmentasyon yöntemi uyarlamalı olarak ayarlanır ve önerilen ayardır. Diğer seçenekler de global, edge ve Chan-Vese dahil mevcuttur. Bir havza seçeneği de yakından yerleştirilmiş hücreler veya NETs arasında ayrım yardımcı olmak için dahildir. - Segment denetim örnekleri seçeneğini tıklatarak, her iki kanaldaki hücreleri önce segmentdenetimi için Segmentasyon sekmesini girin.
- Örnek tür alt menüsünden PMA'yı seçin ve veri kümesinde yer alan tüm görüntülerin bölümletilmeye başlamak için Toplu İşlem seçeneğini (önerilir) tıklayın. Örnek türü menüsündeki görüntüleri seçin ve segmentasyon sonrası oluşturulan ikili görüntü maskelerini (DNA maskesi ve NET maskesi) görselleştirmek ve doğrulamak için Görüntü görüntü veri düğmesini tıklayın.
- Hem DNA kanalında hem de NET kanalında Yöntem alt menüsüne tıklayarak segmentasyon yöntemini seçin.
- Tanımlanabilir Özelliklerin Tek Hücreli Analizi
- Çözüm sekmesini girin ve eşik belirleme düğmesini tıklatarak kontrol örneklerini analiz edin.
- Örnek türünü PMA olarak değiştirin ve uyarılmış örneklerin analizini tamamlamak için hücre özelliklerini al düğmesine tıklayın.
- Örnek türü alt menüsünden bir resim seçin ve bindirmeyi ve görüntüdeki hücre sayısını ve NET oluşturan hücreleri görüntülemek için Görüntü görüntü veri düğmesini tıklatın.
- NET oluşturan Hücreleri Tanımlamak için Hücre özelliklerinin karşılaştırılması
- Örnek türü alt menüsünden örnek seçin ve analizi tamamlamak için ANALIZ NETs düğmesine tıklayın. Tek tek görüntüler analiz için örnek türü alt menüsünden seçilebilir veya tüm toplu görüntü toplu seçeneğini seçerek analiz edilebilir (önerilir).
- Belirli bir örnek için en iyi sonuçları elde etmek için NET ölçütlerini el ile ayarlayın. Tanımlama kalitesini değerlendirmek için tanımlanan NET'leri orijinal görüntülerle karşılaştırın.
Not: NET ölçütleri daha sonra veri kümesindeki tüm görüntülerde kullanılabilir. NET kriterlerindeki tüm değişiklikler tüm kontrol örneklerinde aynı anda uygulanır. Bu, NET parametrelerinin aşırı takılması nedeniyle ortaya çıkabilecek olası farklılıkların olasılığını sınırlar. NET kriterlerindeki ayarlar kullanıcının gereksinimlerine göre ayarlanabilir. Yanlış keşif oranları ve NETQUANT arasındaki ilişki daha önce13araştırılmıştır. Alan artışı için tipik aralıklar 2\u20124, dairesellik 0.7\u20120.9 ve DNA/NET oranı 0.6-2.0'dır. - Görüntü sayısının, görüntü başına hücre sayısının ve görüntü başına NET'lerin yüzdesinin görüntülendiği Hücre veri alt menüsündeki veri özetini inceleyin.
Not: Tüm veri kümesindeki NET'lerin toplam yüzdesi "NET göstergesi" tarafından görüntülenir. Toplam görüntü sayısı, hücre sayısı, örnekteki NET'lerin yüzdesi (NTs%) ve kontrol örneğindeki NET-gauge'un altındaki özet istatistik tablosunda %nits görüntülenir. Kontrol verilerinin uyarılmış örneklerden elde edilen verilerle birlikte raporlanmasını öneririz.
- Sonuç Çıktıları
- Sonuç çıktılarını seçmek ve görüntülemek için Çıktı sekmesini girin.
- Çıktının biçimini seçerek ve Çıktı sonuçları düğmesine tıklayarak kontrol ve PMA çözümlemesi sonucu oluşturulan çeşitli veri çıktılarını keşfedin ve karşılaştırın.
Not: Hem denetimler hem de stimülasyonlar için analiz sonrası oluşturulan tüm veriler, hedef alt menüde seçildiği gibi çözümklasörüne kaydedilir. Veriler .csv veya .pdf formatlarında kaydedilir. - Analiz için kullanılan yazılımın sürümünü ve NET kriterlerini elde etmek için Yöntem dosyasını başlatın (yayın amaçlı yöntemler bölümüne dahil edilecektir).
- Belirli bir örnekteki tek tek veri noktalarını görselleştirmek için Sonuçlar veri tablosuna tıklayın.
- Örneklerdeki NET alan dağılımını ve DNA:NET oranını görselleştirin. Kırmızı çizgi grafiklerdeki eşik değerini gösterir.
- Bivariate dağıtım dosyasına tıklayarak NET alanını DNA'nın şekline göre belirleyin.
- Önceki Analizve Toplu Tüm Adımları Yükleme
- Önceki çözümleme düğmesini kullanarak daha önce başarılı olan analiz ayarlarını NETQUANT'a yükleyin.
- Son çıktıyı doğrudan elde etmek için Kurulum menüsünde yer alan Tüm Adımları Toplu olarak kullanın 5\u201212(Şekil 1, Şekil 2, Şekil 3, Şekil 4 , Şekil 5) adımlarını çalıştırın.
Sonuçlar
5 x 105 nötrofil/mL 12 kuyulu bir plakaya yerleştirilen ve 20 nM PMA ile uyarılmış veya 150 dakika boyunca uyarılmamış olarak bırakılan kapaklara tohumlandı. Örnekler daha sonra birincil tavşan anti-insan nötrofil elastaz antikorları, ikincil keçi anti-tavşan florofor konjuge antikorlar ve DAPI kullanılarak lekelenmiştir - DNA lekeleri bir floresan etiketli boya (Ayrıntılar için Malzemeler Tablosu bakınız). Daha sonra epifloresan mikrosk...
Tartışmalar
NET oluşumu çeşitli nötrofil armamentarium için nispeten yeni bir ektir4 ve araştırma alanları geniş bir yelpazede NETTs inmasını incelemek için ilgi belirgin bir dalgalanma olmuştur5,7,14,15. İmmünfluoresan mikroskopi ve sonraki görüntü tabanlı nicelik kullanılarak görüntülerin elde edilmesi, NET'leri ölçmek için yaygın olarak kullanılan bir ...
Açıklamalar
TM ve PN NETQUANT kullanılan algoritmalar ile ilgili bekleyen bir patent var.
Teşekkürler
Çalışma Crafoord Vakfı (TM ve PN), İsveç Hükümeti Araştırma hibe (PN, TM), İsveç araştırma konseyi (PN) ve Groschinsky Vakfı (TM, PN) tarafından finanse edilmiştir.
Malzemeler
| Name | Company | Catalog Number | Comments |
| BD Vacutainer Heparinised plastic tubes | BD Biosciences | 367885 | |
| Lymphoprep | Axis-Shield | 114547 | |
| RPMI-1640 with L-Glutamine | Gibco | 11835-030 | |
| 50mL conical flasks | Sarstedt | 62.547.004 | |
| 15mL conical flasks | Sarstedt | 62.554.002 | |
| 12-well Tissue culture plates | Falcon | 10626491 | |
| #1 Coverslips 10mm | Menzel Glaser | CS10100 | |
| Glass slides | Menzel Glaser | 631-0098 | |
| Primary anti-human elastase | DAKO | DAKO rabbit 1373, contract immunization | |
| Secondary fluorophore conjugated goat anti-rabbit | Life technologies | A-11072, A-11070 | |
| PROLONG-Gold Antifade reagent with DAPI | Life technologies | P36930 | Mounting medium |
| Goat serum | Sigma-Aldrich | G9023 | |
| Phorbol 12-myristate 13-acetate (PMA) | Sigma-Aldrich | 79346 | |
| Paraformaldehyde | Sigma-Aldrich | 158127 | |
| Triton X-100 | Sigma-Aldrich | T8787 | |
| Nikon Ti-E Epifluorescence microscope | Nikon | ||
| CCD camera | Andor Zyla | ||
| Plan Apochromat 20x, 40x objectives | Nikon | ||
| Windows 10 | Microsoft | Operating system | |
| macOS Sierra 10.12 | Apple | Operating system | |
| MATLAB | Mathworks |
Referanslar
- Nauseef, W. M., Borregaard, N. Neutrophils at work. Nature Immunology. 15 (7), 602-611 (2014).
- Borregaard, N., Cowland, J. B. Granules of the human neutrophilic polymorphonuclear leukocyte. Blood. 89 (10), 3503-3521 (1997).
- Nordenfelt, P., Tapper, H. Phagosome dynamics during phagocytosis by neutrophils. Journal of Leukocyte Biology. 90 (2), 271-284 (2011).
- Brinkmann, V., et al. Neutrophil extracellular traps kill bacteria. Science. 303 (5663), 1532-1535 (2004).
- Sorensen, O. E., Borregaard, N. Neutrophil extracellular traps - the dark side of neutrophils. Journal of Clinical Investigation. 126 (5), 1612-1620 (2016).
- Yipp, B. G., Kubes, P. NETosis: how vital is it?. Blood. 122 (16), 2784-2794 (2013).
- Jorch, S. K., Kubes, P. An emerging role for neutrophil extracellular traps in noninfectious disease. Nature Medicine. 23 (3), 279-287 (2017).
- Fuchs, T. A., et al. Novel cell death program leads to neutrophil extracellular traps. J Cell Biol. 176 (2), 231-241 (2007).
- Mohanty, T., et al. A novel mechanism for NETosis provides antimicrobial defense at the oral mucosa. Blood. 126 (18), 2128-2137 (2015).
- Hakkim, A., et al. Activation of the Raf-MEK-ERK pathway is required for neutrophil extracellular trap formation. Nature Chemical Biology. 7 (2), 75-77 (2011).
- Brinkmann, V., Goosmann, C., Kuhn, L. I., Zychlinsky, A. Automatic quantification of in vitro NET formation. Frontiers in Immunology. 3, 413 (2012).
- Coelho, L. P., et al. Automatic determination of NET (neutrophil extracellular traps) coverage in fluorescent microscopy images. Bioinformatics. 31 (14), 2364-2370 (2015).
- Mohanty, T., Sorensen, O. E., Nordenfelt, P. NETQUANT: Automated Quantification of Neutrophil Extracellular Traps. Frontiers in Immunology. 8, 1999 (2017).
- Kaplan, M. J., Radic, M. Neutrophil extracellular traps: double-edged swords of innate immunity. Journal of Immunology. 189 (6), 2689-2695 (2012).
- Cedervall, J., Olsson, A. K. Immunity Gone Astray - NETs in Cancer. Trends in Cancer. 2 (11), 633-634 (2016).
- Ginley, B. G., et al. Computational detection and quantification of human and mouse neutrophil extracellular traps in flow cytometry and confocal microscopy. Scientific Reports. 7 (1), 17755 (2017).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır