Method Article
用于嵌合抗原受体 T 细胞的实时效力测定,用于定位固体和血液癌细胞
摘要
我们描述了一个定量实时体外细胞解检测系统,以评估嵌合抗原受体T细胞针对液体和固体肿瘤细胞的效力。该协议可以扩展以评估其他免疫效应细胞,以及联合治疗。
摘要
治疗癌症的奇美抗原受体(CAR)T细胞治疗,对儿童急性淋巴细胞白血病等耐药和耐火血液恶性肿瘤有显著的临床效益。目前正在努力将这种有前途的疗法推广到固体肿瘤,以及其他血液学癌症。在这里,我们描述了在固体和液体肿瘤细胞上以抗原为目标的强效CAR T细胞的开发和生产。 然后,使用基于高灵敏度阻抗的xCELLigence测定,实时评估这些CAR T细胞的体外效力。具体来说,考察了不同成本信号域的影响,如糖皮质激素诱导肿瘤坏死因子受体(TNFR)相关蛋白(GITR)对CAR T细胞体外效力的影响。本报告包括:使用慢病毒基因转导的临床前研究生成CAR T细胞,扩大CAR T细胞,验证CAR表达,以及运行和分析xCELLigence效力测定。
引言
近年来,CAR T细胞治疗是复发和难治性造血恶性肿瘤的癌症免疫治疗最突出的突破之一。与最近的美国 美国食品和药物管理局(FDA)批准CD19定向CAR T细胞用于急性淋巴细胞白血病、非霍奇金淋巴瘤和扩散性大B细胞淋巴瘤,并指定突破性治疗B细胞成熟抗原(BCMA)导向的CAR T细胞用于多发性骨髓瘤,该技术在科学界引起了极大的轰动,并推动了全球众多基础、应用和临床研究。 4,5.2019年1月,临床试验数据库登记了700多项临床试验(clinicaltrials.gov);其中约450项试验即将开始或正在积极招募患者。大多数临床试验都集中在血液恶性肿瘤,利用CAR T细胞靶向CD20,CD22和BCMA,除了CD19,临床试验正在进行以及6,7。虽然大多数试验都使用自体CART细胞疗法,其中相当一部分也在探索异源性CART细胞8、9、10的效用。尽管血液恶性肿瘤取得了可喜的结果,但事实证明,使用CAR T细胞靶向实体肿瘤的难度要大得多,原因多种多样,包括但不限于缺乏肿瘤中唯一表达的良好靶点,实体肿瘤和肿瘤"逃逸"的异质性,以及CAR T细胞在进入肿瘤微环境11、12、13、14方面遇到的困难。15.迫切需要开发固体肿瘤特异性CAR T细胞,以克服这些疗效障碍和"靶向肿瘤"毒性问题。虽然在设计和测试CAR T细胞时需要多种体外和体内方法,但强健和预测性的体外效力测定是最重要的16,17。
为了评估CAR T细胞的效力,已经开发出各种体外方法。一般来说,这些效力测定可以分为两大类,这取决于它们(i)是否直接测量CAR T细胞对靶性肿瘤细胞的细胞解物活性,或(ii)测量替代标记物,如CAR T细胞在杀死目标细胞时释放的细胞因子。直接测量细胞解物活性的技术包括铬-51释放测定(CRA)18、利用荧光探针19、20测量目标细胞凋亡的成像测定法,以及检测凋亡靶细胞21的流式细胞测定测定。在这些测定中,CAR T细胞通常与目标细胞共同培养,这些细胞已预先标记了放射性或荧光探针,然后进行适当的测量。虽然它长期以来因其敏感性而被认为是该领域的黄金标准,但CRA有一些缺点。首先,它是端点测定,不提供动力学信息。其次,目标细胞需要贴上铬-51的标签,铬-51倾向于从细胞中渗出,并能显著增加背景噪声22。最后,它要求采取适当的预防措施和处置放射性废物。替代测定法测量CAR T细胞与靶细胞相互作用的副产品,作为效力的表示,包括使用基于流细胞学的方法或酶链接免疫吸附剂测定的CAR T细胞释放的各种细胞因子的定量。再次,这些是终点测定,测量细胞因子在给定时间点的累积释放,因此,不一定反映CAR T细胞的实际细胞解物活性。
当开发效力测定时,尤其是定义基于细胞的治疗的释放标准(如 CAR T-cell)的测定标准时,分析必须涉及最少的操作和动手时间,因为每次相互作用都是另一个需要考虑的变量,并且会降低测定的整体鲁棒性和一致性。此外,CAR T细胞与肿瘤细胞的相互作用是一个动态过程,提供有关这些动态相互作用的信息,如细胞分析率,对于效力评估至关重要。考虑到这些标准,我们为CAR T细胞开发了无标签动力学效力测定,利用xCELLigence实时细胞分析(RTCA)平台。xCELLigence 利用专用的微子板 (E-Plates),每个井底部都嵌入了金色生物传感器。这些生物传感器使用粘附固体肿瘤细胞或使用特定抗体系结的液体癌细胞,实时监测目标细胞数、细胞大小、细胞基质附着强度和细胞-细胞相互作用(即屏障功能)17、23、24、25、26、27、28的变化。工作流程很简单,只需将目标细胞播种到电子板的孔中,然后以不同的效应器与目标比率添加 CAR T 细胞(图 1)。随后,当生物传感器持续监测目标细胞的生存能力时,数据会自动实时显示。
在过去的15年中,xCELLigence测定已经验证了评估自然杀伤细胞(NK)细胞、T细胞、CAR T细胞、检查点抑制剂、双特异性抗体、溶酶病毒以及一些联合疗法17、29、30、31、32、33、34的效力。最近,xCELLigism效力测定被评估为制造T细胞受体(TCR)工程T细胞35。在这里,我们报告使用RTCA系统来评估CAR T细胞的体外效力,旨在靶向临床治疗中的实体肿瘤和液体肿瘤。
研究方案
1. CAR编码慢病毒的生成
注:一旦特定的CAR T细胞质粒结构完成(CD47和其他),慢病毒CARs由标准程序生成,使用293 FT细胞,慢病毒包装混合物,和转染剂(见材料表)如描述29。随后,使用定量逆转录聚合酶链反应(RT-PCR)试剂盒和热循环器(见材料表)根据制造商的协议测量慢病毒RNA量来确定病毒定子。重要的是,所有慢病毒程序都严格按照安全要求进行。
- 种子 15 x 106 HEK293FT 细胞在 Dulbecco 的改性 Eagle 的培养基 (DMEM) 中,在加湿的 5% CO2培养箱内一个 150 mm 的培养皿中,在 37°C 下孵育细胞过夜。
- 准备两个15 mL管转染复合物。第一管含有慢病毒载体质粒DNA(5μg)和慢病毒包装混合物(22.5微克)中的2.5 mL转染稀释溶液。第二管含有82.5μL的转染试剂,含有2.5 mL的转染稀释溶液(见材料表)。
- 将管 1 的含量移入管 2 中,并在室温下孵育混合物 15 分钟。
- 将管内内容物滴入HEK293FT细胞的培养皿,在加湿的5%CO2培养箱中,在37°C下孵育样品过夜。
- 第二天,用19mL的新鲜DMEM培养基取代现有的培养基,并在37°C的加湿5%CO2培养箱内继续孵育细胞过夜。
- 将培养基从培养皿转移到 50 mL 离心管。将管子与含病毒的介质放在冰箱中。
- 重复上述步骤,添加新鲜的 DMEM 并在 1 天后再次收集。
- 将两个介质集合组合到一个离心管中。在 4°C 下以 2,000 x g将管离心 30 分钟。
- 将大部分含有慢病毒的上清液转移到超透明离心管中。留下上清液的最低体积,约1 mL,以避免干扰可能含有细胞和/或碎屑的颗粒。
- 在4°C下,在110,000 x g处,在100分钟内,将上述上清液超离。
- 小心地取出上清液,并轻轻地将 100 μ0 μL 的 DMEM 培养基加入管底部的病毒颗粒中。将管子放在冰上15分钟,轻轻混合溶液,将慢病毒溶液与预冷却无菌管中分出。将这些病毒库存管储存在-80°C冷冻箱中。
- 使用定量RT-PCR试剂盒根据制造商的协议确定扁豆病毒的定子,该协议提取并测量慢病毒RNA。
2. CAR T细胞的生成和扩展
- 在1mL的CAR T细胞培养基中激活先前冷冻的人类PBMC(约1 x 106至2 x 106细胞),使用相同数量的CD3/CD28涂层微珠(见材料表),并在加湿的5%CO2培养箱中孵育细胞,24小时。
- 在冰上解冻扁豆病毒的等分。
- 加入1μL的转导增强剂到井与细胞和混合。
- 在5:1的多重感染(MOI)中向细胞添加慢病毒,然后轻轻混合。第二天,重复此步骤(第一次转导后 24 小时)。
- 每2-3天监测T细胞的生长。添加更多新鲜的CAR T细胞培养基,使细胞的密度保持在1 x 106至2 x 106细胞/mL。
- 使用冷冻溶液使用标准协议冻结 CAR T 细胞(参见材料表)。
- 使用标准方法解冻CAR T细胞,并在CAR T细胞培养基中预培养它们约+2-4小时,使用IL-2(300单位/mL),然后再将其应用到测定中。
3. 流量细胞测定检测CAR表达
- 将 3 x 105 CAR T 细胞和非转导 T 细胞转移到两个独立的 1.5 mL 微离心管。
- 在300 x g下将管离心2分钟,在含有1%人血清的荧光活性细胞分拣(FACS)缓冲液中重新悬浮细胞。
- 将100 μL的细胞溶液放入两个5mL聚苯乙烯FACS管中,并将管在冰上保持5分钟。
- 将1μL的生物素化山羊抗小鼠F(ab')2添加到每种细胞类型的一个管中。然后,将2μL的PE标记抗标记抗体(见材料表)添加到每种细胞类型的另一管中。混合好,并在冰上孵育30分钟。
- 在每个管中用3 mL的FACS缓冲液清洗细胞,并在300 x g下离心5分钟;丢弃上生物和涡流非常短暂或短暂地摇动管,以重新悬浮残余液体中的细胞。
- 在每个管中加入2μL的APC抗CD3和2μL的7-AAD抗体溶液(见材料表)。在沾有抗F(ab')2 Ab的细胞管中,加入1μL的PE标记链球菌。短暂混合,在冰上孵育管子30分钟以上。
- 使用 FACS 缓冲液再次洗涤细胞,如步骤 3.5 中所述,并为每个管添加额外的 200 μL 的 FACS 缓冲液。
- 使用流细胞测量分析细胞,首先在正向散射图中对 T 细胞进行浇注,然后在 CD3 与 7-AAD 图中对活细胞(7-AAD 负数)进行浇注。最后一步是分析反标记、反 ScFv 或反 F(ab')2与 CD3。
4. 实时细胞测定效力测定
注:根据制造商的建议条件执行 RTCA 测定。简而言之,首先在E-Plate的井中为目标细胞进行板,然后在第二天加入CAR T细胞。实时监测CAR T细胞对目标细胞的细胞化活性。T细胞和模拟转导T细胞(模拟CART细胞)用作负效应细胞控制。以下方案描述了粘附性肿瘤细胞系的体外实时细胞测定效力测定。
- 在 xCELLigence E-Plate 的每个孔中添加 100 μL 的目标细胞培养基,将板放在 xCELLigence 仪器内,并进行背景读数。然后,将E-Plate转移到组织培养罩进行细胞播种。
- 使用标准协议从培养装置中试穿目标癌细胞。然后将细胞转移到15 mL离心管中,并加入高达15 mL的新鲜培养基。在200 x g下通过离心将细胞细胞进行5分钟的细胞。丢弃上清液,加入5 mL的新鲜介质,并使用血清学移液器轻轻重新悬浮细胞颗粒。使用血细胞计和显微镜计算活细胞的密度。
- 适当调整细胞密度,然后将100升的细胞悬浮液添加到E-Plate的每个孔中。目标细胞数量通常为粘附细胞系(BxPC3、Hela-CD19和SKOV3)的10,000个细胞/孔,或30,000个细胞/孔(如Raji)的悬浮细胞(有关用抗体预涂孔以束缚液体癌细胞的详细信息,见下文)。
- 在室温下将 E-Plate 平衡 30 分钟,使细胞均匀地稳定在井底(这至关重要;不要跳过此步骤)。
- 将电子板放入细胞培养箱内的 xCELLigence 仪器中,开始测量阻抗(显示为细胞指数与时间)每隔 15 分钟自动进行。
- 第二天,准备效应器CAR T细胞。确保提前准备适当的对照(即Mock CAR T细胞、非转导控制T细胞和/或不相关的CAR T细胞),以确保所有细胞同时准备就绪。将效应器单元和控制单元调整到适当的密度,并准备连续稀释,以确保在步骤 9 中向每个孔中添加 100 μL 效应器细胞悬浮液时达到所需的 E:T 比率。
- 暂停 xCELLigence 数据采集,并将 E-Plate 从培养箱带到细胞培养罩。
- 从每个井中取出 100 μL 的介质。每口井的残留介质量现在为100 μL。
- 加入100 μL的连续稀释作用器CAR T细胞或其他控制细胞(即模拟CAR T细胞),以达到所需的E:T比。
- 在室温下将电子板平衡30分钟,使效应细胞稳定下来,然后将E-Plate放回xCELLigence仪器中。恢复数据采集。
- 如果需要,可以在关键时间点 xCELLigence 数据采集暂停并移除板,以便收集小样本,以便通过正交检测进行分析(即通过 ELISA 或流式细胞测定测量细胞因子生产)。
- 在 EGFR-GITR-CD3 CAR T 细胞实验中,使用 ELISA 套件测量 INF® 产量(按照制造商的说明进行操作;参见材料表)。
注意关于液体癌症的使用:用于测试非粘附血液学癌细胞,在添加细胞之前,E-Plate的孔首先涂上一种抗体,该抗体是针对癌细胞表面表达的抗原的特异性。对于Raji B细胞系,使用基于抗CD40的系绳试剂(参见材料表中的液体肿瘤杀灭测定试剂盒)。以下是涂覆板的过程: - 用系绳缓冲液稀释系绳试剂(抗CD40),至4μg/mL浓度。
- 在组织培养罩内工作,在 E-Plate 的每个孔中加入 50 μL 的稀释系绳试剂。将 E-Plate 放在室温下或 37°C 培养箱中 3 小时。
- 取出系绳试剂,用洗涤缓冲液至少清洗 E-Plate 2 倍。此时,E-Plate 已准备好播种拉吉目标细胞(30,000 个细胞/孔)。
- 继续执行步骤 4.1(上图)以执行该过程的其余部分。
结果
CAR 慢病毒制备和 CAR T 细胞生成和效力评估
CAR慢病毒制剂的分子是使用定量RT-PCR试剂盒(见材料表)根据制造商的协议确定的。滴定方案首先提取病毒RNA,然后测量慢病毒RNA拷贝数,表明传染性病毒颗粒的量。使用上述协议的一个150毫米的碟体产生的病毒的分度通常介于109-1010病毒拷贝/mL之间。图 2A显示了 RT-PCR 周期数与代表性定量 PCR 结果的信号强度。一旦病毒质量得到满足,当色度大于1 x 108 pfu/mL时,它被冻结,以便后续的T细胞转导。在CAR T细胞用慢病毒转导后,T细胞再培养12-14天,其密度保持在1 x 106至2 x 106细胞/mL左右。然后,在下游应用或冻结之前,使用流动细胞仪使用抗ScFv特异性抗体对CAR T细胞进行检查。图2B显示了一个好的代表性批次结果。使用抗ScFv抗体,约50%的CAR T细胞染色阳性(Q2 50.6%对T细胞1%),表明CAR在大约50%的T细胞中的表达。随后,在每批CAR T细胞被冷冻并准备好用于未来应用之前,对细胞分解进行了RTCA效力测定。CAR T 型电池设计、生成和评估过程的一个周期大约需要 1 个月。
CD22-CAR T细胞杀死拉吉淋巴瘤B细胞
抗CD40液体肿瘤系绳套件(见材料表)在4μg/mL的浓度下用于在37°C下涂覆3小时E-Plate。用系绳缓冲液清洗井后,B细胞淋巴瘤细胞以30,000个细胞/孔的密度添加到E-Plate中。在允许细胞沉降30分钟后,E-Plate被放回xCELLigence仪器内,并立即启动阻抗读数,以捕获细胞附着和增殖。第二天,要么添加CD22-CAR T细胞,要么添加Mock CAR T细胞,要么加入未转导的T细胞。在图3中,E:T比率为10:1,用于所有细胞类型。CD22阳性拉吉细胞,用CD22-CAR T细胞治疗,与阴性对照组(未转导T细胞和Mock CAR T细胞)相比,显示出显著的杀伤(绿色痕迹)。
CD47-CAR T细胞有效杀灭胰腺癌细胞
CD47是免疫球蛋白超级家族的跨膜表面糖蛋白。作为一种与细胞相关的蛋白质,它在血液学癌症(白血病、淋巴瘤和多发性骨髓瘤)和固体癌症(如卵巢癌、小细胞肺癌、胰腺癌、胶质细胞瘤)和其他类型的癌症中高度表达36、37。CD47也被称为对巨噬细胞的"不吃不吃"信号,这使得它成为某些癌症的潜在治疗靶点。CD47-CAR T细胞被生产并测试对BxPC3胰腺癌细胞,表达高浓度CD4738,39。BxPC3细胞在第1天以10,000个细胞/孔的密度在E-Plate中播种。实时监测显示,这些细胞在16小时后达到汇合。此时,CAR T 单元在 10:1 的 E:T 比率下添加(图 4A)。还添加了非转导T细胞和模拟CART细胞等控制效应细胞。结果清楚地表明,CD47-CAR T细胞选择性地杀死目标BxPC3细胞29。此外,图4B显示,将CD47-CAR T电池添加到空井时的阻抗信号大大低于目标BxPC3单元产生的阻抗信号。仅CD47-CAR T细胞的孔的细胞指数值达到最大值0.14,仅略高于来自介质的信号(0.02)。这表明,在这个异质杀伤测定中,阻抗信号几乎完全来自靶癌细胞。
GITR 域对 CAR T 细胞的共刺激
当在EGFR-GITR-CD3 CAR中表达时,GITR成本化域先前被报道增强EGFR阳性SKOV3癌细胞的杀灭,而不是EGFR阴性MCF-7癌细胞30。为了更好地阐明 GITR 域的作用,生成并测试了包含完整 GITR 域的 CAR 构造,或者已删除或重新排列域版本的 CAR 构造,并测试了该构造是否能够联合激活 CAR T 单元(图 5A)。图5B,C中的xCELLigence数据显示,GITR成本化域增强了EGFR阳性靶细胞的CAR T细胞杀灭,高于使用缺乏GITR域的原始CAR结构观察到的细胞杀伤。此外,从GITR域(氨基酸184-193)中删除10个氨基酸,废除了这种刺激活性。相反,在 CAR 构造中重新排列 GITR 域的相对位置对其刺激功能的影响较小。使用端点数据,作为T细胞激活的替代物的IFN®生产也证明了GITR域的刺激活性(图5B)。与单纯的"捕捉拍摄"的端点数据相比,xCELLigence仪器的连续阻抗曲线清楚地说明了不同处理的杀伤动力学的细微差异(图5C)。这里获得的结果与体内研究30的结果一致。
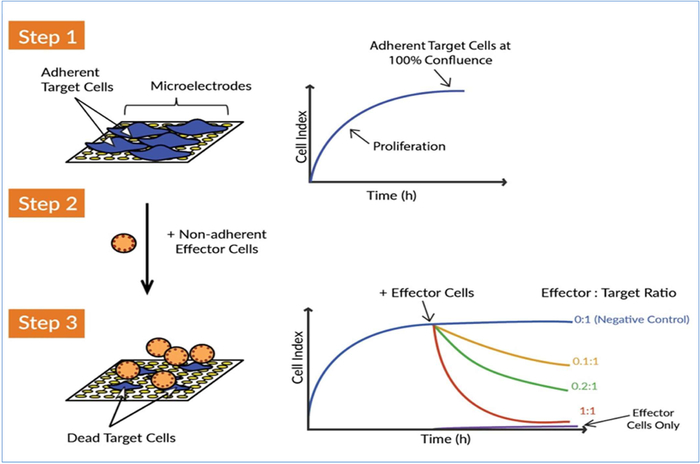
图1:xCELLigence实时细胞分析(RTCA)系统检测由效应细胞杀死目标细胞。测量CAR T效应细胞对靶癌细胞的杀伤活性有三个主要概念步骤。第1步:将目标细胞(即肿瘤细胞)播种到E-Plate的井中。细胞附着在金色生物传感器微电极上,这阻碍了电极之间的电流流动。此阻抗值被测量并绘制为称为细胞索引的无单位参数。细胞指数值随着细胞的生长和到达高原而随着细胞接近汇合而增大。步骤2:效应细胞-非附着免疫细胞-随后添加。由于这些电池不粘附在金微电极上,因此不会直接导致阻抗变化。第3步:如果效应细胞攻击目标癌细胞,肿瘤细胞的破坏会随着时间而减少。效应细胞的这种细胞解欲活性,或效应细胞的效力,可以敏感和精确地监测。从 xCELLigence 系统连续采集阻抗数据,可同时对多个条件进行实时杀伤动力学分析。请点击此处查看此图的较大版本。
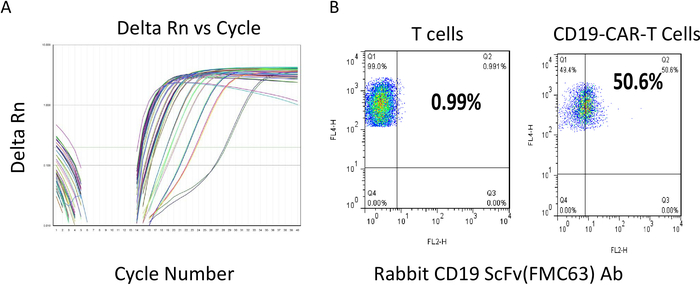
图2:对CAR T细胞的扁豆病毒和流式细胞测定进行蒂特测定。(A) 伦蒂病毒定位剂。不同的颜色线是周期数与增量Rn的代表性样本。(B) 转导后,CAR T 细胞被培养并保持在密度小于2 x 106细胞/mL,然后进行流动分析。y轴反映 T 细胞的染色,正值反映在区域 Q1 和 Q2 中。两个样本对T细胞均为100%阳性。CAR scFV 的表达式使用特定于 scFv 的Ab(x轴)确定。结果表明,CD22-CAR T细胞中超过50%的T细胞scFv阳性。请点击此处查看此图的较大版本。
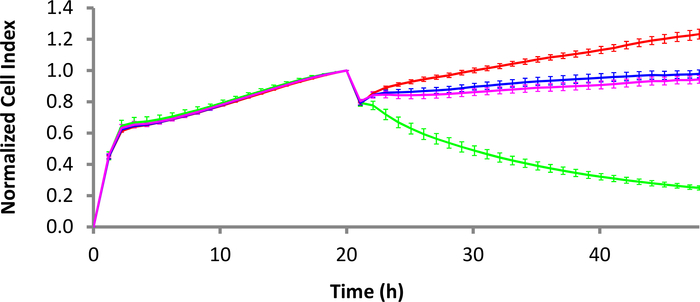
图3:杀死CD22-CAR T细胞对拉吉·伯基特淋巴瘤细胞的动力学。红色曲线是拉吉细胞本身,绿色曲线是使用 CD22-CAR T 细胞处理的拉吉细胞。粉红色和蓝色曲线分别是Mock CAR T细胞治疗和非转导式T细胞治疗。E:T 比率为 10:1。误差条是标准偏差。时间刻度以 2 小时间隔设置,便于显示,尽管有更多的数据点可用。请点击此处查看此图的较大版本。
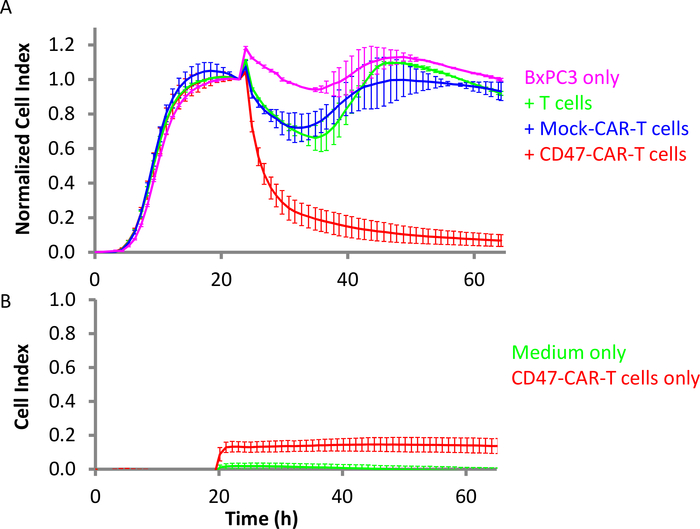
图4:CD47-CAR T细胞对胰腺固体肿瘤细胞的疗效。(A) 粉红是目标 BxPC3 细胞本身, 而红色是 BxPC3 与 CD47-CAR T 细胞添加.绿色是BxPC3与添加非转导T细胞,蓝色是与模拟CART细胞。E:T 比率为 10:1。(B) 在同一设置中,红色为空(缺少目标细胞)控制井,仅 CD47-CAR T 细胞,绿色仅为介质。误差条是标准偏差。请点击此处查看此图的较大版本。
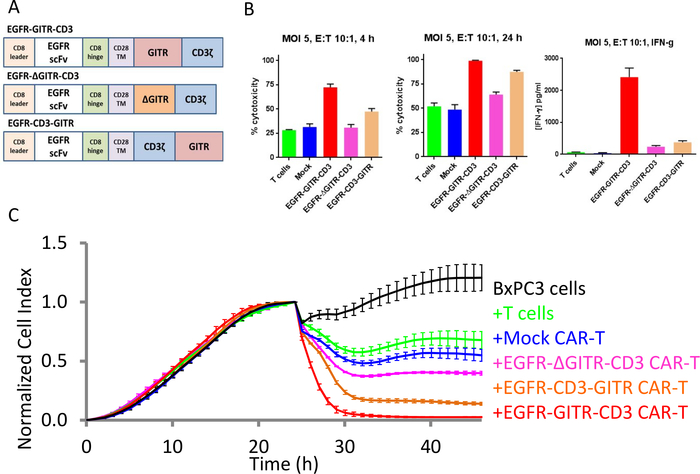
图5:GITR域增加CAR T细胞毒性对EGFR阳性肿瘤细胞系的活性。(A) 不同的 CAR 构造.(B) 4 小时(左)和 24 小时(中)不同 CAR 构造的% 细胞解解的条形图。24 小时时,右侧显示 IFN® 生产。(C) 对所有构造的连续杀伤评估。黑色曲线仅是BxPC3卵巢癌细胞的生长曲线。绿色曲线是仅用T细胞处理的目标细胞,蓝色曲线是用Mock CAR T细胞处理的目标细胞,红色曲线是使用EGFR-GITR-CD3-CAR T细胞处理的目标细胞,粉红色曲线是使用EGFR-+GITR-CD3-CAR T细胞处理的目标细胞,棕色曲线是使用EGFR-CD3-GITR-CAR T细胞处理的目标细胞。请点击此处查看此图的较大版本。
讨论
奇美抗原受体是由细胞外单链可变片段(scFv区域)、铰链区、跨膜区域和细胞质域组成的多域蛋白,由来自CD28和OX4011、40等受体的TCR信号域和附加成本化域组成。为了设计安全、选择性和有效 CARs,必须使用体外效力测定以及最终的动物模型对 CARs 设计中的各种排列进行彻底测试。在这项研究中,我们为实时体外效力测定如何为有效CARs的设计提供信息提供了一个协议和工作流程。
在设计任何类型的效力测定,特别是用于制造目的时,必须使测定具有敏感性、稳健性、一致性,并尽可能接近作用机制16、17、41。此处描述的实时效力测定旨在直接测量 CAR T 细胞的细胞解物活性,而不是使用代位标记物(如细胞因子释放)。重要的是,除了测定板(E-Plate)和用于维持细胞的推荐介质外,该测定不需要任何额外的成分,如染料或试剂。此外,与其他基于标签的测定42、43、44相比,该测定具有极其灵敏的灵敏度,提供高度可重复的数据。此外,xCELLigence 测定适用于使用极低的效应器与目标比,这是评估特定细胞测定的理想选择。
为了证明xCELLigence系统的灵活性和实用性,我们重点研究了两种肿瘤类型,即血液源肿瘤和实体肿瘤。为了评估CD22定向CAR T细胞的效力,Raji细胞(即B细胞淋巴瘤细胞系)使用抗CD40抗体系在E-Plates上。将 Raji 细胞与 E-Plates 底部连接,会产生阻抗信号,反映井中 Raji 细胞的存活性和数量。在加入CD22-CAR T细胞后,拉吉细胞以时间与效应素相关的方式选择性地杀死,最终导致阻抗信号的时间依赖性降低。阻抗的下降表示拉吉细胞17的细胞化或生存能力丧失。这种使用抗体的选择性系绳方法可以扩展到其他液体肿瘤细胞系。使用血液学来源的肿瘤细胞系的另一种策略是使用粘附癌细胞,这些癌细胞被设计为能稳稳地表达肿瘤抗原,如在HeLa细胞中表达的CD19。这种方法的优点是,亲HeLa细胞是现成的,并可用作负控制特异性。这种方法已经验证与CHO-CD22vsCHO细胞和CHO-BCMAs对CHO细胞29。使用这种不同的方法,CAR T细胞的设计和有效性可以很容易地测试。xCELLigence 测定具有固有的灵活性,可以调整测定条件,以最大限度地近似生理条件。
我们在这里描述的效力测定的一个主要优点是,它是一种简单的功能测定,可与基因工程技术结合使用,以高通量方式设计最佳且有效的 CAR。如此处所示,针对EGFR阳性癌细胞的CAR T细胞,该测定可用于评估不同CAR结构/突变体的相对活性。例如,我们表明,当 GITR 域位于 CD3 域的上游时,它比 CD3 域下游的细胞解解活性要强得多。
虽然它与体内CAR T细胞活性不完全相关,但体外细胞因子释放历来被用作衡量CAR T细胞效力的指标。尽管此处描述的基于 xCELLigence 的药效测定可用于在制造期间或发布用于临床应用之前评估基于细胞的疗法,但这些结果与体内疗效的关联程度尚未建立。体内的功效取决于一系列因素和变量,这些因素和变量在体外测定中可能无法重述。这些变量包括:将CAR T细胞定位到肿瘤部位,刺激和激活CAR T细胞及其在患者体内的持续存在能力,以及肿瘤微环境。通过进一步改进,xCELLigence 测定可能能够在体外对其中一些复杂过程进行建模。
此处提供的方案适用于大多数粘附性癌细胞系和一些液体肿瘤细胞系。然而,由于肿瘤类型和阶段的复杂性,临床样本,如原发性癌细胞,需要进一步测试和优化。值得注意的是,这里描述的体外效力测定系统只使用癌细胞系来反映CAR T细胞的潜在活性。人体内部的真实肿瘤情况更为复杂,特别是由于肿瘤动态环境和发展,当实体肿瘤被靶向时。因此,效力评估结果可能不会很好地转化为测试的CAR T细胞的临床疗效。
总之,基于阻抗的xCELLigence平台允许对细胞杀灭进行长时间无标签的监测,即长达10天。这种用于数据收集的长时间尺度的能力使该技术与当前使用的其他检测技术不同,后者需要为时间点收集和耗时的样本操作设置多个实验复制。此外,效应器免疫细胞的最小信号贡献简化了数据分析。该软件可以自动处理数据并生成有用的参数,如细胞分析的百分比,KT50等。该技术已经显示出高灵敏度(E:T比率低至1:20)和较大的动态范围(E:T比率从20:1到1:20),这在其他测定中不容易实现。总体而言,该技术的实施应能以更高的吞吐量规模进行更准确的数据分析,从而促进CAR T细胞试剂的开发,从而以更高的速度推进该领域的发展。
披露声明
作者分别对ProMab生物技术和ACEA生物科学的商业利益进行了CAR T细胞开发及相关效力测定的研究。然而,这并没有改变作者对JoVE增加科学知识传播使命的坚持。本出版物的条款已由 ProMab 生物技术公司和 ACEA 生物科学公司根据其研究政策进行审查和批准。
致谢
作者感谢ProMab生物技术和ACEA生物科学提供了在这项研究中使用的试剂和仪器。
材料
| Name | Company | Catalog Number | Comments |
| 7-AAD | Biolegend | 420404 | |
| Anti-CD40, liquid tumor killing assay kit | ACEA Biosciences | 8100005 | |
| anti-human F(ab')2 | Jackson Immunoresearch laboratories. | 109-116-088 | |
| APC anti-CD3 | Biolegend | 317318 | |
| Assay medium RPMI1640 | life technologies.Corp | 11875-093 | |
| CAR-T cell frozen solution CryostorCS10 | Stemcell technologies | #07930 | |
| CAR-T cell medium from ProMab | AIM-V+300IFU/ml IL-2 | 12055-091 | |
| CD3/CD28 coated microbeads, Dynabeads | Thermofisher | 11131D | |
| DMEM | GElifesciences.com | SH30243.02 | |
| FACS buffer | Promab made | ||
| FBS | Lonza.com | 14-503F | |
| HEK293FT | Thermo Fisher | R70007 | |
| INFg ELISA kit | Thermo Fisher | ||
| Lentiviral Packaging Mix | System Biosciences | VP100 | |
| Lenti-X quantitative RT-PCR titration kit (Clontech) | Takara | 631235 | |
| Promab medium for target cells | Varied with cell lines | ||
| Real time Cellular Analyer | ACEA Biosciences | ||
| Thermal cycler | Thermo Fisher | ||
| Transduction enhance agent, Virus Transduction Enhancer (Alstem) | Transplus, Alstem | V020 | |
| Transfection dilution solution, Opti-MEM | Thermo Fisher | ||
| Transfection reagent, NanoFect reagent | Alstem | NF100 |
参考文献
- Miliotou, A. N., Papadopoulou, L. C. CAR T-cell Therapy: A New Era in Cancer Immunotherapy. Current Pharmaceutical Biotechnology. 19 (1), 5-18 (2018).
- June, C. H., O’Connor, R. S., Kawalekar, O. U., Ghassemi, S., Milone, M. C. CAR T cell immunotherapy for human cancer. Science. 359 (6382), 1361-1365 (2018).
- . FDA approval brings first gene therapy to the United States Available from: https://www.fda.gov/NewsEvents/Newsroom/PressAnnouncements/ucm574058.htm (2017)
- . FDA approves CAR-T cell therapy to treat adults with certain types of large B-cell lymphoma Available from: https://www.fda.gov/newsevents/newsroom/pressannouncements/ucm581216.htm (2017)
- Liu, B., Song, Y., Liu, D. Clinical trials of CAR-T cells in China. Journal of Hematology & Oncology. 10 (1), 166 (2017).
- Fry, T. J., et al. CD22-targeted CAR T cells induce remission in B-ALL that is naive or resistant to CD19-targeted CAR immunotherapy. Nature Medicine. 24 (1), 20-28 (2018).
- Yang, Y., Jacoby, E., Fry, T. J. Challenges and opportunities of allogeneic donor-derived CAR T cells. Current Opinion in Hematology. 22 (6), 509-515 (2015).
- . Celyad Announces FDA Acceptance of IND Application for CYAD-101, a First-in-Class Non-Gene Edited Allogeneic CAR-T Candidate Available from: https://www.celyad.com/en/news/celyad-announces-fda-acceptance-of-ind-application-for-cyad-101-a-first-in-class-non-gene-edited-allogeneic-car-t-candidate (2017)
- Sheridan, C. Allogene and Celularity move CAR-T therapy off the shelf. Nature Biotechnology. 36 (5), 375-377 (2018).
- D’Aloia, M. M., Zizzari, I. G., Sacchetti, B., Pierelli, L., Alimandi, M. CAR-T cells: the long and winding road to solid tumors. Cell Death & Disease. 9 (3), 282 (2018).
- Xu, J., et al. Combination therapy: A feasibility strategy for CAR-T cell therapy in the treatment of solid tumors. Oncology Letters. 16 (2), 2063-2070 (2018).
- Xia, A. L., Wang, X. C., Lu, Y. J., Lu, X. J., Sun, B. Chimeric-antigen receptor T (CAR-T) cell therapy for solid tumors: challenges and opportunities. Oncotarget. 8 (52), 90521-90531 (2017).
- Yong, C. S. M., et al. CAR T-cell therapy of solid tumors. Immunology and Cell Biology. 95 (4), 356-363 (2017).
- Newick, K., O'Brien, S., Moon, E., Albelda, S. M. CAR T Cell Therapy for Solid Tumors. Annual Review of Medicine. 68, 139-152 (2017).
- de Wolf, C., van de Bovenkamp, M., Hoefnagel, M. Regulatory perspective on in vitro potency assays for human mesenchymal stromal cells used in immunotherapy. Cytotherapy. 19 (7), 784-797 (2017).
- Cerignoli, F., et al. In vitro immunotherapy potency assays using real-time cell analysis. PLOS ONE. , (2018).
- Holden, H. T., Oldham, R. K., Ortaldo, J. R., Herberman, R. B. Standardization of the chromium-51 release, cell-mediated cytotoxicity assay: cryopreservation of mouse effector and target cells. Journal of the National Cancer Institute. 58 (3), 611-622 (1977).
- Somanchi, S. S., McCulley, K. J., Somanchi, A., Chan, L. L., Lee, D. A. A Novel Method for Assessment of Natural Killer Cell Cytotoxicity Using Image Cytometry. PLOS ONE. 10 (10), e0141074 (2015).
- Mukherjee, M., Mace, E. M., Carisey, A. F., Ahmed, N., Orange, J. S. Quantitative Imaging Approaches to Study the CAR Immunological Synapse. Molecular Therapy: The Journal of the American Society of Gene Therapy. 25 (8), 1757-1768 (2017).
- Zaritskaya, L., Shurin, M. R., Sayers, T. J., Malyguine, A. M. New flow cytometric assays for monitoring cell-mediated cytotoxicity. Expert Review of Vaccines. 9 (6), 601-616 (2010).
- Nelson, D. L., Kurman, C. C., Serbousek, D. E. Chapter 7, Unit 7: 51Cr release assay of antibody-dependent cell-mediated cytotoxicity (ADCC). Current Protocols in Immunology. , 27 (2001).
- Abassi, Y. A., et al. Label-free, real-time monitoring of IgE-mediated mast cell activation on microelectronic cell sensor arrays. Journal of Immunological Methods. 292 (1-2), 195-205 (2004).
- Glamann, J., Hansen, A. J. Dynamic detection of natural killer cell-mediated cytotoxicity and cell adhesion by electrical impedance measurements. Assay and Drug Development Technologies. 4 (5), 555-563 (2006).
- Solly, K., Wang, X., Xu, X., Strulovici, B., Zheng, W. Application of real-time cell electronic sensing (RT-CES) technology to cell-based assays. Assay and Drug Development Technologies. 2 (4), 363-372 (2004).
- Zhu, J., Wang, X., Xu, X., Abassi, Y. A. Dynamic and label-free monitoring of natural killer cell cytotoxic activity using electronic cell sensor arrays. Journal of Immunological Methods. 309 (1-2), 25-33 (2006).
- Ke, N., Wang, X., Xu, X., Abassi, Y. A. The xCELLigence system for real-time and label-free monitoring of cell viability. Methods in Molecular Biology. 740, 33-43 (2011).
- Lamarche, B. J., Xi, B., Cerignoli, F. Quantifying the Potency of Cancer Immunotherapies: Immune Cell-Mediated Killing Kinetics and Efficacy Analysis in Real-Time without the Use of Labels. Genetic Engineering & Biotechnology News (GEN). 36 (14), 18-19 (2016).
- Golubovskaya, V., et al. CD47-CAR-T Cells Effectively Kill Target Cancer Cells and Block Pancreatic Tumor Growth. Cancers. 9 (10), (2017).
- Golubovskaya, V. M., et al. GITR domain inside CAR co-stimulates activity of CAR-T cells against cancer. Frontiers in Bioscience. 23, 2245-2254 (2018).
- Guedan, S., et al. Enhancing CAR T cell persistence through ICOS and 4-1BB costimulation. JCI Insight. 3 (1), (2018).
- Erskine, C. L., Henle, A. M., Knutson, K. L. Determining optimal cytotoxic activity of human Her2neu specific CD8 T cells by comparing the Cr51 release assay to the xCELLigence system. Journal of Visualized Experiments. (66), e3683 (2012).
- Davenport, A. J., et al. CAR-T Cells Inflict Sequential Killing of Multiple Tumor Target Cells. Cancer Immunology Research. 3 (5), 483-494 (2015).
- Hegde, M., et al. Tandem CAR T cells targeting HER2 and IL13Ralpha2 mitigate tumor antigen escape. The Journal of Clinical Investigation. 126 (8), 3036-3052 (2016).
- Jin, J., et al. Enhanced clinical-scale manufacturing of TCR transduced T-cells using closed culture system modules. Journal of Translational Medicine. 16 (1), 13 (2018).
- Weiskopf, K. Cancer immunotherapy targeting the CD47/SIRPalpha axis. European Journal of Cancer. 76, 100-109 (2017).
- Huang, Y., Ma, Y., Gao, P., Yao, Z. Targeting CD47: the achievements and concerns of current studies on cancer immunotherapy. Journal of Thoracic Disease. 9 (2), E168-E174 (2017).
- Ma, S., Thorpe, P., Vitetta, E., Meyer, J. Combined targeting of exposed phosphatidylserine, CD47 and CD54 on human pancreatic tumor cells in a mouse xenograft model of human pancreatic cancer (P4455). The Journal of Immunology. 190 (1 Supplement), (2013).
- Yamamoto, K., et al. Emergence of CD47- high expression cells confers enhanced tumorigenicity upon KDM6B suppression in pancreatic cancer. Cancer Research. 76 (2 Supplement), (2016).
- Xu, D., et al. The development of CAR design for tumor CAR-T cell therapy. Oncotarget. 9 (17), 13991-14004 (2018).
- FDA. . Guidance for Industry, Potency Tests for Cellular and Gene Therapy Products. , (2017).
- Limame, R., et al. Comparative analysis of dynamic cell viability, migration and invasion assessments by novel real-time technology and classic endpoint assays. PLOS ONE. 7 (10), e46536 (2012).
- Chiu, C. H., et al. Comparison between xCELLigence biosensor technology and conventional cell culture system for real-time monitoring human tenocytes proliferation and drugs cytotoxicity screening. Journal of Orthopaedic Surgery and Research. 12 (1), 149 (2017).
- Hillger, J. M., Lieuw, W. L., Heitman, L. H., IJzerman, A. P. Label-free technology and patient cells: from early drug development to precision medicine. Drug Discovery Today. 22 (12), 1808-1815 (2017).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。