Method Article
Ein Echtzeit-Potenz-Assay für chimerantigene Antigen-Rezeptor-T-Zellen, die auf feste und hämatologische Krebszellen abzielen
In diesem Artikel
Zusammenfassung
Wir beschreiben ein quantitatives Echtzeit-In-vitro-Zytolyse-Assay-System zur Bewertung der Wirksamkeit von chimeric antigenen Antigen-Rezeptor-T-Zellen, die auf flüssige und solide Tumorzellen abzielen. Dieses Protokoll kann erweitert werden, um andere Immuneffektorzellen sowie Kombinationsbehandlungen zu bewerten.
Zusammenfassung
Chimeric Antigen-Rezeptor (CAR) T-Zell-Therapie für Krebs hat signifikanten klinischen Nutzen für resistente und refraktäre hämatologische Malignitäten wie akute lymphatische Leukämie im Kindesalter erreicht. Derzeit wird versucht, diese vielversprechende Therapie zusätzlich zu anderen hämatologischen Krebsarten auf solide Tumoren auszudehnen. Hier beschreiben wir die Entwicklung und Produktion potenter CAR-T-Zellen, die auf Antigene mit einzigartiger oder bevorzugter Expression auf festen und flüssigen Tumorzellen abzielen. Die In-vitro-Potenz dieser CAR-T-Zellen wird dann in Echtzeit mit dem hochempfindlichen Impedanz-basierten xCELLigence-Assay ausgewertet. Insbesondere wird der Einfluss verschiedener kostenimulatorischer Signalisierungsdomänen, wie z. B. Glukokortikoid-induzierter Tumornekrosefaktorrezeptor (TNFR)-bezogenes Protein (GITR), auf die In-vitro-Potenz von CAR-T-Zellen untersucht. Dieser Bericht enthält Protokolle für: Generierung von CAR-T-Zellen für präklinische Studien mit lentiviraler Gentransduktion, Erweiterung von CAR-T-Zellen, Validierung der CAR-Expression und Ausführung und Analyse von xCELLigence-Potenztests.
Einleitung
In den letzten Jahren war die CAR-T-Zelltherapie einer der prominentesten Durchbrüche in der Krebsimmuntherapie bei rezidivierenden und refraktären hämatopoetischen Malignitäten. Mit den jüngsten US-Amerikanischen Die Zulassung von CD19-gerichteten CAR-T-Zellen für akute lymphoblastische Leukämie, Non-Hodgkin-Lymphom und diffuses großes B-Zell-Lymphom sowie die Bezeichnung einer bahnbrechenden Therapie für B-Zell-Reifungsantigen (BCMA) gerichtete CAR-T-Zellen für multiples Myelom, diese Technologie hat große Aufregung in der wissenschaftlichen Gemeinschaft erzeugt und zahlreiche grundlegende, angewandte und klinische Studien weltweitbefeuert. 4,5. Im Januar 2019 wurden mehr als 700 klinische Studien in der klinischen Studiendatenbank registriert (clinicaltrials.gov); etwa 450 dieser Studien standen kurz vor dem Beginn oder rekrutierten aktiv Patienten. Die meisten klinischen Studien konzentrieren sich auf hämatologische Malignitäten, und klinische Studien, die CAR-T-Zellen verwenden, die auf CD20, CD22 und BCMAs abzielen, sowie CD19, sind im Gange6,7. Während die meisten Studien autologe CAR T-Zell-Therapie verwenden, eine signifikante Anzahl von ihnen sind auch die Erforschung der Nützlichkeit der allogenen CAR T-Zellen8,9,10. Trotz vielversprechender Ergebnisse mit hämatologischen Malignitäten hat sich die Verwendung von CAR-T-Zellen zur Zielart ierung sturer Tumoren in der Klinik aus einer Vielzahl von Gründen als viel schwieriger erwiesen, einschließlich, aber nicht beschränkt auf das Fehlen guter Ziele, die ausschließlich im Tumor exprimiert werden, die Heterogenität von soliden Tumoren und Tumor "Flucht", und die Schwierigkeit, die CAR-T-Zellen beim Zugang zum Tumor Mikroumfeld haben11,12,13,14, 15. Es besteht ein kritischer Bedarf für die Entwicklung solider tumorspezifischer CAR-T-Zellen, die diese Wirksamkeitsbarrieren und das Problem der "Ziel-Off-Tumor"-Toxizität überwinden können. Während eine Vielzahl von In-vitro- und In-vivo-Ansätzen bei der Entwicklung und Erprobung von CAR-T-Zellen gerechtfertigt sind, ist ein robuster und prädiktiver In-vitro-Potenztest von primärer Bedeutung16,17.
Um die Wirksamkeit von CAR-T-Zellen zu bewerten, wurden verschiedene In-vitro-Methoden entwickelt. Im Allgemeinen können diese Potenz-Assays in zwei große Kategorien unterteilt werden, je nachdem, ob sie (i) direkt die zytolytische Aktivität von CAR-T-Zellen gegen Zieltumorzellen messen oder (ii) Ersatzmarker wie Zytokine messen, die von den CAR-T-Zellen freigesetzt werden, wenn sie die Zielzellen abtöten. Techniken, die die zytolytische Aktivität direkt messen, umfassen den Chrom-51-Freisetzungstest (CRA)18, bildgebende Assays, die die Apoptose von Zielzellen mit Fluoreszenzsonden19,20, und Flow-Zytometrie-Assays messen, die apoptotische Zielzellen erkennen21. In diesen Assays werden CAR-T-Zellen in der Regel mit Zielzellen kokultiviert, die mit radioaktiven oder fluoreszierenden Sonden vorbeschriftet wurden, gefolgt von einer entsprechenden Messung. Obwohl es wegen seiner Sensibilität seit langem als Goldstandard auf dem Feld gilt, hat die Ratingagentur einige Nachteile. Erstens ist es ein Endpunkt-Assay und liefert keine kinetischen Informationen. Zweitens müssen die Zielzellen mit Chrom-51 beschriftet werden, das dazu neigt, aus den Zellen auszulaugen und das Hintergrundrauschen deutlich zu erhöhen22. Schließlich erfordert sie angemessene Vorsichtsmaßnahmen und die Entsorgung der radioaktiven Abfälle. Alternative Assays, die Nebenprodukte der CAR-T-Zell-Interaktion mit Zielzellen als Indikation für die Wirksamkeit messen, umfassen die Quantifizierung verschiedener Zytokine, die von CAR-T-Zellen mit entweder Strömungszytometrie-basierten Methoden oder enzymgebundenen Immunsorbent-Assays freigesetzt werden. Auch hier handelt es sich um Endpunkt-Assays, die die kumulative Freisetzung der Zytokine zu einem bestimmten Zeitpunkt messen und daher nicht unbedingt die tatsächliche zytolytische Aktivität der CAR-T-Zellen widerspiegeln.
Bei der Entwicklung eines Potenz-Assays, insbesondere eines, der die Freisetzungskriterien für eine zellbasierte Therapie wie eine CAR-T-Zelle definiert, ist es entscheidend, dass der Assay minimale Manipulationen und praktische Zeit beinhaltet, da jede Interaktion eine weitere Variable ist, die berücksichtigt werden muss und die allgemeine Robustheit und Konsistenz des Assays verringern kann. Darüber hinaus ist die Interaktion von CAR-T-Zellen mit den Tumorzellen ein dynamischer Prozess, und die Bereitstellung von Informationen über diese dynamischen Wechselwirkungen, wie die Zytolyserate, ist von primärer Bedeutung für die Potenzbewertung. Unter Berücksichtigung dieser Kriterien haben wir einen etikettenfreien kinetischen Potenztest für CAR T-Zellen entwickelt, der die xCELLigence-Echtzeit-Zellanalyseplattform (RTCA) nutzt. xCELLigence verwendet spezielle Mikrotiterplatten (E-Plates), die Goldbiosensoren enthalten, die in den Boden jedes Brunnens eingebettet sind. Diese Biosensoren arbeiten entweder mit anhaftenden soliden Tumorzellen oder flüssigen Krebszellen, die mit spezifischen Antikörpern verbunden wurden, und überwachen in Echtzeit CAR T-Zell-induzierte Veränderungen der Zielzellzahl, der Zellgröße, der Zellsubstrat-Anhaftungsfestigkeit und der Zell-Zell-Wechselwirkungen (d. h. der Barrierefunktion)17,23,24,25,26,27,28. Der Workflow ist einfach und beinhaltet das einfache Aussaat der Zielzellen in die Brunnen von E-Plates, gefolgt von der Addition der CAR-T-Zellen mit unterschiedlichen Effektor-Ziel-Verhältnissen (Abbildung 1). Da die Biosensoren kontinuierlich die Lebensfähigkeit der Zielzellen überwachen, werden die Daten automatisch in Echtzeit angezeigt.
In den letzten 15 Jahren wurde der xCELLigence-Assay für die Beurteilung der Wirksamkeit von natürlichen Killerzellen (NK) Zellen, T-Zellen, CAR-T-Zellen, Checkpoint-Inhibitoren, bispezifischen Antikörpern, onkolytischen Viren und einigen Kombinationstherapien17,29,30,31,32,33,34. Kürzlich wurde der xCELLigence Potenztest für die Herstellung von T-Zell-Rezeptor (TCR)-entwickelten T-Zellen35ausgewertet. Hier berichten wir über das RTCA-System zur Bewertung der In-vitro-Potenz von CAR-T-Zellen, die auf solide Und flüssige Tumoren in klinischen Therapien abzielen.
Protokoll
1. Generierung des CAR-kodierenden Lentivirus
HINWEIS: Sobald die spezifische CAR-T-Zell-Plasmidkonstruktion (CD47 u.a.) abgeschlossen ist, werden lentivirale CARs nach dem Standardverfahren mit 293 FT-Zellen, einem lentiviralen Verpackungsmix und Transfektionsmitteln (siehe Tabelle der Materialien) erzeugt, wie beschrieben29. Anschließend verwenden Sie ein quantitatives Reverse-Transkriptions-Polymerase-Kettenreaktionskit (RT-PCR) und einen thermischen Cycler (siehe Materialtabelle), um den Virustiter zu bestimmen, indem sie die lentivirale RNA-Menge gemäß dem Herstellerprotokoll messen. Es ist wichtig, dass alle lentiviralen Verfahren streng nach den Sicherheitsanforderungen durchgeführt werden.
- Samen 15 x 106 HEK293FT-Zellen in Dulbeccos modifiziertem Eagle-Medium (DMEM) und bebrüten die Zellen über Nacht bei 37 °C in einer 150-mm-Schale in einem befeuchteten 5% CO2-Inkubator.
- Bereiten Sie zwei 15 ml Rohre mit Transfektionskomplex vor. Die erste Röhre enthält lentivirale Vektorplasmid-DNA (5 g) und lentivirale Verpackungsmischung (22,5 g) in 2,5 ml Transfektionsverdünnungslösung. Das zweite Rohr enthält 82,5 l Transfektionsreagenz in 2,5 ml Transfektionsverdünnungslösung (siehe Materialtabelle).
- Den Inhalt von Rohr 1 in Rohr 2 pfeifen und das Gemisch bei Raumtemperatur 15 min inkubieren.
- Übertragen Sie den Inhalt des Rohres tropfenweise auf die Schale der HEK293FT-Zellen und inkubieren Sie die Probe über Nacht bei 37 °C in einem befeuchteten 5% CO2-Inkubator.
- Ersetzen Sie am nächsten Tag das bestehende Medium durch 19 ml frisches DMEM-Kulturmedium und bebrüten die Zellen über Nacht im befeuchteten 5%CO2-Inkubator bei 37 °C.
- Übertragen Sie das Medium von der Schale auf ein 50 ml Zentrifugenrohr. Bewahren Sie die Röhre mit dem virenhaltigen Medium im Kühlschrank auf.
- Wiederholen Sie den obigen Vorgang, fügen Sie frisches DMEM hinzu und sammeln Sie es nach 1 Tag erneut.
- Kombinieren Sie zwei Sammlungen der Medien in einem Zentrifugenrohr. Zentrieren Sie das Rohr bei 2.000 x g für 30 min bei 4 °C.
- Übertragen Sie den größten Teil des Lentivirus-haltigen Überstandes auf ein ultraklares Zentrifugenrohr. Lassen Sie ein Mindestvolumen, etwa 1 ml, des Überstandes, um zu vermeiden, dass das Pellet, das Zellen und/oder Schmutz enthalten kann, gestört wird.
- Ultrazentrifugieren Sie den oben geklärten Überstand bei 110.000 x g für 100 min bei 4 °C.
- Entfernen Sie den Überstand sorgfältig und fügen Sie dem Viruspellet am Rohrboden vorsichtig 100 L DMEM-Medium hinzu. Lassen Sie die Röhre 15 min auf Eis. Mischen Sie die Lösung sanft und aliquotieren Sie die Lentivirus-Lösung in vorgekühlte sterile Schläuche. Bewahren Sie diese Virusstockröhren in einem -80 °C-Gefrierschrank auf.
- Verwenden Sie ein quantitatives RT-PCR-Kit, um den Titer des Lentivirus gemäß dem Herstellerprotokoll zu bestimmen, das lentivirale RNA extrahiert und misst.
2. Erzeugung und Erweiterung von CAR-T-Zellen
- Aktivieren Sie zuvor gefrorene menschliche PBMCs (ca. 1 x 106 bis 2 x 106 Zellen) in 1 ml CAR T-Zellmedium mit einer gleichen Anzahl von CD3/CD28-beschichteten Mikroperlen (siehe Materialtabelle)und inkubieren Sie die Zellen bei 37 °C in einem befeuchteten 5%CO2-Inkubator für 24 h.
- Tauen Sie ein Aliquot des Lentivirus-Bestands auf Eis.
- Fügen Sie 1 L Transduktions-Enhance-Agent in den Brunnen mit den Zellen und mischen.
- Fügen Sie lentivirus zu den Zellen bei einer Vielzahl von Infektionen (MOI) von 5:1 und mischen Sie sanft. Wiederholen Sie am nächsten Tag diesen Schritt (24 h nach der ersten Transduktion).
- Überwachen Sie das Wachstum der T-Zellen alle 2-3 Tage. Fügen Sie weitere frische CAR T-Zellen Medium, um die Zellen mit einer Dichte von 1 x 106 bis 2 x 106 Zellen/ml zu halten.
- Einfrieren der CAR-T-Zellen mit einem Standardprotokoll mit Gefrierlösung (siehe Materialtabelle).
- CAR-T-Zellen mit einer Standardmethode auftauen und im CAR-T-Zellmedium für ca. 2-4 h mit IL-2 (300 Einheiten/ml) präkulturieren, bevor sie sie auf den Test anwenden.
3. Detektion der CAR-Expression durch Durchflusszytometrie
- Übertragen Sie 3 x 105 CAR-T-Zellen und nicht transduzierte T-Zellen in zwei separate 1,5 ml Mikrozentrifugenröhren.
- Zentrifugieren Sie die Röhrchen bei 300 x g für 2 min und setzen Sie die Zellen in 200 l Fluoreszenz-aktivierten Zellsortierungspuffer (FACS) mit 1% menschlichem Serum wieder aus.
- Pipetten Sie 100 l Zelllösung in zwei 5 ml Polystyrol FACS-Rohre und halten Sie die Rohre auf Eis für 5 min.
- Fügen Sie 1 l biotinylierte Ziege Anti-Maus F(ab')2 zu einem Röhrchen jedes Zelltyps hinzu. Fügen Sie dann dem anderen Röhrchen jedes Zelltyps 2 L PE-beschrifteten Anti-Tag-Antikörper (siehe Materialtabelle)hinzu. Gut mischen und 30 min auf Eis bebrüten.
- Waschen Sie die Zellen mit 3 ml FACS Puffer in jedem Rohr und zentrifugieren Sie die Rohre bei 300 x g für 5 min; Die Überräube und den Wirbel sehr kurz entsorgen oder die Rohre kurz schütteln, um die Zellen in der Restflüssigkeit wieder aufzuhängen.
- Fügen Sie jedem Rohr 2 L APC-Anti-CD3 und 2 l 7-AAD-Antikörperlösung (siehe Materialtabelle)hinzu. In die Röhre von Zellen, die mit Anti-F(ab')2 Ab gefärbt sind, fügen Sie 1 l PE-markiertes Streptavidin hinzu. Kurz mischen und die Rohre auf Eis für 30 weitere min inkubieren.
- Verwenden Sie den FACS-Puffer, um die Zellen erneut zu waschen, wie in Schritt 3.5 beschrieben, und fügen Sie jedem Rohr einen zusätzlichen FACS-Puffer von 200 L hinzu.
- Verwenden Sie die Durchflusszytometrie, um die Zellen zu analysieren, indem Sie zuerst auf die T-Zellen in einem Vorwärtsstreuungs-Diagramm und dann auf den lebenden Zellen (7-AAD-negativ) in einem CD3-vs. 7-AAD-Diagramm gegatingn. Der letzte Schritt besteht darin, Anti-Tag, Anti-ScFv oder Anti-F(ab')2 vs. CD3 zu analysieren.
4. Echtzeit-Cytolyse-Potenz-Assay
HINWEIS: Führen Sie den RTCA-Test gemäß den vom Hersteller empfohlenen Bedingungen durch. Kurz gesagt, zuerst platte die Zielzellen in den Brunnen der E-Platte, gefolgt von der Zugabe von CAR T Zellen am nächsten Tag. Die Zytolyseaktivität von CAR-T-Zellen gegen Zielzellen wird in Echtzeit überwacht. T-Zellen und mock-transduced T-Zellen (Mock CAR T-Zellen) werden als negative Effektorzellensteuerungen verwendet. Das folgende Protokoll beschreibt einen in vitro Echtzeit-Cytolyse-Potenz-Assay für anhantibe Tumorzelllinien.
- Fügen Sie jedem Brunnen der xCELLigence E-Plate 100 l Zielzellkulturmedium hinzu, legen Sie die Platte in das xCELLigence-Instrument und lesen Sie im Hintergrund. Übertragen Sie dann die E-Platte auf eine Gewebekulturhaube für die Zellaussaat.
- Verwenden Sie ein Standardprotokoll, um Zielkrebszellen vom Kulturgerät aus zu trypsinisieren. Dann die Zellen in ein 15 ml Zentrifugenrohr übertragen und frisches Kulturmedium, bis zu 15 ml hinzufügen. Pellet die Zellen durch Zentrifugation für 5 min bei 200 x g. Entsorgen Sie den Überstand, fügen Sie 5 ml frisches Medium hinzu und verwenden Sie eine serologische Pipette, um das Zellpellet sanft wieder aufzuhängen. Zählen Sie die Dichte der lebenden Zellen mit einem Hämozytometer und Mikroskop.
- Passen Sie die Zelldichte entsprechend an und fügen Sie dann 100 L der Zellsuspension zu jedem Brunnen der E-Platte hinzu. Die Zielzellzahl beträgt in der Regel etwa 10.000 Zellen/Gut für anhantibe Zelllinien (BxPC3, Hela-CD19 und SKOV3) oder 30.000 Zellen/gut für Suspensionszellen wie Raji (siehe unten für Details über die Vorbeschichtung von Brunnen mit Antikörpern, um flüssige Krebszellen zu entkernen).
- E-Plate bei Raumtemperatur für 30 min ausgleichen, damit sich die Zellen gleichmäßig auf der Unterseite des Brunnens absetzen können (dies ist entscheidend; überspringen Sie diesen Schritt nicht).
- Legen Sie die E-Platte in das xCELLigence-Instrument im Zellkultur-Inkubator und beginnen Sie, die als Zellindex vs. Zeit angezeigte Impedanz automatisch alle 15 min zu messen.
- Am nächsten Tag bereiten Sie Effektor CAR T Zellen. Stellen Sie sicher, dass Sie im Voraus geeignete Kontrollen (d. h. Mock CAR T-Zellen, nicht transduzierte Kontroll-T-Zellen und/oder nicht verwandte CAR T-Zellen) vorbereiten, um sicherzustellen, dass alle Zellen gleichzeitig bereit sind. Passen Sie die Effektorzellen und die Kontrollzellen an die richtige Dichte an, und bereiten Sie serielle Verdünnungen vor, um sicherzustellen, dass die gewünschten E:T-Verhältnisse erreicht werden, wenn jedem Brunnen in Schritt 9 100 l Effektorzellsuspension hinzugefügt werden.
- Pause xCELLigence Datenerfassung und bringen Sie die E-Plate aus dem Inkubator zu einer Zellkulturhaube.
- Entfernen Sie 100 L Medium aus jedem Brunnen. Die Menge des Restmediums in jedem Brunnen beträgt jetzt 100 l.
- Fügen Sie 100 l seriell verdünnte EFFECTor-CAR-T-Zellen oder andere Kontrollzellen (d. h. Mock CAR T-Zellen) hinzu, um die gewünschten E:T-Verhältnisse zu erreichen.
- E-Plate bei Raumtemperatur 30 min ausgleichen, damit sich Effektorzellen absetzen können, und legen Sie die E-Platte dann wieder in das xCELLigence-Instrument. Setzen Sie die Datenerfassung fort.
- Auf Wunsch kann zu wichtigen Zeitpunkten die xCELLigence-Datenerfassung angehalten und die Platte entfernt werden, um kleine Proben zu sammeln, die durch orthogonale Assays analysiert werden sollen (d.h. Messung der Zytokinproduktion mittels ELISA oder Durchflusszytometrie).
- Messen Sie im EGFR-GITR-CD3 CAR T-Zell-Experiment die INF-Ausbeute mit einem ELISA-Kit (folgen Sie den Anweisungen des Herstellers; siehe Tabelle der Materialien).
ANMERKUNG DER VERWENDUNG VON LIQUID CANCERS: Zum Testen nicht anhaftender hämatologischer Krebszellen werden vor dem Hinzufügen von Zellen die Brunnen der E-Plate zunächst mit einem Antikörper beschichtet, der spezifisch für ein Antigen ist, das auf der Oberfläche der Krebszellen exprimiert wird. Für die Raji B-Zelllinie wird ein Tethering-Reagenz auf Basis von Anti-CD40 verwendet (siehe Flüssigtumor-Tötungs-Assay-Kit in der Tabelle der Materialien). Unten ist das Verfahren zum Beschichten der Platte: - Verdünnen Sie das Tethering-Reagenz (Anti-CD40) mit Tetheringpuffer auf eine Konzentration von 4 g/ml.
- Wenn Sie in einer Gewebekulturhaube arbeiten, fügen Sie jedem Brunnen der E-Plate 50 L des verdünnten Tetheringreagenzes hinzu. Lassen Sie die E-Platte bei Raumtemperatur oder in einem 37 °C Inkubator für 3 h.
- Entfernen Sie das Tethering-Reagenz und waschen Sie die E-Platte mindestens 2x mit Waschpuffer. An diesem Punkt ist die E-Platte bereit für die Aussaat der Raji Zielzellen (30.000 Zellen/Well).
- Fahren Sie mit Schritt 4.1 (oben) fort, um den Rest des Vorgangs auszuführen.
Ergebnisse
CAR Lentivirus-Präparat und CAR-T-Zell-Generierung und Wirksamkeitsbewertung
Die Titter der CAR-Lentivirus-Präparate wurden mit einem quantitativen RT-PCR-Kit (siehe Materialtabelle) nach dem Herstellerprotokoll bestimmt. Das Titrationsprotokoll extrahierte zuerst Virus-RNA und maß dann die lentivirale RNA-Kopiernummer, die die Menge der infektiösen Viruspartikel anzeigte. Der Titer des Virus, der von einer 150-mm-Schale mit dem obigen Protokoll erzeugt wird, liegt in der Regel zwischen 109-1010 viralen Kopien/ml. Abbildung 2A zeigt die RT-PCR-Zyklusnummer im Vergleich zur Signalstärke aus einem repräsentativen quantitativen PCR-Ergebnis. Sobald die Virusqualität befriedigt war, wenn der Titer größer als 1 x 108 pfu/ml war, wurde er für die nachfolgende T-Zell-Transduktion eingefroren. Nachdem die CAR-T-Zellen mit Lentivirus transduziert wurden, wurden die T-Zellen für weitere 12-14 Tage kultiviert, wobei ihre Dichte um 1 x 106 bis 2 x 106 Zellen/ml erhalten blieben. Die CAR-T-Zellen wurden dann mit Anti-ScFv-spezifischen Antikörpern mit einem Durchflusszytometer vor einer nachgeschalteten Anwendung oder beim Einfrieren überprüft. Abbildung 2Bzeigt ein gutes repräsentatives Chargenergebnis. Mit einem Anti-ScFv-Antikörper wurden etwa 50 % der CAR-T-Zellen positiv gebeizt (Q2 50,6% vs. T-Zellen 1%), was auf die Expression von CAR in etwa 50% der T-Zellen hindeutet. Anschließend wurde der RTCA-Potenztest zur Zytolysebestimmung durchgeführt, bevor jede Charge von CAR-T-Zellen eingefroren und für die zukünftige Anwendung bereit war. Ein Zyklus des CAR T-Zell-Design-, Generierungs- und Bewertungsverfahrens dauerte etwa 1 Monat.
Tötung von Raji-Lymphom-B-Zellen durch CD22-CAR-T-Zellen
Das Anti-CD40 Liquid Tumor Tethering Kit (siehe Materialtabelle) wurde in einer Konzentration von 4 g/ml verwendet, um eine E-Platte für 3 h bei 37 °C zu beschichten. Nach dem Waschen der Brunnen mit Tetheringpuffer wurden der E-Platte B-Zell-Lymphomzellen mit einer Dichte von 30.000 Zellen/Well zugesetzt. Nachdem die Zellen sich 30 min absetzen konnten, wurde die E-Platte wieder in das xCELLigence-Instrument gelegt, und Sofortmessungen wurden eingeleitet, um zellgebundene und proliferationsgebundene Zellen zu erfassen. Am folgenden Tag wurden entweder CD22-CAR-T-Zellen, Mock-CAR-T-Zellen oder nicht transducierte T-Zellen hinzugefügt. In Abbildung 3wurde für alle Zelltypen ein E:T-Verhältnis von 10:1 verwendet. CD22-positive Raji-Zellen, die mit CD22-CAR-T-Zellen behandelt wurden, zeigten eine signifikante Tötung (grüne Spur) im Vergleich zu den negativen Kontrollen (untransducierte T-Zellen und Mock CAR T-Zellen).
Effektive Tötung von Bauchspeicheldrüsenkrebszellen durch CD47-CAR T-Zellen
CD47 ist ein Transmembran-Oberflächenglykoprotein der Immunglobulin-Überfamilie. Als integrinassoziiertes Protein exprimiert es sowohl bei hämatologischen Krebsarten (Leukämie, Lymphom und multiplem Myelom) als auch bei festem Krebs (wie Eierstock-, Kleinzell-Lungenkrebs, Bauchspeicheldrüsen-, Glioblastom- und anderen Krebsarten36,37. CD47 ist auch bekannt als ein Do-not-eat-me-Signal an Makrophagen, was es zu einem potenziellen therapeutischen Ziel bei einigen Krebsarten gemacht hat. CD47-CAR T-Zellen wurden hergestellt und gegen BxPC3 Bauchspeicheldrüsenkrebszellen getestet, die hohe Konzentrationen von CD4738,39ausdrücken. BxPC3-Zellen wurden in der E-Platte an Tag 1 mit einer Dichte von 10.000 Zellen/Well gesät. Die Echtzeitüberwachung zeigte, dass diese Zellen nach 16 h die Konfluenz erreichten. Zu diesem Zeitpunkt wurden CAR-T-Zellen mit dem E:T-Verhältnis von 10:1 hinzugefügt (Abbildung 4A). Kontrolleffektorzellen wie nicht transduzierte T-Zellen und Mock CAR T-Zellen wurden ebenfalls hinzugefügt. Die Ergebnisse zeigen deutlich, dass CD47-CAR T-Zellen selektiv die Ziel-BxPC3-Zellen29abtöten. Abbildung 4B zeigt außerdem, dass das Impedanzsignal, wenn CD47-CAR-T-Zellen zu einem leeren Bohrkörper hinzugefügt werden, wesentlich niedriger ist als das Impedanzsignal, das von Ziel-BxPC3-Zellen erzeugt wird. Der Zellindexwert aus Brunnen mit CD47-CAR T-Zellen allein erreichte ein Maximum von 0,14, was nur geringfügig höher ist als das Signal von Medium allein (0,02). Dies deutet darauf hin, dass in diesem heterogenen Tötungstest das Impedanzsignal fast ausschließlich von den Zielkrebszellen abgeleitet wird.
Kostimulation von CAR-T-Zellen durch die GITR-Domäne
In einem EGFR-GITR-CD3 CAR ausgedrückt, wurde die GITR-Kosten-Imulatorei zuvor berichtet, um die Tötung von EGFR-positiven SKOV3-Krebszellen zu verbessern, aber nicht EGFR-negative MCF-7-Krebszellen30. Um die Rolle der GITR-Domäne besser zu klären, wurden CAR-Konstrukte, die die GITR-Domäne in voller Länge enthalten, oder gelöschte oder neu angeordnete Versionen der Domäne generiert und auf die Möglichkeit getestet, CAR-T-Zellen zu koaktivieren (Abbildung 5A). Die xCELLigence-Daten in Abbildung 5B,C zeigen, dass die GITR-Kostendomäne die Tötung von EGFR-positiven Zielzellen durch DIE CAR T-Zelle über das hinaus verbessert, was beim ursprünglichen CAR-Konstrukt beobachtet wird, dem die GITR-Domäne fehlt. Darüber hinaus wurde durch das Löschen von 10 Aminosäuren aus der GITR-Domäne (Aminosäuren 184-193) diese stimulierende Aktivität abgeschafft. Im Gegensatz dazu erwies sich die Neuordnung der relativen Positionierung der GITR-Domäne innerhalb des CAR-Konstrukts als weniger schädlich für ihre Stimulierenden Fähigkeiten. Anhand von Endpunktdaten demonstrierte die IFN-Produktion als Ersatz für die T-Zell-Aktivierung auch die stimulierende Aktivität der GITR-Domäne (Abbildung 5B). Im Gegensatz zu Endpunktdaten, die nur ein "Schnappschuss" sind, beleuchtet das kontinuierliche Impedanzprofil des xCELLigence-Instruments deutlich subtile Unterschiede in der Tötungskinetik der verschiedenen Behandlungen (Abbildung 5C). Die hier erzielten Ergebnisse stimmen mit denen einer in vivo-Studieüberein 30.
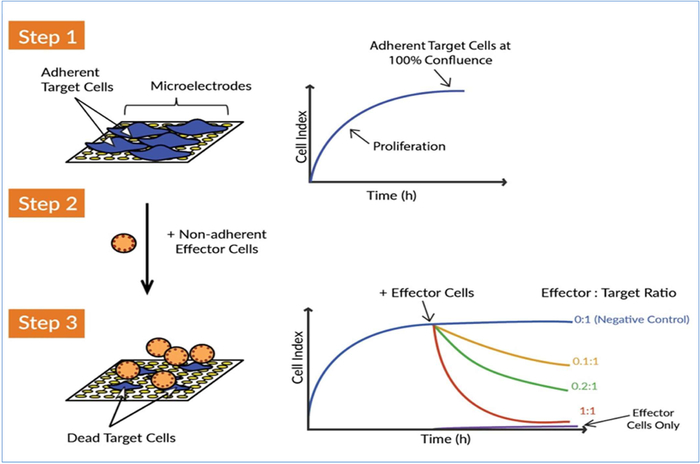
Abbildung 1: Das xCELLigence Real-Time Cell Analysis (RTCA)-System erkennt die Tötung von Zielzellen durch Effektorzellen. Es gibt drei Hauptkonzeptionsschritte zur Messung der Tötungsaktivität von CAR T-Effektorzellen gegen Zielkrebszellen. Schritt 1: Samen sie die Zielzellen (d.h. Tumorzellen) in den Brunnen einer E-Platte. Die Zellen heften sich an die Goldbiosensor-Mikroelektroden an und dies behindert den Stromfluss zwischen den Elektroden. Dieser Impedanzwert wird als einheitsloser Parameter namens Zellindex gemessen und dargestellt. Der Wert des Zellindex steigt, wenn die Zellen wachsen und erreicht ein Plateau, wenn sich die Zellen dem Zusammenfluss nähern. Schritt 2: Effektorzellen-nicht haftende Immunzellen werden anschließend hinzugefügt. Da diese Zellen nicht an den Goldmikroelektroden haften, verursachen sie nicht direkt eine Impedanzänderung. Schritt 3: Wenn die Effektorzellen die Zielkrebszellen angreifen, wird die Zerstörung der Tumorzellen durch eine Abnahme des Zellindex im Laufe der Zeit widergespiegelt. Diese zytolytische Aktivität der Effektorzellen oder die Wirksamkeit der Effektorzellen kann empfindlich und präzise überwacht werden. Die kontinuierliche Erfassung von Impedanzdaten aus dem xCELLigence-System ermöglicht eine kinetische Echtzeit-Tötungsanalyse für mehrere Bedingungen gleichzeitig. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
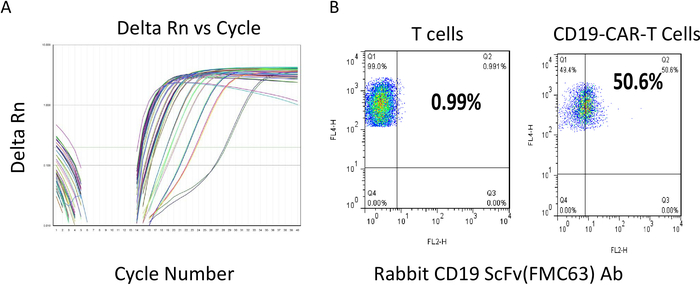
Abbildung 2: Titerbestimmung des Lentivirus und Durchflusszytometrie-Bewertung der CAR-T-Zellen. (A) Lentivirale Titerbestimmung. Die verschiedenen Farblinien sind repräsentative Proben für Zykluszahl vs. Delta Rn. Niedrige Zykluszahlen deuten auf eine relativ hohe Menge an Virus-RNA-Vorlage in den Proben hin. (B) Nach der Transduktion wurden CAR-T-Zellen kultiviert und mit einer Dichte von weniger als 2 x 106 Zellen/ml gehalten und anschließend einer Strömungsanalyse unterzogen. Die y-Achsereflektiert die Färbung für T-Zellen, wobei positive Werte in den Bereichen Q1 und Q2 widergespiegelt werden. Beide Proben sind 100% positiv für T-Zellen. Die Expression von CAR scFV wird mit einem scFv-spezifischen Ab (x-achse) bestimmt. Das Ergebnis zeigt, dass mehr als 50% der T-Zellen in CD22-CAR T-Zellen scFv-positiv sind. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
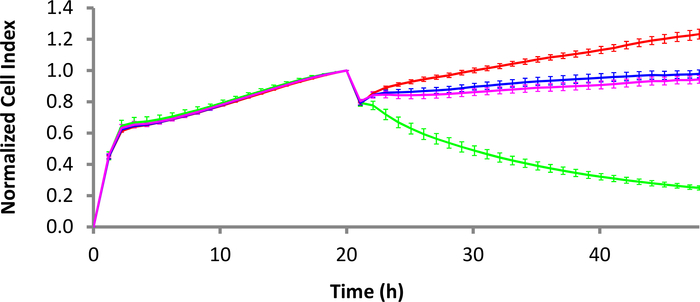
Abbildung 3: Tötungsdynamik von CD22-CAR-T-Zellen gegen die Lymphomzellen von Raji Burkitt. Während die rote Kurve die Raji-Zellen allein ist, ist die grüne Kurve die Raji-Zellen mit CD22-CAR T-Zellen behandelt. Die rosa und blauen Kurven sind Mock CAR T-Zell-Behandlung und nicht transduced T-Zell-Behandlung, beziehungsweise. Das E:T-Verhältnis ist 10:1. Fehlerbalken sind Standardabweichungen. Die Zeitskala ist in 2-Stunden-Intervallen für eine einfache Anzeige eingerichtet, obwohl mehr Datenpunkte verfügbar sind. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
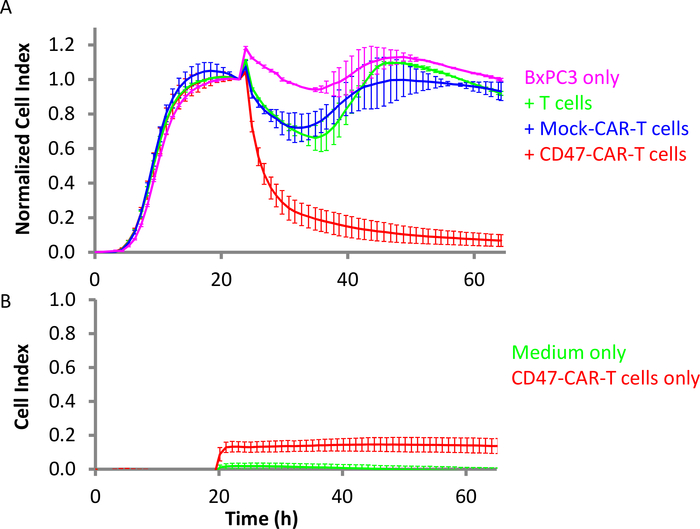
Abbildung 4: Wirksamkeit von CD47-CAR-T-Zellen gegen solide Tumorzellen der Bauchspeicheldrüse. (A) Pink ist das Ziel BxPC3-Zellen allein, während rot ist BxPC3 mit CD47-CAR T-Zellen hinzugefügt. Grün ist BxPC3 mit der Zugabe von nicht transducierten T-Zellen, und blau ist mit Mock CAR T-Zellen. Das E:T-Verhältnis ist 10:1. (B) In der gleichen Einstellung ist Rot leer (fehlende Zielzellen) Steuerbrunnen mit CD47-CAR T-Zellen nur und grün ist nur das Medium. Fehlerbalken sind Standardabweichungen. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
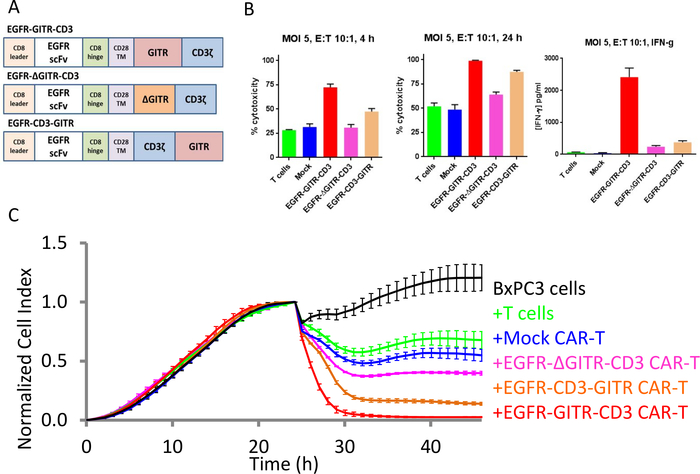
Abbildung 5: GITR-Domäne erhöht die zytotoxische Aktivität von CAR-T-Zellen gegen EGFR-positive Tumorzelllinien. (A) Verschiedene CAR-Konstrukte. (B) Bar-Plots von % Zytolyse für verschiedene CAR-Konstrukte bei 4 h (links) und 24 h (Mitte). Die IFN-Produktion bei 24 h ist rechts dargestellt. (C) Kontinuierliche Tötungsauswertung für alle Konstrukte. Die schwarze Kurve ist die Wachstumskurve nur von BxPC3 Eierstockkrebszellen. Die grüne Kurve ist die Zielzellen, die nur mit T-Zellen behandelt werden, die blaue Kurve sind die Zielzellen, die mit Mock CAR T-Zellen behandelt werden, die rote Kurve sind die Zielzellen, die mit EGFR-GITR-CD3-CAR T-Zellen behandelt werden, die rosa Kurve sind die Zielzellen, die mit EGFR-GITR-CD3-CAR T-Zellen behandelt werden, und die braune Kurve ist die Zielzellen, die mit EGFR-CD3-GITR-CAR-T-Zellen behandelt werden. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Diskussion
Chimäre Antigenrezeptoren sind mehrgliedrige Proteine, die aus einem extrazellulären einkettigen variablen Fragment (scFv-Region), einer Scharnierregion, einer Transmembranregion und einer zytoplasmatischen Domäne bestehen, die aus TCR-Signaldomänen und zusätzlichen Kosten-Imulatorei-Domänen von Rezeptoren wie CD28 und OX4011,40besteht. Um sichere, selektive und effiziente CARs zu entwerfen, ist es unerlässlich, dass die verschiedenen Permutationen im Design der CARs gründlich mit In-vitro-Potenztests und schließlich Tiermodellen getestet werden. In dieser Studie haben wir ein Protokoll und einen Workflow dafür bereitgestellt, wie ein Echtzeit-In-vitro-Potenztest das Design wirksamer CARs unterstützen kann.
Bei der Gestaltung jeder Art von Potenz-Assay, insbesondere für Herstellungszwecke, ist es zwingend erforderlich, dass der Assay empfindlich, robust, konsistent und so nah am Wirkmechanismus wie möglich16,17,41sein muss. Der hier beschriebene Echtzeit-Potenztest dient dazu, die zytolytische Aktivität der CAR-T-Zelle direkt zu messen, anstatt einen Ersatzmarker wie die Zytokinfreisetzung zu verwenden. Wichtig ist, dass der Assay keine zusätzlichen Komponenten wie Farbstoffe oder Reagenzien außer der Assayplatte (E-Plate) und den empfohlenen Medien zur Aufrechterhaltung der Zellen erfordert. Darüber hinaus ist der Assay exquisit empfindlich und liefert hoch reproduzierbare Daten im Vergleich zu anderen labelbasierten Assays42,43,44. Darüber hinaus ist der xCELLigence-Assay für die Verwendung sehr niedriger Effektor-Ziel-Verhältnisse geeignet, was ideal für die Beurteilung einer spezifischen Zytolyse ist.
Um die Flexibilität und Nützlichkeit des xCELLigence-Systems zu demonstrieren, haben wir uns auf zwei Tumortypen konzentriert, nämlich Tumoren hämatologischen Ursprungs und soliden Tumoren. Um die Wirksamkeit von CD22-gerichteten CAR-T-Zellen zu beurteilen, wurden Raji-Zellen (d. h. eine B-Zell-Lymphom-Zelllinie) mit einem Anti-CD40-Antikörper an die E-Plates gebunden. Das Ankleben von Raji-Zellen an den Boden der E-Plates führt zu einem Impedanzsignal, das die Lebensfähigkeit und Anzahl der Raji-Zellen im Brunnen widerspiegelt. Nach der Zugabe von CD22-CAR T-Zellen werden die Raji-Zellen selektiv zeit- und effektorabhängig abgetötet, was zu einer zeitabhängigen Abnahme des Impedanzsignals führt. Der Rückgang der Impedanz bedeutet Zytolyse oder Verlust der Lebensfähigkeit der Raji-Zellen17. Dieser selektive Tethering-Ansatz mit Antikörpern kann auf andere flüssige Tumorzelllinien ausgedehnt werden. Eine alternative Strategie zur Verwendung von Tumorzelllinien hämatologischen Ursprungs ist die Verwendung von anhaftenden Krebszellen, die entwickelt wurden, um die Tumorantigene, wie CD19, die in HeLa-Zellen exprimiert werden, stabil auszudrücken. Der Vorteil dieses Ansatzes ist, dass die elterlichen HeLa-Zellen leicht verfügbar sind und als negative Kontrolle für spezifität verwendet werden können. Ein solcher Ansatz wurde bereits mit CHO-CD22 vs. CHO-Zellen und CHO-BCMAs vs. CHO-Zellen29validiert. Mit solchen unterschiedlichen Ansätzen können CAR T-Zell-Design und Wirksamkeit leicht getestet werden. Der xCELLigence-Assay ist von Natur aus flexibel, und die Assay-Bedingungen können angepasst werden, um die physiologischen Bedingungen maximal anzunähern.
Ein großer Vorteil des Hier beschriebenen Potenz-Assays ist, dass es sich um einen einfachen funktionellen Assay handelt, der in Verbindung mit gentechnischen Techniken verwendet werden kann, um optimale und effiziente CARs in einer Hochdurchsatz-Manier zu entwerfen. Wie hier für CAR-T-Zellen gezeigt wurde, die auf EGFR-positive Krebszellen abzielen, kann der Assay verwendet werden, um die relative Aktivität verschiedener CAR-Konstrukte/Mutanten zu bewerten. Wir haben beispielsweise gezeigt, dass die GITR-Domäne, wenn sie sich vor der CD3-Domäne befindet, eine wesentlich robustere zytolytische Aktivität anzeigt als nach der CD3-Domäne.
Obwohl es nicht perfekt mit der in vivo CAR T-Zellaktivität korreliert, wurde die In-vitro-Zytokinfreisetzung in der Vergangenheit als Maß für die Wirksamkeit von CAR T-Zellen verwendet. Obwohl der hier beschriebene xCELLigence-basierte Potenztest zur Bewertung zellbasierter Therapien während der Herstellung oder vor der Veröffentlichung für die klinische Anwendung verwendet werden kann, ist es noch nicht so, wie gut diese Ergebnisse mit der In-vivo-Wirksamkeit korrelieren. etabliert. Die In-vivo-Wirksamkeit hängt von einer Vielzahl von Faktoren und Variablen ab, die nicht innerhalb eines In-vitro-Tests rekapituliert werden können. Zu diesen Variablen gehören: Homing der CAR-T-Zellen an die Stelle des Tumors, die Stimulation und Aktivierung der CAR-T-Zelle und ihre Fähigkeit, innerhalb des Patienten fortzubestehen, und die Tumormikroumgebung. Mit weiterer Verfeinerung kann der xCELLigence-Assay einige dieser komplexen Prozesse in vitro modellieren.
Das hier vorgesehene Protokoll gilt für die meisten anhaftenden Krebszelllinien und einige der flüssigen Tumorzelllinien. Klinische Proben wie primäre Krebszellen müssen jedoch aufgrund der Komplexität der Tumortypen und -phasen weiter getestet und optimiert werden. Es ist sicherlich erwähnenswert, dass das hier beschriebene In-vitro-Potenz-Assay-System Krebszelllinien verwendet, nur um die potenzielle Aktivität der CAR-T-Zellen widerzuspiegeln. Die reale Tumorsituation im menschlichen Körper ist viel komplexer, vor allem, wenn ein solider Tumor aufgrund der dynamischen Tumorumgebung und -entwicklung ins Visier genommen wird. Daher kann sich das Ergebnis der Wirksamkeitsbewertung nicht sehr gut in die klinische Wirksamkeit der getesteten CAR-T-Zellen niederschlagen.
Zusammenfassend lässt sich sagen, dass die vorgestellte impedanzbasierte xCELLigence-Plattform eine etikettenfreie Überwachung der Zelltötung über einen längeren Zeitraum, nämlich bis zu 10 Tage, ermöglicht. Diese Kapazität für eine so lange zeitliche Skala für die Datenerfassung unterscheidet die Technologie von anderen Assays, die derzeit verwendet werden und die die Einrichtung mehrerer experimenteller Replikationen für die Zeitpunkterfassung und mühsame Probenmanipulation erfordern. Darüber hinaus vereinfacht der minimale Signalbeitrag der Effektor-Immunzellen die Datenanalyse. Die Software kann Daten automatisch verarbeiten und nützliche Parameter wie den Prozentsatz der Zytolyse, KT50, etc. generieren. Die Technologie hat bereits eine hohe Empfindlichkeit (mit E:T-Verhältnissen von nur 1:20) und einen großen Dynamikbereich (mit E:T-Verhältnissen von 20:1 bis 1:20) gezeigt, was mit anderen Assays nicht leicht zu erreichen ist. Insgesamt sollte die Implementierung dieser Technologie eine genauere Datenanalyse auf einer höheren Durchsatzskala ermöglichen, die die Entwicklung von CAR-T-Zell-Reagenzien verbessern und das Feld in einem viel höheren Tempo voranbringen wird.
Offenlegungen
Die Autoren forschen an der Entwicklung von CAR T-Zell und den damit verbundenen Potenz-Assays, die Geschäftsinteressen von ProMab Biotechnologies bzw. ACEA Biosciences sind. Dies ändert jedoch nichts an der Einhaltung der Mission von JoVE durch die Autoren, die Verbreitung wissenschaftlicher Erkenntnisse zu erhöhen. Die Bedingungen dieser Veröffentlichung wurden von ProMab Biotechnologies und ACEA Biosciences in Übereinstimmung mit ihrer Forschungspolitik überprüft und genehmigt.
Danksagungen
Die Autoren danken ProMab Biotechnologies und ACEA Biosciences für die Bereitstellung der in dieser Studie verwendeten Reagenzien und Instrumente.
Materialien
| Name | Company | Catalog Number | Comments |
| 7-AAD | Biolegend | 420404 | |
| Anti-CD40, liquid tumor killing assay kit | ACEA Biosciences | 8100005 | |
| anti-human F(ab')2 | Jackson Immunoresearch laboratories. | 109-116-088 | |
| APC anti-CD3 | Biolegend | 317318 | |
| Assay medium RPMI1640 | life technologies.Corp | 11875-093 | |
| CAR-T cell frozen solution CryostorCS10 | Stemcell technologies | #07930 | |
| CAR-T cell medium from ProMab | AIM-V+300IFU/ml IL-2 | 12055-091 | |
| CD3/CD28 coated microbeads, Dynabeads | Thermofisher | 11131D | |
| DMEM | GElifesciences.com | SH30243.02 | |
| FACS buffer | Promab made | ||
| FBS | Lonza.com | 14-503F | |
| HEK293FT | Thermo Fisher | R70007 | |
| INFg ELISA kit | Thermo Fisher | ||
| Lentiviral Packaging Mix | System Biosciences | VP100 | |
| Lenti-X quantitative RT-PCR titration kit (Clontech) | Takara | 631235 | |
| Promab medium for target cells | Varied with cell lines | ||
| Real time Cellular Analyer | ACEA Biosciences | ||
| Thermal cycler | Thermo Fisher | ||
| Transduction enhance agent, Virus Transduction Enhancer (Alstem) | Transplus, Alstem | V020 | |
| Transfection dilution solution, Opti-MEM | Thermo Fisher | ||
| Transfection reagent, NanoFect reagent | Alstem | NF100 |
Referenzen
- Miliotou, A. N., Papadopoulou, L. C. CAR T-cell Therapy: A New Era in Cancer Immunotherapy. Current Pharmaceutical Biotechnology. 19 (1), 5-18 (2018).
- June, C. H., O’Connor, R. S., Kawalekar, O. U., Ghassemi, S., Milone, M. C. CAR T cell immunotherapy for human cancer. Science. 359 (6382), 1361-1365 (2018).
- . FDA approval brings first gene therapy to the United States Available from: https://www.fda.gov/NewsEvents/Newsroom/PressAnnouncements/ucm574058.htm (2017)
- . FDA approves CAR-T cell therapy to treat adults with certain types of large B-cell lymphoma Available from: https://www.fda.gov/newsevents/newsroom/pressannouncements/ucm581216.htm (2017)
- Liu, B., Song, Y., Liu, D. Clinical trials of CAR-T cells in China. Journal of Hematology & Oncology. 10 (1), 166 (2017).
- Fry, T. J., et al. CD22-targeted CAR T cells induce remission in B-ALL that is naive or resistant to CD19-targeted CAR immunotherapy. Nature Medicine. 24 (1), 20-28 (2018).
- Yang, Y., Jacoby, E., Fry, T. J. Challenges and opportunities of allogeneic donor-derived CAR T cells. Current Opinion in Hematology. 22 (6), 509-515 (2015).
- . Celyad Announces FDA Acceptance of IND Application for CYAD-101, a First-in-Class Non-Gene Edited Allogeneic CAR-T Candidate Available from: https://www.celyad.com/en/news/celyad-announces-fda-acceptance-of-ind-application-for-cyad-101-a-first-in-class-non-gene-edited-allogeneic-car-t-candidate (2017)
- Sheridan, C. Allogene and Celularity move CAR-T therapy off the shelf. Nature Biotechnology. 36 (5), 375-377 (2018).
- D’Aloia, M. M., Zizzari, I. G., Sacchetti, B., Pierelli, L., Alimandi, M. CAR-T cells: the long and winding road to solid tumors. Cell Death & Disease. 9 (3), 282 (2018).
- Xu, J., et al. Combination therapy: A feasibility strategy for CAR-T cell therapy in the treatment of solid tumors. Oncology Letters. 16 (2), 2063-2070 (2018).
- Xia, A. L., Wang, X. C., Lu, Y. J., Lu, X. J., Sun, B. Chimeric-antigen receptor T (CAR-T) cell therapy for solid tumors: challenges and opportunities. Oncotarget. 8 (52), 90521-90531 (2017).
- Yong, C. S. M., et al. CAR T-cell therapy of solid tumors. Immunology and Cell Biology. 95 (4), 356-363 (2017).
- Newick, K., O'Brien, S., Moon, E., Albelda, S. M. CAR T Cell Therapy for Solid Tumors. Annual Review of Medicine. 68, 139-152 (2017).
- de Wolf, C., van de Bovenkamp, M., Hoefnagel, M. Regulatory perspective on in vitro potency assays for human mesenchymal stromal cells used in immunotherapy. Cytotherapy. 19 (7), 784-797 (2017).
- Cerignoli, F., et al. In vitro immunotherapy potency assays using real-time cell analysis. PLOS ONE. , (2018).
- Holden, H. T., Oldham, R. K., Ortaldo, J. R., Herberman, R. B. Standardization of the chromium-51 release, cell-mediated cytotoxicity assay: cryopreservation of mouse effector and target cells. Journal of the National Cancer Institute. 58 (3), 611-622 (1977).
- Somanchi, S. S., McCulley, K. J., Somanchi, A., Chan, L. L., Lee, D. A. A Novel Method for Assessment of Natural Killer Cell Cytotoxicity Using Image Cytometry. PLOS ONE. 10 (10), e0141074 (2015).
- Mukherjee, M., Mace, E. M., Carisey, A. F., Ahmed, N., Orange, J. S. Quantitative Imaging Approaches to Study the CAR Immunological Synapse. Molecular Therapy: The Journal of the American Society of Gene Therapy. 25 (8), 1757-1768 (2017).
- Zaritskaya, L., Shurin, M. R., Sayers, T. J., Malyguine, A. M. New flow cytometric assays for monitoring cell-mediated cytotoxicity. Expert Review of Vaccines. 9 (6), 601-616 (2010).
- Nelson, D. L., Kurman, C. C., Serbousek, D. E. Chapter 7, Unit 7: 51Cr release assay of antibody-dependent cell-mediated cytotoxicity (ADCC). Current Protocols in Immunology. , 27 (2001).
- Abassi, Y. A., et al. Label-free, real-time monitoring of IgE-mediated mast cell activation on microelectronic cell sensor arrays. Journal of Immunological Methods. 292 (1-2), 195-205 (2004).
- Glamann, J., Hansen, A. J. Dynamic detection of natural killer cell-mediated cytotoxicity and cell adhesion by electrical impedance measurements. Assay and Drug Development Technologies. 4 (5), 555-563 (2006).
- Solly, K., Wang, X., Xu, X., Strulovici, B., Zheng, W. Application of real-time cell electronic sensing (RT-CES) technology to cell-based assays. Assay and Drug Development Technologies. 2 (4), 363-372 (2004).
- Zhu, J., Wang, X., Xu, X., Abassi, Y. A. Dynamic and label-free monitoring of natural killer cell cytotoxic activity using electronic cell sensor arrays. Journal of Immunological Methods. 309 (1-2), 25-33 (2006).
- Ke, N., Wang, X., Xu, X., Abassi, Y. A. The xCELLigence system for real-time and label-free monitoring of cell viability. Methods in Molecular Biology. 740, 33-43 (2011).
- Lamarche, B. J., Xi, B., Cerignoli, F. Quantifying the Potency of Cancer Immunotherapies: Immune Cell-Mediated Killing Kinetics and Efficacy Analysis in Real-Time without the Use of Labels. Genetic Engineering & Biotechnology News (GEN). 36 (14), 18-19 (2016).
- Golubovskaya, V., et al. CD47-CAR-T Cells Effectively Kill Target Cancer Cells and Block Pancreatic Tumor Growth. Cancers. 9 (10), (2017).
- Golubovskaya, V. M., et al. GITR domain inside CAR co-stimulates activity of CAR-T cells against cancer. Frontiers in Bioscience. 23, 2245-2254 (2018).
- Guedan, S., et al. Enhancing CAR T cell persistence through ICOS and 4-1BB costimulation. JCI Insight. 3 (1), (2018).
- Erskine, C. L., Henle, A. M., Knutson, K. L. Determining optimal cytotoxic activity of human Her2neu specific CD8 T cells by comparing the Cr51 release assay to the xCELLigence system. Journal of Visualized Experiments. (66), e3683 (2012).
- Davenport, A. J., et al. CAR-T Cells Inflict Sequential Killing of Multiple Tumor Target Cells. Cancer Immunology Research. 3 (5), 483-494 (2015).
- Hegde, M., et al. Tandem CAR T cells targeting HER2 and IL13Ralpha2 mitigate tumor antigen escape. The Journal of Clinical Investigation. 126 (8), 3036-3052 (2016).
- Jin, J., et al. Enhanced clinical-scale manufacturing of TCR transduced T-cells using closed culture system modules. Journal of Translational Medicine. 16 (1), 13 (2018).
- Weiskopf, K. Cancer immunotherapy targeting the CD47/SIRPalpha axis. European Journal of Cancer. 76, 100-109 (2017).
- Huang, Y., Ma, Y., Gao, P., Yao, Z. Targeting CD47: the achievements and concerns of current studies on cancer immunotherapy. Journal of Thoracic Disease. 9 (2), E168-E174 (2017).
- Ma, S., Thorpe, P., Vitetta, E., Meyer, J. Combined targeting of exposed phosphatidylserine, CD47 and CD54 on human pancreatic tumor cells in a mouse xenograft model of human pancreatic cancer (P4455). The Journal of Immunology. 190 (1 Supplement), (2013).
- Yamamoto, K., et al. Emergence of CD47- high expression cells confers enhanced tumorigenicity upon KDM6B suppression in pancreatic cancer. Cancer Research. 76 (2 Supplement), (2016).
- Xu, D., et al. The development of CAR design for tumor CAR-T cell therapy. Oncotarget. 9 (17), 13991-14004 (2018).
- FDA. . Guidance for Industry, Potency Tests for Cellular and Gene Therapy Products. , (2017).
- Limame, R., et al. Comparative analysis of dynamic cell viability, migration and invasion assessments by novel real-time technology and classic endpoint assays. PLOS ONE. 7 (10), e46536 (2012).
- Chiu, C. H., et al. Comparison between xCELLigence biosensor technology and conventional cell culture system for real-time monitoring human tenocytes proliferation and drugs cytotoxicity screening. Journal of Orthopaedic Surgery and Research. 12 (1), 149 (2017).
- Hillger, J. M., Lieuw, W. L., Heitman, L. H., IJzerman, A. P. Label-free technology and patient cells: from early drug development to precision medicine. Drug Discovery Today. 22 (12), 1808-1815 (2017).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten