Method Article
В режиме реального времени потенции Асса для химерных антигенов рецепторов T клеток ориентации твердых и гематологических раковых клеток
В этой статье
Резюме
Мы описываем количественную систему анализа цитолизва в реальном времени в режиме реального времени для оценки потенции химерных антигенных рецепторов Т-клеток, нацеленных на жидкие и твердые опухолевые клетки. Этот протокол может быть расширен для оценки других клеток иммунного эффектора, а также комбинированных методов лечения.
Аннотация
Химерный рецептор антигена (CAR) Т-клеточная терапия рака достигла значительного клинического преимущества для устойчивых и огнеупорных гематологических злокачественных новообразований, таких как детский острый лимфоцитарный лейкоз. В настоящее время предпринимаются усилия по распространению этой многообещающей терапии на твердые опухоли в дополнение к другим гематологическим ракам. Здесь мы описываем развитие и производство мощных Т-клеток CAR, нацеленных на антигены с уникальным или преференциальным выражением на твердых и жидких опухолевых клетках. Потенция in vitro этих т-клеток CAR затем оценивается в режиме реального времени с помощью высокочувствительного анализа на основе импеданса xCELLigence. В частности, исследуется влияние различных дорогостоящих сигнальных доменов, таких как глюкокортикоидноидный рецептор фактора некроза опухоли (TNFR), связанный с протеином (GITR), на потенцию in vitro Т-клеток CAR. Этот отчет включает в себя протоколы для: генерации CAR Т-клеток для доклинических исследований с использованием трансдукции ллентивирного гена, расширение Т-клеток CAR, проверка экспрессии CAR, а также запуск и анализ анализ потенций xCELLigence.
Введение
В последние годы Т-клеточная терапия CAR стала одним из самых заметных прорывов в иммунотерапии рака для рецидивов и огнеупорных гематопоитических злокачественных новообразований. С недавним УПРАВЛЕНИЕм по контролю за продуктами и лекарствами США (FDA) одобрение CD19-направленных Т-клеток CAR для острого лимфобластного лейкоза, неходжкинской лимфомы, и диффузной большой В-клеточной лимфомы, и назначение прорывной терапии для B-клеточного созревания антигена (BCMA)-направленных CAR Т-клеток для множественной миеломы, эта технология вызвала большое волнение в научном сообществе и подпитывается многочисленные основные, прикладные, и клинические исследования во всем мире1,2,3, 4,5. В январе 2019 года в базе данных клинических испытаний было зарегистрировано более 700 клинических испытаний (clinicaltrials.gov); около 450 из этих испытаний либо собирались начать, либо активно набирали пациентов. Большинство клинических испытаний сосредоточены на гематологических злокачественных новообразований, и клинические испытания с использованием CAR Т-клеток ориентации CD20, CD22, и BCMAs, в дополнение к CD19, продолжаются, а также6,7. Хотя большинство испытаний используют аутологичное CAR Т-клеточная терапия, значительное число из них также изучают полезность аллогенных CAR Т-клеток8,9,10. Несмотря на многообещающие результаты с гематологическими злокачественными новообразованиями, использование Т-клеток CAR для целевой твердых опухолей оказалось гораздо сложнее в клинике по целому ряду причин, в том числе, но не ограничиваясь отсутствием хороших целей, которые исключительно выражены в опухоли, неоднородность твердых опухолей и опухоли "побег", и трудности, что CAR T клетки имеют в доступе к микросреде11,12 , 12 , 12 , 12 , 12 , 12 , 12 , 12 , 12 , 12 , 12 , 12,12, 15. Существует острая необходимость в развитии твердых опухоли конкретных Т-клеток, которые могут преодолеть эти барьеры на пути к эффективности и проблемы "на целевой опухоли" токсичности. В то время как множество in vitro и in vivo подходы оправданы в разработке и тестировании CAR Т-клеток, надежный и прогностический анализ потенции in vitro имеет первостепенное значение16,17.
Для того, чтобы оценить потенцию CAR Т-клеток, различные методы in vitro были разработаны. В целом, эти анализы потенции могут быть разделены на две широкие категории в зависимости от того, они (i) непосредственно измерить цитолитической активности т-клеток CAR против целевых опухолевых клеток, или (ii) измерения суррогатных маркеров, таких как цитокины, которые высвобождаются КЛЕТКи CAR Т, как они убивают клетки-мишени. Методы, которые измеряют цитолитическую активность непосредственно включают анализ выброса хрома-51 (CRA)18, визуализации на основе анализов, которые измеряют апоптоз клеток-мишеней с помощью флуоресцентных зондов19,20, и поток цитометрии анализы, которые обнаруживают апоптотические клетки-мишени21. В этих анализах, CAR Т-клетки, как правило, совместно культивируется с целевыми клетками, которые были предварительно помечены радиоактивными или флуоресцентными зондами, а затем соответствующие измерения. Хотя он уже давно считается золотым стандартом в области из-за его чувствительности, CRA имеет некоторые недостатки. Во-первых, это конечная точка ассоса и не предоставляет кинетическую информацию. Во-вторых, целевые клетки должны быть помечены хромом-51, который имеет тенденцию выщелачиваться из клеток и может значительно увеличить фоновый шум22. Наконец, это требует надлежащих мер предосторожности и удаления радиоактивных отходов. Альтернативные анализы, которые измеряют побочные продукты взаимодействия Т-клеток CAR с клетками-мишенями как признак потенции, включают количественную оценку различных цитокинов, выделяемых Т-клетками CAR, используя либо методы цитометрии, либо связанные с ферментами иммуносорбентные анализы. Опять же, это конечные анализы, которые измеряют кумулятивное высвобождение цитокинов в данный момент времени и, таким образом, не обязательно могут отражать фактическую цитолитической активности Т-клеток CAR.
При разработке потенции анализ, особенно тот, который определяет критерии выпуска для клеточной терапии, такие как CAR Т-клеток, очень важно, чтобы анализ включать минимальные манипуляции и практические время, потому что каждое взаимодействие является еще одной переменной, которая должна быть учтена и может уменьшить общую надежность и последовательность анализ. Кроме того, взаимодействие Т-клеток CAR с опухолевыми клетками является динамичным процессом, и предоставление информации об этих динамических взаимодействиях, таких как скорость цитолиза, имеет первостепенное значение для оценки потенции. С учетом этих критериев мы разработали анализ кинетической потенции без этикетки для т-клеток CAR, которая использует платформу анализа клеток xCELLigence в реальном времени (RTCA). xCELLigence использует специализированные микротитерные пластины (E-plates), которые содержат биосенсоры золота, встроенные в нижней части каждой скважины. Работая либо с приверженцами твердых опухолевых клеток, или жидких раковых клеток, которые были привязаны с помощью конкретных антител, эти биосенсоры монитор в режиме реального времени CAR T-клеток индуцированных изменений в целевом количестве клеток, размер клеток, клеточная субстрата крепления силы, и клеточной клетки взаимодействия (т.е. барьер функции)17,23,24,25,26,27,28. Рабочий процесс прост и включает в себя просто посев целевых клеток в скважины E-плиты, а затем добавление CAR Т-клеток в различных сэффектор ов с точки зрения целевых соотношений (Рисунок 1). Впоследствии, поскольку биосенсоры непрерывно контролируют жизнеспособность целевых ячеек, данные автоматически отображаются в режиме реального времени.
За последние 15 лет анализ xCELLigence был проверен для оценки потенции естественных клеток убийцы (НК), Т-клеток, Т-клеток, ингибиторов контрольных точек, биспецифических антител, онколитических вирусов и некоторых комбинированных терапий17,29,30,31,32,33,34. Недавно, xCELLigence потенции асси была оценена для производства Т-клеточных рецепторов (TCR) инженерии Т-клеток35. Здесь мы сообщаем, используя систему RTCA для оценки потенции в пробирке CAR Т-клеток, предназначенных для целевой твердых опухолей и жидких опухолей в клинических методах лечения.
протокол
1. Поколение лентивирусного корытя
ПРИМЕЧАНИЕ: После того, как конкретные CAR Т-клеточной плазмидной конструкции завершена (CD47 и другие), лентивирные КАРР генерируются стандартной процедурой, используя 293 FT клеток, лентивирусной упаковки смеси, и трансфекционные агенты (см. Таблица материалов), как описано29. Впоследствии, используйте количественную обратную транскрипцию полимеразной цепной реакции (RT-PCR) комплект и тепловой цикл (см. таблицу материалов) для определения вируса титр путем измерения количества лентивирусной РНК в соответствии с протоколом производителя. Важно, чтобы все ленцивиральные процедуры проводились строго в соответствии с требованиями безопасности.
- Семена 15 х 106 HEK293FT клеток в Dulbecco в модифицированной среде Eagle (DMEM) и инкубировать клетки на ночь при 37 градусов по Цельсию в одном 150 мм блюдо внутри увлажненной 5% CO2 инкубатора.
- Приготовьте две трубки мощностью 15 мл с трансфекционным комплексом. Первая трубка содержит лентивирусную векторную плазмидную ДНК (5 мкг) и лентивирусную упаковочную смесь (22,5 мкг) в 2,5 мл раствора трансфективного разбавления. Вторая трубка содержит 82,5 л трансфекционного реагента в 2,5 мл раствора трансфекционного разбавления (см. Таблицу Материалов).
- Трубят содержимое трубки 1 в трубку 2, и инкубировать смесь при комнатной температуре в течение 15 минут.
- Перенесите содержимое трубки на блюдо из клеток HEK293FT и инкубировать образец на ночь при 37 градусах По Цельсия в увлажненных 5% CO2 инкубатора.
- На следующий день замените существующую среду на 19 мл свежей среды культуры DMEM и продолжайте инкубировать клетки на ночь внутри увлажненного 5% инкубатора CO2 при 37 градусах Цельсия.
- Перенесите средство от блюда к центрифуге 50 мл. Храните трубку с вирусосодержащей средой в холодильнике.
- Повторите вышеупомянутую процедуру, добавив свежий DMEM и собирая его снова после 1 дня.
- Объедините две коллекции носителей в одну центрифужную трубку. Центрифугна трубки при 2000 х г в течение 30 мин при 4 градусах Цельсия.
- Перенесите большую часть лентивирусно-содержащего супернатанта в ультраклирную центрифугу трубку. Оставьте минимальный объем, около 1 мл, супернатанта, чтобы не беспокоить гранулы, которые могут содержать клетки и/или мусор.
- Ultracentrifuge выше уточнил супернатант на 110000 х г в течение 100 мин при 4 градусах Цельсия.
- Удалите супернатант тщательно и аккуратно добавьте 100 зл ИК средних DMEM к вирусной гранулы на дно трубки. Оставьте трубку на льду в течение 15 мин. Смешайте раствор осторожно и aliquot раствор лентивирусного в прешилированных стерильных труб. Храните эти вирусные трубки в морозильной камере -80 градусов.
- Используйте количественный набор RT-PCR для определения титра лентивирусного в соответствии с протоколом производителя, который извлекает и измеряет лентивирусную РНК.
2. Поколение и расширение Т-клеток CAR
- Активировать ранее замороженные человеческие ПБМК (около 1 х 106 х 106 клеток) в 1 мл Т-клеточной среды CAR с равным количеством микробусов с покрытием CD3/CD28 (см. Таблицу материалов)и инкубировать клетки при 37 градусах Цельсия в увлажненных 5% CO2 инкубатора для 24 ч.
- Оттепель aliquot лентивирусного запаса на льду.
- Добавить 1 л трансдукции повышения агента в колодец с клетками и перемешать.
- Добавить лентивирус в клетки при множественности инфекции (МВД) 5:1 и аккуратно перемешать. На следующий день повторите этот шаг (24 ч после первого трансдукции).
- Мониторинг роста Т-клеток каждые 2-3 дня. Добавьте больше свежей среды CAR T-клетки для поддержания клеток при плотности 1 х 106 до 2 х 106 ячеек/мл.
- Заморозить ячейки CAR T со стандартным протоколом с помощью решения замораживания (см. таблицу материалов).
- Оттепель CAR T клетки, используя стандартный метод и прекультуры их в CAR Т-клеточной среде около 2-4 ч с IL-2 (300 единиц / мл) перед применением их для ассе.
3. Обнаружение экспрессии CAR по цитометрии потока
- Передача 3 х 105 CAR Т-клеток и нетрансиндуцированных Т-клеток в две отдельные 1,5 мл микроцентрифуговых труб.
- Центрифуги труб на 300 х г в течение 2 мин и повторной концентрации клеток в 200 Зл флуоресценции активированных клеток сортировки (FACS) буфер, содержащий 1% человеческой сыворотки.
- Пипетка 100 л клеточного раствора в двух 5 мл полистирола FACS труб и держать трубки на льду в течение 5 минут.
- Добавьте 1 зл биотинилатированных коз анти-мышь F (ab')2 к одной трубке каждого типа клетки. Затем добавьте 2 ЗЛ анти-тега на этикетке PE (см. таблицу материалов)в другую трубку каждого типа клеток. Хорошо перемешать и навистить на льду в течение 30 минут.
- Вымойте клетки с 3 мл буфера FACS в каждой трубке и центрифуги труб на 300 х г в течение 5 минут; отбросить супернатантов и вихря очень кратко или встряхнуть трубки кратко, чтобы восстановить клетки в остаточной жидкости.
- Добавьте 2 ЗЛ APC anti-CD3 и 2 ЗЛ из 7-AAD антитела раствор (см. таблицу материалов) к каждой трубке. В трубку клеток, окрашенных анти-F (ab')2 Ab, добавить 1 Зл PE-маркированных стрептавидин. Кратко перемешайте трубки на льду еще 30 минут.
- Используйте буфер FACS, чтобы снова мыть клетки, как описано в шаге 3.5, и добавьте дополнительные 200 юаней буфера FACS к каждой трубке.
- Используйте цитометрию потока, чтобы проанализировать клетки, сначала gating на Т-клетки в вперед рассеяния против бокового рассеяния участка, а затем gating на живых клетках (7-AAD-отрицательный) в CD3 против 7-AAD участка. Последним шагом является анализ анти-тег, анти-ScFv или анти-F (ab')2 против CD3.
4. В режиме реального времени цитолиза потенции ассси
ПРИМЕЧАНИЕ: Выполните rtCA асссе в соответствии с рекомендуемыми условиями производителя. Вкратце, первая плита клетки цели в уэллах E-плиты, последовано за добавлением клеток CAR T на следующий день. Активность цитолиза Т-клеток CAR против целевых клеток контролируется в режиме реального времени. Т-клетки и макет-трансиндуцированных Т-клеток (Mock CAR Т-клетки) используются в качестве отрицательного контроля эффектор клеток. Следующий протокол описывает in vitro в режиме реального времени цитолиза потенции анализа для адепта опухолевых клеток линий.
- Добавьте 100 кЛ среды культуры целевых клеток к каждому колодцу xCELLigence E-Plate, поместите пластину внутри прибора xCELLigence и примите фоновое чтение. Затем, передача E-плиты в ткани культуры капюшон для клеточного посева.
- Используйте стандартный протокол для trypsinize целевых раковых клеток из устройства культуры. Затем перенесите клетки в центрифугу 15 мл и добавьте свежую культурную среду, до 15 мл. Пелле клетки центрифугации в течение 5 мин при 200 х г. Откажитесь от супернатанта, добавьте 5 мл свежей среды и используйте серологический пипетку, чтобы аккуратно переопустить клеточную гранулу. Подсчитайте плотность живых клеток с помощью гемоцитометра и микроскопа.
- Отрегулируйте плотность клеток соответствующим образом, а затем добавьте 100 л клеточной подвески к каждой скважине E-Plate. Целевой номер ячейки, как правило, около 10000 клеток / хорошо для приверженных клеточных линий (BxPC3, Hela-CD19, и SKOV3), или 30000 клеток / хорошо для подвесных клеток, таких как Raji (см. ниже для деталей относительно precoating скважин с антителами для того, чтобы притронет жидкие раковые клетки).
- Уравновешивать E-Plate при комнатной температуре в течение 30 минут, чтобы клетки равномерно оседают на дне колодца (это очень важно; не пропускайте этот шаг).
- Поместите E-Plate в инструмент xCELLigence внутри инкубатора клеточной культуры и начните измерять импеданс, отображаемый как Cell Index против времени, автоматически каждые 15 минут.
- На следующий день подготовьте эффектор CAR T-клетки. Убедитесь в том, чтобы подготовить соответствующие элементы управления (т.е. Mock CAR Т-клеток, нетрансиндуированных контроль Т-клеток, и / или не связанных CAR Т-клеток) заранее, чтобы убедиться, что все клетки готовы в то же время. Отрегулируйте клетки-эффекторы и контрольные элементы до надлежащей плотности и подготовьте серийные разбавления, чтобы обеспечить желаемое соотношение E:T будет достигнуто, когда 100 ЗЛ суспензии ячейки эффектора добавляется к каждому колодцу в шаге 9.
- Пауза xCELLigence сбора данных и довести E-Plate от инкубатора к капюшону клеточной культуры.
- Удалите 100 л среды из каждого колодца. Количество остаточной среды в каждой скважине в настоящее время составляет 100 л.
- Добавьте 100 л последовательно разбавленного эффектора CAR T-клеток или других контрольных ячеек (т.е. Mock CAR T-клеток) для достижения желаемого соотношения E:T.
- Выровнять E-Plate при комнатной температуре в течение 30 минут, чтобы позволить клеткам-эффектору поселиться, а затем поместите E-Plate обратно в инструмент xCELLigence. Возобновить сбор данных.
- При желании, в ключевые точки времени xCELLigence приобретение данных может быть приостановлено и пластины удалены для того, чтобы собрать небольшие образцы для анализа ортогоналовых анализов (т.е., измерения производства цитокинов ELISA или потока цитометрии).
- В эксперименте EGFR-GITR-CD3 CAR T-cell измерьте выход INF с комплектом ELISA (следуйте инструкциям производителя; см. Таблицу материалов).
ПРИМЕЧАНИЕ ПРИМЕЧАНИЕ ПРИМЕЧАНИЕ ЛИКВУК КРАКС: Для тестирования непридерживающиеся гематологических раковых клеток, до добавления клеток скважины E-Plate сначала покрыты антителом, которое характерно для антигена, который выражается на поверхности раковых клеток. Для линии клеток Raji B используется привязывающий реагент на основе анти-CD40 (см. набор жидкой опухоли, убивающий асссев в таблице материалов). Ниже приведена процедура покрытия пластины: - Разбавить привязавательный реагент (анти-CD40) привязывающими буфером до концентрации 4 мкг/мл.
- Работая внутри капюшона культуры ткани, добавьте 50 зл ели разбавленного привязного реагента к каждой скважине E-Plate. Оставьте E-Plate при комнатной температуре или в инкубаторе 37 градусов по Цельсию на 3 ч.
- Удалите привязывание реагента и мыть E-плиты по крайней мере 2x с мытьем буфера. На данный момент E-Plate готов к посеву целевых ячеек Раджи (30 000 клеток/колодца).
- Продолжить шаг 4.1 (выше), чтобы выполнить остальную часть процедуры.
Результаты
CAR лентивирусной подготовки и CAR Т-клеток генерации и потенции оценки
Титры препаратов CAR lentivirus определялись с помощью количественного комплекта RT-PCR (см. Таблицу материалов)в соответствии с протоколом производителя. Протокол титрования извлекли РНК вируса сначала, а затем измерили номер копии лентивирусной РНК, который указал количество инфекционных вирусных частиц. Титр вируса, генерируемого из одной 150-мм тарелки с использованием вышеуказанного протокола, обычно колеблется от 109-1010 вирусных копий/мл. На рисунке 2А показан номер цикла RT-PCR по сравнению с силой сигнала от репрезентативного количественного результата ПЦР. После того, как качество вируса было удовлетворено, когда титр был больше, чем 1 х 108 pfu/mL, он был заморожен вниз для последующего т-клеток трансдукции. После того, как Т-клетки CAR были трансумциированы с помощью лентивирусной связи, Т-клетки культивировались в течение дополнительных 12-14 дней, сохраняя их плотность около 1 х 106 х 106 клеток/мл. CAR Т-клетки были затем проверены с анти-ScFv-специфических антител с помощью цитометра потока до применения вниз по течению или заморозить вниз. Хороший репрезентативный результат партии показан на рисунке 2B. Используя анти-ScFv антитела, около 50% из клеток CAR T окрашенных положительных (No 2 50,6% против Т-клеток 1%), что свидетельствует о выражении ЦАР примерно в 50% Т-клеток. Впоследствии, RTCA потенции асссбыл был выполнен для определения цитолиза, прежде чем каждая партия CAR Т-клеток была заморожена и готова к будущему применению. Один цикл car T-клеток дизайн, генерация, и оценка процедуры занимает около 1 месяца.
Убийство клеток лимфомы Раджи В клетками CD22-CAR T
Анти-CD40 жидких опухолей привязывая комплект (см. Таблица материалов) был использован в концентрации 4 мкг/мл, чтобы покрыть E-плиты для 3 ч при 37 градусов по Цельсию. После мытья скважин с привязывающим буфером, В-клеточные клетки лимфомы были добавлены в E-Plate при плотности 30000 клеток/ хорошо. После того, как клетки могли довольствоваться 30 минутами, E-Plate была помещена обратно в инструмент xCELLigence, и показания импеданса были немедленно начаты для того, чтобы захватить вложение и пролиферацию клеток. На следующий день были добавлены либо CD22-CAR T-клетки, Т-клетки Mock CAR, либо нетрансутированные Т-клетки. На рисунке 3соотношение E:T 10:1 использовалось для всех типов клеток. CD22-положительные клетки Раджи, обработанные с CD22-CAR Т-клеток отображается значительное убийство (зеленый след) по сравнению с отрицательными контроля (нетрансиндуцированных Т-клеток и Мок CAR Т-клеток).
Эффективное убийство раковых клеток поджелудочной железы клетками CD47-CAR T
CD47 является трансмембранным поверхностным гликопротеином суперсемейства иммуноглобулина. Как интегрин-связанный протеин, он высоки выражен в обоих гематологических раках (лейкемия, лимфома, и множественной миеломы) и твердых рака (таких как рак яичников, мелкоклеточного рака легких, поджелудочной железы, глиобластомы) и других видов рака36,37. CD47 также известен как не-есть-я сигнал макрофагов, который сделал его потенциальной терапевтической мишенью в некоторых видов рака. CD47-CAR Т-клетки были произведены и протестированы против BxPC3 раковых клеток поджелудочной железы, которые выражают высокий уровень CD4738,39. Клетки BxPC3 были посеяны в E-Plate на 1 день при плотности 10000 клеток / хорошо. Мониторинг в реальном времени показал, что эти клетки достигли всблонь после 16 ч. В этот момент, CAR Т-клетки были добавлены в соотношении E:T 10:1 (Рисунок 4A). Также были добавлены элементы контроля, такие как нетрансиндутовые Т-клетки и Т-клетки Mock CAR. Результаты ясно показывают, что CD47-CAR T клетки выборочно убивают целевые клетки BxPC329. Кроме того, на рисунке 4B показано, что сигнал импеданса при добавлении клеток CD47-CAR T в пустой колодец значительно ниже, чем сигнал импедеданса, генерируемый целевыми ячейками BxPC3. Значение индекса ячеек от скважин только с клетками CD47-CAR T достигло максимума 0,14, что лишь немного выше сигнала только от среды (0,02). Это указывает на то, что в этом неоднородном убийственом анализе сигнал импеданса выводится почти исключительно из раковых клеток-мишеней.
Костимуляция Т-клеток CAR по домену GITR
Когда выражается в EGFR-GITR-CD3 CAR, GITR costimulatory домена ранее сообщалось для повышения убийства EGFR-положительных раковых клеток SKOV3, но не EGFR-отрицательных MCF-7 раковых клеток30. Чтобы лучше прояснить роль домена GITR, были созданы и протестированы конструкции CAR, содержащие полнометражный домен GITR, или удаленные или перестроенные версии домена, и протестированы на способность коактивировать клетки CAR T(рисунок 5A). Данные xCELLigence на рисунке 5B,C показывают, что домен GITR costimulatory усиливает убийство клеток CAR EGFR-положительных целевых ячеек выше того, что наблюдается с оригинальной конструкцией CAR, в которой отсутствует домен GITR. Кроме того, удаляя 10 аминокислот из домена ГИТР (аминокислоты 184-193) упразднили эту стимулирующую деятельность. В отличие от этого, перестановка относительного позиционирования домена GITR в рамках конструкции ЦАР оказалась менее вредной для его стимулирующих возможностей. Используя данные конечной точки, производство ИФНЗ в качестве суррогата активации Т-клеток также продемонстрировало стимулирующую активность домена GITR(рисунок 5B). В отличие от конечных данных, которые являются просто "снэп выстрел", непрерывный профиль impedance прибора xCELLigence четко освещает тонкие различия в убийстве кинетики различных методов лечения (Рисунок 5C). Результаты, полученные здесь, согласуются с результатами исследования in vivo30.
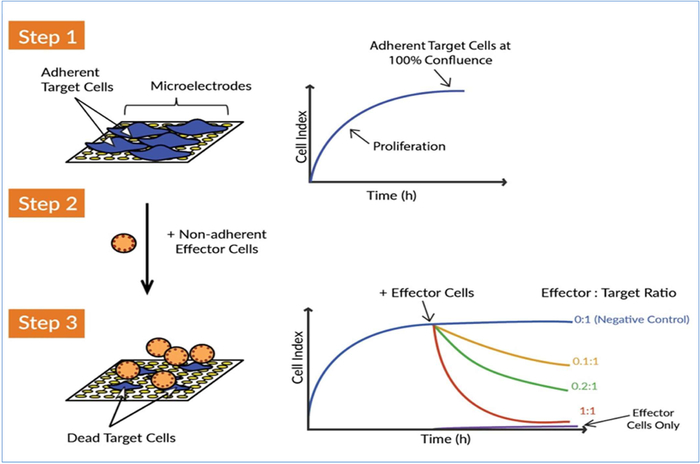
Рисунок 1: Система анализа клеток xCELLigence в реальном времени (RTCA) обнаруживает убийство клеток-мишеней клетками-эффекторами. Есть три основных концептуальных шага для измерения убийствельной активности клеток CAR T-эффектора против целевых раковых клеток. Шаг 1: Семя клетки-мишени (т.е. опухолевые клетки) в колодец E-плиты. Клетки прикрепляются к микроэлектродам золотого биосенсора, что препятствует потоку электрического тока между электродами. Это значение impedance измеряется и построено как безединый параметр, называемый Cell Index. Значение индекса клеток увеличивается по мере роста клеток и достигает плато по мере приближения клеток к слиянию. Шаг 2: Эффекторные клетки-непридерживаемые иммунные клетки впоследствии добавляются. Поскольку эти клетки не придерживаются золотых микроэлектродов, они напрямую не вызывают изменения в бесприступной деятельности. Шаг 3: Если клетки-эффекторы атакуют раковые клетки цели, разрушение опухолевых клеток отражается снижением индекса клеток с течением времени. Эта цитоличная активность клеток-эффекторов, или потенция клеток-эффекторов, может быть чувствительно и точно контролируется. Непрерывное получение impedance данных из системы xCELLigence позволяет в режиме реального времени убийство кинетического анализа для нескольких условий одновременно. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.
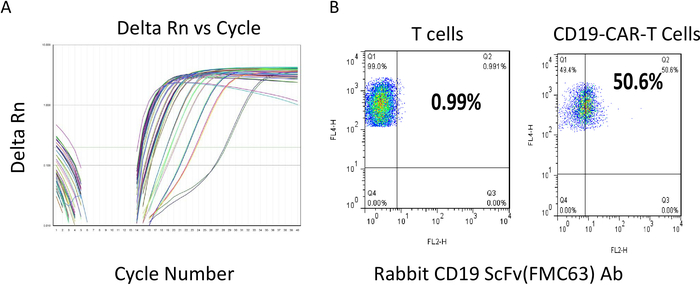
Рисунок 2: Титер определение лентивирусной и цитометрии потока оценки CAR Т-клеток. (A) Лентивирная дичер определение. Различные цветовые линии являются репрезентативными образцами для числа циклов по сравнению с дельтой Rn. Низкие числа цикла указывают на относительно большое количество шаблона РНК вируса, присутствующем в образцах. (B) После трансдукции, CAR Т-клетки были культивированы и поддерживается при плотности менее 2 х 106 клеток / мл, а затем подвергаются анализу потока. Оси y-отражаетокрашивание для Т-клеток, с положительными значениями, отраженными в областях No1 и No2. Оба образца на 100% положительные для Т-клеток. Выражение CAR scFV определяется с помощью scFv-специфического Ab (x-оси). Результат показывает, что более 50% Т-клеток являются положительными в CD22-CAR Т-клеток. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.
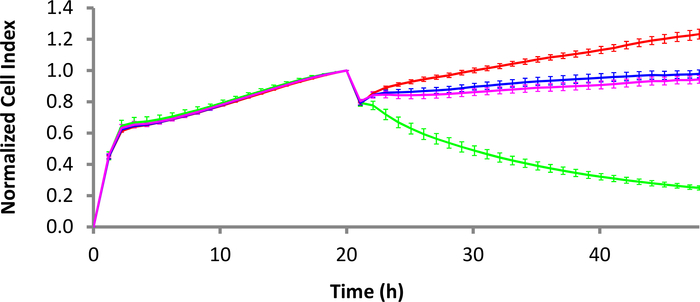
Рисунок 3: Убийственная динамика Т-клеток CD22-CAR против лимфомы клеток Раджи Буркитта. В то время как красная кривая является только клетками Раджи, зеленая кривая – это клетки Раджи, обработанные Т-клетками CD22-CAR. Розовые и синие кривые Mock CAR Т-клеток лечения и нетрансиндуцированной Т-клеточной обработки, соответственно. Коэффициент E:T 10:1. Бары ошибок являются стандартным отклонением. Шкала времени устанавливается с интервалом в 2 ч для легкого отображения, хотя доступно больше точек данных. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.
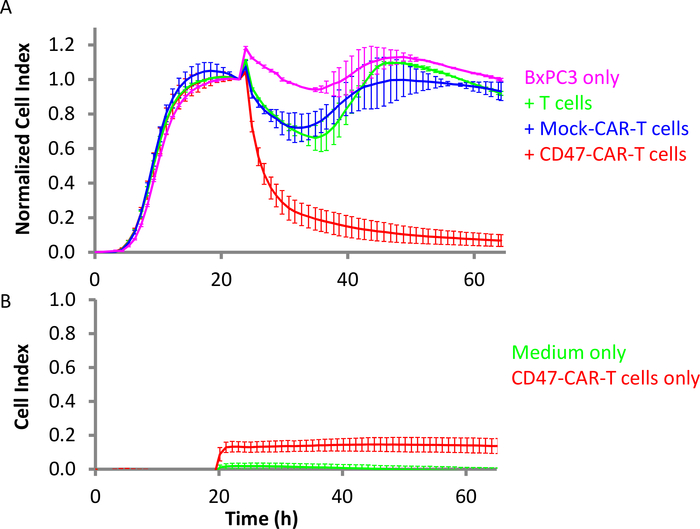
Рисунок 4: Эффективность Т-клеток CD47-CAR против поджелудочная железа твердых опухолевых клеток. (A) Розовый является целью BxPC3 клетки в одиночку, в то время как красный BxPC3 с CD47-CAR Т-клетки добавил. Зеленый цвет BxPC3 с добавлением nontransduced Т-клеток, и синий с Mock CAR T-клетками. Коэффициент E:T 10:1. (B) В том же месте, красный является пустым (отсутствие целевых ячеек) контроль скважин с CD47-CAR Т-клеток только и зеленый является только средой. Бары ошибок являются стандартным отклонением. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.
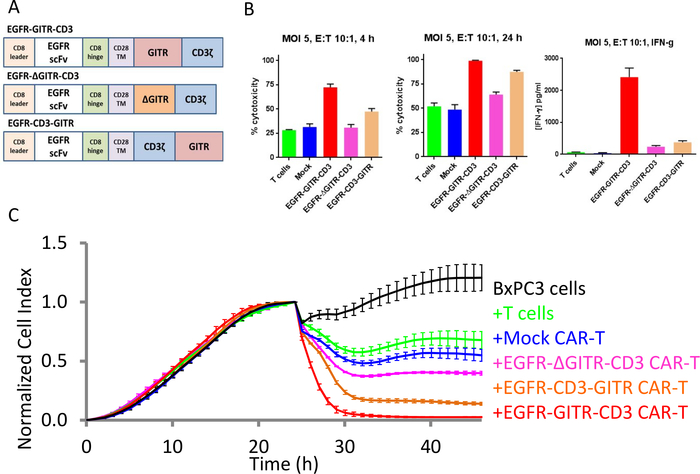
Рисунок 5: ДОмен GITR увеличивает цитотоксическую активность CAR T против EGFR-положительных опухолевых клеточных линий. (A) Различные конструкции CAR. (B) Бар участков % цитоз для различных конструкций ЦАР на 4 ч (слева) и 24 ч (средний). Продукция ИФНЗ на уровне 24 ч показана справа. (C) Непрерывная оценка убийства для всех конструкций. Черная кривая является кривой роста bxPC3 раковых клеток яичников только. Зеленая кривая является целевой клетки, обработанные только Т-клеток, синяя кривая является целевой клетки, обработанные Мок CAR Т-клеток, красная кривая является целевой клетки, обработанные EGFR-CD3-GITR-T клеток. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.
Обсуждение
Химерные рецепторы антигена являются многодоменными белками, состоящими из внеклеточного одноцепного переменного фрагмента (область scFv), области шарнира, трансмембранной области и цитоплазматического домена, состоящего из доменов Сигнализации TCR и дополнительных затратных доменов от рецепторов, таких как CD28 и OX4011,40. Для разработки безопасных, селективных и эффективных CARs, крайне важно, чтобы различные перестановки в дизайне CARs тщательно протестированы с использованием in vitro потенции анализы и, в конечном итоге, животных моделей. В этом исследовании мы предоставили протокол и рабочий процесс о том, как анализ потенции in vitro может информировать дизайн эффективных ЦАРов.
При разработке любого типа потенции, особенно для производственных целей, крайне важно, чтобы асссе будет чувствительным, надежным, последовательным, и как можно ближе к механизму действия, как это возможно16,17,41. Описанная здесь потенция в реальном времени предназначена для измерения цитолитической активности Т-клетки CAR напрямую, а не с помощью суррогатного маркера, такого как высвобождение цитокинов. Важно отметить, что для проведения ассея не требуется никаких дополнительных компонентов, таких как красители или реагенты, кроме пластины для ассеа (E-Plate) и рекомендуемых носителей для поддержания клеток. Кроме того, анализ является изысканно чувствительным и обеспечивает высоко воспроизводимые данные по сравнению с другими этикетками на основе анализов42,43,44. Кроме того, анализ xCELLigence поддается использованию очень низких коэффициентов эффектора к цели, что идеально подходит для оценки конкретного цитолиза.
Для того, чтобы продемонстрировать гибкость и полезность системы xCELLigence, мы сосредоточились на двух типах опухолей, а именно на опухолях гематологического происхождения и твердых опухолях. Для того, чтобы оценить потенцию CD22-направленных Т-клеток CAR, клетки Раджи (т.е. В-клеточная лимфома клеточной линии) были привязаны к E-плиты с помощью анти-CD40 антитела. Привязка клеток Раджи к нижней части E-плит приводит к сигналу импеданса, который отражает жизнеспособность и количество клеток Раджи в колодце. После добавления Клеток CD22-CAR T, клетки Раджи выборочно убойны в time- и effector-dependent образе, кульминацией в времени-зависимом уменьшении в сигнале impedance. Падение импеданса означает цитолиза или потерю жизнеспособности клеток Раджи17. Этот селективный подход привязывая используя антитела можно распространить к другим жидкостным линиям клетки тумора. Альтернативная стратегия использования опухолевых клеток линий гематологического происхождения заключается в использовании адептов раковых клеток, которые разработаны, чтобы застойно выразить опухолевые антигены, такие как CD19, выраженные в клетках HeLa. Преимущество этого подхода заключается в том, что родительские клетки HeLa легко доступны и могут быть использованы в качестве отрицательного контроля за спецификой. Такой подход уже был подтвержден с CHO-CD22 против CHO клеток и CHO-BCMAs против CHO ячеек29. Используя такие различные подходы, CAR Т-клеток дизайн и эффективность могут быть легко протестированы. XCELLigence асссе по своей сути гибок, и условия ассеса могут быть скорректированы для того, чтобы максимально приблизить физиологические условия.
Одним из основных преимуществ анализа потенции мы описали здесь, что это простой функциональный анализ и может быть использован в сочетании с генной инженерии методы для разработки оптимальных и эффективных CARs в высокой пропускной способностью моды. Как было показано здесь для CAR Т-клеток, предназначенных для целевой EGFR-положительных раковых клеток, ассс можно использовать для оценки относительной активности различных конструкций CAR / мутантов. Например, мы показали, что, когда домен GITR расположен вверх по течению домена CD3, он показывает гораздо более надежную цитолитическую активность, чем когда он расположен ниже по течению домена CD3.
Хотя это не коррелирует идеально с активностью in vivo CAR T клеток, в vitro цитокинов релиз исторически используется в качестве меры потенции CAR Т-клеток. Хотя xCELLigence основе потенции оценки, описанные здесь могут быть использованы для оценки клеточной терапии во время производства или до освобождения для клинического применения, насколько хорошо эти результаты коррелируют с эффективностью in vivo еще не было Установлено. Эффективность In vivo зависит от множества факторов и переменных, которые не могут быть повторены в рамках анализа in vitro. К таким переменным относятся: самонаводящиеся Т-клетки CAR к месту опухоли, стимуляция и активация Т-клетки CAR и ее способность сохраняться внутри пациента, а также микроокружение опухоли. При дальнейшем уточнении анализ xCELLigence может быть способен моделировать некоторые из этих сложных процессов in vitro.
Протокол, представленный здесь, применяется к большинству адептов линий раковых клеток и некоторым линиям клеток жидкой опухоли. Клинические образцы, такие как первичные раковые клетки, однако, должны быть дополнительно протестированы и оптимизированы из-за сложности типов опухоли и фаз. Это, безусловно, стоит отметить, что in vitro потенции системы анализа, описанной здесь использует раковые клетки линий только для отражения потенциальной активности CAR Т-клеток. Реальная ситуация опухоли внутри человеческого тела является гораздо более сложным, особенно когда твердая опухоль является мишенью, из-за динамической опухолевой среды и развития. Таким образом, результат оценки потенции не может перевести очень хорошо в клинической эффективности CAR Т-клеток испытания.
Таким образом, представленная платформа xCELLigence на основе импедеданса позволяет бесименно контролировать убийство клеток в течение длительного периода времени, а именно до 10 дней. Эта способность для такой длинной временной шкалы для сбора данных отличает технологию от других анализов, которые в настоящее время используются и которые требуют создания нескольких экспериментальных репликаторов для сбора временных точек и трудоемких манипуляций образца. Кроме того, минимальный сигнальный вклад эффектора иммунных клеток упрощает анализ данных. Программное обеспечение может обрабатывать данные автоматически и генерировать полезные параметры, такие как процент цитолиза, KT50 и т.д. Технология уже продемонстрировала высокую чувствительность (с соотношениями E:T как низко как 1:20) и большой динамический диапазон (с e:T соотношения от 20:1 до 1:20), который не легко достичь с другими анализами. В целом, внедрение этой технологии должно позволить более точный анализ данных по более высокой пропускной шкале, что позволит повысить развитие Т-клеточных реагентов CAR, продвигая поле гораздо более высокими темпами.
Раскрытие информации
Авторы проводят исследования в области развития Т-клеток CAR и связанных с ними анализов потенции, которые являются бизнес-интересами ProMab Biotechnologies и ACEA Biosciences, соответственно. Однако это не меняет приверженности авторов миссии JoVE по расширению распространения научных знаний. Условия этой публикации были рассмотрены и утверждены ProMab Biotechnologies и ACEA Biosciences в соответствии с ее политикой исследований.
Благодарности
Авторы благодарят ProMab Biotechnologies и ACEA Biosciences за предоставление реагентов и инструментов, используемых в данном исследовании.
Материалы
| Name | Company | Catalog Number | Comments |
| 7-AAD | Biolegend | 420404 | |
| Anti-CD40, liquid tumor killing assay kit | ACEA Biosciences | 8100005 | |
| anti-human F(ab')2 | Jackson Immunoresearch laboratories. | 109-116-088 | |
| APC anti-CD3 | Biolegend | 317318 | |
| Assay medium RPMI1640 | life technologies.Corp | 11875-093 | |
| CAR-T cell frozen solution CryostorCS10 | Stemcell technologies | #07930 | |
| CAR-T cell medium from ProMab | AIM-V+300IFU/ml IL-2 | 12055-091 | |
| CD3/CD28 coated microbeads, Dynabeads | Thermofisher | 11131D | |
| DMEM | GElifesciences.com | SH30243.02 | |
| FACS buffer | Promab made | ||
| FBS | Lonza.com | 14-503F | |
| HEK293FT | Thermo Fisher | R70007 | |
| INFg ELISA kit | Thermo Fisher | ||
| Lentiviral Packaging Mix | System Biosciences | VP100 | |
| Lenti-X quantitative RT-PCR titration kit (Clontech) | Takara | 631235 | |
| Promab medium for target cells | Varied with cell lines | ||
| Real time Cellular Analyer | ACEA Biosciences | ||
| Thermal cycler | Thermo Fisher | ||
| Transduction enhance agent, Virus Transduction Enhancer (Alstem) | Transplus, Alstem | V020 | |
| Transfection dilution solution, Opti-MEM | Thermo Fisher | ||
| Transfection reagent, NanoFect reagent | Alstem | NF100 |
Ссылки
- Miliotou, A. N., Papadopoulou, L. C. CAR T-cell Therapy: A New Era in Cancer Immunotherapy. Current Pharmaceutical Biotechnology. 19 (1), 5-18 (2018).
- June, C. H., O’Connor, R. S., Kawalekar, O. U., Ghassemi, S., Milone, M. C. CAR T cell immunotherapy for human cancer. Science. 359 (6382), 1361-1365 (2018).
- . FDA approval brings first gene therapy to the United States Available from: https://www.fda.gov/NewsEvents/Newsroom/PressAnnouncements/ucm574058.htm (2017)
- . FDA approves CAR-T cell therapy to treat adults with certain types of large B-cell lymphoma Available from: https://www.fda.gov/newsevents/newsroom/pressannouncements/ucm581216.htm (2017)
- Liu, B., Song, Y., Liu, D. Clinical trials of CAR-T cells in China. Journal of Hematology & Oncology. 10 (1), 166 (2017).
- Fry, T. J., et al. CD22-targeted CAR T cells induce remission in B-ALL that is naive or resistant to CD19-targeted CAR immunotherapy. Nature Medicine. 24 (1), 20-28 (2018).
- Yang, Y., Jacoby, E., Fry, T. J. Challenges and opportunities of allogeneic donor-derived CAR T cells. Current Opinion in Hematology. 22 (6), 509-515 (2015).
- . Celyad Announces FDA Acceptance of IND Application for CYAD-101, a First-in-Class Non-Gene Edited Allogeneic CAR-T Candidate Available from: https://www.celyad.com/en/news/celyad-announces-fda-acceptance-of-ind-application-for-cyad-101-a-first-in-class-non-gene-edited-allogeneic-car-t-candidate (2017)
- Sheridan, C. Allogene and Celularity move CAR-T therapy off the shelf. Nature Biotechnology. 36 (5), 375-377 (2018).
- D’Aloia, M. M., Zizzari, I. G., Sacchetti, B., Pierelli, L., Alimandi, M. CAR-T cells: the long and winding road to solid tumors. Cell Death & Disease. 9 (3), 282 (2018).
- Xu, J., et al. Combination therapy: A feasibility strategy for CAR-T cell therapy in the treatment of solid tumors. Oncology Letters. 16 (2), 2063-2070 (2018).
- Xia, A. L., Wang, X. C., Lu, Y. J., Lu, X. J., Sun, B. Chimeric-antigen receptor T (CAR-T) cell therapy for solid tumors: challenges and opportunities. Oncotarget. 8 (52), 90521-90531 (2017).
- Yong, C. S. M., et al. CAR T-cell therapy of solid tumors. Immunology and Cell Biology. 95 (4), 356-363 (2017).
- Newick, K., O'Brien, S., Moon, E., Albelda, S. M. CAR T Cell Therapy for Solid Tumors. Annual Review of Medicine. 68, 139-152 (2017).
- de Wolf, C., van de Bovenkamp, M., Hoefnagel, M. Regulatory perspective on in vitro potency assays for human mesenchymal stromal cells used in immunotherapy. Cytotherapy. 19 (7), 784-797 (2017).
- Cerignoli, F., et al. In vitro immunotherapy potency assays using real-time cell analysis. PLOS ONE. , (2018).
- Holden, H. T., Oldham, R. K., Ortaldo, J. R., Herberman, R. B. Standardization of the chromium-51 release, cell-mediated cytotoxicity assay: cryopreservation of mouse effector and target cells. Journal of the National Cancer Institute. 58 (3), 611-622 (1977).
- Somanchi, S. S., McCulley, K. J., Somanchi, A., Chan, L. L., Lee, D. A. A Novel Method for Assessment of Natural Killer Cell Cytotoxicity Using Image Cytometry. PLOS ONE. 10 (10), e0141074 (2015).
- Mukherjee, M., Mace, E. M., Carisey, A. F., Ahmed, N., Orange, J. S. Quantitative Imaging Approaches to Study the CAR Immunological Synapse. Molecular Therapy: The Journal of the American Society of Gene Therapy. 25 (8), 1757-1768 (2017).
- Zaritskaya, L., Shurin, M. R., Sayers, T. J., Malyguine, A. M. New flow cytometric assays for monitoring cell-mediated cytotoxicity. Expert Review of Vaccines. 9 (6), 601-616 (2010).
- Nelson, D. L., Kurman, C. C., Serbousek, D. E. Chapter 7, Unit 7: 51Cr release assay of antibody-dependent cell-mediated cytotoxicity (ADCC). Current Protocols in Immunology. , 27 (2001).
- Abassi, Y. A., et al. Label-free, real-time monitoring of IgE-mediated mast cell activation on microelectronic cell sensor arrays. Journal of Immunological Methods. 292 (1-2), 195-205 (2004).
- Glamann, J., Hansen, A. J. Dynamic detection of natural killer cell-mediated cytotoxicity and cell adhesion by electrical impedance measurements. Assay and Drug Development Technologies. 4 (5), 555-563 (2006).
- Solly, K., Wang, X., Xu, X., Strulovici, B., Zheng, W. Application of real-time cell electronic sensing (RT-CES) technology to cell-based assays. Assay and Drug Development Technologies. 2 (4), 363-372 (2004).
- Zhu, J., Wang, X., Xu, X., Abassi, Y. A. Dynamic and label-free monitoring of natural killer cell cytotoxic activity using electronic cell sensor arrays. Journal of Immunological Methods. 309 (1-2), 25-33 (2006).
- Ke, N., Wang, X., Xu, X., Abassi, Y. A. The xCELLigence system for real-time and label-free monitoring of cell viability. Methods in Molecular Biology. 740, 33-43 (2011).
- Lamarche, B. J., Xi, B., Cerignoli, F. Quantifying the Potency of Cancer Immunotherapies: Immune Cell-Mediated Killing Kinetics and Efficacy Analysis in Real-Time without the Use of Labels. Genetic Engineering & Biotechnology News (GEN). 36 (14), 18-19 (2016).
- Golubovskaya, V., et al. CD47-CAR-T Cells Effectively Kill Target Cancer Cells and Block Pancreatic Tumor Growth. Cancers. 9 (10), (2017).
- Golubovskaya, V. M., et al. GITR domain inside CAR co-stimulates activity of CAR-T cells against cancer. Frontiers in Bioscience. 23, 2245-2254 (2018).
- Guedan, S., et al. Enhancing CAR T cell persistence through ICOS and 4-1BB costimulation. JCI Insight. 3 (1), (2018).
- Erskine, C. L., Henle, A. M., Knutson, K. L. Determining optimal cytotoxic activity of human Her2neu specific CD8 T cells by comparing the Cr51 release assay to the xCELLigence system. Journal of Visualized Experiments. (66), e3683 (2012).
- Davenport, A. J., et al. CAR-T Cells Inflict Sequential Killing of Multiple Tumor Target Cells. Cancer Immunology Research. 3 (5), 483-494 (2015).
- Hegde, M., et al. Tandem CAR T cells targeting HER2 and IL13Ralpha2 mitigate tumor antigen escape. The Journal of Clinical Investigation. 126 (8), 3036-3052 (2016).
- Jin, J., et al. Enhanced clinical-scale manufacturing of TCR transduced T-cells using closed culture system modules. Journal of Translational Medicine. 16 (1), 13 (2018).
- Weiskopf, K. Cancer immunotherapy targeting the CD47/SIRPalpha axis. European Journal of Cancer. 76, 100-109 (2017).
- Huang, Y., Ma, Y., Gao, P., Yao, Z. Targeting CD47: the achievements and concerns of current studies on cancer immunotherapy. Journal of Thoracic Disease. 9 (2), E168-E174 (2017).
- Ma, S., Thorpe, P., Vitetta, E., Meyer, J. Combined targeting of exposed phosphatidylserine, CD47 and CD54 on human pancreatic tumor cells in a mouse xenograft model of human pancreatic cancer (P4455). The Journal of Immunology. 190 (1 Supplement), (2013).
- Yamamoto, K., et al. Emergence of CD47- high expression cells confers enhanced tumorigenicity upon KDM6B suppression in pancreatic cancer. Cancer Research. 76 (2 Supplement), (2016).
- Xu, D., et al. The development of CAR design for tumor CAR-T cell therapy. Oncotarget. 9 (17), 13991-14004 (2018).
- FDA. . Guidance for Industry, Potency Tests for Cellular and Gene Therapy Products. , (2017).
- Limame, R., et al. Comparative analysis of dynamic cell viability, migration and invasion assessments by novel real-time technology and classic endpoint assays. PLOS ONE. 7 (10), e46536 (2012).
- Chiu, C. H., et al. Comparison between xCELLigence biosensor technology and conventional cell culture system for real-time monitoring human tenocytes proliferation and drugs cytotoxicity screening. Journal of Orthopaedic Surgery and Research. 12 (1), 149 (2017).
- Hillger, J. M., Lieuw, W. L., Heitman, L. H., IJzerman, A. P. Label-free technology and patient cells: from early drug development to precision medicine. Drug Discovery Today. 22 (12), 1808-1815 (2017).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены