Method Article
Um ensaio de potência em tempo real para células T do receptor de antígeno quimérico visando células cancerosas sólidas e hematológicas
Neste Artigo
Resumo
Descrevemos um sistema quantitativo de ensaio de citolíse in vitro em tempo real para avaliar a potência das células T do receptor de antígeno quimérico que visam células tumorais líquidas e sólidas. Este protocolo pode ser estendido para avaliar outras células efetores imunes, bem como tratamentos combinados.
Resumo
A terapia com células T do receptor de antígeno quimérico (CAR) para o câncer alcançou benefícios clínicos significativos para neoplasias hematológicas resistentes e refratárias, como leucemia linfócito aguda infantil. Esforços estão em andamento para estender essa terapia promissora para tumores sólidos, além de outros cânceres hematológicos. Aqui, descrevemos o desenvolvimento e a produção de potentes células T CAR visando antígenos com expressão única ou preferencial em células tumorais sólidas e líquidas. A potência in vitro dessas células T CAR é então avaliada em tempo real usando o ensaio xCELLigence altamente sensível à base de impedância. Especificamente, o impacto de diferentes domínios de sinalização costimulatória, como a proteína relacionada ao receptor de necrose tumoral induzida por glicocorticoide (TNFR) (GITR), sobre a potência in vitro das células T CAR é examinada. Este relatório inclui protocolos para: geração de células T CAR para estudos pré-clínicos usando transdução de genes lentivirais, expansão das células T CAR, validando a expressão do CAR e executando e analisando ensaios de potência xCELLigence.
Introdução
Nos últimos anos, a terapia com células T da RCA tem sido um dos avanços mais proeminentes na imunoterapia do câncer para neoplasias hematopoiéticas reincidentes e refratárias. Com os eua recentes Food and Drug Administration (FDA) aprovação de células T CAR dirigidas por CD19 para leucemia linfoblástica aguda, linfoma não Hodgkin e linfoma difuso de grandes células B, e a designação de terapia inovadora para antígeno de maturação de células B (BCMA) dirigiu células T de CARRO para mieloma múltiplo, esta tecnologia gerou grande excitação na comunidade científica e tem alimentado inúmeros estudos básicos, aplicados e clínicos em todo o mundo1, 2,3, 3, 3,3, 3, 3, 3, 3, 3, 3, 3, 3, 3, 3, 3, 3, 3, 3, 3, 3, 3, 3, 3, 3, 3, 3, 3, 3, 3, 3, 3, 3, 3, 3, 3, 3, 3, 3, 3 de ensino básico e clínico alimentaram inúmeros estudos básicos, aplicados e clínicos em todo o mundo1,2,3, 3 4,5. Em janeiro de 2019, mais de 700 ensaios clínicos foram registrados no banco de dados de ensaios clínicos (clinicaltrials.gov); cerca de 450 desses ensaios estavam prestes a começar ou estavam recrutando ativamente pacientes. A maioria dos ensaios clínicos estão focados em neoplasias hematológicas, e ensaios clínicos utilizando células T CAR visando CD20, CD22 e BCMAs, além de CD19, estão emcurso,bem como6,7. Enquanto a maioria dos ensaios estão usando a terapia autologous CAR Células T, um número significativo deles também estão explorando a utilidade das células T do CARRO alogênico8,9,10. Apesar dos resultados promissores com malignidades hematológicas, o uso de células T CAR para atingir tumores sólidos tem se mostrado muito mais difícil na clínica por uma variedade de razões, incluindo, mas não se limitando à falta de bons alvos que são expressos exclusivamente no tumor, a heterogeneidade de tumores sólidos e tumor "escape", e a dificuldade que as células CAR T têm em acessar o microambiente tumoral 11 ,12,13 , 14 , 14 , 14 , 14 , 14 , 14 , 14 , 14 , 14 , 14 , 14 , e a dificuldade que as células CAR T têm em acessar o microambiente tumoral 11 , 12 , 13 , 14 , 14 , 14 , 14 , 14 , 14 , 14 , 14 , 14 , 14 , 14 , 14 , 14 , 14 , 14 , 14 , 14 , 14 , 14 , 14 , 14 , 14 , 14 , 14 , 14 , 14 , ea dificuldade que as células CAR T têm em acessar o microambiente tumoral 11 , 12 , 13 , 14 , 14 , 14 , 14 , 14 , 14 , 14 , ea dificuldade que as células CAR T têm em acessar o microambiente tumoral11,12,13 , 14,14, 15.Há uma necessidade crítica para o desenvolvimento de células T CAR específicas de tumor estoirização sólidaque podem superar essas barreiras à eficácia e ao problema da toxicidade "no tumor alvo". Enquanto uma infinidade de abordagens in vitro e in vivo são justificadas no projeto e teste de células T CAR, um ensaio de potência in vitro robusto e preditivo é de importância primária16,17.
A fim de avaliar a potência das células T CAR, vários métodos in vitro foram desenvolvidos. Em geral, esses ensaios de potência podem ser divididos em duas categorias amplas, dependendo se eles(i)medir diretamente a atividade ctolítica das células T CAR contra células tumorais alvo, ou (ii)medir marcadores substitutos, como citocinas que são liberados pelas células T CAR como eles matam as células-alvo. Técnicas que medem a atividade citolítica diretamente incluem o ensaio de liberação cromo-51 (CRA)18,ensaios baseados em imagens que medem a apoptose de células-alvo usando sondas fluorescentes19,20,e ensaios de citometria de fluxo que detectam células-alvo apoptotéticas21. Nestes ensaios, as células T CAR são tipicamente co-cultivadas com células-alvo que foram pré-rotuladas com sondas radioativas ou fluorescentes, seguidas de medição adequada. Embora tenha sido considerado o padrão ouro no campo devido à sua sensibilidade, o CRA tem algumas desvantagens. Primeiro, é um ensaio de ponto final e não fornece informações cinéticas. Em segundo lugar, as células-alvo precisam ser rotuladas com cromo-51, que tende a lixiviar para fora das células e pode aumentar significativamente o ruído de fundo22. Por último, exige as devidas precauções e a eliminação dos resíduos radioactivos. Ensaios alternativos, que medem subprodutos da interação com células T do CAR com células-alvo como uma indicação de potência, incluem a quantidade de várias citocinas liberadas pelas células T CAR usando métodos baseados em citometria de fluxo ou ensaios imunosordobrados ligados a enzimas. Mais uma vez, estes são ensaios de ponto final que medem a liberação cumulativa das citocinas em um determinado ponto de tempo e, portanto, podem não refletir necessariamente a atividade citolítica real das células T CAR.
Ao desenvolver um ensaio de potência, particularmente aquele que define os critérios de liberação para uma terapia baseada em células, como uma célula T car, é fundamental que o ensaio envolva manipulações mínimas e tempo prático porque cada interação é outra variável que precisa ser contabilizada e pode diminuir a robustez geral e a consistência do ensaio. Além disso, a interação das células T CAR com as células tumorais é um processo dinâmico, e fornecer informações sobre essas interações dinâmicas, como a taxa de citocise, é de importância primordial para a avaliação da potência. Com esses critérios em mente, desenvolvemos um ensaio de potência cinética sem rótulopara células T CAR que utiliza a plataforma de análise de células em tempo real xCELLigence (RTCA). a xCELLigence utiliza placas especializadas de microtiter (Placas E) que contêm biossensores de ouro embutidos na parte inferior de cada poço. Trabalhando com células tumorais sólidas aderentes, ou células cancerosas líquidas que foram amarradas usando anticorpos específicos, esses biossensores monitoram em mudanças induzidas por células T em tempo real no número de células-alvo, tamanho celular, força de fixação de substrato celular e interações células celulares (ou seja, função de barreira)17,23,24,25,27,28. O fluxo de trabalho é simples e envolve simplesmente semeadura das células-alvo para os poços de Placas-E, seguido pela adição das células T CAR em diferentes proporções efeteror-a-alvo (Figura 1). Posteriormente, à medida que os biossensores monitoram continuamente a viabilidade das células-alvo, os dados são automaticamente exibidos em tempo real.
Nos últimos 15 anos, o ensaio xCELLigence foi validado para avaliar a potência das células assassinas naturais (NK), células T, células T CAR, inibidores de checkpoint, anticorpos biespecíficos, vírus oncolíticos e algumas terapias combinadas17,29,30,31,32,33,34. Recentemente, o ensaio de potência xCELLigence foi avaliado para a fabricação de células T projetadas por células T35. Aqui relatamos empregar o sistema RTCA para avaliar a potência in vitro das células T CAR projetadas para atingir tumores sólidos e tumores líquidos em terapias clínicas.
Protocolo
1. Geração de lentivírus car-codificação
NOTA: Uma vez que a construção específica do plasmid da T-pilha do CARRO é terminada (CD47 e outro), os CARs lentivirais são gerados pelo procedimento padrão, usando pilhas de 293 FT, uma mistura de empacotamento lentiviral, e agentes do transfection (veja a tabela dos materiais)como descrito29. Posteriormente, use um kit de reação em cadeia de transcrição reversa quantitativa (RT-PCR) e um cycler térmico (ver a Tabela de Materiais)para determinar o titer do vírus medindo a quantidade de RNA lentiviral de acordo com o protocolo do fabricante. É importante que todos os procedimentos lentivirais sejam realizados rigorosamente seguindo os requisitos de segurança.
- Sementes 15 x 106 células HEK293FT no meio modificado da Águia de Dulbecco (DMEM) e incubam as células durante a noite a 37 °C em um prato de 150 mm dentro de uma incubadora de 5% de CO2 umidificado.
- Prepare dois tubos de 15 mL com complexo de transfecção. O primeiro tubo contém DNA de plasmid de vetor lentiviral (5 μg) e mistura de embalagens lentivirais (22,5 μg) em 2,5 mL de solução de diluição de transfecção. O segundo tubo contém 82,5 μL de reagente de transfecção em 2,5 mL de solução de diluição de transfecção (ver a Tabela de Materiais).
- Pipet o conteúdo do tubo 1 no tubo 2, e incubar a mistura à temperatura ambiente por 15 min.
- Transfira o conteúdo do tubo dropwise para o prato de células HEK293FT e incubar a amostra durante a noite em 37 °C em uma incubadora de 5% umidificado CO2.
- No dia seguinte, substitua o meio existente por 19 mL de meio de cultura DMEM fresco e continue a incubar as células durante a noite dentro da incubadora de CO2 umidificada de 5% a 37 °C.
- Transfira o meio do prato para um tubo de centrífuga de 50 mL. Mantenha o tubo com o meio contendo vírus na geladeira.
- Repita o procedimento acima, adicionando DMEM fresco e coletando-o novamente após 1 dia.
- Combine duas coleções dos meios em um tubo da centrífuga. Centrífuga o tubo a 2.000 x g por 30 min a 4 °C.
- Transfira a maior parte do supernatant contendo lentivírus para um tubo de centrífuga ultraclara. Deixe um volume mínimo, cerca de 1 mL, do supernatant para evitar perturbar a pelota que pode conter células e / ou detritos.
- Ultracentrifuge o supernatant esclarecido acima em 110.000 x g para 100 min em 4 °C.
- Retire o supernatant cuidadosamente e adicione suavemente 100 μL de dmem médio para a pelota do vírus na parte inferior do tubo. Deixe o tubo no gelo por 15 min. Misture a solução suavemente e alide a solução lentivírus em tubos estéreis pré-refrigerados. Guarde estes tubos de estoque de vírus em um freezer de -80 °C.
- Use um kit rt-PCR quantitativo para determinar o d'água do lentivírus de acordo com o protocolo do fabricante, que extrai e mede rna lentiviral.
2. Geração e expansão das células T CAR
- Ative PBMCs humanos previamente congelados (cerca de 1 x 106 a 2 x 106 células) em 1 mL de célulaS T de CAR com um número igual de microesferas revestidas de CD3/CD28 (ver a Tabela de Materiais)e incubar as células a 37 °C em uma incubadora de 5% co2 umumeizada por 24 h.
- Descongele um alibrdo do estoque de lentivírus no gelo.
- Adicione 1 μL de transdução melhorar agente no poço com as células e misture.
- Adicione lentivírus às células em uma multiplicidade de infecção (MOI) de 5:1 e misture suavemente. No dia seguinte, repita esta etapa (24 h após a primeira transdução).
- Monitore o crescimento das células T a cada 2-3 dias. Adicione mais fresco CAR T-cell médio para manter as células em uma densidade de 1 x 106 a 2 x 106 células / mL.
- Congele as células T car com um protocolo padrão usando solução de congelamento (veja a Tabela de Materiais).
- Descongele as células T car usando um método padrão e pré-cultura-los no meio de células T CAR por cerca de ~ 2-4 h com IL-2 (300 unidades / mL) antes de aplicá-los ao ensaio.
3. Detecção da expressão do CAR por citometria de fluxo
- Transfira 3 x 105 células T CAR e células T não transinduzidas para dois tubos separados de microcentrífuga de 1,5 mL.
- Centrífugas os tubos a 300 x g por 2 min e resuspendem as células em 200 μL de tampão de classificação celular ativada por fluorescência (FACS) contendo 1% de soro humano.
- Pipet 100 μL de solução celular em dois tubos FACS de poliestireno de 5 mL e mantenha os tubos no gelo por 5 min.
- Adicione 1 μL de anti-rato de cabra biotinylado F (ab')2 a um tubo de cada tipo de célula. Em seguida, adicione 2 μL de anticorpo anti-tag rotulado por EPe (veja a Tabela de Materiais)ao outro tubo de cada tipo de célula. Misture bem e incuba-los no gelo por 30 min.
- Lave as células com 3 mL de tampão FACS em cada tubo e centrífuga os tubos a 300 x g por 5 min; descartar os supernatantes e vórtices muito brevemente ou agitar os tubos brevemente para resuspender as células do líquido residual.
- Adicione 2 μL de APC anti-CD3 e 2 μL da solução de anticorpos 7-AAD (veja a Tabela de Materiais)a cada tubo. No tubo de células manchadas com anti-F (ab')2 Ab, adicione 1 μL de streptavidin a pe.rotulado. Misture brevemente e incubar os tubos no gelo por mais 30 min.
- Use o buffer FACS para lavar as células novamente, conforme descrito na etapa 3.5 e adicione um adicional de 200 μL de buffer FACS a cada tubo.
- Use citometria de fluxo para analisar as células por primeiro gating nas células T em uma dispersão para a frente vs lado dispersar enredo e, em seguida, gating nas células vivas (7-AAD-negativo) em um lote CD3 vs 7-AAD. O passo final é analisar anti-tag, anti-ScFv ou anti-F (ab')2 vs CD3.
4. Ensaio de potência da citocese em tempo real
NOTA: Realize o ensaio rtca de acordo com as condições recomendadas pelo fabricante. Em resumo, primeira placa as células-alvo nos poços da Placa E, seguido pela adição de células T CAR no dia seguinte. A atividade de citocise das células T CAR contra células-alvo é monitorada em tempo real. Células T e células T transinduzidas por simulações (células T do Carro Simulado) são usadas como controles de células efecionistas negativas. O seguinte protocolo descreve um ensaio in vitro da potência da citolyse em tempo real para linhas de células tumorais aderentes.
- Adicione 100 μL de meio de cultura de células-alvo para cada poço do xCELLigence E-Plate, coloque a placa dentro do instrumento xCELLigence, e fazer uma leitura de fundo. Em seguida, transfira o E-Plate para um capuz de cultura de tecido para semeadura celular.
- Use um protocolo padrão para trypsinizar células cancerosas alvo do dispositivo de cultura. Em seguida, transfira as células para um tubo de centrífuga de 15 mL e adicione o meio de cultura fresca, até 15 mL. Pelotas as células por centrífuga por 5 min a 200 x g. Descarte o supernatant, adicione 5 mL de meio fresco, e use uma pipeta sorológica para resuspender suavemente a pelota celular. Conte a densidade das células vivas usando um hemocytometer e microscópio.
- Ajuste a densidade celular adequadamente e, em seguida, adicione 100 L da suspensão celular para cada poço da Placa E. O número de células-alvo é tipicamente em torno de 10.000 células / bem para linhas celulares aderentes (BxPC3, Hela-CD19, e SKOV3), ou 30.000 células / bem para células suspensas, como Raji (veja abaixo para obter detalhes sobre poços de pré-revestimento com anticorpos, a fim de amarrar células cancerosas líquidas).
- Equilibre o E-Plate à temperatura ambiente por 30 min para permitir que as células se instalem uniformemente na parte inferior do poço (isso é crítico; não pule esta etapa).
- Coloque o E-Plate no instrumento xCELLigence dentro da incubadora de cultura celular e comece a medir a impedância, exibida como Índice de Celular versus tempo, automaticamente a cada 15 min.
- No dia seguinte, prepare células T car efetoras. Certifique-se de preparar controles apropriados (ou seja, células T Do Carro Simulado, células T de controle não transinduzidas e/ou células T CAR não relacionadas) antes do tempo para garantir que todas as células estejam prontas ao mesmo tempo. Ajuste as células efetivos e as células controle para a densidade adequada, e prepare diluições em série para garantir que as proporções E:T desejadas sejam alcançadas quando 100 μL de suspensão de células efetoras forem adicionadas a cada poço na etapa 9.
- Pausa mcelligence aquisição de dados e trazer o E-Plate da incubadora para um capuz de cultura celular.
- Retire 100 μL de médio de cada poço. A quantidade de meio residual em cada poço é agora 100 μL.
- Adicione 100 μL de células T CAR efetivos em série diluídas ou outras células controle (ou seja, células T Mock CAR) para alcançar as proporções E:T desejadas.
- Equilibre o E-Plate à temperatura ambiente por 30 min para permitir que as células efetivas se instalem e, em seguida, coloque a Placa E de volta para o instrumento xCELLigence. Retomar a aquisição de dados.
- Se assim for o desejar, nos pontos-chave xCELLigence aquisição de dados pode ser pausada e a placa removida, a fim de coletar pequenas amostras a serem analisadas por ensaios ortogonais (ou seja, medir a produção de citocina pela ELISA ou citometria de fluxo).
- No experimento de célulaS T car egfr-GITR-CD3, medir o rendimento INFγ com um kit ELISA (siga as instruções do fabricante; veja a Tabela de Materiais).
NOTA SOBRE o uso de cânceres líquidos: Para testar células cancerosas hematológicas não aderentes, antes de adicionar células os poços da Placa E são revestidos pela primeira vez com um anticorpo que é específico para um antígeno que é expresso na superfície das células cancerosas. Para a linha de células Raji B um reagente de amarração com base em anti-CD40 é usado (ver tumor líquido matando kit ensaio na Tabela de Materiais). Abaixo está o procedimento para revestir a placa: - Diluir o reagente de amarração (anti-CD40) com tampão de amarração a uma concentração de 4 μg/mL.
- Trabalhando dentro de uma capa de cultura de tecido, adicione 50 μL do reagente de amarração diluído a cada poço da Placa E. Deixe o E-Plate à temperatura ambiente ou em uma incubadora de 37 °C por 3 h.
- Retire o reagente de amarração e lave o E-Plate pelo menos 2x com tampão de lavagem. Neste ponto, o E-Plate está pronto para semeadura das células-alvo Raji (30.000 células / bem).
- Continue com a etapa 4.1 (acima) para realizar o resto do procedimento.
Resultados
Preparação de lentivírus car e geração de células T car e avaliação de potência
Os titers das preparações do lentivirus do CAR foram determinados usando um jogo quantitativo de RT-PCR (veja a tabela dos materiais)de acordo com o protocolo do fabricante. O protocolo de titration extraiu o vírus RNA primeiramente e mediu então o número lentiviral da cópia do RNA, que indicou a quantidade de partículas virais infecciosas. O titer do vírus gerado a partir de um prato de 150 mm usando o protocolo acima geralmente varia entre 109-1010 cópias virais/mL. A Figura 2A mostra o número do ciclo RT-PCR contra a força do sinal de um resultado de PCR quantitativo representativo. Uma vez que a qualidade do vírus foi satisfeita, quando o titer era maior de 1 x 108 pfu/mL, foi congelado para baixo para a transdução subseqüente da pilha de T. Depois que as células T car foram transinduzidas com lentivírus, as células T foram cultivadas por mais 12-14 dias, mantendo sua densidade em torno de 1 x 106 a 2 x 106 células/mL. As células T car foram então verificadas com anticorpos específicos anti-ScFv usando um citometro de fluxo antes de uma aplicação a jusante ou congelar. Um bom resultado de lote representativo é mostrado na Figura 2B. Usando um anticorpo anti-ScFv, cerca de 50% das células T CAR mantiveram positivo (Q2 50,6% vs. Células T 1%), indicando a expressão do CAR em cerca de 50% das células T. Posteriormente, o ensaio de potência RTCA foi realizado para determinação citolyse antes de cada lote de células T CAR foi congelado para baixo e pronto para aplicação futura. Um ciclo do projeto, da geração, da geração, e do procedimento da avaliação da T-pilha do CARRO tomou aproximadamente 1 mês.
Matança de células B de linfoma Raji por células T CD22-CAR
O kit de amarração tumoral líquido anti-CD40 (ver a Tabela de Materiais)foi usado a uma concentração de 4 μg/mL para revestir uma Placa E por 3 h a 37 °C. Depois de lavar os poços com tampão de amarração, as células de linfoma de células B foram adicionadas à Placa E a uma densidade de 30.000 células/poço. Depois de permitir que as células se contentassem com 30 min, a Placa E foi colocada de volta dentro do instrumento xCELLigence, e as leituras de impedância foram imediatamente iniciadas para capturar o apego e proliferação celular. No dia seguinte, ou células T CD22-CAR, células T do Carro Simulado ou células T não transinduzidas foram adicionadas. Na Figura 3,uma relação E:T de 10:1 foi usada para todos os tipos de células. As células Raji cd22 positivas, tratadas com células T CD22-CAR, apresentaram mortes significativas (traço verde) em comparação com os controles negativos (células T não transinduzidas e células T do Carro Simulado).
Matança eficaz de pilhas de cancro pancreatic por pilhas de T do CD47-CAR
CD47 é uma glicoproteína de superfície transmembrana da superfamília de imunoglobulina. Como uma proteína associada à integrina, é altamente expressa em cânceres hematológicos (leucemia, linfoma e mieloma múltiplo) e cânceres sólidos (como câncer de ovário, pequenas células, pâncreas, glioblastoma) e outros tipos de cânceres36,37. CD47 também é conhecido como um sinal de não comer-me para macrófagos, o que o tornou um alvo terapêutico potencial em alguns tipos de câncer. As células T CD47-CAR foram produzidas e testadas contra células cancerosas pancreáticas BxPC3 que expressam altos níveis de CD4738,39. As células BxPC3 foram semeadas no E-Plate no dia 1, com uma densidade de 10.000 células/poço. O monitoramento em tempo real mostrou que essas células atingiram a confluência após as 16h. Neste momento, as células T CAR foram adicionadas na proporção De 10:1(Figura 4A). Células efetoras de controle, como células T não transinduzidas e células T do Carro Simulado, também foram adicionadas. Os resultados mostram claramente que as células T CD47-CAR matam seletivamente as células BxPC3 alvo29. Além disso, a Figura 4B mostra que o sinal de impedância quando as células T CD47-CAR são adicionadas a um poço vazio é substancialmente menor do que o sinal de impedância gerado pelas células BxPC3 alvo. O valor do Índice de Celular de poços com células T CD47-CAR sozinhas atingiu um máximo de 0,14, que é apenas ligeiramente maior do que o sinal de médio sozinho (0,02). Isso indica que, neste ensaio heterogêneo de matar, o sinal de impedância é derivado quase exclusivamente das células cancerosas alvo.
Coestimulação de células T CAR pelo domínio GITR
Quando expresso em um CAR EGFR-GITR-CD3, o domínio costimulatório GITR foi previamente relatado para aumentar a morte de células cancerosas SKOV3 EGFR-positivas, mas não células cancerosas MCF-7 eGFR-negativas30. Para esclarecer melhor o papel do domínio GITR, as construções car contendo o domínio GITR completo, ou versões excluídas ou reorganizadas do domínio, foram geradas e testadas para a capacidade de coativar células T car (Figura 5A). Os dados xCELLigence na Figura 5B,C mostra que o domínio costimulatory GITR aumenta a matança de células T CAR de células-alvo EGFR-positivo acima do que é observado com a construção original CAR que não tem o domínio GITR. Além disso, a exclusão de 10 aminoácidos do domínio GITR (aminoácidos 184-193) aboliu esta atividade estimulante. Em contraste, a reorganização do posicionamento relativo do domínio GITR dentro da construção car provou ser menos prejudicial às suas capacidades estimulatórias. Usando dados do ponto final, a produção de IFNγ como um substituto da ativação da T-pilha igualmente demonstrou a atividade estimulatory do domínio de GITR(figura 5B). Em contraste com os dados do ponto final, que é um mero "snap shot", o perfil de impedância contínua do instrumento xCELLigence ilumina claramente diferenças sutis na cinética matando dos diferentes tratamentos (Figura 5C). Os resultados obtidos aqui são consistentes com os de um estudo in vivo30.
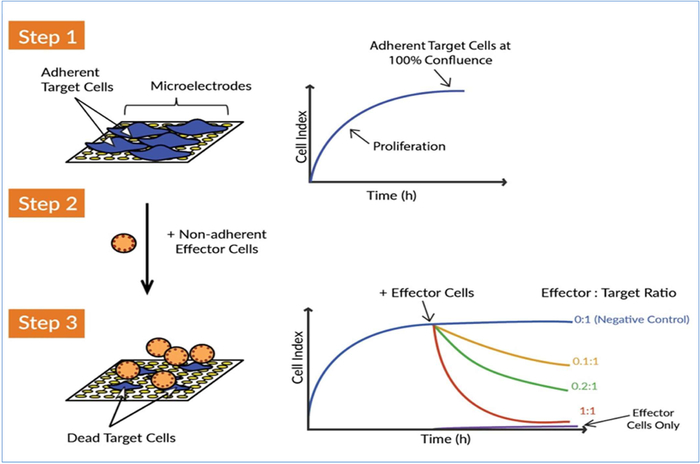
Figura 1: O sistema de análise celular em tempo real xCELLigence (RTCA) detecta a matança de células-alvo por células efetoras. Há três etapas concepcionais principais a medir a atividade da matança de pilhas do ef eficaz do CAR de encontro às pilhas de cancro do alvo. Passo 1: Seme as células-alvo (ou seja, células tumorais) no poço de uma placa E. As células se ligam aos microeletrodos biossensores de ouro e isso impede o fluxo de corrente elétrica entre os eletrodos. Esse valor de impedância é medido e traçado como um parâmetro sem unidade chamado Índice de Celular. O valor do Índice celular aumenta à medida que as células crescem e atinge um platô à medida que as células se aproximam da confluência. Passo 2: Células efebulosas não aderententes células imunes são posteriormente adicionados. Como essas células não aderem aos microeletrodos de ouro, elas não causam diretamente uma mudança de impedância. Passo 3: Se as células efecionistas atacarem as células cancerosas alvo, a destruição das células tumorais é refletida por uma diminuição no Índice Celular ao longo do tempo. Esta atividade citolítica das células efíperas, ou a potência das células efíperas, pode ser monitorada de forma sensível e precisa. A aquisição contínua de dados de impedância do sistema xCELLigence permite a análise cinética em tempo real para múltiplas condições simultaneamente. Clique aqui para ver uma versão maior deste número.
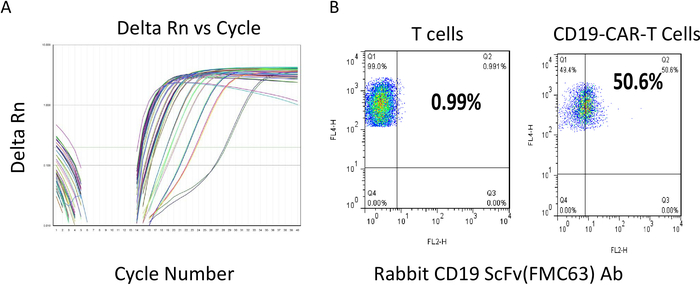
Figura 2: Titer determinação do lentivírus e fluxo de citometria avaliação das células T CAR. (A)Lentiviral titer determinação. As diferentes linhas de cores são amostras representativas para o número do ciclo versus delta Rn. Números de ciclo baixo indicam uma quantidade relativamente alta de modelo de RNA do vírus presente nas amostras. (B)Após a transdução, as células T CAR foram cultivadas e mantidas a uma densidade inferior a 2 x 106 células/mL e depois submetidas à análise de fluxo. O eixo yreflete a coloração para as células T, com valores positivos refletidos nas áreas Q1 e Q2. Ambas as amostras são 100% positivas para as células T. A expressão do CAR scFV é determinada usando um Ab(x-eixo)específico do scFv. O resultado mostra que mais de 50% das células T são scFv positivo em células T CD22-CAR. Clique aqui para ver uma versão maior deste número.
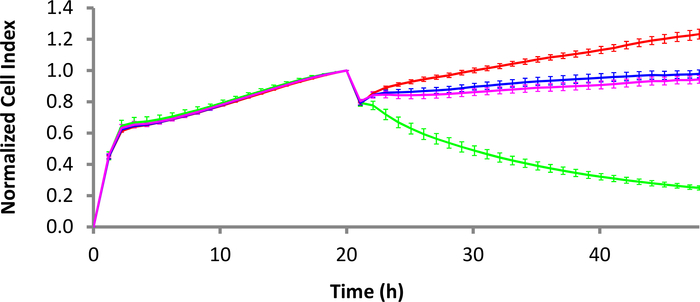
Figura 3: Matar a dinâmica das células T CD22-CAR contra as células de linfoma de Raji Burkitt. Enquanto a curva vermelha é as células Raji sozinho, a curva verde é as células Raji tratados com células T CD22-CAR. As curvas cor-de-rosa e azul são o tratamento da T-pilha do CARRO do mock e o tratamento nontransduced da T-pilha, respectivamente. A relação E:T é 10:1. Barras de erro são desvio padrão. A escala de tempo é configurada em intervalos de 2 h para fácil exibição, embora mais pontos de dados estejam disponíveis. Clique aqui para ver uma versão maior deste número.
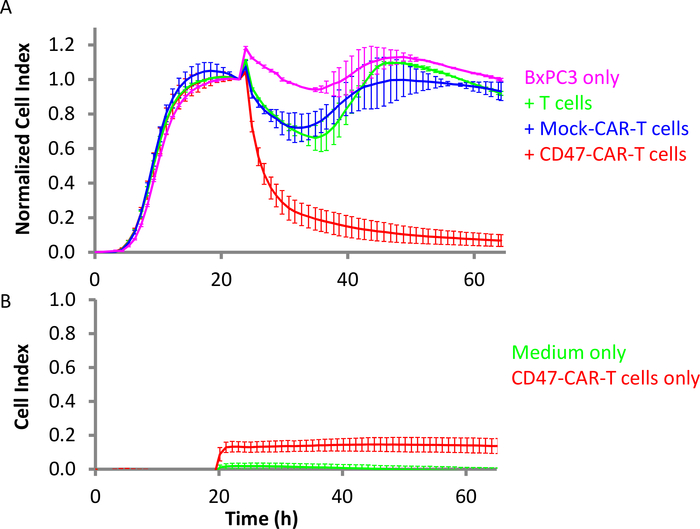
Figura 4: Eficácia das células T CD47-CAR contra células tumorais sólidas pancreáticas. (A)Rosa é o alvo células BxPC3 sozinho, enquanto o vermelho é BxPC3 com células T CD47-CAR adicionado. Verde é BxPC3 com a adição de células T não transinduzidas, e azul é com células T Mock CAR. A relação E:T é 10:1. (B) No mesmo cenário, o vermelho está vazio (sem células-alvo) poços de controle com células T CD47-CAR apenas e verde é o meio só. Barras de erro são desvio padrão. Clique aqui para ver uma versão maior deste número.
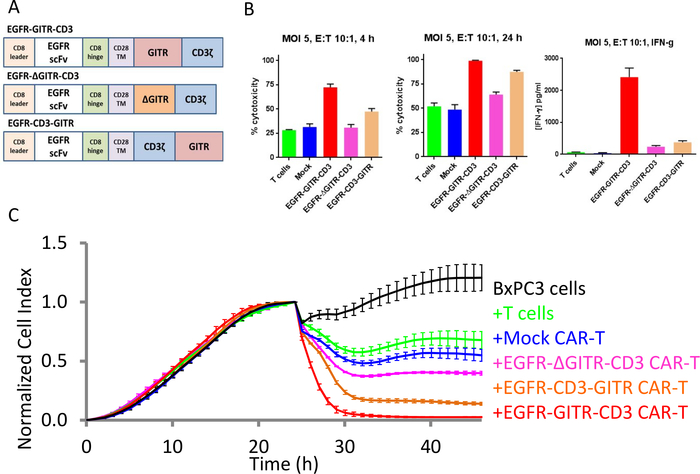
Figura 5: O domínio GITR aumenta a atividade citotóxica de células T-CAR contra linhas de células tumorais positivas do EGFR. (A)Construções diferentes do CARRO. (B) Bar parcelas de % citolyse para diferentes construções car em 4 h (esquerda) e 24 h (meio). A produção de IFNγ às 24 h é mostrada à direita. (C)Avaliação contínua de matança para todas as construções. A curva preta é a curva de crescimento apenas das células cancerosas do ovário BxPC3. A curva verde é as células-alvo tratadas apenas com células T, a curva azul é as células-alvo tratadas com células T do Carro Simulado, a curva vermelha é as células-alvo tratadas com células T EGFR-GITR-CD3-CAR, a curva rosa é as células-alvo tratadas com células T EGFR-ΔGITR-CD3-CAR, e a curva marrom são as células-alvo tratadas com células CAR EGFR-CD3-GITR-T. Clique aqui para ver uma versão maior deste número.
Discussão
Os receptores de antígeno quimérico são proteínas multidomínio compostas por um fragmento variável de cadeia única extracelular (região scFv), uma região de dobradiça, uma região de transmembrana e um domínio citoplasmacomico composto por domínios de sinalização tcr e domínios costimulatórios adicionais de receptores como CD28 e OX4011,40. Para projetar CARs seguros, seletivos e eficazes, é imperativo que as várias permutações no projeto dos CARs sejam completamente testadas usando ensaios de potência in vitro e, eventualmente, modelos animais. Neste estudo, nós fornecemos um protocolo e um fluxo de trabalho de como um ensaio de potência in vitro em tempo real pode informar o projeto de CARs eficazes.
Na concepção de qualquer tipo de ensaio de potência, particularmente para fins de fabricação, é imperativo que o ensaio seja sensível, robusto, consistente e o mais próximo possível do mecanismo de ação16,17,41. O ensaio de potência em tempo real descrito aqui é projetado para medir a atividade citolítica da célula T CAR diretamente ao invés de usar um marcador substituto, como a liberação de citocina. Importante, o ensaio não requer quaisquer componentes adicionais, tais como corantes ou reagentes que não seja a placa de ensaio (E-Plate) e os meios de comunicação recomendados para a manutenção das células. Além disso, o ensaio é extremamente sensível e fornece dados altamente reproduzíveis em comparação com outros ensaios baseados emrótulo42,43,44. Além disso, o ensaio xCELLigence é passível de usar proporções efetuais muito baixas de efetora-alvo, o que é ideal para a avaliação de citolise específica.
A fim de demonstrar a flexibilidade e utilidade do sistema xCELLigence, temos focado em dois tipos de tumores, ou seja, tumores de origem hematológica e tumores sólidos. A fim de avaliar a potência das células T CAR dirigidas por CD22, as células Raji (ou seja, uma linha de células de linfoma de células B) foram amarradas às Placas E usando um anticorpo anti-CD40. O tethering de pilhas de Raji à parte inferior das E-placas conduz a um sinal da impedância que reflita a viabilidade e o número de pilhas de Raji no poço. Após a adição de células T CD22-CAR, as células Raji são seletivamente mortas de forma dependente de tempo e efetiva, culminando em uma diminuição dependente do tempo no sinal de impedância. A queda na impedância significa citolyse ou perda de viabilidade das células Raji17. Esta aproximação seletiva do tethering usando anticorpos pode ser estendida a outras linhas líquidas da pilha do tumor. Uma estratégia alternativa ao uso de linhas celulares tumorais de origem hematológica é usar células cancerosas aderentes que são projetadas para expressar de forma evigorada os antígenos tumorais, como cd19 expressa em células HeLa. A vantagem desta abordagem é que as células hela parentais estão prontamente disponíveis e podem ser usadas como um controle negativo para especificidade. Tal abordagem já foi validada com células CHO-CD22 vs. CHO e células CHO-BCMAs vs. células CHO29. Usando tais aproximações diferentes, o projeto e a eficácia da T-pilha do CARRO podem facilmente ser testados. O ensaio xCELLigence é inerentemente flexível, e as condições de ensaio podem ser ajustadas para aproximar-se de condições fisiológicas.
Uma grande vantagem do ensaio de potência que descrevimos aqui é que é um ensaio funcional simples e pode ser usado em conjunto com técnicas de engenharia genética para projetar CARs ideais e eficazes de forma de alta produtividade. Como foi mostrado aqui para células T CAR projetadas para atingir células cancerosas EGFR-positivas, o ensaio pode ser usado para avaliar a atividade relativa de diferentes construções/mutantes de CAR. Por exemplo, mostramos que, quando o domínio GITR está localizado a montante do domínio CD3, ele mostra uma atividade citolítica muito mais robusta do que quando está localizado a jusante do domínio CD3.
Embora não se correlacione perfeitamente com a atividade in vivo da pilha de T do CARRO, a liberação in vitro da citocina foi usada historicamente como uma medida da potência da pilha de T do CARRO. Embora o ensaio de potência baseado em xCELLigence descrito aqui possa ser usado para avaliar terapias à base de células durante a fabricação ou antes de ser liberado para aplicação clínica, o quão bem esses resultados se correlacionam com a eficácia in vivo ainda não foi Estabelecido. A eficácia in vivo depende de uma série de fatores e variáveis que podem não ser recapitulados dentro de um ensaio in vitro. Tais variáveis incluem: homing das pilhas de T do CAR ao local do tumor, a estimulação e a ativação da pilha de T do CAR e sua habilidade de persistir dentro do paciente, e do microenvironment do tumor. Com mais refinamento, o ensaio xCELLigence pode ser capaz de modelar alguns desses processos complexos in vitro.
O protocolo fornecido aqui aplica-se à maioria das linhas de células cancerosas aderentes e algumas das linhas de células tumorais líquidas. Amostras clínicas, como células cancerosas primárias, no entanto, precisam ser testadas e otimizadas devido à complexidade dos tipos e fases tumorais. É certamente digno de nota que o sistema de ensaio de potência in vitro descrito aqui usa linhas de células cancerosas apenas para refletir a atividade potencial das células T CAR. A situação real do tumor dentro do corpo humano é muito mais complexa, especial quando um tumor contínuo é alvejado, devido ao ambiente e ao desenvolvimento dinâmicos do tumor. Portanto, o resultado da avaliação de potência pode não se traduzir muito bem na eficácia clínica das células T CAR testadas.
Em resumo, a plataforma xCELLigence baseada em impedância apresentada permite o monitoramento sem rótulos de matança celular por um longo período de tempo, ou seja, até 10 dias. Essa capacidade de uma escala temporal tão longa para coleta de dados diferencia a tecnologia de outros ensaios que estão atualmente em uso e que exigem a criação de múltiplas réplicas experimentais para coleta de pontos de tempo e manipulação laboriosa de amostras. Além disso, a contribuição mínima do sinal das células imunes efetoras simplifica a análise de dados. O software pode processar dados automaticamente e gerar parâmetros úteis, como a porcentagem de citolíse, KT50, etc. A tecnologia já demonstrou alta sensibilidade (com proporções De:T tão baixas quanto 1:20) e uma grande faixa dinâmica (com proporções de E:T de 20:1 para 1:20), o que não é facilmente alcançado com outros ensaios. Em geral, a implementação dessa tecnologia deve permitir uma análise de dados mais precisa em uma escala de taxa de transferência mais alta que irá melhorar o desenvolvimento de reagentes de células T da RCA, avançando o campo em um ritmo muito maior.
Divulgações
Os autores realizam pesquisas sobre o desenvolvimento de células T da RCA e ensaios associados de potência que são interesses comerciais da ProMab Biotechnologies e da ACEA Biosciences, respectivamente. No entanto, isso não altera a adesão dos autores à missão da JoVE de aumentar a disseminação do conhecimento científico. Os termos desta publicação foram revisados e aprovados pela ProMab Biotechnologies e pela ACEA Biosciences de acordo com sua política de pesquisa.
Agradecimentos
Os autores agradecem à ProMab Biotechnologies e à ACEA Biosciences por fornecer os reagentes e instrumentos utilizados neste estudo.
Materiais
| Name | Company | Catalog Number | Comments |
| 7-AAD | Biolegend | 420404 | |
| Anti-CD40, liquid tumor killing assay kit | ACEA Biosciences | 8100005 | |
| anti-human F(ab')2 | Jackson Immunoresearch laboratories. | 109-116-088 | |
| APC anti-CD3 | Biolegend | 317318 | |
| Assay medium RPMI1640 | life technologies.Corp | 11875-093 | |
| CAR-T cell frozen solution CryostorCS10 | Stemcell technologies | #07930 | |
| CAR-T cell medium from ProMab | AIM-V+300IFU/ml IL-2 | 12055-091 | |
| CD3/CD28 coated microbeads, Dynabeads | Thermofisher | 11131D | |
| DMEM | GElifesciences.com | SH30243.02 | |
| FACS buffer | Promab made | ||
| FBS | Lonza.com | 14-503F | |
| HEK293FT | Thermo Fisher | R70007 | |
| INFg ELISA kit | Thermo Fisher | ||
| Lentiviral Packaging Mix | System Biosciences | VP100 | |
| Lenti-X quantitative RT-PCR titration kit (Clontech) | Takara | 631235 | |
| Promab medium for target cells | Varied with cell lines | ||
| Real time Cellular Analyer | ACEA Biosciences | ||
| Thermal cycler | Thermo Fisher | ||
| Transduction enhance agent, Virus Transduction Enhancer (Alstem) | Transplus, Alstem | V020 | |
| Transfection dilution solution, Opti-MEM | Thermo Fisher | ||
| Transfection reagent, NanoFect reagent | Alstem | NF100 |
Referências
- Miliotou, A. N., Papadopoulou, L. C. CAR T-cell Therapy: A New Era in Cancer Immunotherapy. Current Pharmaceutical Biotechnology. 19 (1), 5-18 (2018).
- June, C. H., O’Connor, R. S., Kawalekar, O. U., Ghassemi, S., Milone, M. C. CAR T cell immunotherapy for human cancer. Science. 359 (6382), 1361-1365 (2018).
- . FDA approval brings first gene therapy to the United States Available from: https://www.fda.gov/NewsEvents/Newsroom/PressAnnouncements/ucm574058.htm (2017)
- . FDA approves CAR-T cell therapy to treat adults with certain types of large B-cell lymphoma Available from: https://www.fda.gov/newsevents/newsroom/pressannouncements/ucm581216.htm (2017)
- Liu, B., Song, Y., Liu, D. Clinical trials of CAR-T cells in China. Journal of Hematology & Oncology. 10 (1), 166 (2017).
- Fry, T. J., et al. CD22-targeted CAR T cells induce remission in B-ALL that is naive or resistant to CD19-targeted CAR immunotherapy. Nature Medicine. 24 (1), 20-28 (2018).
- Yang, Y., Jacoby, E., Fry, T. J. Challenges and opportunities of allogeneic donor-derived CAR T cells. Current Opinion in Hematology. 22 (6), 509-515 (2015).
- . Celyad Announces FDA Acceptance of IND Application for CYAD-101, a First-in-Class Non-Gene Edited Allogeneic CAR-T Candidate Available from: https://www.celyad.com/en/news/celyad-announces-fda-acceptance-of-ind-application-for-cyad-101-a-first-in-class-non-gene-edited-allogeneic-car-t-candidate (2017)
- Sheridan, C. Allogene and Celularity move CAR-T therapy off the shelf. Nature Biotechnology. 36 (5), 375-377 (2018).
- D’Aloia, M. M., Zizzari, I. G., Sacchetti, B., Pierelli, L., Alimandi, M. CAR-T cells: the long and winding road to solid tumors. Cell Death & Disease. 9 (3), 282 (2018).
- Xu, J., et al. Combination therapy: A feasibility strategy for CAR-T cell therapy in the treatment of solid tumors. Oncology Letters. 16 (2), 2063-2070 (2018).
- Xia, A. L., Wang, X. C., Lu, Y. J., Lu, X. J., Sun, B. Chimeric-antigen receptor T (CAR-T) cell therapy for solid tumors: challenges and opportunities. Oncotarget. 8 (52), 90521-90531 (2017).
- Yong, C. S. M., et al. CAR T-cell therapy of solid tumors. Immunology and Cell Biology. 95 (4), 356-363 (2017).
- Newick, K., O'Brien, S., Moon, E., Albelda, S. M. CAR T Cell Therapy for Solid Tumors. Annual Review of Medicine. 68, 139-152 (2017).
- de Wolf, C., van de Bovenkamp, M., Hoefnagel, M. Regulatory perspective on in vitro potency assays for human mesenchymal stromal cells used in immunotherapy. Cytotherapy. 19 (7), 784-797 (2017).
- Cerignoli, F., et al. In vitro immunotherapy potency assays using real-time cell analysis. PLOS ONE. , (2018).
- Holden, H. T., Oldham, R. K., Ortaldo, J. R., Herberman, R. B. Standardization of the chromium-51 release, cell-mediated cytotoxicity assay: cryopreservation of mouse effector and target cells. Journal of the National Cancer Institute. 58 (3), 611-622 (1977).
- Somanchi, S. S., McCulley, K. J., Somanchi, A., Chan, L. L., Lee, D. A. A Novel Method for Assessment of Natural Killer Cell Cytotoxicity Using Image Cytometry. PLOS ONE. 10 (10), e0141074 (2015).
- Mukherjee, M., Mace, E. M., Carisey, A. F., Ahmed, N., Orange, J. S. Quantitative Imaging Approaches to Study the CAR Immunological Synapse. Molecular Therapy: The Journal of the American Society of Gene Therapy. 25 (8), 1757-1768 (2017).
- Zaritskaya, L., Shurin, M. R., Sayers, T. J., Malyguine, A. M. New flow cytometric assays for monitoring cell-mediated cytotoxicity. Expert Review of Vaccines. 9 (6), 601-616 (2010).
- Nelson, D. L., Kurman, C. C., Serbousek, D. E. Chapter 7, Unit 7: 51Cr release assay of antibody-dependent cell-mediated cytotoxicity (ADCC). Current Protocols in Immunology. , 27 (2001).
- Abassi, Y. A., et al. Label-free, real-time monitoring of IgE-mediated mast cell activation on microelectronic cell sensor arrays. Journal of Immunological Methods. 292 (1-2), 195-205 (2004).
- Glamann, J., Hansen, A. J. Dynamic detection of natural killer cell-mediated cytotoxicity and cell adhesion by electrical impedance measurements. Assay and Drug Development Technologies. 4 (5), 555-563 (2006).
- Solly, K., Wang, X., Xu, X., Strulovici, B., Zheng, W. Application of real-time cell electronic sensing (RT-CES) technology to cell-based assays. Assay and Drug Development Technologies. 2 (4), 363-372 (2004).
- Zhu, J., Wang, X., Xu, X., Abassi, Y. A. Dynamic and label-free monitoring of natural killer cell cytotoxic activity using electronic cell sensor arrays. Journal of Immunological Methods. 309 (1-2), 25-33 (2006).
- Ke, N., Wang, X., Xu, X., Abassi, Y. A. The xCELLigence system for real-time and label-free monitoring of cell viability. Methods in Molecular Biology. 740, 33-43 (2011).
- Lamarche, B. J., Xi, B., Cerignoli, F. Quantifying the Potency of Cancer Immunotherapies: Immune Cell-Mediated Killing Kinetics and Efficacy Analysis in Real-Time without the Use of Labels. Genetic Engineering & Biotechnology News (GEN). 36 (14), 18-19 (2016).
- Golubovskaya, V., et al. CD47-CAR-T Cells Effectively Kill Target Cancer Cells and Block Pancreatic Tumor Growth. Cancers. 9 (10), (2017).
- Golubovskaya, V. M., et al. GITR domain inside CAR co-stimulates activity of CAR-T cells against cancer. Frontiers in Bioscience. 23, 2245-2254 (2018).
- Guedan, S., et al. Enhancing CAR T cell persistence through ICOS and 4-1BB costimulation. JCI Insight. 3 (1), (2018).
- Erskine, C. L., Henle, A. M., Knutson, K. L. Determining optimal cytotoxic activity of human Her2neu specific CD8 T cells by comparing the Cr51 release assay to the xCELLigence system. Journal of Visualized Experiments. (66), e3683 (2012).
- Davenport, A. J., et al. CAR-T Cells Inflict Sequential Killing of Multiple Tumor Target Cells. Cancer Immunology Research. 3 (5), 483-494 (2015).
- Hegde, M., et al. Tandem CAR T cells targeting HER2 and IL13Ralpha2 mitigate tumor antigen escape. The Journal of Clinical Investigation. 126 (8), 3036-3052 (2016).
- Jin, J., et al. Enhanced clinical-scale manufacturing of TCR transduced T-cells using closed culture system modules. Journal of Translational Medicine. 16 (1), 13 (2018).
- Weiskopf, K. Cancer immunotherapy targeting the CD47/SIRPalpha axis. European Journal of Cancer. 76, 100-109 (2017).
- Huang, Y., Ma, Y., Gao, P., Yao, Z. Targeting CD47: the achievements and concerns of current studies on cancer immunotherapy. Journal of Thoracic Disease. 9 (2), E168-E174 (2017).
- Ma, S., Thorpe, P., Vitetta, E., Meyer, J. Combined targeting of exposed phosphatidylserine, CD47 and CD54 on human pancreatic tumor cells in a mouse xenograft model of human pancreatic cancer (P4455). The Journal of Immunology. 190 (1 Supplement), (2013).
- Yamamoto, K., et al. Emergence of CD47- high expression cells confers enhanced tumorigenicity upon KDM6B suppression in pancreatic cancer. Cancer Research. 76 (2 Supplement), (2016).
- Xu, D., et al. The development of CAR design for tumor CAR-T cell therapy. Oncotarget. 9 (17), 13991-14004 (2018).
- FDA. . Guidance for Industry, Potency Tests for Cellular and Gene Therapy Products. , (2017).
- Limame, R., et al. Comparative analysis of dynamic cell viability, migration and invasion assessments by novel real-time technology and classic endpoint assays. PLOS ONE. 7 (10), e46536 (2012).
- Chiu, C. H., et al. Comparison between xCELLigence biosensor technology and conventional cell culture system for real-time monitoring human tenocytes proliferation and drugs cytotoxicity screening. Journal of Orthopaedic Surgery and Research. 12 (1), 149 (2017).
- Hillger, J. M., Lieuw, W. L., Heitman, L. H., IJzerman, A. P. Label-free technology and patient cells: from early drug development to precision medicine. Drug Discovery Today. 22 (12), 1808-1815 (2017).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados